Kinetika Reaksi Redoks
Ilham Al Bustomi*, Teguh Andy A.M, Kiftiyah Yuni Fatmawardi, Vera Nurchabibah, Nadhira Izzatur Silmi, Yuliatin, Pretty Septiana
Kelompok 5, Kelas AB, Jurusan Kimia, Fakultas MIPA, Universitas Brawijaya, Jl. Veteran 65145, Indonesia
ABSTRAK
Percobaan kinetika reaksi redoks ini bertujuan untuk menentukan orde reaksi dan tetapan laju reaksi redoks. Kinetika reaksi redoks merupakan cabang ilmu kimia yang membahas tentang laju reaksi dan faktor-faktor yang mempengaruhinya dalam suatu reaksi oksidasi-reduksi. Ketetapan laju reaksi dalam percobaan dapat diketahui dengan mencampurkan larutan Na2S2O3, kanji, K2S2O8 kedalam larutan KI dengan
variasi konsentrasi dan didapatkan orde untuk I- adalah orde 2 dan untuk S2O82- tidak
didapatkan orde reaksi karena tidak terjadi perubahan warna. Penentuan orde dilihat dari grafik orde yang dibandingkan dengan literature. Grafik diperoleh dari tabel pengaruh spesi terhadap laju reaksi.
This redox reaction kinetics experiment aims to determine reaction order and rate constants of redox reactions. Kinetics of redox reactions is a branch of chemistry that discusses the reaction rate and the factors that influence in an oxydation-reduction reaction. Reaction rate constants in the experiment can be determined by mixing a solution of Na2S2O3, starch ,K2S2O8 into KI solution with varying
concentrations and obtained the order for I- of order 2 and to S2O82- not be obtained
because the reaction order does not change colour. The determination of the order seen from the graph order is compared with the literature. The graph is obtained from table speci influence on the rate of reaction.
I. PENDAHULUAN
Reaksi redoks adalah reaksi yang terjadi perubahan bilangan oksidasi. Konsep
tentang bilangan oksidasi,. Bilangan oksidasi didefinisikan sebagai muatan yang dimiliki suatu atom jika seandainya electron diberikan kepada atom yang lain yang keelektronegatifannya lebih kecil lebih positif, sedangkan atom yang keelektronegatifanya lebih kecil lebih positif.Reaksi redoks mencakup reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi yang terjadi penurunan bilangan oksidasi melalui penangkapan elektron, contohnya [1]:
Cu2+(aq)+ 2e→Cu(s)
Sedangkan reaksi oksidasi adalah reaksi yang terjadi peningkatan bilangan oksidasi melalui pelepasan elektron, contohnya :
Zn(s) →Zn2+
2 Laju reaksi (reaction rate) adalah perubahan kosentrasi reaktan atau produk terhadap waktu (M/s). kita telah mengetahui bahwa setiap reaksi dapat dinyatakan dengan persamaan umum [2] :
Reaktan → Produk
Persamaan ini memberitahukan bahwa, selama berlangsungnya suatu reaksi, molekul reaktan bereaksi sehingga produk terbentuk. Sebagai hasilnya, kita dapat mengamati jalannya reaksi dengan cara memantau menurunnya konsentrasi reaktan atau meningkatnya reaksi produk [2].
Percobaan kinetik berdasarkan reaksi redoks untuk menentukan persamaan laju dan energi aktivasi. Reaksi redoks digambarkan dengan reaksi [3]
S2O82- +I-→ 2SO42-+I3- (1)
Dalam percobaan ini, laju penggunaan atau pemakaian iodin akan terhitung untuk menentukan persamaan laju. Pada proses reaksi 1 , jumlah iodin yang dihasilkan akan tereduksi seperti pada reaksi kedua [3]
2S2O32-(aq)_+I3-(aq) → S4O62-(aq)+3I-(aq) (2)
Untuk mengamati titik akhir reaksi dengan mudah, kanji ditambahkan untuk memperoleh kompleks larutan kanji iodin berwana biru pekat, yang akan mengganti ketika seluruh tiosulfat digunakan dan iodin bebas terbentuk dalam larutan[3]
I2+(C6H10O5)n x H2O → Kompleks kanji iodin biru pekat (3)
Iodida (I-) dan ion persulfat (S2O82-) bereaksi untuk memperoleh Iodin (I2) dan sulfat (SO42-).
Iodin dihasilkan dan segera digunakan oleh ion tiosulfat [S2O32-]. Segera seluruh ion S2O3
2-digunakan, proses terbentuknya iodin bebas bereaksi dengan kanji.Pembentukan larutan menjadi biru. sejumlah tiosulfat ditambahkan sama dengan pembentukan iodin dalam waktu yang dibutuhkan larutan untuk beralih ke biru [4].
Kinetika kimia juga disebut reaksi kinetik yang mempelajari tentang laju dan mekanisme dari reaksi kimia. Sistem bereaksi tidak dalam kesetimbangan, jadi reaksi kinetik bukan bagian dari termodinamika tetapi merupakan cabang dari kinetika. Laju konversi J merupakan kuantitas luas dan bergantung pada ukuran sistem. Konversi laju per unit volume J/V disebut laju reaksi r [5].
(1.1)
Ketika V konstans, (1/V)(dnA/dt)=d(nA/V)dt=dcA/dt=d[A]/dt, dimana cA = [A] adalah
konsentrasi molar A. Sehingga persamaannya akan menjadi [5].
(1.2)
II. METODOLOGI
II.1. Alat dan Bahan
buah stopwatch. Bahan-bahan yang di gunakan antara lain , KI 0.4 M, Na2S2O3 0.01 M,
K2S2O8 0.2 M, Indikator Kanji (amilum 1%).
II.2. Prosedur kerja
2.2.1 Reaksi Peroksida
Pengaruh konsentrasi I- terhadap laju reaksi dengan variasi konsentrasi I- dan konsentrasi persulfat konstan. Pertama disiapkan 2 gelas kimia 100 mL yang telah dibersihkan, kemudian dimasukkan larutan KI ke dalam gelas 1. Dimasukkan K2S2O3 0,01 M
; (NH4)2S2O8 0,2 M dan kanji ke dalam gelas 2. Campuran dalam gelas 2 di masukkan ke
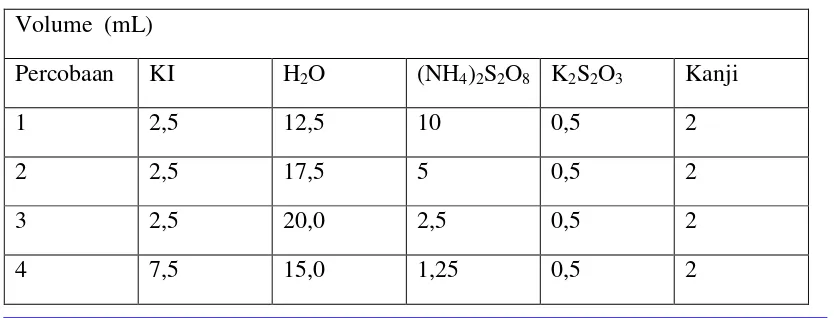
dalam gelas 1, dan di hidupkan stopwatch. Bila terjadi perubahan warna larutan dari tak berwarna menjadi biru, di matikan stopwatch dan dicatat waktu. Diulangi percobaan sesuai dengan tabel berikut :
Tabel 1. Komposisi reaksi redoks dengan variasi KI
Volume (mL)
Percobaan KI H2O K2S2O8 Na2S2O3 Kanji
1 10 10 5 0.5 2
2 5 15 5 0.5 2
3 2,5 17,5 5 0.5 2
4 20 0 5 0.5 2
Pengaruh ion persulfat terhadap laju reaksi dengan variasi konsentrasi K2S2O8 dan
konsentrasi KI konstan. Disiapkan 2 gelas kimia 100 mL yang telah dibersihkan. Dimasukkan larutan KI ke dalam gelas 1. Dimasukkan Na2S2O3 0,01 M ; K2S2O8 0,2 M dan kanji ke dalam
gelas 2, campuran dalam gelas 2 di masukkan ke dalam gelas 1, dan di hidupkan stopwatch. Bila terjadi perubahan warna larutan dari tak berwarna menjadi biru, di matikan stopwatch dan dicatat waktu. Diulangi percobaan sesuai dengan tabel berikut :
Tabel 2. Komposisi reaksi redoks dengan variasi K2S2O8
Volume (mL)
Percobaan KI H2O (NH4)2S2O8 K2S2O3 Kanji
1 2,5 12,5 10 0,5 2
2 2,5 17,5 5 0,5 2
3 2,5 20,0 2,5 0,5 2
4
III. HASIL DAN PEMBAHASAN
Berdasarkan percobaan yang telah dilakukan didapatkan beberapa data sebagai berikut :
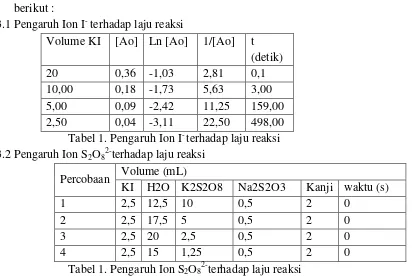
3.1 Pengaruh Ion I- terhadap laju reaksi
Volume KI [Ao] Ln [Ao] 1/[Ao] t (detik)
20 0,36 -1,03 2,81 0,1
10,00 0,18 -1,73 5,63 3,00
5,00 0,09 -2,42 11,25 159,00
2,50 0,04 -3,11 22,50 498,00
Tabel 1. Pengaruh Ion I- terhadap laju reaksi 3.2 Pengaruh Ion S2O82-terhadap laju reaksi
Percobaan Volume (mL)
KI H2O K2S2O8 Na2S2O3 Kanji waktu (s)
1 2,5 12,5 10 0,5 2 0
2 2,5 17,5 5 0,5 2 0
3 2,5 20 2,5 0,5 2 0
4 2,5 15 1,25 0,5 2 0
Tabel 1. Pengaruh Ion S2O82-terhadap laju reaksi
Dari data hasil percobaan tersebut dapat dibuat grafik : 1. Grafik variasi [I-] orde 0
Grafik 1. Grafik variasi [I-] orde 0
y = -0.0004x + 0.2401 R² = 0.5738
0.00 0.15 0.30 0.45
-200 0 200 400 600
[A
o]
t (detik)
2. Grafik variasi [I-] orde 1
Grafik 2. Grafik variasi [I-] orde 1
3. Grafik variasi [I-] orde 2
Grafik 3. Grafik variasi [I-] orde 2
Data yang didapatkan pada percobaan ini adalah banyaknya waktu yang dibutuhkan untuk terjadinya perubahan warna pada larutan dengan konsentrasi KI yang berbeda-beda. Data tersebut dapat digunakan untuk menentukan orde reaksi melalui grafik dengan sumbu x sebagai waktu dalam satuan detik dan sumbu y sebagai konsentrasi KI, kemudian didapatkan persamaan linier. Berdasarkan grafik yang didapatkan, dapat ditentukan orde reaksinya. Orde reaksi dari percobaan peroksida yang dipengaruhi konsentrasi I- merupakan orde dua. Karena nilai dari R2 yang didapatkan mendekati nilai satu, yaitu sebesar 0.9789. Jika dibandingkan dengan literatur, orde reaksi dari peroksida yaitu satu sehingga orde reaksi yang didapatkan tidak sesuai dengan literatur dikarenakan kontaminasi pada larutan KI [6].
6 Tujuan dari percobaan kinetika reaksi redoks yaitu untuk menentukan orde reaksi dan ketetapan laju reaksi redoks. Prinsip percobaan kinetika reaksi redoks yaitu ditentukannya orde reaksi dan ketetapan laju reaksi yang didasarkan pada reaksi redoks yang terjadi antara ion peroksida sulfat dengan ion I- yang akan menghasilkan ion sulfat dan ion triiodida. Iod yang dihasilkan dalam bentuk iod triiodida direaksikan dengan ion tiosulfat. Amilum ditambahakan sebagai indikator yang akan bereaksi dengan iod membentuk kompleks berwarna biru. Waktu yang dibutuhkan untuk perubahan warna larutan digunakan sebagai acuan untuk menentukan laju reaksi.
Orde reaksi memiliki arti sebagai banyaknya faktor konsentrasi zat reaktan yang mempengaruhi kecepatan reaksi berdasarkan satuan waktu. Orde reaksi dipengaruhi oleh besarnya konsentrasi pereaksi, temperatur, tekanan, katalis, dan luas permukaan. Kenaikan temperatur dapat mempercepat laju reaksi karena kenaikan temperatur energi kinetik meningkat. Konsetrasi mempengaruhi laju reaksi karena adanya perbedaan jumlah partikel. Semakin banyak partikel yang ada, kemungkinan untuk saling bertumbukan semakin tinggi. Semakin besar ukuran partikel zat, maka reaksi akan semakin cepat karena luas permukaan zat yang saling bertumbukan semakin besar, sehingga peluang tumbukan efektif juga semakin besar. Katalis akan mempercepat laju reaksi karena energi aktivasi larutan meningkat. Tekanan yang semakin besar akan menurukan volume gerak partikel, sehingga partikel akan semakin berdekatan dan tumbukan dapat terjadi lebih sering [7].
IV. KESIMPULAN
DAFTAR PUSTAKA
[1] Suyanta, 2013, Redoks dan Elektrokimia, PLPG Kimia, Surabaya. [2] Chang, Raymond, 2004, Kimia Dasar Edisi 3 Jilid 2, Erlangga, Jakarta.
[3] Wu,Ya Hong, Shan Ling Tong, Sheng Hu, Mao Ying Wu, Zhi Feng Hao, Yan Yan,2014, Thermodynamics and Kinetics, Possibility and Actuality. World Journal of Chemical Education, . 2(2): 26-28.
[4] Sa’adah, N. L., Ekadina D. U., Maulana I.,2009,Penentuan Laju Reaksi Berdasarkan Perubahan Warna Melalui Metode Imajiner, Universitas Negeri Semarang, Semarang [5] Levine, N, Ira, 2009, Physical Chemistry sixth Edition, Mc Graw-Hill Companies, New
York.
[6] Dita, A , 2015, Kajian Empiris Mekanisme Reaksi Hidrogen Peroksida dengan Iodida pada Suasana Asam, jurnal penelitian , 11 (1) : 72-80.
![Grafik 2. Grafik variasi [I-] orde 1](https://thumb-ap.123doks.com/thumbv2/123dok/3953757.1897177/5.612.104.361.73.256/grafik-grafik-variasi-i-orde.webp)