LAPORAN RESMI PRAKTIKUM KINETIKA KIMIA Nama / NIM : Muhamad Syaiful Ampri. (652015011)
Tanggal Praktikum : 12 Oktober 2016
Judul : Reaksi Oksidasi Iodida oleh Hidrogen Peroksida
TUJUAN
1. Menentukan hukum laju reaksi antara iodida dan hidrogen peroksida dalam suasana asam.
2. Menentukan faktor-faktor yang mempengaruhi hukum laju reaksi.
LANDASAN TEORI
Dalam ilmu kimia kita tentu sering mendengar istilah laju reaksi. dalam
penerapannya, jika laju reaksi tersebut sebanding dengan konsentrasi dua reaktan A dan B sehingga:
v = k [A][B]
koefisien k disebut konstanta laju, yang tidak bergantung pada konsentrasi (tetapi bergantung pada temperatur). Lain halnya dengan ordo dari suatu reaksi kimia, ordo reaksi nilainya ditentukan secara percobaan dan tidak dapat diturunkan secara teori, walaupun stokhiometrinya telah diketahui (Atkins, 1996).
Besar kecilnya nilai dari laju dari suatu reaksi kimia dapat ditentukan dalam beberapa faktor, antara lain sifat pereaksi, suhu, katalis dan konsentrasi pereaksi. Dalam sifat pereaksinya, ada yang reaktif dan ada yang kurang reaktif, misalnya bensin lebih cepat terbakar daripada minyak tanah. Berdasarkan suhunya, hampir semua pereaksi menjadi lebih cepat bila suhu dinaikkan, karena kalor yang diberikan akan menambah energi kinetik partikel pereaksi, akibatnya, jumlah energi tabrakan bertambah besar. Dalam katalis, laju reaksi dapat dipercepat dengan menambah zat yang disebut katalis. Katalis sangat diperlukan dalam reaksi organik, termasuk dalam organisme. Sedangkan pada konsentrasi pereaksi, dua molekul yang akan bereaksi harus bertabrakan langsung.
Jika konsentrasi pereaksi diperbesar, berarti kerapatannya bertambah dan akan memperbanyak kemungkinan tabrakan sehingga akan mempercepat reaksi (Syukri, 1999).
Suatu reaksi kimia berlangsung karena atom-atom bersekutu atau bersenyawa dan membentuk molekul-molekul baru, dengan cara mengadakan reorganisani dari elektron-elektron dalam masing-masing atom. Kecepatan berlangsungnya reaksi kimia dan energi-energi yang berhubungan dengan reaksi tersebut, serta mekanismenya dipelajari dalam kinetika kimia. Mekanisme reaksi dapat diramalkan dengan bantuan pengamatan dan pengukuran besaran termodinamika suatu reaksi, dengan mengamati arah jalannya reaktan maupun produk suatu sistem. Syarat untuk terjadinya suatu reaksi kimia bila terjadi penurunan energi bebas (ţ G < 0). Tujuan utama kinetika kimia untuk menjelaskan bagaimana laju bergantung pada konsentrasi reaktan dan mengetahui mekanisme suatu reaksi berdasarkan pengetahuan tentang laju reaksi secara eksperimen (Oxtoby,1999).
Laju Reaksi
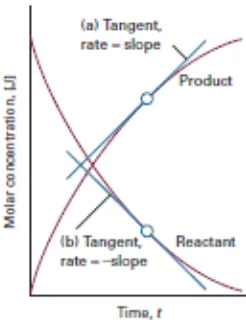
Laju reaksi didefinisikan sebagai perubahan konsentrasi persatuan waktu. Laju rekasi kimia terlihat dari perubahan konsentrasi molekul reaktan atau konsentrasi molekul produk terhadap waktu. Laju rekasi tidak tetap, melainkan berubah terus menerus seiring dengan perubahan konsentrasi (Chang,2006)
(Atkins, 2010)
Dalam percobaan ini volume tiosulfat yang dititrasikan sebesar b adalah jumlah peroksida yang bereaksi selama t detik, maka konsentrasi peroksida setelah t detik adalah sebesar (a-b). Jika a adalah banyaknya tiosulfat yang setara dengan peroksida saat to atau mula-mula. Dengan membuat grafik ln (a-b) terhadap t maka akan didapatkan –k sebagai slope sehingga harga k dapat ditentukan. Dengan persamaan sebagai berikut:
ln (a – b) = -kt + ln a (Atkins, 1996).
Pengaruh Konsentrasi Reaktan pada Laju Reaksi Kimia
Konsentrasi memiliki peranan yang sangat penting dalam laju reaksi, sebab semakin besar konsentrasi pereaksi, maka tumbukan yang terjadi semakin banyak, sehingga menyebabkan laju reaksi semakin cepat. Begitu juga, apabila semakin kecil konsentrasi pereaksi, maka semakin kecil tumbukan yang terjadi antar partikel, sehingga laju reaksi pun semakin kecil (Ulfin, 2010). Hubungan kuantitatif antara konsetrasi pereaksi dengan laju reaksi dinyatakan dalam suatu persamaan, yaitu persamaan laju reaksi. Untuk reaksi :
mA + nB → pC + qD Persamaan laju reaksi dari persamaan diatas adalah
v = k[A]m [B]n……….. …(2.1)
Laju reaksi terlihat dari perubahan konsentrasi molekul reaktan atau konsentrasi molekul produk terhadap waktu. Laju reaksi tidak tetap melainkan berubah terus-menerus seiring dengan perubahan konsentrasi (Purba, 2007).
Pengaruh Temperatur pada Laju Reaksi Kimia
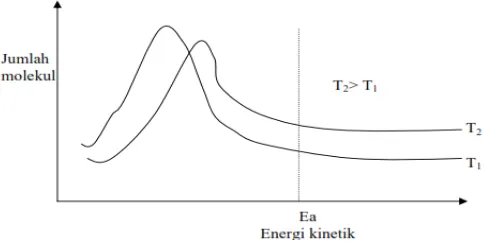
Hubungan laju reaksi dengan temperatur dijelaskan melalui persamaan Arhenius. kenaikan temperatur akan meningkatkan gerakan molekul. Semakin banyak molekul yang bergerak dengan kecepatan rata- rata tinggi akan memperbesar peluang terjadinya tumbukan efektif, yaitu tumbukan yang mencapai energi pengaktifan, sehingga laju reaksi akan meningkat. Dibawah ini adalah grafik yang menggambarkan energi kinetik
molekul pada dua temperatur yang berbeda, dimana energi aktivasi pada suhu yang lebih tinggi ( T2 ) lebih kecil dari pada energi aktivasi pada suhu rendah ( T1 ).
Grafik 1Energi aktivasi pada dua temperatur yang berbeda
(Atkins, 2010). Konstanta laju reaksi (k) bergantung pada temperatur (T) dan besarnya energi aktivasi (Ea). Hubungan k, T, dan Ea dapat dinyatakan dalam persamaan Arrhenius sebagai berikut :
k=A e−RTEa ………..(2.2)
lnk=lnA− Ea
RT ……….…….(2.3)
Dimana A adalah faktor frekuensi dan R adalah konstanta gas (Schwedt, 1994).
ALAT DAN BAHAN
Beaker glass 250 ml Beaker glass 100 ml
Pipet volume (1 ml, 2 ml, 3 ml) Gelas ukur 100 ml
Gelas arloji Spatula Stopwatch Magnetik stirer
Hotplate stirer Termometer Aquades Asam klorida Kalium iodida Pati
Natrium thiosulfat Hidrogen peroksida
METODE
Penentuan hukum laju reaksi.
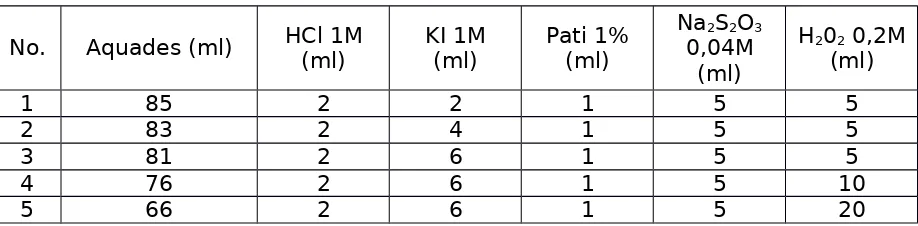
Tabel 1
1. Dipastikan alat yang digunakan bersih.
2. Disiapkan larutan HCl 1M,KI 1M, Na2S2O3 0,04M, pati 1%, dan H202 0,2M.
3. Dicampurkan larutan sesuai dengan tabel 1 didalam beaker glass 250 ml yang
disediakan dan diukur suhunya.
4. Ditambah larutan H202 kedalam larutan campuran disetiap beaker glass 250 ml dengan
komposisi.
5. Dilakukan perhitungan waktu saat larutan H202 dicampurkan didalam larutan
campuran.
6. Waktu dihentikan ketika muncul warna biru pada larutan campuran yang sudah
ditambahkan H202.
7. Diukur suhu campuran (larutan campuran + H202) setelah reaksi. 8. Dilakukan percobaan sebanyak 2 kali ulangan.
9. Diulangi percobaan dengan mengganti volume larutan sesuai dengan tabel 1
Penentuan Energi Aktivasi dan Faktor Preeksponensial Reaksi.
1. Diulangi percobaan 1 dengan digunakan komposisi 3
2. Campuran larutan dimasukan dalam icebath dan waterbath 500C sebanyak 2 kali sebagai pengganti hotplat stire.
HASIL PENGAMATAN
1. Pada suhu ruang.
1 85 2 2 1 5 5
2. Pada icebath
No 3. Pada hotbath
No
1. Tentukan laju reaksi ini pada suhu 70oC!
2. Tentukan waktu yang dibutuhkan untuk terbentuk warna biru pada percobaan 4 pada suhu 70oC!
3. Beri pandangan anda pada percobaan dan literatur!
Jawab.
v2 v1=
k[A2]X[B2]y k[A1]X[B1]y
Dimana v=1/t(detik)
Orde terhadap zat H2O2
t1
t2=
k[I2]X[H2O22]y k[I1]X[H2O21]y
138 74,5=
k[0,07]X[0,02]y k[0,07]X[0,01]y
1,9 = 2y y = setara 1
Orde terhadap zat I
t1 t2=
k[I2]X[H2O22]
y
k[I1]X[H2O21]y
384 186=
k[0,04]X[0,01]y k[0,02]X[0,01]y
2,06 = 2X X = setara 1
Jadi v= k [I].[H2O2]
0.02 0.02 0.03 0.03 0.04 0.04 0.05 0.05
-6 -5 -4 -3 -2 -1 0
f(x) = - 71.69x - 1.87
R² = 0.87 Linear ()
1/T
ln
1
Maka laju reaksi
V = -71,686 [0,01][0,07]
= 0,05 M/detik
2. Waktu tiap 10C = 74/28 = 2,6 s/0C
Selisih suhu = (70-28)0C = 42 0C
Maka waktu yang dibutuhkan = 74 - (42x2,6)
= 74 – 109,2
= -35,2 detik
3. Menurut saya hasil percobaan dan literatur sudah sesuai, karena hasil praktikum juga menyatakan semakin besar volume reaktan maka laju reaksi semakin cepat dan semakin tinggi temperature larutan maka laju reaksi semakin cepat.
PEMBAHASAN
Percobaan ini dilakukan dengan 2 bagian, bagian pertama adalah memvariasikan konsentrasi reaktan, adapun variasi yang diberikan dapat dilihat pada tabel 1. Bagian kedua adalah memvariasikan temperatur.
Pada bagian pertama, yakni pengaruh konsentrasi terhadap laju, dilakukan sebanyak 5 kali run dengan variasi volume aquades, larutan KI dan H2O2.
Sedangkan untuk larutan HCl 1M, Amilum, dan Na2S2O3 0,04 M dibuat tetap.
Seluruh komposisi dalam percobaan dibuat setengah resep dari modul yang sudah ada. Pada percobaan ini, ketika aquades + HCL+ KI+ amilum+ Na2S2O3,
+¿+H2O2→ I2+2H2O
reaksi berlangsung sangat cepat
I2 +Pati → Kompleks (biru tua)
Aquades berfungsi sebagai larutan pengencer serta mencuci alat, larutan HCl sebagai pemberi suasana asam, larutan KI sebagai substrat atau reduktor, amilum sebagai pembentuk kompleks amilum iodin, larutan Na2S2O3 sebagai
penangkap iodin agar tidak terakumulasi sehingga tetap dalam bentuk ion iodida atau sebagai reagen pembatas, sedangkan larutan H2O2 berfungsi sebagai
oksidator. Berdasarkan teori, semakin tinggi konsentrasi reaktan maka laju reaksi semakin cepat. Hal ini karena semakin tinggi konsentrasi, partikelnya semakin banyak sehingga kemungkinan terjadi tumbukan efektif semakin besar. Hal ini terbukti dalam percobaan 1-5 konsentrasi semakin bertambah dan waktu yang dibutuhkan untuk perubahan warna nya semakin cepat sehingga laju reaksi semakin cepat pula. Dari data hasil pengamatan kita dapat menghitung dan mencari grafik laju reaksi, sebagai berikut :
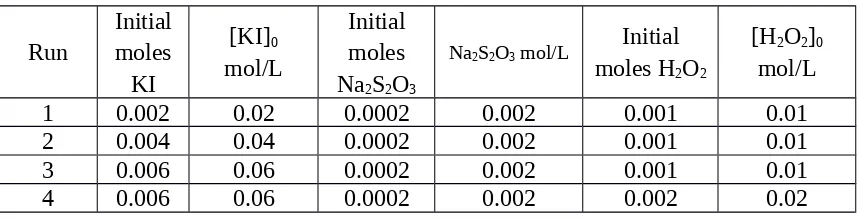
Pengaruh konsentrasi reaktan pada laju reaksi kimia
Diketahui: [KI] = 1, [Na2S2O3]=0,04, dan [H2O2] = 0,2
Tabel 5. Tabel perhitungan Konsentrasi
Run [KI] 1 1.0 0.002 0.002 0.040 0.005 0.0002 0.200 0.005 0.001 2 1.0 0.004 0.004 0.040 0.005 0.0002 0.200 0.005 0.001 3 1.0 0.006 0.006 0.040 0.005 0.0002 0.200 0.005 0.001 4 1.0 0.006 0.006 0.040 0.005 0.0002 0.200 0.010 0.002 5 1.0 0.006 0.006 0.040 0.005 0.0002 0.200 0.020 0.004
Tabel 6. Tabel Perhitungan Konsentrasi mula-mula
Run
1 0.002 0.02 0.0002 0.002 0.001 0.01
2 0.004 0.04 0.0002 0.002 0.001 0.01
3 0.006 0.06 0.0002 0.002 0.001 0.01
5 0.006 0.06 0.0002 0.002 0.004 0.04
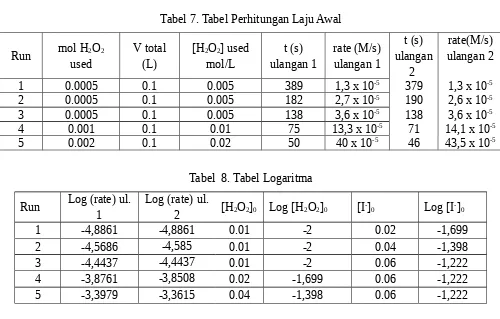
Tabel 7. Tabel Perhitungan Laju Awal
Run mol H2O2
Tabel 8. Tabel Logaritma
Run Log (rate) ul. 1
Log (rate) ul.
2 [H2O2]0 Log [H2O2]0 [I -]
0 Log [I-]0
1 -4,8861 -4,8861 0.01 -2 0.02 -1,699
2 -4,5686 -4,585 0.01 -2 0.04 -1,398
3 -4,4437 -4,4437 0.01 -2 0.06 -1,222
4 -3,8761 -3,8508 0.02 -1,699 0.06 -1,222
5 -3,3979 -3,3615 0.04 -1,398 0.06 -1,222
Dari data diatas, diperoleh 2 grafik dari tabel 8 untuk menentukan orde reaksi dari [H2O2] dan [I-]. Grafik diatas diperoleh dari persamaan berikut:
−¿
Orde reaksi [H2O2] diperoleh dari persamaan: −¿
−¿ I¿
¿ k
nlog
[
H2O2]+log¿ ¿¿ v=mlog¿
log¿
-2.1 -2 -1.9 -1.8 -1.7 -1.6 -1.5 -1.4 -1.3
-6 -5 -4 -3 -2 -1 0
f(x) = 2.11x - 0.4 R² = 0.92
grafil ulangan 1
grafil ulangan 1 Linear (grafil ulangan 1)
Grafik 2. Grafik Log (rate) terhadap Log [H2O2]0
-1.8 -1.7 -1.6 -1.5 -1.4 -1.3 -1.2 -1.1
-6 -5 -4 -3 -2 -1 0
f(x) = 2.13x - 1.35 R² = 0.56
grafil ulangan 1
grafil ulangan 1 Linear (grafil ulangan 1)
Grafik 3. Grafik Log (rate) terhadap Log [I-] 0
Dari persamaan grafik yang didapat ulangan pertama, orde reaksi untuk I- adalah 2,1.
-2.1 -2 -1.9 -1.8 -1.7 -1.6 -1.5 -1.4 -1.3
-6 -5 -4 -3 -2 -1 0
f(x) = 2.18x - 0.25 R² = 0.92
grafik ulangan 2
grafik ulangan 2 Linear (grafik ulangan 2)
-1.8 -1.7 -1.6 -1.5 -1.4 -1.3 -1.2 -1.1
-6 -5 -4 -3 -2 -1 0
f(x) = 2.18x - 1.27 R² = 0.55
grafik ulangan 2
grafik ulangan 2 Linear (grafik ulangan 2)
Grafik Log (rate) terhadap Log [I-] 0
Sedangkan pada ulangan ke-dua didapat persamaan grafik, orde reaksi untuk [H2O2] adalah 2,18 dibulatkan menjadi 2,2 dan ordo reaksi untuk I- adalah 2,18 dibulatkan menjadi 2,2. Dari percobaan ulangan pertama ini diperoleh orde reaksi dari [H2O2] = 2,1 dan orde reaksi [I-] =2,1 . Sehingga diperoleh persamaan laju reaksi:
−¿ I¿ ¿ ¿
v=k[H2O2]2,1¿
Dan pada percobaan ulangan ke-dua diperoleh orde reaksi dari [H2O2] = 2,2 dan orde reaksi [I-] =2,2 . Sehingga diperoleh persamaan laju reaksi:
−¿ I¿ ¿ ¿
v=k[H2O2]2,2¿
0.02 0.02 0.03 0.03 0.04 0.04 0.05 0.05
-6 -5 -4 -3 -2 -1 0
f(x) = - 71.69x - 1.87
R² = 0.87 Linear ()
1/T
ln
1
/t
Berdasarkan teori, semakin tinggi temperatur maka laju reaksinya semakin besar, hal ini karena semakin tinggi temperatur maka kemungkinan terjadinya tumbukan molekul reaktan semakin besar, sehingga reaksi terjadi semakin cepat. Hal ini terbukti dalam percobaan, bisa dilihat dilampiran, bahwa semakin tinggi temperature yang digunakan laju reaksi semakin cepat berlangsung. Kemudian diolah datanya untuk menentukan nilai Ea dan A (factor Arrhenius). Didapat nilai Ea adalah sebesar
Diperoleh energi aktivasi ln K = ln A - Ea RT
Ln -71,686 = ln A - 8,314.301Ea
KESIMPULAN
Dari hasil percobaan yang telah dilakukan dapat diambil beberapake simpulan antara lain:
1. Semakin besar volume reaktan maka laju reaksi semakin cepat 2. Semakin tinggi temperature larutan maka laju reaksi semakin cepat 3. Persamaan laju pada percobaan ini adalah :
Ulangan 1 adalah V= k x [H2O2]2,1 x [l-]2,1 Ulangan 2 adalah V= k x [H2O2]2,2 x [l-]2,2 4. Diperoleh energi aktivasi ln K = ln A - Ea
Ln -71,686 = ln A - 8,314.301Ea
DAFTAR PUSTAKA
Atkins, P. W F.,Julio de Paula. (2010).“Physical Chemistry ninth edition”.New York :W. H Freeman and Company
Chang,Raymond.(2006). “Kimia Dasar : Konsep-Konsep Inti Jilid 2”. Jakarta : Erlangga
Oxtoby, D. W.(1999). “Prinsip-Prinsip Kimia Modern”. Jakarta: Erlangga.
Purba, Michael. (2007). “Kimia Untuk SMA kelas XI Semester 1”. Jakarta: Erlangga.
Schwedt, G. (1994). “Chemistry Analitycal”. USA : John Wiley Sons Inc
Ulfin, Ita dkk.(2010). “Kimia Dasar”. ITS Press : Surabaya
Atkins, P.W. 1996. Kimia Fisika Jilid 2 Edisi Keempat. Erlangga. Jakarta.
![Grafik 2. Grafik Log (rate) terhadap Log [H2O2]0](https://thumb-ap.123doks.com/thumbv2/123dok/1419040.1521278/11.595.126.477.322.525/grafik-grafik-log-rate-terhadap-log-h-o.webp)
![Grafik 3. Grafik Log (rate) terhadap Log [I-]0](https://thumb-ap.123doks.com/thumbv2/123dok/1419040.1521278/12.595.127.475.77.285/grafik-grafik-log-rate-terhadap-log-i.webp)
