LAPORAN PRAKTIKUM KIMIA DASAR II
PERCOBAAN II KINETIKA KIMIA
NAMA : DEANU HARATINU TU’U
NIM : J1D114201
KELOMPOK : II (DUA)
ASISTEN : RARA IUDA VERDINA TUNGGAL
PROGRAM STUDI FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMBUNG MANGKURAT
PERCOBAAN II KINETIKA KIMIA
I. TUJUAN PERCOBAAN
Tujuan percobaan praktikum ini adalah untuk mempelajari pengaruh konsentrasi reaktan terhadap laju reaksi, mempelajari pengaruh temperatur terhadap laju reaksi, dan menentukan orde reaksi.
II. TINJAUAN PUSTAKA
II.1. Kinetika Kimia
Kinetika kimia adalah pengkajian laju dan mekanisme reaksi kimia. Besi lebih cepat berkarat dalam udara lembab daripada dalam udara kering, makanan lebih cepat membusuk bila tidak didinginkan. Ini merupakan contoh yang lazim dari perubahan kimia yang kompleks dengan laju yang beraneka menurut kondisi reaksi (Sunarya, 2002).
Pengertian kecepatan reaksi digunakan untuk melukiskan kelajuan perubahan kimia yang terjadi. Sedangkan pengertian mekanisme reaksi digunakan untuk melukiskan serangkaian langkah-langkah reaksi yang meliputi perubahan keseluruhan dari suatu reaksi yang terjadi. Dalam kebanyakan reaksi, kinetika kimia hanya mendeteksi bahan dasar permulaan yang lenyap dan hasil yang timbul, jadi hanya reaksi yang keseluruhan yang dapat diamati. Perubahan reaksi keseluruhan yang terjadi kenyataannya dapat terdiri atas beberapa reaksi yang berurutan, masing-masing reaksi merupakan suatu langkah reaksi pembentukan hasil-hasil akhir (Sastrohamidjojo, 2001).
II.2. Laju Reaksi
banyak kegunaan, misalnya dalam teknik kimia, dan kajian kesetimbangan kimia. Laju reaksi secara mendasar tergantung pada:
- Konsentrasi reaktan, yang biasanya membuat reaksi berjalan dengan lebih apabila konsentrasinya dinaikkan. Hal ini diakibatkan karena peningkatan pertumbukan atom per satuan waktu.
- Luas permukaan yang tersedia bagi reaktan untuk saling berinteraksi, terumata reaktan padat dalam sistem heterogen. Luas permukaan yang besar akan meningkatkan laju reaksi.
- Tekanan, dengan meningkatkan tekanan, kita menurunkan volume antar molekul sehingga akan meningkatkan frekuensi tumbukan molekul.
- Energi aktivasi, yang didefinisikan sebagai jumlah energi yang diperkukan untuk membuat reaksi bermulai dan berjalan secara spontan. Energi aktivasi yang lebih tinggi mengimplikasikan bahwa reaktan memerlukan lebih banyak energi untuk memulai reaksi daripada reaksi yang berenergi aktivasi lebih rendah.
- Temperatur, yang meningkatkan laju reaksi apabila dinaikkan, hal ini dikarenakan temperatur yang tinggi meningkatkan energi molekul, sehingga meningkatkan tumbukan antar molekul per satuan waktu.
- Keberadaan ataupun ketiadaan katalis. Katalis adalah zaat yang mengubah lintasan (mekanisme) suatu reaksi dan akan meningkatkan laju reaksi dengan menurunkan energi aktivasi yang diperlukan agar reaksi dapat berjalan. Katalis tidak dikonsumsi ataupun berubah selama reaksi, sehingga ia dapat digunakan kembali.
- Untuk beberapa reaksi, keberadaan radiasi elektromagnetik, utamanya ultraviolet, diperlukan untuk memutuskan ikatan yang diperlukan agar reaksi dapat bermulai. Hal ini utamanya terjadi pada reaksi yang melibatkan radikal
(Sukamto, 1989).
cabang ilmu kimia yang membahas tentang laju reaksi dan faktor-faktor yang mempengaruhinya. Laju atau kecepatan reaksi adalah perubahan konsentrasi pereaksi ataupun produk dalam suatu satuan waktu. Laju suatu reaksi dapat dinyatakan sebagai laju berkurangnya konsentrasi suatu pereaksi, atau laju bertambahnya konsentrasi suatu produk. Konsentrasi biasanya dinyatakan dalam mol per liter. Laju reaksi suatu reaksi kimia dapat dinyatakan dengan persamaan laju reaksi. Untuk reaksi berikut:
A + B → AB
Persamaan laju reaksi secara umum ditulis sebagai berikut: r=k
[
A]
m[
B]
nk sebagai konstanta laju reaksi, m dan n adalah orde parsial masing-masing pereaksi. Besarnya laju reaksi dipengaruhi oleh faktor-faktor sebagai berikut:
1. Sifat dan ukuran pereaksi 2. Konsentrasi pereaksi 3. Suhu pereaksi 4. Katalis (Sukamto, 1989).
Sifat pereaksi dan ukuran pereaksi menentukan laju reaksi. Semakin relatif dari sifat pereaksi, laju reaksi akan semakin bertambah atau reaksi berlangsung semakin cepat. Semakin luas permukaan zat pereaksi laju reaksi akan semakin bertambah, hal ini dijelaskan dengan semakin luas permukaan zat yang bereaksi maka daerah interaksi zat pereaksi semakin luas juga. Permukaan zat pereaksi dapat diperluas dengan memperkecil ukuran pereaksi. Jadi untuk meningkatkan laju reaksi, pada zat pereaksi dalam bentuk serbuk lebih baik bila dibandingkan dalam bentuk bongkahan.
Sifat dasar pereaksi. Zat-zat berbeda secara nyata dalam lajunya mereka mengalami perubahan kimia. Molekul hidrogen dan flour bereaksi secara meledak, bahkan pada temperatur kamar, dengan menghasilkan molekul hidrogen fluorida.
(sangat cepat pada temperatur kamar)
Pada kondisi serupa, molekul hidrogen dan oksigen bereaksi begitu lambat sehingga tidak nampak perubahan kimia:
2H2 + O2 → H2O
(Sunarya, 2002).
Pada umumnya jika konsentrasi zat semakin besar maka laju reaksinya semakin besar, dan sebaliknya jika konsentrasi pula, dan sebaliknya jika konsentrasi suatu zat semakin kecil maka laju reaksinya pun semakin kecil. Untuk beberapa reaksi, laju reaksinya dapat dinyatakan dengan persamaan matematik yang dikenal dengan hukum laju reaksi atau reaksi yang dinamakan orde reaksi. Menentukan orde reaksi dari suatu reaksi kimia pada prinsipnya menentukan seberapa besar pengaruh perubahan konsentrasi pereaksi terhadap laju reaksi (Keenan, 1979).
Laju reaksi kimia bertambah dengan naiknya temperatur. Biasanya kenaikan sebesar 10℃ akan melipatkan dua atau tiga laju suatu reaksi antara molekul-molekul. Kenaikan laju reaksi ini dapat diterangkan sebagian sebagai lebih cepatnya molekul-molekul bergerak kian kemari pada temperatur yang lebih tinggi dan karenanya bertabrakan satu sama lain lebih sering. Tetapi, ini belum menjelaskan seluruhnya, ke molekul-molekul lebih sering bertabrakan, tetapi mereka juga bertabrakan dengan dampak (benturan) yang lebih besar, karena mereka bergerak lebih cepat. Pada temperatur besar, karena makin banyak molekul yang memiliki kecepatan lebih besar dan karenanya memiliki energi cukup untuk bereaksi. Hampir semua reaksi menjadi lebih cepat bila suhu dinaikkan karena kalor yang diberikan akan menambah energi kinetik partikel pereaksi. Akibatnya jumlah dan energi tumbukan bertambah besar (Sunarya, 2002).
II.3. Katalis
kemudian terbentuk kembali sebagai zat bebas. Suatu reaksi menggunakan katalis disebut dengan reaksi katalis atau prosesnya disebut katalisme. Sifat katalis:
- Katalis tidak bereaksi secara permanen, karena tidak mengalami perubahan kimia selama reaksi.
- Katalis tidak mempengaruhi hasil akhir reaksi.
- Katalis tidak memulai reaksi tapi hanya mempengaruhi lajunya. - Katalis bekerja efektif pada suhu optimum.
- Suatu katalis hanya mempengaruhi laju reaksi spesifik, berarti katalis bekerja pada satu reaksi atau sejenis reaksi dan tidak untuk reaksi jenis lain.
- Keaktifan katalis dapat diperbesar zat lain yang disebut promoter.
- Hasil suatu reaksi kadang-kadang dapat bertindak sebagai katalis dan disebut autokatalis.
- Katalis dapat bereaksi dengan zat lain sehingga sifat katalisnya hilang. - Katalis yang dapat memperlambat reaksi disebut katalis negatif
(Sunarya, 2002).
Berdasarkan fasanya, dapat dibedakan menjadi 2, yaitu katalis homogen dan katalis heterogen.
- Katalis homogen adalah katalis yang mempunyai fasa yang sama dengan pereaksi, mungkin gas, cair, dan padat.
- Katalis heterogen adalah katalis yang mempunyai fasa yang berbeda dengan pereaksi. Umumnya zat katalis ini berupa zat padat dan pereaksinya cair atau gas
(Sunarya, 2002).
dan alkali tanah yang bersifat basa, murah, dan menghasilkan konversi yang tinggi. Katalis basa heterogen umumnya berupa oksida logam dan logam oksida berpenyangga. Katalis heterogen oksida logam yang sering digunakan untuk reaksi transesterifikasi adalah CaO karena harganya murah, mudah didapat, dan tidak terlalu beracun (Fanny dkk, 2012).
III. ALAT DAN BAHAN A. Alat
Alat-alat yang digunakan pada percobaan ini adalah 6 buah tabung reaksi, stopwatch, penangas air, termometer, pipet tetes, 5 buah erlenmeyer, labu takar, dan buret.
B. Bahan
Bahan-bahan yang digunakan pada percobaan ini adalah HCl 0,1 N, HCl 0,05 N, HCl 0,01 N, Na2S2O3 0,05 N, Na2S203 0,1 N, Na2S203
0,01 N, KMnO4 0,1 N, H2C2O4 0,1 N, dan akuades.
IV. PROSEDUR PERCOBAAN
A. Menentukan Pengaruh Konsentrasi Reaktan Terhadap Laju Reaksi
A.1. Pengaruh Konsentrasi HCl
1. Menyiapkan 6 buah tabung reaksi dengan komposisi sebagai berikut:
Pereaksi
Tabung reaksi
ke-1 2 3 4 5 6
Na2S2O3 0,1 N 5 ml – 5 ml – 5 ml –
HCl 0,1 N – 5 ml – _ – _
HCl 0,05 N _ _ _ 5 ml _ _
2. Menuangkan tabung reaksi 2 ke tabung reaksi 1, tabung reaksi 4 ke tabung reaksi 3, dan tabung reaksi 6 ke tabung reaksi 5 dengan cepat.
3. Mencatat perubahan warna dan waktu yang diperlukan reaksi yaitu sampai tepat mulai terjadi kekeruhan.
A.2. Pengaruh Konsentrasi Na2S2O3
Dengan menggunakan pereaksi di bawah ini, mengerjakan seperti pada prosedur a.
Pereaksi Tabung reaksi
ke-1 2 3 4 5 6
HCl 0,1 N 5 ml – 5 ml – 5 ml –
Na2S2O3 0,1 N – 5 ml – _ – _
Na2S2O3 0,05 N _ _ _ 5 ml _ _
Na2S2O3 0,01 N _ _ _ _ 5 ml
B. Menentukan Pengaruh Temperatur Terhadap Laju Reaksi
1. Menyiapkan 6 buah tabung reaksi dengan komposisi sebagai berikut:
Pereaksi Tabung reaksi ke...
1 2 3 4 5 6
HCl 0,1 N 5 ml – 5 ml – 5 ml –
Na2S2O3 0,1 N – 5 ml – 5 ml – 5 ml
Suhu Kamar 50C 100C
2. Mengatur temperatur dari tabung reaksi sesuai tabel dengan menempatkan tabung reaksi di dalam penangas air.
4. Mencatat waktu yang diperlukan mulai dari isi kedua tabung dicampurkan hingga tepat terjadi perubahan warna.
C. Menentukan Orde Reaksi
1. Mengisi buret dengan larutan KMnO4 0,1 N.
2. Menyiapkan 5 buah erlenmeyer, mengisinya dengan H2C2O4 0,1
N dan akuades (komposisi setiap erlenmeyer sesuai tabel di bawah).
3. Menambahkan KMnO4 ke dalam setiap erlenmeyer dari dalam
buret dengan jumlah sesuai tabel berikut:
Pereaksi
Erlenmeyer
1 2 3 4 5
H2C2O4 0,1 N 5 ml 10 ml 15 ml 10 ml 10 ml
KMnO4 0,1 N 2 ml 2 ml 2 ml 3 ml 4 ml
Akuades 13 ml 8 ml 3 ml 7 ml 6 ml
4. Mencatat waktu yang diperlukan mulai dari KMnO4 ditambahkan
hingga warna ungu tepat hilang.
V. HASIL DAN PEMBAHASAN
A. Hasil dan Perhitungan 1. Hasil
a. Menentukan Pengaruh Konsentrasi Reaktan Terhadap Laju Reaksi
a.1. Pengaruh konsentrasi HCl
Menyiapka
Tabung ke-2 ke tabung ke-1
kembali ke-2
tabung ke-4 ke tabung ke-3
kembali ke-4
tabung ke-6 ke tabung ke-5
kembali ke-6
a.2. Pengaruh konsentrasi Na2S2O3
an pereaksi
Tabung ke-2 ke tabung ke-1
tabung ke-4 ke tabung ke-3
tabung ke-4 ke tabung ke-3.
5 ml Na2S2O3 0,1 N + 5 ml HCl 0,1
b. Menentukan Pengaruh Temperatur Terhadap Laju Reaksi Langkah Percobaan Hasil Pengamatan
kan pereaksi untuk
- Erlenmeyer 2
- Erlenmeyer
3
- Erlenmeyer
4
- Erlenmeyer
5
ml akuades
ke – 1 = 781 sekon
perubahan warna ungu ke merah bata
10 ml H2C2O4 + 2 ml KMnO4 + 8
ml akuades
ke – 1 = 502 sekon
perubahan warna ungu ke merah bata
15 ml H2C2O4 + 2 ml KMnO4 + 3
ml akuades
ke – 1 = 397 sekon
perubahan warna ungu ke merah bata
10 ml H2C2O4 + 3 ml KMnO4 + 7
ml akuades
ke – 1 = 579 sekon
perubahan warna ungu ke merah bata
10 ml H2C2O4 + 4 ml KMnO4 + 6
ke – 1 = 620 sekon
perubahan warna ungu ke merah bata
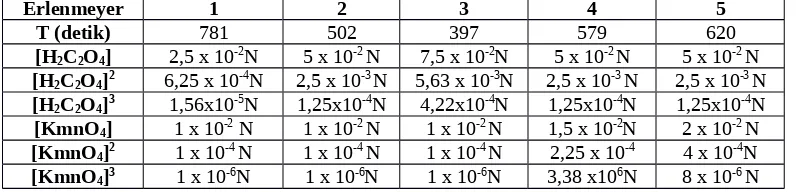
2. Perhitungan
Percobaan 4 Penentuan Orde Reaksi Diketahui : N H2C2O4 = 0,1 N
Voksalat.N oksalat
Vtotallarutan V H
Voksalat.N oksalat
Vtotallarutan V H2C2O4 = 10 ml = 0,01 lt
Voksalat.N oksalat
Vtotallarutan V H2C2O4 = 15 ml = 0,015 lt
= [
0,015.0,1
= [0,075]3
= 4,22 . 10-4
2. Konsentrasi KMnO4
[KMnO4] =
Vpermanganat.N permanganat
Vtotallarutan V KMnO4 = 2 ml = 0,002
V permanganat.N permanganat
Vtotallarutan V KMnO
Vpermanganat.N permanganat
t = 502 s
T (detik) 781 502 397 579 620
[H2C2O4] 2,5 x 10-2N 5 x 10-2 N 7,5 x 10-2N 5 x 10-2 N 5 x 10-2 N
Pada praktikum kali ini, dilakukan sebuah percobaan tentang kinetika kimia, yaitu pengkajian laju dan mekanisme reaksi kimia. Praktikan dalam percobaan ini akan mengamati faktor-faktor yang mempengaruhi laju reaksi, dan membandingkan hasil percobaan dengan teori yang telah diajarkan. Faktor-faktor yang mempengaruhi laju reaksi adalah sifat reaktan, konsentrasi, luas permukaan, temperatur, dan juga katalis.
Percobaan pertama adalah untuk mengetahui pengaruh dari faktor konsentrasi reaktan terhadap laju reaksi. Percobaan ini dibagi dalam dua percobaan larutan, yaitu larutan HCl dan larutan Na2S2O3. Yang pertama
HCl 0,1 N, 5 ml HCl 0,05 N, dan 5 ml HCl 0,01 N. Perbedan dalam konsentrasi masing-masing larutan HCl dimaksudkan agar praktikan dapat mengamati pengaruh konsentrasi larutan tersebut terhadap laju reaksi.
Pertama, tabung reaksi dua yang berisi HCl 0,1 N dituangkan ke dalam tabung reaksi satu, yang kemudian dituangkan kembali secara terus-menerus antara tabung reaksi satu dan tabung reaksi dua. Dari percobaan keempat. Tabung reaksi keempat berisi HCl 0,05 N yang dilakukan prosedur yang sama seperti tabung reaksi satu dan tabung reaksi dua. Setelah dilakukan penuangan dengan cepat antara tabung reaksi tiga dan tabung reaksi empat, didapatkan data hasil pengamatan bahwa larutan mulai tepat keruh pada detik ke-70. Setelah didapatkan hasil ini, dilanjutkan dengan percobaan tabung reaksi berikutnya; tabung reaksi lima dan tabung reaksi enam. Saat dilakukan penuangan tabung reaksi enam ke tabung reaksi lima, pengamatan sampai terjadi kekeruhan ternyata memakan waktu yang lebih lama, yaitu 85 detik. Dari ketiga percobaan tentang pengaruh konsentrasi reaktan ini, memperlihatkan hasil yang jelas tentang pengaruh konsentrasi HCl tersebut terhadap laju reaksi.
Kemudian dilanjutkan dengan percobaan menggunakan larutan Na2S2O3. Dengan larutan yang akan dilakukan pengujian adalah HCl 0,1 N,
Na2S2O3 0,1 N, Na2S2O3 0,05 N, Na2S2O3 0,01 N. Menggunakan prosedur yang
sama dengan percobaan larutan HCl, ternyata percobaan dengan Na2S2O3 ini
besar konsentrasi larutan ternyata berpengaruh terhadap laju reaksi yang terjadi.
Berikutnya adalah percobaan untuk mengetahui pengaruh temperatur terhadap laju reaksi. Percobaan ini dilakukan menggunakan larutan yang sama dengan percobaan sebelumnya, namun hanya menggunakan dua larutan saja, yaitu Na2S2O3 0,1 N dan HCl 0,1 N. Dalam percobaan ini dilakukan tiga kali
percobaan yang berbeda, dalam Pertama-tama dilakukan pencampuran larutan HCl 0,1 N dan Na2S2O3 0,1 N pada suhu kamar ( 33℃¿ , dan didapatkan
data hasil pengamatan bahwa ternyata terjadi kekeruhan pada detik ke-33. Sementara pada percobaan berikutnya yaitu pada suhu 50 ℃ dan suhu
100℃ , berturut-turut menunjukkan kekeruhan pada detik ke-10 dan detik ke-3. Hasil ini menunjukkan gambaran yang jelas tentang pengaruh temperatur terhadap laju reaksi.
Berikutnya adalah penentuan orde reaksi. Percobaan ini adalah agar praktikan dapat menentukan orde suatu reaktan terhadap suatu reaksi. Dalam percobaan ini digunakan larutan KMnO4 0,1 N dan H2C2O4 0,1 N. Pada
erlenmeyer pertama dicampurkan H2C2O4 sebanyak 5 ml dengan KMnO4
sebanyak 2 ml serta akuades sebanyak 13 ml, waktu yang diperlukan untuk reaksi ini adalah 781 detik. Pada erlenmeyer kedua dicampurkan H2C2O4
sebanyak 10 ml dengan KMnO4 sebanyak 2 ml serta akuades sebanyak 8 ml,
waktu yang diperlukan untuk reaksi ini adalah 502 detik. Pada erlenmeyer ketiga dicampurkan H2C2O4 sebanyak 15 ml dengan KMnO4 sebanyak 2 ml
serta akuades sebanyak 3 ml, waktu yang diperlukan untuk reaksi ini adalah 397 detik. Pada erlenmeyer keempat dicampurkan H2C2O4 sebanyak 10 ml
dengan KMnO4 sebanyak 4 ml serta akuades sebanyak 6 ml, waktu yang
diperlukan untuk reaksi ini adalah 579 detik. Pada erlenmeyer kelima dicampurkan H2C2O4 sebanyak 10 ml dengan KMnO4 sebanyak 8 ml serta
akuades sebanyak 2 ml, waktu yang diperlukan untuk reaksi ini adalah 620 detik.
VI. KESIMPULAN
1. Kenaikan suhu akan memberikan energi kinetik bagi partikel pereaksi sehingga reaksi akan semakin cepat.
2. Konsentrasi pereaksi berpengaruh terhadap laju reaksi, yaitu semakin besar konsentrasi dari pereaksi yang digunakan maka semakin cepat juga laju reaksi yang terjadi di antara dua zat yang dicampurkan.
3. Orde reaksi MnO4- dan H2C2O4 memerlukan waktu yang cukup lama
untuk terjadinya perubahan warna.
DAFTAR PUSTAKA
Fanny, Widdy Andya, Subagjo, Tirto Prakoso. 2012. ‘Pengembangan Katalis Kalsium Oksida untuk Sintesis Biodiesel’. Jurnal Teknik Kimia Indonesia, Vol. 11, No. 2, 2012, 66-73.
Keenan. 1979. Kimia untuk Universitas. Jakarta: Erlangga.
Sastrohamidjojo, Hardjono. 2001. Kimia Dasar. Yogyakarta: Gadjah Mada University Press.
Sunarya, Yayan. 2002. Kimia Dasar II Berdasarkan Prinsip-Prinsip Kimia Terkini. Bandung: Alkemi Grafisindo Press.
0.1 0.05 0.01
Konsentrasi HCl Terhadap t (waktu)
Konsentrasi HCl
Pengaruh Konsentrasi Na2S2O3 Terhadap t (waktu)
1.28 1.99 2.51 1.72 1.61
Grafik Hubungan [H2SO4] terhadap 1/t
Linear ()
1.28 1.99 2.51 1.72 1.61 0
Grafik Hubungan [H2C2O4]2 terhadap t (waktu)
1.28 1.99 2.51 1.72 1.61
Grafik Hubungan [H2C2O4]3 terhadap t (waktu)
Linear ()
1.28 1.99 2.51 1.72 1.61 0
Grafik Hubungan [KmnO4] terhadap 1/t
1.28 1.99 2.51 1.72 1.61
Grafik Hubungan [KmnO4]2 terhadap 1/t
Linear ()
1.28 1.99 2.51 1.72 1.61 0
![Grafik Hubungan [H2C2O4]2 terhadap t (waktu)](https://thumb-ap.123doks.com/thumbv2/123dok/1582572.1548173/22.595.154.475.101.302/grafik-hubungan-h-c-o-terhadap-t-waktu.webp)
![Grafik Hubungan [H2C2O4]3 terhadap t (waktu)](https://thumb-ap.123doks.com/thumbv2/123dok/1582572.1548173/23.595.154.470.446.642/grafik-hubungan-h-c-o-terhadap-t-waktu.webp)
![Grafik Hubungan [KmnO4]2 terhadap 1/t](https://thumb-ap.123doks.com/thumbv2/123dok/1582572.1548173/24.595.159.466.450.683/grafik-hubungan-kmno-terhadap-t.webp)