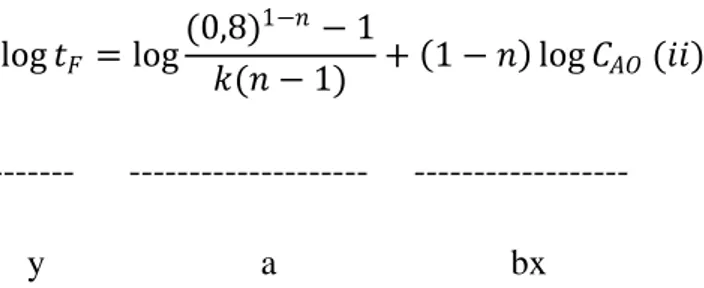KIMIA FISIKA
Kinetika Kimia
Departemen Teknik Kimia Universitas Indonesia
Annisa Permatadietha
Eka Nurin Sharfina I.
Hans Dinata
1006661203
1006661235
100668647
1
KINETIKA KIMIA 2
KINETIKA KIMIA
Kinetika kimia adalah bagian ilmu kimia fisika yang mempelajari laju reaksi kimia, faktor - faktor yang mempengaruhinya serta penjelasan hubungannya terhadap mekanisme reaksi. Kinetika kimia disebut juga dinamika kimia, karena adanya gerakan molekul, elemen atau ion dalam mekanisme reaksi dan laju reaksi sebagai fungsi waktu. Mekanisme reaksi dapat diramalkan dengan bantuan pengamatan dan pengukuran besaran termodinamika suatu reaksi, dengan mengamati arah jalannya reaktan maupun produk suatu sistem. Syarat untuk terjadinya suatu reaksi kimia bila terjadi penurunan energi bebas. Dipertanyakan, berapa cepat reaksi reaksi berlangsung , dengan perkataan lain, berapa nilai laju reaksi itu.
I. Laju Reaksi
Laju reaksi menyatakan laju berkurangnya jumlah reaktan atau laju bertambahnya jumlah produk dalam satuan waktu. Satuan jumlah zat bermacam-macam, misalnya gram, mol, atau konsentrasi. Sedangkan satuan waktu digunakan detik, menit, ataupun jam. Dalam reaksi kimia banyak digunakan zat kimia yang berupa larutan atau berupa gas dalam keadaan tertutup, sehingga dalam laju reaksi digunakan satuan konsentrasi (molaritas). Perhatikan reaksi berikut.
Persamaan laju reaksi didefinisikan sebagai perubahan jumlah molekul reaktan atau produk dalam suatu waktu tertentu, dengan formulasi sebagai berikut.
𝑳𝒂𝒋𝒖 𝑹𝒆𝒂𝒌𝒔𝒊 = −𝒅𝒏𝑹
𝒅𝒕 = 𝒅𝒏𝑷
𝒅𝒕 ….(1)
Perhatikanlah reaksi berikut
𝐴 + 𝐵 → 𝐶
ketika pada suatu saat, konsentrasi setiap molekul reaksi itu adalah 𝐴 , 𝐵 , dan 𝐶 . Salah satu pengukuran laju rekasi adalah laju pembentukan atau konsumsi spesies tertentu. Misalnya, laju konsumsi reaktan A adalah
KINETIKA KIMIA 3 𝒗𝑨 = −
𝒅 𝑨 𝒅𝒕 dan laju pembentukan produk C :
𝒗𝑪 = 𝒅 𝑪 𝒅𝒕
Kedua laju itu positif sehingga berdasarkan reaksi diatas, stoikiometri reaksi ditunjukkan dalam persamaan berikut.
𝒅 𝑪 𝒅𝒕 = − 𝒅 𝑨 𝒅𝒕 = − 𝒅 𝑩 𝒅𝒕
karena kapanpun molekul C terbentuk, satu molekul A dan satu molekul B musnah. Untuk reaksi dengan stoikiometri lebih rumit, seperti:
𝐴 + 2𝐵 → 3𝐶 + 𝐷
hubungan antara berbagai laju pembentukan dan konsumsi dari reaksi diatas adalah sebagai berikut. 𝒅 𝑪 𝒅𝒕 = 𝟏 𝟑 𝒅 𝑪 𝒅𝒕 = − 𝒅 𝑨 𝒅𝒕 = − 𝟏 𝟐 𝒅 𝑩 𝒅𝒕
Ada beberapa hal yang dapat mempengaruhu laju reaksi, diantaranya: A. Konsentrasi
Semakin besar konsentrasi zat-zat yang bereaksi maka laju reaksi akan semakin cepat dengan
B. Luas permukaan bidang sentuh
Semakin kecil ukuran zat maka semaki besar luas permukaannya sehingga laju reaksi semakin cepat.
C. Suhu
Suhu juga berbanding lurus dengan laju reaksi dengan persamaan Vt = V0 (nt2 – t1/∆t) dimana V adalah laju reaksi, t adalah suhu, ∆t adalah kenaikan suhu dan n adalah perubahan laju reaksi terhadap kenaikan suhu. Sedangkan jika yang diketahui adalah waktu, maka persamaannya menjadi Tt = T0 (1/n)t2 – t1/∆t
KINETIKA KIMIA 4 D. Katalisator
Katalisator adalah zat yang dapat mempercepat atau memperlambat reaksi tanpa mengalami perubahan pada akhir reaksi. Aktivator adalah katalis yang dapat menurunkan energi aktivasi suatu larutan sehingga laju reaksi semakin cepat, sedangkan inhibitor adalah katalis yang memperlambat laju reaksi. Katalis anorganik adalah katalis yang berasal dari senyawa anorganik seperti Ni pada pembuatan margarin dan Fe pada pembuatan gas NH3 , sedangkan katalis organik adalah katalis yang berasal dari senyawa organik seperti ragi dan enzim
II. Hukum laju Reaksi
Dari hasil percobaan diketahui bahwa umumnya laju reaksi tergantung pada konsentrasi awal dari zat-zat pereaksi, pernyataan ini disebut Hukum Laju Reaksi. Hukum laju adalah persamaan matermatis yang menggambarkan laju reaksi sebagai fungsi dari konsentrasi dari spesi yang terlibat dalam reaksi. Secara umum untuk reaksi pA + qB → rC maka hukum lajunya adalah:
𝐯 = 𝐤[𝐀]𝐦[𝐁]𝐧 ….(2)
dengan:
v = Laju reaksi (mol dm-3 det-1 ) k = Tetapan laju reaksi
m = orde reaksi terhadap A n = orde reaksi terhadap B
[A] = Konsentrasi awal A (mol dm) [B] = Konsentrasi awal B (mol dm)
Suku k , konstanta laju, adalah konstanta kesebandingan antara laju reaksi dan konsentrasi reaktan. Konstanta laju dapat ditentukan melalui pengukuran laju reaksi di unit konsentrasi reaktan atau mengetahui laju di beberapa konsentrasi reaktan dengan menggunakan persamaan:
KINETIKA KIMIA 5 Untuk reaksi yang hanya melibatkan 1 reaktan, jiika c0 adalah konsentrasi mula mula reaktan dan c adalah konsentrasi reaktanpada waktu t, persamaan diferensiasi lajunya adalah:
-dc/cn = k dt …(4) (n = orde reaksi)
Dengan mengintegralkannya kita peroleh:
−𝒅𝒄𝒄𝒏 = 𝒌 𝒅𝒕 ….(5)
Maka ketika nilai n disubstitusi dengan hasilnya adalah: n = 0 → k = (co-c) / t
n = 1 → c = co e-kt
n = 2 → k = 1/t [1/c - 1/c0] n = n → k = 1/(n-1)t [1/(cn-1
) – 1/(c0n-1)]
Untuk reaksi yang melibatkan lebih dari 1 reaktan, dimana c = x dan c0 = a-x , persamaan lajunya menjadi:
𝒅𝒙
(𝒂−𝒙)𝒏= 𝒌𝒅𝒕 ….(6)
Maka ketika nilai n disubstitusi dengan hasilnya adalah: n = 0 → k = x / t
n = 1 → k = 2.303/t log a/(a-x) n = 2 → k = 1/t [1/a – x - 1/a]
n = n → k = 1/(n-1)t [1/(a-x)n-1– 1/(an-1
)]; n ≥ 2
III. Orde dan Molekularitas
Laju reaksi seringkali diperoleh berbanding langsung dengan konsentrasi reaktan dengan bilangan pangkat yang sederhana yang disebut orde reaksi. Dalam persamaan laju, v = k[A]m[B]n , maka reaksi ini berorde m terhadap A dan dan berorde n terhadap. B, sedangkan orde keseluruhannya adalah m+n. Umumnya orde reaksi harus ditentukan melalui percobaan dan tidak dapat ditentukan dari persamaan setara keseluruhannya. Dari percobaan-percobaan itu untuk mencari orde A maka harus dilihat percobaan-percobaan dimana nilai [B] sama, dan sebaliknya untuk mencari orde dari B maka dilihat percobaan dimana nilai [A] sama.
Molekularitas adalah jumlah koefisien stoikiometri reaktan yang terlibat dalam persamaan reaksi stoikiometri, misalnya:
2A +3B = 3C +2D Maka molekularitasnya adalah 2 + 3 = 5.
KINETIKA KIMIA 6 Tak selamanya nilai molekularitas dan order adalah sama. Reaksi yang memilki nilai molekularitas dan orde total yang berbeda akibat kehadiran suatu reaktan dikenal sebagai reaksi pseudo-order.
Orde reaksi dapat menjadi basis dalam mengelompokan jenis jenis reaksi. Secara umum orde reaksi selalu bernilai antara 0 sampai 3.
3.1 Reaksi Orde Nol
Reaksi dikatakan berorde nol terhadap salah satu pereaksinya apabila perubahan konsentrasi oereaski tersebut tidak mempengaruhi laju reaksi. Persamaan laju reaksinya ialah:
v = k [A]0 = k ....(7)
maka laju reaksi orde ke-nol adalah suatu konstanta, tidak bergantung pada konsentrasi reaktan, dimana integrasi persamaaannya adalah:
𝒅𝒙 = 𝒌𝒅𝒕
x = kt ….(8)
Gbr. 1 Grafik Reaksi Orde pertama
sumber: http://kimia-asyik.blogspot.com/2009/12/grafik-orde-reaksi.html
Untuk waktu paruh, yaitu waku yang dibutuhkan suatu reaktan untuk meluruhkan sebagian konsentrasi semula, dimana t = t1/2 dan x = a/2 persamaannya adalah:
KINETIKA KIMIA 7 3.2 Reaksi Orde Satu
Suatu reaksi dikatakan berorde 1 jika laju reaksi berbanding lurus dengan konsentrasi reaktan. Maka persamaan lajunya adalah
dx/ (a – x) = k dt ....(10)
dengan mengintegralkan persamaan tersebut didapatkan persamaan:
ln[A] / [A]0 = -kt ....(11)
dimana : k = 𝟏𝒕𝒍𝒏𝒂−𝒙𝒂 ....(12)
k = 𝟐.𝟑𝟎𝟐𝒕 𝒍𝒐𝒈𝒂−𝒂/𝟐𝒂 ....(13) dari persamaan ini dapat dihitung konstanta reaksi dari reaksi orde pertama. Selain melalui persamaan tersebut, menghitung konstanta reaksi dapat juga melalui waktu paruh. Berdasarkan persamaan diatas dan definisi dari waktu paruh (t = t1/2 dan x = a/2) maka
t1/2 = 1/k . ln x/ (x/2) ....(14)
atau
t1/2 = 1/k. ln 2 = (2.303 log2) / k ....(15)
Gbr. 2 Grafik Reaksi Orde Pertama
KINETIKA KIMIA 8 3.3 Reaksi Orde Dua
Suatu reaksi dikatakan berorde 2 terhadap salah satu pereaksi jika laju reaksi merupakan pangkat 2 dari konsentrasi pereaksi tersebut. Persamaan lajunya adalah:
dx/(a-x)2 = kdt ....(16)
dengan mengintegralkannya kita memperoleh:
1/(a-x) = kt +Z ....(17)
dimana Z = 1/a ....(18)
sehingga k = 1/t = x/a (a-x) ....(19)
Jika dengan menggunakan definisi waktu paruh yaitu x = a / 2 maka besarnya waktu paru ditentukan oleh:
t1/2 = 1/ (ka) ....(20)
Gbr. 3 Grafik Reaksi Orde Dua
sumber: http://kimia-asyik.blogspot.com/2009/12/grafik-orde-reaksi.html
IV. Ketergantungan Laju Pada Temperatur 4.1 Persamaan Arrhenius
Energi aktivasi dapat dinotasikan sebagai energi minimum yang dibutuhkan untuk reaksi kimia spesifik yang terjadi. Reaksi energi aktivasi biasanya dinotasikan dalam Ea, dan diberikan dalam satuan kilojoule per mole. Tetapan laju bergantung pada suhu dan energi aktivasi seperti yang ditunjukkan oleh persamaan Arrhenius yaitu:
KINETIKA KIMIA 9 dimana besaran A menyatakan faktor frekuensi. Dari persamaan tersebut didapatkan persamaan:
ln k = ln Ae – (Ea/RT)
Untuk mengetahui konstanta laju reaksi pada suhu lain jika energi aktivasinya diketahui dapat digunakan persamaan:
ln k1/k2 = (Ea/R)[(T1-T2) / (T1T2)]
Faktor-faktor yang mempengaruhi Energi aktivasi (Ea): 1. Suhu
Kita dapat menggunakan persamaan Arrhenius untuk menggambarkan pengaruh dari perubahan suhu pada tetapan reaksi dan tentunya laju reaksi. Jika misalkan tetapan laju berlipat ganda, maka juga laju reaksi akan berlipat ganda juga. Fraksi molekul-molekul mampu untuk bereaksi dua kali lipat dengan peningkatan suhu sebesar 10ºC. Hal ini menyebabkan laju reaksi hampir menjadi berlipat ganda.
2. Faktor frekuensi (A)
Dalam persamaan ini kurang lebih konstan untuk perubahan suhu yang kecil. Kita perlu melihat bagaimana perubahan e-EA/RT atau energi dari fraksi molekul sama atau lebih
dengan aktivasi energi. 3. Katalis
Katalis akan menyediakan rute agar reaksi berlangsung dengan energi aktivasi yang lebih rendah.
4.2 Teori Tumbukan
Teori tumbukan didasarkan atas teori kinetik gas yang mengamati tentang bagaimana suatu reaksi kimia dapat terjadi. Menurut teori tersebut kecepatan reaksi antara dua jenis molekul A dan B sama dengan jumiah tumbukan yang terjadi per satuan waktu antara kedua jenis molekul tersebut. Jumlah tumbukan yang terjadi persatuan waktu sebanding dengan konsentrasi A dan konsentrasi B. Jadi makin besar konsentrasi A dan konsentrasi B akan semakin besar pula jumlah tumbukan yang terjadi. Teori tumbukan ini ternyata memiliki beberapa kelemahan, antara lain :
- tidak semua tumbukan menghasilkan reaksi sebab ada energi tertentu yang harus dilewati (disebut energi aktivasi = energi pengaktifan) untak dapat menghasilkan reaksi. Reaksi hanya akan terjadi bila energi tumbukannya lebih besar atau sama dengan energi pengaktifan (Ea).
KINETIKA KIMIA 10
A + B → T* → C + D
- molekul yang lebih rumit struktur ruangnya menghasilkan tumbukan yang tidak sama jumlahnya dibandingkan dengan molekul yang sederhana struktur ruangnya.
Teori tumbukan di atas diperbaiki oleh teori keadaan transisi atau teori laju reaksi absolut. Dalam teori ini diandaikan bahwa ada suatu keadaan yang harus dilewati oleh molekul-molekul yang bereaksi dalam tujuannya menuju ke keadaan akhir (produk). Keadaan tersebut dinamakan keadaan transisi. Mekanisme reaksi keadaan transisi dapat ditulis sebagai berikut:
dimana:
A dan B =molekul-molekul pereaksi T* = molekul dalam keadaan transisi
C dan D = molekul-molekul hasil reaksi
Secara diagram keadaan transisi ini dapat dinyatakan sesuai kurva berikut
Dari diagram terlibat bahwa energi pengaktifan (Ea) merupakan energi keadaan awal sampai dengan energi keadaan transisi. Hal tersebut berarti bahwa molekul-molekul pereaksi harus memiliki energi paling sedikit sebesar energi pengaktifan (Ea) agar dapat mencapai keadaan transisi (T*) dan kemudian menjadi hasil reaksi (C + D).
V. Meknisme Reaksi.
Reaksi elementer memiliki beberapa tahapan. Setiap tahap disebut reaksi antara (intermediet). Tahap reaksi elementer dikarakterisasi oleh kemolekulannya. Contohnya dalam reaksi total:
KINETIKA KIMIA 11 memiliki dua tahap reaksi elementer, yaitu:
1. Tahap elementer pertama adalah reaksi unimolekul
yaitu yang melibatkan dekomposisi atau penataan ulang suatu partikel tunggal, yaitu: O3(g) → O2(g) + O(g).
2. Tahap elementer kedua adalah reaksi bimolekul, yaitu ketika dua partikel bereaksi: O3(g) + O(g) → 2O2(g). Hukum laju untuk reaksi elementer dapat langsung diperoleh dari persamaan stoikiometrinya, sehingga orde reaksi merupakan koefisien dari reaktannya. Hukum Laju Untuk Tahap Elementer Umum:
Semua tahap elementer dalam mekanisme reaksi tidak memiliki laju yang sama. Biasanya terdapat satu tahap yang memiliki laju lebih lambat daripada yang lain, sehingga membatasi kecepatan berlangsungnya reaksi keseluruhan. Tahap reaksi elementer yang memiliki laju paling lambat disebut tahap penentu laju. Hukum laju dari tahap penentu laju adalah merupakan hukum laju dari reaksi keseluruhan.
Contoh:
NO2(g) + CO(g) → NO(g) + CO2(g)
memiliki hukum laju secara percobaan r = k[NO2]2. Hal ini karena reaksi di atas memiliki mekanisme dua-tahap, yaitu:
1. NO2(g) + NO2(g) → NO3(g) + NO(g) (lambat, penentu laju) 2. NO3(g) + CO(g) → NO2(g) + CO2(g) (cepat)
KINETIKA KIMIA 12 Sesuai dengan tahap lambat yang berperan sebagai penentu laju, maka hukum laju reaksi adalah:
r = k[NO2] [NO2] = k[NO2]2.
Hal ini sesuai hasil percobaan. Senyawa NO3 disebut senyawa intermediet yang dalam reaksi keseluruhan tidak muncul, karena segera setelah terbentuk akan bereaksi kembali membentuk spesi lain.
KINETIKA KIMIA 13 Contoh Soal 1
Konstanta laju orde pertama k, untuk reaksi ikatan C-N dalam N, N-dimetilnikotinamida diukur dengan temperatur yang berbeda dengan NMR (Nuclear Magnetic Resonance) adalah:
T oC 10.0 15.7 21.5 27.5 33.2 38.5 45.7 k sec-1 2.08 4.57 8.24 15.8 28.4 46.1 93.5 Tentukan energi aktivasi, E, dan faktor pre-eksponensial, 𝑘0 untuk rotasi Solusi
Energi aktivasi E adalah acuan pengukuran sensitivitas konstanta laju. E yang tinggi menandakan konstanta laju yang bertambah secara terus menerus dengan temperatur. Dari persamaan Arrhenius
𝑘𝑇 = 𝑘𝑂exp −𝐸
𝑅𝑇 (3 − 251) di mana 𝑘𝑇 = konstanta laju pada temperatur yang diketahui
𝑘𝑂 = faktor pre-eksponensial 𝐸 = energi aktivasi
𝑅 = kontanta gas (8.314 J/mol K) 𝑇 = temperatur absolut (K = 273,15 + 0
C)
Hal yang memungkinkan untuk menentukan energi aktivasi E dan faktor pre-eksponensial 𝑘𝑂.
Persamaan 3-251 dilinearkan sehingga menghasilkan 𝑙𝑛𝑘𝑇 = 𝑙𝑛𝑘𝑂− 𝐸
𝑅𝑇 (3 − 252)
Dengan memplot 𝑙𝑛𝑘𝑇 dan 1𝑇, gradien sama dengan −𝐸𝑅 didapatkan dan perpotongannya sama dengan 𝑙𝑛𝑘𝑂. Dari konstanta yang telah diketahui, energi aktivasi E dan faktor
pre-eksponensial 𝑘𝑂ditentukan. Persamaan 3-251 adalah bentuk
Tabel 3-8 T (0C) k (detik-1) T (K) 1/T 10 2,08 283,15 0,003532 15,7 4,57 288,85 0,003462 21,5 8,24 294,65 0,003394 27,5 15,8 300,65 0,003326
KINETIKA KIMIA 14 33,2 28,4 306,35 0,003264
38,5 46,1 311,65 0,003209 45,7 93,5 318,85 0,003136
𝑦 = 𝐴𝑒𝐵𝑋 (3 − 253) Persamaan 3-253 dilinearkan menghasilkan
ln 𝑦 = ln 𝐴 + 𝐵𝑋 3 − 254 di mana ln y = ln kT
ln A = ln kO B = -E/R X = 1/T
Program komputer PROG1 menentukan nilai konstanta A dan B. Tabel 3-9 menghasilkan hasil dari program dan kontanta A dan B.
Konstanta untuk persamaannya adalah:
A = 78728 x 1015
B = -0,94869 x 104
Koefisien korelasi = 0,99966
Gradien B = -E/R = -0,9487 x 104 dan A = kO = 7,873 x 1014. Energi aktivasi E = RB = 8314 x 104 (J/mol) dan E = 78,9 x 103 J/mol. Faktor pre-eksponensial adalah kO = 7,87 x 1014 detik -1
. Gambar 3-20 menghasilkan plot ln kT terhadap 1/T.
R.T Dillon (1932) mempelajari reaksi antara etilen bromida dan kalium iodida pada dalam 99 % metanol dengan data sebagai berikut:
Tabel 3-9
1/T Ln K eksperimen (detik-1) ln k teoritis (detik-1)
0,00353 0,732 0,795 0,00346 1,520 1,456 0,00339 2,109 2,103 0,00333 2,760 2,745 0,00326 3,346 3,332 0,00321 3,831 3,859 0,00314 4,538 4,546
KINETIKA KIMIA 15
Gambar 3-20 Konstanta laju k, untuk rotasi ikatan C-N dalam N,N-dimetildikotamida 0.0000 0.1000 0.2000 0.3000 0.4000 0.5000 0.6000 0.7000 0 20 40 60 80 100 Ko n st an ta laju ln k ( 1 /d e tik) 1/T (K)
KINETIKA KIMIA 16 Contoh Soal 2
𝐶2𝐻4𝐵𝑟2+ 3 𝐾𝐼 → 𝐶2𝐻4+ 2 𝐾𝐵𝑟 + 𝐾𝐼3 Suhu: 59,72 0C
Konsentrasi awal KI: 0,1531 kmol/m3
Konsentrasi awal C2H4Br2: 0,02864 kmol/m3
Waktu, kdetik Fraksi dibromida yang direaksikan
29,7 0,2863 40,5 0,3630 47,7 0,4099 55,8 0,4572 62,1 0,4890 72,9 0,5396 83,7 0,5795
Tentukan konstanta laju orde reaksi kedua.
Solusi:
Reaksi di stokiometri dapat direpresentasikan sebagai
𝐴 + 3𝐵 𝑃𝑟𝑜𝑑𝑢𝑐𝑡𝑠→𝑘 (3 − 255)
Asumsikan bahwa reaksi yang terjadi adalah orde kedua dalam sistem volum yang konstan, persamaan lajunya adalah
−𝑟𝐴 = −𝑑𝐶𝐴
𝑑𝑡 = 𝑘𝐶𝐴𝐶𝐵 (3 − 256) Dari stoikiometri:
A B
KINETIKA KIMIA 17
Jumlah saat t = t CA CB
Jumlah yang telah bereaksi (CAO - CA) (CBO-CB)
dan (𝐶𝐵𝑂 − 𝐶𝐵) = 3(𝐶𝐴𝑂− 𝐶𝐴). Fraksi konversi 𝑋𝐴didefinisikan sebagai 𝑋𝐴 =
𝐶𝐴𝑂− 𝐶𝐴
𝐶𝐴𝑂 (3 − 257) sehingga
𝐶𝑋 = 𝐶𝐴𝑂 1 − 𝑋𝐴 (3 − 258) Penurunan persamaan di atas terhadap waktu t menghasilkan
−𝑑𝐶𝐴 𝑑𝑡 = 𝐶𝐴𝑂 𝑑𝑋𝐴 𝑑𝑡 (3 − 259) Konsentras B adalah 𝐶𝐵 = 𝐶𝐵𝑂− 3 𝐶𝐴𝑂− 𝐶𝐴 (3 − 260) Dalam konversi fraksi, konsentrasi B adalah
𝐶𝐵 = 𝐶𝐵𝑂− 3𝐶𝐴𝑂𝑋𝐴 (3 − 261)
Substitusi persamaan 3-258 dan 3-261 ke dalam persamaan 3-256 menghasilkan
−𝑑𝐶𝐴
𝑑𝑡 = 𝑘𝐶𝐴𝑂 1 − 𝑋𝐴 𝐶𝐵𝑂 − 3𝐶𝐴𝑂𝑋𝐴 (3 − 262)
Substitusi persamaan 3-259 ke dalam persamaan 3-262 dan penyusunan ulang menghasilkan 𝐶𝐴𝑂𝑑𝑋𝐴
𝐶𝐴𝑂 1 − 𝑋𝐴 𝐶𝐵𝑂− 3𝐶𝐴𝑂𝑋𝐴 = 𝑘𝑑𝑡 (3 − 263)
Integrasi persamaan 3-263 di antara limit t = 0, 𝑋𝐴 = 0 dan t = t, 𝑋𝐴 = 𝑋𝐴 menghasilkan 𝑑𝑋𝐴 1 − 𝑋𝐴 𝐶𝐵𝑂 − 3𝐶𝐴𝑂𝑋𝐴 𝑋𝐴 0 = 𝑘 𝑑𝑡 𝑡 0 3 − 264 Persamaan 3-264 dapat diekspresikan dengan
KINETIKA KIMIA 18 𝑑𝑋𝐴 𝐶𝐴𝑂 1 − 𝑋𝐴 𝐶𝐶𝐵𝑂 𝐴𝑂 − 3𝑋𝐴 𝑋𝐴 0 = 𝑘 𝑑𝑡 𝑡 0 3 − 265
di mana 𝜃𝑛 = 𝐶𝐵𝑂/𝐶𝐴𝑂. Persamaan 3-265 menjadi 𝑑𝑋𝐴 𝐶𝐴𝑂 1 − 𝑋𝐴 𝜃𝐵− 3𝑋𝐴 𝑋𝐴 0 = 𝑘 𝑑𝑡 𝑡 0 3 − 266 Konversi persamaan 3-266 menjadi fraksi parsial menghasilkan
1 1 − 𝑋𝐴 𝜃𝐵− 3𝑋𝐴 = 𝐴 1 − 𝑋𝐴 + 𝐵 𝜃𝐵 − 3𝑋𝐴 3 − 267 1 = 𝐴 𝜃𝐵 − 3𝑋𝐴 + 𝐵 1 − 𝑋𝐴
Menyamakan koefisien konstanta dan 𝑋𝐴 menghasilkan
"Const" 1 = 𝐴𝜃𝐵 + 𝐵 (3 − 268) "𝑋𝐴" 0 = −3𝐴 − 𝐵 (3 − 269)
Menambahkan persamaan 3-268 dan 3-269 menghasilkan 1 = 𝐴(𝜃𝐵 − 3). Sehingga, 𝐴 = 1 ( 𝜃𝐵 − 3) dan 𝐵 = −3𝐴 = −3 (𝜃𝐵 − 3). Persamaan 3-267 diekspresikan sebagai
1 𝐶𝐴𝑂 𝑑𝑋𝐴 1 − 𝑋𝐴 𝜃𝐵− 3𝑋𝐴 𝑋𝐴 0 − 3𝑑𝑋𝐴 𝜃𝐵 − 3 𝜃𝐵 − 3𝑋𝐴 𝑋𝐴 0 = 𝑘 𝑑𝑡𝑡 0 = 1 𝐶𝐴𝑂 𝜃𝐵 − 3 − ln 1 − 𝑋𝐴 − 3 −1 3 ln(𝜃𝐵 − 3𝑋𝐴) = 𝑘𝑡 = 1 𝐶𝐴𝑂 𝜃𝐵− 3 ln (𝜃𝐵 − 3𝑋𝐴) 1 − 𝑋𝐴 = 𝑘𝑡 (3 − 270)
Dengan memasukkan konsentrasi awal A dan B, yaitu, 𝐶𝐴𝑂 dan 𝐶𝐵𝑂 ke dalam persamaan 3-270 menghasilkan 1 𝐶𝐴𝑂 𝐶𝐵𝑂 𝐶𝐴𝑂 − 3 ln 𝐶𝐵𝑂 𝐶𝐴𝑂 − 3𝑋𝐴 1 − 𝑋𝐴 = 𝑘𝑡 (3 − 271)
KINETIKA KIMIA 19 1 𝐶𝐵𝑂 − 3𝐶𝐴𝑂 ln 𝐶𝐵𝑂 𝐶𝐴𝑂 − 3𝑋𝐴 1 − 𝑋𝐴 = 𝑘𝑡 (3 − 272) Dengan menyusun ulang persamaan 3-272 menghasilkan
ln 𝐶𝐵𝑂
𝐶𝐴𝑂 − 3𝑋𝐴
1 − 𝑋𝐴 = 𝑘𝑡 𝐶𝐵𝑂 − 3𝐶𝐴𝑂 3 − 273
Persamaan 3-273 adalah bentuk 𝑦 = 𝐴𝑒𝐵𝑥dan memplotkan ln 𝐶𝐵𝑂
𝐶𝐴𝑂−3𝑋𝐴
1−𝑋𝐴 terhadap t
menghasilkan gradien B = 𝑘 𝐶𝐵𝑂 − 3𝐶𝐴𝑂 . Tabel 3-10 menghasilkan nilai ln 𝐶𝐵𝑂
𝐶𝐴𝑂−3𝑋𝐴
1−𝑋𝐴 dan t. Program komputer PROG1 mengkalkulasi gradien B dari persamaan 𝑦 = 𝐴𝑒𝐵𝑥. Dari gradien, memungkinkan untuk menentukan konstanta laju k.
Konstanta untuk persamaan yang ada adalah:
A = 5,325 B = 0,0056969 Koefisien korelasi = 0,99984 Gradien = 𝑘 𝐶𝐵𝑂− 3𝐶𝐴𝑂 = 0,0057 𝐶𝐴𝑂 = 0,02864, 𝐶𝐵𝑂= 0,1531 k(0,1531 – 3.0,02864) = 0,0057 0,06718k = 0,0057 k = 0,0848 𝑚 3 𝑘𝑚𝑜𝑙 𝑘𝑑𝑒𝑡𝑖𝑘 k = 0,0848 𝑚 3 𝑘𝑚𝑜𝑙 𝑘𝑑𝑒𝑡𝑖𝑘 x 10 3 1 𝑚3 𝑥 1 𝑘𝑚𝑜𝑙 103𝑚𝑜𝑙 k = 0,0848 103 1 𝑚𝑜𝑙 𝑑𝑒𝑡𝑖𝑘 x 3600 𝑑𝑒𝑡𝑖𝑘 𝑗𝑎𝑚 k = 0,305 𝑚𝑜𝑙 𝑗𝑎𝑚1
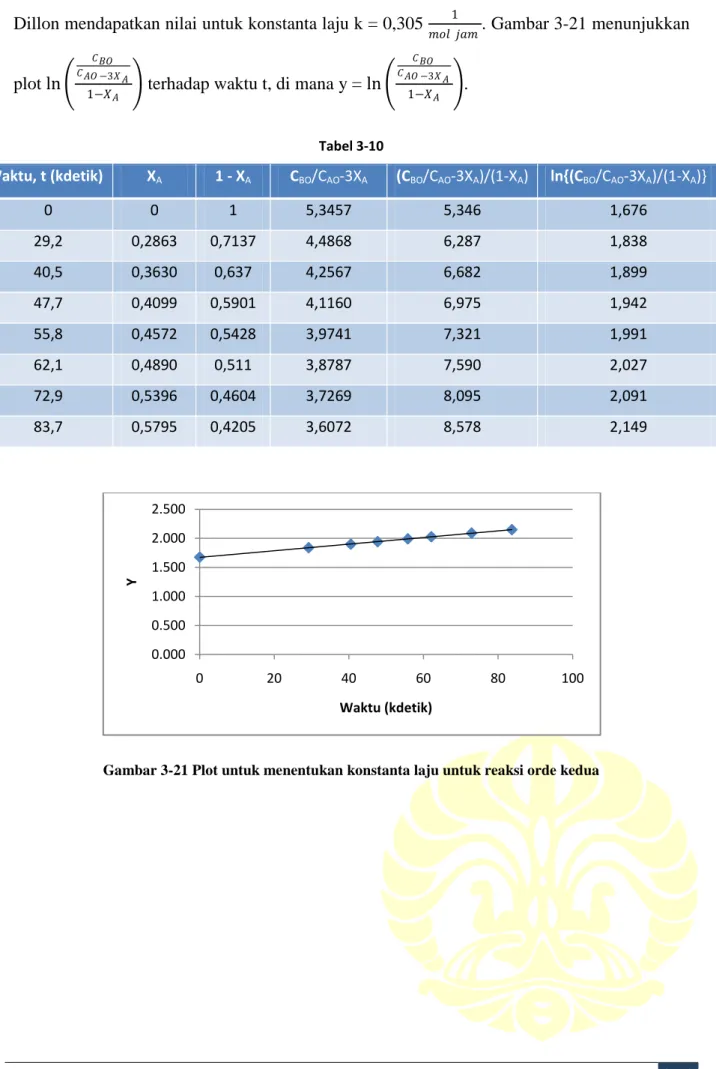
KINETIKA KIMIA 20 Dillon mendapatkan nilai untuk konstanta laju k = 0,305 𝑚𝑜𝑙 𝑗𝑎𝑚1 . Gambar 3-21 menunjukkan
plot ln 𝐶𝐵𝑂 𝐶𝐴𝑂 −3𝑋𝐴
1−𝑋𝐴 terhadap waktu t, di mana y = ln 𝐶𝐵𝑂 𝐶𝐴𝑂 −3𝑋𝐴 1−𝑋𝐴 . Tabel 3-10 Waktu, t (kdetik) XA 1 - XA CBO/CAO-3XA (CBO/CAO-3XA)/(1-XA) ln{(CBO/CAO-3XA)/(1-XA)} 0 0 1 5,3457 5,346 1,676 29,2 0,2863 0,7137 4,4868 6,287 1,838 40,5 0,3630 0,637 4,2567 6,682 1,899 47,7 0,4099 0,5901 4,1160 6,975 1,942 55,8 0,4572 0,5428 3,9741 7,321 1,991 62,1 0,4890 0,511 3,8787 7,590 2,027 72,9 0,5396 0,4604 3,7269 8,095 2,091 83,7 0,5795 0,4205 3,6072 8,578 2,149
Gambar 3-21 Plot untuk menentukan konstanta laju untuk reaksi orde kedua 0.000 0.500 1.000 1.500 2.000 2.500 0 20 40 60 80 100 Y Waktu (kdetik)
KINETIKA KIMIA 21 Contoh Soal 3 Tabel 3-11 merupakan tabel data laju reaksi [-d(B2H6)/dt] dari reaksi B2H6 dan aseton pada suhu 1140C : B2H6 + 4 Me2CO → 2(Me2CHO)2BH. Jika persamaan laju reaksi, 𝑣 = 𝑘𝑃𝐵𝑛2𝐻6𝑃 𝑀𝑒2𝑂𝐻 𝑛 , tentukanlah n, m, dan k. Solusi 𝑣 = 𝑘𝑃𝐵2𝐻6 𝑛 𝑃 𝑀𝑒2𝑂𝐻 𝑚
Persamaan linear dari laju reaksi ialah. 𝑙𝑛 𝑣 = 𝑙𝑛 𝑘 + 𝑛 𝑙𝑛 𝑃𝐵2𝐻6 + 𝑚 𝑙𝑛 𝑃𝑀𝑒2𝐶𝑂 𝑌 = 𝐶0+ 𝐶1 𝑋1+ 𝐶2 𝑋2
dimana koefisien 𝐶0 = k, 𝐶1 = n, dan 𝐶2 = m. Software PROG3 dapat digunakan untuk menentukan koefisien dari kelipatan setiap variabel independen 𝑃𝐵2𝐻6 dan 𝑃𝑀𝑒2𝐶𝑂 serta variabel dependen laju. Hasil yang diberikan ialah sebagai berikut.
𝐶0 = 4.67755 𝐶1 = 0.978166 𝐶2 = 0.954575
𝐾𝑜𝑒𝑓𝑖𝑠𝑖𝑒𝑛 𝑘𝑜𝑟𝑒𝑙𝑎𝑠𝑖 = 0.9930
Jadi, 𝐶0 = k = 4.68, 𝐶1 = n = 0.98, dan 𝐶2 = m = 0.95. Jadi, persamaan reaksinya menjadi 𝑣 = 𝑘𝑃𝐵0.982𝐻6𝑃
𝑀𝑒2𝑂𝐻
0.95 , atau dapat dilakukan dengan pendekatan.
𝑣 = 4.7𝑃𝐵2𝐻6𝑃𝑀𝑒2𝐶𝑂
Konstanta laju k dapat ditentukan dengan asumsi m ≡ n ≡ 1 sehingga, 𝑣 = 𝑘𝑃𝐵1.02𝐻6𝑃
𝑀𝑒2𝑂𝐻 1.0
𝑘 = 𝑣
𝑃𝐵2𝐻6𝑃𝑀𝑒2𝐶𝑂
Rata-rata konstanta laju reaksi k = 3.85 dan persamaan laju reaksinya menjadi = 3.85𝑃𝐵2𝐻6𝑃𝑀𝑒2𝐶𝑂. Hasil perhitungan konstanta laju reaksi dari PROG3 adalah 4,68 dan hasil kalkulasidari tabel 3-12 adalah 3.85. Presentase deviasi (penyimpangan) dari kedua nilai
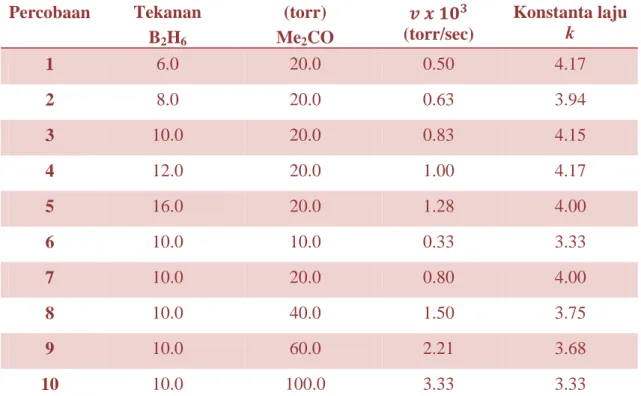
KINETIKA KIMIA 22 itu adalah 17.8%. Gambar 3-22 menunjukkan plot dari tekanan parsial dari B2H6 dan Me2CO terhadap nilai laju reaksi.
Tabel 3-12 Percobaan Tekanan B2H6 (torr) Me2CO 𝒗 𝒙 𝟏𝟎𝟑 (torr/sec) Konstanta laju k 1 6.0 20.0 0.50 4.17 2 8.0 20.0 0.63 3.94 3 10.0 20.0 0.83 4.15 4 12.0 20.0 1.00 4.17 5 16.0 20.0 1.28 4.00 6 10.0 10.0 0.33 3.33 7 10.0 20.0 0.80 4.00 8 10.0 40.0 1.50 3.75 9 10.0 60.0 2.21 3.68 10 10.0 100.0 3.33 3.33
Gambar 3-22. Grafik Tekanan Parsial B2H6 dan Me2CO terhadap laju reaksi
0 20 40 60 80 100 120 0 500 1000 1500 2000 2500 3000 3500 Teka na n Pa rsia l (to rr )
Laju reaksi (torr/sec) B2H6
KINETIKA KIMIA 23 Contoh Soal 4 Reaksi disosiasi termal irreversible dari paraldehid pada suhu 2590C dan konstanta volume diberikan pada data berikut ini.
Waktu, h 0 1 2 3 4 ∞
Ptotal, mmHg 100 175 220 250 270 300
Tentukan orde reaksi dan konstanta laju reaksinya.
Solusi
Dekomposisi paraldehid dinyatakan dengan (CH3CHO)3 → 3 CH3CHO. Dalam stoikiometri dapat dinyatakan dengan A → 3B. Asumsi awal bahwa reaksi ini adalah reaksi orde satu, sehingga persamaan laju untuk volume konstan pada sistem batch adalah :
−𝑟𝐴 = − 𝑑𝐶𝐴
𝑑𝑡 = 𝑘1𝐶𝐴
Jika reaktan dan produk mengabaikan hukm gas ideal, konsentrasinya menjadi,
𝐶𝐴 = 𝑛𝐴 𝑉 = 𝑃𝐴 𝑅𝑇 dimana nilai 𝑃𝐴, −𝑑𝑃𝐴 𝑑𝑡 = 𝑘1𝑃𝐴
Persamaan diatas dapat diintegralkan, dimana kondisi batasnya adalah ketika t = 0, pA = pAO dan pada t = t, pA = pA, sehingga.
𝑑𝑝 𝑝𝐴 = 𝑘1 𝑑𝑡 𝑡 0 𝑝𝐴 𝑝𝐴𝑂 dimana. 𝑙𝑛 𝑝𝐴 𝑝𝐴𝑂 = −𝑘1 𝑡 k1 k1 (3-282) (3-281) (3-280) (3-279) (3-278)
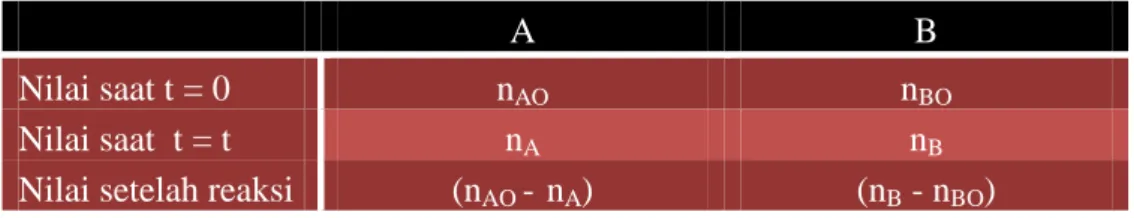
KINETIKA KIMIA 24 Jika nA adalah mol dari paraldehid pada waktu t dan nAO adalah mol paraldahid saat t = 0, maka pada waktu t, mol asetaldehid berdasarkan stoikiometri adalah;
A B
Nilai saat t = 0 nAO nBO
Nilai saat t = t nA nB
Nilai setelah reaksi (nAO - nA) (nB - nBO)
dalam stoikiometri 3(nAO - nA) = (nB - nBO). Total mol saat waktu t = nr = nA + 3(nAO - nA) + nBO, walaupun nBO = 0. Apabila kita menggunakan hukum gas ideal, maka n = pV/RT, dan pada saat V dan T konstan,
pT = pA + 3(pAO - pA) = pA + 3pAO - 3pA) pT = 3pAO - 2pA atau
pT = 12(3pAO - pT) dimana. pT = tekanan total
pA = tekanan parsial dari A (paraldehid) pada waktu t pAO = tekanan parsial dari A pada waktu t = 0
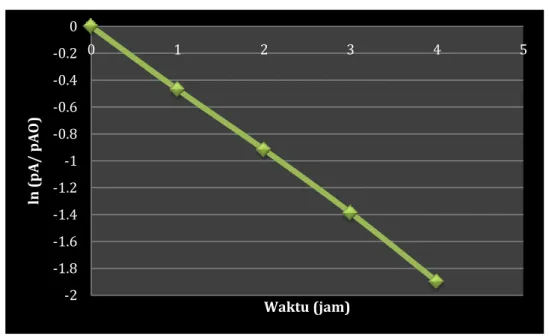
Tabel 3-13 menunjukkan hubungan rasio dari pA/ pAO terhadap waktu t.
Apabila kita memplot ln pA/ pAO terhadap waktu t (Gambar 3-23) maka akan menghasilkan garis lurus dengan kemiringan yang sama nilainya dengan konstanta laju reaksi k. Jadi, asumsi nahwa reaksi ini merupakan reaksi orde satu adalah benar. Hubungan antara rasio dari pA/ pAO terhadap waktu t diwakilkan oleh persamaan Y = AcBX.
Software PROG1 akan menentukan konstanta laju reaksi k1 dari kemiringan Y = AcBX. Konstanta yang dihasilkan adalah.
A = 1.0082 B = -0.47105
KINETIKA KIMIA 25 Kemiringan B = k1. Jadi persamaan Y = AcBX menjadi 0.47 hr-1.
Tabel 3-13
Waktu, hr pT, mmHg pada 00C pA = ½(3pAO - pT) pA/ pAO
0 100 100 1.0 1 175 62.5 0.625 2 220 40.0 0.400 3 250 25.0 0.250 4 270 15.0 0.15 ∞ 300 0 0.0
Gambar 3-23. Grafik ln (pA/ pAO) terhadap waktu (jam)
-2 -1.8 -1.6 -1.4 -1.2 -1 -0.8 -0.6 -0.4 -0.2 0 0 1 2 3 4 5 ln (p A/ p AO ) Waktu (jam)
KINETIKA KIMIA 26 Contoh Soal 5 Reaksi 2NOCl → 2NO + Cl2 pada suhu 2000
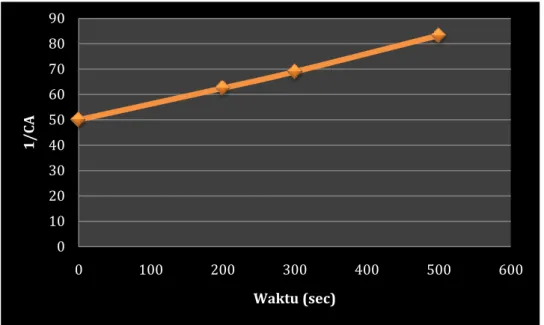
C. Konsentrasi dari NOCl cenderung konstan dan hanya berubah sesuai dengan data dibawah ini.
t, sec 0 200 300 500
CNOCl, gmol/l 0.02 0.016 0.0145 0.012 Tentukan orde reaksi dan konstanta laju reaksinya.
Solusi
Jika reaksi berorde dua, persamaan laju reaksinya adalah :
−𝑟𝐴 = − 𝑑𝐶𝐴
𝑑𝑡 = 𝑘𝐶𝐴2
Persamaan diatas dapat diintegralkan, dimana kondisi batasnya adalah ketika t = 0, CA = CAO dan pada t = t, CA = CA, sehingga.
− 𝑑𝐶𝐴 𝐶𝐴2 = 𝑘 𝑑𝑡 𝑡 0 𝐶𝐴 𝐶𝐴𝑂 1 𝐶𝐴− 1 𝐶𝐴𝑂 = 𝑘𝑡
Apabila kita memplot 1/ CA terhadap waktu t maka akan dihasilkan garis lurus dengan kemiringan k = 0.06661 /gmol.s. Software PROG1 mampu menentukan konstanta laju reaksi untuk reaksi orde kedua. Persamaan 3-285 sebanding dengan 1/Y = A + BX dimana gradien B adalah konstanta laju reaksi k. Hasil kalkulasi dari perhitungan langsung melalui program komputer ditunjukkan pada Tabel 3-14.
Konstanta dari persamaan garisnya adalah : A = 0.496 x 102 B = 0.0666 Koefisien korelasi = 0.9992 (3-285) k1 (3-284) (3-283)
KINETIKA KIMIA 27
Tabel 3-14
Waktu, sec (Hasil)
1/CNOCl, gmol/l (Estimasi) 1/CNOCl, gmol/l 0 50 49.6 200 62.5 62.9 300 68.97 69.5 500 83.3 82.8
Gambar 3-24 menunjukkan hubungan antara 1/ CA sebagai ungsi waktu t. Grafik akan membentuk garis lurus, sehinga hipotesa mengenai orde reaksi terbukti benar. Kemiringan /gradien merupakan nilai konstanta laju reaksi k.
Konstanta laju reaksi k = 0.0666 𝑔𝑚𝑜𝑙 .𝑠𝑒𝑐1
Gambar 3-24. Grafik 1/CA terhadap waktu (s)
0 10 20 30 40 50 60 70 80 90 0 100 200 300 400 500 600 1 /C A Waktu (sec)
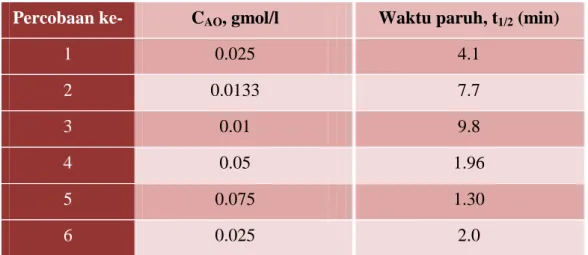
KINETIKA KIMIA 28 Contoh Soal 6 Reaksi dekomposisi pada fase gas A → B + 2C terjadi di dalam reaktor dengan volume konstan. Percobaan pertama hingga kelima terjadi pada suhu 1000C. Percobaan keenam dilakukan pada suhu 1100C (Tabel 3-15). Tentukan (1) order reaksi dan konstanta laju reaksi, dan (2) energi aktivasi dan faktor frekuensi (faktor tumbukan) dari reaksi ini.
Solusi
Waktu paruh untuk reaksi orde ke-n adalah.
𝑡1 2= 2𝑛−1− 1 𝑘(𝑛 − 1) 1 𝐶𝐴𝑂𝑛−1 Tabel 3-15
Waktu Paruh t1/2 sebagai Fungsi Konsentrasi CAO
Percobaan ke- CAO, gmol/l Waktu paruh, t1/2 (min)
1 0.025 4.1 2 0.0133 7.7 3 0.01 9.8 4 0.05 1.96 5 0.075 1.30 6 0.025 2.0
Dengan men-logkan persamaan 3-286, persamaannya menjadi.
ln 𝑡1 2 = ln
2𝑛−1− 1
𝑘(𝑛 − 1)+ 1 − 𝑛 ln 𝐶𝐴𝑂
Grafik CAO terhadap t1/2 akan menghasilkan kemiringan dari suatu garis linear yang sama dengan (1-n). Namun, persamaan 3-287 bisa juga ditulis dalm formulasi berikut ini.
Y = AXB
Dengan memodifikasi persamaan diatas, maka. ln 𝑌 = ln 𝐴 + 𝐵 ln 𝑋
(3-286)
(3-287)
(3-288)
KINETIKA KIMIA 29 Konstanta dari persamaan 3-289 adalah :
A = 0.0878 B = 1.0032
Koefisien korelasi = 0.97195
Kemiringan/gradien garis B = 1 – n. Software PROG1 menghasilkan kemiringan B = -1.003, sehingga, orde reaksi adalah n = 2. Ketika t1/2 = 5 menit, dan CAO = 0.022 gmol/l pada suhu 1000C, sehingga dari persamaan 3-286.
𝑘100 = 2𝑛−1− 1 (𝑛 − 1) 1 𝐶𝐴𝑂𝑛−1𝑡 1/2 = 2 − 1 1 𝑥 1 0.022 𝑥 1 5 = 9.09𝑔𝑚𝑜𝑙1 . 𝑚𝑖𝑛
Pada 1100C, CAO = 0.025 gmol/l, t1/2 = 2 menit, dan
𝑘100 = 2 − 1 1 𝑥 1 0.025 𝑥 1 2 = 20 1 𝑔𝑚𝑜𝑙. 𝑚𝑖𝑛
Energi aktivasi danfaktor frekuensi (faktor tumbukan) dapat ditentukan dari persamaan Arrhenius.
𝑘𝑇 = 𝑘0exp −𝐸𝑅𝑇
dimana. 𝑘𝑇 = konstanta laju reaksi pada suhu tertentu 𝑘0 = faktor frekuensi
E = energi aktivasi
R = konstanta gas ideal 1.987 kal/mol.K
𝑘100 = 𝑘0exp 𝑅 373 −𝐸 𝑘110 = 𝑘0exp 𝑅 383 −𝐸
(3-290)
(3-291) (3-292)
KINETIKA KIMIA 30 Dengan membandingkan persamaan 3-291 dengan persamaan 3-292, sehingga,
𝑘100 𝑘110 =
exp(−𝑅 373 )𝐸 exp(−𝑅 383 )𝐸
Hilangkan faktor eksponensialnya, sehingga persamaan 3-293 menjadi.
ln𝑘100 𝑘110 = −𝐸 𝑅 373 − −𝐸 𝑅 383 ln9.09 20.0= 𝐸 𝑅 1 383− 1 373 𝐸 = −0.7886 𝑥 1.987 −6.999 𝑥 10−5 = 22.388 𝑘𝑎𝑙 𝑔𝑚𝑜𝑙
Faktor frekuensi pada suhu 1000C adalah.
𝑘0 = 𝑘100 exp −𝐸𝑅𝑇 = 900 exp 1.987 𝑥 373 −22.388 = 1.19 𝑥 1014 1 𝑔𝑚𝑜𝑙. 𝑚𝑖𝑛
Faktor frekuensi pada suhu 1100C adalah.
𝑘0 = 𝑘110 exp −𝐸𝑅𝑇 = 20 exp 1.987 𝑥 383 −22.388 = 1.19 𝑥 1014 1 𝑔𝑚𝑜𝑙. 𝑚𝑖𝑛 (3-293) (3-294)
KINETIKA KIMIA 31 Contoh Soal 7
(Example 3-8)
Hidrolisis metil asetat merupakan reaksi autokatalisis dan termasuk reaksi berorde satu dengan hasil keduanya adalah metil asetat dan asam asetat. Reaksi ini termasuk jenis reaksi dasar, bimolekular dan timbal balik pada volume konstan untuk tujuan perancangan. Berikut adalah data terkait reaksi tersebut.
Konsentrasi dari metil asetat = 0.45 gmol/l Konsentrasi dari asam asetat = 0.045 gmol/l
Perubahan yang terjadi didalam reaktor bath dalam 1 jam adalah sebesar 65%. Hitunglah (1) konstanta laju reaksi dan nyatakan persamaan laju reaksinya, (2) waktu ketika laju reaksinya maksimum, dan (3) jenis dari reaktor sistem optimum yang dibutuhkan untuk melakukan proses 200 m3/jam. Bagaimanakah volume reaktor dalam sistem ini?
Solusi
Reaksi hidrolisis dari metil asetat adalah sebagai berikut. CH3COOCH3 + H2O → CH3COOH + CH3OH
(A) (B)
Secara sederhana reaksi diatas merupakan reaksi A → B. Untuk reaksi autokatalisis A + B → B + B dan laju konsumsi dari sepsi A adalah.
−𝑟𝐴 = − 𝑑𝐶𝐴
𝑑𝑡 = 𝑘1𝐶𝐴𝐶𝐵 k1
KINETIKA KIMIA 32 Contoh Soal 8
(Example 3-9)
Huang dan Dauerman (1969) mempelajari mengenai asetilasi dari senyawa benzyl klorida dalam dilute solution pada 1020C. Dengan menggunakan equimolal konsentrasi dari sodium asetat dan benzyl klorida (0.757 kmol/m3). Tabel 3-16 akan mengurutkan data fraksi dari benzyl klorida sisa hasil yang tidak dikonversi vs waktu. Tentukan orde reaksi dan konstanta reaksi pada suhu ini.
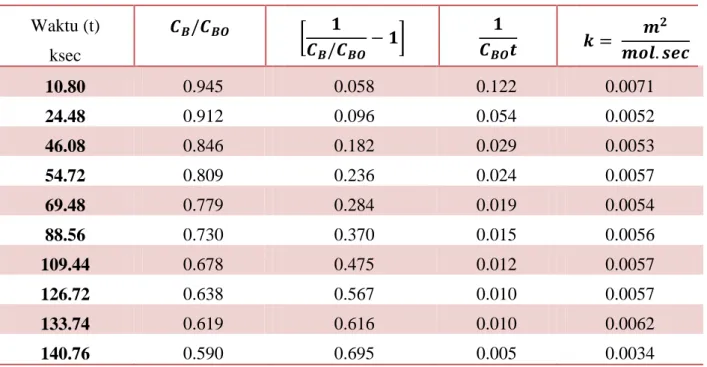
Solusi Waktu, t (ksec) CB/CBO dimana B = C6H5CH2Cl 10.80 0.945 24.48 0.912 46.08 0.846 54.72 0.809 69.48 0.779 88.56 0.730 109.44 0.678 126.72 0.638 133.74 0.619 140.76 0.590
Reaksi ini diasumsikan akan beroder reaksi dua berdasarkan reaksi NaAc + C6H5CH2Cl → C6H5CH2Ac + Na+ + Cl-, dimana bisa disederhanakan dengan pernyataan reaksi spesi A dan B, sehingga.
A + B → Produk
Persamaan laju reaksi untuk spesi B adalah. −𝑟𝐵 = −𝑑𝐶𝐵
𝑑𝑡 = 𝑘𝐶𝐴𝐶𝐵
Stoikiometri pada kedua spesi A dan B dapat dinyatakan sebagai berikut.
k1 (3-297)
KINETIKA KIMIA 33
A B
Nilai saat t = 0 CAO CBO
Nilai saat t = t CA CB
Nilai setelah reaksi (CAO - CA) (CBO - CB)
Nilai XB dapat dicari dengan,
𝑋𝐵 = 𝐶𝐵𝑂− 𝐶𝐵 𝐶𝐵𝑂
Persamaan 3-299 dapat juga dimodifikasi menjadi. 𝐶𝐵 = 𝐶𝐵𝑂 (1 − 𝑋𝐵)
Karena konsentrasi A dan B adalah sama, maka, 𝐶𝐴 = 𝐶𝐵 = 𝐶𝐵𝑂 (1 − 𝑋𝐵) dan −𝑑𝐶𝐵 𝑑𝑡 = 𝐶𝐵𝑂 𝑑𝑋𝐵 𝑑𝑡
dengan mensubstitusi persamaan 3-300 dan 3-302 ke persamaan 3-298, dihasilkan, −𝑟𝐵 = −𝐶𝐵𝑂
𝑑𝑋𝐵
𝑑𝑡 = 𝑘𝐶𝐵𝑂2 (1 − 𝑋𝐵)2
Persamaan diatas dapat diintegralkan, dimana kondisi batasnya adalah ketika t = 0, XA = 0 dan pada t = t, XB = XB, sehingga.
𝑑𝑋𝐵 (1 − 𝑋𝐵)2 = 𝑘𝐶𝐵𝑂 𝑑𝑡 𝑡 0 𝑋𝐵 0 1 1 − 𝑋𝐵 = 0 𝑋𝐵 𝑘𝐶𝐵𝑂𝑡 1 1 − 𝑋𝐵 − 1 = 𝑘𝐶𝐵𝑂𝑡 (3-299) (3-300) (3-301) (3-302) (3-303) (3-304) (3-305) (3-306)
KINETIKA KIMIA 34 1
𝐶𝐵/𝐶𝐵𝑂 − 1 = 𝑘𝐶𝐵𝑂𝑡
Konstanta laju reaksi k dapat dikalkulasikan melalui persamaan 3-307 menjadi.
𝑘 = 1 𝐶𝐵𝑂𝑡
1
𝐶𝐵/𝐶𝐵𝑂− 1
Tabel 3-17 menunjukkan nilai kalkulasi dari konstnta laju rekasi k pada beberapa variasi waktu. Tabel 3-17 Waktu (t) ksec 𝑪𝑩/𝑪𝑩𝑶 𝟏 𝑪𝑩/𝑪𝑩𝑶− 𝟏 𝟏 𝑪𝑩𝑶𝒕 𝒌 = 𝒎𝟐 𝒎𝒐𝒍. 𝒔𝒆𝒄 10.80 0.945 0.058 0.122 0.0071 24.48 0.912 0.096 0.054 0.0052 46.08 0.846 0.182 0.029 0.0053 54.72 0.809 0.236 0.024 0.0057 69.48 0.779 0.284 0.019 0.0054 88.56 0.730 0.370 0.015 0.0056 109.44 0.678 0.475 0.012 0.0057 126.72 0.638 0.567 0.010 0.0057 133.74 0.619 0.616 0.010 0.0062 140.76 0.590 0.695 0.005 0.0034
Rata-rata dari nilai konstanta laju reaksi adalaj k = 0.0055 m3/(mol.sec). Ini memnuktikan bahwa reaksi tersebut berorde dua.
(3-307)
KINETIKA KIMIA 35 Contoh Soal 9
(Example 3-10)
(1) Perkirakan bahwa reaksi orde satu (n=1) berlangsung di dalam reaktor batch dengan volume konstan V. Tulis kesetibangan material pada A dan integralkan hinga diperoleh persamaan 𝐶𝐴 = 𝐶𝐴𝑂exp(−𝑘𝑡), dimana 𝐶𝐴𝑂 merupakan konsentrasi dari A pada reaktor ketika t = 0.
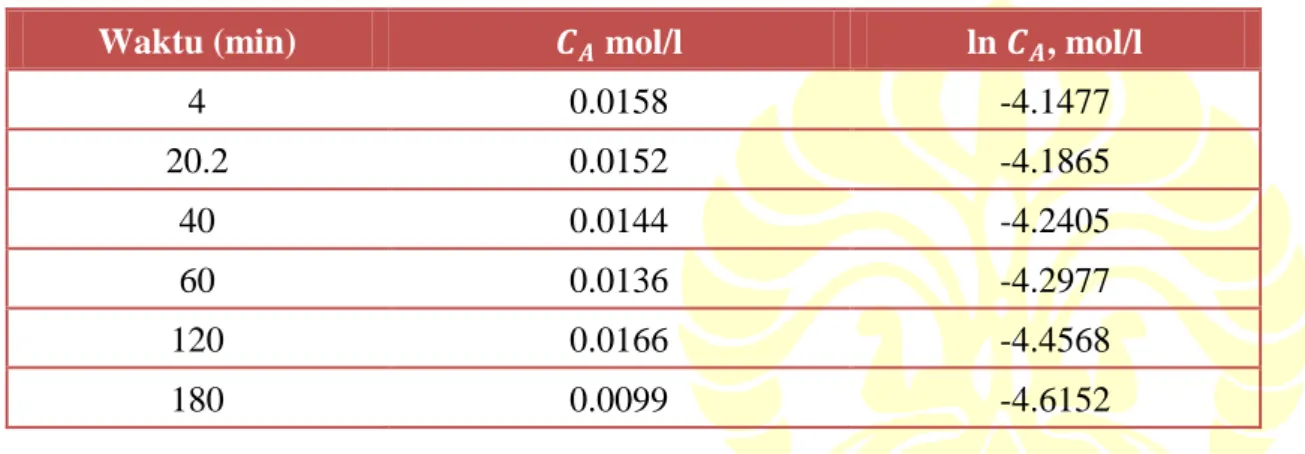
(2) Pemisahan fasa gas dari sulfur klorida SO2Cl2 → SO2 + Cl2 diasumsikan sebagai reaksi orde satu. Reaksi ini berlangsung pada suhu konstan, reaktor batch isotermal, dan konsentrasi SO2Cl2 berubah seiring perubahan waktu, sesuai data di bawah ini.
t, sec 4.0 20.2 40.0 60.0 120.0 180.0
CNOCl, gmol/l 0.0158 0.0152 0.0144 0.0136 0.0116 0.0099
Gunakan data diatas utnuk menguji hukum laju, dan tentukan konstanta laju reaksi k. Berikan nilai dan unit dari k.
Solusi
(1) Asumsikan bahwa reaksi berorde satu dalam reaktor batch isotermal pada volume konstan, sehinga persamaan reaksinya menjadi A → Produk, dimana.
−𝑟𝐴 = − 1 𝑉
𝑑𝑛𝐴
𝑑𝑡 = 𝑘1𝐶𝐴 dimana jumlah mol𝑛𝐴 adalah 𝑛𝐴 = 𝐶𝐴𝑉
dimana 𝐶𝐴 = konsentrasi spesi A V = volume reaktor batch
Dengan mensubstitusi persamaan 3-310 ke dalam persamaan 3-309. −𝑟𝐴 = −
1
𝑉𝑑(𝑉𝐶𝐴) = 𝑘1𝐶𝐴 = − 𝑑𝐶𝐴
KINETIKA KIMIA 36 dimana V bernila konstan.
Persamaan diatas dapat diintegralkan, dimana kondisi batasnya adalah ketika t = 0, CA = CAO dan pada t = t, CA = CA, sehingga.
𝑑𝐶𝐴 𝐶𝐴 = − 𝑘1 𝑑𝑡 𝑡 0 𝐶𝐴 𝐶𝐴𝑂 dan ln 𝐶𝐴 𝐶𝐴𝑂 = 𝑘1𝑡 sehingga, 𝐶𝐴 = 𝐶𝐴𝑂exp(-𝑘1𝑡)
(2) gunakan persamaan 3-314 pada pemisahan fassa gas dari sulfur klorida, danl persamaannya dapat dituliskan menjadi.
𝑌 = 𝐴𝑐𝐵𝑋
Persamaan diatas dapat dimodifikasi menjadi. ln 𝑌 = ln 𝐴 + 𝐵𝑋
Tabel 3-18 menunjukkan perubahan konsentrasi SO2Cl2, 𝐶𝐴 sebagai fungsi waktu t.
Tabel 3-18
Waktu (min) 𝑪𝑨 mol/l ln 𝑪𝑨, mol/l
4 0.0158 -4.1477 20.2 0.0152 -4.1865 40 0.0144 -4.2405 60 0.0136 -4.2977 120 0.0166 -4.4568 180 0.0099 -4.6152
Grafik ln 𝐶𝐴 terhadap waktu t menghasilkan sebuah garis lurus dengan kemiringan (-B) sama dengan konstanta laju rekasi. Kontanta dari persamaan 𝑌 = 𝐴𝑐𝐵𝑋 adalah.
(3-313) (3-312)
KINETIKA KIMIA 37 A = 0.015999
B = -0.26711 x 10-2
Kofisien korelasi = 0.99991
Kontanta laju reaksi 𝑘1 = -B = 0.00267 sec -1. Grafik 3-25 menunjukkan perubahan ln 𝐶𝐴 terhadap waktu t (min).
Gambar 3-25. Grafik ln CA terhadap waktu t (min)
-4.7 -4.6 -4.5 -4.4 -4.3 -4.2 -4.1 0 50 100 150 200 ln CA Waktu (min)
KINETIKA KIMIA 38 Contoh Soal 10
(Example 3-11)
Reaksi pemisahan gas dengan teori stoikiometri 2A → 2B + C mengikuti hukum laju reaksi orde dua 𝑟𝑑 𝑚𝑜𝑙𝑚3 . 𝑠 = 𝑘𝐶𝐴2, dimana 𝐶𝐴 merupakan konsentrasi reaktan dalam mol/m
3 . Konstanta laju reaksi k bergantung dengan suhu dari reaksi tersebut berdasarkan dengan persamaan Arrhenius.
𝑘 𝑚3
𝑚𝑜𝑙. 𝑠 = 𝑘0exp −𝐸 𝑅𝑇
dimana. 𝑘0 𝑚𝑜𝑙 .𝑠𝑚3 = faktor pre-eksponensial 𝐸 (𝑚𝑜𝑙𝐽 ) = energi aktivasi reaksi 𝑅 = konstanta gas
(1) Perkirakan reaksi ini belangsung dalam reaktor batch dengan colume konstan V (𝑚3) pada temperatur konstan T (K), reaksi diawali dengan spesi A murni pada konsentrasi 𝐶𝐴𝑂. Tulislah perbedaan kesetimbangan pada spesi A dan gunakan metode integral untuk memperoleh persamaan untuk 𝐶𝐴 (t) pada 𝐶𝐴𝑂 dan nilai k.
(2) P0 (atm) sebagai variabel tekanan, dan buktikan bahwa t1/2 mewakili pencapaian hasil konversi sebesar 50% dari spesi A dalam reaktor tersebut, sama dengan RT/kp0. Asumsikan perilaku gas idealnya.
(3) Pemisahan nitrogen oksida (N2O) menjadi unsur nitrogen dan oksigen berlangsung pada 5.0 1 reaktor batch pada suhu konstan 1.015K, diawali dengan N2O pada tekanan tertentu. Tekanan reaktor P(t) dikontrol, dan waktu paruh (t1/2) mewakili pencapaian hasil konversi sebesar 50% dari spesi N2O didata pada Tabel 3-19. Gunakan hasil data tersebut untuk membuktikan bahwa pemisahan N2O merupakan reaksi orde dua dan tentukan nilai k pada suhu 1.015 K.
Tabel 3-19
P0 (atm) 0135 0.286 0.416 0.683 t1/2, (sec) 1060 500 344 209
KINETIKA KIMIA 39 (4) Ekperimen yang sama berlangsung pada temperatur berbeda-beda pada tekanan tunggal 1.0 atm. Hasilnya ditunjukkan pada Tabel 3-20. Tentukan parameter persamaan Arrhenius (k0 dan E) untuk reaksi ini.
Tabel 3-20
P0 (atm) 0135 0.286 0.416 0.683 t1/2, (sec) 1060 500 344 209
Solusi
(1) Karena reaksi berlangsung dalam sistem batch pada volume konstan, persamaan laju reaksi orde dua adalah sebagai berikut.
−𝑟𝐴 = − 1 𝑉 𝑑𝑛𝐴 𝑑𝑡 = − 𝑑𝑛𝐴 𝑑𝑡 = 𝑘𝐶𝐴2 dimana 𝑘 = 𝑘0exp −𝐸𝑅𝑇 .
Persamaan diatas dapat diintegralkan, dimana kondisi batasnya adalah ketika t = 0, CA = CAO dan pada t = t, CA = CA, sehingga.
− 𝑑𝐶𝐴 𝐶𝐴2 = 𝑘 𝑑𝑡 𝑡 0 𝐶𝐴 𝐶𝐴𝑂
Dengan mengntegralkan persmaan 3-318 maka. 1 𝐶𝐴 = 𝑘𝑡 𝐶𝐴𝑂 𝐶𝐴 1 𝐶𝐴− 1 𝐶𝐴𝑂 = 𝑘0 exp −𝐸 𝑅𝑇 𝑡
Jadi, konsentrasi dari spesi A pada variabel 𝐶𝐴𝑂 dan k adalah. 1 𝐶𝐴 = 1 𝐶𝐴𝑂 + 𝑘0 exp −𝐸 𝑅𝑇 𝑡
(2) Persamaan waktu paruh (t1/2) untuk orde ke-n adalah.
(3-317)
(3-318)
(3-319)
(3-320)
KINETIKA KIMIA 40 𝑡12= 2𝑘(𝑛−1)𝑛 −1−1𝐶1
𝐴𝑂𝑛 −1
Karena reaksi ini berode dua, dimana nilai n = 2, dan nilai tersebut disubstitusikan dalam persamaan 3-322, sehingga persamaannya menjadi.
𝑡1 2= 𝐶𝐴𝑂−1 𝑘 = 1 𝑘𝐶𝐴𝑂 dimana, 𝐶𝐴𝑂 = 𝑛𝐴𝑂 𝑉 = 𝑝𝐴𝑂𝑉 𝑅𝑇𝑉 = 𝑝𝐴𝑂 𝑅𝑇
Substitusikan persamaan 3-324 ke dalam persamaan 3-323 menjadi. 𝑡12= 𝑘𝑝 1
𝐴𝑂/𝑅𝑇
= 𝑅𝑇 𝑘𝑝𝐴𝑂
(3) Pemisahan nitrogen oksida (N2O) menjadi nitrogen dan oksigen dinyatakan dalam persamaan berikut ini.
2 N2O → 2 N2 + O2
Waktu paruh t1/2 untuk orde ke-n adalah.
𝑡1 2=
(2𝑛−1− 1) 𝐶 𝐴𝑂𝑛−1 𝑘(𝑛 − 1)
Jadi, dengan menggunakan 3-324 persamaannya menjadi.
𝑡1 2= (2𝑛−1− 1) 𝑘(𝑛 − 1) 𝑝𝐴𝑂 𝑅𝑇 1−𝑛
Dengan menggunakan hukum logaritma untuk masing-masing persamaan, 3-327.
ln( 𝑡1 2) = ln (2𝑛−1− 1) 𝑘 𝑛 − 1 + 1 − 𝑛 ln 𝑝𝐴𝑂 𝑅𝑇 Persamaan 3-328 dapat dituliskan setara dengan. 𝑌 = 𝐴𝑋𝐵 (3-322) (3-323) (3-324) (3-325) (3-326) (3-327) (3-328) (3-329)
KINETIKA KIMIA 41 Persamaan 3-329 dapat dimodifikasi mengenai.
ln 𝑌 = ln 𝐴 + 𝐵 ln 𝑋 dimana kemiringan B = 1- n.
Dari Tabel 3-19, kita dapat menentukan variabel bebas 𝑅𝑇𝑝𝑜 pada temperatur konstan pada 1.015 K dan konstanta gas R = 0.08206 (1.atm / mol . k) (Tabel 3-21). Variabel terikatnya adalah t1/2. 𝒑𝒐, atm t1/2 (sec) 𝒑𝒐 𝑹𝑻 , 𝒙 𝟏𝟎−𝟑 t1/2 (estimasi) 0.135 1.060 1.6208 1.059.8 0.286 500 3.4337 501.7 0.416 344 4.9945 342.2 0.683 209 8.2001 209.5
Konstanta dari persamaan 3-330 adalah. A = 1.7834
B = -0.992
Koefisien korelasi = 1.0
Kemiringan B = -0.9922 = 1 –n. Jadi, nilai dari n = 1.992 ≡ 2 dan reaksi terbukti berorde dua. Nilai dari konstanta laju reaksi pada suhu T = 1.015 K adalah.
𝑡1 2= 𝑅𝑇 𝑘𝑝𝑂 Jadi, 𝑘 = 𝑅𝑇 𝑝𝑂 𝑡12= 0.08206 𝑥 1.015 0.135 𝑥 1.060 1. 𝑎𝑡𝑚 𝑚𝑜𝑙 − 𝐾. 𝐾 𝑎𝑡𝑚. 𝑠𝑒𝑐 = 0.582 1 𝑚𝑜𝑙. 𝑠𝑒𝑐
(4) Dengan persamaan Arrhenius.
KINETIKA KIMIA 42 𝑘 𝑚 3 𝑚𝑜𝑙. 𝑠 = 𝑘0exp −𝐸 𝑅𝑇 Persamaan diatas dimodifikasi mengenai.
ln 𝑘𝑇 = ln 𝑘0 − 𝐸 𝑅𝑇
Konstanta laju reaksi 𝑘𝑇 dapat ditentukan dengan menentukan variabel suhu T dari persamaan waktu paruh sebagai berikut ini.
𝑡1 2= (2𝑛−1− 1) 𝑘(𝑛 − 1) 𝑅𝑇 𝑝𝐴𝑂 1−𝑛
Jika, tekanan 1 atm, 𝑝𝐴𝑂 = 1 dn n = 2, waktu paruh pada persamaan 3-327 adalah t1/2 = RT/kT dan kT = RT/t1/2. Tabel 3-22 dapat diturunkan dari Tabel 3-20 untuk nilai kT, variabel terikat, adalah suhu T dan t1/2. Persamaan 3-331 dapat ditulis setara dengan persamaan.
𝑌 = 𝐴𝑋𝐵
Persamaan 3-333 dapat dimodifikasi mengenai. ln 𝑌 = ln 𝐴 + 𝐵 ln 𝑋
dimana konstanta A = kO dan kemiringan B = -E/R. Konstanta pada persamaan laju reaksi ini anatar lain.
A = 0.3378 x 1013 B = -0.29875 x 105
Koefisien korelasi = 0.9999
Konstanta gas R = 0.08206 1.tm/mol.K 𝑻 (𝑲) t1/2 (sec) 𝟏/𝑻 𝒌𝑻 𝑹𝑻 𝒕𝟏 𝟐 ( 𝟏 𝒎𝒐𝒍. 𝒔𝒆𝒄) 900 5.464 0.00111 0.0135 (3-334) (3-333)
KINETIKA KIMIA 43 950 1.004 0.00105 0.0776 1000 219 0.001 0.3747 1050 55 0.00095 1.5666 Energi aktivasi = 𝐸𝑅 = 𝐵 = -0.2988 x 105 = 0.2988 x 105 x 0.08206 = 2.452 1/mol
KINETIKA KIMIA 44 Contoh Soal 11
(Example 3-12)
Untuk sintesis amonia, 𝑁2+ 3𝐻2 → 2𝑁𝐻3 dengan bantuan katalis besi. Temukan mekanisme laju dengan reaksi sebagai berikut
𝐻2(𝑔)+ 2𝑆 𝑘1 𝑘−1 2𝐻𝑆 (3 − 335) 𝑁2+ 2𝑆𝑘→ 2𝑁𝑆 (3 − 336) 2 𝑁𝑆 + 3𝐻𝑆 𝑘3 𝑘−3 𝑁𝐻3𝑆 + 3𝑆 (3 − 337) 𝑁𝐻3𝑆 𝑘4 𝑘−4 𝑁𝐻(𝑔)+ 𝑆 (3 − 338) Solusi
Boudart (1972) memperkenalkan asumsi intermediet yang paling berlimpah (masi). Asumsi ini menyatakan bahwa, tempat yang terisi oleh seluruh spesi, kecuali intermediet yang paling berlimpah dianggap tidak sebanding dengan tempat yang terisi oleh intermediet yang paling berlimpah dan tempat yang kosong.
Ekspresi laju untuk mekanisme ddi atas didasarkan oleh asumsi-asumsi berikut: 1. Intermediet yang paling berlimpah adalah NS, sehingga
𝐶𝑇 = 𝐶𝑆+ 𝐶𝑁𝑆 (3 − 339)
2. Langkah 1, 3, dan 4 berada pada kesetimbangan dan langkah 2 adalah langkah penentu laju.
3. Kondisi di mana reaksi 𝑁2 + 3𝐻2 → 2𝑁𝐻3 berlangsung adalah kondisi yang tidak memungkinkan untuk adanya laju untuk reaksi sebaliknya.
𝐶𝑇 = total konsentrasi dari beberapa tempat dan didefinisikan sebagai 𝑚𝑜𝑙 𝑡𝑜𝑡𝑎𝑙 𝑑𝑎𝑟𝑖 𝑏𝑒𝑟𝑏𝑎𝑔𝑎𝑖 𝑡𝑒𝑚𝑝𝑎𝑡
𝑢𝑛𝑖𝑡 𝑚𝑎𝑠𝑎 𝑘𝑎𝑡𝑎𝑙𝑖𝑠 𝐶𝑆 = konsentrasi tempat yang kosong
KINETIKA KIMIA 45 𝑚𝑜𝑙 𝑖𝑑𝑟𝑜𝑔𝑒𝑛 𝑡𝑒𝑟𝑎𝑑𝑠𝑜𝑟𝑝
𝑢𝑛𝑖𝑡 𝑚𝑎𝑠𝑎 𝑘𝑎𝑡𝑎𝑙𝑖𝑠 𝐶𝑁𝑆 = konsentrasi dari intermediet yang paling berlimpah 𝐶𝑁𝐻3𝑆 = konsentrasi amonia teradsorp
𝑚𝑜𝑙 𝑎𝑚𝑜𝑛𝑖𝑎 𝑡𝑒𝑟𝑎𝑑𝑠𝑜𝑟𝑝 𝑢𝑛𝑖𝑡 𝑚𝑎𝑠𝑎 𝑘𝑎𝑡𝑎𝑙𝑖𝑠 𝑝𝑁3 = tekanan parsial nitrogen
𝑝𝑁𝐻3 = tekanan parsial amonia
−𝑟𝑁2 = laju reaksi nitrogen, mol nitrogen terdekomposisi per unit waktu per unit massa katalis
Karena langkah 2 adalah langkah penentuan laju, maka ekspresi lajunya adalah: −𝑟𝑁2 = 𝑘2𝑝𝑁2𝐶𝑆2 (3 − 340)
Laju netto dari dekomposisi 𝐻2adalah
−𝑟𝑁2 𝑛𝑒𝑡 = 𝑘1𝑝𝐻2𝐶𝑆2− 𝑘−1𝐶𝐻𝑆2 (3 − 341)
Dengan basis asumsi pseudo-steady state, laju netto dari dekomposisi adalah nol, sehingga 𝑘1𝑝𝐻2𝐶𝑆2 = 𝑘 −1𝐶𝐻𝑆2 dan 𝐾1 = 𝑘1 𝑘−1 = 𝐶𝐻𝑆2 𝑝𝐻3𝐶𝑆2 (3 − 342) 𝐾3 = 𝑘3 𝑘−3 = 𝐶𝑆3𝐶 𝑁𝐻3𝑆 𝐶𝑁𝑆𝐶𝐻𝑆3 (3 − 343) 𝐾4 = 𝑘4 𝑘−4 = 𝐶𝑆𝑝𝑁𝐻3 𝐶𝑁𝐻3𝑆 (3 − 344)
Dari persamaan 3-343, konsentrasi intermedietyang paling berlimpah adalah
𝐶𝑁𝑆 = 𝐶𝑆 3𝐶
𝐻𝑁3𝑆 𝐾3𝐶𝐻𝑆3
(3 − 345)
Konsentrasi amonia yang teradsorp dari persamaan 3-344 adalah
𝐶𝑁𝐻3𝑆 = 𝐶𝑆𝑝𝑁𝐻3
KINETIKA KIMIA 46 Konsentrasi hidrogen yang teradsorp dari persamaan 3-342 adalah
𝐶𝐻𝑆 = 𝑘1𝑝𝐻2𝐶𝑆2 1 2(3 − 347)
Substitusi persamaan 3-346 dan 3-347 ke dalam persamaan 3-345 menghasilkan
𝐶𝑁𝑆 = 𝐶𝑆3𝐶 𝑆𝑝𝑁𝐻3 𝐾3𝐾4 𝑘1𝑝𝐻2𝐶𝑆2 3 2 3 − 348 = 𝑝𝑁𝐻3𝐶𝑆 𝐾𝑝𝐻 2 1,5 (3 − 349)
di mana 𝐾 = 𝐾11,5𝐾3𝐾4. Substiusi persamaan 3-349 ke dalam persamaan 3-339 menghasilkan 𝐶𝑇 = 𝑝𝑁𝐻3𝐶𝑆 𝐾𝑝𝐻1,52 + 𝐶𝑆 (3 − 350) atau 𝐶𝑆 =𝑝 𝐶𝑇 𝑁𝐻3𝐶𝑆 𝐾𝑝𝐻1,52 + 1 (3 − 351)
Substitusi persamaan 3-351 ke dalam ekspresi laju dari persamaan 3-340 menghasilkan −𝑟𝑁2 = 𝑘2𝑝𝑁2 𝑝 𝐶𝑇 𝑁𝐻3𝐶𝑆 𝐾𝑝𝐻1,52 + 1 2 (3 − 352)
KINETIKA KIMIA 47 Contoh Soal 12
(Example 3-1)
Reaktan A terdekomposisi dalam suatu reaktor 𝐴 → 𝑝𝑟𝑜𝑑𝑢𝑘
Komposisi A dalam reaktor diukur dengan waktu yang berbeda dengan hasil yang ditunjukkandi kolom 1 dan 2. Cari persamaan laju yang merepresentasikan data.
Kolom 1 Kolom 2 Kolom 3 Kolom 4
Waktu t, detik Konsentrasi CA, mol/Liter ln (CAO/CA) 1/CA
0 CAO = 10 ln (10/10) = 0 0,1 20 8 ln (10/8) = 0,2231 0,125 40 6 0,511 0,167 60 5 0,6931 0,200 120 3 1,204 0,333 180 2 1,609 0,500 300 1 2,303 1,000
Data Eksperimen Data Teoritis
Solusi
Menebak Kinetika Orde Pertama
Mulai dengan menebak bentuk laju yang paling sederhana atau kinetika orde pertama. Hal ini berarti 𝐶𝐴𝑂 vs t seharusnya menghasilkan garis lurus, lihat persamaan 11 atau 12 atau 𝐶𝐴 gambar 3.1. Sehingga kolom 3 dihitung dan plot dari gambar E3.1a dibuat. Namun, hasilnya ternyata bukan merupakan garis lurus, sehingga kinetika orde pertama tidak dapat merepresentasikan data dan kita harus menebak bentuk laju lain.
KINETIKA KIMIA 48
Gambar E.3.1a Menebak Kinetik Orde Kedua.
Persamaan 16 menyatakan bahwa 1/CA vs t seharusnya menghasilkan garis lurus. Jadi hasil perhitungan kolom 4, plott kolom 1 vs kolom 4, seperti ditunjukkan pada gambar E3.1b. Ternyata, garis yang dihasilkan bukanlah garis lurus, sehingga bentuk kinetik orde kedua tidak berlaku.
Gambar E.3.1b Menebak Kinetik Orde ke-n.
Mari kita tinjau dari metode fractional life dengan F = 80%. Lalu Eq. 33b menjadi
𝑡𝐹 = (0,8)1−𝑛 − 1 𝑘(𝑛 − 1) 𝐶𝐴𝑂1−𝑛 (𝑖) 0 0.5 1 1.5 2 2.5 0 100 200 300 400 ln CAO /CA Waktu t (detik)
Data dari kolom 1 dan 3 tidak menghasilkan garis lurus (bukan reaksi orde pertama) 0 0.2 0.4 0.6 0.8 1 1.2 0 100 200 300 400 1 /CA Waktu t (detik)
Data dari Kolom 1 dan 4 tidak menghasilkan garis lurus (bukan reaksi orde kedua)
KINETIKA KIMIA 49 Selanjutnya ambil logaritma
log 𝑡𝐹 = log
(0,8)1−𝑛− 1
𝑘(𝑛 − 1) + 1 − 𝑛 log 𝐶𝐴𝑂(𝑖𝑖) --- --- --- y a bx
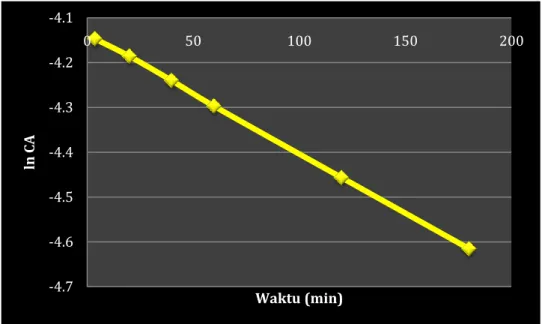
Prosedurnya adalah sebagai berikut, Pertama plot data 𝐶𝐴vs t, gambar kurva yang smooth untuk merepresentasikan data (yang terpenting) seperti yang terlihatr pada Gambar E.3.1c, lalu ambil CAO = 10,5 dan 2 dan isi tabel di bawah ini.
CAO CA end (= 0,8 CAO) Waktu yang diperlukan tF, ᵟ log tF log CAO 10 8 0 --> 18,5 = 18,5 log 18,5 = 1,27 1,00
5 4 59 --> 82 = 23 1,36 0,70
2 1,6 180 --> 215 = 35 1,54 0,30
Dari kurva, bukan dari data Selanjutnya, plot log tF vs log CAO, seperti yang ditunjukkan di Gambar E.3.1d dan mencari gradiennya.
Gambar E.3.1c dan E.3.1d
Sekarang kita mempunyai orde reaksi. Untuk mengevaluasi konstanta laju, Ambil poin mana pun pada kurva CA vs t. Ambil nilaki CAO = 10, di mana tF = 18,5 detik. Dengan memasukkan semua nilai ke dalam persamaan (i) menghasilkan
0 2 4 6 8 10 12 0 200 400 CA tF(detik) Kurva smooth tidak perlu melewati semua poin di data 0.00 0.50 1.00 1.50 2.00 0.00 0.50 1.00 1.50 A xi s Ti tle Axis Title Gradien = 1 – n = -0,4 n = 1,6
KINETIKA KIMIA 50 18,5 = 0,8 1−1,4− 1 𝑘 (1,4 − 1) 101−1,4 di mana 𝑘 = 0,05
Sehingga, persamaan laju yang merepresentasikan reaksi adalah
−𝑟𝐴 = 0,005
𝑙𝑖𝑡𝑒𝑟1,4
𝑚𝑜𝑙1,4𝑑𝑒𝑡𝑖𝑘 𝐶𝐴1,4
𝑚𝑜𝑙 𝑙𝑖𝑡𝑒𝑟 𝑑𝑒𝑡𝑖𝑘
KINETIKA KIMIA 51 DAFTAR PUSTAKA
Chang, Reymond. 2005. Kimia Dasar : Konsep-Konsep Inti Jilid 2, Edisi Ketiga. Jakarta : Elangga.