LAPORAN MINGGUAN
PRAKTIKUM KIMIA DASAR
REAKSI KIMIA
Oleh:
Nama
: Nugraheni Wahyu Permatasari
NRP
: 133020112
Kelompok
: E
Meja
: 4 (Empat)
Tanggal Percobaan
: 18 Oktober 2013
Asisten
: Aldia Januaresti Atmanagara
LABORATORIUM KIMIA DASAR
JURUSAN TEKNOLOGI PANGAN
FAKULTAS TEKNIK
UNIVERSITAS PASUNDAN
BANDUNG
2013
REAKSI KIMIA
Nugraheni Wahyu Permatasari
133020112
Jurusan Teknologi Pangan, Fakultas Teknik, Universitas Pasundan
ABSTRAK
Dalam ilmu kimia reaksi itu merupakan salah satu cara untuk mengetahui sifat-sifat kimia dari satu atau berbagai jenis zat. Tujuan Percobaan adalah untuk mengetahui dan mempelajari jenis dan sifat (sifat kimia dan sifat fisika) dari zat yang direaksikan, serta untuk mencari rumus senyawa dan koefisien reaksi dari senyawa dengan cara mereaksi dua buah zat atau lebih yang dibuktikan adanya perubahan warna, bau, suhu, timbulnya gas dan endapan. Prinsip Percobaan adalah berdasarkan penggabungan molekul terbagi menjadi dua bagian atau lebih. Molekul yang kecil atau atom-atom dalam molekul. Reaksi kimia selalu melibatkan terbentuk dan terputusya ikatan kimia. Berdasarkan Hukum Kekekalan Massa yang dikemukakan Lavoisier: “Massa zat sebelum dan sesudah reaksi adalah sama” dan berdasarkan Hukum Perbandingan Tetap (Hukum Proust) : “Dalam setiap persenyawaan perbandingan massa unsur-unsur selalu tetap”. Berdasarkan Bronsted Lowry : “Asam sebagai setiap zat sembarang yang menyumbang proton dan basa sebagai setiap zat sembarang yang menerima proton”. Hasil yang didapatkan adalah kita dapat mengetahui yang termasuk reaksi penetralan terdapat pada percobaan nomor 1, 2, 3 dan 9, yang termasuk reaksi kompleksometri terdapat pada percobaan nomor 4, 5, 6, 7, 8, 10, 11, 12 dan 13, yang termasuk reaksi pertukaran ganda terdapat pada percobaan nomor 4, 5, 6 dan 7, yang termasuk reaksi redoks terdapat pada percobaan nomor 10, 11, 12, 15, 16, 18 dan 19, yang termasuk reaksi pengendapan terdapat pada percobaan nomor 7, 8, 11, 14, 15, 17, 19 dan 20, yang termasuk reaksi pembentukan terdapat pada percobaan nomor 10 dan 15.
Key words: Reaksi kimia.
PENDAHULUAN
Reaksi kimia adalah suatu proses dimana zat-zat baru yaitu hasil reaksi, terbentuk dari beberapa zat aslinya, yang disebut pereaksi. Biasanya suatu reaksi kimia disertai oleh kejadian-kejadian fisis, seperti perubahan warna, pembentukan endapan, atau timbulnya gas atau bisa juga reaksi kimaia di definisikan sebagi berikut, Reaksi kimia adalah suatu proses alam yang selalu menghasilkan antar perubahan senyawa kimia.
Tujuan Percobaan adalah untuk mengetahui dan mempelajari jenis dan sifat (sifat kimia dan sifat fisika) dari zat yang direaksikan, serta untuk mencari rumus senyawa dan koefisien reaksi dari senyawa dengan cara mereaksi dua buah zat atau lebih yang dibuktikan adanya perubahan warna, bau, suhu , timbulnya gas dan endapan.
Prinsip Percobaan adalah berdasarkan penggabungan molekul terbagi menjadi dua bagian atau lebih.Molekul yang kecil atau atom-atom dalam molekul.Reaksi kimia selalu melibatkan terbentuk dan terputusya ikatan kimia. Berdasarkan Hukum Kekekalan Massa yang dikemukakan Lavoisier: “Massa zat sebelum dan sesudah reaksi adalah sama” dan berdasarkan Hukum Perbandingan Tetap (Hukum Proust) : “Dalam setiap persenyawaan perbandingan massa unsur-unsur selalu tetap”. Berdasarkan Bronsted Lowry : “Asam sebagai setiap zat sembarang yang menyumbang proton dan
basa sebagai setiap zat sembarang yang menerima proton”.
METODOLOGI
Bahan dan Alat yang DigunakanBahan yang digunakan pada percobaan ini adalah NaOH 0,05M, HCl 0,1M, CH3COOH 0,05M, phenolphthalein (PP), metil merah (MM), K2CrO40,1M, K2Cr2O7 0,1M, Al2(SO4)3 0,1M, NaOH 1M, NH4OH 1M, ZnSO4 0,1M, (NH4)2SO4 1M, Pb(No3)2 0,1M, NaCl 0,1M, NaCl 0,5M, AgNO3 1M, BaCl2 0,1M, HCl 1M, CaCO3 1M, Ba(OH)2 1M, H2C2O4 0,1M, H2SO4 1M, Fe2+ 0,1 M, KMnO4 0,05M, CuSO4 0,05M,Fe3+ 0,1M, KSCN 0,1M, Na3PO4 1M, dan lakmus merah. Alat yang digunakan pada percobaan ini adalah tabung reaksi, rak tabung reaksi, pipet, botol semprot, cawan, batang pengaduk, corong, timbangan digital, penjepit, bunsen, pipa U, bunsen, dan korek api.
Metode Percobaan
Tabel 3. Metode Percobaan Reaksi Kimia
No Reaksi
1.
a. 1ml NaOH 0,05 M + 1 tetes phenolphthalein (PP)
b. 1ml NaOH 0,05M + 1 tetes metil merah (MM)
c. 1ml HCl 0,1M + 1 tetes phenolphthalein (PP) d. 1ml HCl 0,1M + 1 tetes metil merah (MM)
2
a. 1ml CH3COOH 0,05 M + 1 tetes phenolphthalein (PP)
b. 1ml CH3COOH 0,05M + metil merah (MM) c. 1ml NaOH 0,05M + 1 tetes phenolphthalein
(PP)
d. 1ml NaOH 0,05M + 1 tetes metil merah (MM) 3. a. 1ml NaOH 0,05M(pp) (1.a) + 1 ml HCl 0,1M(pp) (1.c) b. 1ml NaOH 0,05M(mm) (1.b) + 1ml HCl 0,1M(mm) (1.d)
c. 1ml NaOH 0,05M(pp) (2.a) + 1ml CH3COOH 0,05M(pp) (2.c) d. 1ml NaOH 0,05M(mm) (2.b) + 1 ml CH3COOH 0,05M(mm) (2.d) 4. a. 1ml K2CrO4 0,1M + 1ml HCl 0,1M b. 1ml K2Cro4 0,1M + 1ml NaOH 0,05M 5. a. 1ml K2Cr2O7 0,1M + 1ml HCl 0,1M b. 1ml K2Cr2O7 0,1M + 1ml NaOH 0,05M 6.
1ml Al2(SO4)3 0,1M + 1tetes NaOH 1M 7.
1ml Al2(SO4)3 0,1M + 1 tetes NaOH 1M + tetes demi tetes NH4OH 1M
8.
a. 1ml ZnSO4 0,1M + 5 tetes NaOH 1M b. 1ml ZnSO4 0,1 M+ 5 tetes NaOH 1M + tetes
demi tetes NH4OH 1M 9.
Tabung Pertama : 4ml (NH4)2SO4 + NaOH 0,05 M
Tabung Kedua : Lakmus Merah
10.
1ml Pb(NO3)2 0,1M + 1 ml NaCl 0,1
Kemudian campuran tersebut dipanaskan sambil dikoconk dan catat pengamatan dan dinginkan sambil diamati
11.
1ml NaCl 0,5M + 10 tetes AgNO3 12 1ml BaCl2 0,1M + 1ml K2CrO4 0,1M 13. 1ml BaCl2 0,1M +1ml K2Cr2O7 0,1M 14. 1ml BaCl2 0,1M + 1ml HCl 1M + 1ml K2CrO4 0,1M 15.
Tabung Pertama : 1 gram CaCO3 + 1ml HCL 1 M
Tabung Kedua : 1ml Ba(OH)2 16.
1ml H2C2O4 0,1M + 2 tetes H2SO4
Lalu dipanaskan dan diteteskan KMnO4 sambil dikocok, teteskan terusKMnO4 sampai
warnanya tidak hilang lagi 17.
1ml Fe2+ 0,1M + 2 tetes H2C2O4 1M
Kemudian diteteskan KMnO4 sambil dikocok, teteskan terus larutan KMnO4 sampai warna tidak hilang lagi. Bandingkan kecepatan laju hilangnya warna KMNO4 dengan percbaan 16 18.
1ml CuSO4 0,05 M + NaOH 1M sedikit demi sedikit sampai berlebih
19.
1 ml CuSO4 0,05 + NH4OH 1 M sedikit demi sedikit sampai berlebih
20.
2ml Fe3+ 0,1 M + 2ml KSCN 0,1 M
Dibagi menjadi 2, yang satu ditambahkan Na3PO4, lalu dibandingkan
HASIL DAN PEMBAHASAN
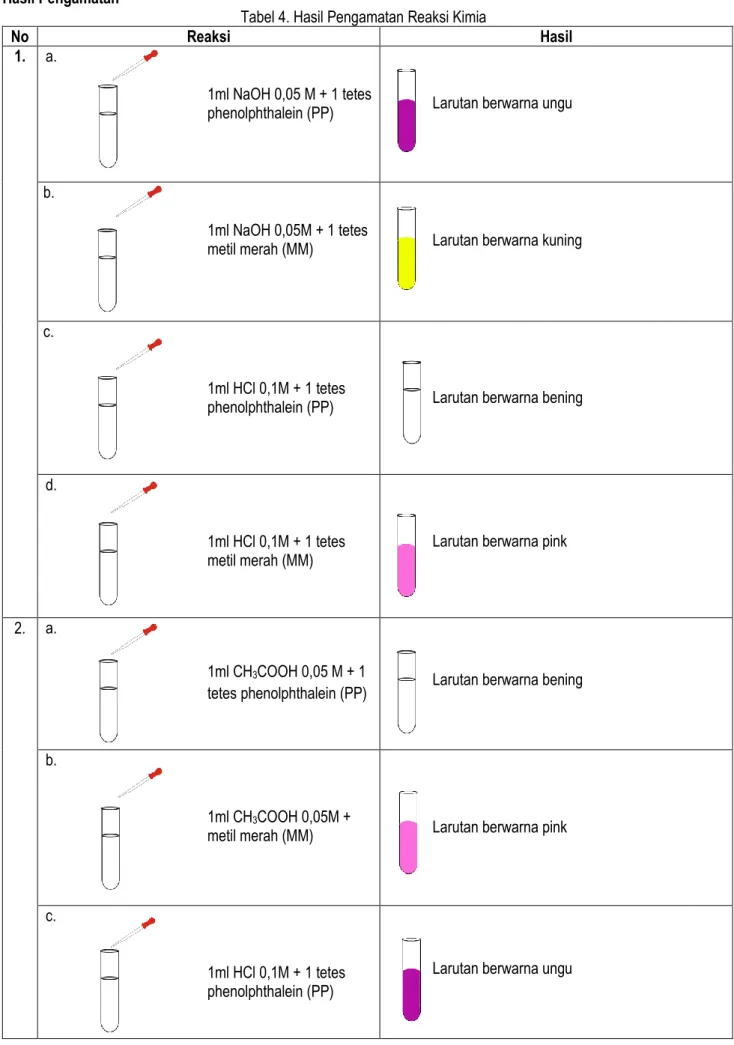
Hasil PengamatanTabel 4. Hasil Pengamatan Reaksi Kimia
No Reaksi Hasil
1. a.
1ml NaOH 0,05 M + 1 tetes
phenolphthalein (PP) Larutan berwarna ungu
b.
1ml NaOH 0,05M + 1 tetes
metil merah (MM) Larutan berwarna kuning
c.
1ml HCl 0,1M + 1 tetes
phenolphthalein (PP) Larutan berwarna bening
d.
1ml HCl 0,1M + 1 tetes metil merah (MM)
Larutan berwarna pink
2. a.
1ml CH3COOH 0,05 M + 1
tetes phenolphthalein (PP) Larutan berwarna bening
b.
1ml CH3COOH 0,05M +
metil merah (MM) Larutan berwarna pink
c.
1ml HCl 0,1M + 1 tetes phenolphthalein (PP)
d.
1ml NaOH 0,05M + 1 tetes metil merah (MM)
Larutan berwarna kuning
3. a.
1ml NaOH 0,05M(pp) (1.a)
+ + 1 ml HCl 0,1M(pp) (1.c) Larutan berwarna bening
b.
1ml NaOH 0,05M(mm)(1.b)
+ + 1ml HCl 0,1M(mm) (1.d) Larutan berwarna merah c.
1ml NaOH 0,05M(pp) (2.a) +
+ 1ml CH3COOH 0,05M(pp)(2.c) Larutan berwarna bening
d.
1ml NaOH 0,05M(mm) (2.b)+
+ 1 ml CH3COOH 0,05M(mm) (2.d) Larutan berwarna merah
4. a.
+ 1ml K2CrO4 0,1M +
1ml HCl 0,1M Larutan berwarna orange
b.
+ 1ml K2Cro4 0,1M +
1ml NaOH 0,05M Larutan berwarna kuning
5. a.
+ 1ml K2Cr2O7 0,1M +
b.
+ 1ml K2Cr2O7 0,1M +
1ml NaOH 0,05M Larutan berwarna kuning
6.
+ 1ml Al2(SO4)3 0,1M + 1tetes NaOH 1M
Larutan berwarna putih
7.
1ml Al2(SO4)3 0,1M + + 1 tetes NaOH 1M + tetes demi tetes NH4OH 1M
Larutan berwarna bening
8. a.
1ml ZnSO4 0,1M +
+ 5 tetes NaOH 1M Larutan berwarna putih keruh mengendap b.
1ml ZnSO4 0,1 M+ 5 tetes NaOH 1M + tetes demi tetes NH4OH 1M
Larutan berwarna putih mengendap
9.
Pertama :
4ml (NH4)2SO4 + NaOH 0,05 M Tabung Kedua :
Lakmus Merah Lakmus berwarna biru
10.
1ml Pb(NO3)2 0,1M +
+ 1 ml NaCl 0,1 Larutan berwarna bening
11.
1ml NaCl 0,5M +
12.
+ 1ml BaCl2 0,1M + 1ml K2CrO4 0,1M
Larutan kuning muda dan mengendap
13.
+ 1ml BaCl2 0,1M +
1ml K2Cr2O7 0,1M Larutan kuning dan ada gas gelembung
14.
1ml BaCl2 0,1M + 1ml HCl 1M +
+ + 1ml K2CrO4 0,1M Larutan berwarna orange
15.
Tabung Pertama:
1 gram CaCO3 + 1ml HCL 1 M Tabung Kedua:
1ml Ba(OH)2 Larutan mengendap dan ada gas gelembung
16.
1ml H2C2O4 0,1M +
2 tetes H2SO4 + KMnO4 Larutan berwarna cokelat dan ada endapan
17
1ml Fe2+ 0,1M + 2 tetes H2C2O4 1M +
1ml KMnO40,05M Larutan berwarna ungu tua dan mengendap
18.
1ml CuSO4 0,05 M + NaOH 1M sedikit demi
19
1 ml CuSO4 0,05 + NH4OH 1 M sedikit demi
sedikit sampai berlebih Larutan berwarna biru ke ungu-unguan dan mengendap 20. 2ml Fe3+ 0,1 M + 2ml KSCN 0,1 M (dibagi 2, tabung 2 di tambahkan Na3PO4)
Larutan berwarna cokelat pekat
Larutan berwarna cokelat encer
(Sumber : Nugraheni Wahyu Permatasari, 133020112, Meja 4, Kelompok E) Pembahasan
Berdasarkan hasil pengamatan kita dapat mengetahui yang termasuk reaksi penetralan terdapat pada percobaan nomor 1, 2, 3 dan 9, yang termasuk reaksi kompleksometri terdapat pada percobaan nomor 4, 5, 6, 7, 8, 10, 11, 12 dan 13, yang termasuk reaksi pertukaran ganda terdapat pada percobaan nomor 4, 5, 6 dan 7, yang termasuk reaksi redoks terdapat pada percobaan nomor 10, 11, 12, 15, 16, 18 dan 19, yang termasuk reaksi pengendapan terdapat pada percobaan nomor 7, 8, 11, 14, 15, 17, 19 dan 20, yang termasuk reaksi pembentukan terdapat pada percobaan nomor 10 dan 15.
Setiap larutan mempunyai sifat yang berbeda-beda. Ada larutan yang mudah larut apabila dicampurkan dengan larutan yang lain, ada yang memerlukan waktu agak lama. Lalu ada juga larutan yang menghasilkan warna mencolok dan ada juga yang malah tidak berubah warna.
Dipercobaan reaksi kimia yang telah dilakukan masih banyak terjadi kesalahan.Hasil yang didapat praktikan berbeda dengan hasil reaksi yang benar.Kesalahan tersebut dipengaruhi oleh faktor diantaranya, kurangnya ketelitian praktikan saat menggunakan pipet. Pipet yang telah dipakai untuk mengambil zat sebelumnya tidak dibersihkan terlebih dahulu saat akan mengambil zat yang lain. Sehingga zat sebelumnya tercampur dengan zat lain dan mempengaruhi hasil akhir reaksi kimia tersebut. Bila terjadi perbedaan baik itu perubahan warna, endapan dan tidak adanya endapan, hal itu bisa terjadi karena faktor lingkungan. Faktor lingkungan seperti, tinggi rendahnya suhu ruangan yang mempengaruhi proses kelarutan, takaran yang tidak sesuai, ataupun botol larutan yang tidak ditutup kembali.
Reaksi kimia adalah suatu proses dimana zat-zat baru yaitu hasil reaksi, terbentuk dari beberapa zat aslinya, yang disebut pereaksi. Biasanya suatu reaksi kimia disertai oleh kejadian-kejadian fisis, seperti perubahan warna, pembentukan endapan, atau timbulnya gas.
Beberapa dari percobaan reaksi kimia diatas dapat digolongkan menjadi beberapa jenis reaksi, yaitu:
Reaksi Penetralan adalah larutan asam kuat dan larutan basa kuat yang dicampurkan dan menghasilkan produk reaksi berupa garam dalam air. Reaksi yang penting dalam reaksi ini adalah reaksi asam dan basa yang apabila direaksikan dalam perbandingan tertentu selalu membentuk uap air. Perubahan sifat ini menunjukan bahwa pada percampuran larutan asam dengan larutan basa, terjadi suatu reaksi yang mengasilkan garam dan air.yang termasuk kedalam reaksi penetralan terjadi pada percobaan nomor 1, 2, 3 dan 9.
Reaksi kompleksometri adalah reaksi ion logam, yaitu kation dengan anion atau molekul netral. Terdiri dari atom pusat dan sejumlah ligan yang terikat pada atom pusat. Satu ion atau molekul kompleks terdiri dari atom pusat yang ditandai dengan bilangan koordinasi, yakni suatu angka bulat yang menunjukan jumlah ligan (monodentat) yang membentuk kompleks stabil dengan satu atan (ion) pusat. Ligan dalam kompleks dapat berupa anion atau molekul netral yang mengandung sebuah atom lebih sepasang elektron yang dapat diberikan pada ion logam.yang termasuk kedalam reaksi kompleksometri terjadi pada percobaan nomor4, 5, 6, 7, 8, 10, 11, 12, dan 13.
Reaksi pertukaran ganda yang melibatkan pertukaran bagian dari pereaksi. Yang termasuk reaksi pertukaran ganda terjadi pada percobaan nomor4, 5, 6, dan 7.
Reaksi redoks dapat dipahami sebagai transfer elektron dari salah satu senyawa (disebut reduktor) ke senyawa lainnya (disebut oksidator). Dalam proses ini, senyawa yang satu akan teroksidasi dan senyawa lainnya akan tereduksi, oleh karena itu disebut redoks. Oksidasi sendiri dimengerti sebagai kenaikan bilangan oksidasi, dan reduksi adalah penurunan bilangan oksidasi. Dalam prakteknya, transfer dari elektron ini akan selalu mengubah bilangan oksidasinya, tapi banyak reaksi yang diklasifikasikan sebagai reaksi redoks walaupun sebenarnya tidak ada elektron yang berpindah (seperti yang melibatkan ikatan kovalen). yang termasuk reaksi redoks terjadi pada percobaan nomor10, 11, 12, 15, 16, 18, dan 19.
Reaksi pengendapan adalah reaksi antara zat-zat atau ion logam yang sukar larut dalam air, sehingga terbentuklah endapan. Pembentukan endapan menunjukan perubahan sifat kelarutan yang bila terjadi reaksi antara zat berbeda, maka zat tersebut tidak seluruhnya larut. Sehingga terbentuklah endapan pada hasil reaksinya. yang termasuk reaksi pengendapanterjadi pada percobaan nomor 7, 8, 11, 14, 15, 17, 19, dan 20
Reaksi pembentukan adalah penggabungan atom-atom dari beberapa unsur membentuk senyawa baru.yang termasuk reaksi terjadi pada percobaan nomor 10 dan 15.
Tanda-tanda terjadinya reaksi kimia, yaitu: 1. Terjadi pembentukan endapan.
Hal ini terjadi jika zat baru yang terbentuk tidak larut/sukar larut dalam air.
2. Terjadi pembentukan gas.
Hal ini terjadi jika zat baru yang dihasilkan berbentuk gas sehingga menimbulkan gelembung-gelembung gas yang seringkali memiliki bau yang khas.
3. Terjadi perubahan warna.
Hal ini biasa terjadi jika zat baru yang terbentuk mempunyai warna yang berbeda dengan warna zat semula.
4. Terjadi perubahan suhu.
Pada setiap reaksi kimia berlangsung selalunya disertai dengan penyerapan dan pelepasan energi panas (kalor).Jika suhu materi naik, maka terjadi reaksi Eksoterm.Sedangkan jika suhu materi menurun maka terjadi reaksi Endoterm.
Faktor yang mempengaruhi laju reaksi, yaitu: 1. Konsentrasi
Larutan dengan konsentrasi yang besar (pekat) mengandung partikel yang lebih rapat, jika dibandingkan dengan larutan encer.Semakin tinggi konsentrasi berarti semakin banyak
molekul-molekul dalam setiap satuan luas ruangan, akibatnya tumbukan antar molekul makin sering terjadi dan reaksi berlangsung semakin cepat. 2. Luas permukaan sentuh
Suatu zat akan bereaksi apabila bercampur dan bertumbukan. Pada pencampuran reaktan yang terdiri dari dua fasa atau lebih, tumbukan berlangsung pada bagian permukaan zat.Padatan berbentuk serbuk halus memiliki luas permukaan bidang sentuh yang lebih besar daripada padatan berbentuk lempeng atau butiran. Semakin luas permukaan partikel, maka frekuensi tumbukan kemungkinan akan semakin tinggi sehingga reaksi dapat berlangsung lebih cepat.
3. Temperatur
Setiap partikel selalu bergerak.Dengan naiknya suhu, energi gerak (kinetik) partikel ikut meningkat sehingga makin banyak partikel yang memiliki energi kinetik di atas harga energi aktivasi.Kenaikan suhu akan memperbesar laju reaksi Harga tetapan laju reaksi akan berubah jika suhunya berubah. 4. Katalisator
Katalis adalah zat yang dapat memperbesar laju reaksi, tetapi tidak mengalami perubahan kimia secara permanen, sehingga pada akhir reaksi zat tersebut dapat diperoleh kembali.Katalis mempercepat reaksi dengan cara menurunkan harga energi aktivasi (Ea). Katalisis adalah peristiwa peningkatan laju reaksi sebagai akibat penambahan suatu katalis. Meskipun katalis menurunkan energi aktivasi reaksi, tetapi ia tidak mempengaruhi perbedaan energi antara produk dan pereaksi. Dengan kata lain, penggunaan katalis tidak akan mengubah entalpi reaksi.
Aplikasi di bidang pangan pada percobaan kimia, yaitu pada pnambahan C6H12O6 (Glukosa) pada air dalam pembuatan teh manis, penambahan Na2CO3 dalam pembuatan kue sebagai pengembang, penamahan MSG (Monoso dium Glutamat) pada masakan dan pembuatan garam.
KESIMPULAN
Berdasarkan hasil pengamatan dari percobaan reaksi kimia, dapat diketahui yang termasuk reaksi penetralan terdapat pada percobaan nomor 1, 2, 3 dan 9, yang termasuk reaksi kompleksometri terdapat pada percobaan nomor 4, 5, 6, 7, 8, 10, 11, 12 dan 13, yang termasuk reaksi pertukaran ganda terdapat pada percobaan nomor 4, 5, 6 dan 7, yang termasuk reaksi redoks terdapat pada percobaan nomor 10, 11, 12, 15, 16, 18 dan 19, yang termasuk reaksi pengendapan terdapat pada percobaan nomor 7, 8, 11, 14, 15, 17, 19 dan 20, yang termasuk reaksi pembentukan terdapat pada percobaan nomor 10 dan 15.
DAFTAR PUSTAKA
Anonim. 2011. Faktor-faktor yang mempengaruhi laju reaksi.
http://datachem.blogspot.com/2011/05/faktor-faktor-yang-mempengaruhi-laju.html.
Accesed : 21 Oct 2013.
Anonim. 2012. Reaksi Kimia dan Perubahan Kimia. http://www.kamuslife.com/2012/02/reaksi-kimia-dan-perubahan-kimia-tanda.html.
Accesed : 21 Oct 2013.
Brady, E. James. (1999), Kimia Universitas Asas dan Struktur, Binapura Aksara : Jakarta.
Sutrisno, E.T. dan Nurminabari, I.S.2010.Penuntun Praktikum Kimia Dasar. Universitas Pasundan : Bandung