LAPORAN MINGGUAN
PRAKTIKUM KIMIA DASAR
STOIKIOMETRI
Oleh :
Nama
: Ernalia Rosita
NRP
: 133020175
Kelompok
: G
Meja
: 11 (Sebelas)
Tanggal Percobaan : 23 Oktober 2013
Asisten
: Vanidya Afsarah Permadi
LABORATORIUM KIMIA DASAR
JURUSAN TEKNOLOGI PANGAN
FAKULTAS TEKNIK
UNIVERSITAS PASUNDAN
BANDUNG
2013
STOIKIOMETRI
ERNALIA ROSITA 133020175
Jurusan Teknologi Pangan, Fakultas Teknik, Universitas Pasundan
ABSTRAK
Stoikiometri berasal dari bahasa Yunani yaitu stoiceon (unsur) dan metrein (mengukur). Stoikiometri berarti mengukur unsur-unsur dalam hal ini adalah partikel atom ion, molekul yang terdapat dalam unsur atau senyawa yang terlibat dalam reaksi kimia. Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) yang didasarkan pada hukum-hukum dasar dan persamaan reaksi. Tujuan dari percobaan ini adalah untuk menentukan hasil reaksi kimia dari percobaan selain itu agar praktikan dapat dengan mudah menuliskan rumus dari suatu senyawa dan mempelajari stoikiometri. Prinsip dari percobaan ini adalah berdasarkan metode Variasi Kontinyu, dimana dalam metode ini dilakukan sederet pengamatan kuantitas molar totalnya sama. Tapi masing-masing kuantitas pereaksi berubah-ubah. Salah satu sifat fisika dipilih diperiksa seperti: massa, volume, suhu dan daya serap. Oleh karena itu kuantitas pereaksi berlainan, perubahan harga sifat fisika dari sistem ini dappat digunakan untuk meramalkan stoikiometri sistem.
Keywords: Stoikiometri, reaksi kimia, variasi kontinyu, tujuan percobaan, prinsip percobaan. PENDAHULUAN
Stoikiometri berasal dari bahasa Yunani yaitu stoiceon (unsur) dan metrein (mengukur). Stoikiometri berarti mengukur unsur-unsur dalam hal ini adalah partikel atom ion, molekul yang terdapat dalam unsur atau senyawa yang terlibat dalam reaksi kimia. Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) yang didasarkan pada hukum-hukum dasar dan persamaan reaksi. Stoikiometri beberapa reaksi dapat dipelajari dengan mudah, salah satunya dengan metode JOB atau metode Variasi Kontinyu, yang mekanismenya yaitu dengan dilakukan pengamatan terhadap kuantitas molar pereaksi yang berubah-ubah, namun molar totalnya sama.
Tujuan dari percobaan ini adalah untuk menentukan hasil reaksi kimia dari percobaan selain itu agar praktikan dapat dengan mudah menuliskan rumus dari suatu senyawa dan mempelajari stoikiometri.
Prinsip dari percobaan ini adalah berdasarkan metode Variasi Kontinyu, dimana dalam metode ini dilakukan sederet pengamatan kuantitas molar totalnya sama. Tapi masing-masing kuantitas pereaksi berubah-ubah. Salah satu sifat fisika dipilih diperiksa seperti: massa, volume, suhu dan daya serap. Oleh karena itu kuantitas pereaksi berlainan, perubahan harga sifat fisika dari sistem ini dappat digunakan untuk meramalkan stoikiometri sistem.
METODOLOGI A. Alat Percobaan
Alat - alat yang digunakan pada percobaan stoikiometri adalah gelas kimia, termometer, pipet seukuran dan filler.
B. Bahan Percobaan
Bahan yang digunakan pada percobaan
stoikiometri adalah NaOH 1 M, CuSO4 1 M dan
CH3COOH 1 M.
C. Metode Percobaan
NaOH 1 M dan CuSO4 1 M
a.
25 ml NaOH 5 ml CuSO4 NaOH + CuSO4
b.
20 ml NaOH 10 ml CuSO4 NaOH + CuSO4
c.
15 ml NaOH 15 ml CuSO4 NaOH + CuSO4
d.
e.
5 ml NaOH 25 ml CuSO4 NaOH + CuSO4
NaOH 1 M + CH3COOH 1 M
a.
5 ml NaOH 25 ml CH3COOH NaOH + CH3COOH
b.
10 ml NaOH 20 ml CH3COOH NaOH + CH3COOH
c.
15ml NaOH 15 ml CH3COOH NaOH + CH3COOH
d.
20 ml NaOH 10 ml CH3COOH NaOH + CH3COOH
e.
25 ml NaOH 5 ml CH3COOH NaOH + CH3COOH
HASIL DAN PEMBAHASAN A. Hasil Pengamatan
Berdasarkan hasil percobaan yang dilakukan didapatkan hasil sebagai berikut:
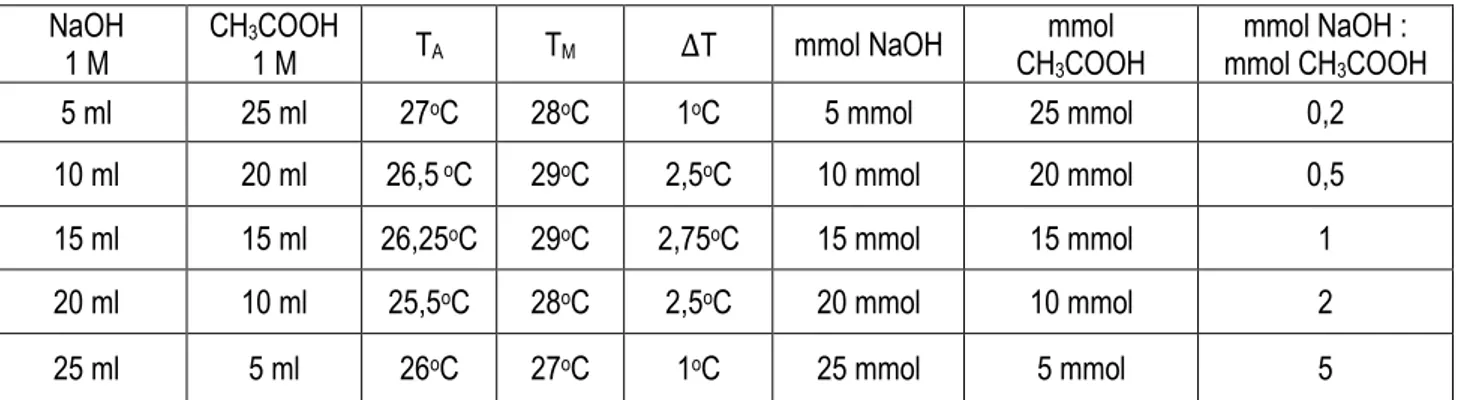
Tabel 1. Hasil Pengamatan Variasi Kontinyu Sistem NaOH + CH3COOH
NaOH
1 M CH31 M COOH TA TM T mmol NaOH CHmmol 3COOH
mmol NaOH : mmol CH3COOH 5 ml 25 ml 27oC 28oC 1oC 5 mmol 25 mmol 0,2 10 ml 20 ml 26,5 oC 29oC 2,5oC 10 mmol 20 mmol 0,5 15 ml 15 ml 26,25oC 29oC 2,75oC 15 mmol 15 mmol 1 20 ml 10 ml 25,5oC 28oC 2,5oC 20 mmol 10 mmol 2 25 ml 5 ml 26oC 27oC 1oC 25 mmol 5 mmol 5
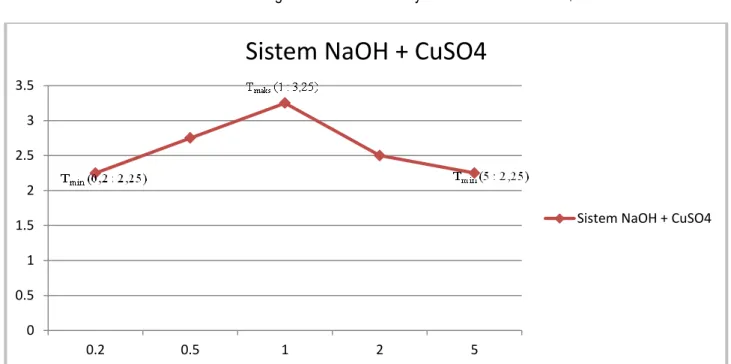
Tabel 2. Hasil Pengamatan Variasi Kontinyu Sistem NaOH + CuSO4
NaOH
1 M CuSO
4
1 M TA TM T mmol NaOH mmol CuSO4 mmol NaOH : mmol CuSO
4 5 ml 25 ml 25,75oC 28oC 2,25oC 5 mmol 25 mmol 0,2 10 ml 20 ml 26,25oC 29oC 2,75oC 10 mmol 20 mmol 0,5 15 ml 15 ml 26,25oC 29,5oC 3,25oC 15 mmol 15 mmol 1 20 ml 10 ml 26,5oC 29oC 2,5oC 20 mmol 10 mmol 2 25 ml 5 ml 25,75oC 28oC 2,25oC 25 mmol 5 mmol 5
(Sumber: Ernalia Rosita, 133020175, Meja 11, Kelompok G, 2013)
Grafik 1. Grafik Pengamatan Variasi Kontinyu Sistem NaOH + CH3COOH
0 0.5 1 1.5 2 2.5 3 0.2 0.5 1 2 5
Sistem NaOH + CH3COOH
Grafik 2. Grafik Pengamatan Variasi Kontinyu Sistem NaOH + CuSO4
B. Pembahasan
Berdasarkan hasil percobaan stoikiometri yang dilakukan, ada dua variasi kontinyu sistem yang diamati yaitu variasi kontinyu sistem NaOH +
CH3COOH dan variasi kontinyu sistem NaOH + CuSO4.
Pada variasi kontinyu sistem NaOH + CH3COOH
didapatkan larutan yang mencapai titik maksimum yaitu
pada larutan 15 ml NaOH + 15 ml CH3COOH dengan
titik maksimum (1 : 2,75). Sedangkan titik minimum sistem tersebut terdapat pada larutan 5 ml NaOH + 25
ml CH3COOH dan 25 ml NaOH + 5 ml CH3COOH
dengan titik minimum (0,2 : 1) dan (5 : 1). Selanjutnya,
variasi kontinyu sistem NaOH + CuSO4. Pada variasi
kontinyu sistem NaOH + CuSO4 didapatkan larutan
yang mencapai titik maksimum yaitu pada larutan 15 ml
NaOH + 15 ml CuSO4 dengan titik maksimum (1 : 3,25).
Sedangkan titik minimum sistem tersebut terdapat pada
larutan 5 ml NaOH + 25 ml CuSO4 dan 25 ml NaOH + 5
ml CuSO4 dengan titik minimum (0,2 : 2,25) dan
(5 : 2,25).
Stoikiometri berasal dari bahasa Yunani yaitu stoiceon (unsur) dan metrein (mengukur). Stoikiometri berarti mengukur unsur-unsur dalam hal ini adalah partikel atom ion, molekul yang terdapat dalam unsur atau senyawa yang terlibat dalam reaksi kimia. Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) yang didasarkan pada hukum-hukum dasar dan persamaan reaksi. Stoikiometri beberapa reaksi dapat dipelajari dengan mudah, salah satunya dengan metode JOB atau metode Variasi Kontinyu, yang mekanismenya yaitu dengan dilakukan pengamatan terhadap kuantitas molar pereaksi yang berubah-ubah, namun molar totalnya sama.
Molaritas adalah banyaknya zat terlarut (dalam mol) per liter larutan. Molaritas dapat diperlakukan sebagai faktor konversi antara volume larutan dan banyaknya zat terlarut. Molaritas sebagai faktor konversi dapat diaplikasikan pada larutan individual, pada larutan yang dicampur atau diencerkan dengan menambah lebih banyak pelarut (Petrucci dkk, 2011). Molaritas, sistem konsentrasi ini didasarkan pada volum larutan dan dengan demikian cocok untuk digunakan dalam prosedur-prosedur laboratorium yang volume larutan merupakan jumlah yang diukur. Batasannya adalah sebagai berikut: Molaritas = jumlah mol solut per liter larutan, dengan rumus:
Molalitas adalah konsentrasi yang
menyatakan jumlah mol zat terlarut dalam 1000 g pelarut. Kemolalan tidak tergantung pada temperatur dan digunakan dalam bidang kimia fisik terutama untuk sifat koligatif larutan dengan rumus:
Bila g gram zat terlarut dilarutkan dalam p gram zat pelarut dengan massa rumus relatif (Mr), maka molalitas dapat juga dirumuskan menjadi:
Normalitas yang bernotasi (N) adalah satuan konsentrasi yang sudah memperhitungkan kation atau anion yang dikandung sebuah larutan. Normalitas didefinisikan sebagai banyaknya zat dalam gram ekivalen dalam satu liter larutan. Secara sederhana
0 0.5 1 1.5 2 2.5 3 3.5 0.2 0.5 1 2 5
Sistem NaOH + CuSO4
Sistem NaOH + CuSO4
M= n / V
m = n / p
m = gram x 1000
gram ekivalen adalah jumlah gram zat untuk mendapat satu muatan dengan rumus:
Dalam stoikiometri dikenal titik maksimum dan titik minimum. Yang dimaksud dengan titik maksimum adalah titik dimana terjadi kombinasi sempurna dengan parameter suhu. Sedangkan titik minimum adalah titik dimana terjadi kombinasi tidak sempurna yang memiliki suhu rendah.
Faktor kesalahan yang dapat terjadi pada saat praktikum adalah:
1. Kesalahan penggunaan termometer. Praktikan
masih melakukan kesalahan dalam
menggunakan termometer sehingga suhu yang diamati kurang stabil dan kurang maksimal.
2. Kebersihan alat. Kurang bersihnya alat pada saat praktikum sangat berpengaruh terhadap hasil pengamatan yang didapat. Kebersihan alat mempengaruhi reaksi kimia yang terjadi pada larutan yang diamati. Sehingga, jika alat kurang bersih, laju reaksi bisa terganggu bahkan tidak bereaksi.
3. Penggunaan filler. Praktikan masih belum mengetahui cara menggunakan filler dengan benar. Kesalahan penggunaan filler ini menghambat kerja praktikan pada percobaan stoikiometri.
Terlepas dari kesalahan yang dapat terjadi pada saat praktikum, praktikan mengetahui cara untuk mengatasi kesalahan-kesalahan tersebut. Cara untuk mengatasi kesalahan-kesalahan pada saat praktikum adalah dengan cara:
1. Dalam penggunaan termometer, agar mendapat hasil yang tepat praktikan harus menggunakan tali kasur yang diikatkan diujung termometer karena jika tidak, suhu badan akan mempengaruhi termometer sehingga dapat terjadi kesalahan pengukuran pada suhu larutan yang diamati.
2. Membersihkan alat sebelum dan sesudah menggunakannya. Alat yang bersih dapat membantu praktikan untuk mendapat hasil pengamatan yang tepat sehingga tidak terjadi kesalahan pada percobaan.
3. Mengetahui cara menggunakan alat yang akan digunakan terlebih dahulu agar pada saat praktikum praktikan tidak membuang-buang waktu dan dapat menyelesaikan pekerjaan dengan cepat.
Aplikasi di bidang pangan stoikiometri adalah pada proses pembuatan larutan untuk pengujian produk pangan, untuk mengetahui tekanan suhu dalam suatu produk, untuk mengetahui dan menentukan kadar molaritas dalam bidang pangan, untuk
menentukan normalitas dalam bidang pangan, untuk menentukan fraksi mol dalam peracikan kadar bahan pangan, dll.
KESIMPULAN
Berdasarkan hasil percobaan stoikiometri pada saat praktikum, dapat disimpulkan bahwa larutan terbaik yang mencapai kombinasi sempurna atau mencapai stoikiometri adalah larutan yang mencapai titik maksimum. Larutan tersebut adalah larutan terbaik dalam peracikan suatu bahan pangan.
DAFTAR PUSTAKA
Maulana, Puri. 2012. Pengertian Molaritas, M, Contoh
Soal, Kemolalan, Larutan, Kimia.
http://perpustakaancyber.blogspot.com. Diakses: 27 Oktober 2013.
Petrucci, H.R. 2011. Kimia Dasar Prinsip – Prinsip dan Aplikasi Modern. Jakarta: Erlangga.
Supardi, D. Perhitungan-perhitungan Kimia.
http://dsupardi.wordpress.com. Diakses: 27 Oktober 2013. N = ek