LAPORAN PRAKTIKUM KIMIA DASAR TERMOKIMIA
Nama : Listi Nur Maitsa NRP : 143020008 Kelompok : A
Meja : 4 (Empat) Asisten : Akbar Maulana
LABORATORIUM KIMIA DASAR JURUSAN TEKNOLOGI PANGAN
FAKULTAS TEKNIK UNIVERSITAS PASUNDAN
STOIKHIOMETRI
Listi Nur Maitsa 143020008 Asisten : Akbar Maulana
Tujuan Percobaan
Tujuan percobaan termokimia mempelajari bahwa setiap reaksi kimia selalu disertai dengan perubahan energi, perubahan kaloor dapat diukur atau dipelajari dengan percobaan yang sederhana, dan reaksi kimia dapat berlangsung secara endoterm atau eksoterm.
Prinsip Percobaan
Prinsip percobaan termokimia, yaitu berdasarkan:
Hukum Hess : “Kalor yang dibebaskan atau diserap tidak bergantung pada jalannya reaksi, tetapi bergantung pada keadaan awal dan akhir”.
Hukum Black : “Kalor yang diserap akan sama dengan kalor yang dilepas”.
Hukum Lavoisier : “Setiap reaksi kimia, massa zar yang bereaksi sama dengan dan massa produk reaksi”.
Metode Percobaan
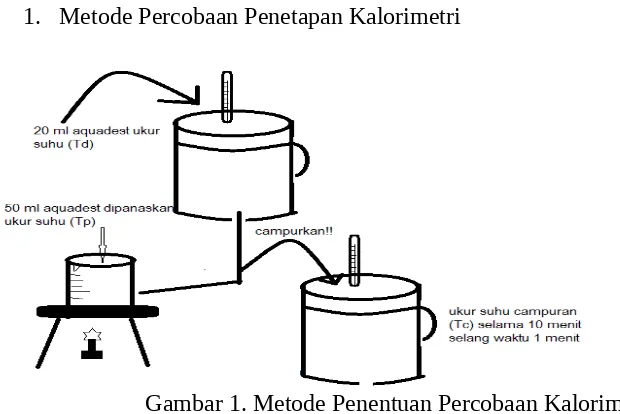
[image:2.612.120.430.485.692.2]1. Metode Percobaan Penetapan Kalorimetri
Gambar 2. Hasil Percobaan Penentuan Kalor Reaksi Zn(s) + CuSO4(I)
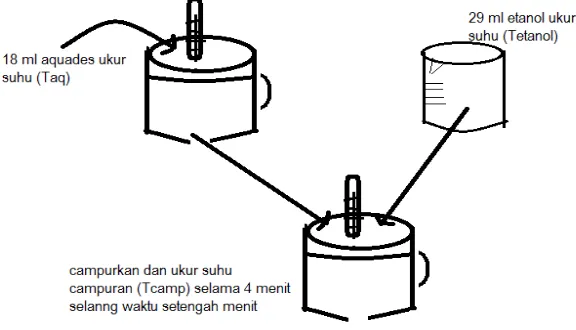
3. Metode Penentuan Kadar Etanol dalam Air
Gambar 3. Hasil Percobaan Penentuan Kadar Etanol dalam Air
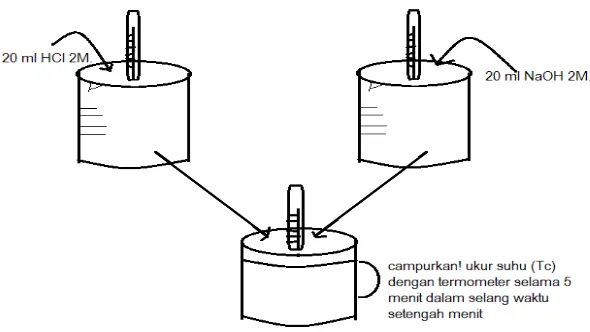
[image:3.612.130.418.420.585.2]Gambar 4. Penentuan Percobaan Kalor Penetralan HCL dan NaOH
Hasil Pengamatan
Berdasarkan hasil pengamatan yang telah dilakukan didapatkan hasil sebagai berikut :
No Percobaan Hasil
1 Penentuan tetapan kalorimetri
Td = 301 K Tp = 363 K Tc = 333 K Q1 = 5376 J Q2 = 5040 J Q3 = -336 J K = -10.5 J/K a = 333.27 b = -0.75
2 Penentuan kalor reaksi Zn(s) +CuSO4(aq)
Tc = 328 K Td = 302 K T1J = 26 K Q4 = -273 J Q5 = 2295.32 J Q6 = 2022.32 J a = 325
Tet = 301 K TM = 301 K TA = 307.81 K T2J = 6.81 K Q7 = 572.17 J Q8 = 261.56 J Q9 = -71.52 J Q10 = 762.21 J ∆H = 2222, 18 J/mol a = 311,13
b = 0,22
4 Penentuan kalor penetralan HCl +NaOH
THCl = 301 K TNaOH = 300 K TM = 300,5 K TA = 311.75 K T3J = 11.25 Q11 = 1781,37 J Q12 = -118.2 J Q13 = 1899.56 J ∆H = 2675.44 J/mol a = 311.13
b = 0,22
Pembahasan
Berdasarkan percobaan termokimia pada penentuan ketetapan kalorimeter didapatkan hasil a= 333.27, b= -0,76, y1= 332.51, y2= 307.27, y3= 330.33, y4= 330.23, y5= 329.47, y6= 328.71, y7= 327.95, y8= 327.19, y9= 326.19, y10= 306,15, Q1= 5376 , Q2= 5040 , Q3= -336 , k= -10.5. Penentuan kalor CuSO4 + Zn didapatkan hasil a= 325, b= 8.6, y1= 333.6, y2= 342.2, y3= 350.8, y4= 359.4, Q4= -273, Q5= 2295,32, Q6= 2022,32, ΔH= 67410.66. Penentuan kalor etanol dalam air didapatkan hasil a= 307.30, b= 0.23 , y1= 307.53, y2= 307.76, y3= 307.98, y4= 308.21, y5= 308.45, y6= 308.45, y7= 308.68, y8= 309.14, ΔT2j= 6.81, Q7= 572.17, Q8= 261.56 , ΔH= 2222.17. Penentuan kalor penetralan HCl dan NaOH didapatkan hasil a= 311.13, b= 0.22, y1= 311.35, y2= 331.58 , y3= 331.79 , y4= 312.01, y5= 312.23, y6= 312.45, y7= 312.67 , y8= 312.89 , y9= 313.11 , y10= 313.33, ΔT3j= 11.246 , Q11= 1781.37, Q12= 118.2, Q13= 1899.56, ΔH= 2675.436.
Kalor merupakan energi kinetik-energi kinetik dari atom-atom dan molekul-molekul. Apabila suatu zat panas, harga rata-rata dari energy kinetic molekulnya besar dan kalor prmbrtukannya banyak, begitupun sebaliknya. (Brady, 1999)
Termokimia merupakan cabang ilmu kimia yang mempelajari kalor reaksi yang terlibat dalam suatu reaksi kimia. Oleh karena kalor reaksi adalah suatu bentuk energi dan sebagian besar reaksi kimia berlangsung pada tekanan tetap, maka kalor reaksi dinyatakan sebagai perubahan entalpi (∆H). (Brady,1999)
Menurut hukum Hess, karena entalpi adalah fungsi keadaan, perubahan entalpi dari suatu reaksi kimia adalah sama, walaupun langkah-langkah yang digunakan untuk memperoleh produk berbeda. Dengan kata lain, hanya keadaan awal dan akhir yang berpengaruh terhadap perubahan entalpi, bukan langkah-langkah yang dilakukan untuk mencapainya hal ini menyebabkan perubahan entalpi, bukan langkah-langkah yang dilakukan untuk mencapainya. Hal ini menyebabkan perubahan entalpi suatu reaksi dapat dihitung sekalipun tidak diukur secara langsung. Caranya adalah dengan melakukan operasi aritmatika pada beberapa persamaan reaksi yang perubahan entalpinya diketahui. Persamaan-persamaan reaksi yang perubahan entalpinya diketahui. Persamaan-persamaan reaksi tersebut diatur sedemikian rupa sehingga penjumlahan semua persamaan akan menghasilkan reaksi yang kita inginkan. Jika suatu persamaan reaksi dikalikan (atau dibagi) dengan sutu angka, perubahan entalpinya juga harus dikali (dibagi). Jika persamaan itu dibalik maka tanda perubahan entalpi harus dibalik pula (yaitu menjadi –ΔH). (Johari, 2006)
Perubahan entalpi adalah perubahan entalpi total pada suatu sistem reaksi ( dimana rekatan dan produk reaksi dinyatakan sebagai sistem termodinamik ) yang terjadi ketika satu molekul bereaksi sempurna dengan oksigen yang terjadi pada 298K dan tekanan atmosfer 1 atm. Umumnya, nilai entalpi pembakaran dinyatakan dalam joule atau kilojoule per satu mol reaktan yang berekasi sempurna dengan oksigen. Hampir semua reaksi pembakaran akan menghasilkan nilai perubahan entalpi negatif (ΔHcomb < 0), (Anonim, 2011).
Prinsip dari percobaan termokimia adalah penentuan tetapan dengan mengamati perubahan temperatur pada selang waktu tertentu dengan menggunakan alat yang disebut dengan kalorimeter. Alat yang digunakan pada praktikum ini, menggunakan thermostat yang dapat menjaga suhu agar tetap stabil ketika pengukuran dengan menggunakan thermometer berlangsung.
netralisasi, pelarutan dan pengendapan ). Pada kalorimeter ini, kalor reaksi = jumlah kalor yang diserap / dilepaskan larutan sedangkan kalor yang diserap oleh gelas dan lingkungan diabaikan (Novita Sari, 2014).
Reaksi kimia berlangsung disertai perubahan energi berupa penyerapan atau pelepasan kalor (panas). Reaksi kimia yang melibatkan penyerapan kalor disebut reaksi endoterm, sedangkan reaksi kimia yang melibatkan pelepasan kalor disebut reaksi eksoterm (Anonim,2012).
(Gambar.1 Grafik Reaksi Endoterm dan Eksoterm)
Pada percobaan penetuan kalorimeter termasuk reaksi eksoterm. Pada percobaan penentuan CuSO4 termasuk reaksi eksoterm. Pada percobaan penentuan etanol dalam air termasuk reaksi eksoterm. Pada percobaan penentuan HCl dan NaOH termasuk reaksi endoterm.
Kesimpulan
Berdasarkan percobaan termokimia pada penentuan ketetapan kalorimeter didapatkan hasil a= 333.27, b= -0,76, y1= 332.51, y2= 307.27, y3= 330.33, y4= 330.23, y5= 329.47, y6= 328.71, y7= 327.95, y8= 327.19, y9= 326.19, y10= 306,15, Q1= 5376 , Q2= 5040 , Q3= -336 , k= -10.5. Penentuan kalor CuSO4 + Zn didapatkan hasil a= 325, b= 8.6, y1= 333.6, y2= 342.2, y3= 350.8, y4= 359.4, Q4= -273, Q5= 2295,32, Q6= 2022,32, ΔH= 67410.66. Penentuan kalor etanol dalam air didapatkan hasil a= 307.30, b= 0.23 , y1= 307.53, y2= 307.76, y3= 307.98, y4= 308.21, y5= 308.45, y6= 308.45, y7= 308.68, y8= 309.14, ΔT2j= 6.81, Q7= 572.17, Q8= 261.56 , ΔH= 2222.17. Penentuan kalor penetralan HCl dan NaOH didapatkan hasil a= 311.13, b= 0.22, y1= 311.35, y2= 331.58 , y3= 331.79 , y4= 312.01, y5= 312.23, y6= 312.45, y7= 312.67 , y8= 312.89 , y9= 313.11 , y10= 313.33, ΔT3j= 11.246 , Q11= 1781.37, Q12= 118.2, Q13= 1899.56, ΔH= 2675.436.
DAFTAR PUSTAKA
DAFTAR PUSTAKA
Anonim. 2012. Termokimia dan Entalpi.http://ramadhanakurnia.blogspot.com/. Diakses 21 Desember 2014
Brady, J.E.1999. Kimia Universitas Asas dan Struktur Jilid Satu.Binarupa Aksara:Jakarta
Johari, J.M.C., Rachmawati, M. 2006. Kimia 2. Jakarta: Penerbit Esis. Halaman: 55-60