Oleh :
Nama : Zia Ulfah
NRP : 123020117
Kelompok : E
Meja : 1 (satu)
Tanggal Percobaan : 22 November 2012 Asisten : Hilda Rani Dwitama
LABORATORIUM KIMIA DASAR JURUSAN TEKNOLOGI PANGAN
FAKULTAS TEKNIK UNIVERSITAS PASUNDAN
BANDUNG
2012
STOIKIOMETRI
Zia Ulfah 123020117
Asisten : Hilda Rani Dwitama
Tujuan Percobaan : Untuk mengamati reaksi kimia yang kuantitas molar totalnya sama, tetapi kuantitas masing-masing pereaksi berubah-ubah, dan untuk mengetahui cara untuk meramalkan atau menetukan stoikiometri sistem suatu reaksi, serta menentukan titik maksimum dan titik minimum stoikiometri dalam reaksi.
Prinsip Percobaan : Berdasarkan metode Variasi Kontinyu, dimana dalam metode ini dilakukan sederet pengamatan kuantitas molarnya sama. Tapi masing-masing kuantitas pereaksi berubah-ubah. Salah satu sifat fisika dipilih diperiksa seperti : massa, volume, suhu, dan daya serap. Oleh karena itu kuantitas pereaksi berlainan , perubahan harga sifat fisika dari sistem ini dapat digunakan untuk meramalkan stoikiometri sistem.
Metode Percobann :
I. Sistem CuSO4 1 M dan NaOH 2 M
CuSO4 1 M NaOH 2 M 1.
5 mL 25 mL
CuSO4 1 M NaOH 2M 2.
10 mL 20 mL
3.
15 mL 15 mL
4.
20 mL 10 mL
5.
25 mL 5 mL
Cantumkan hasil pengamatan dalam tabel berikut :
VCuSO4 1M VNaOH 2 M TM TA ΔT
5 mL 25 mL
10 mL 20 mL
15 mL 15 mL
20 mL 10 mL
25 mL 5 mL
TM = TCuSO4+TNaOH
2 TA = TCuSO4+TNaOH
ΔT = TA-TM
II. Sistem NaOH 0,1 M dan HCl 1 M NaOH 0,1 M HCl 1 M 1.
5 mL 25 mL
2.
10 mL 20 mL
3.
15 mL 15 mL
4.
20 mL 10 mL
5.
25 mL 5 mL
Cantumkan hasil pengamatan dalam tabel berikut :
VNaOH 0,1M VHCl 1M TM TA ΔT
5 mL 25 mL
10 mL 20 mL
15 mL 15 mL
20 mL 10 mL
25 mL 5 mL
TM = TNaOH+THCl 2 TA = TNaOH+THCl
ΔT = TA-TM
(Sumber, Zia Ulfah, Meja 01, Kelompok E, 2012)
Hasil Pengamatan :
Berdasarkan hasil percobaan yang dilakukan, didapatkan hasil sebagai berikut:
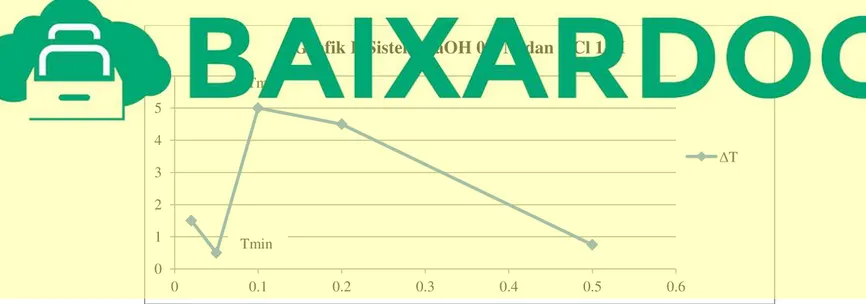
I. Sistem NaOH 0,1 M dan HCl 1 M Tabel I. Sistem NaOH 0,1 M dan HCl 1 M No V NaOH
0,1M
V HCl 1M
TM TA ΔT Mmol
NaOH
Mmol HCl
Mmol NaOH
Mmol HCl
1 5 mL 25 mL 26,5°C 28°C 1,5°C 0,5 25 0,02
2 10 mL 20 mL 26,5°C 27°C 0,5°C 1 20 0,05
3 15 mL 15 mL 26,5°C 31,5°C 5°C 1,5 15 0,1
4 20 mL 10 mL 26,5°C 31°C 4,5°C 2 10 0,2
5 25 mL 5 mL 26,25°C 27°C 0,75°C 2,5 5 0,5
(Sumber, Zia Ulfah, Meja 01, Kelompok E, 2012)
0 1 2 3 4 5 6
0 0.1 0.2 0.3 0.4 0.5 0.6
Grafik I. Sistem NaOH 0,1 M dan HCl 1 M
ΔT Tmax
Tmin
II. Sistem CuSO4 1 M dan NaOH 2 M
Tabel II. Sistem CuSO4 2 M dan NaOH 0,5 M No V CuSO4
2 M
VNaOH 0,5 M
TM TA ΔT Mmol
CuSO4
Mmol NaOH
Mmol CuSO4 Mmol NaOH
1 5 mL 25 mL 26,25°C 27°C 0,75°C 10 12,5 0,8
2 10 mL 20 mL 26,75°C 28°C 1,25°C 20 10 2
3 15 mL 15 mL 26,25°C 29°C 2,75°C 30 7,5 4
4 20 mL 10 mL 26°C 28°C 2°C 40 5 8
5 25 mL 5 mL 26,25°C 28°C 1,75°C 50 2,5 20
(Sumber, Zia Ulfah, Meja 01, Kelompok E, 2012)
Pembahasan :
Stoikiometri merupakan bidang dalam ilmu kimia yang menyangkut hubungan kuantitatif antara zat-zat yang terlibat dalam reaksi kimia, baik sebagai pereaksi maupun sebagai hasil reaksi. Stoikiometri juga menyangkut perbandingan atom antar unsur-unsur dalam suatu rumus kimia, Berdasarkan metode Variasi Kontinyu, dimana dalam metode ini dilakukan sederet pengamatan kuantitas molarnya sama. Tapi masing-masing kuantitas pereaksi berubah-ubah. Salah satu sifat fisika dipilih diperiksa seperti massa, volume, suhu, dan daya serap. Oleh karena
0 0.5 1 1.5 2 2.5 3
0 5 10 15 20 25
Grafik II. Sistem CuSO4 2 M dan NaOH 0,5 M
ΔT Tmax
Tmin
itu kuantitas pereaksi berlainan , perubahan harga sifat fisika dari sistem ini dapat digunakan untuk meramalkan stoikiometri sistem. Dalam percobaan ini seharusnya suhu maksimalnya berada pada reaksi yang volumenya 15 mL dengan 15 mL, karena reaksi akan bereaksi secara sempurna. Suhu minimumnya seharusnya terdapat pada reaksi yang volumenya 5 mL dengan 25 mL. Dalam hasil percobaan suhu tertinggi terdapat pada reaksi yang volumenya 15 mL dengan 15 mL. Tetapi suhu terendah tidak pada volume 3 mL dengan 25 mL. Aplikasi dalam bidang pangan dari stoikiometri adalah untuk mengetahui perbedaan suhu dalam suatu larutan, untuk mengidentifikasi suatu senyawa dalam peracikan pangan, untuk mengetahui dan menentukan kadar molaritas dalam bidang pangan, untuk menentukan normalitas dalam bidang pangan, untuk penentuan fraksi mol dalam peracikan pangan.
Penjelasan grafik hasil percobaan yaitu sumbu X menunjukan Mmol NaOH/Mmol HCl dan sumbu Y menunjukan ΔT. Grafik menunjukan suhu yang terjadi itu mengalami penurunan dan kenaikan. Faktor kesalahan praktikan dalam melaksanakan praktikum itu biasanya kurang teliti. Praktikan salah mereaksikan larutan yang seharusnya konsentrasinya yang ditentukan tetapi larutan yang konsentrasinya lebih besar atau lebih kecil. Misalkan praktikan meraksikan sistem NaOH 0,5 M dan HCl 1 M yang seharusnya praktikan mereaksikan sistem NaOH 0,1 M dan HCl 1 M.
Molaritas suatu larutan menyatakan jumlah mol suatu zat per liter larutan.Normalitas didefinisikan banyaknya zat dalam gram ekivalen dalam satu liter larutan. Mol adalah satuan dasar SI yang mengukur jumlah zat. Satu mol didefinisikan sebagai jumlah zat suatu sistem yang mengandung "entitas elementer" (atom, molekul, ion, elektron) sebanyak atom-atom yang berada dalam 12 gram karbon-12. Sehingga:
satu mol besi mengandung sejumlah atom yang sama banyaknya dengan satu mol emas;
satu mol benzena mengandung sejumlah molekul yang sama banyaknya dengan satu mol air;
jumlah atom dalam satu mol besi adalah sama dengan jumlah molekul dalam satu mol air.
Termometer adalah alat untuk mengukur suhu. Cara penggunaan termometer yaitu keluarkan termometer dari wadahnya. Pada saat mengukur suhu larutan, pegang tali yang ada di atas termometer, jangan memegang termometernya, karena suhu tubuh kita bisa mempengaruhi pengukuran suhu pada larutan. Kemudian celupkan ujung termometer yang berwarna merah ke dalam larutan yang akan diukur suhunya.
Ukur suhunya secara cermat hingga cairan dalam termometer yang berwarna merah berhenti (tidak naik atau tidak turun lagi). Catat suhunya, kemudian bersihkan termometer dengan tissue atau lap dan masukkan termometer ke dalam wadahnya kembali. Macam-macam termometer ada berbagai macam yaitu, Termometer raksa, Termokopel, Termometer inframerah, Termometer Galileo, Termistor, Termometer bimetal mekanik, Sensor suhu bandgap silikon, merkuri termo, dan Termometer alkohol. Parameter yang digunakan dalam percobaan ini adalah termometer. Tujuan percobaan dari stoikiometri ini adalah untuk mengamati reaksi kimia yang kuantitas molar totalnya sama, tetapi kuantitas masing-masing pereaksinya berubah-ubah, dan untuk mengetahui cara untuk meramalkan atau menetukan stoikiometri sistem suatu reaksi, serta menentukan titik maksimum dan titik minimum stoikiometri dalam reaksi. Tmax adalah suhu maksimum yang didapat pada suatu larutan, sedangkan Tmin adalah suhu minimum yang didapat dari sebuah larutan. Tmax yang didapat dari Tabel 1 adalah 5°C dan Tminnya adalah 0,5°C. pada Tabel 2, Tmax yang didapat sebesar 2,75°C dan Tmin yang didapat sebesar 0,75°C.
Kesimpulan :
Praktikan dapat membandingkan perbedaan suhu dsn molaritas dari suatu campuran larutan. Praktikan dapat mengetahui mana reaksi sistem yang paling tinggi suhunya dan paling rendah suhunya. Suhu yang paling tinggi berarti termasuk reaksi yang kombinasinya sempurna sedangkan suhu yang terendah adalah kombinasi yang kurang sempurna atau kurang baik. Intinya praktikan dapat mengetahui mana reaksi yang paling sempurna.
DAFTAR PUSTAKA
Anonim. 2012. Stoikiometri. www.wikipedia.com Acessed : 25 November 2012 Anonim. 2012.Stoikiometri. belajar-ilmupendidikan.blogspot.com Acessed : 25
November 2012
Sutrisno, E, T., Nurminabari, I, S., 2012. Penuntun Praktikum Kimia Dasar.
Universitas Pasundan : Bandung