Laboratorium Kimia Fisik, Jurusan Kimia, FMIPA, UB 1
Termokimia
Teguh Andi A.M* , Kiftiyah Yuni Fatmawardi, Vera Nurchabibah, Nadhira Izzatur Silmi, Yuliatin, Pretty Septiana, Ilham Al Bustomi
Kelompok 5, Kelas AB, Jurusan Kimia, Fakultas MIPA, Universitas Brawijaya, Jl. Veteran 65145, Indonesia
ABSTRAK
Telah dilakukan percobaan berjudul termokimia yang bertujuan untuk menentukan kalor reaksi atau reaksi atau kalor pelarutan dengan kalorimeter. Termokimia merupakan kajian tentang kalor yang dihasilkan atau dibutuhkan oleh suatu reaksi kimia. Prinsip dari percobaan adalah Asas Black, dimana Asas Black merupakan hukum yang mempelajari tentang perubahan kalor dari sistem ke lingkungan maupun sebaliknya. Kaldor yang dilepaskan sama dengan kalor yang dilepas (Q lepas = Q terima). Metode yang digunakan dalam percobaan ini adalah metode kalorimetri, yaitu metode yang digunakan untuk menentukan nilai kalor berdasarkan pengamatan perubahan suhu dalam sistem adiabatik, dengan menggunakan alat yang dinamakan kalorimeter. Dari hasil percobaan diperoleh harga air kalorimeter sebesar -1,5 kal/mol K, kalor penetralan HCl dengan NaOH 31,8 kal/mol , kalor pembentukan CuSO4 dan NH4OH sebesar 21,1 kal/mol , didapatkan Ksp PbCl2 1,099 x 10-3 , 9,766 x 10-4 , 8,64 x 10-4, 7,67 x 10-4, dan 6,899 x 10 -4
Has done the experiment titled Thermochemical which aims to determine the heat of reaction or heat of dissolution with the calorimeter. Thermochemistry is the study of heat generated or required by a chemical reaction. The principle of the experiment is the principle of the Black Rule. Where Black Rule is a lega principle learn about the changes of heat from the system to the environment and vice verca. Heat is released with the heat absorbed (Q realesed= Q absorb). The method use in this experiment is a colorimetric method. The method use to determine the calori value based on observation of adiabatic temperature change in the system using a tool called a calorimeter. From the experiment result obtained by the capacity of the calorimeter. -1,5 cal/mol K, heat counteraction of HCl with NaOH 31,8 cal/mol , heat of formation of CuSO4 and NH4OH is 21,1 cal/mol , Ksp PbCl2 1,099 x 10-3 , 9,766 x 10-4 , 8,64 x 10-4, 7,67 x 10-4, and 6,899 x 10 -4
I. PENDAHULUAN
Laboratorium Kimia Fisik, Jurusan Kimia, FMIPA, UB 2
Perubahan energi dapat terjadi dalam suatu sistem maupun lingkungan. Sistem dapat berupa gas, uap air dan uap dalam kontak dengan cairan. Secara umum sistem dibagi 3 macam yaitu [1] :
a. Sistem terbuka merupakan sistem yang memungkinkan terjadinya pertukaran energi dan materi ke lingkungan. Contohnya suatu zat dalam gelas kimia. b. Sistem tertutup merupakan sistem yang memungkinkan terjadinya pertukaran
energi tanpa pertukaran materi ke lingkungan. Contohnya sejumlah gas dalam silinder yang dilengkapi penghisap.
c. Sistem terisolasi merupakan sistem yang tidak ada pertukaran energi maupun materi ke lingkungan.
Kalor adalah perpindahan energi termal. Kalor mengalir dari satu bagian ke bagian lain atau dari satu sistem ke sistem lain, karena adanya perbedaan temperatur. Besarnya kalor reaksi bergantung pada [ 2 ] :
a. Jumlah zat yang bereaksi b. Keadaan fisika
c. Temperatur d. Tekanan
e. Jenis reaksi (Ptetap atau Vtetap)
Kalor reaksi kalor adalah kalor yang menyertai suatu reaksi dengan koefisien yang paling sederhana. Contoh [3] :
3 H2(g) + N2(g) → 2 NH3(g) ∆H = -92 KJ
Ditinjau dari jenis reaksi, terdapat beberapa jenis reaksi yaitu kalor pembentukan, kalor penguraian, kalor penetralan, kalor reaksi dan kalor pelarutan.
Menurut hukum Hess, panas yang timbul atau diserap pada suatu reaksi (panas sekali) tidak bergantung pada cara bagaimana reaksi tersebut berlangsung, hanya bergantung pada keadaan awal dan akhir [4].
Satu- satunya cara untuk mengukur besarnya kalor yang dilepaskan atau diserap dalam suatu reaksi kimia adalah melalui eksperimen. Alat yang digunakan untuk mengukur kalor reaksi dinamakan calorimeter. Penggunaaan calorimeter menunjukkan bahwa pengukuran besarnya kalor reaksi tidak dapat diukur secara langsung Kalorimeter bom dapat digunakan untuk pengukuran yang cermat. Perubahan suhu reaksi dan perkiraan kapasitas kalor dapat digunakan untuk memperkirakan kalor reaksi dengan cukup baik.Ada reaksi eksoterm dan endoterm. Reaksi eksoterm adalah reaksi yang melepaskan kalor. Sedangkan reaksi endoterm adalah reaksi yang menyerap kalor [5].
Laboratorium Kimia Fisik, Jurusan Kimia, FMIPA, UB 3
I.1. Alat dan Bahan
Alat-alat yang digunakan pada percobaan ini adalah 1 set kalorimeter, 2 buah erlenmeyer 250 mL, 1 buah termometer skala 0.1 OC, 1 buah termometer 100 OC, 1 buah gelas ukur 250 mL, 2 buah gelas kimia 250 mL, 1 buah gelas kimia 500 mL, 1 buah hot plate, 1 buah buret 50 mL, 10 buah tabung reaksi, 3 buah batang pengaduk, 2 buah penjepit tabung. Bahan-bahan yang di gunakan antara lain larutan NaOH 0.5 M, larutan HCl 0.5 M, larutan CuSO4 0.05 M, larutan NH4OH 0.05 M, Kristal
CuSO4.5H2O, larutan Pb(NO3)2 0.075 M, dan larutan KCl 1.0 M
II.2. Prosedur kerja
2.2.1 Penentuan Harga Kalorimeter
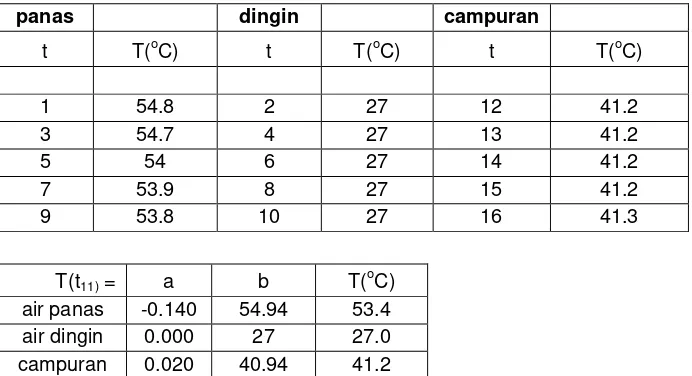
200 mL air dipanaskan hingga 55 OC. Kemudian dituangkan kedalam kalorimeter yang dilengkapi batang pengaduk dan termometer 0.1 OC. Ditutup. Temperatur diamati pada menit ke 1, 3, 5, 7, dan 9. 200 mL air pada temperatur ruang dimasukkan kedalam gelas kimia dan dicelupkan termometer 100 OC Temperatur diamati pada menut ke 2, 4, 6, 8, dan 10. Air dingin dicampurkan kedalam air kalorimeter pada menit 11. Diaduk. Temperatur diamati setiap menit selama 10 menit. Harga air kalorimeter ditentukan sesuai Azas Black.
2.2.2 Penentuan Kalor Penetralan
200 mL NaOH 0.5 M dimasukkan kedalam kalorimeter yang telah dilengkapi batang pengaduk dan temometer 0.1 OC. Ditutup. Temperatur diamati pada menit ke 1, 3, 5, 7, dan 9. HCl 0.5 mL dimasukkan ke dalam gelas kimia dan dicelupkan termometer 100 OC. Temperatur diamati pada menit ke 2, 4, 6, 8, dan 10. HCl 0.5 M dimasukkan ke dalam kalorimeter pada ke 11. Diaduk. Temperatur diamati setiap menit selama 10 menit. Kalor penetralan mol dapat ditentukan
2.2.3 Penentuan Kalor Pembentukan
200 mL NH4OH 0.05 M dimasukkan kedalam kalorimeteryang telah dilengkapi batang pengaduk dan temometer 0.1 OC. Ditutup. Temperatur diamati pada menit ke 1, 3, 5, 7, dan 9. CuSO4 0.05 M dimasukkan kedalam gelas kimia dan dicelupkan termometer 100 OC. Temperatur diamati pada menit ke 2, 4, 6, 8, dan 10. CuSO4 0.05 M dimasukkan kedalam kalorimeter pada menit ke-11. Diaduk. Temperatur diamati setiap menit selama 10 menit. Kalor pembentukan per mol dapat ditentukan.
2.2.4 Penentuan Kalor Pelarutan dan Ksp
Laboratorium Kimia Fisik, Jurusan Kimia, FMIPA, UB 4
Diambahkan KCl 1.0 M sesuai dengan tabel. Dikocok. Didiamkan selama 5 menit dan diamati endapannya.
No Volume (mL) Pb(NO3)2
0.075 M Volume (mL) KCl 1.0 M
1 10 1
2 10 2
3 10 3
4 10 4
Disiapkan campuran sesuai dengan tabel pada tabung reaksi.
No Volume (mL) Pb(NO3)2 0.075 M
Volume (mL) KCl 1.0 M
1 10 1.5
2 10 2
3 10 2.5
4 10 3
5 10 3.5
Campuran yang telah dilengkapi termometer dipanaskan dengan penangas beaker dan diaduk secara perlahan-lahan. Temperatur dicatat saat endapan tepat larut.
III. HASIL DAN PEMBAHASAN
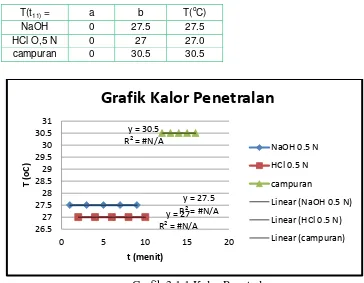
3.1 Tabel Pengamatan 3.1.1 Tabel Kalor penetralan
NaOH 0.5 N HCl O,5 N Campuran
t T(oC) t T(oC) t T(oC)
1 27.5 2 27.0 12 30.5
3 27.5 4 27.0 13 30.5
5 27.5 6 27.0 14 30.5
7 27.5 8 27.0 15 30.5
Laboratorium Kimia Fisik, Jurusan Kimia, FMIPA, UB 6
Grafik 3.1.2 Penentuan Kalor Pembentukan
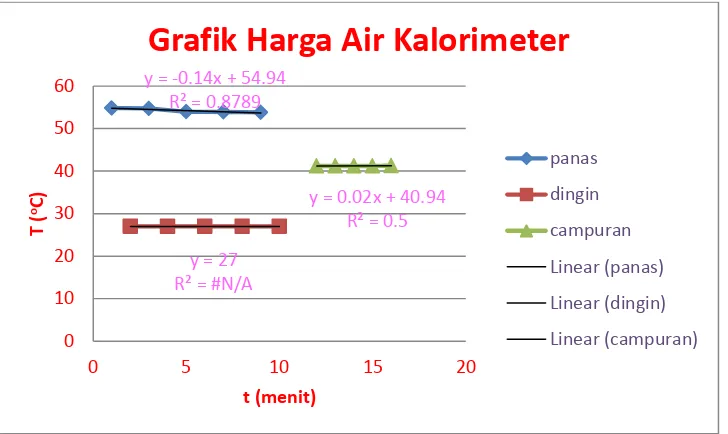
3.1.3 Tabel penentuan harga air kalorimeter
Laboratorium Kimia Fisik, Jurusan Kimia, FMIPA, UB 7
Laboratorium Kimia Fisik, Jurusan Kimia, FMIPA, UB 8
3.1.4 Grafik hubungan ln Ksp dengan 1/T
3.2 Hasil
Penentuan harga air kalorimeter dilakukan dengan cara mencampurkan dua air dengan temperature yang berbeda dan diukur temperaturnya sehingga didapatkan temperatur campuran. Rata-rata temperatur air panas sebesar 54,24oC atau 327,24 K.Rata-rata temperatur air dingin sebesar 27oC atau 300 K. Sehingga didapatkan temperatur campuran sebesar 41,22oC atau 314,22 K. Dengan Asas Black kalor jenis air (Cps) sebesar -1,5 kal/mol.K.
Penentuan kalor penetralan dilakukan dengan cara mencampurkan HCl sebagai lingkungan dengan NaOH yang bertindak sebagai sistem. Didapatkan temperatur rata-rata HCl sebesar 27oC atau 300 K. Temperatur rata-rata NaOH sebesar 27.5 oC atau 300,5 K.Sehingga didapatkan temperatur campuran rata-rata sebesar 30,5oC atau 303,5 K. Pada reaksi tersebut temperatur larutan meningkat dari temperatur awal, hal ini terjadi karena saat reaksi terjadi pelepasan kalor. Kalor yang dilepaskan oleh sistem reaksi (NaOH dan HCl) diserap oleh lingkungan pelarut dan material lain (kalorimeter). Akibatnya, temperatur lingkungan naik yang ditunjukkan oleh kenaikan temperatur larutan. Sedangkan sistem pada reaksi tersebut, temperaturnya turun dan mencapai keadaan stabil membentuk NaCl dan H2O. Berdasarkan percobaan didapatkan nilai ∆H sebesar 31,85 kal/mol. Karena ∆H bernilai positif, maka reaksi terjadi secara endoterm.
Penentuan kalor pembentukan dilakukan dengan cara mencampurkan CuSO4 dengan NH4OH. Didapatkan temperatur rata-rata CuSO4 sebesar 27oC atau 300 K. Temperatur NH4OH sebesar 27,5oC atau 300,5 K. Sehingga didapatkan temperatur campuran sebesar 27,68oC atau 300,68 K. Berdasarkan percobaan didapatkan ∆H sebesar 21,1 kal/mol. Karena ∆H bernilai positif, maka reaksi terjadi secara endoterm.
Penentuan Kalor pelarutan dilakukan dengan cara mencampurkan Pb(NO3)2 dengan KCl dan menghasilkan endapan Kristal berwarna putih. Endapan Kristal tersebu berupa PbCl2.
y = 1182.8x - 10.445
0.00275 0.00280 0.00285 0.00290 0.00295 0.00300 0.00305 0.00310 0.00315
ln Ksp
1/T
Laboratorium Kimia Fisik, Jurusan Kimia, FMIPA, UB 9
Berdasarkan percobaan diketahui, apabila semakin banyak volume KCl yang ditambahkan, maka endapan yang terbentuk semakin banyak. Sedangkan untuk penentuan Ksp, endapan dapat larut dengan cara menaikkan temperatur dan diaduk. Bedasarkan perhitungan pada penambahan 1,5 mL KCl didapatkan Ksp sebesar 1,099 x 10-3. Pada penambahan 2 mL KCl diperoleh Ksp sebesar 9,766 x 10-4. Pada penambahan 2,5 mL KCl diperoleh Ksp sebesar 8,64 x 10-4. Pada penambahan 3 mL KCl diperoleh Ksp sebesar 7,67 x 10-4. Dan pada penambahan 3,5 mL KCl didapatkan Ksp sebesar 6,899 x 10 -4. Sehingga dapat disimpulkan bahwa semakin banyak volume KCl yang ditambahkan akan menurunkan hasil kali kelarutan (Ksp) PbCl2.
IV. KESIMPULAN
Dari percobaan yang dilakukan dapat disimpulkan harga air kalorimeter sebesar -1,5 kal/mol K, kalor penetralan HCl dengan NaOH 31,8 kal/mol , kalor
pembentukan CuSO4 dan NH4OH sebesar 21,1 kal/mol , didapatkan Ksp PbCl2 1,099 x 10-3 , 9,766 x 10-4 , 8,64 x 10-4, 7,67 x 10-4, dan 6,899 x 10 -4 . Sehingga dapat
Laboratorium Kimia Fisik, Jurusan Kimia, FMIPA, UB 1 0
V. DAFTAR PUSTAKA
[1] Atkins, P.W , 2006 , Kimia Fisika . Jilid I . Edisi 6 . Penerjemah : Kartohadiprojo . Erlangga . Jakarta.
[2] Alberty, R.A dan Daniel, F . 2006 ,Kimia Fisika , Jilid I . Edisi 5 . Penerjemah : Sudja . Erlangga , Jakarta.
[3] Oxtoby, D.W, Gills, H.P dan Nachtrieb, N.H . 2007, Prinsip-prinsip Kimia Modern , Jilid II ,Edisi 6 . Penerjemah : Suminar, Erlangga, Jakarta.
[4] Robert N.Goldberg and Rebecca M.Lennen, 2002, Thermodynamic Quantities for the Ionization Reactions, Journal of Physics and Chemistry 31(2) : 231-271 [5] Nwanguma,B.C, and Chilaka, F.C, 2008, Studies on Thermodynamics and Kinetics