LAPORAN PRAKTIKUM
TERMOKIMIA
DISUSUN OLEH:
Risma karnivora 27
( kelompok 3)
Kelas : XI IPA 5
SMA Negeri Arjasa
1. Tujuan
a. Untuk mempelajari perubahan energi pada reaksi kimia.
b. Untuk mengukur perubahan kalor dengan percobaan sederhana.
2. Dasar Teori
a. Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sedangkan energi kimia didefinisikan sebagai energi yang dikandung setiap unsur atau senyawa. Energi kimia yang terkandung dalam suatu zat adalah semacam energi potensial zat tersebut. Energi potensial kimia yang terkandung dalam suatu zat disebut panas dalam atau entalpi dan dinyatakan dengan simbol H. Selisih antara entalpi reaktan dan entalpi hasil pada suatu reaksi disebut perubahan entalpi reaksi.
b. Perubahan energi dapat terjadi dalam suatu sistem maupun lingkungan. Sistem dapat berupa gas, uap air, dan uap dalam kontak dengan cairan. Secara umum sistem dibagi 3 macam, yaitu:
1. Sistem tersekat (terisolasi) : sistem yang tidak ada pertukaran energi maupun materi ke lingkungan. Contoh: termos.
2. Sistem tertutup : sistem yang memungkinkan terjadinya pertukaran energi tanpa pertukaran materi ke lingkungan. Contoh: sejumlah gas dalam silinder yang dilengkapi penghisap.
3. Sistem terbuka : sistem yang memungkinkan terjadinya pertukaran energi dan materi ke lingkungan. Contohnya: suatu zat dalam gelas kimia.
Jumlah kalor yang terlibat dalam reaksi dapat ditentukan dengan menggunakan kalorimeter. Besaran fisika yang dapat diamati adalah temperatur. Kalorimeter dibuat sedemikian rupa sehingga menyerupai termos ideal dimana tidak terjadi perpindahan kalor dari kalorimeter ke isinya (Campuran reaksi yang akan ditentukan kalor reaksinya) atau sebaliknya.
Dalam hal ini jumlah kalor yang dibebaskan/diserap oleh reaksi sama dengan jumlah kalor yang diserap/dibebaskan oleh kalorimeter ditambah dengan jumlah kalor yang diserap/dibebaskan oleh larutan didalam kalorimeter. Oleh karena itu energi tidak dapat dimusnahkan atau diciptakan.
Maka : q reaksi + q kalorimeter + q larutan = 0 atau
q reaksi = - (q kalorimeter + q larutan)
c. Ada beberapa jenis calorimeter, diantaranya calorimeter klasik calorimeter bom. Berikut cara mengukur ∆ H reaksi dengan menggunakan kedua calorimeter tersebut.
Calorimeter Klasik
Alat ini disebut juga calorimeter cangkir kopi karena
menggunakan cangkir kopi Styrofoam sebagai tempat campuran reaksinya. Mula-mula suhu pereaksi diukur, lalu pereaksi
dicampurkan ke dalam cangkir kopi. Sesudah reaksi selesai
(biasanya dalam waktu beberapa detik), suhu dari campuran reaksi ini diukur. Berdasarkan perubahan suhu sebelum dan sesudah reaksi, nilai ∆ H reaksi dapat dihitung. Reaksi-reaksi yang dapat diukur menggunakan calorimeter klasik ini adalah reaksi-reaksi yang berlangsung pada tekanan tetap, misalnya reaksi pelarutan, reaksi penetralan, dan reaksi pengendapan.
Calorimeter Bom
Calorimeter bom biasanya dipakai untuk mempelajari reaksi eksoterm yang tidak akan berjalan apabila tidak dipanaskan. Misalnya, reaksi pembakaran antara CH4 dengan O2 atau reaksi yang melibatkan gas (contoh: reaksi H2 dan O2). Alatnya terdiri dari wadah yang terbuat dari baja yang kuat tempat reaksi berlangsung. Wadah tersebut dimasukkan ke dalam bak yang tersekat dengan dilengkapi pengaduk dan termometer. Suhu awal diukur, kemudian reaksi dijalankan dengan cara menyalakan pemanas kawat kecil yang berada di dalam wadah. Panas yang dikeluarkan oleh reaksi diserap oleh wadah dan bak, sehingga menyebabkan suhu alat naik. Berdasarkan perubahan suhu dan kapasitas panas alat yang telah diukur, jumlah panas yang diberikan oleh reaksi dapat dihitung. Dibandingkan dengan
calorimeter klasik, pengukuran dengan calorimeter bom jauh lebih teliti.
1. Gelas pop mie (2 cup) + tutup 2. Pengaduk / pinset
3. Termometer 4. Tabung reaksi 5. Tissue
6. Cairan HCL dan NaOH
4. Langkah kerja :
1. Menyiapkan 2 gelas pop mie dan penutupnya yang sudah dilubangi 2 buah lubang untuk tempat pengaduk dan thermometer.
2. Menuangkan cairan HCL dan NaOH di masing-masing gelas dan kemudian tutup kedua gelas tersebut.
3. Mengukur setiap cairan dengan thermometer yang sudah dinormalkan terlebih dahulu.
4. Mengamati perubahan suhu yang terjadi pada setiap cairan.
5. Setelah mendapatkan data perubahan suhu yang terjadi pada setiap cairan, mencampurkan cairan HCL dan NaOH pada salah satu gelas. 6. Mengaduk dengan menggunakan pengaduk secara memutar sehingga
kedua cairan dapat tercampur dengan merata.
7. Mengukur suhu pada cairan yang dicampur dengan menggunakan thermometer.
8. Mengamati perubahan yang terjadi pada kedua larutan yang sudah tercampur secara merata.
9. Menarik data dari percobaan yang sudah dilakukan dengan membuat table hasil pengamatan.
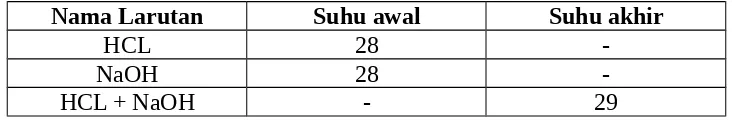
5. Data hasil pengamatan :
Nama Larutan Suhu awal Suhu akhir
HCL 28
-NaOH 28
-HCL + NaOH - 29
8. Daftar pustaka :
Achmad, Drs Hiskia.1992. Wujud Zat dan Kesetimbangan Kimia. Bandung : PT Citra Aditya Bakti.
Alberty, Robert. 1992. Kimia Fisika. Jakarta: Erlangga.