I. PENDAHULUAN
A. Judul Percobaan
Tingkat Reaksi
B. Tujuan
II. METODE
A. Alat dan Bahan
Alat
1. Gelas beker
2. Tabung reaksi besar 3. Tabung reaksi kecil 4. Fortex
5. Stopwatch
6. Rak tabung reaksi 7. Pro pipet
8. Pipet ukur
Bahan
1. Larutan Na2S2O3
2. Larutan HCl 3. Larutan aquades
B. Cara Kerja
1. Penentuan tingkat reaksi Na2S2O3
Sebanyak 3 ml larutan HCl 3 M dimasukkan kedalam gelas beker menggunakan pro pipet. Larutan Na2S2O3 0,1 M diencerkan untuk mendapatkan molaritas 0,08
M; 0,06 M; 0,04 M; 0,02 M, rumus V1.N1 = V2.N2 digunakan untuk perhitungan
pengenceran. Semua larutan hasil pengenceran difortex. Lalu larutan Na2S2O3 0.1
M dimasukkan kedalam tabung reaksi sebanyak 10 ml menggunakan pro pipet.
Tanda X dibuat di bawah gelas beker lalu larutan HCl 3 M. Kemudian stopwatch
dinyalakan bersamaan dengan penambahan larutan Na2S2O3 0.1 M kedalam gelas
reaksi digambar dan tingkat reaksi Na2S2O3 ditentukan dengan menggunakan
rumus
V1
V2 =
[Na2S2O3]y [Na2S2O3]
y
2. Penentuan tingkat reaksi HCl
Sebanyak 5 ml larutan Na2S2O3 0.1 Mdimasukkan kedalam gelas beker. Larutan
HCl 3 M diencerkan untuk mendapatkan molaritas 2,5 M; 2 M; 1,5 M; 1 M, rumus V1. N1 = V2 . N2 digunakan untuk perhitungan pengenceran. Semua larutan
hasil pengenceran difortex. Kemudian larutan HCl 3 M dimasukkan kedalam tabung reaksi sebanyak 15 ml menggunakan pro pipet. Tanda x dibuat dibawah gelas beker Na2S2O3. Stopwatch dinyalakan bersamaan dengan penambahan
larutan HCl 3 M kedalam gelas beker berisi larutan Na2S2O3. Stopwatch dimatikan
ketika terjadi kekeruhan dan tanda x tidak terlihat lagi.. Waktu dicatat. Percobaan
diulangi dengan konsentrasi larutan HCl 2.5 M, 2 M, 1.5 M, dan 1 M. Grafik
tingkat reaksi digambar dan tingkat reaksi HCl ditentukan dengan menggunakan rumus
V1
V2 =
[HC l]x [HCl]x
A. Hasil
Orde rekasi merupakan jumlah dari bilangan pangkat setiap konsentrasi reaktan yang ada dalam hukum laju. Orde reaksi dapat berupa bilangan bulat positif, nol, atau bilangan pecahan. Pada umumnya, reaksi kimia memiliki orde reaksi berupa bilangan bulat positif (Hadyana, 2002).
Laju reaksi adalah laju yang diperoleh dari perubahan konsentrasi produk dibagi dengan koefisien spesies tersebut dalam ersamaan kimia yang balans untuk reaksi tersebut atau jumlah mol reaktan per satuan volume yang bereaksi dalam satuan waktu tertentu. Laju reaksi kimia dapat dilihat dari perubahan konsentrasi molekul reaktan atau konsentrasi molekul produk terhadap waktu. Laju reaksi tidak tetap melainkan berubah terus menerus seiring dengan perubahan konsentrasi (Oxtoby dkk, 2001).
Ada beberapa faktor yang mempengaruhi kecepatan reaksi. Menurut Dewati (2010), faktor – faktor yang mempengaruhi kecepatan reaksi yaitu :
Semakin lama waktu reaksi, maka reaksi yang terjadi akan semakin
Untuk setiap kenaikan temperature akan memberikan kenaikan harga k. semakin besar harga k, maka kecepatan reaksi akan semakin besar pula.
3. Komposisi dan Konsentrasi
Konsentrasi suatu bahan sangat berpengaruh terhadap kecepatan reaksi. 4. Katalis
Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu.
5. Luas permukaan sentuh
Pada dasarnya, semakin kecil partikel pereaksi, maka semakin besar permukaan pereaksi yang bersentuhan dalam reaksi, sehingga reaksinya makin cepat.
Pada prinsipnya, hukum aksi massa menyatakan bahwa “laju reaksi kimia sebanding dengan massa aktif senyawa – senyawa yang bereaksi”, tetapi untuk larutan encer, massa aktif dapat digantikan dengan konsentrasi, yang jauh lebih mudah untuk di ukur.
dituliskan sebagai laju pembentukan produk, maka laju reaksi akan bernilai positif. Jika konsentrasi produk setelah reaksi berlangsung t detik adalah x mol dm-3, maka laju reaksinya + dx/dt. Pengukuran kinetika reaksi pertama kali
dilakukan oleh Wichelny menyimpulkan bahwa laju reaksi pada setiap waktu sebanding dengan konsentrasi (C) yang tersisa pada setiap waktu, secara matematik dapat dituliskan – dC/dt = k.C, dan dC/dt = sering kali disebut sebagai differential rate expression dan k = konstanta laju reaksi.
Orde dan molekularitas merupakan dua pengertian yang berbeda. Bentuk persamaan laju reaksi yang lebih umum adalah : Laju = k[A]x[B]y[C]z... dan seterusnya dan orde reaksi keseluruhan merupakan jumlah semua pangkat yang terdapat dalam persamaan laju reaksi, orde reaksi total : x + y + z + .... dan seterusnya. Hukum laju reaksi : laju reaksi dinyatakan sebagai perubahan konsentrasi zat pereaksi atau produk reaksi setiap satuan waktu (2,3,5,6,7).
Laju reaksi = Perubahan konsentrasiPerubahan waktu atau Laju = ± ∆ X∆ t
Tanda negatif digunakan jika X adalah pereaksi dan tanda positif digunakan jika X adalah produk reaksi. Laju keseluruhan dari suatu reaksi kimia pada umumnya bertambah jika konsentrasi salah satu pereaksi dinaikkan. Hubungan laju reaksi dan konsentrasi dapat diperoleh dari data eksperimen. Untuk reaksi, A + B → produk dapat diperoleh bahwa laju reaksi dapat berbanding lurus dengan [A]x dan
[B]y. Atau ditulis dengan: Laju = k [A]x [B]y
Disebut hukum laju reaksi atau persamaan laju reaksi, dengan k adalah tetapan laju reaksi, x dan y merupakan bilangan bulat yang menyatakan orde ke x terhadap A dan orde ke y terhadap B, sedangkan (x + y) adalah orde reaksi keseluruhan. Hukum laju diperoleh secara eksperimen dan tidak bergantung pada persamaan stoikiometri(2,3,5). Orde reaksi adalah jumlah pangkat konsentrasi
tersebut. Jika [A] adalah konsentrasi dan [A]0 adalah konsentrasi pada saat t = 0,
maka
−d[A]
dt =k dan hasil integral [A]0 – [A] = k.t
Menurut Chang (2005), hukum laju memungkinkan untuk menghitung laju reaksi dari konstanta laju dan konsentrasi reaktan. Hukum laju dapat juga dikonversi menjadi persamaan yang memungkinkan kita untuk menentukan konsentrasi reaktan di setiap waktu selama reaksi berlangsung.
1. Reaksi Orde-Pertama
Reaksi orde pertama ialah reaksi yang lajunya bergantung pada konsentrasi reaktan dipangkatkan dengan satu. Dalam reaksi orde pertama dari jenis lajunya ialah
A → produk
laju = - ∆[∆tA]
Dari hukum laju, kita juga mengetahui bahwa Laju = k [A] Jadi
- ∆∆t[A] = k[A]
Hasil integral untuk memperoleh hubungan antara konsentrasi pereaksi terhadap waktu :
ln [A]0
[A] = k.t
Telah diketahui bahwa setiap reaksi dapat dinyatakan dengan persamaan umum:
reaktan → produk
A → B
Untuk reaksi diatas kita dapat menyatakan laju sebagai:
Laju = - ∆∆t[A] atau laju = ∆[∆ tB]
dengan ∆[A] dan ∆[B] adalah perubahan konsentrasi (dalam molaritas) selama waktu ∆ t. Karena konsentrasi A menurun selama selang waktu tersebut, ∆[A] merupakan kuantitas negative. Laju reaksi adalah kuantias positif, sehingga tanda minus diperlukan dalam rumus laju agar lajunya positif. Sebaliknya, laju
pembetukan produk tidak memerlukan tanda minus sebab ∆[B] adalah kuantitas
positif (konsentrasi B meningkat seiring waktu).
Ciri reaksi orde pertama yaitu menurunya konsentrasi reaktan seiring dengan waktu, dan plot dari hubungan garis lurus untuk memperoleh konstanta laju. Kemiringan garis sama dengan –k.
2. Waktu Paruh
Waktu paruh ialah waktu yang diperlukan agar konsentrasi reaktan turun menjadi setengah dari konsentrasi awalnya. Waktu orde pertama tidak bergantung pada konsentrasi awal reaktan.
3. Reaksi Orde Kedua
Reaksi orde kedua adalah reaksi yang lajunya bergantung pada konsentrasi salah satu reaktan dipangkatkan dua atau pada konsentrasi dua reaktan berbeda yang masing – masingnya dipangkatkan satu. Jenis yang paling sederhana
1 [A]−
1
[A]0=k . t
Satu jenis reaksi orde kedua yang lain ialah A + B → produk dan hukum lajunya ialah
laju = k[A][B]
Reaksi ini adalah reaksi orde pertama dalam A dan orde pertama dalam B, sehingga orde reaksi keseluruhanya adalah 2. Reaksi orde pertama dan kedua merupakan jenis reaksi yang paling lazim. Reaksi dengan orde ke-nol jarang terjadi. Untuk reaksi orde ke-nol hukum lajunya ialah
laju = k[A]0
= k 4. Reaksi Orde Ketiga
Suatu reaksi dapat dinyatakan dengan :
−d[A]
dt = k [A]3
Hasil integral untuk memperoleh hubungan antara konsentrasi pereaksi terhadap waktu :
Reaksi yang berlangsung dalam percobaan adalah sebagai berikut: 2 HCl(aq) + Na2S2O3(aq) → 2 NaCl(aq) + H2O(l) + SO2(g) + S(s)
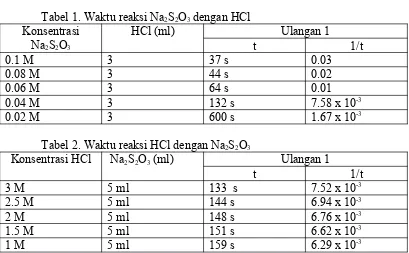
lama. Hal ini sesuai dengan teori pengaruh konsentrasi terhadap laju reaksi, yaitu semakin tinggi konsentrasi maka, waktu reaksi semakin cepat sedangkan semakin kecil konsentrasi maka, waktu reaksi semakin lambat.
Berdasarkan perhitungan rumus, orde reaksi Na2S2O3 didapatkan nilai y
sebesar 1, dan pada orde reaksi HCl nilai x sebesar 0. Jadi jumlah bilangan pangkat setiap konsentrasi reaktan HCl dan Na2S2O3 adalah 1 dan 0. Sehingga
persamaan reaksinya:
V = k [Na2S2O3]1
yang berarti laju reaksi berbanding lurus dengan konsentrasi Na2S2O3 dan
konsentrasi HCl tidak mempengaruhi laju reaksi.
Pada grafik orde reaksi HCl adalah 0 dengan laju yang relative konstan meskipun pada konsentrasi 2.5 M dan 3 M laju reaksi nya berlangsung lebih cepat. Pada grafik orde reaksi Na2S2O3 laju reaksinya 1 dengan laju yang
meningkat sebanding dengan meningkatnya konsentrasi larutan. Perbandingan hasil orde reaksi HCl dengan Na2S2O3 pada perhitungan dengan rumus dan grafik
IV.KESIMPULAN
Berdasarkan percobaan yang telah dilakukan, dapat disimpulkan bahwa: Tingkat reaksi HCl dan Na2S2O3 berdasarkan perhitungan rumus
didapatkan nilai orde reaksi Na2S2O3 sebesar 1 dan nilai orde reaksi HCl sebesar 0,
sedangkan berdasarkan grafik tingkat reaksi Na2S2O3 adalah 1 yang ditandai
DAFTAR PUSTAKA
Chang, R. 2003. Kimia Dasar. Erlangga, Jakarta.
Dewati, R. 2010. Kinetika Reaksi Pembuatan Asam Oksalat Dari Sabut Siwalan Dengan Oksidator H2O2. Jurnal Penelitian Ilmu Teknik Vol 10 (1) :
29-37.
Hadyana, P.A. 2002. Kamus Kimia. Balai Pustaka, Jakarta.
Oxtoby, D.W., Gillis, H.P., dan Nachtrieb, N.H. 2001. Prinsip – Prinsip Kimia
Modern. Erlangga, Jakarta.
LAMPIRAN
1. Pengeceran
a. Perhitungan pengenceran Na2S2O3
V1. N1 = V2 . N2
V1 = volume HCl yang diperlukan
N1 = normalitas HCl awal
V2 = volume total larutan