TUJUAN
Menghitung kapasitas panas kalorimeter serta penentuan panas pelarutan NaOH dan penentuan panas reaksi netralisasi antara HCl dan NaOH
TEORI PERCOBAAN Reaksi
Reaksi kimia dibedakan menjadi reaksi eksoterm dan endoterm. Reaksi kimia yang melepaskan atau mengeluarkan kalor disebut reaksi eksoterm, sedangkan reaksi kimia yang menyerap kalor disebut reaksi endoterm. Perubahan entalpi (ΔH) positif menunjukkan bahwa dalam perubahan terdapat penyerapan kalor atau pelepasan kalor.
Pada reaksi endoterm, sistem menyerap energi. Oleh karena itu, entalpi sistem akan bertambah. Artinya entalpi produk (Hp) lebih besar daripada entalpi pereaksi (Hr). Akibatnya, perubahan entalpi, merupakan selisih antara entalpi produk dengan entalpi pereaksi (Hp -Hr) bertanda positif. Sehingga perubahan entalpi untuk reaksi endoterm dapat dinyatakan:
ΔH = Hp- Hr > 0
Sebaliknya, pada reaksi eksoterm , sistem membebaskan energi, sehingga entalpi sistem akan berkurang, artinya entalpi produk lebih kecil daripada entalpi pereaksi. Oleh karena itu , perubahan entalpinya bertanda negatif. Sehingga p dapat dinyatakan sebagai berikut:
ΔH = Hp- Hr < 0
Untuk Reaksi Eksoterm
Pada reaksi eksoterm terjadi perpindahan kalor dari sistem ke lingkungan atau pada
reaksi tersebut dikeluarkan panas. Pada reaksi eksoterm harga ΔH = negatif ( – )
Contoh :
C(s) + O2(g) → CO2(g) + 393.5 kJ ;
ΔH = -393.5 kJ
Untuk Reaksi Endoterm
Pada reaksi terjadi perpindahan kalor dari lingkungan ke sistem atau pada reaksi
tersebut dibutuhkan panas. Pada reaksi endoterm harga ΔH = positif ( + )
Contoh :
▸ Baca selengkapnya: reaksi yang terjadi di anode pada aki adalah
(2)Kalorimetri
Pengukuran perubahan energi dalam reaksi kimia
Perubahan energi dalam reaksi kimia selalu dapat dibuat sebagai panas, sebab itu lebih tepat bila istilahnya disebut panas reaksi. Alat yang dipakai untuk mengukur panas reaksi disebut kalorimeter (sebetulnya kalori meter, walaupun diketahui sekarang panas lebih sering dinyatakan dalam joule daripada kalori). Ada beberapa macam bentuk dari alat ini, salah satu dinamakan Kalorimeter Bomb yang diperlihatkan pada gambar diatas. Kalorimeter semacam ini biasanya dipakai untuk mempelajari reaksi eksotermik, yang tak akan berjalan bila tidak dipanaskan, misalnya reaksi pembakaran dari CH4 dengan O2 atau reaksi antara H2
dan O2. Alatnya terdiri dari wadah yang terbuat dari baja yang kuat (bombnya) dimana
pereaksi ditempatkan. Bomb tersebut dimasukkan pada bak yang berisolasi dan diberi pengaduk serta termometer. Suhu mula-mula dari bak diukur kemudian reaksi dijalankan dengan cara menyalakan pemanas kawat kecil yang berada di dalam bomb. Panas yang dikeluarkan oleh reaksi diabsorpsi oleh bomb dan bak menyebabkan temperatur alat naik. Dari perubahan suhu dan kapasitas panas alat yang telah diukur maka jumlah panas yang diberikan oleh reaksi dapat dihitung.
Kapasitas Panas dan Panas Spesifik
Sifat-sifat air yang memberikan definisi asal dari kalori adalah banyaknya perubahan temperatur yang dialami air waktu mengambil atau melepaskan sejumlah panas. Istilah umum untuk sifat ini disebut kapasitas panas yang didefinisikan sebagai jumlah panas yang diperlukan untuk mengubah temperatur suatu benda sebesar 10C.
Sifat intensif berhubungan dengan kapasitas panas adalah kalor jenis (panas spesifik) yang didefinisikan sebagai jumlah panas yang diperlukan untuk menaikkan suhu 1 g zat sebesar 10C. Untuk air, panas spesifiknya adalah 4,18 Jg-1C-1. Kebanyakan zat mempunyai panas spesifik yang lebih kecil dari air. Misalnya besi, panas spesifiknya hanya 0,452 J g-1 0C
-1
. Berarti lebih sedikit panas diperlukan untuk memanaskan besi 1 g sebesar 10C daripada air atau juga dapat diartikan bahwa jumlah panas yang akan menaikkan suhu 1 g besi lebih besar dari pada menaikkan suhu 1 g air.
Besarnya panas spesifik untuk air disebabkan karena adanya sedikit pengaruh dari laut terhadap cuaca. Pada musim dingin air laut lebih lambat menjadi dingin dari daratan sehingga udara yang bergerak dari laut ke darat lebih panas daripada udara dari darat ke laut. Demikian juga dalam musim panas, air laut lebih lambat menjadi panas daripada daratan.
Rumus :
q = m.c. Δ’t
Keterangan :
q = jumlah kalor (Joule)
c = kalor jenis
Asas Black adalah suatu prinsip dalam termodinamika yang dikemukakan oleh Joseph Black. Asas ini menjabarkan:
Jika dua buah benda yang berbeda yang suhunya dicampurkan, benda yang panas memberi kalor pada benda yang dingin sehingga suhu akhirnya sama
Jumlah kalor yang diserap benda dingin sama dengan jumlah kalor yang dilepas benda panas
Benda yang didinginkan melepas kalor yang sama besar dengan kalor yang diserap bila dipanaskan
Rumus Asas Black =
(M1 X C1) (T1-Ta) = (M2 X C2) (Ta-T2)
Catatan :
M1 = Massa benda yang mempunyai tingkat temperatur lebih tinggi
C1 = Kalor jenis benda yang mempunyai tingkat temperatur lebih tinggi
Ta = Temperatur benda yang mempunyai tingkat temperatur lebih tinggi
T1 = Temperatur akhir pencampuran kedua benda
M2 = Massa benda yang mempunyai tingkat temperatur lebih rendah
C2 = Kalor jenis benda yang mempunyai tingkat temperatur lebih rendah
SKEMA PERCOBAAN
A. Penentuan Kapasitas Panas Kalorimetri
B. Penentuan Panas Pelarutan
Memasukkan 50 ml aquades ke dalam kalorimetri, diaduk dan dibiarkan 5 menit, sampai suhunya merata dan mencatat suhunya.
Ditempat lain, memanaskan 100 ml aquades dalam labu bundar dengan kompor sampai suhu 600C
Memasukkan 100 ml aquades panas itu kedalam kalorimetri yang berisi 50 ml aquades tadi.
Mengamati dan mencatat suhunya, setiap 10 detik selama ± 5 menit atau sampai suhunya konstan
Memasukkan aquades 100ml dalam kalorimetri & catat suhu
Menimbang 1 gr Kristal dan
Melarutkan kristral NaOH kedalam kalorimetri 1, yang berisi aquades dan mengaduknya
Mencatat suhu setiap 10 detik selama menit ke 5
C. Penentuan Panas Reaksi Netralisasi
Alat dan Bahan :
- Beaker glass 600, 125, 100 ml - Batang pengaduk
- Pipet Volume 25 ml - botol timbang
- Gelas ukur 100, 10 ml - Termos pengganti kalorimeter
- Klem & statif - kompor
- Labu ukur 100 ml - larutan HCl 35%
- Spatula -Thermometer
- Kristal NaOH - Corong gelas
- Sikat & sendok -Pipet tetes
DATA HASIL PERCOBAAN
A.PENENTUAN KAPASITAS PANAS KALORIMETER
Suhu aquades 50 ml = 30oC
Tabel 1. Hasil Percobaan Penentuan Panas Kalorimeter
No. Waktu (detik) Suhu (oC) No. Waktu (detik) Suhu (oC)
1 10 41.5 7. 70 42.1
2 20 41.8 8. 80 42.8
3 30 42 9. 90 43
4. 40 42 10. 100 43
5. 50 42 11. 110 43
6. 60 42 12. 120 43
Tuang 50 ml larutan NaOH 12N dan mencata suhu NaOH
Memasukkan larutan HCl 1 N kedalam kalorimeter dan mencatat suhunya.
Mencatat suhu campuran setiap 10 detik selama menit ke 2, sambil mengaduknya
B.PENENTUAN KAPASITAS PANAS PELARUTAN Tabel 2.Hasil Percobaan Penentuan Panas Pelarutan NaOH
No. Massa NaOH (gram) Suhu Awal, To (oC) Waktu (detik) Suhu (oC)
C.PENENTUAN PANAS REAKSI NETRALISASI
Tabel 3. Hasil Percobaan Penentuan Panas Reaksi Netralisasi
3 0,3 0,3 30 30
10 33
20 – 30 34
40 – 60 36
70 – 120 38
120 – 150 37
4 0,1
0,1 30 30
10 33
20 – 40 34
50 – 90 35
100 – 150 37
HASIL PERHITUNGAN, PEMBAHASAN dan DISKUSI
A.KAPASITAS PANAS KALORIMETER
Pada percobaan panas reaksi ini kita dapat menghitung panas kalorimeter menggunakan neraca panas dengan mencampurkan aquades biasa dengan aquades panas. Mula – mula ukurlah suhu aquades biasa dalam kalorimeter dan diamkan ±5 menit agar suhu kalorimeter merata setelah itu campurkan aquades panas (dengan suhu 60oC) . Suhu aquades campuran diukur sampai suhunya tidak banyak berubah. Suhu diukur setiap 10 detik selama ±5 menit. Dari perhitungan neraca panas diperoleh nilai panas kalorimeter (H) sebesar 570,14 J.
B.PANAS PELARUTAN
Table 4. Hasil Perhitungan Panas Pelarutan
No Massa NaOH (gr) Panas Pelarutan (KJ)
1 1.0193 13,665
2 2.0125 13,245
3 3.0218 12,578
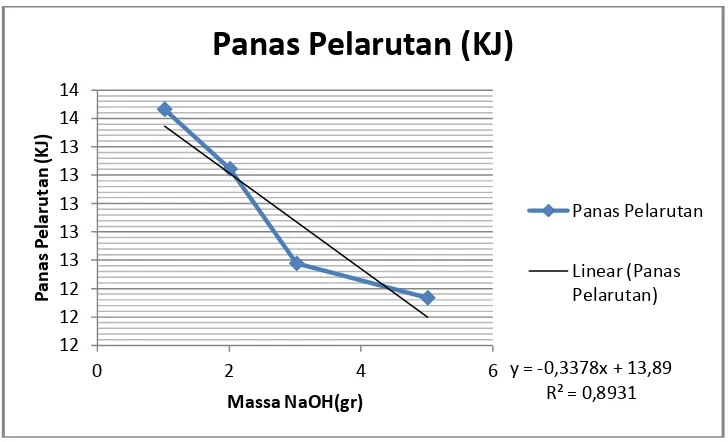
Gambar 1. Grafik panas pelarutan (KJ/gmol) vs massa NaOH (gr)
Dari grafik dan tabel diatas dapat dijelaskan bahwa semakin besarnya massa NaOH maka semakin kecil panas pelarutannya dan begitu juga sebaliknya. Sehingga massa NaOH berbanding terbalik dengan panas pelarutannya.
Panas pelarutan yang terdapat pada tabel diatas bernilai positif (+). Hal ini menunjukkan bahwa reaksi yang terjadi adalah reaksi endotermik, yaitu terjadi perpindahan panas dari lingkungan ke sistem atau pada reaksi tersebut terjadi penyerapan panas sehingga nilai panas pelarutannya positif (+).
Dari grafik panas pelarutan diatas menunjukkan hubungan antara massa NaOH dengan panas pelarutannya sehingga didapatkan persamaan y = -0.337x + 13.89
Panas pelarutan dihitung pada tiap – tiap massa NaOH. Panas pelarutan tersebut dapat dihitung menggunakan azaz black,
C.PANAS REAKSI NETRALISASI
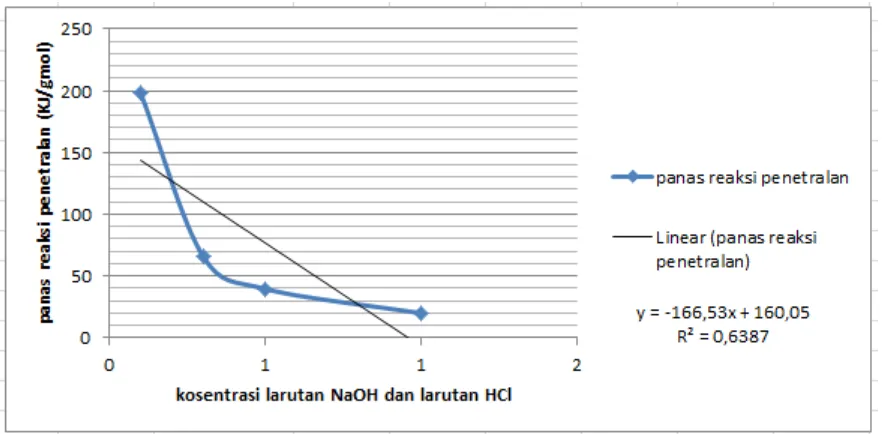
Table 5. hasil Perhitungan Panas reaksi Penetralan
Grafik 2. Grafik panas reaksi penetralan (KJ/gmol) vs kosentrasi lart. NaOH dan lart. HCl Dari grafik dan tabel diatas dapat dijelaskan bahwa semakin kecil konsentrasi NaOH dan HCl maka semakin besar panas reaksi netralisasinya dan begitu juga sebaliknya. Sehingga konsentrasi NaOH dan HCl berbanding terbalik dengan panas reaksi netralisasinya.
Panas reaksi netralisasi yang terdapat pada tabel diatas bernilai positif (+). Hal ini menunjukkan bahwa reaksi yang terjadi adalah reaksi endotermik, yaitu terjadi perpindahan panas dari lingkungan ke sistem atau pada reaksi tersebut terjadi penyerapan panas sehingga nilai panas reaksi netralisasinya positif (+).
Dari grafik panas reaksi netralisasi diatas menunjukkan hubungan antara konsentrasi NaOH dan HCl dengan panas reaksi netralisasinya sehingga didapatkan persamaan y = -166,53x + 160,05
Panas reaksi netralisasi dihitung pada tiap – tiap konsentrasi NaOH dan HCl. Panas reaksi netralisasi tersebut dapat dihitung menggunakan azaz black,
KESIMPULAN
Dari percobaan panas reaksi ini dapat disimpulkan bahwa :
Kapasitas panas kalorimeter dihitung menggunakan neraca panas, sehingga nilai panas kalorimeternya adalah 570,14 J
Semakin besar massa NaOH maka semakin kecil panas pelarutannya dan begitu juga sebaliknya. Sehingga massa NaOH berbanding terbalik dengan panas pelarutannya. Dan reaksi yang terjadi adalah reaksi endotermik sehingga nilai panas pelarutannya positif (+)
DAFTAR PUSTAKA
Modul praktikum kimia fisika
Himmelblau,David M.”Basic Principles Calculations in Chemical 6th
editions”:Austin,Texas
Smith,J.M.Introduction of Chemical Engineering Termodynamics”.Mac Graw
Hill:Singapore.
Judjono Suwarno, dkk.2004.”LECTURE NOTEKIMIA FISIKA I ”.Jurusan Teknik
Kimia.Fakultas Teknologi Industri.Institut Teknologi Sepuluh November : Surabaya.
Geankoplis,Christie J.”Transport Processes and Unit Operations”.
APPENDIKS
MEMBUAT LARUTAN HCl 1 N SEBANYAK 100 ml
PENGENCERAN HCl 1 N VOLUME HCl = 100 ml
HCl 0,5 N N1V1 = N2V2
1 × V1 = 0,5 × 100
V1 = 50 ml
PENGENCERAN NaOH 1 N VOLUME NaOH = 100 ml NaOH 0,5 N
N1V1 = N2V2
1 × V1 = 0,5 × 100
V1 = 50 ml
MENGHITUNG KAPASITAS PANAS KALORIMETER
Volume aquades biasa (V1) = 50 ml
(aquades biasa + calorimeter) = (aquades panas) ((m1 × Cp)+ H) (T1– Tx) + H= m2 × Cp × (T2– Tx)
(49,75 gram × 4,184 J/goC) (49 - 30) + H = 98,32 gram × 4,184 J/goC × (60 – 49) 3954,93 + H = 4525,07
Azas black :
MENGHITUNG PANAS REAKSI NETRALISASI
NaOH + HCl NaCl + H2O
H NaOH pada suhu 35oC (308,15 K)
=
=
=
= 22,5 J/gmol x 0,0667 gmol = 1,5 J H HCl pada suhu 30oC (303,15 K)
=
=
=
= 17,5549 J/gmol x 0,14286 mol = 2,507 J
Azas black :
(m × )NaOH + (m × )HCl + (m × )H2O +
Hkalorimeter(303,15 – 298,15) + ∆Hreaksi = m × )NaOH + (m ×
)HCl + (m × )H2O
(2,6667 x 1,5) + (5,21429 x 2,507) + ((570,14 x 5)) + ∆Hreaksi netralisasi = (2,6667 x 1,534)
+ (5,21429 x 2,58) + ((570,14 x 5)