LAPORAN PRAKTIKUM KIMIA FISIK
LAJU REAKSI
Dosen Pembimbing: Drs. Budi Santoso APT, MT
Kelompok/ Kelas : V/ 1B
Nama :
1. Muhammad Januar Ramadhan NIM. 151411049
2. Muhamad Adam Abraham NIM. 151411050
3. Muhamad Faizal NIM. 151411051
4. Muhammad Ikhsan NIM. 151411052
Tanggal Praktikum : 26 Oktober 2015
Tanggal Pengumpulan Laporan : 2 November 2015
PROGRAM STUDI DIPLOMA III TEKNIK KIMIA
JURUSAN TEKNIK KIMIA
▸ Baca selengkapnya: laporan praktikum laju reaksi menggunakan cangkang telur dan balon
(2)BAB I
PENDAHULUAN
1. 1. Tujuan Percobaan
Setelah melakukan percobaan ini, mahasiswa diharapkan mampu:
Memahami proses reaksi yang terjadi ( antara H202 dengan HI )
Melakukan titrasi dengan baik dan benar
Menentukan konstanta kecepatan reaksi
1. 2. Teori Dasar
Pada suhu kamar cairan hidrogen mengalami reaksi autoprotolitik. Reaksi:
2H2O2 ↔H3O2+ +HO2
-Dari harga tersebut di atas dapat dapat ditunjukkan bahwa H2O2 merupakan
pelarut yang protonik, disamping sebagai oksidator kuat baik dalam suasana asam maupun dalam suasana basa. Hidrogen peroksida dalam suhu kamar juga akan terurai menjadi :
2H2O2↔ 2H2O + O2 ∆H=-23,6 kkal
Dengan adanya katalisator (misalnya Cl2,Br2, Fe)maka penguraian akan
semakin cepat, demikian pula jika suhunya dinaikkan.
Hidrogen peroksida mebebaskan iodium yang berasal dari kalium iodida yang telah diasamkan dengan asam sulfat.Kecepatan reaksi tersebut sangat bergantung pada konsentrasi peroksida, kalium iodida dan asam sulfatnya. Jika reaksi ini merupakan reaksi irreversible (karena adanya natrium tiosulfat yang akan mengubah yodium bebsa menjadi asam yodida kembali), maka kecepatan reaksi yang terjadi besarnya seperti pada reaksi pembentukkannya, sampai konsentrasi terakhir tidak beubah. Reaksi yang terjadi dapat dilihat di bawah ini :
H2O3 + 2KI + H2SO4 → K2SO4 + I2 +2 H2O
2-Pada percobaan ini, kecepatan reaksi hanya tergantung pada berkurangnya konsentrasi hidrogen iodida saja, sehingga reaksi mengikuti reaksi orde / tingkat 1.
Pada larutan yang mempunyai keasaman yang tinggi atau konsentrasi iodida yang tinggi, akan diperoleh kecepatan reaksi yang lebih besar. Kepekatan indikator kanji terhadap iod sangat diperlukan, dimana kanji dengan iod akan bereaksi membentuk senyawa komplek yang berwarna biru, karena adanya adsorpsi iod oleh koloid kanji. Besarnya adsorpsi larutan kanji terhadap iod dipengaruhi oleh konsentrasi iodida yang tersedia.Dengan demikian timbulnya warna biru bukan hanya ditentukan oleh konsentrasi iod saja melainkan juga karena adanya iodida.
Oleh Kolthof dijelaskan, bahwa semakin tinggi konsentrasi iodidanya, kepekaannya akan naik perlahan, tetapi jika semakin rendah konsentrasi iodidanya maka kepekaannya akan menurun dengan cepat. Untuk menentukan kecepatan reaksi, perlu ditentukan terlebih dahulu kostanta kecepatan reaksi yang dapat ditentukan dengan :
-dC / dt = k Cn
-dC / C = k dt
ln C = -kt
ln (Ct/C0) = - kt
k = - 1t ln (Ct/C0) atau k = 1t ln (C0/Ct)
dimana, C0 = konsentrasi awal (mula-mula)
Ct = konsentrasi setelah t detik
k = konstanta kecepatan reaksi
In
t
Kurva In(a-b) terhadap t
t In (a - b)
Kurva In(a-b) terhadap t
k = 1t ln a
(a−b)
kt = ln a
(a−b) (1)
Dengan membuat kurva t lawan ln a
(a−b), akan diperoleh harga k yang
merupakan koefisien arah (gradien) dari garis lurus. Atau persamaan (1) diubah menjadi :
kt = ln a – ln (a-b)
ln (a-b)= -kt + ln a (2)
BAB II
METODOLOGI PERCOBAAN
2.1 Alat dan Bahan
No ALAT JUMLAH BAHAN JUMLAH
1. Buret 50 mL 1 Larutan H202 3
% 15ml
2. Erlenmeyer 250 mL 2 Larutan H2SO4
2N 40ml
3. Erlemneyer 1000 mL 1 Larutan KMnO4
0,1 N 4,1ml
4. Gelas kimia 250 mL 1 Kristal Kaliun
Iodidia ( KI ) 3,5 gram
5. Gelas kimia 100 mL 3 Larutan
Na2S2O3 0,1 N 10 ml
6. Labu takar 100 mL 2 Larutan kanji 10
% 3ml
7. Gelas ukur 100 mL 1 Larutan H2SO4
pekat 1ml
8. Hotplate/ Pemanas Air suling 500ml
9. Pengaduk magnet dan
Stopwatch 1
10. Botol semprot 1
A. Penentuan ekivalen H2O2 dengan tiosulfat
A.
B.
B. Penentuan Kecepatan Reaksi
Catatan :
M
engisi buret dengan larutan standar Na2S2O3 0,1 N
M
em
buat Larutan A
Lautan H2O2 diencerkan dengan air suling sam
apai tanda batas
M
em
buat larutan B
M
enam
bahkanLarutan
M
emasukkan larutan A dengan cepat ke dalam larutan B kemudian stopwatch dijalankan
M
engaduk cam
puran larutan A dan larutan B dengan pengaduk m
agnet M
enam
bahkan 2 m
L larutan tiosulfat dari buret kem
udian m
engaduknya M
encatat waktu pada saat larutan berubah m
Selama reaksi berlangsung,pengadukan harus terus berlangsung dan stopwatch jangan dimatikan dari awal hingga akhir percobaan. Jadi hanya dicatat waktunya saja pada saat larutan berubah warna menjadi biru.
2.4. Keselamatan Bekerja
1. Sebelum bekerja lihatlah MSDS bahan yang akan digunakan
2. Gunakan jas lab dan alat perlindung lain yang diperlukan
BAB III
3.2. Perhitungan
1. Data pengamatan
Titrasi 10 mL H2O2 dengan KMnO4 0,1 N = 4,1 mL (rata-rata/x)
Titrasi 10 mL KMnO4 dengan Na2S2O3 = 10 mL (rata-rata/y)
2.Perhitungan
A. Penentuan ekivalen H2O2 dengan tiosulfat
10 mL H2O2 0,3% → x mL KMnO4
10 mL KMnO4 → y mL tiosulfat
1 mL KMnO4 → y/10 mL tiosulfat
x mL KMnO4 → xy/10 mL tiosulfat
10 mL H2O2 0,3% → xy/10 mL tiosulfat
10 mL H2O2 3% → xy mL tiosulfat
Sehingga:
10 mL H2O2 0,3% → 4,1 mL KMnO4
10 mL KMnO4 → 10 mL tiosulfat
1 mL KMnO4 → 1 mL tiosulfat
4,1 mL KMnO4 → 4,1 mL tiosulfat
10 mL H2O2 0,3% → 4,1 mL tiosulfat
10 L H2O2 3% → 41 mL tiosulfat
B. Penentuan kecepatan reaksi
a = volume tiosulfat yang ditambahkan saat t0 (mula-mula)
No Na2S2O3 (b) , mL t (detik)
1. 2 250
2. 4 265
3. 6 285
4. 8 331
5. 10 437
6. 12 531
7. 14 883
= 105 xy
= 105 (4,1)(10)
= 20,5 b = 2 mL Sehingga;
t pertama = xy2 −2
t kedua = xy2 −4
t ketiga = xy2 −6 , dst
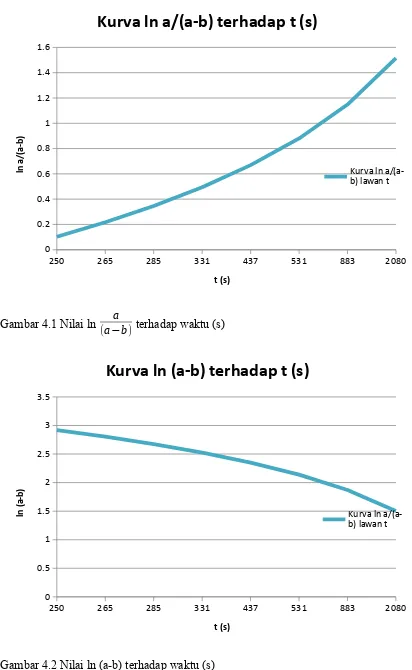
Berdasarkan grafik ln a
(a−b) terhadap t (s) didapatkan persamaan garis:
y = 6,937.10-4x +¿ 0,2326
No ln (a−b) ln a
(a−b) t’ (
x−y
2 ¿−2
1. 2,917 0,102 18,5
2. 2,803 0,217 16,5
3. 2,674 0,346 14,5
4. 2,525 0,494 12,5
5. 2,351 0,669 10,5
6. 2,140 0,880 8,5
7. 1,871 1,148 6,5
8. 1,504 1,516 4,5
250 265 285 331 437 531 883 2080 0
0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
Kurva ln a/(a-b) terhadap t (s)
Kurva ln a/(a-b) lawan t
t (s)
ln
a
/(
a-b
)
Gambar 4.1 Nilai ln a
(a−b) terhadap waktu (s)
250 265 285 331 437 531 883 2080
0 0.5 1 1.5 2 2.5 3 3.5
Kurva ln (a-b) terhadap t (s)
Kurva ln a/(a-b) lawan t
t (s)
ln
(
a-b
)
Pertanyaan :
1. Apa yang dimaksud dengan kecepatan reaksi?
2. Apa satuan konstanta kecepatan reaksi untuk reaksi tingkat 1? 3. Tuliskan reaksi yang terjadi secara lengkap.
4. Berapa konsentrasi H2O2 yang digunakan?
5. Apa kegunaan asam sulfat dalam percobaan ini?
Jawaban :
1. Kecepatan reaksi adalah
Laju reaksi menyatakan banyaknya reaksi kimia yang berlangsung per satuan waktu. Laju reaksi juga menyatakan molaritas zat terlarut dalam reaksi yang dihasilkan tiap detik reaksi. Perkaratan besi merupakan contoh reaksi kimia yang berlangsung lambat, sedangkan peledakan mesiu atau kembang api adalah contoh reaksi yang cepat.
2. Satuan konstanta pada orde 1 = S-1
3. Reaksi secara lengkap
a. Pengoksidasi MnO4- menjadi Mn2+ oleh H2O2.
2MnO4- + 5H2O2 + 6H+ 2Mn2+ + 5O2 + 8H2O
b. Pelarutan KI dengan aquadest kemudian ditambahkan H2SO4.
KI(s) + H2O(aq) KI(aq)
KI(aq) + H2SO4 HI(aq) + K2SO4(aq)
c. Pembentukan asam iodida.
KI(aq) + H2SO4(aq) HI(aq) + K2SO4(aq)
d. Reaksi asam iodida dengan asam peroksida
H2O2 + 2HI I2 + 2H2O
4. 3%
5. Kegunaan asam sulfat ialah untuk mengoksidasi MnO4- menjadi Mn2+ dan
3.3. Pembahasan
Muhammad Januar Ramadhan (151411049)
Kecepatan reaksi adalah banyaknya reaksi kimia yang berlangsung per satuan waktu. Laju reaksi menyatakan molaritas zat terlarut dalam reaksi yang dihasilkan tiap detik reaksi. Faktor yang mempengaruhi laju reaksi adalah luas permukaan, suhu, katalis, dan konsentrasi (molaritas).
Pada percobaan kali ini, kita membuat dua macam larutan, yaitu H2O2 3% 5mL diencerkan sampai tanda batas. Larutan kedua adalah campuran dari H2SO4 2N (30mL), Air suling 500mL, 3mL larutan kanji, 1.5gram KI, 2mL larutan Na2S2O3. Campurkan kedua larutan kedalam labu takar 1L. Pada saat awal pencampuran zat, nyalakan stopwatch dan aduk menggunakan magnet pengaduk . Pada waktu tertentu larutan akan berubah menja di biru, catat waktunya (stopwatch dan pengadukan jangan dihentikan). Lalu tambahkan 2mL Na2s2O3kemudian larutan akan berubah jernih kembali. Kemudiant unggu kembali sampai berubah kembali menjadi warna biru, dan saat itu terjadi , catat waktunya.Waktu yang kita ambil adalah selisih dari awal larutan jernih sampai menjadi warna biru. Kami melakukan percobaan ini berulang-ulang. Larutan jernih kembali karenaNa2S2O3 mengubah iodium bebas
menjadi asam iodida kembali, sehingga kanji tidak mengadsorbsi iod.
Dan didapatkan grafik seperti di bawah ini.
2 5 00 2 6 5 2 8 5 3 3 1 4 3 7 5 3 1 8 8 3 2 0 8 0
5 10 15 20
Volume (mL) terhadap waktu (t)
Series 1
Dari grafik di atas, saya menyimpulkan bahwa makin banyak volume Na2S2O3 yang ditambahkan, maka makin lambat laju reaksi campuran. Karena kanji semakin sulit mengadsorpsi iod yang terkandung dalam campuran.
Muhamad Adam Abraham (151411050)
Laju reaksi adalah berkurangnya jumlah peraksi untuk satuan waktu atau bertambahnya jumlah hasil reaksi untuk setiap satuan waktu. Ukuran jumlah zat dalam reaksi kimia pada umumnya dinyatakan sebagai konsentrasi molar atau molaritas, dengan demikian maka laju reaksi menyatakan berkurangnya konsentrasi pereaksi atau bertambahnya konsentrasi zat hasil reaksi setiap satu satuan waktu.
1. Suhu
Kenaikkan suhu dapat mempercepat laju reaksi karena dengan bertambahnya suhu, energi kinetik partikel meningkat sehingga memungkinkan semakin banyaknya tumbukan efektif.
2. Katalis
Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu tanpa mengalami perubahan atau terpakaai oleh reaksi itu sendiri.Katallis menyediakan suatu jalur pilihan dengan energi aktivasi lebih rendah sehingga memungkinkan laju reaksi meningkat.
3. Konsentrasi
Konsentrasi mempercepat laju reaksi karena semakin banyaknya pertikel memungkinkan lebih banyak tumbukan den menyebabkan lebih banyaknya tumbukan efektif.
Pada percobaan yang telah dilakukan, campuran dari beberapa zat (H2O2,H2O,
H2SO4,KMnO4,KI, dan Na2S2O) diaduk menggunakan pengaduk magnet untuk
didapatkan laju reaksinya.
Campuran dari beberapa zat akan berubah warna menjadi biru pada saat t tertentu. Hal ini disebabkan koloid dari kanji melakukan adsorpsi terhadap iod yang membentuk senyawa kompleks. Setelah terjadi perubahan warna, campuran diberikan tiosulfat sebanyak 2 mL untuk mengubah warna campuran dari biru ke warna bening kembali. Hal ini terjadi karena tiosulfat mengubah iodium bebas menjadi asam iodida, pada kondisi ini kanji tidak mengabsorpsi iod yang menyebabkan campuran kembali berwarna bening.
250 265 285 331 437 531 883 2080
0
Volume Na2S2O3 terhadap t
Muhamad Faizal (151411051)
Pada percobaan pertama yaitu penentuan ekivalen H2O2 dengan tiosulfat,
larutan H2O2 yang telah ditambah H2SO4 (suasana asam ) dititrasi dengan
KMnO4 . Titik ekivalen tercapai setelah ditambahkan 4,1 mL KMnO4 dan ditandai saat larutan berubah warna menjadi merah muda.
Pada percobaan kedua yaitu mentitrasi larutan KMnO4 dengan larutan
Na2S2O3. Penambahan ini dilakukan pada suasana asam (penambahan H2SO4)
dan berfungsi untuk mengoksidasi MnO4- menjadi Mn2+ dan mempercepat
terjadinya reaksi. Titik ekivalen tercapai setelah ditambahkan 10 mL Na2S2O3
dan ditandai saat larutan mulai berubah warna dari coklat kemerahan menjadi bening.
Pada percobaan penentuan kecepatan reaksi diawali dengan pembuatan
larutan a dan larutan b
Pada larutan b ditambahkan larutan kanji untuk mendeteksi apakah iodium
habis bereaksi dengan tiosulfat
Larutan a ditambahkan pada larutan b dan setelah itu diaduk dengan
pengaduk magnet, beberapa saat kemudian akan terjadi perubahan warna dari bening menjadi biru
Hal yang diamati dalam percobaan ini yaitu waktu yang dibutuhkan saat
warna larutan berubah dari bening menjadi biru
Saat larutan telah berwarna biru tambahkan 2 mL larutan tiosulfat ke dalam
larutan, maka warna larutan akan dengan cepat berubah dari biru menjadi bening
Reaksi ketika terjadi perubahan warna dari biru ke bening :
S2O32- + I2 → 2I- + S4O6
2- Namun, lama kelamaan larutan akan kembali berubah warna menjadi biru
ketika tiosulfat habis bereaksi
Saat percobaan tidak disertai dengan penambahan suhu sehingga reaksi
berlangsung lambat
Faktor yang mempengaruhi laju reaksi salah satunya adalah suhu
Semakin tinggi suhu yang diberikan maka reaksi akan berlangsung cepat
Semakin rendah suhu yang diberikan maka reaksi akan berlangsung lambat
Konstanta laju reaksi yang diperoleh dari percobaan yaitu 6, 937. 10-4 s-1
Laju reaksi menyatakan banyaknya reaksi kimia yang berlangsung per satuan waktu. Laju reaksi juga menyatakan molaritas zat terlarut dalam reaksi yang dihasilkan tiap detik reaksi. Perkaratan besi merupakan contoh reaksi kimia yang berlangsung lambat, sedangkan peledakan mesiu atau kembang api adalah contoh reaksi yang cepat.
Pada reaksi kimia seperti
aA+bB → pP+qQ
Dengan a,b,p,q adalah koefisien reaksi, dan A,B,P,Q adalah zat yang terlibat dalam reaksi, laju reaksi dalam sistem tertutup adalah
V=−1d[A]=−1d[B]=1d[P]=1d[Q]
a dt b dt p dt q dt
Diamana [A], [B], [P], [Q] menyatakan konsentrasi zat-zat tersebut.
Pada praktikum laju reaksi ini di dapatkan dari campuran zat-zat, yaitu H2O2,Air suling, H2SO4,KMnO4,KI, dan Na2S2O, diaman zat-zat tersebut di aduk
menggunakan pengaduk magnet.
Pada saat t tertentu campuran akan berubah menjadi warna biru yang di sebabkan oleh reaksi kanji dengan iod yang membentuk senyawa komplek dimana iod di absorbsi oleh kanji,tetapi besarnya absorbsi kanji terhadap iod juga di pengaruhi oleh konsentrasi iodida yang tersedia.
Setiap campuran menjadi biru campuran di tambahkan 2ml Na2S2O3 sehingga
campuran menjadi bening kembali,karena Na2S2O3 mengubah iodium bebas menjadi
asam iodida kembali, sehingga kanji tidak mengadsorbsi iod. Pada praktikum di dapatkan grafik Volume Na2S2O3 terhadap t
250 265 285 331 437 531 883 2080
0
Volume Na2S2O3 terhadap t
Series 1
Pada grafik dapat di lihat, semakin bertambah volume Na2S2O3 yang berada
pada campuran, maka laju reaksi campuran semakin lambat, karena kanji semakin lama dalam mengadsorbsi iod yang terkandung pada campuran.
Pada percobaan pada tanggal 19-oktober-2015 diperoleh data
Titrasi 10 mL H2O2 dengan KMnO4 0,1 N = 4,1 mL (rata-rata/x)
Titrasi 10 mL KMnO4 dengan Na2S2O3 = 10 mL (rata-rata/y)
Dan berdasarkan tabel di peroleh grafik Volume Na2S2O3 terhadap waktu
250 265 285 331 437 531 883 2080
0 5 10 15 20
Volume Na2S2O3 terhadap t
Series 1
t (s)
V
o
lu
m
e
N
a2
S2
O
3
(
m
l)
Pada grafik dapat di lihat, bahwasanya semakin bertambah volume Na2S2O3 pada
campuran, maka akan semakin lama terjadinya reaksi , dalam hal ini campuran berubah menjadi warna biru, itu di sebabkan karena kanji yang mengadsorbsi iod.Dan lamanya reaksi di sebabkan karena Tiosulfat yang menghambat kanji dalam
mengadsorbsi iod.
Untuk menentukan konstanta laju reaksi di dapatkan dari grafik lna/(a-b)
No Na2S2O3 (b) , mL t (detik)
1. 2 250
2. 4 265
3. 6 285
4. 8 331
5. 10 437
6. 12 531
7. 14 883
250 265 285 331 437 531 883 2080 0
0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
Kurva ln a/(a-b) terhadap t (s)
Kurva ln a/(a-b) lawan t
t (s)
ln
a
/(
a-b
)
Sehingga di dapatkan nilai k= m(gradien) = 6,937.10-4
BAB V
Mentik Hulupi, Cs (1996). Praktikum Kimia Fisika, puast pengembangan pendidikan Politeknik, Bandung
Tony bird, (1987), kimia fisika untuk universitas, PT.Gramedia, Jakarta Wasilak, (1972) Praktikum Pengantar Kimia Organik
Gambar Ket Gambar Ket
Erlenmeyer 1000ml
dan Erlenmeyer
250ml
Corong Dan Gelas ukur 100ml
Buret
Percobaan Penentuan Kecepatan Reaksi
sebelum berubah warna
Labu takar 100ml
Percobaan Penentuan Kecepatan Reaksi pada saat berubah
warna
Gelas Kimia 250ml
Dan Gelas kimia
100ml