LAPORAN AKHIR
LAPORAN AKHIR
PRAKTIKUM KIMIA DASAR 1
PRAKTIKUM KIMIA DASAR 1
PERCOBAAN KE - III
PERCOBAAN KE - III
VARIASI KONTINU
VARIASI KONTINU
Dosen Pembimbing: Dosen Pembimbing: Drs. Iriani Bakti, M.Si Drs. Iriani Bakti, M.Si Drs. Parham Saadi, M.Si Drs. Parham Saadi, M.SiAsisten : Asisten :
Noor Azmila Rahmi Noor Azmila Rahmi
Wily Astri Wily Astri Disusun Oleh : Disusun Oleh : Kelompok IV Kelompok IV Choirul
Choirul Amin Amin (AIC310003)(AIC310003) Fitriana
Fitriana Rahmatunnisa Rahmatunnisa (A1C310016)(A1C310016) Khairiatul
Khairiatul Muna Muna (A1C310013)(A1C310013) Muhammad
Muhammad Russadi Russadi (A1C310032)(A1C310032) Nur Indah Sari
Nur Indah Sari (A1C310045)(A1C310045)
PROGRAM STUDI PENDIDIKAN KIMIA PROGRAM STUDI PENDIDIKAN KIMIA JURUSAN PENDIDIKAN MATEMATIKA DAN IPA JURUSAN PENDIDIKAN MATEMATIKA DAN IPA FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS LAMBUNG MANGKURAT UNIVERSITAS LAMBUNG MANGKURAT
BANJARMASIN BANJARMASIN
2010 2010
PERCOBAAN III
PERCOBAAN III
Judul
Judul : : Variasi Variasi KontinuKontinu Tujuan
Tujuan : : Untuk Untuk mempelajari mempelajari Stoikiometri Stoikiometri sistemsistem CuSO
CuSO44-NaOH dan stoikiometri asam basa-NaOH dan stoikiometri asam basa Hari
Hari / / Tanggal Tanggal : : Sabtu Sabtu / / 04 04 Desember Desember 20102010 Tempat
Tempat : : Laboratorium Laboratorium Kimia Kimia FKIP FKIP UnlamUnlam Banjarmasin
Banjarmasin
I.
I. DASAR TEORIDASAR TEORI
Ilmu kimia
Ilmu kimia merupakan salah merupakan salah satu cabang satu cabang Ilmu PengIlmu Pengetahuan Alam etahuan Alam (IPA)(IPA) sains. Kimia adalah ilmu yang mempelajari mengenai komposisi dan sifat zat atau sains. Kimia adalah ilmu yang mempelajari mengenai komposisi dan sifat zat atau materi dari skala atom hingga molekul serta perubahan atau transformasi serta materi dari skala atom hingga molekul serta perubahan atau transformasi serta interaksi mereka untuk membentuk materi yang ditemukan sehari-hari. Kimia interaksi mereka untuk membentuk materi yang ditemukan sehari-hari. Kimia juga
juga mempelajari mempelajari pemahaman pemahaman sifat sifat dan dan interaksi interaksi atom atom individu individu dengan dengan tujuantujuan untuk menerapkan pengetahuan tersebut pada tingkat makroskopik.
untuk menerapkan pengetahuan tersebut pada tingkat makroskopik.
Ilmu kimia merupakan pusat dari segala ilmu yang berlandaskan pada Ilmu kimia merupakan pusat dari segala ilmu yang berlandaskan pada percobaan.
percobaan. Jika Jika dari dari sejumlah sejumlah percobaan percobaan diperoleh diperoleh hasil hasil yang yang sama, sama, makamaka keteraturan ini dapat diungkapkan dalam pernyataan yang singkat dan disebut keteraturan ini dapat diungkapkan dalam pernyataan yang singkat dan disebut hukum. Namun, tidak semua hal dapat diamati dengan percobaan, seperti atom, hukum. Namun, tidak semua hal dapat diamati dengan percobaan, seperti atom, molekul dan ion yang merupakan dasar kimia bersifat abstrak. Oleh karena itu, molekul dan ion yang merupakan dasar kimia bersifat abstrak. Oleh karena itu, diperlukan hukum dasar kimia yang dapat menjelaskan dasar kimia tersebut.
diperlukan hukum dasar kimia yang dapat menjelaskan dasar kimia tersebut.
Suatu zat kimia dapat dikenal dari sifat intensitasnya, misalnya suatu Suatu zat kimia dapat dikenal dari sifat intensitasnya, misalnya suatu cairan dapat dipastikan adalah air, bila diperiksa akan mempunyai kerapatan 1,0 cairan dapat dipastikan adalah air, bila diperiksa akan mempunyai kerapatan 1,0 Kg
Kg-1-1, titik didih 100, titik didih 100ooC dan titik beku 0C dan titik beku 0ooC. Jika zat lebih rumit, seperti zat organikC. Jika zat lebih rumit, seperti zat organik dari bahan alam, maka diperlukan pengujian yang lebih banyak untuk mengetahui dari bahan alam, maka diperlukan pengujian yang lebih banyak untuk mengetahui rumus senyawa maupun struktur molekulnya, selain itu kuantitas molar, pereaksi rumus senyawa maupun struktur molekulnya, selain itu kuantitas molar, pereaksi
berlainan
berlainan perubahan perubahan harga harga sifat sifat dari dari sistem sistem juga juga dapat dapat digunakan digunakan untukuntuk meramalkan stoikiometri sistem.
meramalkan stoikiometri sistem.
Stoikiometri merupakan bidang dalam ilmu kimia yang menyangkut Stoikiometri merupakan bidang dalam ilmu kimia yang menyangkut hubungan kuantitatif antara zat-zat yang terlibat dalam reaksi kimia, baik sebagai hubungan kuantitatif antara zat-zat yang terlibat dalam reaksi kimia, baik sebagai pereaksi
pereaksi maupun maupun sebagai sebagai hasil hasil reaksi. reaksi. Stoikiometri Stoikiometri juga juga menyangkutmenyangkut perbandingan
perbandingan atom atom antar antar unsur-unsur unsur-unsur dalam dalam suatu suatu rumus rumus kimia, kimia, misalnyamisalnya perbandingan atom
perbandingan atom H H dan dan atom atom O O dalam dalam molekul molekul HH22O. Kata stokiometri berasalO. Kata stokiometri berasal dari bahasa Yunani yaitu stoicheon yang artinya unsur dan metron yang berarti dari bahasa Yunani yaitu stoicheon yang artinya unsur dan metron yang berarti mengukur. Seorang ahli kimia Prancis, Jeremias Benjamin Ritchter (1762-1807) mengukur. Seorang ahli kimia Prancis, Jeremias Benjamin Ritchter (1762-1807) adalah orang yang pertama kali meletakkan prinsip-prinsip dasar stoikiometri. adalah orang yang pertama kali meletakkan prinsip-prinsip dasar stoikiometri. Menurutnya stoikiometri adalah ilmu tentang pengukuran perbandingan Menurutnya stoikiometri adalah ilmu tentang pengukuran perbandingan kuantitatif atau pengukuran perbandingan antar unsur kimia yang satu dengan kuantitatif atau pengukuran perbandingan antar unsur kimia yang satu dengan yang lain.
yang lain.
Dalam stoikiometri terkandung beberapa hukum dasar yaitu sebagai Dalam stoikiometri terkandung beberapa hukum dasar yaitu sebagai berikut :
berikut : 1.
1. Hukum Kekekalan MassaHukum Kekekalan Massa
Menyatakan bahwa materi tidak dapat diciptakan atau dimusnahkan yang Menyatakan bahwa materi tidak dapat diciptakan atau dimusnahkan yang terjadi hanyalah perpindahan. Sehingga massa zat sebelum dan s
terjadi hanyalah perpindahan. Sehingga massa zat sebelum dan s esudah reaksiesudah reaksi adalah sama.
adalah sama. 2.
2. Hukum Perbandingan TetapHukum Perbandingan Tetap
Menyatakan bahwa perbandingan unsur-unsur didalam persenyawaan selalu Menyatakan bahwa perbandingan unsur-unsur didalam persenyawaan selalu tetap. Massa zat yang bereaksi selalu tetap.
tetap. Massa zat yang bereaksi selalu tetap. 3.
3. Hukum Perbandingan BergandaHukum Perbandingan Berganda
Menyatakan bahwa jika dua unsur dapat membentuk lebih dari dua senyawa, Menyatakan bahwa jika dua unsur dapat membentuk lebih dari dua senyawa, maka massa salah satu unsur dari senyawa tersebut tetap. Senyawa unsur dari maka massa salah satu unsur dari senyawa tersebut tetap. Senyawa unsur dari senyawa atom unsur lebih lainnya merupakan perbandingan bilangan bulat senyawa atom unsur lebih lainnya merupakan perbandingan bilangan bulat sederhana.
4.
4. Hukum Perbandingan VolumeHukum Perbandingan Volume
Menyatakan bahwa, pada suatu suhu dan tekanan tertentu, volume gas dalam Menyatakan bahwa, pada suatu suhu dan tekanan tertentu, volume gas dalam suatu reaksi berbanding sebagai bilangan bulat dan sederhana atau volume suatu reaksi berbanding sebagai bilangan bulat dan sederhana atau volume berbanding lurus dengan ko
berbanding lurus dengan koefisien reaksinya.efisien reaksinya. 5.
5. Hukum atau Hipotesis AvogadroHukum atau Hipotesis Avogadro
Menyatakan bahwa, pada suhu dan tekanan yang sama, semua gas yang Menyatakan bahwa, pada suhu dan tekanan yang sama, semua gas yang volumenya sama mengandung jumlah molekul yang sama.
volumenya sama mengandung jumlah molekul yang sama.
Reaksi kimianya biasanya bergantung antara dua campuran murni. Satu Reaksi kimianya biasanya bergantung antara dua campuran murni. Satu bentuk
bentuk yang yang paling paling lazim lazim dari dari campuran campuran adalah adalah larutan. larutan. Di Di alam alam sebagian sebagian besarbesar reaksi berlangsung di dalam larutan air. Contohnya cairan tubuh baik hewan reaksi berlangsung di dalam larutan air. Contohnya cairan tubuh baik hewan maupun tumbuhan merupakan larutan dari berbagai zat. Dalam tanah, reaksi pada maupun tumbuhan merupakan larutan dari berbagai zat. Dalam tanah, reaksi pada umumnya berlangsung dalam lapisan tipis larutan yang diabsopsi dari padatan. umumnya berlangsung dalam lapisan tipis larutan yang diabsopsi dari padatan.
Reaksi kimia dibagi menjadi dua kelompok besar, yaitu reaksi asam basa Reaksi kimia dibagi menjadi dua kelompok besar, yaitu reaksi asam basa dan reaksi redoks. Pada reaksi asam basa tidak ada perubahan biloks, sedangkan dan reaksi redoks. Pada reaksi asam basa tidak ada perubahan biloks, sedangkan pada
pada reaksi reaksi redoks redoks terjadi terjadi perubahan perubahan bilangan bilangan oksidasi. oksidasi. Kedua Kedua reaksi reaksi kimia kimia iniini dapat dikelompokkan ke dalam 4 tipe reaksi:
dapat dikelompokkan ke dalam 4 tipe reaksi: a.
a. Reaksi SintesisReaksi Sintesis b.
b. Reaksi DekomposisiReaksi Dekomposisi c.
c. Reaksi Penggantian TunggalReaksi Penggantian Tunggal d.
d. Reaksi Penggantian GandaReaksi Penggantian Ganda
Stoikiometri reaksi dalam larutan dapat ditentukan menggunakan Hukum Stoikiometri reaksi dalam larutan dapat ditentukan menggunakan Hukum Kekekalan Massa. Akan tetapi tidak lagi mengkonversi massa dan jumlah bahan Kekekalan Massa. Akan tetapi tidak lagi mengkonversi massa dan jumlah bahan kimia (zat yang bereaksi), melainkan antara
kimia (zat yang bereaksi), melainkan antara volume larutan dan jumlah zat denganvolume larutan dan jumlah zat dengan konsentrasi sebagai faktor konversi. Artinya, banyaknya zat terlarut dalam suatu konsentrasi sebagai faktor konversi. Artinya, banyaknya zat terlarut dalam suatu larutan dapat diketahui jika volume dan konsentrasi larutan juga diketahui. Atau larutan dapat diketahui jika volume dan konsentrasi larutan juga diketahui. Atau dapat dituliskan:
dapat dituliskan:
dimana,
dimana, n n = = jumlah jumlah molmol M = molaritas larutan M = molaritas larutan
V = volume (liter) V = volume (liter)
Pada dasarnya, stoikiometri reaksi dalam larutan sama dengan stoikiometri Pada dasarnya, stoikiometri reaksi dalam larutan sama dengan stoikiometri pada
pada umumnya, umumnya, yaitu yaitu perbandingan perbandingan mol mol zat-zat zat-zat yang yang terlibat terlibat dalam dalam reaksi reaksi samasama dengan koefisien reaksinya. Hitungan stoikiometri dengan salah satu zat dalam dengan koefisien reaksinya. Hitungan stoikiometri dengan salah satu zat dalam reaksi diketahui atau dapat ditentukan jumlah molnya. Koefisien reaksi yang reaksi diketahui atau dapat ditentukan jumlah molnya. Koefisien reaksi yang setara menunjukkan jumlah mol yang merupakan titik stoikiometri.
setara menunjukkan jumlah mol yang merupakan titik stoikiometri.
Berdasarkan sifat fisika pembuktian suatu rumus senyawa berhubungan Berdasarkan sifat fisika pembuktian suatu rumus senyawa berhubungan dengan kuantitas pereaksinya, yakni suhu. Suhu didefinisikan sebagai kuantitas dengan kuantitas pereaksinya, yakni suhu. Suhu didefinisikan sebagai kuantitas tingkat panas atau dingin benda atau zat yang dapat menetapkan arah aliran kalor tingkat panas atau dingin benda atau zat yang dapat menetapkan arah aliran kalor secara spontan. Suhu lazimnya diukur dengan beberapa skala termometer.
secara spontan. Suhu lazimnya diukur dengan beberapa skala termometer.
Dalam metode variasi kontinu dilakukan sederetan pengamatan yang Dalam metode variasi kontinu dilakukan sederetan pengamatan yang kuantitatif bervariasi. Salah satu sifat kimia dipilih untuk diperiksa, seperti massa, kuantitatif bervariasi. Salah satu sifat kimia dipilih untuk diperiksa, seperti massa, volume, suhu, atau daya serap. Sifat kimia umumnya merujuk pada sifat suatu volume, suhu, atau daya serap. Sifat kimia umumnya merujuk pada sifat suatu materi pada kondisi sekitar, yaitu pada suhu kamar, tekanan atmosfer dan materi pada kondisi sekitar, yaitu pada suhu kamar, tekanan atmosfer dan atmosfer beroksigen. Sifat ini terutama timbul pada reaksi kimia dan hanya dapat atmosfer beroksigen. Sifat ini terutama timbul pada reaksi kimia dan hanya dapat diamati dengan mengubah identitas kimiawi suatu zat. Sifat kimia dapat diamati dengan mengubah identitas kimiawi suatu zat. Sifat kimia dapat digunakan untuk menyusun klasifikasi kimia. Sifat ini biasanya digunakan untuk digunakan untuk menyusun klasifikasi kimia. Sifat ini biasanya digunakan untuk menyatakan elektronegativitas, potensial ionisasi, jenis ikatan kimia yang menyatakan elektronegativitas, potensial ionisasi, jenis ikatan kimia yang dibentuk (logam, ion dan kovalen).
dibentuk (logam, ion dan kovalen).
Karena kuantitas molar pereaksi berlainan, perubahan harga sifat dari Karena kuantitas molar pereaksi berlainan, perubahan harga sifat dari sistem kimia tersebut dapat digunakan untuk meramalkan stoikiometri sistem. sistem kimia tersebut dapat digunakan untuk meramalkan stoikiometri sistem. Stoikiometri menyangkut cara atau perhitungan kimia untuk menimbang dan Stoikiometri menyangkut cara atau perhitungan kimia untuk menimbang dan menghitung spesi-spesi kimia. Bila digambarkan grafik secara fisika yang diamati menghitung spesi-spesi kimia. Bila digambarkan grafik secara fisika yang diamati (diukur) terhadap kuantitas pereaksinya, maka akan diperoleh suatu titik (diukur) terhadap kuantitas pereaksinya, maka akan diperoleh suatu titik maksimum atau minimum yang sesuai dengan titik stokiometri sistem, yang maksimum atau minimum yang sesuai dengan titik stokiometri sistem, yang menyatakan perbandingan pereaksi-pereaksi dalam senyawa.
II.
II. ALAT DAN BAHANALAT DAN BAHAN
Alat-alat yang digunakan dalam percobaan ini adalah : Alat-alat yang digunakan dalam percobaan ini adalah : 1.
1. Gelas Gelas kimia kimia : : 2 2 buahbuah 2.
2. Gelas Gelas ukur ukur : : 2 2 buahbuah 3. Batang
3. Batang pengaduk pengaduk : : 1 1 buahbuah 4.
4. Pipet Pipet tetes tetes : : 2 2 buahbuah 5.
5. Termometer Termometer : : 1 1 buahbuah 6.
6. Baskom Baskom : : 1 1 buahbuah
Bahan-bahan yang digunakan dalam percobaan ini adalah : Bahan-bahan yang digunakan dalam percobaan ini adalah : 1.
1. Larutan NaOH 1 MLarutan NaOH 1 M 2.
2. Larutan CuSOLarutan CuSO44 0,1 M. 0,1 M. 3.
3. Larutan HCl 1 MLarutan HCl 1 M 4.
4. AirAir
III.
III. PROSEDUR PERCOBAANPROSEDUR PERCOBAAN A. Stoikiometri Sistem CuSO
A. Stoikiometri Sistem CuSO44-NaOH-NaOH
1. Memasukkan masing-masing 10 ml NaOH 1 M dan 2 ml CuSO
1. Memasukkan masing-masing 10 ml NaOH 1 M dan 2 ml CuSO44 0,1 M ke 0,1 M ke dalam 2 gelas kimia, menyamakan temperaturnya dengan mencelupkan dalam 2 gelas kimia, menyamakan temperaturnya dengan mencelupkan gelas kimia yang berisi larutan ke dalam air bersama-sama. Mencatat gelas kimia yang berisi larutan ke dalam air bersama-sama. Mencatat temperaturnya sebagai temperatur awal.
temperaturnya sebagai temperatur awal. 2.
2. Sambil Sambil mengaduk, mencampurkan kedua mengaduk, mencampurkan kedua larutan larutan dan mencatat dan mencatat suhusuhu tertinggi yang dicapai sebagai temperatur akhir.
tertinggi yang dicapai sebagai temperatur akhir.
3. Mengulangi prosedur yang sama dengan perbandingan volume sesuai tabel 3. Mengulangi prosedur yang sama dengan perbandingan volume sesuai tabel
pengamatan, mencatat temperatur dari percobaan tersebut. pengamatan, mencatat temperatur dari percobaan tersebut. 4.
4. Membuat grafik Membuat grafik yang menghubungkan volume yang menghubungkan volume sistem sistem sebagai abssebagai absisis terhadap
terhadap T sebagai ordinat.T sebagai ordinat. 5.
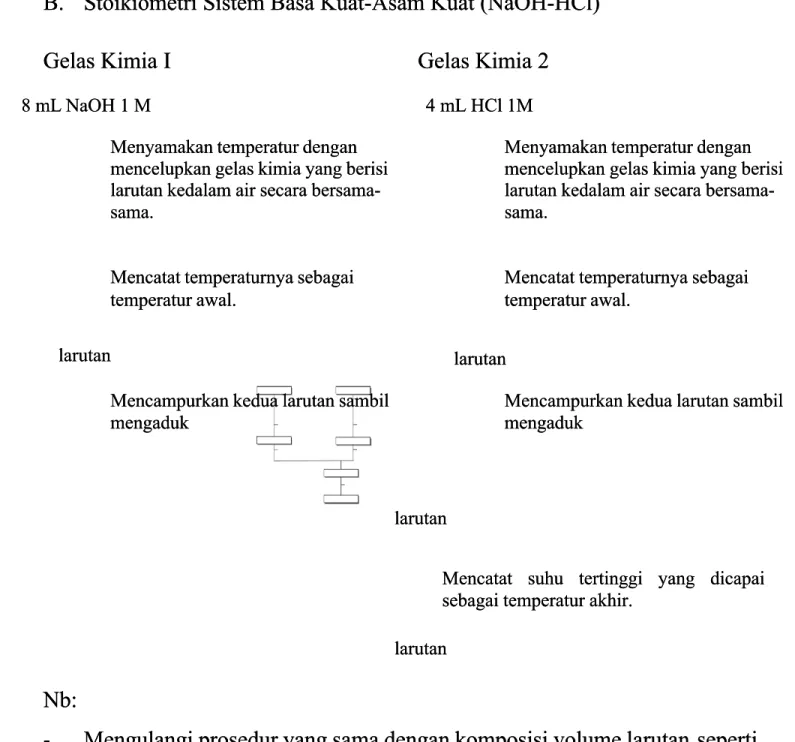
B. Stoikiometri Sistem Asam Kuat-Basa Kuat (NaOH-HCL) B. Stoikiometri Sistem Asam Kuat-Basa Kuat (NaOH-HCL)
1. Memasukkan masing-masing 8 ml NaOH 1 M dan 4 ml HCl 1 M ke dalam 2 1. Memasukkan masing-masing 8 ml NaOH 1 M dan 4 ml HCl 1 M ke dalam 2 gelas kimia, menyamakan temperaturnya dengan mencelupkan gelas kimia gelas kimia, menyamakan temperaturnya dengan mencelupkan gelas kimia yang berisi larutan ke dalam air bersama-sama. Mencatat temperaturnya yang berisi larutan ke dalam air bersama-sama. Mencatat temperaturnya sebagai temperatur awal.
sebagai temperatur awal. 2.
2. Sambil mengaduk, meSambil mengaduk, mencampurkan kedua lncampurkan kedua larutan dan arutan dan mencatat mencatat suhusuhu tertinggi yang dicapai sebagai temperatur akhir.
tertinggi yang dicapai sebagai temperatur akhir.
3. Mengulangi prosedur yang sama dengan perbandingan volume sesuai tabel 3. Mengulangi prosedur yang sama dengan perbandingan volume sesuai tabel
pengamatan, mencatat temperatur dari percobaan tersebut. pengamatan, mencatat temperatur dari percobaan tersebut. 4.
4. Membuat grafik Membuat grafik yang menghubungkan volume yang menghubungkan volume sistem sistem sebagai abssebagai absisis terhadap
terhadap T sebagai ordinat.T sebagai ordinat.
5. Membuat kesimpulan dari kegiatan di atas. Jika sistem diganti dengan 5. Membuat kesimpulan dari kegiatan di atas. Jika sistem diganti dengan
NaOH dan
NaOH dan HH22SOSO44 dengan konsentrasi yang sama. Memprediksikan volume dengan konsentrasi yang sama. Memprediksikan volume kedua larutan yang menghasilkan titik stoikiometrinya.
kedua larutan yang menghasilkan titik stoikiometrinya.
IV.
IV. HASIL HASIL PENGAMATANPENGAMATAN A.
A. Stoikiometri Stoikiometri sistem sistem NaOH-CuSONaOH-CuSO44
Dari percobaan dan pengamatan mengenai stoikiometri sistem CuSO Dari percobaan dan pengamatan mengenai stoikiometri sistem CuSO44 -- NaOH diperoleh hasil sebagai berikut :
NaOH diperoleh hasil sebagai berikut : No.
No. NaOH (ml) NaOH (ml) CuSOCuSO44(ml) (ml) TTmula-mulamula-mula TTakhirakhir ∆T∆T 1 1 10 10 2 2 29ºC 29ºC 28ºC 28ºC -1ºC-1ºC 2 2 9 9 3 3 30ºC 30ºC 29ºC 29ºC 1ºC1ºC 3 3 8 8 4 4 29ºC 29ºC 29ºC 29ºC 0ºC0ºC 4 4 7 7 5 5 28ºC 28ºC 29ºC 29ºC 1ºC1ºC 5 5 6 6 6 6 29ºC 29ºC 29,5ºC 29,5ºC 0,5ºC0,5ºC 6 6 5 5 7 7 29ºC 29ºC 30ºC 30ºC 1ºC1ºC 7 7 4 4 8 8 29ºC 29ºC 30,5ºC 30,5ºC 1,5ºC1,5ºC 8 8 3 3 9 9 29ºC 29ºC 30ºC 30ºC 1ºC1ºC 9 2 9 2 10 10 29ºC 29ºC 29ºC 29ºC 0ºC0ºC
B.
B. Stoikiometri Stoikiometri sistem sistem NaOH-HClNaOH-HCl
Dari percobaan dan pengamatan mengenai stoikiometri sistem basa Dari percobaan dan pengamatan mengenai stoikiometri sistem basa kuat- kuat-asam kuat (NaOH-HCl) diperoleh hasil sebagai berikut :
asam kuat (NaOH-HCl) diperoleh hasil sebagai berikut : No.
No. NaOH (ml) NaOH (ml) HCl (ml) HCl (ml) TTmula-mulamula-mula TTakhirakhir ∆T∆T 1 1 8 8 4 4 29ºC 29ºC 30ºC 30ºC 1ºC1ºC 2 7 2 7 5 5 29,5ºC 29,5ºC 30ºC 30ºC 0,5ºC0,5ºC 3 6 3 6 6 6 29ºC 29ºC 30,5ºC 30,5ºC 1,25ºC1,25ºC 4 4 5 5 7 7 29ºC 29ºC 30ºC 30ºC 1ºC1ºC 5 4 5 4 8 8 29,5ºC 29,5ºC 30ºC 30ºC 0,5ºC0,5ºC V. ANALISIS DATA V. ANALISIS DATA 1.
1. Stoikiometri Sistem CuSOStoikiometri Sistem CuSO44 -NaOH -NaOH
Dari hasil pengamatan, bila NaOH direaksikan dengan CuSO
Dari hasil pengamatan, bila NaOH direaksikan dengan CuSO44, maka akan, maka akan menghasilkan Na
menghasilkan Na22SOSO44 dan Cu(OH) dan Cu(OH)22 dengan persamaan reaksi sebagai berikut: dengan persamaan reaksi sebagai berikut:
2NaOH (aq) + CuSO
2NaOH (aq) + CuSO44(aq) (aq) NaNa22SOSO44(aq) + Cu(OH)(aq) + Cu(OH)22(aq)(aq)
Koefisien dari reaksi setara tersebut menunjukkan jumlah mol yang merupakan Koefisien dari reaksi setara tersebut menunjukkan jumlah mol yang merupakan titik stoikiometri pada reaksi tersebut. Karena volume reaktan dari 9 perlakuan titik stoikiometri pada reaksi tersebut. Karena volume reaktan dari 9 perlakuan berbeda,
berbeda, maka maka perubahan perubahan volume volume tersebut tersebut dapat dapat digunakan digunakan untuk untuk meramalmeramal stoikiometri sistem untuk mendapatkan perbandingan jumlah mol dengan stoikiometri sistem untuk mendapatkan perbandingan jumlah mol dengan menggunakan rumus.
menggunakan rumus.
Mol = Molaritas x Volume Mol = Molaritas x Volume
Diketahui molaritas NaOH adalah 1M dan molaritas CuSO
Diketahui molaritas NaOH adalah 1M dan molaritas CuSO44 adalah 0.1M. Dari adalah 0.1M. Dari persamaan
persamaan reaksi reaksi didapat didapat perbandingan perbandingan koefisien koefisien NaOH NaOH : : CuSOCuSO44 = 2 : 1, ini = 2 : 1, ini adalah kondisi reaksi stoikiometri, dimana semua reaktan habis bereaksi dan tidak adalah kondisi reaksi stoikiometri, dimana semua reaktan habis bereaksi dan tidak
ada pereaksi pembatas. Jadi, kondisi di saat
ada pereaksi pembatas. Jadi, kondisi di saat perbandingan molnya 2 : 1 itulah yangperbandingan molnya 2 : 1 itulah yang disebut titik stoikiometri.
disebut titik stoikiometri.
Titik stoikiometri bisa dilihat dari grafik, bisa berupa maksimum atau titik Titik stoikiometri bisa dilihat dari grafik, bisa berupa maksimum atau titik minimum. Dari grafik hasil percobaan, titik maksimum dicapai saat perbandingan minimum. Dari grafik hasil percobaan, titik maksimum dicapai saat perbandingan volume NaOH : CuSO
volume NaOH : CuSO44 = 4 : 8, dari perhitungan dengan rumus n = M x V didapat = 4 : 8, dari perhitungan dengan rumus n = M x V didapat perbandingan molnya 5 : 1. Ini bukan titik stoikiometri karena tidak sesuai dengan perbandingan molnya 5 : 1. Ini bukan titik stoikiometri karena tidak sesuai dengan perbandingan koefisien reaksi setara yaitu 2 : 1.
perbandingan koefisien reaksi setara yaitu 2 : 1.
Dari grafik, didapat dua titik minimum yaitu saat perlakuan 1 dan 2. Dari grafik, didapat dua titik minimum yaitu saat perlakuan 1 dan 2. Dimana ∆T dari ke
Dimana ∆T dari kedua perlakuan ini berharga negatif, yaitu -1dua perlakuan ini berharga negatif, yaitu -1 ooC. Nilai Tm lebihC. Nilai Tm lebih tinggi daripada Ta. Kalau misal titik minimum diasumsikan sebagai titik tinggi daripada Ta. Kalau misal titik minimum diasumsikan sebagai titik stoikiometri pada percobaan ini, maka berarti ada dua titik stoikiometri. Padahal stoikiometri pada percobaan ini, maka berarti ada dua titik stoikiometri. Padahal kalau dilihat dari hasil perhitungan, perbandingan mol pada perlakuan 1 adalah 50 kalau dilihat dari hasil perhitungan, perbandingan mol pada perlakuan 1 adalah 50 : 1 dan pada perlakuan 2 adalah 30 : 1. Ini tidak sesuai dengan perbandingan : 1 dan pada perlakuan 2 adalah 30 : 1. Ini tidak sesuai dengan perbandingan koefisien reaksi setara. Maka 2 t
koefisien reaksi setara. Maka 2 titik minimum ini bukan titik stoikiometri.itik minimum ini bukan titik stoikiometri.
Dalam grafik yang seperti ini, tampak ada penyimpangan. Ini terjadi Dalam grafik yang seperti ini, tampak ada penyimpangan. Ini terjadi karena sewaktu praktikum pada perlakuan 1 dan 2, praktikan melakukan karena sewaktu praktikum pada perlakuan 1 dan 2, praktikan melakukan kesalahan pada cara penggunaan termometer, seharusnya termometer dipegang kesalahan pada cara penggunaan termometer, seharusnya termometer dipegang pada
pada tali tali diatasnya, diatasnya, sedangkan sedangkan praktikan praktikan memegangnya memegangnya pada pada batangbatang termometernya. Ini terjadi pada saat proses penyamaan suhu larutan NaOH dan termometernya. Ini terjadi pada saat proses penyamaan suhu larutan NaOH dan CuSO
CuSO44, akibatnya pada data hasil pengamatan pada perlakuan 1 dan 2, Tm lebih, akibatnya pada data hasil pengamatan pada perlakuan 1 dan 2, Tm lebih tinggi daripada Ta. Saat mengukur suhu akhir, praktikan tidak melakukan tinggi daripada Ta. Saat mengukur suhu akhir, praktikan tidak melakukan kesalahan dalam cara penggunaan termometer, sehingga yang berpengaruh dalam kesalahan dalam cara penggunaan termometer, sehingga yang berpengaruh dalam harga ∆T yang negatif adalah Tm
harga ∆T yang negatif adalah Tm-nya. Kalau praktikan menggunakan termometer-nya. Kalau praktikan menggunakan termometer dengan benar maka harga Tm akan lebih rendah atau mungkun sama dengan Ta, dengan benar maka harga Tm akan lebih rendah atau mungkun sama dengan Ta, sehingga harga ∆T
sehingga harga ∆T-nya berharga positif atau nol.-nya berharga positif atau nol.
Karena titik maksimum bukan titik stoikiometri dan 2 titik minimum juga Karena titik maksimum bukan titik stoikiometri dan 2 titik minimum juga bukan
bukan titik titik stoikiometri, stoikiometri, maka maka berdasarkan berdasarkan perbandingan perbandingan mol, mol, diketahui diketahui bahwabahwa titik stoikiometri terjadi saat perbandingan volume NaOH : CuSO
titik stoikiometri terjadi saat perbandingan volume NaOH : CuSO44 = 2 : 10 yakni = 2 : 10 yakni pada
minimum
minimum, maka berarti ada 2 titik minimum, karena yang harga ∆T = 0, maka berarti ada 2 titik minimum, karena yang harga ∆T = 0ooC tidakC tidak hanya pada perlakuan ke-9, tapi juga pada perlakuan ke-3 saat perbandingan hanya pada perlakuan ke-9, tapi juga pada perlakuan ke-3 saat perbandingan volume NaOH : CuSO
volume NaOH : CuSO44 = 8 : 4. Titik pada perlakuan ke-3 tidak dikatakan sebagai = 8 : 4. Titik pada perlakuan ke-3 tidak dikatakan sebagai
titik stoikiometri karena perbandingan molnya 20 : 1, ini tidak sesuai dengan titik stoikiometri karena perbandingan molnya 20 : 1, ini tidak sesuai dengan perbandingan
perbandingan pada pada koefisien koefisien reaksi reaksi setara. setara. Titik Titik pada pada perlakuan perlakuan ke-9 ke-9 dikatakandikatakan sebagai titik stoikiometri karena perbandingan molnya 2 : 1 dan ini sesuai dengan sebagai titik stoikiometri karena perbandingan molnya 2 : 1 dan ini sesuai dengan perbandingan koefisien pada reaksi setara.
perbandingan koefisien pada reaksi setara.
Untuk membuktikan bahwa perlakuan ke-9 adalah kondisi dimana te
Untuk membuktikan bahwa perlakuan ke-9 adalah kondisi dimana te rdapatrdapat titik stoikiometri, dapat diuji dengan menggunakan salah satu hukum stoikiometri, titik stoikiometri, dapat diuji dengan menggunakan salah satu hukum stoikiometri, Hukum Kekekalan Massa, yaitu massa sebelum reaksi = massa sesudah reaksi. Hukum Kekekalan Massa, yaitu massa sebelum reaksi = massa sesudah reaksi. Dengan menggunakan hukum ini, dapat terlihat jelas bahwa titik maksimum (saat Dengan menggunakan hukum ini, dapat terlihat jelas bahwa titik maksimum (saat perbandingan
perbandingan volume volume NaOH NaOH : : CuSOCuSO44 = 4 : 8) dan 2 titik minimum (saat = 4 : 8) dan 2 titik minimum (saat
perbandingan volume
perbandingan volume NaOH NaOH : : CuSOCuSO44 = 50 :1 dan 30 : 1) pada grafik, bukanlah = 50 :1 dan 30 : 1) pada grafik, bukanlah
titik stoikiometri. Dengan menggunakan perhitungan n = M x V dan massa = n x titik stoikiometri. Dengan menggunakan perhitungan n = M x V dan massa = n x Mr, diketahui bahwa pada titik maksimum (perlakuan ke-7), massa sebelum reaksi Mr, diketahui bahwa pada titik maksimum (perlakuan ke-7), massa sebelum reaksi = massa sesudah reaksi. Massa sebelum reaksi = massa NaOH + massa CuSO = massa sesudah reaksi. Massa sebelum reaksi = massa NaOH + massa CuSO44 = =
0,2876 g, sedangkan massa sesudah reaksi = massa Na
0,2876 g, sedangkan massa sesudah reaksi = massa Na22SOSO44 + massa Cu(OH) + massa Cu(OH)22 ++
massa NaOH berlebih = 0,2876 g. Ini terjadi karena reaksi ini bukan reaksi massa NaOH berlebih = 0,2876 g. Ini terjadi karena reaksi ini bukan reaksi stoikiometri karena terdapat pembatas yaitu CuSO
stoikiometri karena terdapat pembatas yaitu CuSO44 sehingga ada NaOH yang sehingga ada NaOH yang
berlebih sebanyak 0,288 g berlebih sebanyak 0,288 g..
Walaupun massa sebelum reaksi = massa sesudah reaksi, tetapi reaksi ini Walaupun massa sebelum reaksi = massa sesudah reaksi, tetapi reaksi ini bukan merupakan
bukan merupakan reaksi reaksi stoikiometri, stoikiometri, karena tidak karena tidak semua semua reaktan reaktan habis habis bereaksi.bereaksi. Dan juga tidak dapat dikatakan sebagai titik stoikiometri karena perbandingan mol Dan juga tidak dapat dikatakan sebagai titik stoikiometri karena perbandingan mol pada reaksi yang tidak sesuai dengan perband
pada reaksi yang tidak sesuai dengan perbandingan pada koefisien reaksi.ingan pada koefisien reaksi.
Perlakuan ke-9 sebagai titik stoikiometri menunjukkan hasil perhitungan Perlakuan ke-9 sebagai titik stoikiometri menunjukkan hasil perhitungan massa yang sesuai dengan Hukum Kekekalan Massa. Massa sebelum reaksi = massa yang sesuai dengan Hukum Kekekalan Massa. Massa sebelum reaksi = 0,2395 g dan massa sesudah reaksi = 0,2395 g. Ini sesuai karena semua reaktan 0,2395 g dan massa sesudah reaksi = 0,2395 g. Ini sesuai karena semua reaktan habis bereaksi, tidak ada pereaksi pembatas sehingga tidak ada reaktan yang habis bereaksi, tidak ada pereaksi pembatas sehingga tidak ada reaktan yang tersisa pada akhir reaksi.
2.
2. Stoikiometri Sistem Asam Kuat-Basa Kuat (HCl-NaOH)Stoikiometri Sistem Asam Kuat-Basa Kuat (HCl-NaOH)
Dari hasil pengamatan, bila HCl bereaksi dengan NaOH, maka akan Dari hasil pengamatan, bila HCl bereaksi dengan NaOH, maka akan menghasilkan NaCl dan H
menghasilkan NaCl dan H22O dengan persamaan reaksi sebagai berikut:O dengan persamaan reaksi sebagai berikut: NaOH (aq) + HCl (aq)
NaOH (aq) + HCl (aq) NaCl (aq) + HNaCl (aq) + H22O (O (l l ))
Koefisien dari reaksi setara tersebut menunjukkan jumlah mol yang merupakan Koefisien dari reaksi setara tersebut menunjukkan jumlah mol yang merupakan titik stoikiometri pada reaksi tersebut, karena volume reaktan pada 5 perlakuan titik stoikiometri pada reaksi tersebut, karena volume reaktan pada 5 perlakuan berbeda,
berbeda, maka maka perubahan perubahan volume volume tersebut tersebut dapat dapat digunakan digunakan untuk untuk meramalkanmeramalkan stoikiometri sistem untuk mendapatkan perbandingan jumlah mol dengan stoikiometri sistem untuk mendapatkan perbandingan jumlah mol dengan menggunakan rumus mol = Molaritas x Volume. Diketahui titik stoikiometri menggunakan rumus mol = Molaritas x Volume. Diketahui titik stoikiometri terjadi saat perbandingan volume HCl : NaOH = 6 : 6, dan perbandingan molnya terjadi saat perbandingan volume HCl : NaOH = 6 : 6, dan perbandingan molnya 1 : 1, ini sesuai dengan perbandingan koefisien reaksi, yaitu 1 : 1.
1 : 1, ini sesuai dengan perbandingan koefisien reaksi, yaitu 1 : 1.
Dari grafik hasik pengamatan, titik ini merupakan titik maksimum yang Dari grafik hasik pengamatan, titik ini merupakan titik maksimum yang terjadi pada ∆T = 1,25
terjadi pada ∆T = 1,25ooC. Titik stoikiometri tidak terdapat pada titik minimum,C. Titik stoikiometri tidak terdapat pada titik minimum, karena pada grafik, titik minimum terjadi saat perlakuan 2 dan 5, dimana kedua karena pada grafik, titik minimum terjadi saat perlakuan 2 dan 5, dimana kedua perlakuan
perlakuan itu itu perbandingan perbandingan volume volume NaOH NaOH : : HCl HCl berturut-turut berturut-turut 7 7 : : 5 5 dan dan 4 4 : : 88 yang perbandingan molnya berturut-turut 7 : 5 dan 1 : 2. Ini tidak sesuai dengan yang perbandingan molnya berturut-turut 7 : 5 dan 1 : 2. Ini tidak sesuai dengan koefisian reaksi setara yaitu 1 : 1.
koefisian reaksi setara yaitu 1 : 1.
Dengan menggunakan Hukum Kekekalan Massa, diketahui bahwa pada Dengan menggunakan Hukum Kekekalan Massa, diketahui bahwa pada reaksi yang terjadi saat perlakuan ke-3, massa sebelum reaksi = massa sesudah reaksi yang terjadi saat perlakuan ke-3, massa sebelum reaksi = massa sesudah reaksi yaitu 0,459 g. Pada reaksi ini semua reaktan habis bereaksi, tidak ada reaksi yaitu 0,459 g. Pada reaksi ini semua reaktan habis bereaksi, tidak ada pereaksi pembatas, ini disebut reaksi stoikiometri.
pereaksi pembatas, ini disebut reaksi stoikiometri.
3.
3. Stoikiometri Sistem Asam Kuat-Basa Kuat (HStoikiometri Sistem Asam Kuat-Basa Kuat (H22SOSO44-NaOH)-NaOH)
Berdasarkan data yang diperoleh, reaksi antara NaOH dan H
Berdasarkan data yang diperoleh, reaksi antara NaOH dan H22SOSO44 adalahadalah sebagai berikut:
sebagai berikut:
2NaOH (aq)
2NaOH (aq) + H+ H22SOSO44(aq)(aq) Na Na22SOSO44(aq) + 2H(aq) + 2H22O (O (l l ))
Dari perhitungan secara teoretis, dengan melihat perbandingan koefisien yang Dari perhitungan secara teoretis, dengan melihat perbandingan koefisien yang merupakan juga perbandingan mol reaksi, maka perbandingannya adalah 2 : 1. merupakan juga perbandingan mol reaksi, maka perbandingannya adalah 2 : 1. Jika diimplikasikan pada larutan masing-masing berkonsentrasi 1M, Jika diimplikasikan pada larutan masing-masing berkonsentrasi 1M, menyesuaikan volume pada percobaan sebelumnya dengan mengadopsi skala menyesuaikan volume pada percobaan sebelumnya dengan mengadopsi skala
perbandingan volume
perbandingan volume reaksi, reaksi, didapat pada didapat pada volume 8 volume 8 : 4 : 4 pada perlakuan pada perlakuan ke-1 ke-1 daridari kegiatan 2. Keterangan lebih lanjut dapat dilihat pada lampiran.
kegiatan 2. Keterangan lebih lanjut dapat dilihat pada lampiran.
VI. KESIMPULAN VI. KESIMPULAN
Berdasarkan penelitian yang telah peneliti lakukan, dapat diambil Berdasarkan penelitian yang telah peneliti lakukan, dapat diambil kesimpulan sebagai berikut:
kesimpulan sebagai berikut: 1.
1. Metode variasi kontinu pada percobaan stoikiometri sistem NaOH-CuSOMetode variasi kontinu pada percobaan stoikiometri sistem NaOH-CuSO44 dan stoikiometri sistem NaOH-HCl merupakan pengamatan kuantitatif antara dan stoikiometri sistem NaOH-HCl merupakan pengamatan kuantitatif antara molaritas dengan volume yang bervariasi dan suhu untuk mengetahui titik molaritas dengan volume yang bervariasi dan suhu untuk mengetahui titik stoikiometri sistem.
stoikiometri sistem. 2.
2. Pada stoikiometri sistem CuSOPada stoikiometri sistem CuSO4-4- NaOH, NaOH, titik titik stoikiometri stoikiometri terdapat terdapat padapada perbandingan volume NaOH : CuSO
perbandingan volume NaOH : CuSO44 = 2 : = 2 : 10 dengan perbandingan mol = 2 :10 dengan perbandingan mol = 2 : 1 yang sesuai dengan koefisien reaksi :
1 yang sesuai dengan koefisien reaksi : 2NaOH (aq) + CuSO
2NaOH (aq) + CuSO44(aq) (aq) NaNa22SOSO44(aq) + Cu(OH)(aq) + Cu(OH)22(aq)(aq) 3.
3. Pada stoikiometri sistem HCl-NaOH, titik stoikiometri terdapat padaPada stoikiometri sistem HCl-NaOH, titik stoikiometri terdapat pada perbandingan
perbandingan volume volume NaOH NaOH : : HCl HCl = = 6 6 : : 6 6 dengan dengan perbandingan perbandingan mol mol 1 1 : : 11 yang sesuai dengan koefisien reaksi:
yang sesuai dengan koefisien reaksi: NaOH (aq) + HCl (aq)
NaOH (aq) + HCl (aq) NaCl (aq) + HNaCl (aq) + H22O (O (l l )) 4.
4. Pada stoikiometri sistem HPada stoikiometri sistem H22SOSO44-NaOH, titik stoikiometri terdapat pada-NaOH, titik stoikiometri terdapat pada perbandingan volume
perbandingan volume NaOH : NaOH : HH22SOSO44= 8 : 4 dengan perbandingan mol 2 : 1= 8 : 4 dengan perbandingan mol 2 : 1 yang sesuai dengan koefisien reaksi :
yang sesuai dengan koefisien reaksi : 2NaOH (aq)
2NaOH (aq) + H+ H22SOSO44(aq)(aq) Na Na22SOSO44(aq) + 2H(aq) + 2H22O (O (l l )) 5.
5. Pada titik stoikiometri yang sesuai dengan koefisian reaksi, maka reaksi iniPada titik stoikiometri yang sesuai dengan koefisian reaksi, maka reaksi ini disebut reaksi stoikiometri, dimana semua reaktan habis bereaksi tanpa disebut reaksi stoikiometri, dimana semua reaktan habis bereaksi tanpa adanya reaktan berlebih dan pereaksi pembatas. Sehingga massa sebelum adanya reaktan berlebih dan pereaksi pembatas. Sehingga massa sebelum reaksi = massa sesudah reaksi. Namun, pada titik bukan stoikiometri, ternyata reaksi = massa sesudah reaksi. Namun, pada titik bukan stoikiometri, ternyata juga
juga berlaku berlaku hukum hukum kekekalan kekekalan massa. massa. Jadi Jadi yang yang menentukan menentukan titiktitik stoikiometri adalah perbandingan mol dengan perbandingan koefisien reaksi. stoikiometri adalah perbandingan mol dengan perbandingan koefisien reaksi.
6.
6. Kalau kedua reaktan konsentrasinya sama maka titik stoikiometri adalah titikKalau kedua reaktan konsentrasinya sama maka titik stoikiometri adalah titik saat perbandingan volume = perbandingan koefisien.
saat perbandingan volume = perbandingan koefisien. 7.
7. Kalau kedua reaktan mempunyai konsentrasi berbeda, maka titik stoikiometriKalau kedua reaktan mempunyai konsentrasi berbeda, maka titik stoikiometri adalah titik saat perbandingan mol = perbandingan koefisien.
adalah titik saat perbandingan mol = perbandingan koefisien. 8.
8. Hubungan antara volume sistem dengan perubahan suhu adalah semakinHubungan antara volume sistem dengan perubahan suhu adalah semakin besar
besar selisih selisih antara antara volume volume dari dari kedua kedua larutan larutan tersebut tersebut yang yang akanakan dicampurkan berdasarkan perbandingan koefisien mol reaksi dalam dicampurkan berdasarkan perbandingan koefisien mol reaksi dalam konentrasi larutan, maka semakin kecil pula suhu campuran yang dihasilkan. konentrasi larutan, maka semakin kecil pula suhu campuran yang dihasilkan. Semakin kecil selisih antara volume dari kedua larutan yang akan Semakin kecil selisih antara volume dari kedua larutan yang akan dicampurkan berdasarkan perbandingan koefisien mol reaksi dalam dicampurkan berdasarkan perbandingan koefisien mol reaksi dalam konsentrasi larutan, maka semakin besar suhu campuran yang dihasilkan konsentrasi larutan, maka semakin besar suhu campuran yang dihasilkan menimbang kalor yang berlaku. Bahkan, jika tidak ada selisih diantara menimbang kalor yang berlaku. Bahkan, jika tidak ada selisih diantara keduanya, maka suhu umumnya mencapai titik maksimum dan terjadi reaksi keduanya, maka suhu umumnya mencapai titik maksimum dan terjadi reaksi stoikiometri. Umumnya berlaku pada reaksi koefisien 1 : 1, untuk stoikiometri. Umumnya berlaku pada reaksi koefisien 1 : 1, untuk perbandingan
perbandingan koefisien koefisien yang yang lebih lebih kompleks, kompleks, maka maka reaksi reaksi mendekati mendekati padapada koefisien reaksi yang terlihat.
koefisien reaksi yang terlihat. 9.
9. Titik stoikiometri merupakan titik dengan indikasi suatu sistem mengalamiTitik stoikiometri merupakan titik dengan indikasi suatu sistem mengalami perubahan suhu maksimumnya. Pada saat
perubahan suhu maksimumnya. Pada saat itu, terjadi itu, terjadi reaksi stoikiometri reaksi stoikiometri yaituyaitu reaksi yang seluruh reaktannya habis bereaksi pada prosesnya membentuk reaksi yang seluruh reaktannya habis bereaksi pada prosesnya membentuk produk
produk baru baru dengan dengan tidak tidak meninggalkan meninggalkan sisa sisa pereaksi pereaksi (tidak (tidak ada ada pereaksipereaksi pembatas).
pembatas). Reaksi Reaksi stoikiometri stoikiometri berarti berarti menyamakan menyamakan jumlah jumlah molekul molekul atomatom unsur dengan mol yang menyamakan jumlah mol. Reaksi dengan perubahan unsur dengan mol yang menyamakan jumlah mol. Reaksi dengan perubahan materi yang mengaitkan perubahan energi (kalor) terbesar.
materi yang mengaitkan perubahan energi (kalor) terbesar. 10.
10. Suatu reaksi dikatakan sebagai reaksi sistem stoikiometri jika pereaksiSuatu reaksi dikatakan sebagai reaksi sistem stoikiometri jika pereaksi pembatas dalam siste
pembatas dalam sistem tersebut habis m tersebut habis bereaksi (tidak bersisbereaksi (tidak bersisa), sedangkan jikaa), sedangkan jika pereaksi
pereaksi pembatas pembatas tidak tidak habis habis bereaksi bereaksi (bersisa) (bersisa) maka maka disebut disebut dengan rdengan reaksieaksi sistem non-stoikiometri.
VII. DAFTAR PUSTAKA VII. DAFTAR PUSTAKA
Achmad, H dan Tupamahu. 1991.
Achmad, H dan Tupamahu. 1991. Stoikiometri Energitika Kimia.Stoikiometri Energitika Kimia. Bandung: PTBandung: PT Citra Aditya Bakti.
Citra Aditya Bakti. Achmad, H. 1993.
Achmad, H. 1993. Penuntun Dasar-Dasar Praktikum Kimia Penuntun Dasar-Dasar Praktikum Kimia. Bandung: ITB.. Bandung: ITB. Brady, J. E. 1994.
Brady, J. E. 1994. Kimia Universitas Jilid 1 dan 5. Kimia Universitas Jilid 1 dan 5.Jakarta: Erlangga.Jakarta: Erlangga. Chang, R. 2003.
Chang, R. 2003. Kimia Dasar I Konsep-Konsep Inti Jilid I. Kimia Dasar I Konsep-Konsep Inti Jilid I. Jakarta: Erlangga.Jakarta: Erlangga. Dosen-Dosen Kimia di Perguruan Tinggi Indonesia Wilayah Barat. 1994. Dosen-Dosen Kimia di Perguruan Tinggi Indonesia Wilayah Barat. 1994.
Penuntun Praktikum Kimia Dasar.
Penuntun Praktikum Kimia Dasar. Bandung: ITB.Bandung: ITB. Keenan, dkk. 1987.
Keenan, dkk. 1987. Kimia Kimia untuk untuk Universitas Universitas Jilid Jilid I I Edisi Edisi ke ke Enam.Enam. Jakarta:Jakarta: Erlangga.
Erlangga. Rahardjo, S.B. 2008.
Rahardjo, S.B. 2008. Kimia Berbasis Eksperimen. Kimia Berbasis Eksperimen.Solo: Platinum.Solo: Platinum. Rivai, H. 1994.
Rivai, H. 1994. Asas Pemeriksaan Kimia. Asas Pemeriksaan Kimia.Jakarta: UI-Press.Jakarta: UI-Press. Syahmani. 2010.
Syahmani. 2010. Panduan Praktikum Kimia Panduan Praktikum Kimia Dasar.Dasar. Banjarmasin: Program StudiBanjarmasin: Program Studi Pendidikan Kimia FKIP UNLAM.
Pendidikan Kimia FKIP UNLAM. Syukri, S. 1999.
Syukri, S. 1999. Kimia Dasar I. Kimia Dasar I. Bandung: ITB.Bandung: ITB.
LAMPIRAN LAMPIRAN
1.
1. Gambar PercobaanGambar Percobaan 1.1
1.1 Stoikiometri sistemStoikiometri sistem --
Mengukur Volume NaOH dan Mengukur Volume NaOH dan CuSO
CuSO44yang akan direaksikan.yang akan direaksikan.
Memasukkan NaOH dan Memasukkan NaOH dan CuSO
CuSO44 ke dalam masing-ke dalam masing-masing gelas kimia.
masing gelas kimia.
Menyamakan temperatur awal Menyamakan temperatur awal NaOH dan CuSO
Mencampurkan NaOH dan Mencampurkan NaOH dan CuSO
CuSO44 sambil diaduksambil diaduk
Mengukur suhu tertinggi pada Mengukur suhu tertinggi pada campuran (sebagai temperatur campuran (sebagai temperatur akhir).
akhir).
Hasil pencampuran NaOH dan Hasil pencampuran NaOH dan CuSO
CuSO44, berwarna biru muda, berwarna biru muda dengan sedikit endapan.
1.2
1.2 Stoikiometri sistem asam kuat-basa kuatStoikiometri sistem asam kuat-basa kuat--
Mengukur Volume NaOH dan Mengukur Volume NaOH dan HCl
HCl yang akan direaksikan.yang akan direaksikan.
Memasukkan NaOH dan HCl Memasukkan NaOH dan HCl ke dalam masing-masing gelas ke dalam masing-masing gelas kimia.
kimia.
Menyamakan temperatur awal Menyamakan temperatur awal NaOH dan HCl.
Mencampurkan NaOH dan Mencampurkan NaOH dan HCl
HCl sambil diaduksambil diaduk
Mengukur suhu tertinggi Mengukur suhu tertinggi pada
pada campuran campuran (sebagai(sebagai temperatur akhir).
temperatur akhir).
Hasil pencampuran
Hasil pencampuran dan
dan , , berwarnaberwarna bening.
2.
2. Grafik StoikiometriGrafik Stoikiometri 2.1
2.1 Grafik stoikiometri sistemGrafik stoikiometri sistem --
2.2
2.2 Grafik stoikiometri sistem asam kuat-basa kuatGrafik stoikiometri sistem asam kuat-basa kuat-- -1.5 -1.5 -1 -1 -0.5 -0.5 0 0 0.5 0.5 1 1 1.5 1.5 2 2 1 100 99 88 77 66 55 44 33 22 P P e e r r u u b b a a h h a a n n S S u u h h u u Volume NaOH Volume NaOH Stoikiometri Sistem NaOH-CuSO4
Stoikiometri Sistem NaOH-CuSO4
2 2 3 3 4 4 5 5 6 6 7 7 8 8 9 9 1010 Volume CuSO Volume CuSO44 0 0 0.2 0.2 0.4 0.4 0.6 0.6 0.8 0.8 1 1 1.2 1.2 1.4 1.4 8 7 6 5 4 8 7 6 5 4 P P e e r r u u b b a a h h a a n n S S u u h h u u Volume NaOH Volume NaOH
Stoikiometri Sistem NaOH-HCl Stoikiometri Sistem NaOH-HCl
4
4 5 5 6 6 7 7 88 Volume HCl
3.
3. Perhitungan StoikiometriPerhitungan Stoikiometri 3.1
3.1 Stoikiometri sistemStoikiometri sistem --
Perbandingan mol dengan menggunakan rumus
Perbandingan mol dengan menggunakan rumus
NO.
NO. M M NaOHNaOH
(ℓ) (ℓ) CuSO4 CuSO4 (ℓ) (ℓ) Mol Mol NaOH NaOH Mol Mol CuSO4 CuSO4 Perbandingan Perbandingan Mol Mol 1 1 1 1 0,1 0,1 0,01 0,01 0,002 0,002 0,01 0,01 0,0002 0,0002 50 50 : : 11 2 2 1 1 0,1 0,1 0,009 0,009 0,003 0,003 0,009 0,009 0,0003 0,0003 30 30 : : 11 3 3 1 1 0,1 0,1 0,008 0,008 0,004 0,004 0,008 0,008 0,0004 0,0004 20 20 : : 11 4 4 1 1 0,1 0,1 0,007 0,007 0,005 0,005 0,007 0,007 0,0005 0,0005 14 14 : : 11 5 5 1 1 0,1 0,1 0,006 0,006 0,006 0,006 0,006 0,006 0,0006 0,0006 10 10 : : 11 6 6 1 1 0,1 0,1 0,005 0,005 0,007 0,007 0,005 0,005 0,0007 0,0007 1 1 : : 1414 7 7 1 1 0,1 0,1 0,004 0,004 0,008 0,008 0,004 0,004 0,0008 0,0008 5 5 : : 11 8 8 1 1 0,1 0,1 0,00,003 03 0,009 0,009 0,003 0,003 0,0009 0,0009 10 10 : : 33 9 1 9 1 0,1 0,1 0,002 0,002 0,01 0,01 0,002 0,002 0,001 0,001 2 2 : : 11 Persamaan reaksi : Persamaan reaksi : 2 2
Koefisien dari reaksi setara di atas menunjukkan jumlah mol yang Koefisien dari reaksi setara di atas menunjukkan jumlah mol yang merupakan titik stoikiometri. Dari koefisien tersebut, dapat diketahui bahwa titik merupakan titik stoikiometri. Dari koefisien tersebut, dapat diketahui bahwa titik stoikiometri terjadi jika perbandingan volume atau mol
stoikiometri terjadi jika perbandingan volume atau mol : : = 2 : 1. = 2 : 1. Perhitungan massa (Titik Stoikiometri) :
Perhitungan massa (Titik Stoikiometri) : Mr Mr = 40g/mol ; = 40g/mol ; Mr Mr= 159,5g/mol ;= 159,5g/mol ; Mr Mr= 142g/mol ;= 142g/mol ; Mr Mr= 97,5g/mol= 97,5g/mol 2 2 M
M : : 0,002 0,002 mol mol 0,001 0,001 mol mol - - --R
S
S : : - - - - 0,001 0,001 mol mol 0,001 0,001 molmol
bertindak sebagai pereaksi pembatas, karena mempunyai nilai mol yang bertindak sebagai pereaksi pembatas, karena mempunyai nilai mol yang
kecil dibandingkan
kecil dibandingkan .. Massa
Massa == , dengan rumus dasar, dengan rumus dasar
= 0,002 mol
= 0,002 mol 40g/mol 40g/mol = 0,08g
= 0,08g Massa
Massa ==
= 0,001 mol
= 0,001 mol 159,5g/mol 159,5g/mol = 0,1595g
= 0,1595g Massa
Massa ==
= 0,001mol
= 0,001mol 142g/mol 142g/mol = 0,142g
= 0,142g Massa
Massa == = 0,001 mol
= 0,001 mol 97,5g/mol 97,5g/mol = 0,0975g
= 0,0975g Massa
Massa pereaksi pereaksi = = massa massa hasil hasil pereaksipereaksi (0,08
(0,080,1595)g 0,1595)g = = (0,142(0,1420,0975)g0,0975)g 0,2395g
0,2395g = = 0,2395g0,2395g
Perhitungan Massa (Titik Maksimum dan Minimum) Perhitungan Massa (Titik Maksimum dan Minimum) a.
a. Titik MaksimumTitik Maksimum
2NaOH (aq)
2NaOH (aq) ++ CuSOCuSO44 (aq) (aq) NaNa22SOSO44(aq) +(aq) +Cu(OH)Cu(OH)22 (aq) (aq) Mula-mula
Mula-mula : : 0,004 0,004 mol mol 0,0008 0,0008 mol mol - - --Reaksi
Reaksi : : 0,0016 0,0016 mol mol 0,0008 0,0008 mol mol 0,0008 mol 0,0008 mol 0,0008 0,0008 molmol Setimbang
Setimbang : : 0,0024 0,0024 mol mol - - 0,0008 0,0008 mol mol 0,0008 0,0008 molmol
Massa Massa == = 0,004 mol = 0,004 mol 40 g. 40 g. = 0,16 g = 0,16 g Massa Massa ==
= = 0,0008 0,0008 molmol 159,5 g. 159,5 g. = 0,1276 g = 0,1276 g Massa Massa == = 0,0008 mol = 0,0008 mol 142 g. 142 g. = 0,1136 g = 0,1136 g Massa Massa == = 0,0008 mol = 0,0008 mol 97,5 g. 97,5 g. = 0,078 g = 0,078 g berlebih berlebih == = 0,0024 mol = 0,0024 mol 40 g. 40 g. = 0,096 g = 0,096 g Massa
Massa sebelum sebelum reaksi reaksi = = Massa Massa sesudah sesudah reaksireaksi 0,16 g
0,16 g 0,1276 0,1276 g g = = 0,1136 g0,1136 g 0,078 g 0,078 g 0,096 g 0,096 g 0,2876
0,2876 g g = = 0,2876 0,2876 gg
b.
b. Titik Minimum Perlakuan 1Titik Minimum Perlakuan 1
2NaOH (aq) + CuSO
2NaOH (aq) + CuSO44 (aq) (aq) NaNa22SOSO44 + Cu(OH) + Cu(OH)22 (aq) (aq)
Mula-mula
Mula-mula : : 0,01 0,01 mol mol 0,0002 0,0002 mol mol - - --Reaksi
Reaksi : : 0,0004 0,0004 mol mol 0,0002 0,0002 mol mol 0,0002 0,0002 mol mol 0,0002 0,0002 molmol Setimbang
Setimbang : : 0,0096 0,0096 mol mol - - 0,0002 0,0002 mol mol 0,0002 0,0002 molmol
Massa Massa == = 0,01 mol = 0,01 mol 40 g. 40 g. = 0,4 g = 0,4 g Massa Massa == = 0,0002 mol = 0,0002 mol 159,5 g. 159,5 g. = 0,0319 g = 0,0319 g Massa Massa == = 0,0002 mol = 0,0002 mol 142 g. 142 g. = 0,0284 g = 0,0284 g Massa Massa ==
= = 0,0002 0,0002 molmol 97,5 g. 97,5 g. = 0,0195 g = 0,0195 g berlebih berlebih == = 0,0096 mol = 0,0096 mol 40 g. 40 g. = 0,384 g = 0,384 g Massa
Massa sebelum sebelum reaksi reaksi = = Massa Massa sesudah sesudah reaksireaksi 0,4 g
0,4 g 0,0319 0,0319 g g = = 0,028 0,028 gg 0,0195 g 0,0195 g 0,384 g 0,384 g 0,4319
0,4319 g g = = 0,4319 0,4319 gg
c.
c. Titik Minimum Perlakuan 2Titik Minimum Perlakuan 2
2NaOH (aq) + CuSO
2NaOH (aq) + CuSO44 (aq) (aq) NaNa22SOSO44 (aq) + Cu(OH) (aq) + Cu(OH)22 (aq) (aq) Mula-mula
Mula-mula : : 0,009 0,009 mol mol 0,0003 0,0003 mol mol - - --Reaksi
Reaksi : : 0,0006 0,0006 mol mol 0,0003 0,0003 mol mol 0,0003 0,0003 mol mol 0,0003 0,0003 molmol Setimbang
Setimbang : : 0,0084 0,0084 mol mol - - 0,0003 0,0003 mol mol 0,0003 0,0003 molmol
Massa Massa == = 0,009 mol = 0,009 mol 40 g. 40 g. = 0,36 g = 0,36 g Massa Massa == = 0,0003 mol = 0,0003 mol 159,5 g. 159,5 g. = 0,04785 g = 0,04785 g Massa Massa == = 0,0003 mol = 0,0003 mol 142 g. 142 g. = 0,0426 g = 0,0426 g Massa Massa == = 0,0003 mol = 0,0003 mol 97,5 g. 97,5 g. = 0,02925 g = 0,02925 g berlebih berlebih == = 0,0084 mol = 0,0084 mol 40 g. 40 g. = 0,336 g = 0,336 g Massa
0,36 g
0,36 g 0,04785 0,04785 g g = = 0,0426 g0,0426 g 0,02925 g 0,02925 g 0,336 g 0,336 g 0,4078
0,4078 g g = = 0,4078 0,4078 gg
3.2
3.2 Stoikiometri sistem asam kuat-basa kuatStoikiometri sistem asam kuat-basa kuat-- Perbandingan mol dengan menggunakan rumus
Perbandingan mol dengan menggunakan rumus
NO.
NO. M M NaOHNaOH
(ℓ) (ℓ) HCl HCl (ℓ) (ℓ) Mol Mol NaOH NaOH Mol Mol HCl HCl Perbandingan Perbandingan mol mol 1 1 1 1 0,008 0,008 0,004 0,004 0,008 0,008 0,004 0,004 2 2 : : 11 2 2 1 1 0,007 0,007 0,005 0,005 0,007 0,007 0,005 0,005 7 7 : : 55 3 3 1 1 0,006 0,006 0,006 0,006 0,006 0,006 0,006 0,006 1 1 : : 11 4 4 1 1 0,005 0,005 0,007 0,007 0,005 0,005 0,007 0,007 5 5 : : 77 5 5 1 1 0,004 0,004 0,008 0,008 0,004 0,004 0,008 0,008 1 1 : : 22 Persamaan reaksi : Persamaan reaksi : M
M : : 0,006 0,006 mol mol 0,006 0,006 mol mol - - --R
R : 0,006 : 0,006 mol mol 0,006 0,006 mol mol 0,006 0,006 mol mol 0,006 0,006 molmol
S :
S : - - - - 0,006 0,006 mol mol 0,006 0,006 molmol Massa
Massa == , dengan rumus dasar, dengan rumus dasar = 0,006 mol
= 0,006 mol 40g/mol 40g/mol = 0,24g
= 0,24g Massa
Massa == = 0,006 mol
= 0,006 mol 36,5g/mol 36,5g/mol = 0,219g
= 0,219g Massa
Massa == = 0,006 mol
= 0,006 mol 58,5g/mol 58,5g/mol = 0,351g
= 0,351g Massa
Massa == = 0,006 mol
= 0,108g = 0,108g Massa
Massa pereaksi pereaksi = = massa massa hasil hasil pereaksipereaksi (0,24
(0,240,219)g 0,219)g = = (0,351(0,3510,108)g0,108)g 0,459g
0,459g = = 0,459g0,459g
3.3
3.3 Stoikiometri sistem asam kuat-basa kuatStoikiometri sistem asam kuat-basa kuat--))
Perbandingan mol dengan menggunakan rumus
Perbandingan mol dengan menggunakan rumus
, data volume, data volume pada sistem ini = data volume pada sistem ini = data volume
pada sistem asam basa ( pada sistem asam basa (-- , data volume, data volume pada sistem ini pada sistem ini
= data volume
= data volume pada sistem asam basa ( pada sistem asam basa (-- .. NO.
NO. M M NaOHNaOH (ℓ) (ℓ) H2SO4 H2SO4 (ℓ) (ℓ) Mol Mol NaOH NaOH H2SO4 H2SO4 Mol Mol Perbandingan Perbandingan mol mol 1 1 1 1 0,008 0,008 0,004 0,004 0,008 0,008 0,004 0,004 2 2 : : 11 2 1 2 1 0,007 0,007 0,005 0,005 0,007 0,007 0,005 0,005 7 7 : : 55 3 1 3 1 0,006 0,006 0,00,006 06 0,006 0,006 0,006 0,006 1 1 : : 11 4 1 4 1 0,005 0,005 0,00,007 07 0,005 0,005 0,007 0,007 5 5 : : 77 5 1 5 1 0,004 0,004 0,00,008 08 0,004 0,004 0,008 0,008 1 1 : : 22 Persamaan reaksi : Persamaan reaksi : Koefisien dari reaksi setara di atas menunjukkan jumlah mol yang Koefisien dari reaksi setara di atas menunjukkan jumlah mol yang merupakan titik stoikiometri. Dari koefisien tersebut dapat diketahui bahwa titik merupakan titik stoikiometri. Dari koefisien tersebut dapat diketahui bahwa titik stoikiometri terjadi jika p
stoikiometri terjadi jika perbandingan verbandingan volume atau mol olume atau mol :: = 2 : 1. = 2 : 1. Perhitungan massa (Titik Stoikiometri) :
Perhitungan massa (Titik Stoikiometri) :
= 40g/mol ; = 40g/mol ; = 98g/mol ; = 98g/mol ; = 142g/mol ; dan= 142g/mol ; dan
= 18g/mol = 18g/mol
M
M : : 0,008 0,008 mol mol 0,004 mol 0,004 mol - - --R
R : 0,008 : 0,008 mol mol 0,004 0,004 mol mol 0,004 0,004 mol mol 0,008 0,008 mol mol --S
Massa
Massa == , dengan rumus dasar, dengan rumus dasar
= 0,008 mol
= 0,008 mol 40g/mol 40g/mol
= 0,32g = 0,32g Massa
Massa ==
= 0,004 mol
= 0,004 mol 98g/mol 98g/mol
= 0,392g = 0,392g Massa
Massa ==
= 0,004 mol
= 0,004 mol 142g/mol 142g/mol
= 0,568g = 0,568g Massa
Massa ==
= 0,008 mol
= 0,008 mol 18g/mol 18g/mol
= 0,144g = 0,144g Massa
Massa pereaksi pereaksi = = massa massa hasil hasil reaksireaksi (0,32
(0,320,392)g 0,392)g = = (0,568(0,5680,144)g0,144)g
0,712g
0,712g = = 0,712g0,712g
4.
4. Pembuktian Reaksi Sebagai Sistem StoikiometriPembuktian Reaksi Sebagai Sistem Stoikiometri 4.1
4.1 Stoikiometri sistemStoikiometri sistem --
Berdasarkan data yang ada pada lampiran 3.1, maka untuk reaksi antara Berdasarkan data yang ada pada lampiran 3.1, maka untuk reaksi antara
dan dan , dapat dilihat sebagai berikut :, dapat dilihat sebagai berikut :
2
2
M
M : : 0,002 0,002 mol mol 0,001 0,001 mol mol - -
--R
R : 0,002 : 0,002 mol mol 0,001 0,001 mol mol 0,001 0,001 mol mol 0,001 0,001 molmol
S
S : : - - - - 0,001 0,001 mol mol 0,001 0,001 molmol
Keterangan : Keterangan :
M M : : Mula-mulaMula-mula R R : Reaksi: Reaksi S S : : SetimbangSetimbang
sebagai reaksi pembatas. sebagai reaksi pembatas.
4.2
4.2 Stoikiometri sistem asam kuat-basa kuatStoikiometri sistem asam kuat-basa kuat--
Berdasarkan data yang ada pada lampiran 3.2, maka untuk reaksi antara Berdasarkan data yang ada pada lampiran 3.2, maka untuk reaksi antara
dan dan , dapat dilihat sebagai berikut :, dapat dilihat sebagai berikut :
M
M : : 0,006 0,006 mol mol 0,006 0,006 mol mol - - --R
R : 0,006 : 0,006 mol mol 0,006 0,006 mol mol 0,006 0,006 mol mol 0,006 0,006 molmol S :
S : - - - - 0,006 0,006 mol mol 0,006 0,006 molmol Keterangan : Keterangan : M M : : Mula-mulaMula-mula R R : Reaksi: Reaksi S S : : SetimbangSetimbang
dan dan dapat bertindak sebagai reaksi pembatas. dapat bertindak sebagai reaksi pembatas.
4.3
4.3 Stoikiometri sistem asam kuat-basa kuatStoikiometri sistem asam kuat-basa kuat--
Berdasarkan data yang ada pada lampiran 3.3, maka untuk reaksi antara Berdasarkan data yang ada pada lampiran 3.3, maka untuk reaksi antara
dan dan , dapat dilihat sebagai berikut :, dapat dilihat sebagai berikut :
M
M : : 0,008 0,008 mol mol 0,004 mol 0,004 mol - - --R
R : 0,008 : 0,008 mol mol 0,004 0,004 mol mol 0,004 0,004 mol mol 0,008 0,008 mol mol --S
S : : - - - - 0,004 mol 0,004 mol 0,008 mol0,008 mol Keterangan : Keterangan : M M : : Mula-mulaMula-mula R R : Reaksi: Reaksi S S : : SetimbangSetimbang
5.
5. Flow ChartFlow Chart A.
A. Stoikiometri Sistem CuSOStoikiometri Sistem CuSO44-NaOH-NaOH
Gelas
Gelas Kimia Kimia I I Gelas Gelas Kimia Kimia 22
Nb: Nb:
-- Mengulangi dengan prosedur yang sama dengan perbandingan volume sesuaiMengulangi dengan prosedur yang sama dengan perbandingan volume sesuai tabel pengamatan.
tabel pengamatan.
-- Mencatat temperatur yang didapatkan dari percobaan tersebut.Mencatat temperatur yang didapatkan dari percobaan tersebut.
-- Membuat grafik yang menghubungkMembuat grafik yang menghubungkan volume sistem sebagai absis an volume sistem sebagai absis terhadapterhadap ∆T sebagai ordinat.
∆T sebagai ordinat.
-- Membuat kesimpulan mengenai stoikiometri sistem tersebut.Membuat kesimpulan mengenai stoikiometri sistem tersebut. 10
10 mL mL NaOH NaOH 1 1 M M 2 2 mL mL CuSOCuSO44 0,1M 0,1M
Menyamakan temperatur dengan Menyamakan temperatur dengan mencelupkan gelas kimia yang berisi mencelupkan gelas kimia yang berisi larutan kedalam air secara larutan kedalam air secara bersama-sama.
sama.
Mencatat temperaturnya sebagai Mencatat temperaturnya sebagai temperatur awal. temperatur awal. larutan larutan larutan larutan
Mencampurkan kedua larutan sambil Mencampurkan kedua larutan sambil mengaduk mengaduk larutan larutan larutan larutan
Menyamakan temperatur dengan Menyamakan temperatur dengan mencelupkan gelas kimia yang berisi mencelupkan gelas kimia yang berisi larutan kedalam air secara larutan kedalam air secara bersama-sama.
sama.
Mencatat temperaturnya sebagai Mencatat temperaturnya sebagai temperatur awal.
temperatur awal.
Mencampurkan kedua larutan sambil Mencampurkan kedua larutan sambil mengaduk
mengaduk
Mencatat suhu tertinggi yang dicapai Mencatat suhu tertinggi yang dicapai sebagai temperatur akhir.
B.
B. Stoikiometri Sistem Basa Kuat-Asam Kuat (NaOH-HCl)Stoikiometri Sistem Basa Kuat-Asam Kuat (NaOH-HCl) Gelas
Gelas Kimia Kimia I I Gelas Gelas Kimia Kimia 22
Nb: Nb:
--
Mengulangi prosedur yang sama dengan komposisi volume larutan Mengulangi prosedur yang sama dengan komposisi volume larutan sepertisepertitabel pengamatan. tabel pengamatan.
--
Membuat gafik yang menghubungkan volume sistem sebagai absis Membuat gafik yang menghubungkan volume sistem sebagai absis terhadapterhadap ∆T sebagai ordinat.∆T sebagai ordinat.
--
Memberikan kesimpulan dari kegiatan diatas.Memberikan kesimpulan dari kegiatan diatas.8
8 mL mL NaOH NaOH 1 1 M M 4 4 mL mL HCl HCl 1M1M Menyamakan temperatur dengan
Menyamakan temperatur dengan mencelupkan gelas kimia yang berisi mencelupkan gelas kimia yang berisi larutan kedalam air secara larutan kedalam air secara bersama-sama.
sama.
Mencatat temperaturnya sebagai Mencatat temperaturnya sebagai temperatur awal. temperatur awal. larutan larutan larutan larutan
Mencampurkan kedua larutan sambil Mencampurkan kedua larutan sambil mengaduk mengaduk larutan larutan larutan larutan
Menyamakan temperatur dengan Menyamakan temperatur dengan mencelupkan gelas kimia yang berisi mencelupkan gelas kimia yang berisi larutan kedalam air secara larutan kedalam air secara bersama-sama.
sama.
Mencatat temperaturnya sebagai Mencatat temperaturnya sebagai temperatur awal.
temperatur awal.
Mencampurkan kedua larutan sambil Mencampurkan kedua larutan sambil mengaduk
mengaduk
Mencatat suhu tertinggi yang dicapai Mencatat suhu tertinggi yang dicapai sebagai temperatur akhir.
6.
6. Hasil DiskusiHasil Diskusi 6.1
6.1 Nama Penanya : Khalied Fadullah Nama Penanya : Khalied Fadullah Pertanyaan :
Pertanyaan : a.
a. Apa yang dimaksud dengan titik stoikiometri?Apa yang dimaksud dengan titik stoikiometri? b.
b. Apa ada hubungan perubahan suhu dengan titik Apa ada hubungan perubahan suhu dengan titik stoikiometri?stoikiometri? Nama
Nama Penjawab : Khairiatul Muna dan Muhammad RuPenjawab : Khairiatul Muna dan Muhammad Rusadisadi Jawaban :
Jawaban : a.
a. Titik Stoikiometri adalah titik di mana terjadi reaksi stoikiometri di suatuTitik Stoikiometri adalah titik di mana terjadi reaksi stoikiometri di suatu reaksi kimia. Dan reaksi stoikiometri adalah reaksi di mana semua reaksi kimia. Dan reaksi stoikiometri adalah reaksi di mana semua pereaktan
pereaktan habis habis bereaksi bereaksi (tidak (tidak ada ada pereaksi pereaksi pembatas pembatas tersisa). tersisa). TitikTitik stoikiometri tersebut dapat berada pada titik maksimum ataupun pada titik stoikiometri tersebut dapat berada pada titik maksimum ataupun pada titik minimum. Titik maksimum stoikiometri berarti pada suhu maksimum minimum. Titik maksimum stoikiometri berarti pada suhu maksimum terjadi reaksi stoikiometri, sedangkan titik minimum stoikiometri berarti terjadi reaksi stoikiometri, sedangkan titik minimum stoikiometri berarti pada suhu minimum terjadi reaksi stoikiometri.
pada suhu minimum terjadi reaksi stoikiometri. b.
b. Ada, yaitu suhu mempengaruhi perubahan stoikiometri yang lain, sepertiAda, yaitu suhu mempengaruhi perubahan stoikiometri yang lain, seperti massa, mol dan perhitungan lainnya. Hubungan mol dengan volume gas, massa, mol dan perhitungan lainnya. Hubungan mol dengan volume gas, tekanan gas, suhu yaitu berbanding lurus. Semakin besar
tekanan gas, suhu yaitu berbanding lurus. Semakin besar mol dan suhunya,mol dan suhunya, maka semakin besar pula tekanan gas, dan volume gas yang akan maka semakin besar pula tekanan gas, dan volume gas yang akan dihasilkan. Hal tersebut dirumuskan yaitu sebagai berikut : PV = nRT. dihasilkan. Hal tersebut dirumuskan yaitu sebagai berikut : PV = nRT. Dengan catatan semua faktor yang dibutuhkan harus ada dalam Dengan catatan semua faktor yang dibutuhkan harus ada dalam perhitungan.
perhitungan.
6.2
6.2 Nama Penanya : Muhammad Maulani Nama Penanya : Muhammad Maulani Pertanyaan :
Pertanyaan : a.
a. Apakah reaksi eksoterm dan endoterm dapat diramalkan?Apakah reaksi eksoterm dan endoterm dapat diramalkan? b.
b. Mungkinkah hasil perhitungan teori memiliki kesesuaian dengan hasilMungkinkah hasil perhitungan teori memiliki kesesuaian dengan hasil percobaan
percobaan dalam dalam hal hal perkiraan perkiraan suhu suhu berdasarkan berdasarkan teori teori pemutusan pemutusan dandan pembentukan ikatan. Jelaskan!