LAPORAN PRAKTIKUM
KIMIA
Laju Tingkat Reaksi
Kelas XI B MIPA
2015/2016
Kelompok
-
Adhim Bagas Wisnu Aji (01)
BAB 1
PENDAHULUAN
1.1. Latar belakang
Dalam kehidupan sehari-hari kita sering melihat reaksi-reaksi kimia dengan kecepatan yang berbeda-beda. Ada reaksi yang berlangsung sangat cepat seperti petasan yang meledak, ada juga reaksi yang berlangsung sangat lambat seperti perkaratan besi.
Reaksi kimia adalah proses perubahan zat reaksi menjadi produk. Seiring dengan bertambahnya waktu reaksi, maka jumlah pereaksinya akan semakin sedikit, sedangkan produk semakin banyak. Laju reaksi dapat dinyatakan sebagai laju perubahan konsentrasi per satuan waktu. Waktu yang digunakan dapat berupa detik, menit, jam, hari, bulan, maupun tahun, tergantung pada lamanya reaksi berlangsung.
Laju reaksi dapat dipengaruhi oleh beberapa faktor. Diantaranya yaitu konsentrasi, suhu, luas permukaan, tekanan dan katalis.
Oleh karena itu percobaan ini dilakukan untuk mengetahui laju reaksi kimia yang ada dalam kehidupan dan bagaimana perlakuan untuk meningkatkan laju reaksi.
1.2. Tujuan percobaan
Untuk mengetahui faktor-faktor yang mempengaruhi laju reaksi Untuk mengetahui pengaruh konsentrasi dan suhu terhadap laju reaksi Untuki menentukan persamaan laju reaksi kimia
BAB 2
TINJAUAN PUSTAKA
Dalam reaksi kimia terdapat perbedaan laju reaksi antara reaksi yang satu dengan reaksi yang lain. Misalnya ketika kita membakar kertas, reaksi berlangsung begitu cepat sedangkan reaksi pembentukan minyak bumi memerlukan waktu yang sangat lama. Dari hal ini dapat disimpulkan bahwa reaksi kimia memiliki laju reaksi yang berbeda.
Dalam ilmu kimia laju reaksi kimia dipelajari dalam kinetika kimia. Kinetika kimia adalah bagian dari ilmu kimia yang mempelajari tentang laju reaksi kimia, bagaimana cara menghitung laju suatu reaksi kimia dan berbagai hal yang mempengaruhinya.
Cepat lambatnya suatu reaksi kimia yang berlangsung disebut laju reaksi. Laju reaksi dapat dinyatakan sebagai perubahan konsentrasi pereaksi atau produk per satuan waktu. Konsentrasi biasanya dinyatakan dalam mol per liter, tetapi untuk reaksi fase gas, satuan konsentrasi dapat diganti dengan satuan tekanan seperti atmosfer, millimeter merkurium, atau pascal. Satuan waktu yang digunakan dapat berupa detik, menit, jam, hari, bulan, bahkan tahun bergantung pada reaksi tersebut berjalan cepat atau lambat.
Laju reaksi = Perubahan konsentrasi Satuan waktu
Untuk mengukur laju reaksi, perlu dilakukan analisis secara langsung maupun tak langsung tak langsung banyaknya, produk yang terbentuk atau banyaknya reaksi yang tersisa setelah penggal waktu tertentu.
Contoh :
Laju reaksi kimia dapat dinyatakan sebagai laju penguraian konsentrasi molar NO2 atau Laju
pertambahan konsentrasi molar N2 dan O2.
Sesuai dengan perbandingan koefisien reaksinya, laju pembentukan O2 adalah setengah dari laju
pengurangan NO2, yaitu :
Ada beberapa cara menentukan laju reaksi, salah satunya itu ditentukan melalui percobaan, yaitu dengan mengukur konsentrasi salah satu reaksi salah satu produk pada selang waktu yang berlangsung lambat ini dapat ditentukan dengan cara mengeluarkan sampel dari campuran reaksi lalu menganalisanya dengan contoh sebagai berikut :
CH3 COOHs + H2O CH2 COOH + C2H5OH
(Etil asesat) (Air) (Asam Asesat) (Etanol)
Reaksi tersebut sangat lambat berlangsungnya sehingga konsentrasi asam asetat yang dihasilkan dengan mudah dapat ditentukan dengan menggunakan suau larutan asam basa.
Cara yang lebih umum adalah dengan menggunakan suatu alat yang dapat menunjukkan secara kontinu suatu perubahan yang menyertai reaksi. Untuk reaksi gas yang disertai perubahan mol, alat dirancang dapat mengukur perubahan bahan tekanan gas, contohnya sebagai berikut :
2NaO5 (g) 4NO2 (g) + O2
Reaksi tersebut disertai pertambahan jumlah mol gas yang menyebabkan pertambahan tekanan yang dapat dibaca dengan mometer semakin banyak N2O5 yang terurai semakin besar tekanannya,
jika reaksi berlangsung pada volume dan suhu yang tetap maka pertambahan tekanan dapat dikatakan dengan tambahan mol dengan demikian laju penguraian NaO5 dapat ditentukan.
Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi dipengaruhi oleh :
a.
Konsentrasi Pereaksi
Pada umumnya jika konsentrasi zat semakin besar maka laju reaksinya semakin besar, dan sebaliknya jika konsentrasi pula, dan sebaliknya jika sentrasi suatu zat semakin kecil maka laju reaksinya pun semakin kecil. Untuk beberapa reaksi, laju reaksinya pun semakin kecil. Untuk beberapa reaksi, laju reaksi dapat dinyatakan dengan persamaan matematik yang dikenal dengan hukum laju reaksi atau reaksi dinamakan orde reaksi. Menentukan orde reaksi dari suatu reaksi kimia pada prinsipnya menentukan seberapa besar pengaruh perubahan konsentrasi pereaksi terhadap laju reaksi.
b.
Luas Permukaan
Suatu reaksi mungkin melibatkan pereaksi dalam bentuk padat, luas permukaan (total) zat padat akan bertambah jika ukurannya diperkecil. Semakin zat padat terbagi menjadi bagian kecil, semakin cepat reaksi berlangsung. Bubuk zat padat biasanya menghasilkan reaksi yang lebih cepat dibandingkan sebuah bongkah zat padat dengan massa yang sama. Bubuk padat memiliki permukaan yang lebih besar dari pada sebuah bengkah zat padat.
c.
Suhu atau Temperatur
sebagai reaksi berlangsung dengan suhu ruangan maka laju reaksi akan berlipat ganda setiap kenaikan 100C
Perkiraan ini bukan keadaan yang mutlak dan tidak bisa diterapkan pada seluruh reaksi. Bahkan bila pun mendekati benar, laju reaksi akan berlipat ganda setiap 90C atau 110C atau setiap suhu
tertentu. Angka dari derajat suhu yang diperlukan untuk melipat gandakan laju reaksi akan berubah secara bertahap seiring dengan meningkatnya suhu.
Beberapa reaksi pada hakikatnya sangat cepat, sebagai contoh reaksi perpanasan melibatkan ion yang terlarut menjadi zat padat yang tidak larut, atau reaksi ion hidrogen dengan asam dan ion hidroksi dari Alkali didalam larutan, sehingga memanaskan salah satu dari contoh ini tidak memperoleh perbedaan laju reaksi yang baik di laboratorium maupun industri akan berlangsung lebih cepat apabila di panaskan
d.
Tekanan
Bayak reaksi yang melibatkan pereaksi dalam wujud gas. Kelajuan dari reaksi seperti itu juga dipengaruhi oleh tekanan. Penambahan tekanan dengan memperkecil Volume akan memperbesar konsentrasi, dengan demikian dapat memperbesar laju reaksi.
Peningkatan tekanan pada reaksi yang melibatkan gas pereaksi akan meningkatkan laju reaksi. Perubahan tekanan pada suatu reaksi yang melibatkan hanya zat padat maupun zat cair tidak memberikan perubahan apapun pada laju reaksi.
Dalam proses pembuatan amonia dengan proses Haber, laju reaksi antara Hidrogen dan Nitrogen ditingkatkan dengan menggunakan tekanan yang sangat tinggi. alasan utama menggunakan tekanan tinggi adalah untuk meningkatkan persentasi amonia di dalam keseimbangan campuran, namun hal ini juga memberikan perubahan yang berarti pada laju reaksi juga.
Industri yang melibatkan produksi berupa gas yang banyak dilangsungkan pada tekanan tinggi, misalnya pembuatan amonia yang menggunakan tekanan hingga 400 atm.
e.
Katalis
Katalis adalah zat yang dapat mempercepat laju reaksi, tetapi zat itu sendiri tak mengalami perubahan yang kekal (tidak diskon asumsi atau tidak dihabiskan). Katalis dibagi 2 yaitu :
- Katalis Positif.
Katalis positif berfungsi untuk mempercepat laju reaksi dengan cara menurunkan energi pengaktifan, katalis positif disebut juga katalisator.
- Katalis Negatif
Katalis negatif berfungsi untuk memperkuat laju reaksi. Katalis negatif disebut juga inhibator. Adapun Jenis-jenis katalis yaitu :
- Katalis homogen
Wujud katalis homogen ini sama dengan wujud pereaksi. Jenis katalis ini umumnya ikut beraksi tetapi pada akhirnya akan kembali lagi ke bentuk semula.
- Katalis Heterogen
Wujud katalis homogen ini berbeda dari wujud pereaksi. Jenis katalis ini umumnya berupa logam-logam dan bereaksi yang dipercepat adalah reaksi gas-gas katalis ini tidak ikut bereaksi, tetapi melalui reaksi permukaan yaitu permukaan logam menyerap molekul-molekul udara hingga apabila dua molekul gas yang dapat bereaksi terserap maka gas-gas itu akan mudah bereaksi katalis ini kebanyakan digunakan dalam reaksi industri.
- Katalis biokimia
Katalis biokimia ini berfungsi untuk mempercepat reaksi-reaksi yang terjadi pada makhluk hidup. Katalis ini berupa enzim-enzim.
Dalam laju reaksi terdapat pula teori tumbukan, reaksi berlangsung sebagai hasil tumbukan antara partikel pereaksi. Akan tetapi tidaklah setiap tumbukan antara partikel menghasilkan reaksi, melainkan hanya tumbukkan antar partikel yang memiliki energi yang cukup serta arah tumbukan yang tepat. Sehingga dapat dikatakan bahwa laju reaksi dapat bergantung pada 3 hal, yaitu:
Frekuensi Tumbukan
Fraksi tumbukan yang melibatkan partikel dengan energi cukup
Tumbukan yang menghasilkan reaksi disebut dengan tumbukan efektif, energi minimum yang harus dimiliki oleh partikel pereaksi sehingga menghasilkan tumbukan efektif yang disebut juga energi pengaktifan untuk memahami arti dari energi pengaktifan perlu diperhatikan pelan-pelan benda yang ada di sekitar kita yang dapat terbakar.
Adapun persamaan laju reaksi dan orde reaksi yaitu sebagai berikut: mA + nB pC = qD
- m,n,p,q : Koefisien masing-masing zat yang terlihat dalam reaksi
Ketetapan jenis reaksi (K) adalah salah satu tetapan yang harganya bergantung pada jenis pereaksi dan suhu., setiap reaksi mempunyai harga K tertentu pada suhu tertentu. Harga K berubah jika suhu berubah, kenaikan suhu dan katalisator umumnya dan memperbesar harga K.
BAB 3
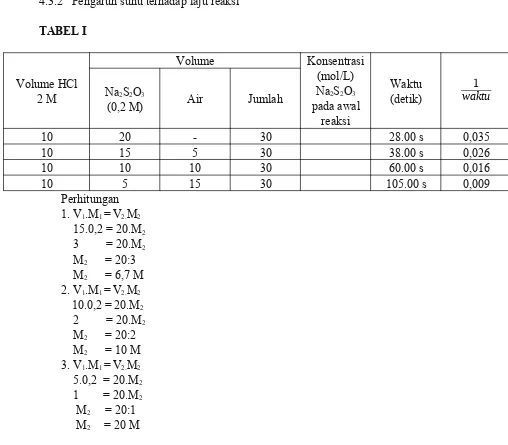
3.2.1. Pengaruh konsentrasi terhadap laju reaksi
- Dipanaskan hingga suhunya 40o C (gunakan termometer), kemudian letakkan diatas
kertas yang telah diberi tanda silang
- Dimasukkan 3 ml larutan HCl 2 M kedalam gelas kimia tersebut dan catat waktu yang dibutuhkan sejak penambahan larutan HCl hingga tanda silang tidak terlihat lagi dari atas
- Diulangi prosedur diatas menggunakan Na2S2O3 0,1 M – HCl 2 M
4.3.2 Pengaruh suhu terhadap laju reaksi
TABEL II
2. Buatlah grafik waktu1 terhadap konsentrasi HCl ! Bagaimanakah hubungan aljabar antara 1
waktu dan konsentrasi HCl? berapakah tingkat reaksi terhadap HCl?
3. Tulislah persamaan kecepatan reaksinya! 4. Berapakah tingkat reaksinya?
5. menga
4.4. Pembahasan
Laju reaksi adalah capat lambatnya suatu reaksi kimia berlangsung. Laju reaksi dapat dinyatakan sebagai perubahan konsentrasi pereaksi atau produk per satuan waktu. Dalam laju reaksi terdapat orde, yaitu banyaknya faktor konsentrasi zat yang mempengaruhi laju reaksi. Dalam laju reaksi kimia terdapat bilangan orde reaksi. Diantaranya 0, 1 dan 2. Reaksi orde nol adalah reaksi yang laju reaksinya tidak dipengaruhi oleh konsentrasi reaktan. Reaksi orde satu adalah reaksi yang lajureaksinya hanya dipengaruhi oleh konsentrasi reaktan pangkat satu sehingga didapat grafik linear pada grafik perbandingan konsentrasi reaktan dengan laju reaksi. Reaksi orde dua adalah reaksi yang laju reaksinya dipengaruhi oleh konsentrasi reaktan kuadrat. Sehingga didapatkan grafik berbentuk kurfa pada grfik pebandingan konsentrasi reaktan dengan laju reaksi. Didalam laju reaksi terdapat konstanta laju reaksi. Yaitu tetapan dalam perhitungan laju reaksi. Barapapun konsentrasi yang digunakan selalu digunakan tetapan ini. Konstanta laju reaksi ini hanya dipengaruhi oleh jenis pereaksi dan suhu.
Praktikum kali ini dilakukan dua percobaan, yaitu pengaruh konsentrasi dan suhu pada terhadap laju reaksi kimia . pada percobaan pertama dilakukan percobaan pengaruh konsentrasi terhadap laju reaksi kimia. Ketika digunakan 2 ml Na2S2O3 0,1 M dicampur dengan 3 ml HCl 1 M reaksi
berlangsung hingga warna larutan menjadi keruh dan tak terlihat lagi tanda silang dikertas dalam 277 s. Ketika digunakan 2 ml Na2S2O3 0,1 M dicampur dengan 3 ml HCl 2 M reaksi berlangsung
digunakan 2 ml Na2S2O3 0,2 M dicampur dengan 3 ml HCl 2 M reaksi berlangsung hingga warna
larutan menjadi keruh dan tak terlihat lagi tanda silang dikertas dalam 52 s. Dari percobaan ini dapat disimpulkan bahwa semakin besar konsentrasi yang digunakan maka semakin laju pula reaksi berlangsung.
Percobaan kedua adalah pengaruh suhu terhadap laju reaksi. Pada percobaan ini suhu dinaikkan hingga 40oC. Ketika digunakan 2 ml Na
2S2O3 0,2 M dicampur dengan 3 ml HCl 2 M reaksi
berlangsung hingga warna larutan menjadi keruh dan tak terlihat lagi tanda silang dikertas dalam 43 s. Ketika digunakan 2 ml Na2S2O3 0,2 M dicampur dengan 3 ml HCl 1 M reaksi berlangsung hingga
warna larutan menjadi keruh dan tak terlihat lagi tanda silang dikertas dalam 50 s. Ketika digunakan 2 ml Na2S2O3 0,1 M dicampur dengan 3 ml HCl 1 M reaksi berlangsung hingga warna
larutan menjadi keruh dan tak terlihat lagi tanda silang dikertas dalam 95 s. Dari percaobaan ini dan percobaan pertama terdapat perbedaan perlakuan. Yaitu pada percobaa pertama digunakan suhu ruang sedangkan pada percobaan kedua digunakan suhu 40oC, Dan dapat disimpulkan bahwa
semakin tinggi suhu, maka semakin laju pula suatu reaksi berlangsung.
Pada percobaan ini waktu yang ditentukan hingga tanda X tertutup. Yang menyebabkan tanda X tertutup adalah terbentuknya produk berupa senyawa sulfur yang mengendap berwarna putih buram.
Dalam percobaan ini terdapat beberapa faktor kesalahan yaitu ketidak tepatan dalam pengukuran waktu denperbedaan persepsi dalam menentukan tanda silang sudah tak terlihat atau belum.
BAB 5 PENUTUP
5.1. Kesimpulan
Faktor-faktor yang mempengaruhi laju reaksi adalah : - Suhu
- Luas permukaan - Konsentrasi - Tekanan - Katalis
Dari percobaan ini didapat pengaruh konsentrasi dan suhu. Pengaruh konsentrasi yaitu apabila konsentrasi suatu reaktan semakin besar, maka laju reaksi juga meningkat. Dan pengaruh suhu yaitu apabila suhu dinaikkan maka laju suatu reaksi juga meningkat.
Dalam percobaan pengaruh konsentrasi dengan suhu ruang didapat persamaan :
LAMPIRAN FOTO
Alat dan Bahan :
===
Gelas Kimia HCl
Na2S2O3 Aquades
Proses :
===
Pengukuran volume menggunakan gelas ukur Penuangan larutan
Penuangan aquades
Penuangan HCl ke Gelas Kimia Penuangan Na2S2O3 ke Gelas Kimia yang
berisi HCl
Pengamatan menggunakan stopwatch Tampak reaksi kima yang terjadi setelah