LAPORAN PRAKTIKUM
DINAMIKA KIMIA
JUDUL PERCOBAAN :
PENENTUAN LAJU REAKSI IODINASI ASETON
DALAM SUASANA ASAM
Nama : SantiNurAini NRP : 1413100048 Tanggal Praktikum : 28 April 2015 Nama Asisten : Mas Mattius Tanggal Pengumpulan : 12 Mei 2015 Kelompok : 9B
LABORATORIUM FUNDAMENTAL KIMIA JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT TEKNOLOGI SEPULUH NOPEMBER SURABAYA
I. TUJUAN PRAKTIKUM
Tujuan dilakukannya percobaan ini adalah untuk menentukan laju reaksi iodinasi aseton
II.TEORI DASAR 2.1 Laju Reaksi
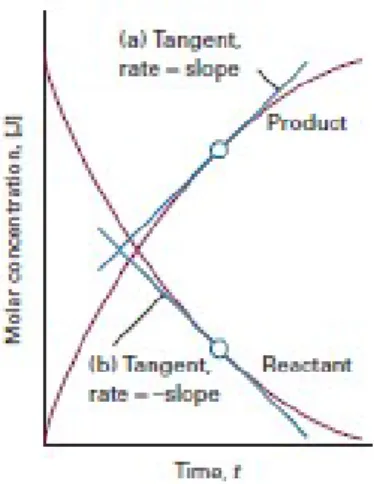
Laju reaksi didefinisikan sebagai perubahan konsentrasi persatuan waktu. Laju rekasi kimia terlihat dari perubahan konsentrasi molekul reaktan atau konsentrasi molekul produk terhadap waktu. Laju rekasi tidak tetap, melainkan berubah terus menerus seiring dengan perubahan konsentrasi (Chang,2006)
Gambar 2.1 Grafik Laju Reaksi antara Waktu dengan Konsentrasi Produk dan Reaktan
(Atkins, 2010)
2.2 Pengaruh Katalis terhadap Laju Reaksi
Katalis adalah zat yang mengambil bagian dalam reaksi kimia, tetapi pada akhir reaksi tidak mempengaruhi produk yang terbentuk. Katalis tidak muncul dalam persamaan kimia. Sifat dari katalis adalah katalis tidak bereaksi secara permanen, katalis tidak mempengaruhi hasil akhir reaksi, katalis bekerja pada suhu optimum. Katalis memumngkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicu oleh atalis terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi(Chang, 2006).
Katalis dapat dibedakan ke dalam dua golongan utama, yaitu katalis homogen dan katalis heterogen. Katalis heterogen adalah katalis yang fasenya berbeda dengan rektan yang akan dikatalisnya. Katalis homogen adalah katalis yang memiliki fase yang sama dengan reaktan yang akan dikatalisnya.
Berikut ini adalah skema umum reaksi katalitik :
A + C → AC ……….(1) B + AC → AB + C ………(2) C adalah katalis, meskipun katalis C termakan pada tahap reaksi 1, namun selanjutnya dihasilkan kembali oleh reaksi 2, sehingga untuk reaksi keseluruhan menjadi :
A + B + C → AB + C ………(3) Katalis homogen terdiri dari katalis asam dan basa, contohnya HCl, H2SO4, NaOH, KOH. Katalis ini umumnya digunakan pada skala laboratorium, karena sulit diakukan secara komersil, operasi pada fase cair dibatasi pada kondisi suh dan tekanan, sehingga peralatan lebih kompleks dan diperlukan pemisahan antara produk dan katalis (Engel, Dkk,2013). 2.3 Hukum Laju
Hukum Laju adalah hubungan antara laju reaksi dan konsentrasi yang dapat diperoleh dari data eksperimen. Hukum laju diperoleh secara eksperimen dan tidak bergantung pada stokiometri. Hukum laju dapat dinyatakan sebagai :
Dalam suatu reaksi A → B, laju reaksinya adalah :
V =k [ A ]X ………... (4)
Dalam suatu reaksi A + B → C, laju reaksinya adalah :
V =k [ A ]X[B]Y
………(5) dimana :
k = tetapan Laju Reaksi
x , y = orde reaksi (Petrucci, 1987)
2.4 Orde Reaksi
Orde reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen itu dalam hokum laju.Orde reaksi tidak dapat dituliskan dari persamaan reaksi, melainkan harus data eksperimen. Beberapa orde reaksi yang umum terdapat dalam persamaan reaksi kimia yaitu:
Reaksi Orde nol
Reaksi dikatakan berorde nol terhadap salah satu satu pereaksinya apabila perubahan konsentrasi pereaksi tersebut tidak mempengaruhi lau reaksi. Persamaan laju reaksi yang berorde 0 yaitu v = k [A]0(Syukri,1999).
[A]
Gambar 2.2 Grafik laju reaksi Orde 0 V = k [A]0
(Petrucci, 1987)
Reaksi Orde satu
Suatu reaksi dikatakan berorde satu terhadapsalah satu pereaksinya jika laju reaksi berbanding lurus dengan konsentrasi pereaksi tersebut. Jika konsentrasi pereaksi tersebut dilipat-tigakan maka laju reaksi akan menjadi 31 atau tiga kalinya. Persamaan laju reaksi yaitu v = k [A] (Syukri,1999).
[A]
Gambar 2.3 Grafik laju reaksi orde 1V = k [A]1
(Petrucci,1987)
Reaksi Orde dua
Suatu reaksi dikatakan berorde dua terhadap salah satu pereaksi jika laju reaksi merupakan pangkat dua dari konsentrasi pereaksi itu. Apabila konsentasi zat itu dilipat-tigakan, maka laju pereaksi akan menjadi 32 atau 9 kali lebih besar (Syukri,1999).
[A]
Gambar 2.4 Grafik laju reaksi Orde 2V = k [A]2
(Petrucci, 1987) III. PROSEDUR PERCOBAAN
3.1 Peralatan dan Bahan
V
V
Peralatan yang digunakan meliputi tabung reaksi, pipet ukur , pipet tetes, kuvet, gelas beker dan stop watch.
Sedangkan bahan yang digunakan meliputi larutan aseton 3 M, larutan HCl baku 1 M, larutan I2 dalam KI 0,1 M.
3.2 Prosedur Percobaan
dicampurkan dengan variasi tertentu
- dicampurkan dengan volume tertentu dan dimulai stopwatch pertama
- diaduk
- dimasukkan kuvet ke dalam Spektrofotometer UV-Vis (waktu pencampuran larutan hingga dimasukkan ke spektrofotometer 1 menit
- diukur absorbansi pertama dan dimulai stopwatch kedua - dicatat absorbansinya tiap detik ke 0, 60, 90, dan 120
- dilakukan percobaan yang sama untuk setiap variasi volume masing-masing reaktan yang diberikan
IV. PEMBAHASAN
Percobaan ini berjudul laju reaksi iodinasi aseton dalam suasana asam. Percobaan ini bertujuan untuk menentukan persamaan laju reaksi iodinasi aseton. Prinsip dari percobaan adalah kinetika kimia, laju reaksi dan spektrofotometer UV-Vis. Reaksi ini dilakukan dengan
KI 0,1 M Aseton 3 M HCl 1 M Campuran di dalam kuvet Campuran di dalam spektrofotometer Uv-Vis Data Absorbansi
menambahkan iodin pada aseton. Reaksi iodinasi aseton ini berjalan sangat lambat, oleh karena itu diperlukan penambahan katalis asam untuk mempercepat terjadinya reaksi. Ketika larutan iodin direaksikan dengan aseton, dengan adanya asam, maka warna kuning dari iodin perlahan-lahan memudar seiring dengan dikonsumsinya iodin tersebut untuk bereaksi dengan aseton. Laju reaksi pada percobaan ini diikuti dengan mengamati penurunan intensitas warna kuning dari iodin dalam larutan pada waktu tertentu
Pada percobaan ini dikaji reaksi iodinasi aseton yang dikatalisa oleh HCl. Laju reaksi diukur dengan mengamati laju perubahan konsentrasi iodin dengan spektrofotometer. Absorbansi larutan diusahakan antara 0,7-0,2 pada panjang gelombang yang sesuai. Oleh karena itu perlu dilakukan variasi konsentrasi awal setiap pereaksi. Percobaan ini dilakukan dengan menggunakan variasi volume untuk masing-masing zat, yaitu Aseton (2,5 ml,5 ml, 7,5 ml,dan 10 ml) untuk run 1-4, HCl (2,5 ml,5 ml, 7,5 ml, dan 10 ml) untuk run 5-8,dan Iodin (2,5 ml,5 ml, 7,5 ml,dan 10 ml) untuk run 9-12. Data percobaan yang didapat berupa absorbansi tiap 0’, 60’, 90’ dan 120’. Data yang didapat kemudian diplot ke dalam grafik hubungan absorbansi terhadap waktu, dimana sumbu x sebagai fungsi waktu dan sumbu y sebagai fungsi absorbansi. Sehingga akan didapatkan 12 grafik. Dari grafik tersebut akan didapat persamaan garisnya y = mx + c, dimana m (slope) merupakan laju reaksi. Kemudian untuk mencari orde reaksi tiap zat terlebih dahulu mencari konsentrasi terkoreksi [M’] dengan menggunakan rumus [M']=
[
M]
mula x Volume ambilVolume total . Setelah didapatkan hasil konsentrasi terkoreksi kemudian diplot kedalam grafik hubungan antara In V (laju reaksi) sebagai sumbu x dengan In [M’] sebagai sumbu y. Didapat persamaan garisnya y = mx + c, dimana m (slope) merupakan orde reaksi. Dari hasil perhitungan dan grafik yg didapat tiap zatnya, orde reaksi untuk Aseton adalah 2, HCl 1, dan Iodin 0. Orde reaksi yang didapat digunakan untuk menghitung konstanta laju reaksi tiap runnya dengan menggunakan rumus K=V
[Aseton'
]xx [ HC l'
]yx [I'
]z , K yg didapat tiap runnya kemudian dirata-rata sehingga dari hasil perhitungan nilai K diperoleh sebesar 0,0009. Sehingga persamaan laju reaksinya menjadi :
V = 0,0009 x [Aseton]2 x [HCl]1
Penambahan Aseton dan Iodin berfungsi sebagai reaktan yang akan mengalami reaksi membentuk sebuah produk. Larutan HCl berfungsi sebagai katalis yang berfungsi mempercepat terjadinya reaksi.
TUGAS
1. Selain dengan spektrofotometer, laju reaksi iodinasi aseton dapat diikuti dengan cara titrasi volumetri. Terangkan cara tersebut !
3. Reaksi iodinasi aseton termasuk reaksi substitusi nukleofilik atau elektrofilik. Terangkan mekanismenya!
JAWAB :
1. Analisa titrasi asam basa atau volumetri adalah analisa kuantitatif dimana kadar komponen dari zat uji ditetapkan berdasarkan volume pereaksi (konsentrasi diketahui) yang ditambahkan kedalam larutan zat uji hingga komponen yang akan di tetapkan bereaksi secara kuantitatif dengan pereaksi tersebut
V. KESIMPULAN DAN SARAN
Dari hasil percobaan yang telah dilakukan dapat diambil beberapa kesimpulan antara lain:
1. Orde reaksi untuk Aseton adalah 2, sedangkan orde reaksi untuk HCl adalah 1, dan orde reaksi untuk I adalah 0
2. Konstanta laju percobaan ini adalah 0,0009 3. Persamaan laju pada percobaan ini adalah :
V= 0,0009 x [Aseton]2 x [HCl]1
DAFTAR PUSTAKA
Atkins, P. W F., Julio de Paula. (2010).“Physical Chemistry ninth edition”. New York :W. H Freeman and Company
Chang,Raymond.(2006). “Kimia Dasar : Konsep-Konsep Inti Jilid 2”. Jakarta : Erlangga
Petrucci, Ralph. (1987).”Kimia Dasar, Prinsip dan Terapan Modern”. Jakarta : Erlangga
Syukri.1999. “Kimia Dasar 2”.Bandung : ITB Press
Thomas Engel. Dkk.(2013). “Physical chemistry”. Kanada : Pearson education inc. (763-765 george woodbury physical chemistry 1997 cole publishing company usa)
LAMPIRAN
A. Analisa DataTabel 1. Data Hasil Pengamatan Percobaan Iodinasi Aseton
Run Volume (ml) Absorbansi pada t (s)
Aseton HCl I 0 60 90 120 1 2.5 10 10 1.807 1.783 1.776 1.746 2 5 10 10 2.74 2.637 2.568 2.513 3 7.5 10 10 2.409 2.25 2.176 2.099 4 10 10 10 2.049 1.905 1.829 1.751 5 10 2.5 10 3.639 3.541 3.529 3.508 6 10 5 10 1.616 1.559 1.529 1.5 7 10 7.5 10 1.417 1.349 1.323 1.276 8 10 10 10 2.116 1.941 1.856 1.769 9 10 10 2.5 0.331 0.221 0.16 0.1 10 10 10 5 0.665 0.569 0.517 0.469 11 10 10 7.5 1.566 1.405 1.323 1.23 12 10 10 10 2.097 1.958 1.886 1.809 B. Grafik
Dari data hasil pengamatan yang diperoleh pada tabel 1, diplotkan ke dalam grafik untuk tiap run sehingga diperoleh 12 grafik hubungan absorbansi terhadap waktu, adapun grafiknya sebagai berikut :
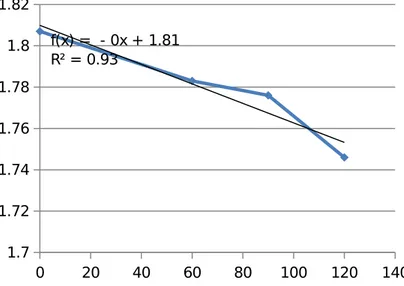
0 20 40 60 80 100 120 140 1.7 1.72 1.74 1.76 1.78 1.8 1.82 f(x) = - 0x + 1.81 R² = 0.93
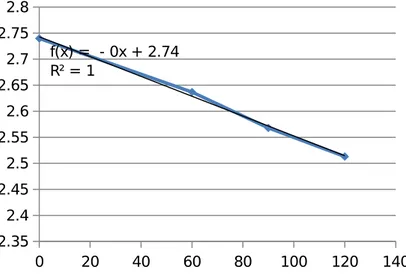
0 20 40 60 80 100 120 140 2.35 2.4 2.45 2.5 2.55 2.6 2.65 2.7 2.75 2.8 f(x) = - 0x + 2.74 R² = 1
Grafik 2. Grafik hubungan Absorbansi terhadap waktu Run 2
0 20 40 60 80 100 120 140 1.9 2 2.1 2.2 2.3 2.4 2.5 f(x) = - 0x + 2.41 R² = 1
Grafik 3. Grafik hubungan Absorbansi terhadap waktu Run 3
0 20 40 60 80 100 120 140
f(x) = - 0x + 2.05 R² = 1
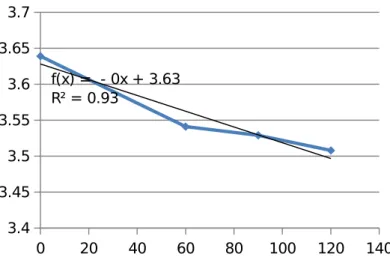
0 20 40 60 80 100 120 140 3.4 3.45 3.5 3.55 3.6 3.65 3.7 f(x) = - 0x + 3.63 R² = 0.93
Grafik 5. Grafik hubungan Absorbansi terhadap waktu Run 5
0 20 40 60 80 100 120 140 1.44 1.46 1.48 1.5 1.52 1.54 1.56 1.58 1.6 1.62 1.64 f(x) = - 0x + 1.62 R² = 1
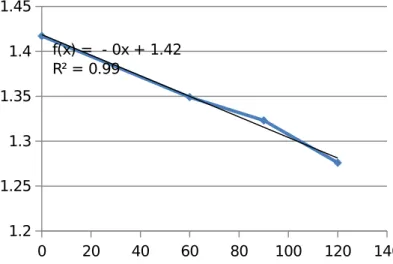
Grafik 6. Grafik hubungan Absorbansi terhadap waktu Run 6 0 20 40 60 80 100 120 140 1.2 1.25 1.3 1.35 1.4 1.45 f(x) = - 0x + 1.42 R² = 0.99
Grafik 7. Grafik hubungan Absorbansi terhadap waktu Run 7
0 20 40 60 80 100 120 140 1.5 1.6 1.7 1.8 1.9 2 2.1 2.2 f(x) = - 0x + 2.12 R² = 1
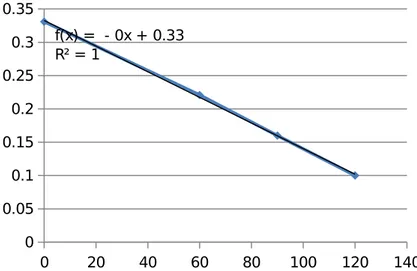
0 20 40 60 80 100 120 140 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 f(x) = - 0x + 0.33 R² = 1
Grafik 9. Grafik hubungan Absorbansi terhadap waktu Run 9
0 20 40 60 80 100 120 140 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 f(x) = - 0x + 0.67 R² = 1
Grafik 10. Grafik hubungan Absorbansi terhadap waktu Run 10
0 20 40 60 80 100 120 140 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 f(x) = - 0x + 1.57 R² = 1
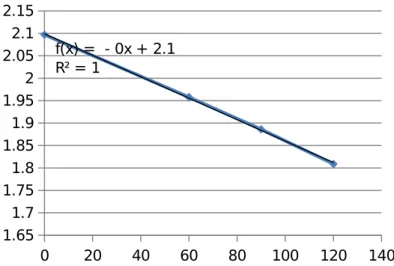
0 20 40 60 80 100 120 140 1.65 1.7 1.75 1.8 1.85 1.9 1.95 2 2.05 2.1 2.15 f(x) = - 0x + 2.1 R² = 1
Grafik 12. Grafik hubungan Absorbansi terhadap waktu Run 12
Dari persamaan grafik yang diperoleh pada grafik diatas didapatkan laju reaksi untuk masing-masing run sebagai berikut :
Tabel 2. Tabel hasil laju reaksi tiap run Run Volume (ml) V Aseton HCl I 1 2.5 10 10 0.0005 2 5 10 10 0.0019 3 7.5 10 10 0.0026 4 10 10 10 0.0025 5 10 2.5 10 0.001 6 10 5 10 0.0011 7 10 7.5 10 0.0011 8 10 10 10 0.0029 9 10 10 2.5 0.0019 10 10 10 5 0.0016 11 10 10 7.5 0.0028 12 10 10 10 0.0024 C. Perhitungan
1. Perhitungan untuk mencari konsentrasi terkoreksi [M’]: Diketahui : [Aseton] = 3 M
[HCl] = 1 M [I2] = 0,1 M
Ditanya : [Aseton’] , [HCl’], [I2’] = …. ? Jawab :
Untuk mencari konsentrasi terkoreksi menggunakan rumus dibawah ini:
[M’] :
[
M]
mula x Volume ambilVolume total Konsentrasi terkoreksi Aseton [Aseton’] tiap run :
Run 1: Run 2: [Aseton’] = 3 M x 2,5 ml22,5 ml [Aseton’] = 3 M x 5 ml25 ml = 0,3333 M = 0,6000 M Run 3: Run 4: [Aseton’] = 3 M x 7,5 ml27,5 ml [Aseton’] = 3 M x 10 ml30 ml = 0,8182 M = 1,0000 M
Run 5 dan 9 (volume sama): Run 6 dan 10 (volume sama):
[Aseton’] = 3 M x 10 ml22,5 ml [Aseton’] = 3 M x 10 ml25 ml
= 1,3333 M = 1,2000 M
Run 7 dan 11(volume sama): Run 8 dan 12 (volume sama):
[Aseton’] = 3 M x 10 ml27,5 ml [Aseton’] = 3 M x 10 ml30 ml = 1,0909 M = 1,0000 M
Tabel 2. Tabel hasil perhitungan [Aseton’] Run [Aseton'] In [Aseton'] V In V 1 0.3333 -1.0986 0.0005 -7.6009 2 0.6000 -0.5108 0.0019 -6.2659 3 0.8182 -0.2007 0.0026 -5.95224 4 1.0000 0.0000 0.0025 5.99146 -5 1.3333 0.2877 0.001 6.90776 -6 1.2000 0.1823 0.0011 6.81245 -7 1.0909 0.0870 0.0011 6.81245 -8 1.0000 0.0000 0.0029 5.84304 -9 1.3333 0.2877 0.0019 -6.2659 10 1.2000 0.1823 0.0016
-6.43775 11 1.0909 0.0870 0.0028 5.87814 -12 1.0000 0.0000 0.0024 6.03229
-Dari data tabel 2 diplotkan kedalam grafik hubungan antara In [Aseton’] dengan In V untuk mencari orde reaksi [Aseton’], sehingga didapatkan grafik dibawah ini :
-1.2000 -1.0000 -0.8000 -0.6000 -0.4000 -0.2000 0.0000 -8 -7 -6 -5 -4 -3 -2 -1 0 f(x) = 1.55x - 5.75 R² = 0.91
Grafik 13. Grafik hubungan antara In [Aseton’] dengan In V
Dari slope grafik di atas didapatkan orde reaksi untuk [Aseton’] adalah 1,54 atau dibulatkan menjadi 2.
Konsentrasi terkoreksi HCl [HCl’] tiap run :
Run 1 dan 9 (volume sama): Run 2 dan 10 (volume sama):
[HCl’] = 1 M x 10 ml22,5 ml [HCl’] = 1 M x 10 ml25 ml = 0,4444 M = 0,4000 M
Run 3 dan 11 (volume sama): Run 4, 8 dan 12 (volume sama) : [HCl’] = 1 M x 10 ml27,5 ml [HCl’] = 1 M x 10 ml30 ml = 0,3636 M = 0.3333 M Run 5: Run 6: [HCl’] = 1 M x 2,5 ml22,5 ml [HCl’] = 1 M x 5 ml25 ml = 0,1111 M = 0,2000 M
Run 7:
[HCl’] = 1 M x 7,5 ml27,5 ml = 0,2727 M
Tabel 3. Tabel hasil perhitungan [HCl’]
Run [HCl'] In [HCl'] V In V 1 0.4444 -0.8109 0.0005 -7.6009 2 0.4000 -0.9163 0.0019 -6.2659 3 0.3636 -1.0116 0.0026 -5.9522 4 0.3333 -1.0986 0.0025 -5.9915 5 0.1111 -2.1972 0.001 -6.9078 6 0.2000 -1.6094 0.0011 -6.8124 7 0.2727 -1.2993 0.0011 -6.8124 8 0.3333 -1.0986 0.0029 -5.8430 9 0.4444 -0.8109 0.0019 -6.2659 10 0.4000 -0.9163 0.0016 -6.4378 11 0.3636 -1.0116 0.0028 -5.8781 12 0.3333 -1.0986 0.0024 -6.0323
Dari data tabel 3 diplotkan kedalam grafik hubungan antara In [HCl’] dengan In V untuk mencari orde reaksi [HCl’], sehingga didapatkan grafik dibawah ini :
-2.5000 -2.0000 -1.5000 -1.0000 -7.0000 -6.8000 -6.6000 -6.4000 -6.2000 -6.0000 -5.8000 -5.6000 -5.4000 -5.2000 f(x) = 0.73x - 5.47 R² = 0.48
Grafik 14. Grafik hubungan antara In [HCl’] dengan In V
Dari slope grafik di atas didapatkan orde reaksi untuk [HCl’] adalah 0,72 atau dibulatkan menjadi 1.
Konsentrasi terkoreksi KI [Kl’] tiap run :
Run 1 dan 5 (volume sama): Run 2 dan 6 (volume sama):
[Kl’] = 0,1 M x 10 ml22,5 ml [Kl’] = 0,1 M x 10 ml25 ml = 0,0444 M = 0,0400 M
Run 3 dan 7 (volume sama): Run 4,8, dan 12 (volume sama): [Kl’] = 0,1 M x 10 ml27,5 ml [Kl’] = 0,1 M x 10 ml30 ml = 0,0364 M = 0.0333 M Run 9: Run 10: [Kl’] = 0,1 M x 2,5 ml22,5 ml = 0,0111 M [Kl’] = 0,1 M x 5 ml25 ml = 0,0200 M Run 11 : [Kl’] = 0,1 M x 7,5 ml27,5 ml = 0,0200 M
Tabel 4. Tabel hasil perhitungan [KI’] Run [I'] In [I'] V In V
1 0.0444 -3.1135 0.0005 -7.6009 2 0.0400 -3.2189 0.0019 -6.2659 3 0.0364 -3.3142 0.0026 -5.9522 4 0.0333 -3.4012 0.0025 -5.9915 5 0.0444 -3.1135 0.001 -6.9078 6 0.0400 -3.2189 0.0011 -6.8124 7 0.0364 -3.3142 0.0011 -6.8124 8 0.0333 -3.4012 0.0029 -5.8430 9 0.0111 -4.4998 0.0019 -6.2659 10 0.0200 -3.9120 0.0016 -6.4378 11 0.0273 -3.6019 0.0028 -5.8781 12 0.0333 -3.4012 0.0024 -6.0323
Dari data tabel 4 diplotkan kedalam grafik hubungan antara In [Kl’] dengan In V untuk mencari orde reaksi [Kl’], sehingga didapatkan grafik dibawah ini :
-5.0000 -4.5000 -4.0000 -3.5000 -3.0000 -6.5000 -6.4000 -6.3000 -6.2000 -6.1000 -6.0000 -5.9000 -5.8000 -5.7000 -5.6000 -5.5000 f(x) = 0.31x - 4.96 R² = 0.36
Grafik 15. Grafik hubungan antara In [Kl’] dengan In V
Dari slope grafik di atas didapatkan orde reaksi untuk [Kl’] adalah 0,30 atau dibulatkan menjadi 0.
2. Perhitungan untuk mencari nilai K Diketahui : orde reaksi [Aseton’] = 2
orde reaksi [HCl’] =1 orde reaksi [I’] = 0 Ditanya : K= …?
Jawab :
Unruk mencari nilai K digunakan rumus dibawah ini :
K= V [Aseton']xx [ HC l']yx [I']z Run 1 : Run 9 : K= 0.0005 [0.3333]2x [0.4444]1x [0.0444 ]0 K = 0.0019 [1.3333 ]2x [0.4444]1x [0.0111]0 = 0.0020 = 0.0005 Run 2 : Run 10 : K= 0.0019 [0.6000]2x [0.4000]1x [0.0400]0 K= 0.0016 [1.2000]2x [0.4000]1x [0.0200]0 = 0.0021 = 0.0004 Run 3 : Run 11 : K= 0.0026 [0.8182]2x [0.3636 ]1x [0.0364]0 K= 0.0028 [1.0909]2x [0.3636 ]1x [0.0273]0 = 0.0014 = 0.0009 Run 4 : Run 12 :
K= 0.0025 [1.0000]2x [0.3333]1x [0.0333]0K = 0.0024 [1.0000]2x [0.3333]1x [0.0333]0 = 0.0008 = 0.0008 Run 5 : K= 0.001 [1.3333]2x [0.1111 ]1x [0.0444]0 = 0.0001 Run 6 : K= 0.0011 [1.2000]2x [0.2000]1x [0.0400]0 = 0.0002 Run 7 K= 0.0011 [1.0909]2x [0.2727 ]1x [0.0364]0 = 0.0003 Run 8 : K= 0.0029 [1.0000]2x [0.3333]1x [0.0333]0=0.0010
Tabel 6. Tabel hasil perhitungan Konstanta Laju (K) Run V (m/s) [Aseton']2 [HCl']1 [I']0 K
1 0.0005 0.1111 0.4444 1.0000 0.0020 2 0.0019 0.3600 0.4 1.0000 0.0021 3 0.0026 0.6694 0.3636 1.0000 0.0014 4 0.0025 1.0000 0.3333 1.0000 0.0008 5 0.001 1.7778 0.1111 1.0000 0.0001 6 0.0011 1.4400 0.2 1.0000 0.0002 7 0.0011 1.1901 0.2727 1.0000 0.0003 8 0.0029 1.0000 0.3333 1.0000 0.0010 9 0.0019 1.7778 0.4444 1.0000 0.0005 10 0.0016 1.4400 0.4 1.0000 0.0004 11 0.0028 1.1901 0.3636 1.0000 0.0009 12 0.0024 1.0000 0.3333 1.0000 0.0008 K rata-rata 0.0009
Dari hasil perhitungan, didapat konstanta laju reaksinya adalah 0,0009. Sehingga persamaan laju reaksi untuk percobaan ini adalah :
V = 0,0009 x [Aseton]2 x [HCl]1 NILAI PERCOBAAN : Tes Pendahulua n Kerja Laporan Praktikum Nilai Akhir (0-100) (0-100) (0-100) Praktikan, SantiNurAini 1413100048 Mengetahui Asisten, Matius
![Tabel 2. Tabel hasil perhitungan [Aseton’]](https://thumb-ap.123doks.com/thumbv2/123dok/4212364.2860424/14.892.144.737.99.1140/tabel-tabel-hasil-perhitungan-aseton.webp)
![Grafik 13. Grafik hubungan antara In [Aseton’] dengan In V](https://thumb-ap.123doks.com/thumbv2/123dok/4212364.2860424/15.892.181.708.109.209/grafik-grafik-hubungan-in-aseton-in-v.webp)
![Grafik 14. Grafik hubungan antara In [HCl’] dengan In V](https://thumb-ap.123doks.com/thumbv2/123dok/4212364.2860424/16.892.243.655.799.1029/grafik-grafik-hubungan-in-hcl-in-v.webp)