HUBUNGAN ANTARA KONSENTRASI DAN TEMPERATUR
TERHADAP LAJU REAKSI DAN NILAI ENERGI AKTIFASI
Fitriyah*, Ikhsannudin, Ninda yerasetyo
Lab. Kimi Dasar Jurusan Kimia Universitas Negeri Semarang Gedung D8 Lt 1 Sekaran Gunungpati Semarang, Indonesia
yahfitri544@gmail.com 089699771331
Abstrak
Laju reaksi merupakan perubahan kosentrasi suatu larutan per satu detik. Eksperimen ini bertujuan untuk mengetahui hubungan antara konsentrasi terhadap waktu tempuh dan laju reaksi, serta mengetahui hubungan temperatur terhadap waktu tempuh larutan dan konstanta laju. Dan untuk menentukan orde reaksi setiap reaktan. Adapun metode yang digunakan adalah metode stoikiometri, metode laju reaksi, dan metode persamaan laju reaksi. Sedangkan untuk langkah kerjanya yaitu dengan mengatur volume dan temperatur. Syaratnya dalam larutan tersebut harus berjumlah seratus mililitter. Untuk selanjutnya klik start dan saat larutan keempat ditumpahkan klik start pada menu. Tunggu hingga warna larutan berubah warna seperti warna pembanding. Hasil dari percobaan ini berupa waktu tempuh. Dari data tersebut pertama dicari laju reaksinya dan kemudian dicari orde reaksi setiap reaktan. Dari laju dan orde reaksi yang telah didapatkan, maka dapat dicari kostanta laju reaksi. Pada konsentrasi yang tinggi waktu yang ditempuh kecil, sehingga laju reaksinya cepat. Sedangkan pada saat temperaturnya tinggi maka waktunya sedikit, sehingga lajunya cepat. Dan untuk orde reaksi suatu larutan (reaktan) berkisar antara nol sampai satu.
Kata Kunci : laju reaksi;orde reaksi; konstanta reaksi; konsentrasi; dan temperatur.
Abstract
The reaction rate is the change in concentration of a solution per one second . This experiment aims to determine the relationship between the concentration of the travel time and the reaction rate , and determine the relationship of solution temperature on travel time and rate constants . And to determine the reaction order of each reactant . The method used is the stoichiometric method . As for his step is to adjust the volume and temperature . The requirement in the solution should amount to one hundred mililitter . For the next click start and when the fourth solution is poured click on the start menu . Wait until the color of the
solution changes color as the color comparator . The results of this experiment in the form of travel time . From these data the rate of reaction is first searched and then searched the reaction order of each reactant . From the pace and order of the reaction has been obtained , it can be searched reaction rate constants . At high concentrations the time taken is small, so the faster the reaction rate . While at high temperature so little time , so the speed is fast . And for the order of the reaction of a solution ( reactant ) ranges from zero to one .
Keywords : rate of reaction ; reaction order ; reaction constants ; concentration ; and temperature .
Pendahuluan
Reaksi adalah proses penyusunan suatu produk dari suatu reaktan. Proses ini dimulai dari adanya energi aktifasi yang mempengaruhi laju dari reaksi tersebut. Sedangkan titrasi adalah mencampurkan beberapa larutan hingga warnanya sesuai dengan indikator.
Titrasi juga diartikan sebagai prosedur menyetarakan mol dua zat dengan pengukuran volume larutan kedua zat pada titik akhir reaksi, yang ditandai dengan perubahan warna zat indikator (Agus, 1986).
Menurut Vogel,1994 sebuah reaksi diawali dengan tumbukan antar partikel. Yang mna setelah tumbukan itu akan terjadi proses penyusunan ulang ikatan dalam reaktan dengan susunan yang berbeda (sebagai produk).
Sedangkan laju reaksi merupakan perubahan konsentrasi persatuan waktu. Dalam persamaan laju reaksi meliputi : konsentrasi larutan, orde reaksi, dan konstanta laju. Konsentrasi merupakan molaritas dari reaktan. Sedangkan orde merupakan pangkat dari konsentrasi reaktan. Dan konstanta laju adalah angka mutlak yang bersifat konstan (tetap).
Terdapat beberapa jenis reaksi, yaitu reaksi yang melibatkan dua molekul dan reaksi yang melibatkan tiga molekul. Reaksi yang melibatkan dua molekul disebut reaksi bimolekul, sedangkan reaksi yang melibatkan tiga molekul disebut reaksi trimolekul. Untuk reaksi trimolekul dibagi lagi menjadi dua macam reaksi, yaitu reaksi sederhana dan reaksi rumit. Reaksi sederhana yaitu apabila orde reaksinya mempunyai nilai yang sama dengan kemolekulannya. Sedangkan untuk reaksi rumit adalah apabila ordenya tidak sama dengan kemolekulannya (Supardi,2012)
Didalam proses pengubahan reaktan hingga menjadi produk ini dipengaruhi oleh beberapa faktor sepeti bentuk fisik reaktan, kosentrasi, temperatur, katalis, dan tekanan..
Dimana ini akan mempengaruhi laju reaksi dan waktu yang diperlukan dalam proses pembuatan produk ini.
Faktor yang mempunyai peranan paling penting yaitu kosentrasi reaktan. Namun terkadang ada juga reaksi yang sangat sensitif terhadap temperatur. Temperatur ini digunakan untuk pengukuran kuantitatif dalam kinetika kimia (Oxtoby,2001).
Dalam hal ini temperatur mempunyai pengaruh terhadap laju reaksi. Semakin tinggi temperatur maka laju reaksi semakin cepat dan waktunya semakin sedikit (Chang,2005).
Dan untuk ketetapan laju reaksi bisa didapatkan menggunakan persamaan empirik milik Archeius. Dalam persamaan ini juga bisa didapatkan besar energi aktifasi. Dan ini persamaan ini juga bisa digunakan untuk mencari nilai dari konstanta laju reaksi (Supardi,2012).
k = A . e –E/RT
Ada beberapa masalah yang berusaha kami pecahkan, antara lain : 1) bagaimana pengaruh konsentrasi terhadap temperatur dan laju reaksi, 2) berapa orde reaksi masing-masing reaktan, 3) bagaimana hubungan antara temperatur terhadap waktu tempuh reaksi dan konstanta laju reaksi, 4) berapa nilai energi aktifasinya
Sedangkan tujuan dari eksperimen ini, yaitu untuk mengetahui hubungan antara konsentrasi terhadap waktu tempuh dan laju reaksi, serta mengetahui hubungan temperatur terhadap waktu tempuh larutan dan konstanta laju. Dan untuk menentukan orde reaksi setiap reaktan. Selain itu untuk menentukan energi aktifasinya.
Metode
Metode yang digunakan dalam praktikum ini yaitu secara online. Yaitu melalui sofware kineticks.swf (sumbe http://www.chem.arizona.edu). Dengan alat yang digunakan adalah gelas ukur 100 ml sebanyak 4 buah, stopwatch, dan gelas kimia 250 ml. Adapun caranya yaitu pertama ditentukan terlebih dahulu volume masing-masing reaktan. Dalam eksperimen ini terdiri dari tiga reaktan, yaitu H2O2 for syn merck, HCl for syn merck, dan KI
for syn merck. Masing-masing reaktan diatur volumenya, yaitu untuk eksperimen pertama volume 0,01M H2O2 10 ml, 1M HCl 20 ml, dan 0,05M KI 10 ml. Sedangkan untuk
eksperimen kedua yaitu volume 0,01M H2O2 10 ml, 1M HCl 20 ml, dan 0,05M KI 10 ml.
Dan untuk eksperimen ke tiga yaitu volume 0,01M H2O2 10 ml, 1M HCl 20 ml, dan 0,05M
KI 20 ml. Dan yang keempat yaitu volume 0,01M H2O2 10 ml, 1M HCl 40 ml, dan 0,05M KI
10 ml (temperaturnya dibuat tetap dari eksperimen satu sampai tiga). Setelah ditentukan konsentrasinya, kemudian menu start diklik. Kemudian tunggu hingga reaktan keempat
ditumpahkan dan lalu klik menu waktu. Ditunggu hingga warna larutan berubah warna seperti warna larutan pembanding. Jika sudah maka menu stop diklik. Sedangkan untuk eksperimen yang kelima suhunnya yang diubah-ubah, namun volumenya dibuat tetap. Temperaturnya diubah-ubah dari 50, 250, 350, dan 450. Sedangkan konsentrasi reaktan dibuat tetap, yaitu 0,01M H2O2 10 ml, 1M HCl 20 ml, dan 0,05M KI 10 ml. Dan untuk
langkah-langkah selanjutnya sama seperti eksperimen pertama, kedua, dan ke tiga.
Data yang telah dihasilkan ini akan diolah menggunakan metode statistika, yaitu mencari nilai rata-rata. Sedangkan metode eksperimennya menggunakan metode titrasi,membandingkan dengan gambar lain sebagai indikatornya yaitu warnanya sudah sama.dan metode laju digunakan untuk mencari nilai laju, kosentrasi dan konstanta laju. Dan untuk variabel-variabelnya adalah untuk menentukan pengaruh volume terhadap laju dan waktu reaksi variabel bebasnya adalah volume larutan, variabel kontrol adalah jenis larutan, dan variabel terikatnya adalah waktu dan laju reaksi. Sedangkan untuk pengaruh temperatur terhadap waktu dan laju reaksi variabel bebasnya temperatur, variabel terikatnya waktu dan laju reaksi, dan variabel kontrolnya volume dan jenis larutan.
Hasil Dan Pembahasan
Data diperoleh dari melakukan eksperimen scara langsung. Eksperimen ini dilakukan menggunakan aplikasi komputer. Sedangkan metodenya yaitu menggunakan metode stoikiometri dan titrasi. Rumusan reaksinya adalah H2O2 + 2HCl + 2KI I2 + 2H2O + 2KCl . Dimana larutan yang di biarkan akan berubah warna menjadi kecoklatan. Ini disebabkan adanya kandungan iodin dalam larutan tersebut.
Tabel 1. Pengaruh volume terhadap laju reaksi tempratur (ᵒC) volume (ml) waktu (s) Trata-rata H₂O₂ 0,01 M KI 0,05 M HCl 1M H₂O 25 10 10 20 60 53,68 53,83 53,92 53,9 53,8 53,7 25 10 20 20 50 27,37 27,6 27,64 27,83 27,83 27,32 25 20 10 20 50 28,25 27,8 27,22
28,44 27,77 27,32
Data yang telah kita peroleh untuk waktunya kita ambil waktu rata-rata karena yang kita butuhkan dalam perhitungan hanya satu waktu. Selain itu untuk memudahkan. Dalam mencari nilai rata-rata ini menggunakan metode statistika
Data diatas digunakan dalam menentukan hubungan antara konsentrasi dengan laju reaksi. Dilihat dari data 1, 2, dan 3 semakin tinggi konsentrasi maka laju reaksinya semakin cepat. dan waktu yang digunakan untuk bereaksi semakin sedikit. Dan semakin banyak volume maka konsentrasinya semakin tinggi. Hasil ini sesuai dengan yang dikemukakan Oxtobi. Sedangkan untuk data kedua dan ketiga sebenarnya sama jika dibulatkan, dan hanya selisih sedikit maka saya anggap sama. Kenapa waktunya sama? Ini dikarenakan volume untuk semua reaktan sama, yaitu 50 ml.
Dengan data ini kita bisa mencari orde masing-masing reaktan. Namun terlebih dahulu dicari waktu rata-ratanya untuk memudahkan. Untuk selanjutnya mencari masing-masing konsentrasi reaktan.
Untuk mencari orde pada tiap-tiap reaktan menggunakan metode hukum laju reaksi. Namun terlebih dahulu kita mencari molaritas / konsentrasi terlebih dahulu. Yaitu dengan menggunakan metode molaritas. Sehingga didapatkan molaritas sebagai berikut :
Tabel 2. Hasil Perhitungan Molaritas (kosentrasi)
Volume awal (ml) Volume air (ml)
Kosentrasi awal (M) Molaritas akhir (M) waktu (sekon) H2O2 KI HCl H2O2 KI HCl H2O2 KI HCl
10 10 20 100 0,05 0,05 1 0,001 0,005 0,2 53,83 10 20 20 0,001 0,01 0,2 27,6 20 10 20 0,002 0,005 0,2 27,8 10 10 40 0,001 0,005 0,4 56,84
Dari hasil perhitungan tersebut, kemudian dicari masing-masing orde reaksi yaitu dengan menggunakan metode laju reaksi. Yaitu dengan menggunakan waktu yang telah kita peroleh dalam eksperimen ini.
Untuk mencari orde reaksi dari KI kita bisa membandingkan antara data pertama dengan data kedua. Hingga diperoleh orde reaksi dari KI yaitu 1. Sebenarnya hasil dari pembagian lajunya tidak 2, namun 1,95. Karena kesulitan maka dibulatkan menjadi 2,
sehingga dioeroleh ordenya menjadi 1. Sedangkan untuk mencari orde reaksi H2O2
menggunakan data ke tiga dan data 1. Sama dengan hasil pembagian laju data pertama dengan data kedua, untuk data yang kedua dengan ketiga juga memperoleh angka tidak bulat. Yaitu diperoleh angka 1,9, namun dibulatkan menjadi 2. Sehingga didapat orde reaksi H2O2
adalah 2. Dan untuk menentukan kosentrasi HCl yaitu dengan membandingkan reaksi pertama dengan keempat. Dari perhitungan menggunakan metode yang sama, yaitu metode laju reaksi didapatkan ordenya yaitu 0. Namun jika ordenya 0, maka waktu yang dibutuhkan juga harusnya sma, kalau tidak mungkin hampir mendekati sama. Namun untuk hasil yang diperoleh bahkan jauh berbeda, yaitu dengan selisih yang cukup besar yakni 3. Mengapa demikian? Ini dikarenakan kurngnya ketelitian dalam mengamati perubahan warna larutan yang dibandingkan. Selain itu kurangnya ketepatan dalam mengklik start timet juga bisa mempengaruhi waktu yang diperoleh. Dan jika dibandingkan dengn hipotesis yang ada sebelumnya, data ini sngat salah, karena seharusnya waktu yang ditempuh untuk data keempat jauh lebih sedikit dibanding data satu.
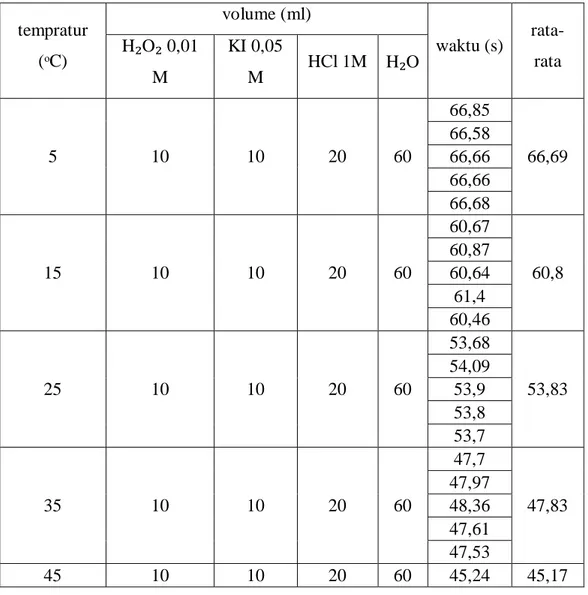
Tabel 4. Pengaruh suhu terhadap waktu dan laju reaksi.
tempratur (ᵒC) volume (ml) waktu (s) rata-rata H₂O₂ 0,01 M KI 0,05 M HCl 1M H₂O 5 10 10 20 60 66,85 66,69 66,58 66,66 66,66 66,68 15 10 10 20 60 60,67 60,8 60,87 60,64 61,4 60,46 25 10 10 20 60 53,68 53,83 54,09 53,9 53,8 53,7 35 10 10 20 60 47,7 47,83 47,97 48,36 47,61 47,53 45 10 10 20 60 45,24 45,17
45,26 45,31 45,23 44,8
Data ini menunjukkan pengaruh temperatur terhadap laju reaksi dan waktu yang ditempuh. Berdasarkan data bahwa semakin tinggi suhunya semakin cepat juga reaksinya ini terlihat waktunya semakin kecil. Dan ini sesuai dengan pendapat Chang.
Sedangkan untuk mengetahui nilai kostanta laju menggunakan metode laju reaksi. Hingga diperoleh untuk nilai K1,K2,K3,K4, dan K5 adalah 3000, 3300, 3700, 4200, dan 4400. Sedangkan saat kita mencari energi aktifasi kita membutuhkan ln K. Sehingga diperoleh ln K1, ln K2, ln K3, ln K4, dan ln K5 adalah 8; 8,1; 8,2; 8,3; dan 8,4. Sedangkan untuk mencari energi aktifasi berdasarkan metode penetapan energi aktifasi, dan ini berdasarkan pada persamaan Archenius kita membutuhkan beberapa data.
Tabel 5. Data-data untuk energi aktifasi temperatur (ᵒC) konstanta laju waktu ln K 1/T (-0C) 5 3000 5 8 0,2 15 3300 15 8,1 0,07 25 3700 25 8,2 0,04 35 4200 35 8,3 0,03 45 4400 45 8,4 0,02
Berdasarkan data perhitungan yang telah diperoleh kemudian dibuat grafik ln K, dengan begitu kita mendapatkan nilai archenius.
Dapat dilihat, bahwa variabel X merupakan 1/T. Dimana T disini adalah temperatur, sedangkan untuk variabel yang menempel pada X adalah energi aktifasi per tetapan gas. dengan perhitungan menggunakan metode penetapan aktifasi, kita dapatkan nilai energi aktifasi sebesar 15,198 J. Sedangkan untuk faktor archeniusnya sebesar kurang lebih adalah 6. Dan untuk slopenya sendiri besarnya adalah -1,828 dan unutuk intersepnya sendiri adalah 8,331.
Kesimpulan
Dari eksperimen tersebut terdapat beberapa kesimpulan, yaitu semakin tinggi konsentrasi reaktan, maka semakin cepat laju reksinya. Sedangkan untuk mencari orde reaksi masing-masing reaktan yaitu dengan cara membandingkan laju reaksi satu dengan yang lain. Dengan syarat salah satu kosentrasi reaktannya ada yang berbeda. dan untuk hubungan antara temperatur dengan laju reaksi yaitu semakin tinggi temperatur maka lajunya semakin cepat. sedangkan untuk nilai orde masing-masing reaktan adalah asam klorida nol, hidrogen
y = -1,828x + 8,331 R² = 0,731 7,9 7,95 8 8,05 8,1 8,15 8,2 8,25 8,3 8,35 8,4 8,45 0 0,05 0,1 0,15 0,2 0,25 ln K 1/T (−ᵒC)
ln K
ln K Linear (ln K)perioksida satu dan kalium iodida juga satu. Untuk nilai energi aktifasinya adalah lima belas koma satu sembilan delapan joule.
Daftar Pustaka
Agus, Akhril. 1986. Mengerti Kimia 2b. Bandung : Bumi Siliwangi. Chang,R. 2004. Kimia Dasar Jilid 2 Edisi Ketiga. Jakarta : Erlangga.
http://group.chem.iastate.edu/Greenbowe/sections/projectfolder/flashfiles/kinetics2/kinetics.s wf
Oxtoby, David .W. 2001. Prinsip-prinsip Kimia Modern Jilid 2 Edisi Keempat. Jakarta : Erlangga.
Sugiyono. 2007. Statistik untuk Penelitian. Bandung : ALFABETA
Supardi, Kasmadi Imam, Gatot Lubandjono. 2012. Kimia Dasar 2. Semarang : UNNES Vogel. 1994. Kimia Analisis Kuantitatif Anorganik. Jakarta : Penerbit Buku Kedokteran