22
PENENTUAN TETAPAN LAJU REAKSI BALIK DAN TETAPAN
KESETIMBANGAN DENGAN PENDEKATAN REAKSI SEARAH DAN HUKUM LAJU REAKSI MAJU
(DETERMINATION OF BACKWARDS RATE CONSTANT AND EQUILIBRIUM CONSTANT USING IRREVERSIBLE APPROACH AND FORWARD RATE LAW)
Patiha
Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universtas Sebelas Maret,
Jl. Ir Sutami No. 36 A, Kentingan Surakarta 57126 telp. (0271) 663375
E-mail: patiha31@yahoo.co.id
Received 6 Juni 2013, accepted 5 September 2013, published 25 September 2013
ABSTRAK
Telah diperkenalkan teknik penentuan tetapan laju reaksi balik kb dan tetapan kesetimbangan K yang menggunakan pendekatan reaksi searah dan hukum laju (awal) reaksi maju. Hukum laju reaksi balik ditentukan dari persamaan integral yang memberikan rerata harga tetapan laju dengan deviasi standar terkecil. Tetapan laju ini dihitung berdasarkan selisih konsentrasi produk teramati pada waktu-waktu tertentu dengan konsentrasi seharusnya jika reaksi maju berlangsung searah. Tetapan laju reaksi balik, kb adalah yang dihitung pada awal pengamatan, Selanjutnya, bersama dengan harga kf (yang diperoleh dari hukum laju reaksi maju), digunakan untuk menghitung tetapan kesetimbangan K. Teknik ini kemudian diuji-cobakan pada data reaksi kesetimbangan order ke-satu pada kedua arah dari Wright (2004) dan Wilkinson (1980). Kesahihan ditentukan berdasarkan kesesuaian harga kb dan K yang diberikan oleh Wright (2004) dan Wilkinson (1980).dengan toleransi perbedaan ≤ 5%. Hasil menunjukkan bahwa teknik tersebut sahih.
kata kunci: hukum laju reaksi balik; hukum laju reaksi maju; pendekatan reaksi searah; tetapan laju reaksi balik; tetapan laju reaksi maju; tetapan kesetimbangan
ABSTRACT
A determination technique of backward rate constant kb and equilibrium constant K using irreversible reaction approach and forward reaction rate law has been introduced. The rate law of backward reaction was determined from the integral equation that produced the smallest standard deviation of the average value of rate constant, k.These rate constants were calculated based on the difference of the concentration of products observed at various definited times to the concentration that should present if the forward reaction is irreversible. The backward rate constant, kb is the rate constant which is calculated at the beginning of the observation. Then, in combination with the kf value which was obtained from the forward
23 the values (with a tolerance of differences ≤ 5%) of kb and K which are given by Wright (2004) and Wilkinson (1980). The results show that the technique is valid.
Key words: backward rate constant; backward rate law; equilibrium constant; forward rate constant; forward rate law; irreversible reaction approach
PENDAHULUAN
Pada umumnya, tetapan kesetimbangan K ditentukan secara termodinamika. Berdasarkan konsep ini, untuk suatu sistem homogen, pada suatu temperatur tertentu, harga K sama dengan nisbah antara konsentrasi semua spesi produk pangkat koefisien masing-masing
dengan pereaksi pangkat koefisien masing-masing pada saat reaksi setimbang. Dalam praktek,
terkadang, ini bisa memerlukan waktu yang relatif lama.
Reaksi kesetimbangan dapat juga dipelajari secara kinetika. Untuk beberapa alasan,
cara ini bahkan lebih menguntungkan. Meski secara termodinamika reaksi pembentukan suatu
produk industri merupakan reaksi eksotermis, proses tetap dilakukan pada temperatur tinggi
karena (pertimbangan kinetika), walau hasilnya relatif lebih sedikit, waktu yang diperlukan
jauh lebih singkat. Konsep termodinamika hanya menyatakan bahwa jika konsentrasi salah
satu pereaksi dilebihkan maka kesetimbangan akan bergeser ke arah produk tetapi, konsep
kinetika menyatakan pereaksi mana yang sebaiknya dilebihkan.
Secara kinetika konvensional, tetapan (keadaan) kesetimbangan biasanya ditentukan
(atau lebih umum, diajarkan) dengan menggunakan metode diferensial yakni dengan logika:
pada saat kesetimbangan laju reaksi maju sama dengan reaksi balik, hal ini mudah diterima.
Namun ada dua masalah yang ternafikan. Pertama, secara eksperimen, laju pada saat
kesetimbangan tidak dapat ditentukan karena konsentrasi komponen reaksi tidak lagi berubah
dengan waktu. Kedua, penentuan tetapan laju berdasarkan metode diferensial tidak akan
memberikan harga yang pasti; harga yang pasti harus diperoleh dengan menggunakan metode
integral (Laidler, 1987). Patiha (2006) menyatakan bahwa, kecuali untuk reaksi order ke-nol,
harga tetapan laju k yang diperoleh (dengan metode diferensial) selalu berbeda dengan yang dari metode integral dan telah memberikan faktor koreksi sehingga harganya sama.
Penentuan harga K dengan metode integral lebih banyak digunakan. Namun sedikitnya ada 3 masalah yang bisa mengganggu. Pertama, terdapat sejumlah persamaan
integral yang cukup rumit dan berbeda tergantung pada order reaksi pada kedua arah. Data
24
kurva yang paling mendekati linear. Tentunya, ini tidak praktis karena penentuannya bersifat
trial and error. Kedua, yang bisa ditentukan hanyalah tetapan laju reaksi maju kf..Wilkinson (1980) menyatakan bahwa harga tetapan laju reaksi balik kb, hanya bisa ditentukan berdasar mekanisme reaksi yang dipostulatkan akan berlangsung. Ini bertentangan dengan kebiasaan
dalam kinetika yakni bahwa mekanisme reaksi dideduksi berdasarkan hukum laju dan bukan
sebaliknya (Espenson, 1995, dan Levine,2009). Ketiga, persamaan integral ini juga masih
menggunakan konsentrasi kesetimbangan sehingga, sekali lagi, tidak praktis dan terkesan,
termodinamika untuk kinetika.
Horiuti dan Nakamura (1967) telah memperkenalkan cara yang praktis untuk
penentuan kf melalui penentuan hukum laju reaksi maju dengan metode laju awal. Mereka
juga menyatakan bahwa antara tetapan kesetimbangan kinetika Kkin dengan tetapan kesetimbangan termodinamika K berlaku hubungan
Kkins =K [1]
dimana s adalah bilangan stoikhiometri. Konsep ini berlaku baik untuk reaksi yang berlangsung dalam satu tahap atau lebih. Tetapi, hukum laju reaksi baliknya (dan tentunya kb) tetap masih harus ditentukan berdasarkan perkiraan mekanisme reaksi yang mungkin terjadi.
Ini bisa menimbulkan ketidakpastian.
Pada reaksi besi(II) dengan raksa (II) yang mempunyai hukum laju awal vf = kf [Fe2+][Hg2*], Levine (2009) mengusulkan suatu mekanisme reaksi dan menyatakan bahwa
Kkin2 = K. Tetapi, Adamson (1986), memberikan mekanisme lain dan menyatakan bahwa pada reaksi tersebut Kkin = K. Implikasinya, untuk memperoleh keterangan yang pasti, hukum laju reaksi balik kb lebih baik ditentukan terlebih dahulu.
Berangkat dari pertimbangan bahwa, sebagai suatu tetapan, harga kf dan kb selalu mempunyai harga yang konstan (pada T tetap) selama reaksi berlangsung dan hukum laju
reaksi maju dan balik pada reaksi kesetimbangan tidak berbentuk pecahan dengan
penjumlahan pada penyebutnya, maka kb seharusnya dapat juga ditentukan pada awal-awal reaksi. Bahkan, mungkin lebih baik karena, pada kondisi ini, perubahan konsentrasi pereaksi
dan produk, relatif linear terhadap waktu. Dengan demikian tujuan kajian ini adalah sebagai
25 1. Memperkenalkan sebuah teknik baru untuk menentukan kb yang hanya mengunakan data pada awal reaksi (tanpa data pada keadaan setimbang.) dan membuktikan
bahwa Kkinyang ditentukan secara ini, sama dengan K secara konvensional. 2. Membuktikan bahwa teknik tersebut sahih .
METODE
Kajian ini bersifat teoritis. Teknik dikembangkan berdasarkan anggapan reaksi maju
dan balik berlangsung searah dan dengan metode laju awal. Untuk hukum laju reaksi maju
harga kf digunakan data dari pustaka. Berdasarkan hukum laju reaksi maju (dalam kasus ini order ke-satu), dihitung konsentrasi produk yang seharusnya ada pada waktu-waktu tertentu
jika reaksi berlangsung searah. Hasil yang diperoleh, tentunya akan lebih besar dari hasil
pengamatan karena sebagian produk telah berubah kembali menjadi pereaksi. Selisih ini
kemudian dijadikan dasar untuk menentukan hukum laju reaksi balik melalui penentuan harga
tetapan laju menggunakan persamaan-persamaan [2] dan [3]
1 perhitungan tersebut bersama dengan harga kf, digunakan untuk menghitung tetapan kesetimbangan Kkin dengan menggunakan persamaan [4]
b
26
HASIL DAN PEMBAHASAN
Teknik yang dikembangkan dalam penelitian ini dinyatakan dalam persamaan (5).
CPs-i = 2 CP-i- CPt-i (5)
Dimana CP, Ct , dan CP-s secara berurutan menyatakan konsentrasi produk sebenar
(pada waktu t), konsentrasi produk teramati (pada waktu t), dan konsenrasi produk.yang
seharusnya ada. Persamaan (5) tersebut dirumuskan mengikuti beberapa pokok pikiran yaitu
kinetika reaksi dipelajari dengan mengikuti perubahan konsentrasi pereaksi (R), hasil
pengamatan pada waktu-waktu tertentu dinyatakan sebagai CR-0, CR-1, sampai CR-x. Harga C
R-1 dan seterusnya tersebut tidaklah menyatakan konsentrasi pereaksi yang sisa yang sebenarnya
sebab, sebagian berasal dari produk karena reaksi balik. Konsentrasi pereaksi yang
seharusnya ada (bila reaksi searah) pada waktu-waktu t dihitung berdasarkan hukum laju
reaksi maju menggunakan konsentrasi awal, CR-0, tetapan laju reaksi maju kf, dan t
selanjutnya dinyatakan sebagai CRt-1dan seterusnya. Hukum laju reaksi balik ditentukan dari
konsentrasi produk. Konsentrasi produk teramati CR-0 – CR-i. Selanjutnya dinyatakan sebagai
CP-0, CP-1 sampai Cp-x. Konsentrasi produk yang seharusnya ada yaitu CRt-0 - CRt-1 sampai C
Rt-x, selanjutnya disebut dengan CPt-0, CPt-1 sampai dengan Cpt-x. Konsentrasi produk yang
kembali menjadi pereaksi yaitu CPt-0 - CP-0, CPt-1 - CP-1sampai dengan Cpt-x-Cp-x. Dengan
demikian konsentrasi produk yang seharusnya teramatj, selanjutnya dinyatakan sebagai CPs-o,
CPs-1 sampai dengan CPs-x, sama dengan selisih antara CP dengan produk yang bereaksi atau
dapat dinyatakan dalam persamaan (6) berikut,
Cps-i = CP-i– (CPt-i– CP-i)
= 2 CP-i - CPt-i (6)
Pertanyaan yang muncul adalah konsentrasi mana dari produk yang sebaiknya
dijadikan dasar bagi penentuan kb. Hukum laju reaksi balik (dan juga reaksi maju) berbanding
lurus dengan konsentrasi setiap spesies pangkat ordernya. Hukum lajunya bukan berbentuk
pecahan. Karena itu, pada dasarnya semua konsetrasi bisa, Namun, yang terbaik adalah pada
awal reaksi karena pada kondisi ini kurva konsentrasi merupakan garis linear. Jika hukum
27 tersebut menggunakan CPs-o dan CPs-1.. Akan tetapi jika hukum laju reaksi balik belum
diketahui maka harus dicari dengan menggunakan semua data CPs-i.
Teknik yang diusulkan dalam penelitian ini telah diujikan pada data yang diperoleh
dari Wright (2004) yaitu tentang reaksi isomerisasi cis- dan trans-1-etil-2-metil siklopropana (tercantum dalam Tabel 1) dan suatu soalan yang dinyatakan sebagai reaksi isomerisasi oleh
Wilkinson (1980). Kedua data tersebut dinyatakan berlangsung menuruti mekanisme reaksi
order ke-satu pada kedua arah.
Tabel 1. Variasi Perubahan Konsentrasi Reaksi Isomerisasi cis-1-Etil-2-metil siklo-propana pada sebagai Fungsi Waktu pada Temperatur 425,6 oC. ( K = [trans]eq/[cis]eq = 2,79 )
t / detik 0 400 1000 1600 2100
[cis] / mol dm-3 0,01679 0,01406 0,01102 0,00892 0,00775
Sumber : Wright (2004)
Seperti terlihat pada Tabel 1, Wright (2004) tidak mencantumkan harga konsentrasi
pereaksi pada keadaan setimbang tetapi memberikan harga tetapan kesetimbangan K sebesar 2,79. Harga ini kemudian digunakan untuk menghitung konsentrasi kesetimbangan dan selanjutnya untuk menghitung kf dengan menggunakan persamaan (7).
t
menentukan harga kb, dengan memanfaatkan harga K. Hasilnya adalah 1,65x10-4 detik-1.
Sedangkan data reaksi “isomerisasi” dari Wilkinson (1980) tercantum dalam Tabel 2.
Berdasarkan konsentrasi kesetimbangan dan aplikasi persamaan (5) dan (4), Wilkinson (1980)
memperoleh harga K, kf, dan kb, masing-masing secara berurutan adalah 2,33; 9,72x10-5detik
-1
; dan 4,17x10-5 detik-1.
Tabel 2. Variasi Perubahan Konsentrasi pada Suatu Reaksi Isomerisasi sebagai Fungsi Waktu
t / jam 0 1,0 2,0 3,0 4,0 ∞
% A 100 72,5 56,8 45,6 39,5 30
28
Aplikasi teknik pendekatan reaksi searah dan aplikasi hukum laju reaksi maju terhadap
data Wright (2004), disajikan dalam Tabel 3. .
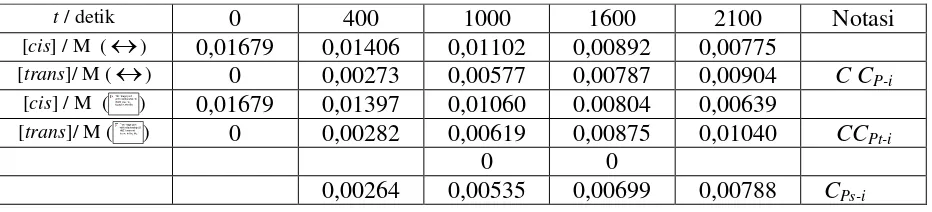
Tabel 3. Hasil Analisis terhadap data Isomerisasi cis-1-Etil-2-metil siklo-propana pada sebagai Fungsi Waktu pada Temperatur 425,6 oC (Wright, 2004) bagi penentuan konsentrasi “Awal” Codan konsentrasi “Akhir” Ct-f hasil reaksi
t / detik 0 400 1000 1600 2100 Notasi
[cis] / M () 0,01679 0,01406 0,01102 0,00892 0,00775
[trans]/ M () 0 0,00273 0,00577 0,00787 0,00904 C CP-i [cis] / M ( ) 0,01679 0,01397 0,01060 0.00804 0,00639
[trans]/ M ( ) 0 0,00282 0,00619 0,00875 0,01040 CCPt-i
0 0
0,00264 0,00535 0,00699 0,00788 CPs-i
Selanjutnya aplikasi data pada Tabel 3 untuk penentuan hukum laju reaksi balik untuk
kemungkinan order ke-satu (menggunakan persamaan [1]) dan order ke-dua (menggunakan
persamaan [3]), memberikan hasil seperti tercantum pada Tabel 4.
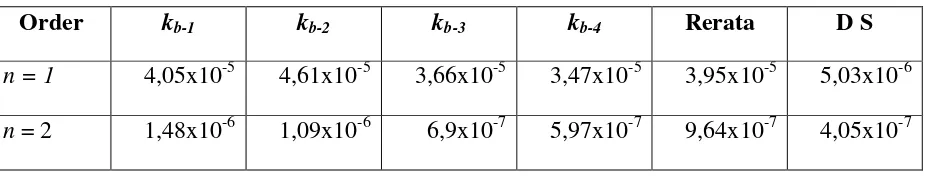
Tabel 4. Harga Tetapan Laju Reaksi Balik kb, Rerata, dan Deviasi Standar (DS) pada
Order kb-1 kb-2 kb-3 kb-4 Rerata DS
n = 1 1,65x10-4 1,46x10-4 1,40x10-4 1,32x10-4 1,46x10-4 1,41x10-5
n = 2 6,05x10-2 2,54x10-2 1,80x10-2 1,46x10-2 2,96x10-2 2,11x10-2
Berdasarkan deviasi standar yang tercantum pada Tabel 4, maka bisa diambil
kesimpulan bahwa reaksi balik dari isomerisasi cis-1-Etil-2-metil siklo-propana adalah order ke-satu terhadap senyawaan cis dan harga kb pada t yang paling awal (= 400 detik) adalah
1,65x10-4 detik-1.
Sedangkan aplikasi teknik pendekatan reaksi searah dan aplikasi hukum laju reaksi
maju terhadap pada data Wilkinsonn (1980),disajikan dalam Tabel 5.
Tabel 5. Hasil Analisis Data reaksi isomerisasi (Wilkinson, 1980) bagi Penentuan
Konsentrasi “Awal” Codan Kon-sentrasi “Akhir” CP-t Hasil Reaksi
t / jam 0 1,0 2,0 3,0 4,0 Notasi
29
% P () 0 27,5 43,2 54,4 60,5 CP-i
% A ( ) 100 70,5 49,7 35,0 24,7
% P ( ) 0 29,5 50,3 65,0 75,3 CPt-i
8
25,5 36,1 43,8 45,7 CPs-i
Aplikasi teknik pada penelitian ini terhadap data pada Tabel 5 untuk penentuan hukum
laju reaksi balik untuk kemungkinan order ke-satu (menggunakan persamaan [1]) dan order
ke-dua (menggunakan persamaan [3]), memberikan hasil seperti tercantum pada Tabel 6.
Tabel 6. Harga Tetapan Laju Reaksi Balik kb, Rerata, dan Deviasi Standar (DS) pada
Data Wilkinson Menggunakan Persamaan Integral Konvensional
Order kb-1 kb-2 kb-3 kb-4 Rerata D S
n = 1 4,05x10-5 4,61x10-5 3,66x10-5 3,47x10-5 3,95x10-5 5,03x10-6
n = 2 1,48x10-6 1,09x10-6 6,9x10-7 5,97x10-7 9,64x10-7 4,05x10-7
Berdasarkan harga deviasi standar yang tercantum dalam Tabel 6, maka bisa diambil
kesimpulan bahwa seharusnya reaksi balik merupakan order ke-dua terhadap senyawaan P (hasil reaksi). Tetapi,Wilkinson menyatakan bahwa reaksi balik juga order ke-satu dan (jika
ini yang dipegang) pada kondisi ini maka jika dibandingkan dengan data Wilkinson
(1980),yaitu 4,17x10-5, maka harga yang memenuhi adalah pada t = 1 hari atau pada yang paling awal.
Selanjutnya, dengan menggunakan persamaan [4], diperoleh harga Kkin = 2,79 untuk
Wright dan 2.40 untuk Wilkinson. Besarnya harga dan perbedaannya dengan yang diberikan
oleh Wright (2004) dan Wilkinson (1980), disajikan dalam Tabel 7.
Tabel 7. Harga Tetapan Laju Reaksi kf Maju dan Balik kbpada Data reaksi isomerisasi
(Wilkinson, 1980) dan isomerisasi cis-1-Etil-2-metil siklo-propana (Wright , 2004)
30
Persamaan Wright Wilkinson
kb t K kb t K
Reversibel 1,65x10-5 2,79 4,17x10-5 2,33
Integral 1,65x10-5 2,79 4,05x10-5 2,40
Perbedaan % 0 % 0 % 2,88 % 3,0
Langkah pertama pada kajian ini adalah penentuan hukum laju reaksi balik melalui
penentuan harga tetapan laju, yakni berdasarkan deviasi standar terkecil dari rerata tetapan
lajunya. Ini dilakukan karena tujuan utamanya adalah untuk menentukan harga tetapan laju
pada awal-awal reaksi; bukan rerata harga tetapan laju reaksi balik. Bahwa penentuan hukum
laju dilakukan terlebih dahulu juga sekaligus untuk menunjukkan bahwa teknik ini berlaku
bagi semua kemungkinan hukum laju dari reaksi balik pada reaksi kesetimbangan
Ternyata hasil menunjukkan bahwa, harga kb pada t sama dengan 400 detik sama dengan yang diberikan oleh Wright (2004) membuktikan bahwa teknik ini sahih, dengan
toleransi ..0..%. Bahwa ada perbedaan pada harga kb pada data Wilkinson, tidak membatalkan kesahihan teknik ini karena perbedaannya masih di bawah 5%. Seperti telah diungkap di atas,
Wilkinson (1980) menyatakan bahwa reaksi isomerisasi...merupakan reaksi order ke-satu pada kedua arah. Ini yang harus dijadikan pegangan dan, berdasarkan fakta perhitungan, yang
paling mendekati harga sebenarnya adalah data pertama ( yang 4,05x10-5); yang dapat dianggap data pada awal reaksi. Jika data tersebut dibandingkan dengan Wilkinson (1980)
yaitu 4,17x10-5, maka kesalahannya hanya 2,88%. Penelusuran terhadap data reaksi
isomerisasi(Wikinson, 1980) menunjukkan bahwa pada data pertama, pereaksi telah bereaksi
27,5% sedang pada reaksi isomerisasi (Wright, 2004) pereaksi telah bereaksi sebesar 16,3%.
Berdasarkan deskripsi data pada Tabel 7. , harga tetapan kesetimbangan yang
diperoleh juga persis sama dengan yang diberikan oleh Wright (2004) tetapi berbeda sebesar
3 % pada data Wilkinson (kemungkinan besar disebabkan karena datanya bukan merupakan
data laju awal) dan harga yang relatif sama pada hidrolisis etil asetat dalam suasana asam
31 Akhirnya, patut dikemukakan disini bahwa andaikata reaksi dibalik (kb yang dianggap benar) maka dengan teknik ini kf terhitung akan sama dengan pustaka. Kiranya dapat disimpulkan bahwa teknik ini sahih.
Implikasi dan implementasi
Salah satu kekurangan penelitian ini adalah karena hanya menentukan tetapan laju
reaksi balik. Adapun tetapan laju reaksi maju langsung diambilkan dari hasil yang telah ada.
Hal ini disebabkan karena tujuan awalnya hanyalah melanjutkan teknik yang ada sekarang
ini, yaitu yang hanya sebatas pada penentuan hukum laju awal. Penelitian selanjutnya akan
berusaha mengembangkan teknik ini sehingga baik tetapan laju reaksi maju maupun balik,
serta tetapan kesetimbangan dapat ditentukan cukup dengan menggunakan beberapa data awal
dari suatu reaksi kimia.
KESIMPULAN
Berdasarkan hasil-hasil perhitungan serta kajian dalam pembahasan, maka dapat diambil
kesimpulan sebagai berikut:
1. Tetapan laju reaksi balik kb dapat ditentukan dengan hanya menggunakan konsentrasi produk pada awal-awal reaksi dan harga Kkin yang diperoleh sama dengan K yang ditentukan secara konvensional.
2. Teknik ini sahih .
UCAPAN TERIMA KASIH
Penulis berterima kasih kepada Dirjen Dikti yang telah membiayai penelitian ini,
semua pihak yang telah membantu, dan kepada ananda: Robert Shah Al Haddaad, Ronald Al
Haddaad, dan Reza Shah Al Haddaad, serta istri saya Nur Laila Hidayati atas dukungan dan
kesabaran mereka.
DAFTAR PUSTAKA
Adamson, A. W. 1986. A text Book of Physical Chemistry, 3rd Ed. Academic Press, Inc. Florida.
32
Horiuti, J. and T. Nakamura. 1967. On the Theory of Heterogeneous Catalysis Adv. Catal., 17, 1-74
Laidler, K. J. 1987. Chemical Kinetics, 3rd Edition. Harper Collins Publisher, Inc. New York.
Levine, I.. N. 2009. Physical Chemistry, 3th Ed. McGraw-Hill, Inc. New York.
Patiha, 2006. Persamaan Kinetika Kimia Tunggal Hibrida Diferensial dan Integral dan Implementasinya. Laporan Penelitian Dasar tidak Dipublikasikan. Surakarta: FMIPA UNS.
Patiha, 2010. Pendekatan Kinetika terhadap Reaksi Kesetimbangan. Laporan Penelitian Fundamental tidak Dipublikasikan. FMIPA UNS. Surakarta.
Wilkinson, F. 1980. Chemical Kinetics and Reaction Mechanisms. Van Nostrand Reinhold Co. Ltd. New York.