Orde Reaksi
dan
Persamaan
Laju Reaksi
Tujuan
O 1. Menentukan orde reaksi
berdasarkan analisis data
primer/sekunder yang diperoleh melalui percobaan
O 2. Menentukan persamaan laju
reaksi berdasarkan analisis data primer/sekunder yang diperoleh melalui percobaan
O 3. Menentukan harga dan satuan
REAKSI CEPAT
Konsentrasi merupakan salah satu faktor yang mempengaruhi laju reaksi. Dengan mengetahui pengaruh konsentasi terhadap laju reaksi maka kita ingin mengetahui sejauh mana pengaruh konsentrasi terhadap laju reaksi melalui perhitungan secara matematis. Salah satu cara mengkaji secara matematis pengaruh konsentrasi reaktan terhadap laju reaksi ialah dengan menentukan orde reaksinya.
Untuk Menjawab Pertanyaan
Kalian, maka Kerjakan LKS
yang dibagikan dan Lakukan
Persamaan Laju
Secara umum untuk reaksi:
V = k[A]
m[B]
nm = orde reaksi
terhadap A
n = orde reaksi
terhadap B
A
+ B
C +
D
Salah satu faktor yang dapat
mempercepat laju reaksi adalah
konsentrasi, namun seberapa cepat
hal ini terjadi? Menemukan orde
reaksi merupakan salah satu cara
memperkirakan
sejauh
mana
konsentrasi
zat
pereaksi
Penentuan Orde
Reaksi
Orde persamaan laju reaksi
hanya dapat ditentukan secara
eksperimen dan tidak dapat
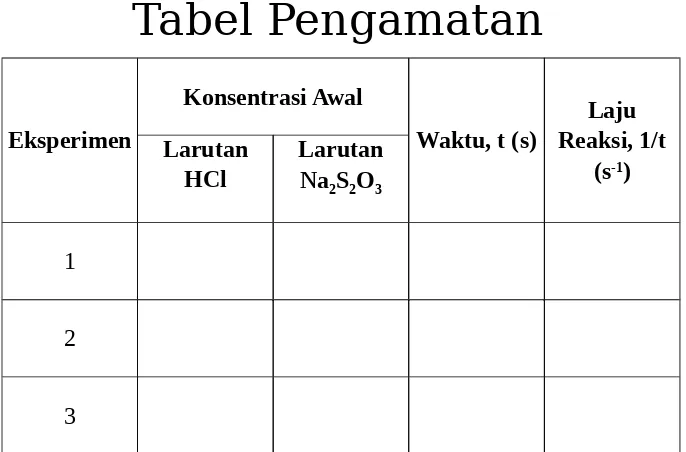
Tabel Pengamatan
Eksperimen
Konsentrasi Awal
Waktu, t (s)
Laju Reaksi, 1/t
(s-1)
Larutan HCl
Larutan Na2S2O3
1
2
Bagaimana cara menentukan orde reak
si dan persamaan laju ? Baca bahan
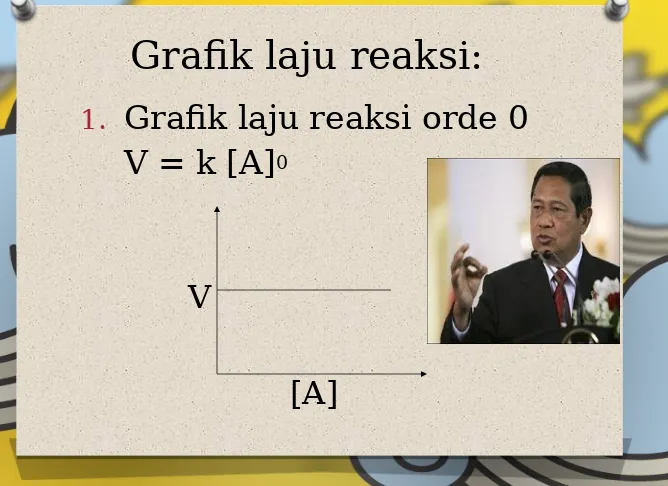
Grafik laju reaksi:
1.
Grafik laju reaksi orde 0
V = k [A]
0V
2. Grafik laju reaksi orde 1:
V = k [A]
1V
3. Grafik laju reaksi orde 2:
V= k [A]
2V
Contoh:
Tentukan:
a. Orde reaksi terhadap A b. Orde reaksi terhadap B2 c. Orde reaksi total
d. Harga tetapan k
Jawab:
a. Mencari orde A bandingkan
data [B
2] yang sama (data
nomor 2 dan 3)
m
2
b. Mencari orde B bandingkan data A yang sama (data nomor 1 dan 2)
c. Orde reaksi total = m + n
= 2+1 = 3
d. Harga tetapan k
e. Persamaan laju reaksi
n
m
B
A
k
V
[
]
[
2
]
1
2
2
5
[
]
[
]
10
2
x
A
B
Grafik laju reaksi
berikut termasuk
orde…
V
[A]
Diketahui reaksi A + B + C
D. Jika
persamaan laju reaksi reaksi tersebut
v = k.[B]
2.[C]
1, berapa kali perubahan
laju reaksinya bila konsentrasi
Dari percobaan reaksi A + B AB, diperoleh data sebagai berikut
1,05.10-2
4,2.10-2
1,05.10-2
1,4.10-1
3,5.10-2
8,4.10-1
7.10-2
Tentukan
A. Orde reaksi untuk A dan B B. Persamaan laju reaksi
C. Harga tetapan laju reaksi