LAPORAN PRAKTIKUM KIMIA DASAR 1
JURUSAN FISIKA
“Termokimia”
Disusun Oleh:
Nama
:Pitri Andayani
NIM
:M0214055
Kelompok :5
LABORATORIUM KIMIA
FAKULTAS MIPA UNS
JUDUL Termokimia TUJUAN
1.Mempelajari bahwa setiap reaksi kimia selalu disertai dengan perubahan energi.
2.Mempelajari bahwa perubahan kalor dapat diukur atau di pelajari dengan percobaan yang sederhana
DASAR TEORI
Termodinamika , dalam arti luas adalah pengkajian hubungan kuantitatif antara kalor dan benyuk lain energi , seperti energi yang dikaitkan dengan gejala elektromagnet , permukaan , dan kimia.Termodinamika kimia dapat didefinisikan sebagai cabang kimia yang menangani hubungan kalor , kerja dan bentuk lain energi , dengan kesetimbangan dalam reaksi kimia dan dalamperubahan keadaan.Erat berkaitan dengan termodinamika kimia adalh termokimia , yang menangani pengukuran dan penafsiran perubahan kalor yang menyertai reaksi kimia , perubahan keadaan , dan pembentukan larutan (Atkins,1999).
Alat yang digunakan untuk mengukur perubahan kalor selama reaksi kimia adalah kalorimeter.dua metode termokimia eksperimen yang paling biasa disebut kalorimetri
pembakaran dan kalorimetri reaksi.dalammetode pertama ,suatu unsur atau senyawa dibakar , biasanya dalam oksigen , dan energi atau kalor yang dibebaskan dalam reaksi itu
diukur.kalorimetri reaksi merujuk pada penentuan kalor reaksi apa saja selain reaksi pembakaran.metode terakhir ini lebih sering digunakan dengan senyawa anorganik dan larutan-larutannya(Dogra,1989).
Hukum-hukum termodinamika: 1. hukum pertama termodinamika
Energi dapat diubah dari satu bentuk ke bentuk lain ,namun energi tak dapat diciptakan maupun dimusnahkan.cara lain untuk mengungkapkan:energi alam semesta ini konstan. 2. hukum kedua termodinamika
Bila perubahan spontan apa saja berlangsung dalm suatu sistem tertentu ,maka akanterjadi kenaikan entropi dalam alam semesta.
3. hukum ketiga termodinamika
Suatu kristal sempurna dalam nol mutlak mempunyai keteraturan sempurna ,jadi entropinya adalah nol (Keenan1990).
Setiap reaksi kimia selalu disertai perubahan energi, baik menyerap atau menghasilkan energi, an energi tersebut bisa saja dalam bentuk kalor. Kalor (heat) yaitu perpindhan energi termal antara dua benda yang suhunya berbeda (Chang,2004).
Secara umum,perubahan energi dalam sistem adalah: dU=dq+dwe+dweksp
dengan dwe sebagai kerja lain disamping kerja pemuaian ,dweksp.misalnya dwe dapat berupa
kerja listrik mengalirkan arus melalui sirkuit.sistem yang dipertahankan pada volume tetap tidak dapat melakukan kerja pemuaian sehingga dweksp=0.jika sistem juga tidak dapat
melakukan kerja lain dwe=0 juga.
Pada keadaan dweksp=0 dan dwe=0
dU=dq pada volume tetap,tak ada tambahan kerja.
Dinyatakan hal tersebut dengan menuliskan dU=dqv.kemudian,pengukuran besarnya energi
diperoleh dari sistem tersebut (q<0),pada saat sistem mengalami perubahan keadaan,kenyataannya adalah pengukuran perubahan energi dalam ,yaitu:
∆U=∫dq untuk perubahan pada volume tetap,tak ada tambahan kerja (Sukardjo,1989).
Suatu reaksi yang membebaskan kalor adalah sutu reaksi eksoterm , dan suatu reaksi yang menyerap kalor adalah reaksi endoterm.dalam membahas perubahan energi selama reaksi kimia , ahli kimia lebih nyaman untuk membayangkan bahwa tiap zat mempunyai isi kalor tertentu ,atau entalpi ,H.perubahan kalor dalam suatu reaksi kimia disebut perubahan entalpi ,∆H.istilah perubahan entalpi merujuk pada peubahan kalor selama suatu proses yang dilakukan pada suatu tekanan konstan.bila kalor dibebaskan, produk mempunai isi kalor atau entalpi yang lebih rendah daripada pereksi.berkurangnya entapi ditunjukkan dengan memberikan tanda minus dalam harga ∆H.bila entalpi pereaksi lebih besar daripada entalpi produk,reaksi tersebut adalah eksoterm,dan sebaliknya.
Dengan membandingkan reaksi endoterm dengan reaksi kebalikannya ,dapa disimpulkan pernyataan umum berikut:jika suatu reaksi eksoterm ,maka reaksi kebalikannya adalah endoterm.kalor yang dibebaskan dalam suatu reaksi eksoterm sama besar dengan kalor yang diserap dalam reaksi endoterm kebalikannya (Keenan,1990).
METODOLOGI A.Alat
Kalorimeter 1 buah
Buret 1 buah
Termometer 1 buah
Gelas kimia 2 buah
Pengaduk 1 buah
Stopwatch 1 buah Gambar Alat
Gambar 3.Gelas Kimia Gambar 4.Buret
B.Bahan
Air dingin 50 ml
Air panas 50 ml
Larutan CuSO4 1M 50 ml Bubuk Zn 3 gram
Larutan HCl 1M 25 ml
C.Cara kerja
1.Percobaan penentuan tetapan kalorimeter
M e m a su k ka n 2 5
m l a ir d in g in ke
ka lo rim e te r
m e n ca ta
t
te m p e ra
tu rn ya
m e m a n
a ska n
2 5 m l
a ir
m e n ca ta
t
te m p e ra
tu rn ya
m e n ca m p u rka n a ir
p a n a s d e n g a n a ir d in g in
ke d a la m ka lo rim e te r
m e n g a d u k d a n
m e n g a m a ti
te m p e ra tu r
ca m p u ra n
m e m b u a t
ku rva
2.Percobaan penentuan kalor reaksi Zn + CuSO4
M e m a
s u k k a n
5 0 m l
C u S O
m e n c a t a t
t e m p e r a t u r n y a
s e la m a 2 m e n it
s e la n g 1 / 2 m e n it
m e n im b
a n g 3
g r a m
b u b u k
Z n
m e n c a m p u
r k a n b u b u k
Z n d e n g a n
C u S O
m e n g a d u k
d a n
m e n g a m a ti
t e m p e r a t u r
c a m p u r a n
m e m b u a t
k u r v a
t e m p e r a t u r
v s s e la n g
3.Percobaan pnentuan kalor penetralan HCl dan NaOH
HASIL DAN PEMBAHASAN A.Hasil
Percobaan 1
Penentuan tetapan kalorimeter
Volume air dingin = volume air panas = 25 ml Massa jenis air = 1 g/cm2
Massa air dingin = massa air panas = massa jenis air x volume = 25 gram Temperatur air dingin = 30°C
Temperatur air panas = 50°C
Tabel temperatur campuran selama 10 menit selang 1 menit
penentuan kalor reaksi Zn + CuSO4
tetapan kalorimeter =1540 J/K cZnSO4 =3,52 J/gK
massa jenis ZnSO4 = 1,14 g/cm3 volume ZnSO4 =50 ml
temperatur awal larutan CuSO4 = 29°C massa ZnSO4 =50 x 1,14 =57
gram
tabel temperatur campuran selama 10 menit selang 1 menit percobaan 3
penentuan tetapan kalorimeter
Volume air dingin = volume air panas = 25 ml Massa jenis air = 1 g/cm2
Massa air dingin = massa air panas = massa jenis air x volume = 25 gram Temperatur air dingin = 27°C
Temperatur air panas = 54°C
Tabel temperatur campuran selama 10 menit selang 1 menit
Waktu(menit) 1 2 3 4 5 6 7 8 9 10
Penentuan kalor penetralan HCl dan NaOH k =2542,43 J/K
volume HCl = volume NaOH = 25 ml massa jenis larutan = 1,03 g/cm3
c = 3,96 J/gK
massa larutan = 1,03 x 50 =51,5 gram Tawal HCl = 27°C
Tawal NaOH = 27°C
Tabel temperatur larutan HCl+NaOH selama 5 menit selang 5 menit B.Pembahasan
percobaan ini karena prinsip kerja kalorimeter yang dapat mengisolasi kalor di sistem sehingga perpindahan kalor dapat diperlambat.
Pada percobaan pencampuran air dingin dan air panas diperoleh suhu campuran yang nilainya lebih tinggi dari suhu air dingin dan lebih rendah dari suhu air panas.Ini menandakan bahwa air dingin menyerap kalor atau suhu dari air panas dan sebaliknya air panas
melepaskan kalor.Untuk menyerap dan melepaskan kalor diperlukan energi.Berdasarkan perhitungan, besarnya kalor yang dilepaskan oleh air panas lebih besar dari kalor yang diserap oleh air dingin.Besarnya kalor ini sebanding dengan perubahan suhu.Semakin besar
perubahan suhu maka semakin besar pula kalor yang diserap atau diterima oleh suatu zat.Sisa kalor yang dilepaskan oleh air panas diserap oleh kalorimeter.Pada percobaan pencampuran air panas dengan air dingin yang pertama diperoleh hasil bahwa suhu campuran semakin lama semakin menurun.Namun pada percobaan kedua suhu campuran tidak stabil.Pada awalnya suhu campuran semakin menurun,namun mulai dari menit ke-9 suhu campuran kembali naik. Berdasarkan perhitungan diperoleh nilai tetapan kalorimeter untuk percobaan pencampuran air panas dengan air dingin yang pertama yaitu 1540 J/K,dan untuk percobaan yang kedua 2542,43 J/K.
Pada percobaan pencampuran bubuk Zn dalam kalorimeter,suhu campuran semakin lama semakin meningkat. Pada saat percobaan,bubuk Zn belum larut seluruhnya sehingga terbentuk gumpalan. Berdasarkan percobaan diperoleh data bahwa semakin lama suhu campuran semakin meningkat. Berdasarkan perhitungan diperoleh nilai kalor reaksi sebesar 18798,9 J dan nilai entalpi reaksi sebesar -469972,5 J/mol. Karena entalpi bernilai negatif maka reaksi ini bersifat eksoterm.
Pada percobaan pencampuran HCl diperoleh data bahwa suhu campuran semakin lama cenderung meningkat. Berdasarkan perhitungan diperoleh nilai kalor penetralan sebesar -59321,2 J/mol.
KESIMPULAN
Berdasarkan percobaan dapat disimpulkan bahwa :
Setiap reaksi kimia selalu disertai dengan perubahan energi yaitu dalam menyerap kalor (reaksi endoterm) maupun melepas kalor (reaksi eksoterm)
Perubahan kalor atau perubahan energi dapat dipelajari dan diukur melalui percobaan yang sederhana, salah satunya melalui percobaan dengan kalorimeter sederhana. DAFTAR PUSTAKA
Atkins,P.W.,1999.Physical Chemistry (Terjemahan:Irma I. Kartohadiprodjo).Jakarta:Erlangga. Chang,Raymond.2004.Kimia Dasar Jilid 1.Jakarta:Erlangga.
Dogra.1989.Kimia Fisika dan Soal-soal.Jakarta:UI Press.
Keenan,Charles W.,dkk.1990.General College Chemistry Sixth Edition (Terjemahan:Aloysius Hadyana Pudjaatmaka).Jakarta:Erlangga.
Sukardjo.1989.Kimia Anorganik.Yogyakarta:Bina Aksara.
Surakarta,7 November 2014
Mengetahui, Praktikan
Pitri
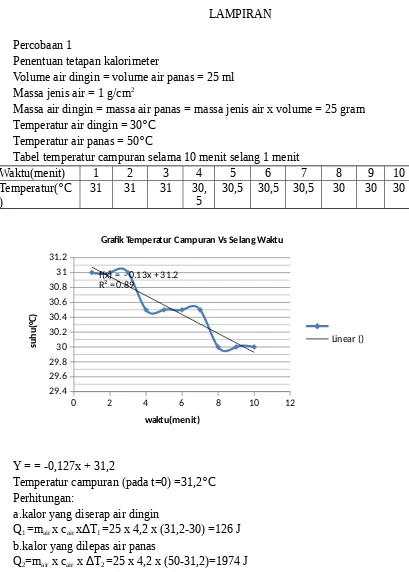
Volume air dingin = volume air panas = 25 ml Massa jenis air = 1 g/cm2
Massa air dingin = massa air panas = massa jenis air x volume = 25 gram Temperatur air dingin = 30°C
Temperatur air panas = 50°C
Tabel temperatur campuran selama 10 menit selang 1 menit
Waktu(menit) 1 2 3 4 5 6 7 8 9 10
Grafik Temperatur Campuran Vs Selang Waktu
Linear ()
Temperatur campuran (pada t=0) =31,2°C Perhitungan:
a.kalor yang diserap air dingin
Q1 =mair x cair x∆T1 =25 x 4,2 x (31,2-30) =126 J
b.kalor yang dilepas air panas
Q2=mair x cair x ∆T2 =25 x 4,2 x (50-31,2)=1974 J
Q 3 = Q2 – Q1 =1848 J
d.tetapan kalorimeter k = Q3
∆ T2 =1540 J/K percobaan 2
penentuan kalor reaksi Zn + CuSO4
tetapan kalorimeter =1540 J/K cZnSO4 =3,52 J/gK
massa jenis ZnSO4 = 1,14 g/cm3 volume ZnSO4 =50 ml
temperatur awal larutan CuSO4 = 29°C massa ZnSO4 =50 x 1,14 =57
gram
tabel temperatur campuran selama 10 menit selang 1 menit
0 2 4 6 8 10 12
Grafik Temperatur Campuran Vs Selang Waktu
Linear ()
a.kalor yang diserap larutan
Q4 = mZnSO4 x cZnSO4 x ∆T4 =57 x 3,52 x (39,8-29) = 2166,9 J
b.kalor yang diserap kalorimeter
Q5 = k x ∆T4 =1540 x (39,8-29) = 16632 J
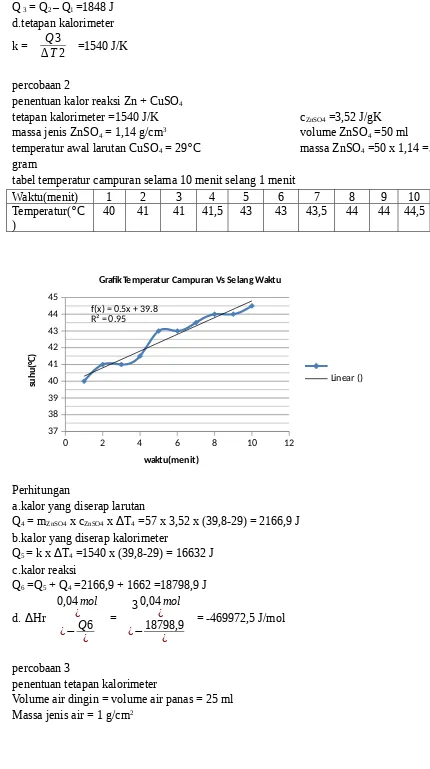
Volume air dingin = volume air panas = 25 ml Massa jenis air = 1 g/cm2
Waktu(menit) 1 2 3 4 5 6 7 8 9 10 Temperatur(°C
)
Massa air dingin = massa air panas = massa jenis air x volume = 25 gram Temperatur air dingin = 27°C
Temperatur air panas = 54°C
Tabel temperatur campuran selama 10 menit selang 1 menit
Waktu(menit) 1 2 3 4 5 6 7 8 9 10
Grafik Temperatur Campuran Vs Selang Waktu
Linear ()
a.kalor yang diserap air dingin
Q7 = m x c x ∆ T7 = 25 x 4,2 x (28,03-27) = 108,15 J
b.kalor yang dilepas air panas
Q8 = m x c x ∆ T8 = 25 x 4,2 x (54-28,03) =2726,85 J
c.kalor yang diserap kalorimeter Q9 = Q8-Q7 = 2618,7 J
Penentuan kalor penetralan HCl dan NaOH k =2542,43 J/K
volume HCl = volume NaOH = 25 ml massa jenis larutan = 1,03 g/cm3
c = 3,96 J/gK
massa larutan = 1,03 x 50 =51,5 gram Tawal HCl = 27°C
Tawal NaOH = 27°C
Tabel temperatur larutan HCl+NaOH selama 5 menit selang 5 menit
Waktu(menit) 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 Temperatur(°C
)
y = 0,116x + 27,54 Reaksi
NaOH(aq) +HCl(aq) NaCl(aq) + H2O(l)
M 0,025 0,025
B 0,025 0,025 0,025 0,025 S 0 0 0,025 0,025 Perhitungan
a.kalor yang diserap larutan
Q10 = m x c x ∆ T10 = 51,5 x 3,96 x (27,54-27) = 110,13 J
b.kalor yang diserap kalorimeter
Q11 = k x ∆ T10 = 2542,43 x (27,54-27) = 1372,9 J
c.kalor reaksi
Q12 = Q10 + Q11 =110,13 +1372,9 =1483,03 J d.kalor penetralan
∆Hn = −Q12
mol NaCl =
−1483,03