LAPORAN PRAKTIKUM KIMIA FISIK ENTALPI ADSORPSI
Nama : Rizka Fithriani Safira Sukma NIM : 131810301049
Kelompok : 5
Asisten : Ika Puji Lestari
LABORATORIUM KIMIA FISIK JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
BAB 1. PENDAHULUAN
1.1 Tujuan
Tujuan percobaan ini adalah mempelajari secara kuantitatif sifat-sifat adsorpsi suatu bahan adsorben dan menentukan entalpi adsorpsi.
1.2 Latar Belakang
Entalpi adalah istilah dalam termodinamika yang menyatakan jumlah energi internal dari suatu sistem termodinamika ditambah energi yang digunakan untuk melakukan kerja pada sebuah materi.. Entalpi yang berperan disini adalah entalpi pelarutan, yang dimaksud dengan entalpi pelarutan adalah jumlah kalor yang diperlukan atau dibebaskan untuk melarutkan 1 mol zat pada keadaan standar.
Entalpi adsorpsi sangat berguna dalam banyak hal dalam kehidupan, misalnya pada suatu proses dapat ditambahkan sabun untuk menstabilkan emulsi air dengan minyak. Kestabilan akan meningkat karena molekul sabun akan teradsorpsi pada permukaan antara kedua cairan. Alternatif pengganti untuk proses koagulasi-flokulasi adalah proses adsorpsi dengan menggunakan karbon aktif. Proses adsorpsi oleh karbon aktif terbukti memberikan hasil yang baik dalam menyisihkan kandungan warna maupun organik. Karbon aktif juga sangat bagus untuk menyerap bau dan zat-zat pengotor lainnya, karena karbon aktif ini memiliki pori-pori permukaan yang besar.
Adsorbsi yang banyak dilihat dalam kehidupan sehari-hari adalah mengenai penyerapan, yaitu seberapa besar daya penyerapan dari sebuah adsorben. Terlebih dahulu dipelajari dan dipahami lebih lanjut mengenai sifat-sifat adsorbsi dari adsorben. Misalnya saja kertas yang menyerap tinta dari pena. Proses adsorpsi lainnya juga terjadi pada hujan. Bila tidak ada proses adsorbsi (penyerapan) air hujan oleh akar-akar tanaman maka akan terjadi banjir sebab tidak ada media yang menyerapnya. Untuk itu, perlu dipelajari lebih lanjut mengenai sifat-sifat adsorbsi dan berapa besar daya adsorbsinya agar tidak terjadi ketimpangan terhadap alam.
1.3 Tinjauan Pustaka
1.3.1 Material Safety Data Sheet (MSDS) a. Akuades
Akuades atau air mempunyai rumus kimia H2O. air tidak bersifat korosif, iritasi,
terhirup. Akuades tidak memiliki efek karsinogenik dan mutagenic. Bahan ini tidak mudah terbakar ataupun meledak. Akuades merupakan senyawa netral yang memiliki pH 7, tidak berbau dan tidak berwarna serta tidak berasa. Air mempunyai titik didih 100oC dan
merupakan senyawa yang stabil (Anonim, 2015). b. Asam Oksalat
Asam oksalat atau H2C2O4 biasanya terdapat dalam bentuk hidratnya yaitu C2O4.H2O.
Bahan ini bersifat iritan, permeator dan korosif terhadap kulit dan mata pada konsentrasi yang tinggi. Bahan ini juga berbahaya jika terkena kulit dan mata secara terus-menerus. Bahan ini tidak bersifat mutagenic atau karsinogenik. Asam oksalat dapat terbakar pada suhu tinggi dan dapat meledak jika bersentuhan dengan api. Asam oksalat biasanya berwujud padat, tidak berbau dan tidak berwarna. Massa molekul relatifnya adalah 90,04 g/mol dengan titik leleh 189,5oC. Bahan ini larut dalam air dingin, dietil eter, alcohol, gliserol dan tidak larut dalam
benzena dan petroleum eter. Penanganan pada kecelakaan dengan kontak kulit atau mata, segera dibasuh dengan air mengalir selama kurang lebih 15 menit, sedangkan jika tertelan segera basuh mulut dengan air dan beri minum, untuk korban yang menghirup segera dibawa ke udara segar (Anonim, 2015).
c. Asam Asetat
Asam asetat atau C2H4O2 atau biasanya CH3COOH. Bahan ini bersifat iritan,
permeator dan korosif terhadap kulit dan mata pada konsentrasi yang tinggi. Bahan ini juga berbahaya jika terkena kulit dan mata secara terus-menerus. Bahan ini tidak bersifat mutagenic atau karsinogenik. Asam asetat biasanya berwujud cair, berbau dan berasa cuka sangat kuat dan tajam serta tidak berwarna. Massa molekul relatifnya adalah 60,05 g/mol dengan titik didih 181,1oC dan titik leleh 16,6oC. Penyimpanan ditempat yang sejuk dan jauh
dari api (Anonim, 2015). d. NaOH
Natrium hidroksida adalah bahan yang bersifat korosif terhadap jaringan tubuh seperti kulit, mata dan mulut. NaOH memiliki titik didih sebesar 100oC dan titik leleh sebesar 0oC. NaOH
e. Indikator Phenolphthalein
Indikator fenolptalein terdiri dari 5% air, 95% etil alcohol dan 1% bubuk fenolptalein. Bahan ini bersifat iritan dan permeator terhadap kulit, iitan pada mata dan berbahaya jika terhirup. Indicator fenolptalein dapat terbakar pada 363oC, dan dapat meledak jika terjai kontak dengan
agen oksidasi asam, tapi tidak meledak jika terkena guncangan. Bahan ini berwujud cair, tidak berwarna pada asam dan berwarna pink atau merah pucat dalam basa. Indicator ini juga tidak berbau memiliki titik didih 78,5oC dan titik leleh -114,1oC. Bahan ini sangat mudah larut
dalam air panas, air dingin, methanol dan dietil eter, juga larut dalam aseton. Bahan ini termasuk bahan yang stabil. Indicator ini sangat reaktif dengan agen oksidasi, asam dan alkali. Indicator ini sebaiknya disimpan dalam area yang khusus. Wadah yang digunakan untuk menyimpan sebaiknya ditutup dengan rapat dan dikunci sampai akan digunakan, hindari sumber-sumber kebakaran seperti api dan suhu yang panas. Tempat diusahakan sejuk dan berventilasi baik (Anonim, 2015).
f. Karbon aktif
Karbon aktif biasanya berbentuk butir atau bubuk hitam yang tidak berbau. Karbon aktif khususnya pada keadaan basah dapat menghabiskan oksigen di udara dalam ruang tertutup. Bahan ini tidak kororsif, namun dapat menyebabkan iritasi pada kulit dan mata, serta iritasi pernapasan jika terkena hirup. Pertolongan pertama sama dengan bahan sebelumnya. Karbon aktif sangat sulit untuk terbakar, bahan ini cenderung menghasilkan nyala kecil tanpa asap ataupun api. Pembakaran akan menghasilkan gas beracun. Penyimpanan ditempat tertutup jauh dari bahan pengoksidasi seperti ozon, oksigen cair, klorin dan permanganate (Anonim, 2015).
1.3.2 Dasar Teori
Salah satu sifat penting dari permukaan zat adalah adsorpsi. Adsorpsi adalah suatu proses yang terjadi ketika suatu fluida (cairan maupun gas) terikat pada suatu padatan dan akhirnya membentuk suatu film (lapisan tipis) pada permukaan padatan tersebut. Berbeda dengan absorpsi dimana fluida terserap oleh fluida lainnya dengan membentuk suatu larutan. Adsorpsi secara umum adalah proses penggumpalan substansi terlarut (soluble) yang ada dalam larutan, oleh permukaan zat atau benda penyerap, dimana terjadi suatu ikatan kimia fisika antara substansi dengan penyerapnya. Dalam proses adsorpsi ada zat yang terserap pada suatu permukaan zat lain yang disebut adsorbat, sedangkan zat yang permukaannya dapat menyerap zat lain disebut adsorben (Brady, 1999).
permukaan zat lain yang disebut adsorbat, sedangkan zat yang permukaannya dapat menyerap zat lain disebut adsorben. Adsorpsi atau penyerapan berbeda dengan absorpsi atau penyerapan, sebab pada proses absorpsi zat yang terserap menembus ke dalam zat penyerap. Secara kimia absorpsi adalah masuknya gas ke dalam padatan atau lareutan, atau masuknya cairan ke dalam padatan. Sedangkan secara fisika, absorpsi adalah perubahan energi radiasi elektromagnetik, bunyi, berkas partikel, dan lain-lain ke dalam bentuk energi lain jika dilewatkan pada suatu medium. Bila foton diserap akan terjadi suatu peralihan ke keadan tereksitasi (Daintith, 1994).
Kinetika adsorpsi menyatakan adanya proses penyerapan suatu zat oleh adsorben dalam fungsi waktu. Adsorpsi terjadi pada permukaan zat padat karena adanya gaya tarik atom atau molekul pada permukaan zat padat. Molekul-molekul pada permukaan zat padat atau zat cair, mempunyai gaya tarik ke arah dalam karena tidak ada gaya-gaya lain yang mengimbangi. Adanya gaya-gaya ini menyebabkan zat padat dan zat cair mempunyai gaya adsorpsi. Adsorpsi berberda dengan absorpsi. Pada absorpsi zat yang diserap masuk ke dalam adsorben, sedangkan pada adsorpsi, zat yang diserap hanya terdapat pada permukaannya (Sukardjo, 1989).
Adsorpsi berbeda dengan absorpsi, sebab pada proses absorpsi zat yang terserap menembus ke dalam zat penyerap sedangkan adsorpsi hanya pada permukaannya saja. Adsorben ialah zat yang melakukan penyerapan terhadap zat lain (baik cairan maupun gas) pada proses adsorpsi. Adsorben yang paling banyak dipakai untuk menyerap zat-zat dalam larutan adalah arang. Zat ini banyak dipakai di pabrik untuk menghilangkan zat-zat warna dalam larutan. Penyerapan bersifat selektif, yang diserap hanya zat terlarut atau pelarut sangat mirip dengan penyerapan gas oleh zat padat. Ketika pelarut yang mengandung zat terlarut tersebut kontak dengan adsorben, terjadi perpindahan massa zat terlarut dari pelarut ke permukaan adsorben, sehingga konsentrasi zat terlarut di dalam cairan dan di dalam padatan akan berubah terhadap waktu dan posisinya dalam kolom adsorpsi (Atkins, 2006).
Jenis-jenis adsorpsi ada dua macam, yaitu Adsorpsi fisik atau Van der Waals yang memiliki cirri-ciri diantaranya panas adsorpsi rendah ( 10.000 kal/mol) serta kesetimbangan adsorpsi reversibel dan cepat. Contoh adsorpsi ini adalah adsorpsi gas pada charcoal. Yang kedua adalah Adsorpsi kimia atau adsorpsi aktivasi di mana panas adsorpsinya tinggi (20.000 – 100.000 kal/mol) dan terjadi dengan pembentukan senyawa kimia, hingga ikatannya lebih kuat. Misalnya : adsorpsi CO pada W, adsorpsi O2 pada Ag, Au, Pt, C, adsorpsi H2 pada Ni (Sukardjo, 1989).
adsorpsi juga dibedakan menjadi tiga macam. Yang pertama disebut chemisorption, terjadi karena ikatan kimia (chemical bonding) antara molekul zat terlarut (solute) dengan molekul adsorban. Adsorpsi ini bersifat sangat eksotermis dan tidak dapat berbalik (irreversible). Yang kedua, adsorpsi fisika (physical adsorption, terjadi karena gaya tarik molekul oleh gaya van der Waals dan yang ketiga disebut ion exchange (pertukaran ion), terjadi karena gaya elektrostatis.
Berdasarkan jenis adsorbatnya, tingkat adsorpsi digolongkan menjadi tiga, yaitu lemah (weak), terjadi pada zat anorganik kecuali golongan halogen (salah satunya adalah klor). Adsorpsi menengah (medium), terjadi pada zat organik alifatik dan adsorpsi kuat (strong) terjadi pada senyawa aromatik (zat organik yang berbau (aroma) dengan struktur benzene (C6H6) (Alberty, 1992).
Jenis-jenis bahan yang dapat digunakan sebagai absorben adalah air (untuk gas-gas yang dapat larut atau untuk pemisahan partikel debu dan tetesan cairan), natrium hidroksida (untuk gas-gas yang dapat bereaksi seperti asam) dan asam sulfat (untuk gas-gas yang dapat bereaksi seperti basa).Dalam proses adsorpsi dikenal juga kolom adsorpsi dimana kolom adsorpsi itu sendiri adalah suatu kolom atau tabung tempat terjadinya proses pengabsorbsi (penyerapan/penggumpalan) dari zat yang dilewatkan di kolom/tabung tersebut. Proses ini dilakukan dengan melewatkan zat yang terkontaminasi oleh komponen lain dan zat tersebut dilewatkan ke kolom ini dimana terdapat fase cair dari komponen tersebut(Warnana, 2007).
Langmuir menganggap permukaan suatu zat padat terdiri dari ruang elementer yang masing-masing dapat mengadsorpsi satu molekul gas. Ia mengandaikan bahwa semua ruang elementer adalah identik dalam afinitasnya untuk molekul gas dan adanya molekul gas pada satu ruang tak mempengaruhi sifat dari ruang yang ada di dekatnya. Bila θ adalah fraksi permukaan yang ditempati oleh molekul gas, laju penguapan dari permukaan adalah rθ, denganr adalah sebagai laju penguapan dari permukaan yang tertutup sempurna pada suhu tertentu. Pada kesetimbangan, laju penguapan gas yang teradsorpsi sama dengan laju kondensasi (Alberty, 1992).
Adsorpsi isotherm Langmuir menggambarkan persamaan sebagai berikut c/(X/m) = (1/α) + c(β/α)
BAB 2. METODOLOGI PERCOBAAN
- Distandarisasi larutan NaOH yang akan digunakan dengan asam oksalat. - Dibuat masing-masing larutan asam asetat sebanyak 50 mL dengan
konsentrasi 1,0; 0,8; 0,6; 0,4 M
- Diambil 5 mL tiap-tiap larutan asam asetat untuk dititrasi dengan 0,5 M NaOH dengan menggunakan indicator pp. Hasil titrasi menunjukkan konsentrasi asam asetat mula-mula.
- Diambil setiap larutan sebanyak 15 mL dan dimasukkan ke dalam Erlenmeyer lalu ditambahkan ke dalam masing-masing larutan beberapa gram adsorben (karbon aktif).
- Dikocok dan ditutup dengan kertas saring dan dimasukkan ke dalam water bath selama 15 menit. Diambil masing-masing filtrate sebanyak 5 mL dan diberi indicator sebanyak 2 tetes, kemudian dititrasi dengan NaOH sehingga dapat diketahui konsentrasi asam asetat dalam larutan. Ditentukan jumlah asam asetat yang diadsorpsi.
Asam Asetat Oksalat
BAB 3. HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Data Hasil Percobaan Konsentrasi Asam
Asetat
V NaOH sebelum adsorbsi
V NaOH setelah ditambah karbon aktif
Suhu 1 Suhu 2
0,4 M 4,4 mL 3,7 mL 3,6 mL
0,6 M 7,3 mL 5,6 mL 5,7 mL
0,8 M 8,3 mL 7,0 mL 7,6 mL
1,0 M 10,3 mL 9,0 mL 9,1 mL
3.1.2 Data Hasil Perhitungan a. Suhu 1 (50oC – 49oC)
Konsentrasi X m X/m Log X/m C Log C
0,4 M 17,7 mg 1 g 0,0177 -1,752 0,372
-0,429
0,6 M 42,9 mg 1 g 0,0429 -1,367 0,617
-0,209
0,8 M 33,0 mg 1 g 0,0330 -1,481 0,702
-0,154
1,0 M 33,0 mg 1 g 0,0330 -1,481 0,871
-0,059 b. Suhu 2 (49oC – 48oC)
Konsentrasi X m X/m Log X/m C Log C
0,4 M 20,4 mg 1 g 0,0204 -1,690 0,372
-0.429
0,6 M 40,5 mg 1 g 0,0405 -1,392 0,617
-0.209
0,8 M 17,7 mg 1 g 0,0177 -1,752 0,702
-0.154 1,0 M 30,6 mg 1 g 0,0306 -0,444 0,871 -0.059
Praktikum kali ini adalah entalpi adsorpsi. Pada praktikum ini digunakan karbon aktif sebagai adsorben yang memiliki sifa-sifat adsorpsi yaitu permukaannya dapat menyerap zat lain. Adsorbat atau zat yang terserap pada suatu permukaan zat lain pada praktikum ini adalah asam asetat yang dititrasi dengan NaOH. Sebelumnya NaOH distandarisasi dengan menggunakan asam oksalat dengan normalitas 0,5 N. Asam oksalat yang larutkan dalam air adalah 1,576 gram. Asam oksalat yang digunakan adalah asam oksalat dihidrat. Larutan asam oksalat tadi kemudian diambil 5 mL untuk dititrasi dengan NaOH. NaOH harus distandarisasi untuk mengetahui atau memastikan konsentrasinya. Selain itu, NaOH juga merupakan bahan / basa sekunder sehingga harus dititrasi terlebih dahulu.
Titrasi dilakukan dengan menambahkan 2 tetes indicator phenolphthalein. Indicator ini dipakai karena asam oksalat dengan NaOH adalah pasangan Asam-basa kuat. Oleh karena itu, maka titik ekuivalen dari titrasi diperkirakan mencapai pH 8 ke atas. Phenolphthalein merupakan indicator yang tidak berwarna pada pH asam, dan akan berwarna pink pada saat mencapai pH 8-10. Hal ini sesuai untuk mengamati titrasi tersebut sehingga dapat dihentikan dengan tepat pada saat mencapai titik ekuivalen. Asam asetat juga dittrasi menggunakan indicator pp. walaupun CH3COOH bukan merupakan asam kuat, namun NaOH adalah asam
kuat sehingga titik ekuivalennya mungkin diantara pH 7-8, karena itulah indicator pp cocok untuk dipakai pada titrasi ini.
Setelah standarisasi selesai, maka dilanjutkan dengan melakukan titrasi CH3COOH
dengan NaOH yang sudah distandarisasi. CH3COOH atau asam asetat sebelumnya telah
diencerkan ke dalam berbagai variasi konsentrasi, yaitu 0,4; 0,6; 0,8 dan 1,0 M. Seperti yang terlihat pada tabel, semakin tinggi konsentrasi, maka volume NaOH yang diperlukan juga semakin bertambah. Konsentrasi 0,4 M membutuhkan 4,4 mL NaOH dan terus naik secara konstan untuk konsentrasi selanjutnya sampai konsentrasi 1,0 M. Semakin tinggi konsentrasi atau semakin pekat larutan maka semakin banyak zat yang yang ada dalam larutan, karena itulah volume NaOH yang dibutuhkan juga semakin besar seiring bertambahnya konsentrasi.
asetat oleh karbon aktif. Suhu yang digunakan mengikuti kelompok yang juga menggunakan waterbath tersebut, karena hal ini dapat dilakukan pada suhu berapa saja. Pemanasan ini bertujuan untuk melihat pengaruh suhu terhadap hasil adsorpsi. Setelah 1 menit, larutan dikeluarkan dari watebath dan diambil 5 mL untuk dititrasi dengan NaOH. Pada titrasi ini, larutan asam asetat diserap oleh karbon aktif sehingga asam asetat yang awalnya tidak murni merjadi lebih murni karena zat-zat lain yang ikut pada asam asetat menjadi terserap oleh karbon aktif. Sehingga asam asetat yang semula konsentrasinya tinggi menjadi lebih rendah konsentrasinya, hal tersebut yang menyebabkan turunnya volume NaOH yang dibutuhkan untuk titrasi.
Suhu yang digunakan pada praktikum ini adalah 2 variasi, yaitu suhu pertama dengan rentang 48-50oC dan suhu kedua pada 48-49oC. Secara rata-rata, semakin tinggi suhu maka
semakin banyak volume NaOH yang dibutuhkan dalam titrasi, walaupun kenaikannya hanya 0,1 mL. Jika konsentrasi asam asetat semakin besar, maka proses adsorpsi yang dilakukan adsorben karbon aktif semakin cepat hal ini dapat dilihat dengan semakin cepatnya titik ekivalen dan titik akhir yang dicapai saat titrasi dengan semakin berkurangnya konsentrasi asam asetat. Reaksi saat titrasi adalah sebagai berikut.
CH3COOH(aq) + NaOH(aq) CH3COONa(aq) + H2O(l)
Sebelum dilakukan titrasi, larutan asam asetat yang didalamnya terdapat karbon aktif disaring dengan menggunakan kertas saring untuk mendapatkan filtrate yang akan dititrasi. Karbon aktif yang ada pada kertas saring kemudian dikeringkan dengan cara dioven. Setelah kering, karbon tersebut ditimbang. Langkah ini dilakukan untuk memperoleh berat adsorben dalam keadaan setimbang (C), yang kemudian dicari lognya untuk dapat dijadikan grafik dengan log X/m. Berikut adalah grafik hubungan log X/m dengan log C pada suhu 1.
-0.5 -0.4 -0.3 -0.2 -0.1 0
Pada grafik tersebut dapat dilihat bahwa y = mx + c, di mana m = n. oleh sebab itu, n yang didapat pada suhu 1 ini adalah 0,799. Sedangkan untuk log k digunakan nilai c = -1,350. Sehingga didapat k = 0,0446. Grafik ini lebih baik dibandingkan dengan grafik yang selanjutnya, karena masih hanya turun dari konsentrasi 0,6 M ke 0,8 M dan penurunannya juga tidak terlampau banyak.
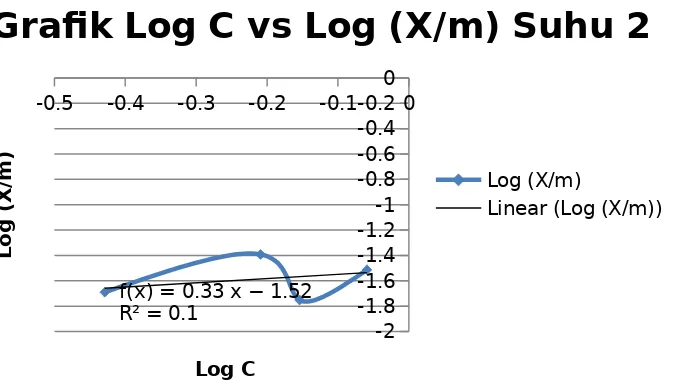
Grafik hubungan Log (X/m) dengan Log C pada suhu 48-49oC
0 0 0 0 0 0 0 0
-3.6 -3.5 -3.4 -3.3 -3.2 -3.1 -3 -2.9
-3.11
-3.49 f(x) = − 38000 x + 114.69
R² = 1
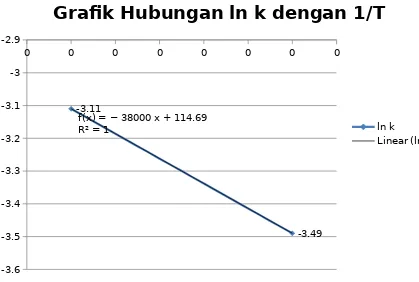
Grafk Hubungan ln k dengan 1/T
ln k
Linear (ln k)
Grafik hubungan ln k dengan 1/T
Gambar diatas adalah grafik hubungan ln k dengan 1/T. Grafik ini menunjukkan garis yang linier. Hal ini disebabkan karena suhu yang digunakan tidak terpaut jauh, suhu pertama adalah antara 49-50oC dan suhu kedua sebesar 48-49oC. Suhu yang digunakan juga hanya
variasi dua suhu karena kendala waktu yang tidak mencukupi. Sehingga tidak dapat terlihat pada daerah mana grafik tidak linier. Dari grafik tersebut didapat ∆H sebesar 315932J mol−1
K−1
atau 315,9kJ mol−1 K−1
BAB 4. PENUTUP
4.1 Kesimpulan
Adapun kesimpulan yang diperoleh dari praktikum kali ini adalah mengetahui sifat dari bahan adsorben yang mana pada praktikum ini adsorben yang digunakan adalah karbon aktif. Karbon aktif memiliki sifat adsorbs yang sangat kuat baik di udara maupun dalam suatu cairan. Oleh karena itu, pada saat asam asetat ditambahkan dengan karbon aktif, konsentrasinya semakin sedikit dilihat dari hasil titrasi dengan volume NaOH yang dibutuhkan semakin sedikit. Hal tersebut terjadi karena karbon aktif mengadsorpsi zat-zat lain yang ada dalam asam asetat.
4.2 Saran
DAFTAR PUSTAKA
Alberty, Robert. 1992. Kimia Fisika Jilid I. Jakarta : Erlangga.
Anonym. 2015. MSDS Akuades. [Serial Online]. http://www.sciencelab.com/msds.php? msdsId=9924923. Diakses tanggal 20 Maret 2015.
Anonym. 2015. MSDS Asam Asetat. [Serial Online]. http://www.sciencelab.com/msds.php? msdsId=9927321. Diakses tanggal 1 April 2015.
Anonym. 2015. MSDS Asam Oksalat. [Serial Online]. http://www.sciencelab.com/msds.php? msdsId=9922902. Diakses tanggal 20 Maret 2015.
Anonym. 2015. MSDS Indicator Phenolphthalein. [Serial Online].
http://www.sciencelab.com/msds.php?msdsId=9921345. Diakses tanggal 20 Maret 2015.
Anonym. 2015. MSDS Karbon Aktif. [Serial Online]. http://www.sciencelab.com/msds.php? msdsId=9923955. Diakses tanggal 1 April 2015.
Anonym. 2015. MSDS NaOH. [Serial Online]. http://www.sciencelab.com/msds.php? msdsId=9924359. Diakses tanggal 20 Maret 2015.
Atkins, P.W. 2006. Kimia Fisik. Jakarta : Erlangga.
Brady, James, E,. 1999. Kimia Universitas Jilid 1. Jakarta : Erlangga. Daintith, J. 1994, Kamus Lengkap Kimia. Jakarta : Erlangga.
Sukardjo. 1989. Kimia Fisika. Jakarta : PT. Rineka Cipta.
Lampiran
Perhitungan 1. Massa asam oksalat :
0,5 N =M2
M = 1 M 1M = MrxVm
1M = 157,6g m
/molx10x10−3L
m=1,576gram
2. Volume Pengenceran 1 M Asam Asetat:
0,4 M Asam Asetat M1.V1=M2.V2
1M.V1=0,4M.50 mL
V1= 20mL
0,6 M Asam Asetat M1.V1=M2.V2
1M.V1=0,6M.50 mL
V1= 30 mL
0,8 M Asam Asetat M1.V1=M2.V2
1M.V1=0,8M.50 mL
V1= 40 mL
1 M Asam Asetat 50 mL
3. Standarisasi NaOH:
MNaOH.VNaOH = MAsam Oksalat.VAsam Oksalat
MNaOH . 5,9 mL = 0,5 N . 5 mL
MNaOH = 0,423 M
4. Massa Asam Asetat sebelum adsorbsi
0,4 M Asam Asetat
- Konsentrasi asam asetat 0,4 M MNaOH.VNaOH = MAsam Asetat.VAsam Asetat
0,423 M. 4,4 mL = MAsam Asetat. 5 mL
- Mol = MxV
= 0,372 M x 5 mL = 1,86 mmol - Massa = n x Mr
= 1,86 m mol x 60 gram/mol = 111, 6 mg
0,6 M Asam Asetat
- Konsentrasi asam asetat 0,6 M MNaOH.VNaOH = MAsam Asetat.VAsam Asetat
0,423 M. 7,3 mL = MAsam Asetat. 5 mL
0,617 M = MAsam Asetat
- Mol = MxV
= 0,617 M x 5 mL = 3,085 mmol - Massa = n x Mr
= 3,085 mmol x 60 gram/mol = 185,1 mg
0,8 M Asam Asetat
- Konsentrasi asam asetat 0,8 M MNaOH.VNaOH = MAsam Asetat.VAsam Asetat
0,423 M. 8,3 mL = MAsam Asetat. 5 mL
0,702 M = MAsam Asetat
- Mol = MxV
= 0,702 M x 5 mL = 3,51 mmol - Massa = n x Mr
= 3,51 mmol x 60 gram/mol = 210,6 mg
1 M Asam Asetat
- Konsentrasi asam asetat 1 M MNaOH.VNaOH = MAsam Asetat.VAaam Asetat
0,423 M. 10,3 mL = MAsam Asetat. 5 mL
- Mol = MxV
= 0,871M x 5 mL = 4,355 mmol - Massa = n x Mr
= 4,355 mmol x 60 gram/mol = 261,3 mg
5. Massa Asam Asetat setelah adsorbsi Suhu 1
0,4 M Asam Asetat
- Konsentrasi asam asetat 0,4 M MNaOH.VNaOH = MAsam Asetat.VAsam Asetat
0,423 M. 3,7 mL = MAsam Asetat. 5 mL
0,313 M = MAsam Asetat
- Mol = MxV
= 0,313 M x 5 mL = 1,565 mmol - Massa = n x Mr
= 1,565 mmol x 60 gram/mol = 93,9 mg
0,6 M Asam Asetat
- Konsentrasi asam asetat 0,6 M MNaOH.VNaOH = MAsam Asetat.VAsam Asetat
0,423 M. 5,6 mL = MAsam Asetat. 5 mL
0,474 M = MAsam Asetat
- Mol = MxV
= 0,474 M x 5 mL = 2,37 mmol - Massa = n x Mr
= 2,37 mmol x 60 gram/mol = 142,2 mg
0,8 M Asam Asetat
MNaOH.VNaOH = MAsam Asetat.VAsam Asetat
0,423 M. 7 mL = MAsam Asetat. 5 mL
0,592 M = MAsam Asetat
- Mol = MxV
= 0,592 M x 5 mL = 2,96 mmol - Massa = n x Mr
= 2,96 mmol x 60 gram/mol = 177,6 mg
1 M Asam Asetat
- Konsentrasi asam asetat 1 M MNaOH.VNaOH = MAsam Asetat.VAsam Asetat
0,423 M. 9 mL = MAsam Asetat. 5 mL
0,761 M = MAsam Asetat
- Mol = MxV
= 0,761M x 5 mL = 3,805 mmol - Massa = n x Mr
= 3,805 mmol x 60 gram/mol = 228,3 mg
Suhu 2
0,4 M Asam Asetat
- Konsentrasi asam asetat 0,4 M MNaOH.VNaOH = MAsam Asetat.VAsam Asetat
0,423 M. 3,6 mL = MAsam Asetat. 5 mL
0,304 M = MAsam Asetat
- Mol = MxV
= 0,304 M x 5 mL = 1,52 mmol - Massa = n x Mr
0,6 M Asam Asetat
- Konsentrasi asam asetat 0,6 M MNaOH.VNaOH = MAsam Asetat.VAsam Asetat
0,423 M. 5,7 mL = MAsam Asetat. 5 mL
0,482 M = MAsam Asetat
- Mol = MxV
= 0,482 M x 5 mL = 2,41 mmol - Massa = n x Mr
= 2,41 mmol x 60 gram/mol = 144,6 mg
0,8 M Asam Asetat
- Konsentrasi asam asetat 0,8 M MNaOH.VNaOH = MAsam Asetat.VAsam Asetat
0,423 M. 7,6 mL = MAsam Asetat. 5 mL
0,643 M = MAsam Asetat
- Mol = MxV
= 0,643 M x 5 mL = 3,215 mmol - Massa = n x Mr
= 3,215 mmol x 60 gram/mol = 192,9 mg
1 M Asam Asetat
- Konsentrasi asam asetat 1 M MNaOH.VNaOH = MAsam Asetat.VAsam Asetat
0,423 M. 9,1 mL = MAsam Asetat. 5 mL
0,769 M = MAsam Asetat
- Mol = MxV
= 0,769M x 5 mL = 3,845 mmol - Massa = n x Mr
6. Massa asam asetat yang diadsorbsi
a. Konsentrasi 0,4 M X
c. Konsentrasi 0,8 M
0 0 0 0 0 0 0 0
Grafk Hubungan ln k dengan 1/T
∆ H=−(−38000).8,314J mol−1K−1
∆ H=315932J mol−1K−1