LAPORAN PRAKTIKUM KIMIA FISIK DAYA HANTAR LISTRIK
Nama : Wiwit Puji Lestari
NIM : 121810301052
Kelompok : 1 Asisten : Eva
LABORATORIUM KIMIA FISIK JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHHUAN ALAM UNIVERSITAS JEMBER
2014
1.1 Latar Belakang
Elektrolit adalah zat yang dapat menghantarkan listrik atau zat yang di dalam larutanya akan terdisosiasi atau akan terurai menjadi ion-ionnya yang menyebabkan kemampuannya untuk menghantarkan listrik. Ditinjau dari kesetimbangan peruraiannya atau derajat disosiasinya, elektrolit dibagi menjadi Elektrolit kuat, yaitu zat yang dalam larutannya terdisosiasi sempurna atau sebagian besar menjadi ion-ion. Elektrolit lemah yaitu zat yang dalam larutannya hanya sebagian kecil terdisosiasi menjadi ion-ion. Zat ini sukar terionisasi, derajat ionisasinya mendekati nol. Selain dua kelompok itu, ada juga senyawa yang larut dalam air tapi tidak dapat menghantarkan listrik, yang disebut larutan nonelektrolit.
Setiap larutan memiliki kemampuan yang berbeda-beda dalam menghantarkan listrik. Larutan elektrolit kuat lebih mudah menghantarkan listrik daripada larutan elektrolit lemah. Perbedaan ini disebabkan kedua larutan memiliki konsentrasi yang berbeda. Untuk lebih memahami mengenai daya hantar listrik pada beberapa senyawa serta pengaruhnya terhadap konsentrasi maka dilakukan percobaan yang berjudul daya hantar listrik.
1.2 Tujuan
Tujuan dari praktikum ini yaitu mengukur daya hantar listrik berbagai senyawa dan mempelajari pengaruh konsentrasi terhadap daya hantar listrik larutan elektrolit.
2.1 Material Safety Data Sheet (MSDS) 2.1.1 CH3COOH
Asam asetat merupakan salah satu asam karboksilat yang mudah ditemui. Asam ini memiliki nama lain asam etanoat, asam asetat glasial, asam ethylic, methane carboxylic acid, atau biasa disebut asam cuka. Rumus molekul dari asam asetat ini adalah C2H4O2 atau biasa ditulis CH3COOH. Asam asetat mempunyai titik lebur 16,7oC dan memiliki titik didih pada 118oC. Asam ini memiliki massa jenis 1,05 gram/mL. Berbeda dengan massa jenis cairannya, massa jenis uap dari asam asetat adalah 2,07 gram/L. Tekanan uap dari asam cuka adalah 11 mmHg pada suhu 20oC, dan 30 mmHg pada suhu 30oC. Asam asetat termasuk zat yang stabil. Zat yang harus dihindari termasuk alkohol, aldehida, senyawa halogen-halogen, oksidasi agen, logam, hidroksida alkali, anhidrida, halida non-logam, permanganates, peroksida, etanolamin, karbonat. Bahan ini sangat korosif dan menyebabkan luka bakar yang serius. Sangat berbahaya jika tertelan atau terhirup lepaskan ke udara segar. Apabila sulit bernapas, berikan pernapasan buatan atau oksigen. Dapatkan medis perhatian segera. Pertolongan Pertama, jika kontak mata maka periksa dan lepaskan lensa kontak. Apabila kasus kontak, segera siram mata dengan banyak air sekurang-kurangnya 15 menit. Air dingin dapat digunakan. Mendapatkan perhatian medis segera. Dalam kasus kontak kulit, segera siram kulit dengan banyak air sekurang-kurangnya 15 menit saat mengeluarkan pakaian yang terkontaminasi dan sepatu. Tutupi kulit yang teriritasi dengan bahan lunak. Cuci pakaian sebelum digunakan kembali. Bersihkan sepatu sebelum digunakan kembali. Mendapatkan perhatian medis segera. Perlindungan pribadi, keselamatan kacamata atau masker, sarung tangan nitril, ventilasi yang baik (Anonim, 2014).
2.1.2 NH4OH
Pertolongan yang seharusnya diberikan setelah terkena NH4OH adalah segera membilas mata dan kulit dengan air bersih selama kurang lebih 15 menit. Apabila terkena pakaian segera dilepas dan diganti dengan pakaian yang bersih. Apabila tertelan berikan segelas air namun jangan berikan makanan lewat mulut sebelum ada perintah dari petugas medis. Apabila terhirup, korban dibawa ke udara terbuka dan jika tidak bernafas maka diberikan oksigen untuk membantunya. Penyimpanannya seharusnya diletakkan pada tempat yang tertutup agar tidak terkontaminasi dengan udara luar kemudian diletakkan pada tempat yang sejuk dan kering (Anonim, 2014).
2.1.3 HCl
HCl atau asam klorida merupakan golongan asam kuat. Asam ini memiliki massa molar 36,46 g/mol. Asam ini merupakan senyawa polar yang mudah larut dalam air. Wujudnya cair, tidak berwarna, dan bau menyengat. Hal yang perlu diperhatikan adalah sifat korosifnya terhadap jaringan tubuh dan beracun bila dikonsumsi. Asam klorida akan menimbulkan permasalahan pada sistem pernapasan, mata, kulit, paru-paru. Apabila terjadi kecelakaan pada penggunaannya cari pertolongan medis profesional setelah tindakan pertolongan pertama dilakukan. Apabila larutan mengenai mata segerasiram mata dengan air berlebih selama 15 menit, mengangkat kelopak mata bawah dan atas sesekali. Apabila kontak dengan kulit maka segerasiram kulit dengan air mengalir selama 15 menit dan sesaat kemudian melepaskan pakaian yang terkontaminasi. apabila tertelan hubungi pihak medis segera (Anonim, 2014). 2.1.4 NaOH
2.1.5 NaCl
NaCl mempunyai massa molar 58,44 gram/mol. Kerapatan atau massa jenisnya adalah 2,16 gram/cm3. NaCl memiliki titik leleh 801oC dan titik didih 1465oC. Garam natrium klorida memiliki kelarutan dalam air sebesar 35,9 gram/100 mL air pada suhu 25oC. Natrium klorida (NaCl) yang dikenal sebagai garam adalah zat yang memiliki tingkat osmotik yang tinggi. Zat ini pada proses perlakuan penyimpanan benih recalsitran berkedudukan sebagai medium inhibitor yang fungsinya menghambat proses metabolisme benih sehingga perkecambahan pada benih recalsitran dapat terhambat. Garam dapur tidak berbahaya bila tertelan namun jika dalam jumlah banyak dapat menyebabkan penyakit tekanan darah tinggi dalam waktu yang lama. Terkena kulit yang teriritasi akan menimbulkan rasa perih. Jika terkena mata dapat menimbulkan iritasi ringan. Pertolongan yang harus dilakukan membilas mata dan kulit yang terkena garam dapur selama kurang lebih 15 menit. Jika terjadi iritasi atau gejala yang lebih parah segera hubungi petugas medis. Penyimpanan seharusnya dilakukan di tempat yang sejuk, kering, dan tertutup (Anonim, 2014).
2.1.6 NaBr
NaBr mempunyai massa molar 102,9 gram/mol. Natrium bromida (NaBr) yang dikenal sebagai garam adalah zat yang memiliki tingkat osmotik yang tinggi. Garam ini mempunyai kelarutan yang baik dalam air. Ion-ion dari garam ini akan terdisosiasi dalam air menjadi Na+ dan Br-. Garam ini tidak menimbulkan efek akut maupun kronis. Namun perlu dilakukan antisipasi terhadap hal-hal yang mungkin terjadi. Apabila terkena kulit yang teriritasi akan menimbulkan rasa perih. Apabila terkena mata dapat menimbulkan iritasi ringan. Pertolongan yang harus dilakukan membilas mata dan kulit yang terkena garam dapur selama kurang lebih 15 menit (Anonim, 2014).
2.1.7 NaI
2.1.8 NH4Cl
Amonium klorida merupakan sebuah senyawa anorganik dengan rumus NH4Cl. Garam
ini mempunyai struktur kristal putih garam, sangat larut dalam air. Solusi dari amonium klorida yang agak asam. Sal amoniak adalah nama dari bentuk alami mineralogi dari amonium klorida. Mineral ini umumnya terjadi pada pembakaran batubara pembuangan (dibentuk oleh kondensasi dari gas batubara yang diturunkan), tetapi juga pada beberapa gunung berapi dan akar manis . Ini adalah produk dari reaksi asam klorida dan amonia. Seperti umumnya garam-garam yang lain, garam-garam ini tidak menimbulkan efek akut maupun kronis. Namun perlu dilakukan antisipasi terhadap hal-hal yang mungkin terjadi. Jika terkena kulit yang teriritasi akan menimbulkan rasa perih. Apabila terkena mata dapat menimbulkan iritasi ringan. Pertolongan yang harus dilakukan membilas mata dan kulit yang terkena garam dapur selama kurang lebih 15 menit (Anonim, 2014).
2.2 Teori
Suatu senyawa dibedakan menjadi elektrolit dan non elektrolit berdasarkan daya hantarnya. Elektrolit adalah zat yang dapat menghantarkan listrik atau zat bila berada dalam suatu larutan misal air akan terurai menjadi ion-ionnya yang menyebabkan kemampuannya untuk menghantarkan listrik. Larutan elektrolit berdasarkan kesetimbangan peruraiannya atau derajat disosiasinya dibagi menjadi: elektrolit kuat yaitu zat yang dalam larutannya terdisosiasi sempurna atau sebagian besar menjadi ion-ion. Zat ini sangat mudah terionisasi dalam larutan, dengan derajat ionisasi 1 atau mndekati 1, misalnya garam-garam alkali, asam kuat dan basa kuat. Elektrolit lemah, yaitu zat yang dalam larutannya hanya sebagian kecil terdisosiasi menjadi ion-ion. Zat ini sukar terionisasi, derajat ionisasinya mendekati 0, misalnya sebagian kecil garam-garam, asam lemah dan basa lemah (Supriyana, 2004).
elektroda tersebut, akibatnya ion positif akan bergerak menuju elektroda negatif (anoda) untuk mengambil elektron dari elektroda ini (oksidasi), sedangkan ion negatif akan bergerak menuju elektroda positif (katoda) untuk menyerahkan elektron pada elektroda ini (reduksi). Ini berarti dalam larutan elektrolit ini terjadi penghantaran muatan dari elektroda yang satu menuju elektroda yang lain dengan jalan diangkut oleh ion-ion (Sukardjo, 1997).
Elektrolit kuat terurai sempurna menjadi ion dalam larutan air atau dalam keadaan lebur. Yang termasuk elektrolit kuat yaitu senyawa ion, yang dalam keadaan padat berupa ion dan senyawa kovalen yang bereaksi sempurna dengan air membentuk ion, misalnya HCl. Zat yang termasuk elektrolit kuat adalah, asam mineral (asam klorida, asam sulfat, asam nitrat), basa dan leburan atau larutan dalam air. Sedangkan elektrolit, lemah hanya sedikit sekali terurai menjadi ion dalam larutan dalam air. Elektrolit ini terutama senyawa kovalen yang sedikit sekali bereaksi dengan air membentuk ion. Oleh karena itu, elektrolit lemah merupakan penghantar listrik yang buruk dan mempunyai derajat disosiasi kecil (Hiskia, 1996).
Daya hantar listrik (konduktivitas) adalah ukuran seberapa kuat suatu larutan dapat menghantarkan listrik. Konduktivitas digunakan untuk ukuran larutan atau cairan elektrolit. Semakin besar jumlah ion dari suatu larutan maka akan semakin tinggi nilai konduktivitasnya. Jumlah muatan dalam larutan sebanding dengan nilai daya hantar molar larutan dimana hantaran molar juga sebading dengan konduktivitas larutan. Konsentrasi elektrolit sangat menentukan besarnya konduktivitas molar (Δm). Konduktivitas molar adalah konduktivitas suatu larutan apabila konsentrasi larutan sebesar satu molar. Larutan encer, ion-ion dalam larutan tersebut mudah bergerak sehingga daya hantarnya semakin besar. Larutan yang pekat, pergerakan ion lebih sulit sehingga daya hantarnya menjadi lebih rendah. Hal lain yang mempengaruhi daya hantar listrik selain konsentrasi adalah jenis larutan (Sukardjo, 1997).
Apabila larutan suatu elektrolit diencerkan, konduktivitas akan turun karena lebih sedikit ion berada per cm3 larutan untuk membawa arus. Apabila semua larutan itu ditaruh antara dua elektroda yang terpisah 1 cm satu sama lain dan cukup besar untuk mencakup seluruh larutan, konduktivitas akan naik selagi larutan diencerkan. Ini sebagian besar disebabkan oleh berkurangnya efek–efek antar ionik untuk elektrolit kuat dan oleh kenaikan derajat disosiasi untuk elektrolit–elektrolit lemah. Hukum Ohm menyatakan bahwa arus I (ampere) yang mengalir dalam sebuah penghantar, berbanding lurus dengan daya gerak listrik (daya elektromotif), E (volt), dan berbanding terbalik dengan resistans (tahanan), R (ohm) dari penghantar.
Kebalikan dari resistans adalah konduktans (G) (hantaran), yang diukur dalam kebalikan ohm (ohm-1), yang dalam satuan SI adalah konduktans dari satu meter kubik zat dan mempunyai satuan ohm-1 m-1, tetapi jika ρ diukur dalam ohm cm, maka konduktivitas harus diukur dalam ohm-1 cm-1 (Pringgodigdo, 1997).
Kemampuan suatu pengahtar untuk memindahkan muatan listrik dikenal sebagai daya hantar listrik yang besarnya berbanding terbalik dengan tahanan (R).
L=1
R
Dimana L adalah daya hantar (Ohm-1) dan R adalah tahanan (Ohm). (Tim Penyusun, 2014).
3.1 Alat dan Bahan 3.1.1 Alat
- Gelas piala 100 mL - Pipet volume - Pipet mohr - Pipet tetes - Botol semprot - Multimeter - Kabel - Saklar
- Sumber arus AC 110 V
3.1.2 Bahan
- Minyak tanah - Asam cuka glasial - Air suling
- Akuades - Kristal NaCl - Larutan NaCl - Larutan NaBr - Larutan NaI - Larutan NH4Cl
Minyak Tanah
Hasil disediakan gelas piala ukuran 100 mL. diisi dengan 25 mL minyak tanah.
diukur daya hantar listrik larutan tersebut dengan menggunakan konduktometer ditentukan sifat zat terhadap arus listrik (konduktor atau isolator).
dilakukan perlakuan yang sama dengan mengganti minyak tanah dengan asam cuka glasial, air suling, larutan NaCl, dan kristal NaCl.
Larutan CH3COOH
Hasil
dibuat larutan CH3COOH dengan konsentrasi 0,01 M; 0,05 M; 0,10 M; 0,50 M; dan 1,00 M masing-masing 25 mL. diukur daya hantar listriknya untuk setiap larutan dan dimulai dengan larutan terencer.
dilakukan perlakuan yang sama terhadap larutan kelompok 1 yaitu dengan mengganti CH3COOH dengan NH4OH, HCl, dan NaOH. digambar grafik daya hantar listrik terhadap konsentrasinya.
ditentukan senyawa yang merupakan elektrolit kuat dan lemah.
dilakukan perlakuan yang sama terhadap larutan kelompok 2 yaitu NaCl, NaBr, NaI, dan NH4Cl. digambar grafik daya hantar listrik terhadap konsentrasinya.
dibandingkan daya hantar listrik kation dan anion segolongan (antara Cl-, Br-, I-, dan antara Na+, NH4+. 3.2.1 Daya hantar listrik berbagai senyawa
3.2.2 Pengaruh konsentrasi terhadap daya hantar larutan elektrolit
4.1 Hasil
a. Menentukan Daya Hantar Listrik berbagai Senyawa
Senyawa I (mA) I (A) V (V) R (Ohm) L (Ohm-1)
Air 0,1 0,1 x 10-3 5 5 x 104 0,2 x 10-4
NaCl 3,0 3,0 x 10-3 5 1,67 x 10-3 6,0 x 10-4
CH3COOH glasial 0 0 5 0 ∞
Minyak Tanah 0 0 5 0 ∞
1,0 5,4 0,93 x 10-3 10,7 x 10-4 4.2 Pembahasan
Percobaan yang dilakukan adalah tentang daya hantar listrik bertujuan untuk mengukur daya hantar listrik berbagai senyawa dan mempelajari pengaruh konsentrasi terhadap daya hantar listrik larutan elektrolit. Percobaan pertama yaitu menentukan daya hantar lisrik dari berbagai senyawa. Berdasarkan kemampuan menghantarkan listrik suatu senyawa digolongkan menjadi dua yaitu senyawa yang dapat menghantarkan listrik biasanya disebut konduktor dan senyawa yang tidak dapat menghantarkan litrik disebut isolator. Bahan yang digunakan adalah minyak tanah, air suling, asam asetat glasial dan larutan NaCl.
Arus yang diperoleh dari hasil percobaan untuk sampel minyak tanah dan asam asetat glasial adalah 0 A sehingga nilai daya hantar yang diperoleh juga nol. Hal tersebut dapat disimpulkan bahwa kedua sampel atau senyawa tersebut tidak dapat menghantarkan arus listrik dan disebut sebagai isolator. Hal ini karena minyak tanah merupakan senyawa hidrokarbon yang memiliki jenis ikatan kovalen nonpolar. Ikatan kovalen non polar ini sulit untuk terionisasi, karena di dalam larutan tidak terdapat ion-ion bebas sehingga membuat minyak tanah tidak dapat menghantarkan arus listrik. Asam asetat adalah golongan asam lemah yang dapat terionisasi sebagian yang dapat menghanntarkan listrik dengan lemah, sedangkan asam asetat glasial merupakan asam asetat murni, karena memiliki kemurnian yang tinggi tersebut maka arus yang dihasilkan adalah 0 A meskipun senyawa ini merupakan senyawa kovalen. Senyawa kovalen baik kovalen polar maupun nonpolar dalam keadaan murni tidak dapat menghantarkan arus listrik, namun bila senyawa kovalen polar dilarutkan dengan pelarut yang sesuai maka senyawa tersebut dapat menghantarkan arus listrik. Hal ini dikarenakan senyawa kovalen polar dalam pelarut yang sesuai mampu membentuk ion-ion.
Larutan NaCl dan air suling pada percobaan ini menghasilkan arus yang berbeda, yaitu daya hantar larutan NaCl sebesar 6,0x10-4 ohm-1 sedangkan air suling sebesar 0,2x10-4ohm-1. Hal ini terjadi karena NaCl dapat mengion secara sempurna jika dilarutkan dalam air sehingga NaCl memiliki kemanpuan mengion lebih besar dibandingkan dengan air suling. Berikut reaksi kedua senyawa tersebut:
NaCl (aq) Na+ (aq) + Cl- (aq) H2O (l) H3O+ (aq) + OH- (aq)
dikarenakan kedua senyawa tersebut dapat menghantarkan listrik meskipun daya yang dihasilkan sangat kecil.
Percobaan yang kedua yaitu mengetahui pengaruh konsentrasi terhadap daya hantar listrik larutan elektrolit. Berdasarkan literatur, semakin besar konsentrasi suatu larutan maka daya hantar listriknya semakin besar pula. Hal ini disebabkan larutan dengan konsentrasi yang tinggi akan memiliki jumlah ion-ion yang lebih banyak dalam larutan. Ion-ion yang semakin banyak akan menyebabkan jarak antara satu ion dengan ion yang lain berdekatan sehingga memudahkan terjadinya perpindahan elektron sehingga menghasilkan arus listrik yang besar. Arus listrik dalam hal ini berbanding lurus dengan daya hantar listrik, sehingga semakin besar arus listrik maka daya hantar listriknya juga akan semakin besar pula.
Bahan yang digunakan pada percobaan ini terbagi dalam dua kelompok yaitu kelompok 1 terdiri dari larutan CH3COOH, NH4OH, HCl dan NaOH sedangkan kelompok 2 terdiri dari larutan NaCl, NaBr,NaI dan NH4Cl. Karena untuk mengetahui pengaruh konsetrasi terhadap daya hantar listrik larutan elektrolit, maka dibuat variasi konsentrasi untuk masing-masing larutan dengan konsentrasi 0,01 M; 0,05 M; 0,10 M; 0,50 M; dan 1,00 M.
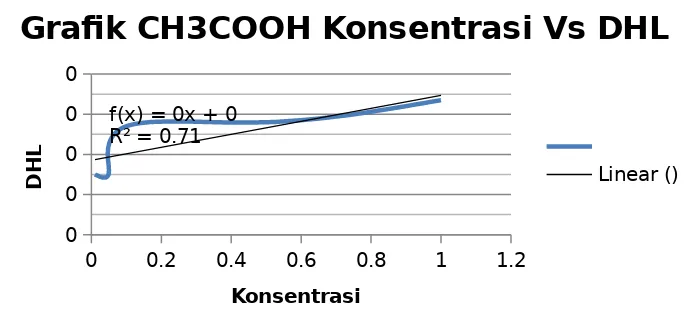
Kelompok 1 semua larutan yang diuji menghasilkan daya hantar listrik semakin besar dengan semakin bertambahnya konsentrasi larutan. Berikut grafik dari setiap larutan:
0 0.2 0.4 0.6 0.8 1 1.2
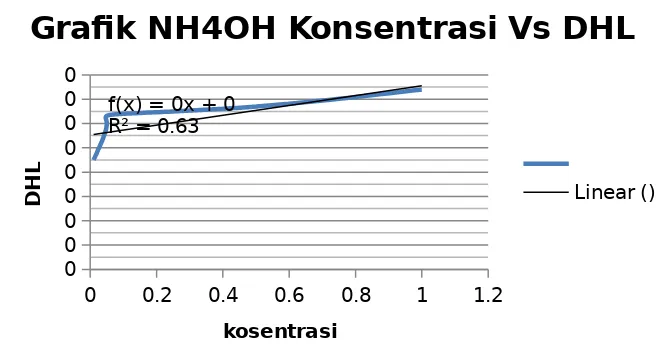
Grafik hasil plot konsentrasi dengan DHL untuk larutan NH4OH juga menunjukkan fenomena yang sama. Dalam hal ini konsentrasi sangat berperan penting dalam penentuan nilai DHL yang diperoleh. Nilai DHL yang diperoleh meningkat dari 0,00045 ohm-1 menjadi 0,00074 ohm-1.
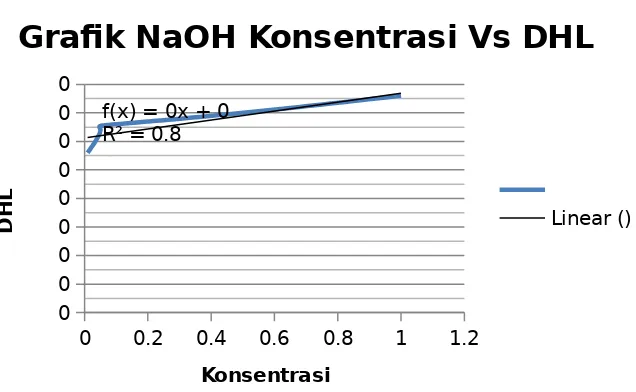
0 0.2 0.4 0.6 0.8 1 1.2 membentuk ion-ionnya. Larutan elektrolit berdasarkan kemampuan mengion dibedakan menjadi dua, yaitu elektrolit kuat adalah suatu zat elektrolit yang terurai sempurna di dalam air, sedangkan elektrolit lemah adalah suatu zat elektrolit yang terurai sebagian di dalam air. Larutan dalam kelompok 1 ini dapat digolongkan kedalam elektrolit kuat dan elektrolit lemah. Penggolongan tersebut dapat diketahui dari besar nilai daya hantar listrik yang dihasilkan. Larutan HCl dan NaOH merupakan larutan elektrolit kuat karena dapat terurai sempurna dalam air. Hal ini juga dapat diketahui dari nilai daya hantar listrik yang dihasilkan dari percobaan. Daya hantar listrik larutan HCl dan NaOH lebih besar daripada daya hantar listrik larutan CH3COOH dan NH4OH, yaitu misalnya pada konsentrasi 1,0 M daya hantar listrik HCl adalah 7,8 x 10-4 ohm-1 dan daya hantar listrik NaOH adalah 7,6 x 10-4 ohm-1. Sedangkan larutan CH3COOH dan NH4OH digolongan dalam larutan elektrolit lemah karena hanya dapat terurai sebagian. Daya hantar listrik pada konsentrasi 1,0 M dari kedua larutan tersebut yaitu CH3COOH adalah 6,7 x 10-4 ohm-1 dan NH4OH adalah 7,4 x 10-4 ohm-1. Berikut reaksi dari
0 0.2 0.4 0.6 0.8 1 1.2
Larutan NaCl adalah adalah larutan garam yang bersifat elektrolit kuat sehingga akan terionisasi dengan baik dalam air. Berdasarkan percobaan daya hantar dari larutan NaCl terus meningkat seiring dengan meningkatnya konsentrasi larutan. Nilai DHL meningkat dari
0 0.2 0.4 0.6 0.8 1 1.2
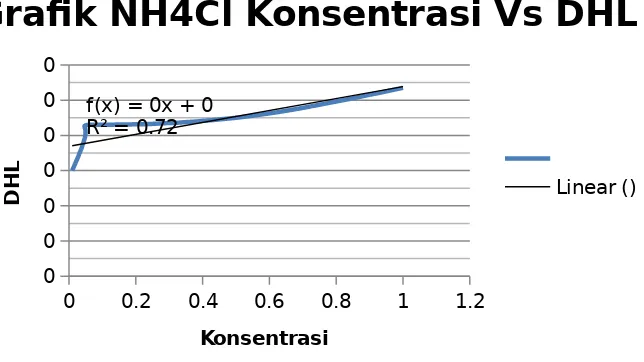
Grafik NH4Cl Konsentrasi Vs DHL
Linear () meningkat mulai dari 0,0006 ohm-1 mencapai 0,00107 ohm-1.
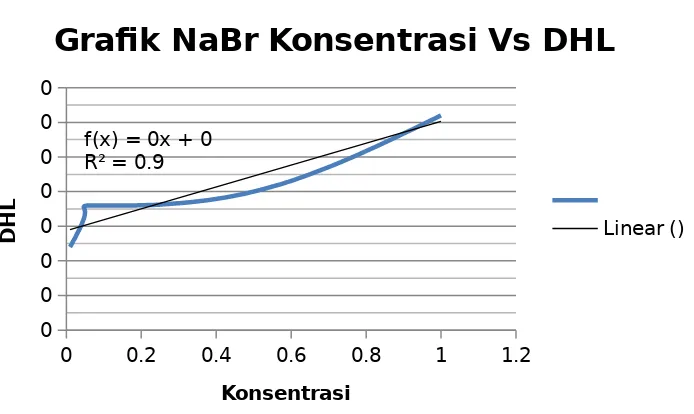
Pada percobaan ini larutan NaI tidak digunakan, dikarenakan kehabisan bahan. NaI merupakan larutan dengan anion yang memiliki nilai besar dalam menghantarkan arus listrik. Larutan elektrolit pada kelompok dua ini menunjukkan sifat daya hantar listrik dari satu golongan, yaitu Cl-, Br-, I- (halogen). Dalam satu golongan, dari atas kebawah keelektronegatifan semakin berkurang dan elektrolit semakin kuat. Karena semakin kebawah dalam satu golongan jari-jari atom semakin jauh, sehingga tarikan inti ke elektron terluar semakin kecil dan membuat senyawa larutan tersbut akan lebih mudah lepas dan mengion. Berikut reaksi yang terjadi dalam kelompok 2:
NaCl (aq) Na+ (aq) + Cl-(aq) NaBr (aq) Na+ (aq) + Br- (aq) NaI (aq) Na+ (aq) + I- (aq) NH4Cl (aq) Cl-(aq) + NH4+ (aq)
BAB 5. PENUTUP
5.1 Kesimpulan
Kesimpulan dari percobaan ini yaitu:
1. Asam asetat glasial dan minyak tanah merupakan senyawa yang termasuk jenis isolator, Sedangkan air suling dan larutan NaCl merupakan senyawa yang termasuk jenis konduktor. Hal ini didasarkan pada kemampuan menghantarkan listrik suatu senyawa. 2. Pengaruh konsentrasi senyawa terhadap daya hantar listrik yaitu dapat mempengaruhi
besarnya daya hantar listrik. Semakin besar konsentrasi senyawa, daya hantar listriknya juga akan semakin besar. Hal ini dikarenakan arus yang dihasilkan dari pengukuran berbanding lurus dengan nilai DHL, sehingga bisa dikatakan konsentrasi juga berbanding lurus dengan DHL.
5.2 Saran
Saran untuk praktikum ini yaitu:
1. Alat yang digunakan seharusnya lebih banyak, karena larutan yang digunakan banyak selain itu supaya lebih cepat saat pengenceran.
DAFTAR PUSTAKA
Anonim. 2014. Acetate Acid.http://www.scienelab.com/msds/php?msdsld=9536790 [diakses 4 Novenber 2014].
Anonim. 2014. Ammonium Hidroxide. http://www.scienelab.com/msds / php?msdsld=9924473
[diakses 4 Novenber 2014].
Anonim. 2014. Ammonium Chlroride. http://www.scienelab.com/msds/php?msdsld=9924521
[diakses 4 Novenber 2014].
Anonim. 2014. HCl. http :// www. sciencelab .com/ msds .php? msds Id=9924285 [diakses 4 Novenber 2014].
Anonim. 2014. NaOH. http://www.sciencelab.com/msds/php?msdsld=9924997 [diakses 4 Novenber 2014].
Anonim. 2014. Sodium Chlroride. http://www.scienelab.com/msds/php?msdsld=9337896
[diakses 4 Novenber 2014].
Anonim. 2014. Sodium Bromide. http://www.scienelab.com/msds/php?msdsld=9463520
[diakses 4 Novenber 2014].
Anonim. 2014. Sodium Iodide. http://www.scienelab.com/msds/php?msdsld=9567890
[diakses 4 Novenber 2014].
Hiskia, Achmad. 1996. Kimia Larutan. Bandung : PT Citra Aditya Bakti. Pringgodigdo. 1977. Ensiklopedia Umum. Yogyakarta : Yayasan Konisius. Sukardjo. 1997. Kimia Fisika. Yogyakarta: Rinaka Cipta.
Supriyana. 2004. Kimia untuk Universitas jilid II. Jakarta: Erlangga.