Aldaffa Rayyanda 2107126227
PENDAHULUAN
Latar Belakang
Industri farmasi di Indonesia merupakan salah satu industri yang mengalami perkembangan cukup pesat dibandingkan negara-negara Asia Tenggara. Aspirin atau asam asetilsalisilat (asetosal) merupakan salah satu jenis obat turunan salisilat yang sering digunakan sebagai senyawa analgesik (pereda nyeri atau pengurang nyeri), antipiretik (melawan demam), dan antiinflamasi (peradangan). Perlindungan asam asetilsalisilat dari kontak dengan asam lambung melalui asetosal oral, yang dikembangkan dalam bentuk tablet atau kapsul dengan pelepasan tertunda (salut enterik), yang tahan terhadap asam dan dapat mengurangi rasa tidak nyaman.
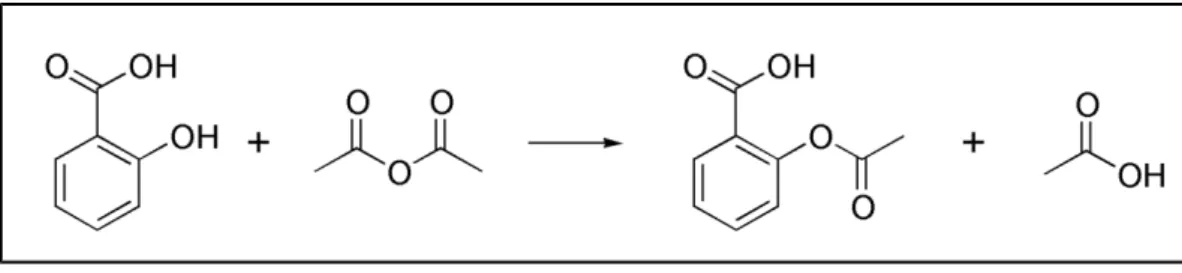
Aspirin dibuat melalui reaksi asetilasi senyawa fenolik (berupa asam salisilat) dengan bantuan asetat anhidrida dengan bantuan katalis kecil yaitu asam sulfat (H2SO4) sebagai zat penghidrasi (Wilmana & Sulistia, 2012). Reaksi asetilasi merupakan reaksi penyisipan gugus asetil (CH3CO-) ke dalam molekul organik seperti (–OH dan –NH2). Reaksi asetilasi ini merupakan reaksi seimbang dengan mengambil satu arah reaksi ke sisi ester, sehingga dapat memperoleh rendemen dan konversi yang tinggi dengan menghilangkan air yang terbentuk (Dewati & Teddy, 2010).
Berdasarkan penjelasan di atas, dapat kita simpulkan bahwa perkembangan obat-obatan khususnya obat pereda nyeri (analgesik) semakin pesat. Karena banyaknya kegunaan aspirin, maka aspirin dibuat di laboratorium untuk mengamati reaksi yang terjadi pada proses pembuatan aspirin dengan menggunakan reaksi asetilasi dan teknik kristalisasi.
Tujuan Praktikum
TINJAUAN PUSTAKA
Teori Bahan
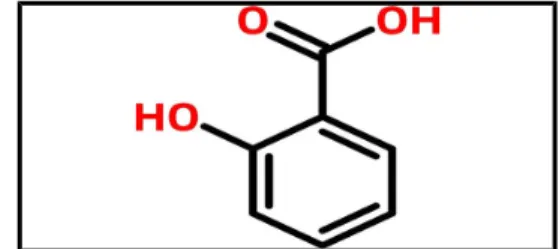
- Asam Salisilat
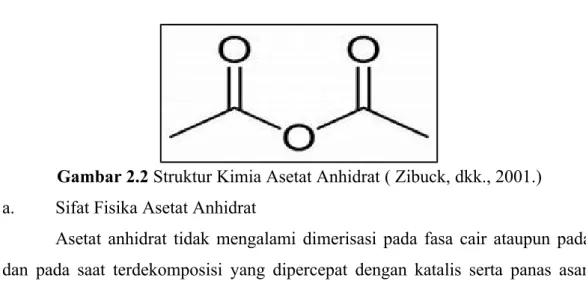
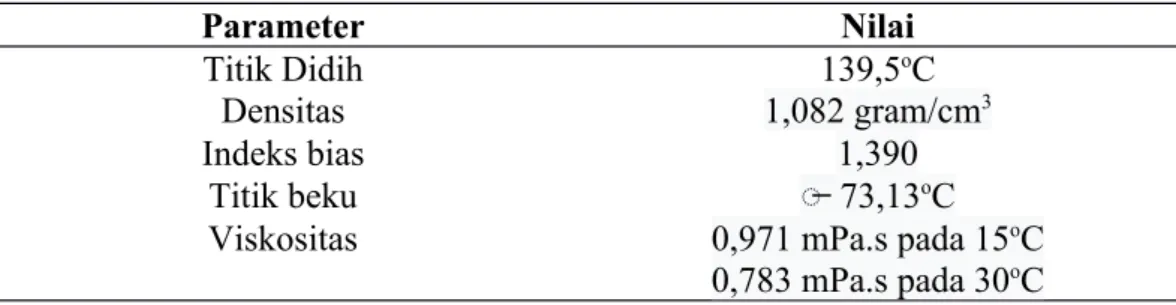
- Asetat Anhidrat
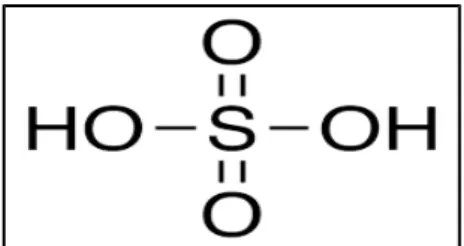
- Asam Sulfat
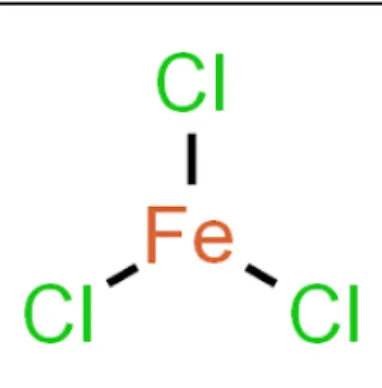
- Feri Klorida
- Etanol
- Akuades
Kegunaan lain asam sulfat adalah untuk penyulingan bensin, produksi pigmen, plastik dan industri serat sintetis. Asam sulfat juga digunakan dalam industri kimia untuk menghasilkan produk kimia khusus seperti pewarna, obat-obatan dan industri fluorida (Müller, 2000). Sulfur dioksida juga banyak dihasilkan oleh industri logam non-ferrous, proses pemanggangan dan peleburan akan menghasilkan gas buang dengan konsentrasi sulfur dioksida yang tinggi sehingga dapat langsung diolah menjadi asam sulfat sebagai produk samping (Müller, 2000). .
Kontak langsung antara asam sulfat dengan asam yang lebih kuat akan menyebabkan kedua senyawa tersebut terurai dalam bentuk karat. Asam sulfat pekat merupakan senyawa dehidrasi dan pengoksidasi kuat, dan pemanasan asam sulfat murni akan menyebabkan asam sulfat terurai menjadi air dan sulfur trioksida (Kumareswaran, 2015). Kemampuan asam sulfat untuk memecah garam dari senyawa asam lainnya digunakan dalam industri untuk menghasilkan natrium sulfat.
Beberapa hidrat dapat dideteksi dalam asam sulfat, yang menjelaskan perbedaan sifat fisik asam sulfat berdasarkan konsentrasinya (Müller, 2000). Asam sulfat merupakan salah satu senyawa yang paling banyak digunakan di semua industri kimia, namun sebagian besar penggunaan asam sulfat terjadi secara tidak langsung karena fungsinya sebagai katalis dan bukan sebagai bahan baku. Pemanfaatan asam sulfat pada dasarnya terbagi menjadi dua, yaitu langsung dan tidak langsung (Müller, 2000).
Pemanfaatan asam sulfat secara tidak langsung merupakan penggunaan asam sulfat terbesar pada seluruh produksi dengan persentase sebesar 60% dari seluruh produksi. Penggunaan asam sulfat digunakan langsung di bidang pertanian untuk merehabilitasi tanah dengan sifat basa kuat (Müller, 2000). Senyawa besi klorida disintesis dalam dua bentuk, yaitu dalam bentuk padat dan dalam bentuk larutan.

Teori Proses
- Pembuatan Aspirin
- Rekristalisasi Aspirin
- Uji Kemurnian Aspirin
Pelarut yang digunakan dalam proses rekristalisasi aspirin adalah etanol karena etanol mudah didapat dan harganya murah. Pada proses rekristalisasi, suhu proses menentukan kecepatan proses yang dilakukan dan besar kecilnya kristal yang terbentuk.Batas suhu proses rekristalisasi aspirin yang dapat diberikan berdasarkan jenis pelarut yang digunakan. . Waktu yang diberikan dalam proses rekristalisasi meliputi waktu pencampuran aspirin dengan pelarut dan waktu pendinginan campuran.
Pengotor dalam aspirin mempengaruhi jenis pelarut yang harus digunakan dalam proses rekristalisasi untuk mencapai hasil yang maksimal dari segi kuantitas dan kualitas. Jenis pelarut yang digunakan pada proses rekristalisasi aspirin dapat mempengaruhi kemurnian aspirin yang dihasilkan dari proses rekristalisasi dan bentuk kristal yang diperoleh dari proses rekristalisasi. Pemilihan jenis pelarut yang digunakan dalam proses rekristalisasi tergantung pada zat yang menjadi pengotor dalam proses pembentukan aspirin.
Semakin tinggi konstanta dielektrik pelarut maka semakin baik pelarut tersebut dalam mencegah reaksi elektrostatis dalam campuran sehingga produk aspirin yang dihasilkan stabil. Nilai persentase mutu aspirin yang diuji dengan instrumen Magnitude Matching IR harus mencapai nilai di atas. Konsentrasi pelarut yang digunakan pada proses rekristalisasi mempengaruhi jumlah aspirin murni yang diperoleh dan kemurnian aspirin yang diperoleh.
Berdasarkan jenis pelarut yang digunakan, jumlah aspirin yang diperoleh dari proses rekristalisasi dapat bertambah atau berkurang seiring dengan meningkatnya konsentrasi pelarut yang digunakan. Pengujian dengan cara pemanasan, aspirin yang diperoleh dipanaskan hingga meleleh dan dianalisis suhu leleh aspirin. Titik leleh aspirin murni adalah 136oC sehingga semakin mendekati titik didih aspirin hasil reaksi dengan data maka semakin murni aspirin yang diperoleh (Pathiranage, et al., 2018).
Aspirin yang diperoleh dilarutkan dan ditetesi indikator pp, kemudian larutan dititrasi dengan NaOH. Mol aspirin yang digunakan dalam titrasi dicari dan dibagi dengan mol teoritis aspirin kemudian dibagi 100% untuk mendapatkan persen kemurnian (Jamali dan Mitchell, 1973). Cara ketiga untuk mengetahui kemurnian aspirin yang dihasilkan adalah dengan meneteskan aspirin yang diperoleh dengan besi klorida (FeCl3).
Teori Produk
- Aspirin
- Asam Asetat
Volume NaOH yang digunakan untuk mengubah warna larutan menjadi merah muda dicatat dan diubah menjadi berat produk reaksi aspirin. Pada proses sintesis aspirin terdapat proses yang memanfaatkan sifat aspirin yang sulit larut dalam alkohol, yaitu proses rekristalisasi. Pembuatan aspirin dilakukan dengan sangat hati-hati mengenai konsentrasinya di udara bila dalam bentuk bubuk, karena bubuk aspirin yang tersebar di udara mudah meledak pada konsentrasi tertentu, sehingga dalam pembuatan tablet aspirin, bubuk aspirin yang terbawa udara harus dibatasi.
Batasan bubuk aspirin yang dapat terangkut di udara dan tidak meledak menurut peraturan di USA adalah 5 mg/m3 (Catherine, 2021). Untuk mengatasi nyeri hebat, seperti nyeri saat pencabutan gigi, dosis yang digunakan untuk meredakan nyeri sebaiknya ditingkatkan menjadi 1 g (Gerber, et al., 2006). Asam asetat merupakan senyawa kimia tidak berwarna berbentuk cair dengan rumus kimia CH3COOH.
Dalam industri, asam asetat tidak hanya digunakan sebagai reagen pada industri kimia saja, tetapi juga digunakan pada industri makanan sebagai pemberi rasa asam (Wang dan Lü, 2021). Asam asetat berbentuk cair, tidak berwarna, bersifat korosif dan dapat melepuh pada kulit, serta memiliki bau yang tajam seperti cuka. Banyak senyawa kimia bermanfaat lainnya yang terbuat dari asam asetat sebagai salah satu komponen utamanya, antara lain etil asetat yang banyak digunakan sebagai pelarut dan decaffeinator pada kopi dan teh, yang merupakan hasil reaksi antara olefin atau alkohol dan asam asetat. , asetamida yang biasa digunakan sebagai bahan pemlastis merupakan hasil dekomposisi termal amonium asetat, asetil klorida yang banyak digunakan untuk proses asetilasi merupakan hasil reaksi asam asetat dengan.
Untuk produk komersial, asam asetat merupakan bahan baku pembuatan produk vinil klorida untuk pembuatan PVC, sebagai bahan dasar pembuatan cuka anhidrat (Hitt, 2003). Secara biologis, asam asetat diproduksi sebagai hasil pencernaan etanol dari Acetobacter atau dari pencernaan glukosa oleh bakteri Clostridium (Elliott, 2009). Asam asetat digunakan untuk banyak industri seperti makanan, kimia, farmasi, tekstil, kosmetik, dan banyak lagi (Mokhena, et al., 2016).
Penggunaan asam asetat dalam industri mencakup berbagai produk seperti pelapis, pelarut, pelarut plastik, minuman beralkohol, resin, dan permen karet. Penggunaan asam asetat terbesar adalah untuk produksi vinil asetat, asetat anhidrat, ester asetat, asam monokloroasetat, dan sebagai pelarut dalam produksi dimetil tereftalat dan asam tereftalat. Penggunaan asam asetat dalam produksi vinil asetat mempunyai persentase sebesar 33% dari total produksi asam asetat, disusul asam tereftalat, asetat anhidrat, dan ester asetat (Hitt, 2003).
METODOLOGI PRAKTIKUM
Alat-Alat yang Digunakan
Bahan-Bahan yang Digunakan
- Pembuatan Aspirin
- Rekristalisasi Aspirin (Pemurnian Aspirin)
- Uji Kemurnian Aspirin
4 g asam salisilat dimasukkan ke dalam labu Erlenmeyer dan ditambahkan 10 mL asam asetat anhidrat dan 5 tetes asam sulfat sedikit demi sedikit. Larutan didinginkan sampai suhu kamar kemudian didiamkan selama 30 menit dengan menggunakan es batu sampai terbentuk endapan. Larutan disaring dengan kertas saring dalam corong Buchner, dan sebelumnya kertas saring bekas ditimbang.
1 mL etanol ditambahkan ke setiap tabung untuk melarutkan kristal aspirin dan asam salisilat.
Rangkaian Alat
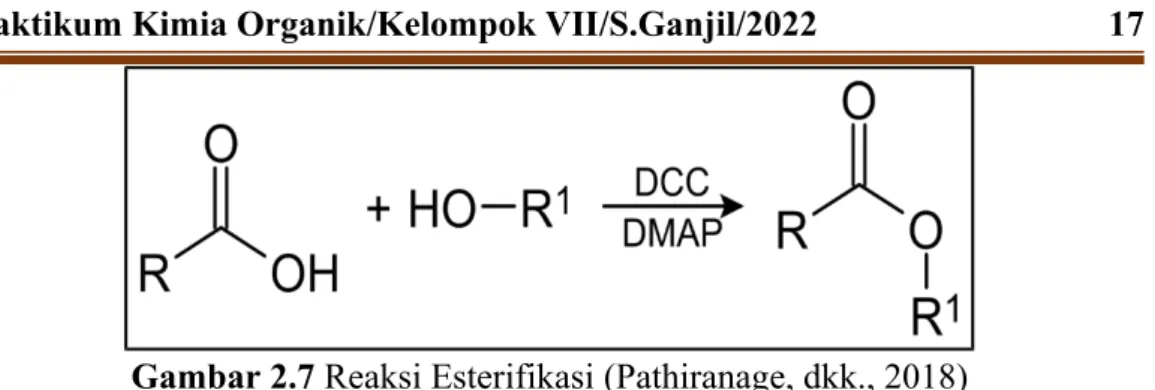
Asam asetilsalisilat atau lebih dikenal dengan aspirin merupakan turunan dari asam salisilat. Aspirin dibuat dengan mereaksikan asam salisilat dengan asam asetat anhidrat menggunakan katalis H2SO4 atau asam sulfat. Oleh karena itu, asam salisilat dapat mengalami dua jenis reaksi yang berbeda, yaitu reaksi asam dan basa.
Reaksi dengan asam asetat anhidrat akan menghasilkan aspirin sedangkan reaksi dengan metanol akan menghasilkan metil salisilat. Setelah kedua bahan ditambahkan, ditambahkan 5 tetes asam sulfat pekat dan dikocok dalam lemari asam. Sedangkan jika diatas 70oC maka bahan yang berada dalam labu didih akan terurai dan banyak terbentuk pengotor yaitu bahan yang tidak ikut bereaksi.
Pemisahan dilakukan menggunakan hopper dengan bantuan pompa vakum yang akan membantu proses pemisahan dengan cara menyedot air yang ada di dalamnya. Kemudian dipanaskan dalam alat pemeras air sampai suhu 70oC sehingga warna larutan menjadi jernih. Dinginkan larutan hingga suhu kamar sebelum dimasukkan ke dalam bak es batu selama 30 menit.
Jika aspirin menghasilkan warna ungu berarti aspirin yang dihasilkan tidak murni dan perlu dikristalisasi kembali. Aspirin atau asam asetilsalisilat dapat dibuat melalui reaksi asetilasi antara asam salisilat dan asam asetat anhidrat menggunakan katalis asam kuat yaitu H2SO4. Proses pembuatan aspirin disebut proses asetilasi, yaitu proses pemasukan gugus asetil dari asam asetat anhidrat untuk menggantikan atom H+ pada asam salisilat dengan menggunakan katalis H2SO4 sehingga menghasilkan kristal aspirin berwarna kekuningan pada proses rekristalisasi awal dan aspirin berwarna putih putih. kristal. pada proses rekristalisasi kedua.
HASIL DAN PEMBAHASAN
Hasil
- Hasil pengamatan pembuatan aspirin
- Hasil Pengamatan rekristalisasi (pemurnian) aspirin
Pembahasan
- Pembuatan aspirin
- Rekristalisasi (pemurnian) aspirin
Hal ini disebabkan karena pada saat penggunaannya suhu yang digunakan melebihi 50oC – 60°C dan pada saat pembuatan aspirin ditambahkan air suling dalam jumlah yang tidak sesuai sehingga tidak mengikuti tahapan yang akan dilakukan. Dalam pembuatan dan pengujian aspirin (asetilsalisilat), hendaknya praktisi memperhatikan kebersihan peralatan yang digunakan sebelum melakukan praktik. Kristalisasi dan karakteristik morfologi asam asetil-salisilat (aspirin) disintesis dari substrat sumber yang berbeda.
Physical and chemical properties of low-pressure, low-temperature plasma-treated deionized water and saline.
KESIMPULAN DAN SARAN
Kesimpulan
Saran