LAPORAN PRAKTIKUM KIMIA FISIKA ISOTERM ADSORBSI
I. TUJUAN
Menentukan isoterm adsorbsi menurut Freundlich bagi proses adsorbsi asam
asetat pada arang
II. DASAR TEORI
Arang adalah padatan berpori hasil pembakaran bahan yang mengandung
karbon. Arang tersusun dari atom-atom karbon yang berikatan secara kovalen
membentuk struktur heksagonal datar dengan sebuah atom C pada setiap
sudutnya. Susunan kisi-kisi heksagonal datar ini tampak seolah-olah seperti
pelat-pelat datar yang saling bertumpuk dengan sela-sela di antaranya (Sudarman,
2001).
Karbon aktif adalah bentuk umum dari berbagai macam produk yang
mengandung karbon yang telah diaktifkan untuk meningkatkan luas
permukaannya. Karbon aktif berbentuk kristal mikro karbon grafit yang pori-porinya
telah mengalami pengembangan kemampuan untuk mengadsorpsi gas dan uap
dari campuran gas dan zat-zat yang tidak larut atau yang terdispersi dalam cairan
(Murdiyanto, 2005). Luas permukaan, dimensi, dan distribusi karbon aktif bergantung pada bahan baku, pengarangan, dan proses aktivasi. Berdasarkan
ukuran porinya, ukuran pori karbon aktif diklasifikasikan menjadi 3, yaitu mikropori
(diameter <2 nm), mesopori (diameter 2–50 nm), dan makropori (diameter >50 nm) (Kustanto, 2000). Penggunaan karbon aktif di Indonesia mulai berkembang dengan pesat, yang dimulai dari pemanfaatannya sebagai adsorben untuk pemurnian pulp,
air, minyak, gas, dan katalis. Namun, mutu karbon aktif domestik masih rendah
(Harfi, 2003), dengan demikian perlu ada peningkatan mutu karbon aktif tersebut.
Adsorbsi adalah gejala pengumpulan molekul-molekul suatu zat pada
permukaan zat lain, sebagai akibat dari ketidakjenuhan gaya-gaya pada
permukaaan zat tersebut. Proses adsorpsi dalam larutan, jumlah zat teradsorpsi
tergantung pada beberapa faktor, seperti : jenis adsorben, jenis adsorbat, luas
permukaan adsorben, konsentrasi zat terlarut, dan temperatur. Bagi suatu sistem
adsorbsi tertentu, hubungan antara banyaknya zat yang teradsorpsi persatuan luas
atau persatuan berat adsorben dengan konsentrasi yang teradsorpsi pada
temperatur tertentu disebut dengan isoterm adsorbsi ini dinyatakan sebagai :
x/m = k. Cn ...(1)
dalam hal ini :
x = jumlah zat teradsorbsi (gram)
m = jumlah adsorben (gram)
C = konsentrasi zat terlarut dalam larutan, setelah tercapai kesetimbangan
adsorpsi
k dan n = tetapan, maka persamaan (1) menjadi :
log x/m = log k + n logc...(2)
Persamaan ini mengungkapkan bahwa bila suatu proses adsorbsi menuruti
isoterm Freundlich, maka aluran log x/m terhadap log C akan merupakan garis
lurus. Dari garis dapat dievaluasi tetapan k dan n (Tim Dosen Kimia Fisik, 2012).
Isoterm Freundlich :
Untuk rentang konsentrasi yang kecil dan campuran yang cair, isoterm
adsorpsi dapat digambarkan dengan persamaan empirik yang dikemukakan oleh
Freundlich. Isoterm ini berdasarkan asumsi bahwa adsorben mempunyai
permukaan yang heterogen dan tiap molekul mempunyai potensi penyerapan yang
berbeda-beda. Persamaan ini merupakan persamaan yang paling banyak
digunakan saat ini. Persamaannya adalah :
x/m = k C 1/n
dimana:
x = banyaknya zat terlarut yng teradsorpsi (mg)
m = massa adsorben (mg)
C = konsentrasi adsorben yang sama
k,n = konstanta adsorben
Dari persamaan tersebut, jika konsentrasi larutan dalam kesetimbangan
diplot sebagai ordinat dan konsentrasi adsorbat dalam adsorben sebagai absis
pada koordinat logaritmik, akan diperoleh gradien n dan intersept. Dari isoterm ini,
III.
ALAT DAN BAHAN
A. Alat1. Cawan porselin 1 buah
2. Labu erlenmeyer bertutup 250mL 12 buah
3. Labu erlenmeyer 150 ml 6 buah
4. Pipet 5 ml 1 buah
5. Pipet 10 ml 1 buah
6. Buret 25 ml 1 buah
7. Corong 2 buah
8. Pengaduk 1 buah
9. Spatula 1 buah
10. Neraca analitik 1 buah
11. Kertas saring 6 buah
12. Statif 1 buah
13. Stopwatch 1 buah
14. Pembakar spirtus 1 buah
15. Kasa asbes 1 buah
16. Kaki tiga 1 buah
B. Bahan
1. Larutan asam asetat 0,5 N
2. Adsorben arang atau karbon
3. Larutan standar NaOH 0,1 N
IV.
CARA KERJA
Panaskan arang
Menyiapkan masing-masing
125 ml larutan CH3COOH
0,5 N ; 0,25N ; 0,125 N ;
0,0625 N ; 0,0313 N dan
0,0156N
Masing-masing sisa CH3COOH10
mL dititrasi dengan NaOH 0,1 N
NaOH
CH3COOH
NaOH
Titrasi larutan tersebut dengan
NaOH 0,1 M masing-masing 5 mL,
5mL, 10 mL, 25 mL, 25 mL, 25 mL
CH3COOH
dinginkan Masukkan masing-masing 1
gram ke dalam 6 erlenmeyer
masuk
Tutup dengan plastik Biarkan 30
Langkah pertama yang dilakukan dalam praktikum isoterm adsorbsi ini
adalah melakukan pemanasan arang terlebih dahulu. Pemanasan dihentikan pada
saat timbul asap, bukan pada saat arang menjadi berwarna merah (membara).
Ketika arang dipanaskan, pori-pori pada permukaan arang akan membuka
sehingga nantinya arang menjadi aktif dan dapat digunakan untuk mengabsorbsi
asam asetat secara maksimal. Apabila pemanasan arang terlalu lama, akibatnya
arang akan berubah menjadi abu dan tidak lagi dapat digunakan sebagai absorben
lagi.
Adapun sifat karbon aktif yang paling penting adalah daya serap. Berikut
merupakan faktor-faktor yang mempengaruhi daya serap adsorbsi.
1. Sifat Serapan
Adsorpsi akan bertambah besar sesuai dengan bertambahnya ukuran molekul
serapan dari sturktur yang sama, seperti dalam deret homolog. Adsorbsi juga
dipengaruhi oleh gugus fungsi, posisi gugus fungsi, ikatan rangkap, struktur
rantai dari senyawa serapan.
2. Temperatur/ suhu
Faktor yang mempengaruhi suhu proses adsoprsi adalah viskositas dan
stabilitas thermal senyawa serapan. Jika pemanasan tidak mempengaruhi
sifat-sifat senyawa serapan, seperti terjadi perubahan warna mau dekomposisi,
maka perlakuan dilakukan pada titik didihnya.
3. pH (Derajat Keasaman)
Untuk asam-asam organik, adsorpsi akan meningkat bila pH diturunkan, yaitu
dengan penambahan asam-asam mineral. Ini disebabkan karena kemampuan
asam mineral untuk mengurangi ionisasi asam organik tersebut. Sebaliknya bila
pH asam organik dinaikkan yaitu dengan menambahkan alkali, adsorpsi akan
berkurang sebagai akibat terbentuknya garam.
4. Waktu Singgung
Bila karbon aktif ditambahkan dalam suatu cairan, dibutuhkan waktu untuk
mencapai kesetimbangan. Waktu yang dibutuhkan berbanding terbalik dengan
jumlah arang yang digunakan. Selisih ditentukan oleh dosis karbon aktif,
pengadukan juga mempengaruhi waktu singgung.
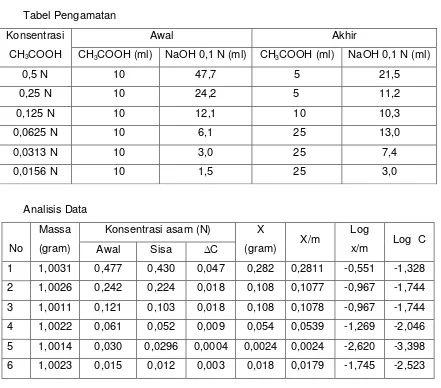
Larutan asam asetat yang digunakan dalam praktikum ini memiliki beberapa
variasi konsentrasi, yakni 0,5 N ; 0,25 N ; 0,125 N ; 0,0625 N ; 0,0313 N ; 0,0156 N.
Selain adanya variasi konsentrasi, ke-enam macam larutan asam asetat tersebut
juga mendapatkan dua perlakuan yang berbeda, yakni : (1) tidak mendapat
setiap jangka waktu 10 menit dalam 30 menit pertama, dan kemudian disaring.
Selanjutnya, semua larutan tersebut dititrasi dengan larutan NaOH 0,1 N untuk
mendapatkan konsentrasi awal (larutan asam asetat murni) dan konsentrasi akhir
(larutan asam asetat + arang). Penentuan konsentrasi awal dak akhir larutan asam
asetat disini menggunakan rumus pengenceran, yakni V1.M1 = V2.M2
Konsentrasi awal dan akhir yang didapat berdasarkan hasil praktikum
kemudian dikurangkan untuk mengetahui harga ∆C larutan asam asetat. Selain itu,
data konsentrasi tersebut juga dapat digunakan untuk menghitung harga X (gram)
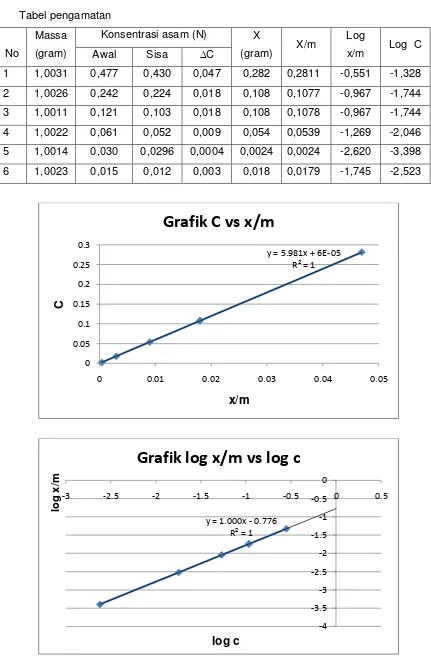
dengan rumus X = massa x Mr x 100/1000. Akhirnya, berdasarkan analisis data
yang telah dilakukan, dihasilkan 2 grafik yang berbentuk linier, yakni grafik C vs
X/m dan grafik log X/m vs log C. Terbentuknya grafik linier dalam praktikum ini
menunjukkan bahwa isotherm adsorbsi yang berlangsung disini memang benar
merupakan isotherm adsorbsi Freundlich.
Berdasarkan persamaan grafik Isoterm Adsorpsi Freundlich (log x/m vs log
c) jika dianalogikan dengan persamaan Freundlich maka akan didapat nilai k dan n.
Persamaan isoterm adsorpsi Freundlich dapat dituliskan sebagai berikut.
Log (x/m) = log k + 1/n log c
sedangkan persamaan grafik Isotherm Adsorpsi Freundlich adalah
y = 1,000x – 0,776
Jadi, didapat nilai Log k = -0,776 dan 1/n = 1,000. Maka nilai k adalah 0,1675 dan
nilai n adalah 1.
Mengenai gambar grafik log x/m vs log C yang dihasilkan sudah sesuai
dengan teori isotherm adsorpsi Freundlich yaitu grafik berupa garis linear
sedangkan grafik C vs x/m belum sesuai dengan teori isotherm adsobsi Langmuir
karena seharusnya grafik seperti setengah trapezium mengalami kenaikan dan
selanjutnya terjadi kekonstanan. Namun dari hasil percobaan ini grafik mengalami
terus mengalami kenaikan. Hal ini mungkin terjadi karena kekurang cermatan
praktikan dalam mengencerkan larutan asam asetat yang akan digunakan, atau
ketidaktepatan praktikan dalam memanaskan arang sehingga arang yang
VI.
KESIMPULAN DAN SARAN
Kesimpulan
1. Percobaan ini tergolong isotherm adsorpsi Freundlich. Oleh karenanya,
didapatkan kurva antara log x/m dengan Log C berbentuk linier.
2. Persamaan isoterm adsorpsi Freundlich dalam percobaan ini dapat
dituliskan y = 1,000x – 0,776. Dengan K = 0,1675 dan n = 1,000
Saran
1. Praktikan lebih baik menyiapkan langkah kerja dan pembagian tugas
anggota kelompok terlebih dahulu sehingga waktu praktikum dapat
digunakan seefektif dan seefisien mungkin
2. Praktikan harus cermat dalam melaksanakan praktikum ini, terlebih lagi
dalam penggunaan buret pada saat titrasi.
VII. DAFTAR PUSTAKA
Harfi.2003.Senyawa-Senyawa Organik.Jakarta : Bumi Aksara.
Kustanto.2000.Karbon Aktif dalam Kehidupan Sehari-hari.Jogjakarta : Universitas
Gadjah Mada
Murdiyanto.2005.Senyawa Karbon.Malang : Universitas Brawijaya.
Sudarman.2001.Manfaat Arang Aktif.Makassar : Universitas Hassanudin.
Tim Dosen Kimia Fisik.2012.Diktat Petunjuk Praktikum Kimia Fisik.Semarang :
Universitas Negeri Semarang.
VIII.
JAWABAN PERTANYAAN
1. Apakah proses adsorpsi ini merupakan adsorpsi fisik atau khemisorpsi?
Jawab :
Pada percobaan ini proses adsorpsi terjadi secara adsorpsi fisik yang memiliki
cirri molekul yang terikat pada adsorben oleh gaya Van Der Walls, mempunyai
entalpi reaksi dan bersifat tidak spesifik
2. Apakah perbedan antara kedua jenis adsorpsi ini? Berikan contoh dari kedua
jenis adsorpsi ini !
Jawab :
a. Adsorbsi fisik, yaitu berhubungan dengan gaya Van der Waals dan
dengan pelarutnya maka zat yang terlarut akan diadsorbsi pada permukaan
adsorben, tidak melibatkan energy aktivasi.
b. Adsorbsi kimia, yaitu reaksi yang terjadi antara zat padat dan zat terlarut
yang teradsorbsi, terjadi pemutusan dan pembentukan ikatan kimia, panas
adsorbsinya tinggi, melibatkan energy aktivasi.
Ex : adsorpsi SDBS
Adsorsi fisik : adsorpsi nitrogen pada besi secara fisik nitrogen cair pada -190 0 C akan teradsorpsi pada besi
Adsorpsi kimia: pada suhu 500 0 C nitrogen teradsorpsi cepat pada permukaan besi.
3. Apakah perbedaan yang terjadi pada pengaktifan arang dengan cara
pemanasan ?
Pengaktifan arang dengan cara pemanasan :
a. L-karbon (L-AC) yaitu karbon aktif yang dibuat dengan oksidasi pada suhu
300oC – 400oC (570o-750oF) dengan menggunakan udara atau oksidasi kimia. L-AC sangat cocok dalam mengadsorbsi ion terlarut dari logam berat
basa seperti Pb2+, Cu2+, Cd2+, Hg2+. Karakter permukaannya yang bersifat
asam akan berinteraksi dengan logam basa. Regenerasi dari L-AC dapat
dilakukan menggunakan asam atau garam seperti NaCl hampir sama pada
perlakuan pertukaran ion.
b. H-karbon (H-AC) yaitu karbon aktif yang dihasilkan dari proses pemasakan
pada suhu 800o-1000oC (1470o-1830oF) kemudian didinginkan pada
atmosphere inersial. H-AC memiliki permukaan yang bersifat basa sehingga
tidak efektif dalam mengadsorbsi logam berat alkali pada suatu larutan air
tetapi sangat lebih effisien dalam mengadsorbsi kimia organik, partikulat
hidrofobik, dan senyawa kimia yang mempunyai kelarutan yang rendah
dalam air. Akan tetapi H-AC dapat dimodifikasi dengan menaikan angka
asiditas. Permukaan yang netral akan mengakibatkan tidak efektifnya dalam
mereduksi dan mengadsorbsi kimia organik sehingga efektif mengadsorbsi
ion logam berat dengan kompleks khelat zat organik alami maupun sintetik
dengan menetralkannya.
4. Bagaimana isotherm Freundlich untuk adsorpsi gas pada permukaan zat
padat? Apa pembatasannya?
Jawab :
Isotherm Freundlich untuk adsorpsi gas pada permukaan zat padat kurang baik
aktif pada permukaan adsorben bersifat heterogen. Gas merupakan campuran
yang homogeny sehingga kurang cocok jika digunakan dalam isotherm
Freundlich.
Batasannya : adsorpsi Freundlich situs-situs aktif pada permukaan adsorben
bersifat heterogen.
5. Mengapa isotherm adsorpsi Freundlich untuk adsorpsi gas pada permukaan zat
padat kurang memuaskan dibandingkan dengan isotherm adsorpsi Langmuir ?
Bagaimana bentuk isotherm adsorpsi yang berakhir ini?
Jawab :
Karena pada adsorpsi Freundlich situs-situs aktif pada permukaan adsorben
bersifat heterogen, sedangkan adsorpsi pada Langmuir bersifat homogen.
Ketika mengadsorpsi gas yang wujudnya campuran yang homogeny, maka
adsorpsi Freundlich kurang cocok. Dari percobaan yang telah dilakukan,
adsorpsi ini berbentuk adsorpsi Langmuir.
Perhitungan
Diketahui [NaOH] = 0,1 N
Asam asetat (CH3COOH) yang diadsorpsi = 100 mL
Jumlah zat yang teradsorbsi (x)
4. x4 = (Cawal-Cakhir) x Mr x V / 1000
= 0,009 x 60 x 100 / 1000
= 0,054 gram
5. x5 = (Cawal-Cakhir) x Mr x V / 1000
= 0,0004 x 60 x 100 / 1000
= 0,0024 gram
6. x6 = (Cawal-Cakhir) x Mr x V / 1000
= 0,003 x 60 x 100 / 1000