PENURUNAN TITIK BEKU
Nina Fitriana*, Frista IrwanindaLab. Kimia Fisika Jurusan Kimia Universitas Negeri Semarang Gedung D8 Lt 2 Sekaran Gunungpati Semarang, Indonesia, 50225
ninafitriana10051995@gmail.com, 085770440465
Abstrak
Percobaan ini dilakukan untuk menentukan tetapan penurunan titik beku asam asetat dan menentukan massa molekul relatif dari zat X. Metode yang digunakan dalam percobaan ini adalah metode penurunan titik beku. Pada percobaan ini digunakan pelarut berupa asam asetat murni dan zat terlarut yaitu naftalena dan zat X. Jika ke dalam suatu pelarut ditambahkan zat terlarut maka suhunya akan semakin rendah. Pada percobaan ini, variabel bebas yang digunakan adalah massa zat terlarut, yaitu massa naftalena yang digunakan dalam penentuan tetapan titik beku asam asetat dan massa zat X untuk penentuan massa molekul relatif zat non elektrolit. Sedangkan variabel terikat yang digunakan adalah penurunan titik beku. Pada praktikum ini juga digunakan metode praktikum dan pelarut yang sama merupakan variabel kontrolnya. Untuk mengetahui hubungan antara penurunan titik beku dengan massa molekul relatif digunakan metode analisis menggunakan persamaan Clausius Claypeyron. Hasil yang diperoleh dalam percobaan ini yaitu nilai Kf (tetapan penurunan titik beku) dari asam asetat sebesar 69,938°C/m dan massa molekul relatif dari zat X sebesar 1126,742 g/mol.
Kata Kunci : Asam asetat ; Penurunan titik beku ; zat X
Abstract
This experiment is done to determine the freezing point depression constant of acetic acid and determine the relative molecular mass of the substance X. The method used in this experiment is a method of freezing point depression. In this experiment used pure solvent such as acetic acid and solutes is naphthalene and X substance. If a solvent is added to the solute, the temperature will be lower. In this experiment, the independent variable used is the mass of the solute, ie the mass of naphthalene used in the determination of the freezing point constant of acetic acid and X substance for the determination of the mass relative molecular mass of non-electrolytic substance. The dependent variable used is the freezing point depression. In this experiment is also used same experiment methods and solvent are control variables. To know the relationship between the freezing point depression with a relative molecular mass used analysis method using Clausius Claypeyron equation. The results obtained in this experiment that the value of Kf (constant freezing point depression) of acetic acid is 69.938°C/m and the
relative molecular mass of substance X is 1126,742 g / mol.
Keywords : Acetic acid ; Depression of freezing point ; X substance
Pendahuluan
Di sekitar kita banyak terjadi perubahan fase suatu zat. Dalam hal ini yang paling
sering ditemui adalah perubahan dari fase cair menjadi fase padat atau yang disebut
membeku. Hal ini terutama terjadi di negara yang memiliki 4 musim, karena memiliki musim
berlangsung cepat. Apapun yang ada pasti akan mengalami proses pembekuan secara cepat.
Oleh karena itu untuk mengatasi hal tersebut dilakukan upaya penurunan titik beku.
Titik beku adalah temperatur pada saat tekanan uap cairan sama (setimbang) dengan
tekanan uap padatannya. Titik beku dilambangkan dengan simbol Tf. Air murni membeku
pada temperatur 0°C dan tekanan 1 atm. Temperatur itu dinamakan titik beku normal air.
Temperatur dimana zat cair membeku pada tekanan 1 atm adalah titik beku normal zat cair
tersebut.
Titik beku suatu larutan pasti selalu lebih rendah daripada titik beku pelarut murninya
(air). Hal ini dikarenakan sebagian partikel air dan partikel-partikel terlarut akan bergabung
dan membentuk ikatan. Sehingga ketika membeku, yang memiliki titik beku paling tinggi
adalah air karena air yang membeku terlebih dahulu, kemudian diikuti oleh partikel-partikel
terlarut.
Setiap larutan memiliki titik beku yang berbeda-beda. Titik beku suatu larutan akan
berubah jika tekanan uapnya juga berubah. Hal ini disebabkan oleh masuknya zat terlarut
yang mempengaruhi perubahan titik beku. Jadi, jika suatu zat terlarut ditambahkan ke dalam
larutan, titik beku larutan tersebut akan berubah. Besarnya perbedaan antara titik beku zat
pelarut dengan titik beku larutan disebut penurunan titik beku (∆Tf) (Parning, 2007).
Titik beku dan titik didih suatu larutan bergantung pada kesetimbangan pelarut dalam
larutan dengan pelarut padatan, selain itu juga bergantung pada kesetimbangan pelarut
dengan pelarut murni (air). Pada saat terjadi kesetimbangan, maka dapat tercapai titik beku
atau titik didihnya (Wahyuni, 2013). Masing-masing pelarut memiliki harga tetapan
penurunan titik beku (Kf) tersendiri.
Untuk menentukan perubahan titik beku yang terjadi dapat digunakan rumus dari
persamaan Clausius Claypeyron :
Keterangan :
Kf = tetapan penurunan titik beku molal
Masalah yang akan dipecahkan dalam praktikum ini adalah bagaimana menentukan
tetapan penurunan titik beku asam asetat dan massa molekul relatif zat X. Dari permasalahan
tersebut, dapat diketahui tujuan dari praktikum ini adalah untuk menentukan tetapan
penurunan titik beku asam asetat dan massa molekul relatif zat X.
Alat-alat yang digunakan dalam praktikum penurunan titik beku ini adalah gelas
kimia 25 mL dari pyrex, gelas arloji, tabung reaksi besar dari pyrex, termometer 100°C, pipet
tetes, pengaduk kaca, stopwatch, baskom untuk membuat thermostat sederhana, serta statif
yang digunakan untuk menggantung termometer. Sedangkan bahan yang digunakan dalam
praktikum ini adalah asam asetat dari Merck, naftalena for syn dari Merck, serta zat X.
Langkah selanjutnya adalah sebanyak 15 mL larutan asam asetat pekat diletakkan
dalam gelas kimia 25 mL dan dimasukkan dalam termostat untuk diukur titik bekunya. Asam
asetat dibiarkan hingga mencair kembali. Kemudian, temperatur asam asetat dibiarkan naik
5°C dan setelah itu 0,2538 gram naftalena dimasukkan kedalam larutan asam asetat tersebut
dan diaduk menggunakan pengaduk kaca. Larutan tersebut dimasukkan ke dalam termostat
untuk dilakukan pengukuran temperatur larutan naftalena dalam asam asetat tiap menit
hingga temperaturnya konstan dan tercapai titik bekunya. Kemudian, 0,2535 gram zat X
dimasukkan ke dalam tabung reaksi besar dan ditambahkan asam asetat pekat 15 mL dan
diaduk menggunakan pengaduk kaca. Larutan tersebut dimasukkan ke dalam termostat untuk
dilakukan pengukuran temperatur larutan zat X dalam asam asetat tiap menit hingga
temperaturnya konstan dan tercapai titik bekunya.
Pada praktikum ini variabel bebas yang digunakan adalah massa zat terlarut, yaitu
massa naftalena yang digunakan dalam penentuan tetapan titik beku asam asetat dan massa
zat X untuk penentuan massa molekul relatif zat non elektrolit. Sedangkan variabel terikat
yang digunakan adalah penurunan titik beku. Pada praktikum ini juga digunakan metode
praktikum dan pelarut yang sama merupakan variabel kontrolnya. Untuk mengetahui
hubungan antara penurunan titik beku dengan massa molekul relatif digunakan metode
analisis menggunakan persamaan Clausius Claypeyron (Team Lecturer of Physical
Chemistry, 2014).
Hasil Dan Pembahasan
Percobaan penurunan titik beku ini bertujuan untuk menentukan tetapan penurunan
titik beku asam asetat dan berat molekul zat X dengan metode titik beku. Dalam percobaan
ini digunakan asam asetat (CH3COOH) sebagai pelarut, sedangkan untuk zat terlarutnya
digunakan naftalena (C8H10) dan zat X (zat yang tidak mudah menguap). Dalam percobaan
ini penambahan naftalena dan zat X ke dalam pelarut menyebabkan terjadinya penurunan
titik beku. Asam asetat yang digunakan sebagai pelarut murni akan membeku dan zat
Pada praktikum ini juga digunakan garam yang ditambahkan pada termostat dengan
tujuan agar es batu dalam termostat tidak mudah mencair karena garam akan menghambat
kestabilan ikatan partikel air yang berada dalam fase padat yaitu berupa es. Asam asetat
(CH3COOH) adalah asam organik yang memberikan rasa asam pada cuka dan merupakan
salah satu contoh dari asam lemah. Asam asetat pekat bersifat korosif dan dapat
menyebabkan luka bakar kulit sehingga perlu penanganan yang tepat untuk asam ini, untuk
mengambil asam asetat pekat harus dilakukan di dalam lemari asam (Anonim, 2014).
Perlakuan pertama adalah menentukan titik beku pelarut murni yaitu asam asetat. Dari
hasil percobaan diperoleh data pada Tabel 1.
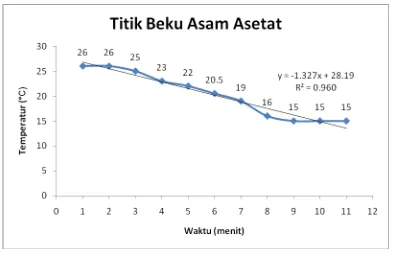
Tabel 1. Temperatur vs Waktu untuk larutan CH3COOH murni Waktu (menit) Temperatur (°C) Kondisi cairan
Belum beku Beku sebagian Beku semua
1 26
2 26
3 25
4 23
5 22
6 20,5
7 19
8 16
9 15
10 15
11 15
Berdasarkan Tabel 1 dapat dilihat pada menit ke 9 – 11, temperatur asam asetat
konstan sehingga temperatur ini yang dicatat sebagai titik beku asam asetat. Dari tabel dapat
disimpulkan bahwa titik beku dari asam asetat murni sebesar 15°C. Hal ini tidak sesuai
dengan teori yang menyatakan bahwa titik beku asam asetat sebesar 16,7 °C (Anonim, 2014).
Hal ini dikarenakan pada percobaan yang dilakukan terjadi kesalahan, salah satunya
disebabkan karena terlalu banyak es batu dan garam krosok yang dimasukkan ke dalam
termostat, sehingga temperatur larutan menjadi cepat turun dan membeku. Selain itu, pada
saat larutan asam asetat masih dalam kondisi beku sebagian, temperaturnya sudah konstan
sehingga temperatur tersebut dicatat sebagai titik beku asam asetat. Grafik dari hasil
Gambar 1. Titik beku asam asetat murni
Pada Gambar 1. dapat disimpulkan bahwa semakin lama waktu yang berjalan maka
temperatur asam asetat murni semakin rendah. Titik beku asam asetat murni ditentukan dari
temperatur yang konstan. Pada gambar 1 ditunjukkan pada menit 9, 10, dan 11, temperatur
asam asetat konstan sebesar 15°C. Berdasarkan referensi yang didapatkan titik beku asam
asetat adalah 16,7°C. Hasil yang kami dapatkan berbeda, hal ini dikarenakan beberapa faktor.
Diantaranya temperatur ruangan saat praktikum yang ikut mempengaruhi titik beku dari asam
asetat.
Setelah itu, percobaan dilanjutkan dengan penentuan tetapan titik beku asam asetat
melalui penambahan zat terlarut naftalena. Naftalena (C8H10) adalah zat yang tidak dapat
larut dalam air dan alkohol, namun dapat larut dalam eter dan benzena. Naftalena berbentuk
kristal putih dan memiliki bau yang kuat. Naftalena memiliki sifat mudah menguap dan
mudah terbakar (Anonim, 2014) .
Dalam percobaan ini juga dicatat penurunan titik beku naftalena dalam asam asetat
setiap menit. Dari hasil percobaan diperoleh data pada Tabel 2.
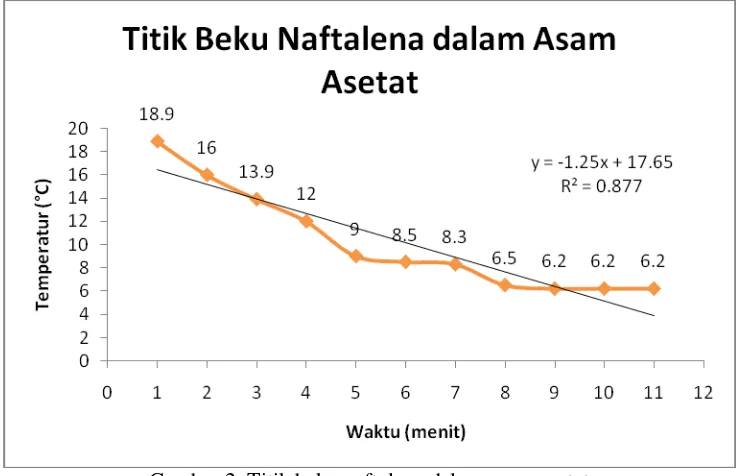
Tabel 2. Penentuan titik beku naftalena dalam asam asetat Waktu (menit) Temperatur (°C) Kondisi cairan
Belum beku Beku sebagian Beku semua
1 18,9
2 16
3 13,9
4 12
5 9
6 8,5
8 6,5
9 6,2
10 6,2
11 6,2
12 6,2
Titik beku larutan = 6,2°C
Penurunan titik beku larutan (∆Tf) = Tf° - Tf = (15 – 6,2)°C = 8,8°C
Dari Tabel 2 diketahui titik beku semakin menurun jika ditambahkan zat terlarut.
Semakin banyak zat terlarut yang ditambahkan, maka titik bekunya semakin rendah. Namun,
dalam percobaan ini tidak dilakukan variasi berat zat terlarut yang ditambahkan. Pada tabel 2,
pada menit ke 9 – 12, temperatur naftalena dalam asam asetat konstan sehingga temperatur
tersebut yang dicatat sebagai titik beku naftalena dalam asam asetat. Grafik dari hasil
percobaan dapat dilihat pada Gambar 2.
Gambar 2. Titik beku naftalena dalam asam asetat
Dari Gambar 2, dapat disimpulkan bahwa semakin lama waktu yang berjalan maka
temperatur naftalena dalam asam asetat juga semakin rendah. Titik beku naftalena dalam
asam asetat ditentukan dari temperatur yang konstan. Pada Gambar 2 ditunjukkan pada menit
9, 10, 11, dan 12 temperatur naftalena dalam asam asetat konstan sebesar 6,2°C.
Setelah itu percobaan dilanjutkan dengan penentuan berat molekul zat X yang
ditambahkan ke dalam asam asetat. Dari percobaan diperoleh data pada Tabel 3.
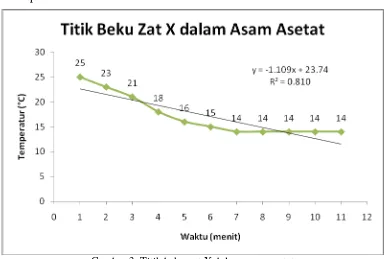
Tabel 3. Penentuan titik beku zat X dalam asam asetat Waktu (menit) Temperatur (°C) Kondisi cairan
Belum beku Beku sebagian Beku semua
2 23
3 21
4 18
5 16
6 15
7 14
8 14
9 14
10 14
11 14
12 14
13 14
Titik beku larutan = 14 °C
Penurunan titik beku larutan (∆Tf) = Tf° - Tf = (15 – 14) °C = 1 °C
Dari data Tabel 3 diketahui titik beku semakin menurun jika ditambahkan zat terlarut.
Semakin banyak zat terlarut yang ditambahkan, maka titik bekunya semakin rendah. Pada
tabel 3, pada menit ke 7–13, temperatur zat X dalam asam asetat konstan sehingga temperatur
tersebut yang dicatat sebagai titik beku zat X dalam asam asetat. Grafik dari hasil percobaan
dapat dilihat pada Gambar 3.
Gambar 3. Titik beku zat X dalam asam asetat
Dari Gambar 3, dapat disimpulkan bahwa semakin lama waktu yang berjalan maka
temperatur zat X dalam asam asetat juga semakin rendah. Grafik ini juga sama dengan grafik
penurunan titik beku naftalena dalam asam asetat karena pelarut yang digunakan sama. Titik
beku zat X dalam asam asetat ditentukan dari temperatur yang konstan. Pada gambar 3
konstan sebesar 14°C. Jadi titik beku zat X dalam asam asetat adalah 14°C. Titik beku zat X
dalam asam asetat tidak berbeda jauh dengan asam asetat, temperatur keduanya hanya selisih
1°C. Sehingga penurunan titik bekunya juga hanya sebesar 1°C.
Setelah didapatkan data titik beku naftalena dalam asam asetat maka dapat dihitung harga ∆Tf (penurunan titik beku). Penurunan titik beku larutan adalah selisih antara titik beku
pelarut murni dengan larutan. Selain itu, dengan menggunakan cara yang sama, dapat
dihitung pula penurunan titik beku dari zat X. Perbedaan titik beku naftalena dalam asam
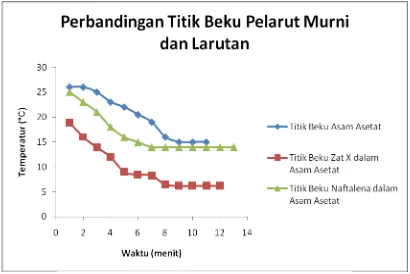
asetat dan zat X dalam asam asetat dapat dilihat pada Gambar 4.
Gambar 4. Perbandingan Titik Beku Pelarut Murni dengan Larutan
Dari Gambar 4, dapat disimpulkan bahwa titik beku larutan selalu lebih rendah
daripada pelarut murni (Maria, Tine dkk, 2007). Hal ini disebabkan dalam suatu larutan
terdapat banyak partikel yang bekerja dibandingkan dengan pelarut murni. Ketika suatu
pelarut murni membeku, maka setelah itu zat-zat terlarutnya juga akan ikut membeku.
Pada Gambar 4 jelas terlihat bahwa titik beku naftalena dalam asam asetat dan titik
beku zat X dalam asam asetat lebih rendah jika dibandingkan dengan titik beku asam asetat
murni. Hanya saja titik beku asam asetat murni dengan titik beku zat X dalam asam asetat
hanya selisih 1°C.
Berdasarkan perhitungan yang telah dilakukan, didapatkan harga penurunan titik beku
naftalena dalam asam asetat sebesar 8,8°C dan harga penurunan titik beku zat X dalam asam
massa jenis sebesar 1,049 g/mL. Dari hasil perhitungan didapatkan massa asam asetat murni
sebesar 15,735 gram. Setelah didapatkan harga penurunan titik beku naftalena dalam asam
asetat dan zat X dalam asam asetat maka dapat dihitung harga tetapan penurunan titik beku
menggunakan persamaan Clausius Claypeyron dan didapatkan Kf sebesar 69,938°C/m.
Harga Kf asam asetat murni yang didapatkan jauh dari harga Kf dalam teori. Secara
teori, harga Kf asam asetat murni adalah 3,57°C/m. Perbedaan hasil yang didapatkan
kemungkinan disebabkan oleh temperatur ruangan ketika melakukan praktikum. Selain itu,
faktor human error juga bisa mempengaruhi hasil yang didapatkan.
Dari Kf yang didapatkan dapat dihitung pula nilai massa molekul relatif dari zat X
menggunakan persamaan Clausius Claypeyron. Massa molekul relatif dari zat X adalah
1126,742 g/mol. Akan tetapi massa molekul relatif yang didapatkan tidak dapat dibandingkan
dengan teori karena belum diketahuinya nama senyawa dari zat X tersebut. Tetapi dari Mr
yang diperoleh, Mr yang didapatkan begitu besar sehingga kemungkinan zat X tersebut
merupakan senyawa kompleks.
Kesimpulan
Titik beku adalah temperatur pada saat tekanan uap cairan sama (setimbang) dengan
tekanan uap padatannya. Titik beku dilambangkan dengan simbol Tf. Titik beku pelarut
murni akan mengalami penurunan jika ke dalam pelarut tersebut ditambahkan zat pelarut.
Dari percobaan yang telah dilakukan diperoleh, nilai Kf (tetapan penurunan titik beku) dari
asam asetat adalah 69,938°C/m dan massa molekul relatif dari zat X sebesar 1126,742 g/mol.
Daftar Pustaka
Maria, Tine dkk. 2007. Sains Kimia 3 SMA/MA. Jakarta: Bumi Aksara.
Parning, Horale, Tiopan. 2007. Kimia 3 SMA/MA Kelas XII. Jakarta: Yudhistira. Purba, Michael. 2004. Kimia Untuk SMA Kelas XII. Jakarta: Erlangga.
Team Lecturer of Physical Chemistry. 2014. Practicum Guide of Physical Chemistry. Semarang: Department of Chemistry FMIPA Unnes.
Wahyuni S. 2013. Diktat Petunjuk Praktikum Kimia Fisik. Semarang: Jurusan Kimia FMIPA Universitas Negeri Semarang.
Harjito. 2013. Panduan Penulisan Manuskrip. Diunduh di www.facebook.com/groups/chemisfun/shshhsnshhs.pdf pada tanggal 2 November 2014. Anonim. 2014. Asam Asetat. Diunduh di http://id.wikipedia.org/wiki/Asam_asetat pada tanggal 12
November 2014 pukul 19.00 WIB.