LAPORAN PRAKTIKUM LARUTAN “Kenaikan Titik Didih ”
Disusun oleh:
Kelompok 3
PROGRAM STUDI S-1 PENDIDIKAN IPA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI SURABAYA
2015
1. Faiqotul Himmah 13030654049 2. Rizka Yuni R. 13030654056 3. M. Tasroun Nihwan 13030654057 4. Devi Nadiya W. 13030654062 5. Winda Nur Ainun 13030654081
KENAIKAN TITIK DIDIH
ABSTRAK
Percobaan “Kenaikan Titik Didih” bertujuan untuk mengetahui pengaruh jenis zat terlarut (volatile dan non volatile), konsentrasi larutan, serta jenis zat terlarut (elektrolit dan non elektolit) terhadap kenaikan titik didih larutan. Metode yang digunakan adalah dengan mencampurkan zat terlarut volatile dan non volatile, serta zat terlarut elektrolit dan nonelektrolit kedalam air, dan membuat variasi konsentrasi larutan gula, kemudian membandingkan hasil dengan titik didih air murni sehingga diperoleh kenaikan titik didih. Hasil yang kami peroleh pada larutan elektrolit dan non elektrolit sudah sesuai dengan teori , yakni nilai titik didih larutan elektrolit lebih besar dibandingkan non elektrolit dengan titik didih secara berurutan adalah 94 ˚C dan 93 ˚C. Pada zat terlarut volatile dan non volatile diperoleh titik didih secara berurutan 96 ˚C dan 94 ˚C, hal ini belum sesuai dengan teori dimana seharusnya titik didih zat terlarut volatile lebih kecil dibanding larutan non volatile. Pada konsentrasi larutan gula terjadi penurunan titik didih, dimana secara teori seharusnya semakin tinggi konsentasi zat terlarut, maka titik didihnya juga akan semakin besar. Adanya ketidaksesuian antara hasil pengamatan dengan hasil perhitungan secara teori ini disebabkan oleh beberapa faktor seperti kesalahan dalam membaca skala yang ditunjukkan oleh termometer, api spiritus yang tidak konstan, dan suhu ruangan yang ber-AC.
DAFTAR ISI
Halaman Sampul...i
Abstrak ...ii
Daftar Isi...iii
BAB I Pendahuluan A. Latar Belakang...1
B. Rumusan Masalah...1
C. Hipotesis...2
D. Tujuan Percobaan...2
E. Manfaat...2
BAB II Kajian Teori A. Kenaikan Titik Didih...3
B. Hukum Raoult...3
BAB III Metode Percobaan A. Alat dan Bahan...6
B. Variabel yang Digunakan...6
C. Alur Percobaan...7
D. Langkah Percobaan...8
BAB IV Data dan Analisis A. Data...10
B. Analisis...11
C. Pembahasan...11
BAB V Penutup A. Kesimpulan...13
B. Saran...13
Daftar Pustaka...14
Lampiran Foto...15
Perhitungan...18
BAB I PENDAHULUAN
A. Latar Belakang
Suhu dimana cairan mendidih dinamakan titik didih. Titik didih adalah temperatur dimana tekanan uap sama dengan tekanan atmosfer. Suhu (temperatur) dimana tekanan uap sebuah zat cair sama dengan tekanan eksternal yang dialami oleh cairan. Berdasarkan nilai titik didih zat terlarut, larutan dapat dibagi dua yaitu titik didih zat terlarut lebih kecil dari pelarutnya sehingga zat terlarut lebih mudah menguap , dan yang kedua zat terlarut lebih besar daripada pelarutnya sehingga apabila dipanaskan pelarut yang lebih dulu menguap. Kenaikan titik didih larutan bergantung pada jenis zat terlarut, konsentrasi larutan, serta eletrolit atau non elektrolit zat terlarut. Untuk membuktikan pengaruh ketiga faktor tersebut terhadap kenaikan titik didih maka perlu dilakukan percobaan ini.
B. Rumusan Masalah
Berdasarkan latar belakang diatas, maka rumusan masalah pada percobaan ini adalah :
1. Bagaimana pengaruh jenis zat terlarut terhadap kenaikan titik didih larutan? 2. Bagaimana hubungan antara konsentrasi larutan dengan kenaikan titik didih
larutan?
3. Bagaimana pengaruh antara larutan elektrolit dan non elektrolit terhadap kenaikan titik didih larutan?
C. Tujuan Percobaan
Adapun tujuan dari percobaan ini adalah sebagai berikut :
1. Mengidentifikasi pengaruh jenis zat terlarut terhadap kenaikan titik didih larutan.
2. Mengidentifikasi hubungan antara konsentrasi larutan dengan kenaikan titik didih larutan.
D. Hipotesis
1. Jika jenis suatu zat terlarut adalah non volatile maka menyebabkan kenaikan titik didih, jika jenis suatu zat terlarut adalah volatile maka tidak terjadi kenaikan titik didih.
2. Jika konsentrasi zat terlarut tinggi maka kenaikan titik didih semakin besar.
3. Jika larutan adalah elektrolit maka menyebabkan kenaikan titik didih, jika larutan adalah nonelektrolit maka tidak terjadi kenaikan titik didih.
E. Manfaat
Manfaat dari percobaan ini adalah dapat membuktikan secara langsungpengaruh jenis zat terlarut (volatile dan non volatile), konsentrasi larutan, sertajenis larutan (elektrolit dan non elektrolit) terhadap kenaikan titik didih suatuzat. Sehingga akan dapat menambah pemahaman mengenai kenaikan titikdidih zat.
BAB II KAJIAN TEORI
A. Kenaikan Titik didih
Suhu dimana cairan mendidih dinamakan titik didih. Jadi, titik didih adalah temperatur dimana tekanan uap sama dengan tekanan atmosfer. Selama gelembung terbentuk dalam cairan, berarti selama cairan mendidih, tekanan uap sama dengan tekanan atmosfer, karena tekanan uap adalah konstan maka suhu dan cairan yang mendidih akan tetap sama. Penambahan kecepatan panas yang diberikan pada cairan yang mendidih hanya menyebabkan terbentuknya gelembung uap air lebih cepat. Cairan akan lebih cepat mendidih, tapi suhu didih tidak naik. Jelas bahwa titik didih cairan tergantung dari besarnya tekanan atmosfer.
Titik didih merupakan satu sifat lagi yang dapat digunakan untuk memperkirakan secara tak langsung berapa kuatnya gaya tarik antara molekul dalam cairan. Cairan yang gaya tarik antar molekulnya kuat, titik didihnya tinggi dan sebaliknya bila gaya tarik lemah, titik didihnya rendah .
Bila dalam larutan biner, komponen suatu mudah menguap (volatile) dan komponen lain sukar menguap (non volatile), makin rendah. Dengan adanya zat terlarut tekanan uap pelarut akan berkurang dan ini mengakibatkan kenaikan titik didih, penurunan titik beku dan tekanan uap osmose. Keempat sifat ini hanya ditentukan oleh banyaknya zat terlarut dan tidak ditentukan oleh jenis zat terlarut. Seperti telah disebutkan, sifat-sifat ini disebut sifat koligatif larutan. Adanya zat terlarut (solute) yang sukar menguap (non volatile), tekanan uap dari larutan turun dan ini akan menyebabkan titik didih larutan lebih tinggi dari pada titik didih pelarutnya. Ini disebabkan karena untuk mendidih, tekanan uap larutan sama dengan tekanan udara dan untuk temperatur harus lebih tinggi.
B. Hukum Roult
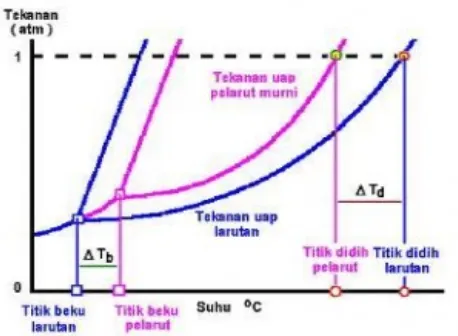
murni. Hal ini juga diikuti dengan penurunan titik beku pelarut murni, atau titik beku larutan lebih kecil dibandingkan titik beku pelarutnya. Hasil eksperimen ini disederhanakan dalam dapat dilihat pada gambar berikut:
Roult menyederhanakan ke dalam persamaan :
ΔTb = Kenaikan titik didih larutan
Kb = Tetapan kenaikan titik didih molal pelarut (kenaikan titik didih untuk 1 mol zat dalam 1000 gram pelarut)
m = molal larutan (mol/100 gram pelarut)
Perubahan titik didih atau ΔTb merupakan selisih dari titik didih larutan dengan titik didih pelarutnya, seperti persamaan :
Hal yang berpengaruh pada kenaikan titik didih adalah harga kb dari zat pelarut. Kenaikan tidak dipengaruhi oleh jenis zat yang terlarut, tapi oleh jumlah partikel/mol terlarut khususnya yang terkait dengan proses ionisasinya.
Untuk zat terlarut yang bersifat elektrolit persamaan untuk kenaikan titik didik harus dikalikan dengan faktor ionisasi larutan, sehingga persamaannya menjadi :
Gambar diagram tekanan suhu untuk titik didih dan titik beku dari pelarut dan larutan
ΔTb = Kb . m
Dimana :
BAB III METODE PERCOBAAN
A. Alat dan Bahan
1. Alat
a. Gelas kimia 3 buah b. Termometer 1 buah c. Pembakar spiritus 1 buah d. Kaki tiga 1 buah
e. Kasa 1 buah
f. Gelas ukur 1 buah g. Neraca digital 1 buah
h. Spatula 1 buah
i. Korek api 1 buah j. Stopwatch 1 buah 2. Bahan
a. NaCl secukupnya
b. Gula pasir secukupnya
c. Air secukupnya
B. Variabel yang Digunakan
1. Variabel kontrol: Jenis zat pelarut
Definisi operasional: Jenis zat pelarut yang digunakan untuk semua percobaan sama, yaitu air.
2. Variabel manipulasi: a. Jenis zat terlarut
Definisi operasional: Untuk percobaan pertama, jenis zat terlarut yang digunakan berbeda, yaitu nonvolatile (NaCl) dan volatile (air).
b. Konsentrasi zat terlarut
Definisi operasional: Untuk percobaan kedua, konsentrasi yang digunakan berbeda dengan menggunakan massa yang berbeda. 3. Variabel respon:
Definisi operasional: Suhu diukur menggunakan thermometer pada semua percobaan.
b. Waktu
Definisi operasional: Waktu dihitung menggunakan stopwatch pada semua percobaan.
c. Kenaikan titik didih
Definisi operasional: Kenaikan titik didih dilihat dari suhu dan waktu.
C. Alur Percobaan
1. Pengaruh jenis zat terlarut terhadap kenaikan titik didih
Air Air Air
Suhu
Kenaikan titik didih
Suhu & waktu Larutan Air 10 ml
Suhu & waktu Larutan NaCl
NaCl 1 gr
- dipanaskan hingga suhu konstan yang ditunjukkan oleh termometer
- dimasukkan ke dalam gelas kimia sebanyak 50 ml
- dimasukkan ke dalam gelas kimia berisi air
- diaduk hingga larut
- dimasukkan ke dalam gelas kimia sebanyak 50 ml
- dipanaskan hingga suhu yang ditunjukkan oleh termometer konstan
- dipanaskan hingga suhu yang ditunjukkan oleh termometer konstan
- ditambahkan ke dalam gelas kimia berisi air
2. Hubungan konsentrasi larutan dengan kenaikan titik didih
D. Langkah Percobaan
1. Pengaruh jenis zat terlarut terhadap kenaikan titik didih a. Menyiapkan alat dan bahan.
b. Menyalakan pembakar spiritus, menaruh gelas kimia yang berisi air 50 ml di atas pembakar spiritus sekaligus mengukur suhu dengan menggunakan termometer.
c. Menghitung suhu air yang dipanaskan selang 2 menit, sampai suhu yang ditunjukkan oleh termometer konstan.
d. Mengulang percobaan dengan memanaskan larutan NaCl (air 50
Air Air Air
Kenaikan titik didih
Suhu & waktu Larutan gula
Gula pasir
Suhu & waktu Larutan gula
Gula pasir
- dimasukkan ke dalam gelas kimia sebanyak 50 ml
- dimasukkan ke dalam gelas kimia berisi air sebanyak 1,0 gr
- diaduk hingga larut
- dimasukkan ke dalam gelas kimia sebanyak 50 ml
- dipanaskan hingga suhu yang ditunjukkan oleh termometer konstan
- dipanaskan hingga suhu yang ditunjukkan oleh termometer konstan
- dibandingkan Gula pasir
Larutan gula
Suhu & waktu
- dimasukkan ke dalam gelas kimia sebanyak 50 ml
- dimasukkan ke dalam gelas kimia berisi air sebanyak 0,5 gr
- diaduk hingga larut
- dimasukkan ke dalam gelas kimia berisi air sebanyak 1,5 gr
- diaduk hingga larut
e. Mencatat hasil kenaikan suhu dari setiap percobaan dan dibandingkan.
2. Hubungan konsentrasi larutan dengan kenaikan titik didih a. Menyiapkan alat dan bahan.
b. Menyalakan pembakar spiritus, menaruh gelas kimia yang berisi larutan gula ( air 50 ml + gula pasir 0,5 gr) di atas pembakar spiritus sekaligus mengukur suhu dengan menggunakan termometer.
c. Menghitung suhu larutan yang dipanaskan selang 2 menit, sampai suhu yang ditunjukkan oleh termometer konstan.
d. Mengulang percobaan dengan memanaskan larutan gula (air 50 ml + NaCl 1,0 gr) dan larutan gula (air 50 ml + air 1,5 ml). e. Mencatat hasil kenaikan suhu dari setiap percobaan dan
BAB IV DATA DAN ANALISIS
A. Data
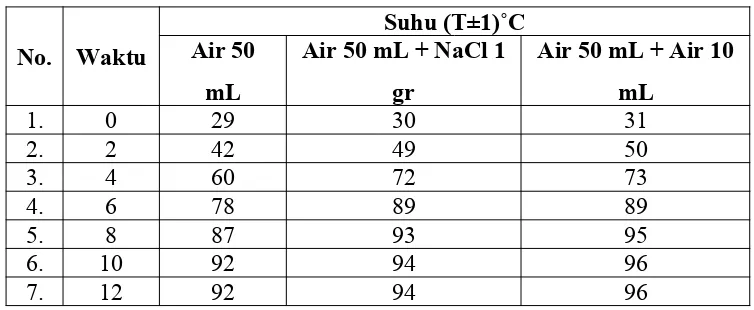
1. Hasil percobaan pengaruh jenis zat terlarut terhadap kenaikan titik didih
Tabel 1. Hasil perhitungan kenaikan titik didih.
No. Waktu
Suhu (T±1)˚C Air 50
mL
Air 50 mL + NaCl 1 gr
Air 50 mL + Air 10 mL
1. 0 29 30 31
2. 2 42 49 50
3. 4 60 72 73
4. 6 78 89 89
5. 8 87 93 95
6. 10 92 94 96
7. 12 92 94 96
2. Hasil percobaan hubungan kosentrasi larutan dengan kenaikan titik didih
Tabel 2. Hasil perhitungan kenaikan titik didih.
No. Waktu
Suhu (T±1)˚C Air 50 mL + Gula
0,5 gr
Air 50 mL + Gula 1 gr
Air 50 mL + Gula 1,5 gr
1. 0 29 30 28
2. 2 51 50 54
3. 4 72 77 77
4. 6 86 87 88
5. 8 91 92 91
6. 10 91 93 91
7. 12 91 93 91
B. Analisis
menjadi 96 ˚C. Sedangkan dalam tabel 2 dapat dilihat bahwa air gula jika dipanaskan memiliki nilai yang variatif tergantung dengan banyaknya zat terlarut didalamnya, yakni ketika gula yang dimasukkan adalah 0,5 gr maka titik didihnya adalah 91˚C, sedangkan ketika ditambah 1 gr titik didihnya adalah 93 ˚C dan ketika ditambahkan gula 1,5 gr maka titik didihnya adalah 91 ˚C.
C. Pembahasan
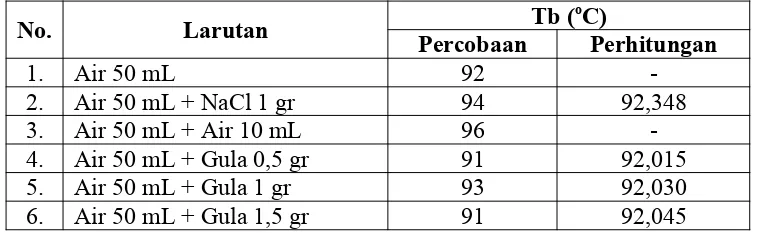
Tabel 3. Perbandingan hasil percobaan dan perhitungan kenaikan titik didih.
No. Larutan Tb (oC)
Percobaan Perhitungan
1. Air 50 mL 92
-2. Air 50 mL + NaCl 1 gr 94 92,348
3. Air 50 mL + Air 10 mL 96
-4. Air 50 mL + Gula 0,5 gr 91 92,015
5. Air 50 mL + Gula 1 gr 93 92,030
6. Air 50 mL + Gula 1,5 gr 91 92,045
Dari tabel perbandingan di atas dapat diketahui bahwa hasil percobaan dan perhitungan kenaikan titik didih menunjukkan perbedaan. Kenaikan titik didih larutan air 50 mL + NaCl 1 gr pada percobaan didapat 94 oC, sedangkanpada perhitungan didapat 92,348 oC. Kenaikan titik didih larutan air 50 mL + gula 0,5 gr pada percobaan didapat 91 oC, sedangkan pada perhitungan didapat 92,015 oC. Kenaikan titik didih larutan air 50 mL + gula 1 gr pada percobaan didapat 93 oC, sedangkan pada perhitungan didapat 92,030 oC. Kenaikan titik didih larutan air 50 mL + gula 1,5 gr pada percobaan didapat 91 oC, sedangkanpada perhitungan didapat 92,045 oC.
mL) seharusnya sama, tetapi pada waktu percobaan kami mendapatkan nilai yang berbeda. Selain itu, semakin banyak massa gula yang dilarutkan, seharusnya semakin tinggi pula titik didihnya. Namun, pada percobaan yang kami lakukan terjadi penurunan nilai kenaikan titik didih pada saat gula yang dilarutkan bermassa 1,5 gr setelah sebelumnya naik dari yang bermassa 0,5 gr ke 1 gr. Pada percobaan yang kami lakukan, nilai kenaikan titik didih larutan gula bermassa 1,5 gr sama dengan larutan gula bermassa 0,5 gr. Ketidaksesuaian hasil dengan teori ini disebabkan karena ketidaktelitian dan kelalaian yang dilakukan saat pelaksanaan percobaan misalnya kesalahan dalam membaca skala yang ditunjukkan oleh termometer, api dari spiritus yang tidak konstan dikarenakan spiritusnya akan habis, pemegangan termometer yang tidak konstan, serta suhu dipengaruhi oleh lingkungan seperti AC.
BAB V PENUTUP
A. Kesimpulan
Dari hasil percobaan “Kenaikan Titik Didih” dapat disimpulkan sebagai berikut:
titik didih, sedangkan pada jenis zat terlarut yang volatile tidak terjadi kenaikan titik didih.
2. Kenaikan titik didih dipengaruhi oleh konsentrasi larutan. Semakin besar konsentrasi larutan (molalitas), maka semakin besar kenaikan titik didih larutan.
3. Kenaikan titik didih dipengaruhi oleh jenis zat terlarut (elektrolit dan non elektrolit). Kenaikan titik didih larutan elektrolit lebih besar dari kenaikan titik didih larutan non elektrolit.
B. Saran
Adapun saran untuk percobaan “Kenaikan Titik Didih” adalah sebagai berikut:
1. Sebaiknya praktikan lebih teliti dalam membaca skala yang ditunjukkan oleh termometer.
2. Seharusnya sebelum memulai praktikum, dalam penggunaan pembakar spiritus hendaknya melihat jumlah spiritusnya apakah cukup atau tidak untuk semua percobaan, agar tidak terjadi perbedaan nyala api yang dihasilkan untuk setiap percobaan sehingga tidak mempengaruhi hasil percobaan.
3. Praktikan diharapkan dapat menjaga posisi termometer dalam keadaan konstan, karena pemegangan termometer yang tidah konstan mempengaruhi hasil percobaan.
4. Diusahakan jika berada dalam ruangan ber-AC, lakukan percobaan sejauh mungkin dengan sumber AC, agar meskipun suhunya terpengaruh tapi tetap seminimal mungkin.
DAFTAR PUSTAKA
Anonim. 2012. Kenaikan Titik Didih (Online). (http://berbagidiblog.blogspot.com/2012/12/kenaikan-titik-didih_4.html, diakses 14 Maret 2015).
Harnanto, Ari, Ruminten. 2009. Kimia 3: Untuk SMA/M Kelas XII. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Gambar 1.
Menimbang gula dengan neraca digital.
Gambar 2. Kaki tiga dan kasa.
Gambar 3.
Garam yang sudah ditimbang. Gula yang sudah ditimbang.Gambar 4.
Gambar 5. Gelas kimia 250 mL.
Gambar 6.
Gambar 7.
Memasukkan gula ke dalam gelas kimia.
Gambar 8.
Memanaskan air 50 mL dengan pembakar spiritus.
Gambar 9.
Memanaskan air 50 mL dan garam 1 gr dengan pembakar spiritus.
Gambar 10.
Memanaskan air 50 mL dan gula 0,5 gr dengan pembakar spiritus.
Gambar 11.
Memanaskan air 50 mL dan gula 1 gr dengan pembakar spiritus.
Gambar 12.
Gambar 13.
Lampiran Perhitungan
1. Pengaruh jenis zat terlarut terhadap kenaikan titik didih a. Air 50 mL
Tb = 92 oC
b. Air 50 mL + NaCl 1 gr
m =
=
= 0,34 m ΔTb = Kb . m . i
= 0,512 . 0,34 . 2 = 0,348
Tb = 92 + 0,348 = 92,348 oC c. Air 50 mL + Air 10 mL
Tb = 96 oC
2. Hubungan kosentrasi larutan dengan kenaikan titik didih a. Air 50 mL + Gula 0,5 gr
m =
=
= 0,029 m ΔTb = Kb . m
= 0,512 . 0,029 = 0,015
Tb = 92 + 0,015 = 92,015 oC b. Air 50 mL + Gula 1 gr
=
= 0,058 m ΔTb = Kb . m
= 0,512 . 0,058 = 0,03
Tb = 92 + 0,03 = 92,030 oC c. Air 50 mL + Gula 1,5 gr
m =
=
= 0,088 m ΔTb = Kb . m
= 0,512 . 0,088 = 0,045