Laporan Kenaikan Titik Didih dan Penurunan Titik Beku
Nama :
1. Cory’atul Khaira 2. Evi Anggun 3. Rizky Hutami
4. Siti Rachmayanti Sekartaji
XII IPA 2
Perum. Griya Asri 2 Blok F, Kec. Tambun Selatan
Kab. Bekasi 17519, Telp 021-98498943, 88369008
Website : www.sman4tamsel.sch.id
Tahun ajaran 2013/2014
a) Tujuan percobaan kenaikan titik didih :
Mengetahui titik didih pada larutan
Mengetahui pengaruh titik didih larutan setelah penambahan zat terlarut Mengetahui proses terjadinya kenaikan titik didih
b) Tujuan percobaan penurunan titik beku :
Mengetahui titik beku pada larutan
2. LANDASAN TEORI
2.1 Titik Didih
Pendidihan terjadi karena panas meningkatkan gerakan atau energi kinetik, dari molekul yang menyebabkan cairan berada pada titik di mana cairan itu menguap, tidak peduli berada di permukaan teratas atau di bagian terdalam cairan tersebut. Apabila sebuah larutan mempunyai tekanan uap yang tinggi pada suhu tertentu, maka molekul-molekul yang berada dalam larutan tersebut mudah untuk melepaskan diri dari permukaan larutan. Atau dapat dikatakan pada suhu yang sama sebuah larutan mempunyai tekanan uap yang rendah, maka molekul-molekul dalam larutan tersebut tidak dapat dengan mudah melepaskan diri dari larutan. Jadi larutan dengan tekanan uap yang lebih tinggi pada suhu tertentu akan memiliki titik didih yang lebih rendah.
Cairan akan mendidih ketika tekanan uapnya menjadi sama dengan tekanan udara luar. Titik didih cairan pada tekanan udara 760 mmHg disebut titik didih standar atau titik didih normal. Jadi yang dimaksud dengan titik didih adalah suhu pada saat tekanan uap jenuh cairan itu sama dengan tekanan udara luar (tekanan pada permukaan cairan). Tekanan uap larutan lebih rendah dari tekanan uap pelarutnya.Hal ini disebabkan karena zat terlarut itu mengurangi bagian atau fraksi dari pelarut sehingga kecepatan penguapan berkurang.
Titik didih suatu larutan dapat lebih tinggi ataupun lebih rendah dari titik didih pelarut, bergantung pada kemudahan zat terlarut tersebut menguap. Selisih titik didih larutan dengan titik didih pelarut disebut kenaikan titik didih ( ΔTb ).
Telah dijelaskan di depan bahwa tekanan uap larutan lebih rendah dari tekanan uap pelarutnya. Hal ini disebabkan karena zat terlarut itu mengurangi bagian atau fraksi dari pelarut sehingga kecepatan penguapan berkurang.
mendidih pada tekanan 1 atm. Dari gambar di atas dapat dilihat bahwa titik didih larutan (titik G) lebih tinggi daripada titik didih air (titik D).
Oleh karena tekanan uap larutan zat non volatil lebih rendah dari pelarut murninya maka untuk mendidihkan larutan perlu energi lebih dibandingkan mendidihkan pelarut murninya. Akibatnya, titik didih larutan akan lebih tinggi daripada pelarut murninya.
Besarnya kenaikan titik didih larutan, ΔTd (relatif terhadap titik didih pelarut murni) berbanding lurus dengan kemolalan larutan. Dalam bentuk persamaan dinyatakan dengan: ∆Tb ≈ m, atau ;
ΔTb = Kb x m
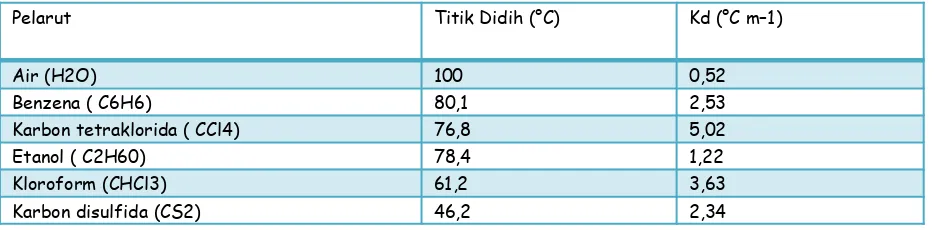
Kb adalah tetapan kesetaraan titik didih molal. Harga Kb bergantung pada jenis pelarut (Tabel 1).
Tabel 1. Tetapan Kenaikan Titik Didih Molal (Kb) Beberapa Pelarut
Pelarut Titik Didih (°C) Kd (°C m–1)
Air (H2O) 100 0,52
Benzena ( C6H6) 80,1 2,53
Karbon tetraklorida ( CCl4) 76,8 5,02
Etanol ( C2H60) 78,4 1,22
Kloroform (CHCl3) 61,2 3,63
Karbon disulfida (CS2) 46,2 2,34
Menurut hukum Raoult, besarnya kenaikan titik didih larutan sebanding dengan hasil kali dari molalitas larutan (m) dengan kenaikan titik didih molal (Kb).Oleh karena itu, kenaikan titik didih dapat dirumuskan seperti berikut.
Keterangan:
ΔTb = kenaikan titik didih molal Td = Titik didih larutan Kb = tetapan kenaikan titik didih molal m = molalitas
ΔTb =Kb x m
2.2 Titik Beku
Penambahan zat terlarut non volatil juga dapat menyebabkan penurunan titik beku larutan. Gejala ini terjadi karena zat terlarut tidak larut dalam fase padat pelarutnya. Contohnya, jika sirup dimasukkan ke dalam freezer maka gula pasirnya akan terpisah dari es karena gula pasir tidak larut dalam es. Agar tidak terjadi pemisahan zat terlarut dan pelarutnya ketika larutan membeku, diperlukan suhu lebih rendah lagi untuk mengubah seluruh larutan menjadi fasa padatnya. Seperti halnya titik didih, penurunan titik beku (ΔTf) berbanding lurus dengan kemolalan larutan :
ΔTf = Penurunan titik beku
Atau Kf =Tetapan kenaikan titik beku
m = Molalitas
Kf disebut tetapan penurunan titik beku molal. Nilai Kf untuk benzena 5,12 °C m–1. Suatu larutan dari zat terlarut non volatil dalam pelarut benzena sebanyak 1 molal akan membeku pada suhu lebih rendah sebesar 5,12 °C dari titik beku benzena. Dengan kata lain, titik beku larutan zat non volatil dalam pelarut benzena sebanyak 1 molal akan mulai membeku pada suhu (5,5 – 5,12) °C atau 0,38 °C.
Penerapan dari penurunan titik beku digunakan di negara yang memiliki musim dingin.Suhu udara pada musim dingin dapat mencapai suhu di bawah titik beku air.Oleh karena itu, dalam air radiator mobil diperlukan zat antibeku yang dapat menurunkan titik beku air.Zat antibeku yang banyak digunakan dalam radiator adalah etilen glikol (C2H6O2).
Selain pada radiator, penerapan dari penurunan titik beku juga digunakan untuk mencairkan es di jalan-jalan dan trotoar pada musim dingin. Hal ini dilakukan dengan cara menaburkan garam-garam, seperti CaCl2 dan NaCl sebagai penurun titik beku air sehingga es dapat mencair.
Contoh Soal Menghitung Penurunan Titik Beku Larutan :
Hitunglah titik beku larutan yang dibuat dari 6,2 g etilen glikol dalam 100 g air.
Jawaban :
molalitas larutan = = 1 m
Penurunan titik beku larutan :
ΔTf = Kf x m = (1,86 °C m–1) ( 1 m) = 1,86 °C
Titik beku larutan = Titik beku normal air – ΔTf = (0,0 – 1,86) °C = –1,86 °C
Jadi, titik beku larutan etilen glikol adalah –1,86 °C
ΔTf = Kf x m
Tf = 0°C - ΔTf
Sama seperti kenaikan titik didih, penurunan titik beku larutan dapat digunakan untuk menentukan massa molekul relatif zat terlarut.
Mr zat terlarut = Kf
Contoh Soal Menghitung Mr dari Data ΔTf :
Suatu larutan dibuat dengan cara melarutkan 3 g zat X ke dalam 100 mL air. Jika titik beku larutan – 0,45 °C, berapakah massa molekul relatif zat X?
Penyelesaian :
Nilai Kf air = 1,86 °C m–1.
ΔTf = {0 – (– 0,45)}°C = 0,45°C
Mr X = 1,86 °C m–1 x = 124
Jadi, Mr zat X adalah 124.
Contoh :
Natrium hidroksida 1,6 gram dilarutkan dalam 500 gram air. Hitung titik didih larutan tersebut!
(Kb air = 0,52 °Cm-1, Ar Na = 23, Ar O = 16, Ar H = 1)
3. ALAT DAN BAHAN
a) Alat dan bahan kenaikan titik didih :
Termometer Neraca
Gelas ukur 1000 mL
Pengaduk Teko listrik Aquades 2250 mL KCl 10 gram NaCl 10 gram
b) Alat dan bahan penurunan titik beku :
Termometer Neraca
Gelas ukur 1000 mL
4. LANGKAH-LANGKAH PERCOBAAN
Langkah percobaan kenaikan titik didih :
Masukkan aquades 750 mL ke dalam gelas kimia 1000 mL dan panaskan dengan teko listrik
hingga mendidih yang ditandai dengan munculnya gelembung-gelembung udara
Catatlah titik didihnya
Masukkan aquades 750 mL ke dalam gelas kimia 1000 mL, tambahkan 10 gram KCl
kemudian aduk hingga rata dan panaskan dengan teko listrik hingga mendidih yang ditandai dengan munculnya gelembung-gelembung udara
Catatlah titik didihnya dan kenaikan titik didihnya
Masukkan aquades 750 mL ke dalam gelas kimia 1000 mL, tambahkan 10 gram NaCl kemudian aduk hingga rata dan panaskan dengan teko listrik hingga mendidih yang ditandai dengan munculnya gelembung-gelembung udara
Catatlah titik didihnya dan kenaikan titik didihnya
Langkah percobaan penurunan titik beku :
Masukkan aquades 500 mL ke dalam gelas kimia 1000 mL dan bekukan dengan cara
dimasukkan kedalam lemari es
Catatlah titik bekunya
Masukkan aquades 500 mL ke dalam gelas kimia 1000 mL, tambahkan 10 gram KCl kemudian
aduk hingga rata dan bekukan dengan cara dimasukkan kedalam lemari es
Catatlah titik bekunya dan penurunan titik bekunya
Masukkan aquades 500 mL ke dalam gelas kimia 1000 mL, tambahkan 10 gram NaCl kemudian aduk hingga rata dan bekukan dengan cara dimasukkan kedalam lemari es
5. TABEL PENGAMATAN
5.1 Tabel Pengamatan Kenaikan Titik Didih
a) Tuliskan tujuan praktikum hari ini Jawab :
Mengetahui pengaruh titik didih larutan setelah penambahan zat terlarut Mengetahui proses terjadinya kenaikan titik didih
b) Isilah tabel data pengamatan di bawah ini Jawab :
No Larutan Titik Didih Kenaikan Titik Didih
1 Aquades 96°C 0
2 KCl 99°C 3°C
3 NaCl 99°C 3°C
c) Berdasarkan tabel data tersebut, buatlah grafik dengan larutan di sumbu X dan titik didih di sumbu Y
Aquades
Larutan KCl
Larutan NaCl
0
d) Berdasarkan hasil percobaan berapakah titik didih aquades? Apakah sama dengan 100°C ? Jika tidak sama, menurut kalian apa penyebabnya ?
Jawab :
e) Kenapa titik didih aquades tidak sama dengan titik didih larutan yang lain ? Jawab :
Karena terjadinya penambahan energy, tidak hanya menambahkan suhu air, namun juga untuk meningkatkan suhu senyawa. Itu terjadinya karena tercampurnya zat pelarut dan zat terlarut tidak hanya mengubah sifat kimia tapi juga sifat fisika.
f) Manakah larutan yang memiliki titik didih tertinggi ? Menurut kalian apa penyebabnya ? Jawab :
KCl dan NaCl. Sama-sama memiliki 99°C. Karena adanya zat terlarut didalamnya. Hal ini dikarenakan larutan KCl dan NaCl memiliki partikel lebih banyak sehingga menghambat penguapan. Oleh karena penguapan terlambat maka energy yang dibutuhkan untuk menguap lebih banyak, begitu juga titik didihnya makin tinggi.
g) Tuliskan manfaat percobaan hari ini menurut kalian Jawab :
5.2 Tabel Penurunan Titik Beku
a) Tuliskan tujuan praktikum hari ini Jawab :
Mengetahui titik beku pada larutan
Mengetahui penurunan titik beku pada larutan
b) Isilah tabel data pengamatan di bawah ini Jawab :
No Larutan Titik Didih Kenaikan Titik Didih
1 Aquades 0°C 0
2 KCl -3°C 3°C
3 NaCl -3°C 3°C
c) Berdasarkan tabel data tersebut, buatlah grafik dengan larutan di sumbu X dan titik didih di sumbu Y
Aquades
Larutan KCl
Larutan NaCl
Category 4
-5
d) Berdasarkan hasil percobaan berapakah titik beku aquades? Apakah sama dengan 0°C ? Jika tidak sama, menurut kalian apa penyebabnya ?
Jawab :
Titik beku aquades 0˚C
e) Apakah titik beku aquades sama dengan titik beku larutan yang lain? Beri penjelasan hasil pengukuran kalian.
Jawab :
f) Manakah larutan yang memiliki titik beku tertinggi ? Menurut kalian apa penyebabnya ? Jawab :
Larutan KCl dan NaCl. Karena dikedua larutan tersebut terdapat penambahan senyawa sehingga titik beku larutan KCl dan NaCl lebih rendah. Ini dikarenakan adanya perubahan larutan KCl dan NaCl. Baik perubahan kimia maupun fisika.
g) Tuliskan manfaat percobaan hari ini menurut kalian Jawab :
6. HASIL PEMBAHASAN
6.1. Hasil Pembahasan Titik Didih
Dari hasil percobaan kenaikan titik didih, aquades tidak memiliki titik didih 100˚C melainkan 96˚C. Hal ini dikarenakan terpengaruhnya tekanan udaranya. Titik didih aquades lebih rendah dibandingkan dengan titik didih larutan KCl dan NaCl, hal ini disebabkan penambahan energi yang terkandung dalam KCl dan NaCl. Partikel yang lebih banyak itulah yang membuat terhambatnya penguapan. Oleh karena penguapan yang terlambat maka energy yang dibutuhkan untuk menguap lebih banyak, begitu juga titik didihnya. Makanya larutan dengan titik didih tertinggi adalah larutan KCl dan NaCl dengan titik didih 99˚C
6.2 Hasil Pembahasan Titik Beku
Dari hasil percobaan penurunan titik beku, aquades memiliki titik beku 0˚C. Sedangkan larutan KCl dan NaCl memiliki titik beku -3˚C. Larutan KCl dan NaCl memiliki titik didih tertinggi, dan itu berlaku untuk penurunan titik bekunya. Dapat disimpulkan bahwa larutan KCl dan NaCl memiliki titik beku terendah.
Percobaan kenaikan titik didih
1.Pengertian titik didih
Titik didih suatu cairan ialah suhu pada saat tekanan uap jenuh cairan itu sama dengan tekanan luar. Titik didih suatu cairan bergantung pada tekanan luar. Penurunan tekanan uap suatu cairan akibat adanya zat terlarut membawa konsekuensi bagi titik didih cairan tersebut. Pada setiap suhu, suatu larutan memiliki tekanan uap yang lebih rendah daripada pelarut murninya, akibatnya suatu larutan akan memiliki titik didih yang lebih tinggi dari pelarut murninya karena energi diperlukan lebih benyak untuk dapat menyamakan tekanan uap larutan dengan tekanan udara luar, energi yang lebih tinggi didapat dari suhu yang dinaikkan.
2.Faktor yang mempengaruhi dalam titik didih
Hasil eksperimen Roult menunjukan bahwa Kenaikan titik didih larutan akan semakin besar apabila konsentrasi (molal) dari zat terlarut semakin besar. Titik didih larutan akan lebih tinggi dari titik didih pelarut murni. Hal ini juga diikuti dengan penurunan titik beku pelarut murni, atau titik beku larutan lebih kecil dibandingkan titik beku pelarutnya. Roult menyederhanakan ke dalam persamaan berikut ini :
Keterangan :
Tb = kenaikan titik didih larutan
Kb = tetapan kenaikan titik diBVGVGDCZKdih molal pelarut (kenaikan titik didih untuk 1 mol zat dalam 1000 gram pelarut)
m = molal larutan (mol/100 gram pelarut)
Perubahan titik didih atau ΔTb merupakan selisih dari titik didih larutan dengan titik didih pelarutnya, seperti persamaan berikut ini :
Hal yang berpengaruh pada kenaikan titik didih adalah harga kb dari zat pelarut. Kenaikan tidak dipengaruhi oleh jenis zat yang terlarut, tapi oleh jumlah partikel/mol terlarut khususnya yang terkait dengan proses ionisasinya. Untuk zat terlarut yang bersifat elektrolit persamaan untuk kenaikan titik didik harus dikalikan dengan faktor ionisasi larutan, sehingga persamaannya menjadi :
Keterangan :
n = jumlah ion-ion dalam larutan α = derajat ionisasi (Anonim, 2011)
Percobaan penurunan titik beku
Tb =kb.m
Tb = Tb -
Tb˚
1.Pengertian titik beku
Titik beku suatu zat merupakan suhu di mana wujud padat dan wujud cair
berada dalam kesetimbangan termal. Pada titik beku, benda sedang mengalami
perubahan wujud dari cair ke padat atau dari padat ke cair dan selama
perubahan wujud, suhu benda selalu tetap.
2.Faktor-faktor titik beku
Agar tidak terjadi pemisahan zat terlarut dan pelarutnya ketika larutan membeku, diperlukan suhu lebih rendah lagi untuk mengubah seluruh larutan menjadi fasa padatnya. Seperti halnya titik didih, penurunan titik beku (ΔTf) berbanding lurus dengan kemolalan larutan :
Keterangan :
ΔTf = Penurunan titik beku
Kf =Tetapan kenaikan titik beku
m = Molalitas
Perubahan titik beku atau ΔTf merupakan selisih dari titik beku pelarut dengan titik beku larutan, seperti persamaan :
Hal yang berpengaruh pada penurunan titik beku adalah harga kf dari zat pelarut. Penurunan tidak dipengaruhi oleh jenis zat yang terlarut, tapi oleh jumlah partikel/mol terlarut khususnya yang terkait dengan proses ionisasinya. Untuk zat terlarut yang bersifat elektrolit persamaan untuk penurunan titik beku harus dikalikan dengan faktor ionisasi larutan, sehingga persamaannya menjadi :
Keterangan :
n = jumlah ion-ion dalam larutan α = derajat ionisasi (Anonim, 2011)
8. Kesimpulan
ΔTf = Kf x m
Tf = 0°C - ΔTf
ΔTf = Tf˚ - Tf
Titik didih adalah suhu saat tekanan uap jenuh cairan sama dengan tekanan udara luar.Kenaikan titik didih adalah selisih titik didih larutan dnegan titik didih pelarut. Faktor yang mempengaruhi kenaikan titik didih adalah konsentrasi (molalitas) dan harga Kb. Semakin tinggi konsentrasi, kenaikan titik didih larutan semakin tinggi. Semakin tinggi harga Kb, kenaikan titik didih laruta semakin tinggi.Kenaikan titik didih tidak dipengaruhi oleh jenis zat ang terlarut.Titik didih larutan KCl dan NaCl 3 gram lebih tinggi daripada titik didih pelarut murni (air).Gula, gliserol, CMC, garam, dan dextrose tidak mempengaruhi kenaikan titik didih larutan, yang mempengaruhi adalah knsentrasi masing-masing bahan.Terjadinya penyimpangan dapat menyebabkan perbedaan hasil dengan literature.
Dari uraian diatas, dapat disimpulkan beberapa hal, sebagai berikut:Yang pertama adalah bahwa penambahan zat terlarut pada suatu pelarut murni akanmenyebabkan turunnya suhu titik beku dari pelarut murni tersebut ( Larutan akanmemiliki titik beku lebih rendah dibandingkan titik beku pelarut murni ). Semakin banyak waktu yang diberikan maka semakin rendah titik beku yang dihasilkan. Dari penelitian yang kami telah lakukan, kami dapat menyimpulkan beberapa hal sebagai berikut :
Proses terjadinya penurunan titik beku dikarenakan adanya perubahan dari tekanan uap, biasanya diakibatkan oleh masuknya suatu zat terlarut lain maka titik bekunya akan berubah (nilai titik beku akan berkurang);
Keadaan titik beku pelarut murni setelah dicampur zat terlarut akan menjadi lebih rendah dibawah titik beku pelarut murni yang semula yaitu dibawah 0oC, zat terlarut akan berpengaruh
pada penurunan titik beku larutan karena pada suatu pelarut murni, zat terlarut akan menyebabkan turunnya suhu titik beku dari pelarut murni tersebut.
Garam dapur berfungsi sebagai zat yang menurunkan titik beku es batu sehingga es batu tidak akan membeku pada suhu 0oC, sehingga ketika sebuah tabung reaksi diletakkan didalam gelas
kimia, akan terbentuk sebuah sistem antara larutan es batu yang suhunya 0oC
(l) dengan larutan uji