LAPORAN PRAKTIKUM KIMIA FISIK II PENENTUAN TITIK BEKU LARUTAN
Nama : Rizka Fithriani Safira Sukma
NIM : 131810301049
Kelompok : 5
Fakultas/ jurusan : MIPA / Kimia
Asisten : Putri Zakiyatul Fadhilah
LABORATORIUM KIMIA FISIKA JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
BAB 1. PENDAHULUAN
1.1 Latar Belakang
Sifat-sifat koligatif larutan ialah sifat-sifat yang hanya ditentukan oleh jumlah partikel dalam larutan dan tidak tergantung jenis partikelnya. Titik beku larutan ialah temperatur pada saat larutan setimbang dengan pelarut padatannya. Larutan akan membeku pada temperatur lebih rendah dari pelarutnya. Tujuan dari dilakukan praktikum ini adalah menentukan besarnya tetapan penurunan titik beku asam asetat dan menentukan berat molekul suatu zat non elektrolit. Praktikum ini dilakukan dengan cara mengukur suhu titik beku larutan.
Percobaan penurunan titik beku pelarut asam asetat terhadap natrium asetat bertujuan untuk mengetahui pengaruh adanya zat terlarut nonvolatile terhadap penurunan titik beku pelarut. Selain itu, percobaan ini juga digunakan untuk menentukan besarnya Berat Molekul zat terlarut. Metode yang digunakan adalah metode dengan variasi waktu dan massa. Titik beku suatu cairan akan berubah jika tekanan uap berubah, biasanya diakibatkan oleh masuknya suatu zat terlarut atau dengan kata lain, jika cairan tersebut tidak murni, maka titik bekunya berubah (nilai titik beku akan berkurang).
Seperti yang kita tahu bahwa titik beku pelarut murni berada pada suhu 0oC, tapi dengan adanya zat terlarut misalnya saja kita tambahkan gula ke dalam air tersebut maka titik beku larutan ini tidak akan sama dengan 0oC lagi, melainkan akan turun menjadi dibawah 0oC, dan inilah yang dimaksud sebagai “Penurunan Titik Beku”.
1.2 Tujuan
Tujuan dari percobaan ini diantarnya adalah:
a. Menentukan tetapan penurunan titik beku molal pelarut
BAB 2. TINJAUAN PUSTAKA
2.1 Material Safety Data Sheet (MSDS)
2.1.1 Naftalen
Naftalen juga dikenal sebagai naftalen, tar kapur, tar putih, albokarbon, atau naftene. Sifat fisik naftalen : rumus kimia C10H8, massa molar 128,17 g/mol, massa jenis 1.14 gcm-3, tidak dapat larut dalam air, alkohol, larut dalam eter dan benzen, titik cair 80,5°C, titik didih 128,17 g/mol, Berwarna putih kristal dan memiliki bau yang kuat. Naftalen mudah menguap dan mudah terbakar. Naftalen merupakan hidrokarbon padat berwarna putih, yang diperoleh dari penyulingan fraksional batu bara. Naftalen sebagian besar diproduksi sebagai bahan baku pembuatan resin alkil untuk pembuatan plastik, seain itu digunakan untuk zat warna dan bahan kimia lain. Penggunaan langsung adalah sebagai pengusir ngengat. Kontak langsung dengan mata dapat ditangani dengan membasuh mata dengan air mengalir dan mata tebuka terus menerus dalam waktu 15 menit. Kontak pada kulit dapat segera dibasuh dengan air dingin sekurang-kurangnya 15 menit (Anonim, 2015).
2.1.2 Asam Asetat
Asam asetat atau C2H4O2 atau biasanya CH3COOH. Bahan ini bersifat iritan, permeator dan korosif terhadap kulit dan mata pada konsentrasi yang tinggi. Bahan ini juga berbahaya jika terkena kulit dan mata secara terus-menerus. Bahan ini tidak bersifat mutagenic atau karsinogenik. Asam asetat biasanya berwujud cair, berbau dan berasa cuka sangat kuat dan tajam serta tidak berwarna. Massa molekul relatifnya adalah 60,05 g/mol dengan titik didih 181,1oC dan titik leleh 16,6oC. Penyimpanan ditempat yang sejuk dan jauh dari api (Anonim, 2015).
O
OH
C
H
3
Gambar 2.1 Struktur Asam Asetat 2.1.3 NaCl
laut dan cairan ekstraseluler pada banyak organisme multiseluler. Massa molar 58.44 g/mol, tidak berwarna/berbentuk kristal putih, densitas 2.16 g/cm3 ,titik leleh 801°C (1074 K), titik didih 1465°C (1738 K), kelarutan dalam air 35.9 g/100 mL (25°C). Larutan ini berbahaya pada kontak mata dan kulit. Kontak langsung dengan mata dapat ditangani dengan membasuh mata dengan air mengalir dan mata tebuka terus menerus dalam waktu 15 menit. Pertolongan pada kontak kulit dapat segera dibasuh dengan air dingin sekurang-kurangnya 15 menit. Pakaian atau sepatu yang terkena harus dikeluarkan dan dibersihkan sebelum digunakan kembali. Terkena kulit segera basuh dengan air selama 15 menit (Anonim, 2015).
2.1.4 Akuades
Akuades atau air mempunyai rumus kimia H2O. Air tidak bersifat korosif, iritasi, permeator atupun sensitif untuk mata, kulit atau menelan. Akuades juga tidak berbahaya jika terhirup. Akuades tidak memiliki efek karsinogenik dan mutagenic. Bahan ini tidak mudah terbakar ataupun meledak. Akuades merupakan senyawa netral yang memiliki pH 7, tidak berbau dan tidak berwarna serta tidak berasa. Air mempunyai titik didih 100oC dan merupakan senyawa yang stabil (Anonim, 2015).
Gambar 2.2 Struktur Air 2.2 Dasar Teori
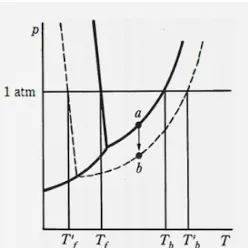
Menurut Sukardjo (2004) sifat koligatif larutan merupakan sifat-sifat yang hanya ditentukan oleh jumlah partikel dalam larutan dan tidak tergantung jenis partikelnya. Zat terlarut tertentu jika ditambahkan kedalam suatu pelarut akan menimbukan perubahan fisik pelarut tersebut besarnya sebanding dengan molalitas zat terlarut yang ditambahkan, sifat fisik tersebut bisa berupa penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmosis. Perbedaan antara sifat fisik dari pelarut dan larutan pada penurunan titik beku larutan dapat dilihat pada gambar 1.
O
Gambar 2.3 Perbedaan sifat fisik pelarut dan larutan
Gambar 1 memperlihatkan diagram fasa larutan yang mengalami pergeseran yang menyebabkan terjadinya perbedaan dengan diagram fasa pelarut murninya. Larutan akan membeku jika temperatur larutan tersebut lebuh rendah dari titik beku larutan murninya, selisih antara titik beku larutan dengan titik beku larutan murninya disebut juga penurunan titik beku (ΔTf). Zat terlarut jika merupakan zat non elektrolit, maka penurunan titik bekunya sebanding dengan molalitas larutan (m). Penambahan zat terlarut tertentu pada suatu pelarut akan mempengaruhi dari sifat koligatif lainnya karena keempat sifat koligatif tersebut saling berkaitan. Titik beku adalah temperatur dimana fasa cair dari suatu larutan setimbang dengan pelarut padatnya. Larutan mempunyai titik beku yang lebih rendah daripada titik beku pelarutnya atau disebut juga dengan (ΔTf), alat yang digunakan untuk mengukur titik beku lautan adalah Beckman (Sukardjo, 2004).
Suhu pada perpotongan garis tekanan tetap pada 1 atm dengan kurva peleburan disebut titik beku. Titik didih adalah suhu perpotongan garis tekanan tetap pada 1 atm dengan kurva penguapan. Penurunan titik beku dan peningkatan titik didih, sama halnya seperti penurunan tekanan uap yang sebanding dengan konsentrasi fraksi molnya (Petruci, 1987).
Pembentukan suatu larutan tidak menimbulkan pengaruh terhadap sifat-sifat kimia zat-zat penyusun larutan tersebut. Air suling (air murni) dan air sumur memperlihatkan reaksi yang sama saja, misalnya direaksikan dengan logam natrium, tetapi sifat-sifat fisis suatu zat yang sering berubah tatkala zat itu menjadi komponen larutan. Pada suhu 20oC air murni pasti membeku, sedangkan air yang dicampur dengan etilen glikol (zat anti beku, “antifreeze” untuk radiator kendaraan) akan tetap cair pada suhu rendah itu (Anshory, 1994).
melainkan akan menjadi lebih rendah di bawah 0oC itulah penyebab terjadinya penurunan titik beku yaitu oleh masuknya suatu zat terlarut atau dengan kata lain cairan tersebut menjadi tidak murni, maka akibatnya titik bekunya berubah (nilai titik beku akan berkurang) (Taufik, 2012).
Larutan dalam senyawa kimia diartikan sebagai suatu campuran homogen yang terdispersi pada spesies kimia dalam skala molekular. Larutan biner merupakan larutan yang terdiri atas dua unsur, sedangkan larutan tersier (terner) merupakan larutan yang terdiri atas tiga unsur, dan kuartener terdiri atas empat unsur. Larutan mempunyai fase yang berbeda-beda. Larutan dapat berupa gas, cairan, atau padatan. Fase ini mempengaruhi sifat dari zat tersebut. Salah satunya sifat koligatif larutan. Ada dua sifat-sifat larutan. Pertama, sifat larutan yang ditentukan dari jenis dan kepekatan (konsentrasi) zat terlarut. Kedua, sifat larutan yang hanya tergantung pada konsentrasi zat terlarut saja tidak tergantung pada jenis larutan. Sifat yang seperti ini disebut sifat koligatif larutan (Purba, 1987).
Suatu zat terlarut yang nonvolatile akan menurunkan titik beku zat pelarutnya. Hal tersebut terjadi karena zat terlarut bersifat sukar menguap, maka pada suhu 0oC ternyata belum membeku dan tekanan permukaannya lebih kecil dari 1 atm, sehingga larutan harus dibekukan pada tekanan 1 atm dengan menurunkan suhu larutan. Penurunan titik beku larutan dari titik beku pelarutnya disebut penurunan titik beku (Dogra, 1894).
Titik beku dan titik didih larutan tergantung pada kesetimbangan pelarut yang berada dalam larutan dengan pelarut padatan atau uap pelarut murni. Kesetimbangan yang lainnya adalah antara pelarut dalam larutan dengan pelarut murni. Pada saat kesetimbangan itu terjadi, maka pula titik beku maupun titik didihnya tercapai (Wahyuni, 2013).
Setiap pelarut memiliki harga tetapan Kf tertentu. Tetapan Kf ini menyatakan besarnya penurunan titik beku larutan 1 molal. Asam asetat ini memeiliki harga Kf sebesar 3,9 sedangkan titik bekunya 16,7°C (pada tekanan 1 atm) (Sachri dan Harun, 1982).
Tetapan Kf hanya bergantung pada jenis besarnya penurunan titik beku untuk larutan 1 molal. Pada umumnya efek enurunan titik beku akan lebih besar daripada efek kenaikan titik didih atau penurunan tekanan uap. Penurunan titik beku relatif lebih banyak digunakan dalam penentuan berat molekul (Jupamahu, 1980).
………..(1)
Harga Kf dapat diperoleh dari praktikum yang dilakukan yaitu dengan mengukur besarnya penurunan titik beku pada bagian penambahan konsentasi zat yang larut. Penurunan titik beku tergantung pada konsentrasi dari zat terlarut didalamnya. Semakin turun titik beku larutan banyak partikel dalam larutan maka titik bekunya semakin rendah sehingga perubahannya sebanding dengan perubahan konsentrasi dari larutan setelah mengalami penambahan zat terlarutnya. Zat terlarut juga dapat mempengaruhi titik beku suatu larutan selain jumlah partikel, (Harnanto, 2009).
Air murni pada tekanan 1 atm membeku pada temperatur 0°C. Besarnya penurunan titik beku suatu larutan hanya ditentukan oleh jumlah partikel zat terlarut. Semakin banyak partikel yang terdapat dalam zat terlarut maka semakin besar pula titik beku suatu larutan (Anshory,1994).
Perubahan temperatur berbanding lurus dengan perubahan titik beku untuk konsentrasi zat terlarut, penurunan tittik beku berkaitan dengan besarnya molalitas total dari zat yang terlarut. Semakin besar molalitas total zat terlarut, maka semakin besar pula penurunan titik beku larutannya. Hal ini sesuai dengan Hukum Roult (Reis,1999).
Proses pembekuan suatu zat cair terjadi bila suhu diturunkan, sehingga jarak antarpartikel sedemikian dekat satu sama lain dan akhirnya bekerja gaya tarik menarik antarmolekul yang sangat kuat. Adanya partikel-partikel dari zat terlarut akan mengakibatkan proses pergerakan molekul-molekul pelarut terhalang, akibatnya untuk dapat lebih mendekatkan jarak antarmolekul diperlukan suhu yang lebih rendah. Jadi titik beku larutan akan lebih rendah daripada titik beku pelarut murninya. Perbedaan titik beku akibat adanya partikel-partikel zat terlarut disebut penurunan titik beku (∆Tf). Penurunan titik beku larutan sebanding dengan hasil kali molalitas larutan dengan tetapan penurunan titik beku pelarut (Kf), dinyatakan dengan persamaan :
∆Tf = Kf m atau ∆Tf = Kf (n x 1000/p)………(2)
Dimana :
∆Tf = penurunan titik beku
Kf = tetapan penurunan titik beku molal n = jumlah mol zat terlarut
p = massa pelarut
Akuades
BAB 3. METODE PERCOBAAN
3.1 Alat dan Bahan 3.1.1 Alat
- Pengaduk
- Gelas beker 100 cc - Gelas beker - Pipet volume 3.1.2 Bahan
- Asam cuka glasial - Aquades
- Es - Garam - Naftalen - Zat x
3.2 Prosedur Kerja 3.2.1 Persiapan
- diisi tabung gelas E dengan campuran air, es dan garam secukupnya. - diisi tabung D dengan air secukupnya.
- diambil pelarut sebanyak 20 ml dan dimasukan ke dalam tabung gelas B (pelarut yang dipakai asam cuka glasial).
CH3COOH
Zat X
3.2.2 Penentuan tetapan penurunan titik beku molal .
- dimasukkan 20 ml bahan ke dalam tabung B sambil didinginkan, - dicatat suhu pada termometer A tiap-tiap menit. Jika suhu sudah
kelihatan tetap maka amati pelarut, sudah membeku atau belum. - diulangi percobaan tahap A dan B sekali lagi dan tentukan titik beku
pelarut murni Tof.
- dibiarkan Pelarut mencair kembali, kemudian dimasukan naftalen sebanyak 1 gram (Bm=128) sebagai zat pelarut.
3.2.3 Penentuan Berat Molekul Zat X
- ditambahkan 2 gram zat x ke dalam Larutan dari percobaan 3.2.2 - dibiarkan mencair kembali
- diamati Tf nya dan diperhitungkan Tf nya
- dihitung BM zat X
BAB 4. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Penentuan Tetapan Penurunan Titik Beku Asam Cuka Glasial a. Penentuan Titik Beku Asam Cuka (Tof).
Pengukuran Hasil
Volume asam cuka glasial 20 mL
Berat jenis asam cuka 1,049 g/mL
Titik beku asam cuka (Tof) 15 oC
b. Penentuan Titik Beku Larutan + Naftalen (Bm= 128) (Tf).
Pengukuran Hasil
Berat naftalen 1 gram
Titik beku pelarut setelah ditambah naftalren (Tf) 14,5 K Penurunan titik beku larutan naftalen (ΔTf) 0,5 K
4.1.2 Penentuan Berat Molekul zat x (NaCl)
Pengukuran Hasil
Volume asam cuka glasial 20 mL
Berat zat X (W1) 2 gram
Titik beku pelarut setelah ditambah zat X 11oC Penurunan titik beku larutan zat X 4 K
4.1.3 Tetapan Penurunan Titik Beku Molar Pelarut (Kf) dan Berat Molekul Zat X (Kf) larutan (asam cuka+ naftalen+ zat X) Berat Molekul Zat X
4.2 Pembahasan
Titik beku adalah temperatur tetap dimana suatu zat tepat mengalami perubahan wujud dari cair ke padat. Setiap zat yang mengalami pembekuan memiliki tekanan 1 atm. Keberadaan partikel-partikel zat pelarut mengalami proses pengaturan molekul-molekul dalam pembentukan susunan kristal padat, sehingga diperlukan suhu yang lebih rendah untuk mencapai susunan kristal padat dari fasa cairnya. Hal ini lah yang menyebabkan terjadinya penurunan titik beku suatu larutan yang keadaannya ditambahkan zat terlarut. Faktor- faktor yang mempengaruhi kelarutan diantaranya tekanan, temperatur, dan luas penampang. Semakin tinggi tekanan dan temperatur maka semakin cepat suatu larutan untuk bereaksi.
0 50 100 150 200 250 300 350 400 450 500 mencair kembali sebelum diulang. Hasil pengulangan tidak memberikan banyak perbedaan untuk asam asetat, hanya saja seperti terlihat pada kurva di atas, percobaan pertama lebih linear dari pengulangannya dilihat dari nilai R2.
hasil percobaan. Berikut hasil plot grafik dari asam cuka yang telah ditambah naftalen
Hasil plotting grafik dari penambahan naftalen juga lebih baik daripada pengukuran asam cuka. Kurva yang dihasilkan lebih linear dan nilainya semakin turun sesuai dengan yang ada di literatur. Penambahan naftalen juga diukur dengan pengulangan dengan metode yang sama seperti pada pengukuran asam asetat yang sebelumnya. Pengukuran titik beku asam aseta dan naftalen akan menghasilkan ∆Tf yang kemudian akan digunakan untuk menghitung harga Kf. Nilai Kf yang diperoleh selanjutnya akan digunakan untuk menghitung berat molekul zat X.
berubah (berkurang). Perbedaan titik beku akibat adanya partikel-partikel zat terlarut disebut penurunan titik beku (∆Tf). Penurunan titik beku larutan sebanding dengan hasil kali molalitas larutan dengan tetapan penurunan titik beku pelarut (Kf). Larutan yang mengandung zat terlarut tak volatil dapat menurunkan titik beku pelarut. Semakin tinggi konsentrasi zat terlarut yang ditambahkan dalam suatu larutan maka semakin besar pula penurunan titik bekunya.
Selanjutnya, asam asetat dan naftalen tersebut dicairkan kembali untuk digunakan dalam pengukuran berat molekul zat X. zat X yang digunakan pada praktikum kali ini adalah NaCl Kristal. Asam asetat + naftalen yang sudah mencair ditambah dengan NaCl sebanyak 2 gram dan dilarutkan sampai benar-benar homogen. Larutan yang sudah homogeny kemudian ukur kembali titik bekunya seperti pada prosedur sebelumnya. Titik beku rat-rata yang diperoleh pada zat X ini adalah 11oC. Berikut adalah grafik yang dihasilkan dari penambahan zat X.
BAB 5. PENUTUP 5.1 Kesimpulan
Kesimpulan yang dapat ditarik dari hasil percobaan dan pengamatan di atas yaitu : 1. Semakin banyak waktu yang diberikan maka semakin rendah titik beku yang
dihasilkan.
2. Dari perhitungan yang telah dilakukan Kf yang diperoleh adalah 8,05 dan 9,39 g/mol K dan berat molekul zat X yang diperoleh adalah 18,31 gram/mol.
5.2 Saran
DAFTAR PUSTAKA
Anonim. 2015. MSDS Akuades. [Serial Online]. http://www.sciencelab.com/msds.php? msdsId=9924923. Diakses tanggal 20 Maret 2015.
Anonim. 2015. MSDS Asam Asetat. [Serial Online]. http://www.sciencelab.com/msds.php? msdsId=9927321. Diakses 1 April 2015.
Anonim. 2014. Sodium Chlroride. [serial online].http://www.sciencelab.com/msds/php? msdsld= 9337896. Diakses tanggal 20 September 2015.
Anonim. 2015. Naphtalene. [Serial Online]. http://www.scien c elab.com /msds-naphtalene/). Diakses tanggal 20 september 2015.
Anshory, Irfan. 1994. Kimia. Jakarta: Erlangga.
Bird, Tony. 1987. Kimia Fisika untuk Universitas. Jakarta: Gramedia Pustaka Utama.
Dogra SK dan S Dogra. 1894. Kimia Fisik dan Soal-soal. Jakarta: UI Press. Harnanto, Ari. 2009. Kimia 3. Jakarta: Pusat perbukuan Pendidikan Nasional. Jupamahu, M.S. 1980. Kimia Fisika 1. Bandung: Departemen Kimia ITB.
Petrucci, Ralph M., 1987. Kimia Dasar Edisi Keempat Jilid 2. Jakarta : Erlangga.
Pratiwi, Widya Anisa. 2013. http://widyaannisap.blogspot.com/2013/09/praktikum-kimia-sifat-koligatif-larutan.html. diakses tanggal 20 September 2015.
Purba, Michael. 1987. Kimia Untuk SMA Kelas XII. Jakarta: Erlangga. Reis. 1999. Sifat-sifat Gas dan Zat Cair. Jakarta: Gramedia.
Sachri, Soebandi dan Harun. 1982. Buku Tabel Ilmu Fisika dan Kimia. Bandung: Binacipta.
Sukardjo. 2004. Kimia Fisika. Yogyakarta: Rineka Cipta.
Taufik, M. 2012. http://taufik-kldp.blogspot.com/2012/10/penurunan-titik-beku-larutan.html. diakses 20 September 2015.
1. PenentuantitikbekularutanAsamCukaGlasial
wasamcuka=20,98gram
Tf = 11oC = 284 K
wasamcuka=20,98gram
Sehingga:
7,5K=
1000×1,34mol Kg
20,98g ×
{
(
Mr2gzat x)
+(
1g128molg
)
}
7,5K=63,87×
(
Mr2gzat X+ 1g128molg
)
0,117=
(
Mr2zat Xg + 1g128molg
)
0,117mol−0,0078mol=Mr2g
zat X
0,1092mol=Mr2g
zat X
Mrzat X=0,10922gmol