LAPORAN PRAKTIKUM KIMIA FISIK II PENENTUAN TITIK BEKU LARUTAN
Nama : Desy Puspitasari
NIM : 141810301013
Kelompok/Kelas : II
Asisten : Kiky Nur Wulandari
LABORATORIUM KIMIA FISIK JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
BAB 1. PENDAHULUAN
1.1 Latar Belakang
Titik beku adalah suhu perubahan wujud cair menjadi wujud padat yang dimiliki oleh suatu pelarut akibat tekanan uap pelarut sama dengan tekanan uap esnya. Penurunan titik beku larutan (ΔTf = freezing point depression) adalah selisih antara titik beku pelarut dengan titik beku larutan. Penurunan titik beku merupakan salah satu sifat koligatif dari suatu larutan. Sifat koligatif larutan adalah sifat larutan yang ditentukan oleh jumlah partikel dalam larutan dan tidak bergantung pada jenis partikelnya. Penurunan titik beku ini terjadi akibat adanya penurunan tekanan uap, sehingga larutan akan membeku pada temperatur lebih rendah daripada pelarut murninya.
Penentuan tetapan penurunan titik beku molal dilakukan dengan menambahkan suatu zat kedalam pelarut murni, misalnya asam cuka glasial sebagai pelarut murni ditambahkan naftalen sebagai zat terlarutnya. Perlakuan tersebut menyebabkan terjadinya perubahan suhu pada pelarut murni. Selisih antara keduanya dapat digunakan untuk menghitung tetapan penurunan titik beku pelarut. Tetapan penurunan titik beku pelarut tersebut digunakan untuk menentukan berat molekul suatu zat x yang memiliki sifat non volatil dapat diketahui. Berdasarkan latar belakang tersebut, maka percobaan penentuan titik beku larutan sangat penting dilakukan.
1.2 Tujuan
BAB 2. TINJAUAN PUSTAKA
2.1 Material Safety Data Sheet (MSDS) 2.1.1 Akuades
Akuades disebut juga Aqua Purificata (air murni) dengan rumus molekul H2O yang dihasilkan dengan cara distilasi. Air tidak menyebabkan iritasi apabila terkena mata, terhirup, dan tertelan. Tindakan pertolongan pertama jika terjadi kontak mata, kulit, terhirup, atau tertelan pada air tidak berlaku karena air tidak berbahaya. Korban jika terjadi iritasi segera dibawa ke pihak medis. Air pada umumnya tidak mudah terbakar dan meledak sehingga data api dan ledakannya juga tidak ada. Air dapat bereaksi keras dengan beberapa spesifik bahan. Hindari kontak dengan semua bahan sampai investigasi menunjukkan substansi kompatibel. Akuades ini memiliki allotrop berupa es dan uap. Air dihasilkan dari pengoksidasian hidrogen dan banyak digunakan sebagai bahan pelarut bagi kebanyakan senyawa dan sumber. Akuades merupakan cairan tidak berwarna dan tidak berbau. Derajat keasaman (pH) dari akuades adalah netral yaitu 7,0. Titik didih dan titik lebur dari akuades berturut-turut adalah 100 oC dan 0 oC. Tekanan uap dari akuades pada suhu 20 oC adalah 17,5 mmHg. Massa jenis dari akuades adalah 1,00 gram/cm3. Rumus formula dari akuades adalah H2O dengan berat molekul 18,0134 gram/mol (Anonim, 2016).
2.1.2 Asam Asetat
dengan barang yang lunak. Asam oksalat apabila terhirup terlalu banyak segera yang memiliki wujud padat berupa kristal berwarna putih, dan berbau aromatik. Berat molekul dari naftalen adalah 128,19 g/mol. Titik didih dan titik lebur naftalen adalah 218oC dan 80,2oC. Naftalen mudah larut dalam air panas, metanol, n-oktanol. Senyawa ini sangat sedikit terdispersi dalam air dingin. Naftalen sangat berbahaya apabila tertelan, berbahaya bila kasus kontak mata (iritan), dan sedikit berbahaya dalam kasus kontak kulit. Tindakan pertolongan pertama untuk kontak mata yaitu periksa dan lepaskan lensa kontak, segera basuh mata dengan banyak air mengalir selama minimal 15 menit. Kontak kulit dengan bahan ini segera cuci dengan air yang banyak. Biarkan korban untuk beristirahat di tempat yang berventilasi baik jika terjadi penghirupan dan jangan dimuntahkan jika tertelan, kecuali diarahkan oleh tenanga medis untuk melakukannya (Anonim, 2016). 2.1.4 Natrium Klorida
menetralisir keracunan. Penyimpanan seharusnya dilakukan di tempat yang sejuk, kering, dan tertutup (Anonim, 2016).
2.2 Landasan Teori
Sifat–sifat koligatif adalah sifat–sifat yang hanya ditentukan oleh jumlah partikel dalam larutan dan tidak tergantung oleh jenis partikelnya, tidak bergantung pada ukuran ataupun berat molekul zat terlarut. Sifat koligatif larutan dapat dibedakan menjadi dua macam, yaitu sifat larutan non elektrolit dan elektrolit. Hal itu disebabkan zat terlarut dalam larutan elektrolit bertambah jumlahnya karena terurai menjadi ion-ion, sedangkan zat terlarut pada larutan non elektrolit jumlahnya tetap karena tidak terurai menjadi ion-ion, sesuai dengan hal-hal tersebut maka sifat koligatif larutan non elektrolit lebih rendah daripada sifat koligatif larutan elektrolit. Larutan merupakan suatu campuran yang homogen dan dapat berwujud padatan, maupun cairan. Akan tetapi larutan yang paling umum dijumpai adalah larutan cair, dimana suatu zat tertentu dilarutkan dalam pelarut berwujud cairan yang sesuai hingga konsentrasi tertentu (Bird, 1993).
Larutan merupakan salah satu bentuk materi yang memiliki dua jenis sifat, yaitu sifat larutan yang tergantung pada jenis zat terlarut dan sifat larutan yang bergantung pada konsentrasi zat terlarut bukan pada jenisnya. Hubungan antara sifat larutan dengan konsentrasi adalah berbanding lurus, sehingga sehingga semakin besar konsentrasi yang ditambahkan dalam larutan, maka sifat larutan seperti penurunan titik beku akan semakin besar. Larutan dengan konsentrasi yang sama akan memberikan sifat yang sama pula. Sifat larutan yang bergantung pada konsentrasi disebut sifat koligatif larutan (Purba, 1987).
Perbedaan tersebut yang menyebabkan terjadinya penurunan titik beku larutan (ΔTf) yang besarnya bergantung pada konsentrasi zat terlarut (Syukri, 1999).
Zat yang tidak mudah menguap jika dilarutkan akan menyebabkan penurunan tenaga bebas. Penurunan tenaga bebas tersebut mengikuti persamaan Nernst.
Gº1 - Gº = RT ln...(1) Gº1 - Gº = Penurunan tenaga bebas pelarut...(2)
Dimana R adalah tetapan gas murni umum, T merupakan suhu mutlak dan x adalah penurunan tenaga bebas (Tim Penyusun, 2016).
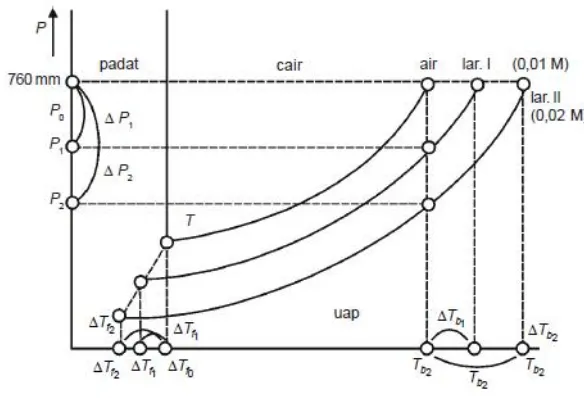
Kemampuan zat pelarut untuk berubah menjadi fase uapnya menurun sebagai akibat dari adanya penurunan tenaga bebas. Penurunan tenaga bebas juga membuat tekanan uap pelarut dalam larutan lebih rendah dibandingkan dengan tekanan uap pelarut yang sama dalam keadaan murni. Penggunaan diagram fasa dapat membantu dalam memahami pengaruh penurunan tekanan uap terhadap titik beku larutan.
Gambar 2.1 Diagram Fasa
Sumber: Tim Kimia Fisik, 2016.
ΔTf = Tof – Tf ……….(3)
Penurunan titik beku besarnya tergantung pada fraksi mol pelarut. Fraksi mol zat terlarut dinyatakan dengan X1 yang diperoleh dari persamaan X = 1-X1. Penurunan titk beku jika dinyatakan sebagai X1 adalah sebagai berikut:
ΔTf = (R(Tof )2/ΔHf) X1 ………..(4)
Berdasarkan persamaan di atas, diketahui bahwa ΔHf merupakan panas pencairan pelarut. Fraksi mol dapat diubah ke dalam bentuk molalitas. Molalitas larutan (m) dapat diperoleh dari pencampuran m mL zat terlarut ke dalam 1000 gram zat terlarut. Berikut persamaannya:
X1 = m / (1000/M)+ m) ………..(5)
M merupakan berat molekul dari pelarut. Nilai X1 = mM/1000 jika larutan encer dengan m mendekati nol. Persamaannya adalah:
ΔTf = (R(Tof )2 M.m)/1000ΔHf ……… (6)
Dari X1 = m.M/1000 di atas diperoleh:
m = 1000 X1/M
Fraksi mol zat terlarut dapat dinyatakan dengan:
X1= m1 / (m1 + m) = (W1/M1) / {(W1/M1 + W/M)}
Dimana W1 adalah berat zat terlarut, M1 sebagai berat molekul zat terlarut dan W sebagai berat pelarut. Larutan yang digunakan merupakan larutan encer, sehingga (W1/M1) >>(W/M).
X1 = (W1.M) / (W.M1) dan ΔTf = (1000/kf) / M1 x (W1/W)
Harga kf dapat dihitung dengan rumus:
kf = (W.M1.ΔTf) / (1000 W1)………(7)
Berat molekul zat terlarut dihitung berdasarkan rumus:
(Tim kimia fisik, 2016).
Pengukuran titik didih dan titik beku suatu larutan dilakukan dengan suhu yang tidak konstan. Satuan konsentrasi molal paling cocok digunakan karena tidak bergantung pada suhu. Perubahan suhu dapat mempengaruhi volume sehingga satuan konsentrasi molar tidak cocok. Jenis pelarut yang berbeda akan memiliki harga ΔKf dan ΔKb yang juga berbeda. Cara untuk mengukur kedua konstanta tersebut yaitu berdasarkan eksperimen pengukuran Tf dan Tb larutan. Nilai ΔKf dan ΔKb hanya bergantung pada jenis pelarut (Achmad, 1996).
Besarnya tekanan uap suatu komponen dalam suatu larutan menurut hukum Roult senilai dengan tekanan uap suatu larutan dikali dengan fraksi mol komponen yang menguap dalam larutan. Cara untuk menentukan titik beku larutan encer menurut Roult:
ΔTf = m. Kf... (9)
BAB 3. METODOLOGI PERCOBAAN
3.1 Alat dan Bahan 3.1.1 Alat
- Termometer alkohol - Tabung gelas - Pengaduk - Stopwatch
- Gelas beker 100 cc - Erlenmeyer
- Gelas ukur 100 cc 3.1.2 Bahan
- Air - Es - Garam
- Asam cuka glasial - Naftalen
3.2 Skema Alat
Keterangan: A. Sensor suhu
B. Tabung gelas 1
C. Pengaduk
A
D B
C
D. Tabung gelas 2
E. Tabung gelas 3
3.3 Skema Kerja 3.3.1 Persiapan
- Diisikan ke dalam gelas E secukupnya. - Diisikan air secukupnya pada tabung D.
- Diambil pelarut sebanyak 20 mL dan dimasukkan ke dalam tabung gelas B.
- Digunakan pelarut asam cuka glasial.
3.3.2 Penentuan Tetapan Penurunan Titik Beku Molal Air, es,
garam
Hasil
Asam Cuka Glasial
- Dicatat suhu pada termometer A tiap-tiap menit setelah 20 mL asam cuka glasial pada dimasukkan dalam tabung B.
- Diamati pelarut sudah membeku atau belum ketika suhu sudah mulai tetap.
- Diulang kedua langkah tadi sekali lagi dan dicatat titik beku pelarut murni Tof.
- Dibiarkan pelarut mencair kembali.
- Dimasukkan naftalen (BM=128) sebagai zat pelarut.
- Dilakukan percobaan seperti ketiga langkah awal dan dicatat Tf (titik beku larutan).
3.3.3 Penentuan Berat Molekul Zat X
Zat X
- Ditambahkan 2 gram zat x pada larutan hasil pada skema 3.3.2 setelah dibiarkan mencair.
- Diamati Tf campuran seperti pada skema kerja 3.3.2. - Dihitung ∆Tf
BAB 4. HASIL DAN PEMBAHASAN
4.1 Hasil Percobaan 4.1.1 Hasil Pengamatan
a. Pengukuran Titik Beku Asam Cuka Glasial Suhu awal = 24,75oC
Menit ke 1 2 3 4
Temperatur 19 20,5 18,5 17
b. Pengukuran Titik Beku Asam Cuka Glasial Setelah Penambahan Naftalen Suhu awal = 26oC
c. Pengukuran Titik Beku Asam Cuka Glasial Setelah Penambahan Naftalen dan zat X
Suhu awal = 27oC
Menit ke 1 2 3 4 5 6
Temperatur 21 14 10,5 10 10 8
4.2.2 Pengolahan Data Hasil a. Penentuan Nilai Kf
No .
Keterangan Hasil Rata – rata
Pengulangan I Pengulangan II
1 Tof asam cuka 290 K 289 K 289,5 K
2 Tf naftalen 283 K 283 K 283 K
3 ∆Tf l 6,5 K
4 W asam cuka 20,98gram
5 Kf 17,46 g
mol K
4.1.2 Penurunan Berat Molekul Zat X No
.
1 Tf zat X 282 K
2 ∆Tf 2 7,5 K
3 ∆Tf total 14 K
4 BM zat X 56,7g/mol
4.2 Pembahasan
Percobaan terakhir pada praktikum kimia fisik 2 merupakan percobaan mengenai penentuan titik beku larutan. Percobaan penentuan titik beku larutan ini dilakukan dengan tujuan menentukan tetapan penurunan titik beku molal pelarut dan menentukan berat molekul zat non volatil yang tidak diketahui. Larutan mempunyai sifat-sifat yang berbeda dari pelarutnya. Salah satu sifat penting dari suatu larutan adalah penurunan titik beku. Titik beku adalah temperatur tetap dimana suatu zat tepat mengalami perubahan wujud dari cair ke padat. Air membeku pada suhu 0°C pada tekanan 1 atm, karena pada suhu itu tekanan uap air sama dengan tekanan uap es. Selisih antara titik beku pelarut dengan titik beku larutan disebut penurunan titik beku (ΔTf = freezing point depression). Penurunan titik beku tidak bergantung pada jenis zat terlarut, tetapi hanya pada konsentrasi partikel dalam larutan. Penurunan titik beku tergolong sifat koligatif.
Setiap zat yang mengalami pembekuan memiliki tekanan 1 atm. Penambahan zat terlarut non volatil ke dalam suatu pelarut menyebabkan terjadinya penurunan titik beku. Keberadaan partikel-partikel zat pelarut mengalami proses pengaturan molekul-molekul dalam pembentukan susunan kristal padat, sehingga diperlukan suhu yang lebih rendah untuk mencapai susunan kristal padat dari fasa cairnya. Hal ini lah yang menyebabkan terjadinya penurunan titik beku suatu larutan yang keadaannya ditambahkan zat terlarut.
garam maka sebagian akan membentuk air garam dan es secara spontan, akibatnya air garam semakin banyak. Air didalam segumpal es terstruktur membentuk tatanan geometrik tertentu dan kaku. Tatanan yang kaku ini akan rusak ketika ditambahkan oleh garam. Rusaknya struktur geometrik yang kaku ini menyebabkan es menjadi mencair akibatnya molekul-molekul air dapat bebas bergerak dalam wujud cair, tetapi merusak struktur padat molekul-molekul es tersebut memerlukan energi yang cukup besar. Reaksi antara garam dan es batu termasuk reaksi eksoterm yaitu reaksi pelepasan panas atau energi. Hal tersebut dapat terjadi karena titik beku larutan garam lebih rendah daripada titik beku pelarut murni sehingga larutan garam melepaskan panas yang akhirnya panas akan diterima oleh es batu dan menyebabkan es batu mencair, sementara itu airpun mencoba membuang panas yang diterimanya. Garam yang digunakan banyak dan tersebar merata dalam larutan garam sehingga membuat suhu larutan menjadi semakin rendah daripada suhu es murni.
presisi yang tinggi karena titik beku asam cuka pada percobaan hampir sama dengan titik beku asam cuka pada literatur yaitu 16,7oC.
Data pengukuran titik beku asam cuka glasial yang didapat pada dua pengulangan tersebut dapat dilakukan pembuatan grafik yaitu sebagai berikut :
Grafik diatas
menunjukkan tingkat kelinieran yang sangat jelek. Nilai pada menit kedua menunjukkan peningkatan. Seharusnya data yang diperoleh memiliki nilai yang lebih kecil dari pada nilai yang pertama. Hal ini dapat disebabkan oleh perbedaan data yang diperoleh pada pengulangan pertama dan kedua untuk menit yang sama. Hal tersebut menyebabkan nilai rata-ratanya menjadi sangat tinggi.
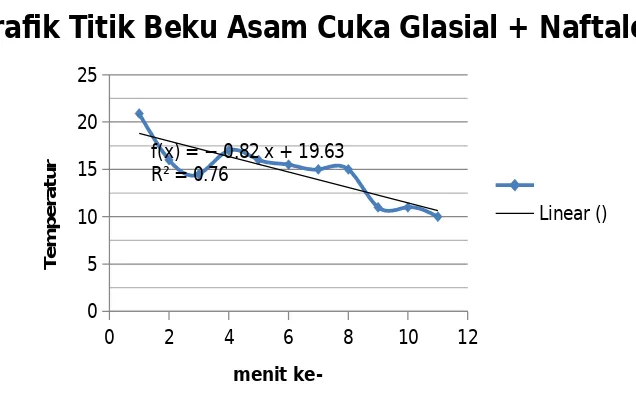
Langkah selanjutnya adalah mengukur penurunan titik beku asam asetat glasisal setelah ditambahkan naftalen. Asam asetat glasial yang sudah membeku dicairkan kembali dengan cara membilas dinding beaker glass dengan air. Ketika asam asetat glasial sudah cair, ditambahkan sebanyak 1 gram naftalen dan diaduk sampai homogen. Larutan yang sudah homogen tersebut kemudian didinginkan dalam gelas beaker dan diamati perubahan suhunya tiap menit hingga konstan. Titik beku asam asetat glasial rata – rata setelah ditambahkan dengan naftalen turun hingga 10oC. Penambahan naftalen ini dapat menurunkan titik beku asam asetat glasial. Penambahan naftalen menyebabkan penurunan energi bebas dari pelarut, sehingga kemampuan pelarut untuk berubah menjadi fase uapnya akan menurun pula. Tekanan uap pelarut dalam larutan akan lebih rendah bila dibandingkan dengan tekanan uap pelarut yang sama dalam
Grafk Titik Beku Asam Cuka Glasial
Penurunan tekanan uap sebanding dengan penurunan titik beku, sehingga apabila tekanan uapnya turun maka perubahan titik beku juga akan turun, dan sebaliknya. Penurunan ini juga diakibatkan oleh adanya partikel naftalen yang menghalangi interaksi molekul asam asetat glasial untuk menjadi padat. Naftalen melemahkan interaksi antar molekul dalam asam asetat glasial sehingga asam asetat glasial terganggu dan suhu yang digunakan untuk membeku menjadi semakin kecil, sehingga titik beku larutan asam asetat glasial akan menurun setelah terjadi penambahan naftalen.
Data pengukuran titik beku asam cuka glasial ditambah naftalen yang didapat pada dua pengulangan tersebut dapat dilakukan pembuatan grafik yaitu sebagai berikut :
Grafik diatas menunjukkan tingkat kelinieran yang sangat jelek. Nilai yang diperoleh mengalami naik turun. Seharusnya data yang diperoleh memiliki nilai semakin kecil dengan pertambahan menit yang terjadi. Hal ini dapat disebabkan oleh perbedaan data yang diperoleh pada pengulangan pertama dan kedua untuk menit yang sama. Hal tersebut menyebabkan nilai rata-ratanya menjadi sangat rendah.
Percobaan terakhir adalah menentukan berat molekul dari zat X. Asam cuka glasial dan naftalen yang sudah membeku dicairkan kembali dan ditambahkan dengan 1 gram zat X. Pengukuran temperatur pada campuran naftalen dan zat x dalam pelarut asam asetat glasial didapatkan titik beku rata – rata sebesar 9ºC atau sekitar 282 K. Suhu yang didapatkan ini merupakan titik
0 2 4 6 8 10 12
Grafk Titik Beku Asam Cuka Glasial + Naftalen
beku campuran. Penurunan yang terjadi disebabkan bertambahnya jumlah zat terlarut dalam larutan. Penurunan suhu ini semakin bertambah seiring banyaknya jumlah zat yang ditambahkan sebab apabila semakin banyak jumlah partikel di dalamnya maka semakin berkurang energi kinetik yang dihasilkan. Penurunan titik beku yang terjadi dapat mengindikasikan bahwa larutan tersebut bukan merupakan larutan murni yang disebabkan adanya penambahan zat terlarut. Data pengukuran titik beku asam cuka glasial ditambah naftalen yang didapat pada dua pengulangan tersebut dapat dilakukan pembuatan grafik yaitu sebagai berikut :
Nilai yang diperoleh pada grafik menunjukkan penurunan. Waktu yang semakin lama menghasilkan suhu yang semakin turun. Hal ini sangat sesuai dengan yang terdapat pada literatur. Menit ke-4 menunjukkan nilai yang sama atau tetap dengan nilai sebelumnya. Tingkat kelinieran yang dimiliki oleh grafik ini merupakan tingkat kelinieran terbagus dibandingkan dengan grafikgrafik yang terdapat sebelumnya.
Reaksi yang terjadi pada peristiwa penurunan titik beku campuran naftalen dan zat x dalam pelarut asam asetat glasial adalah reaksi endodermis karena sistem mendapatkan energi dari lingkungan yang berupa panas. Panas yang diterima digunakan oleh sistem untuk berubah wujud menjadi padat dengan menurunkan suhunya. Persamaan reaksi yang terjadi pada perubahan wujud larutan asam cuka glasial menjadi bentuk padatan adalah sebagai berikut :
CH3COOH (aq) + ∆H → CH3COOH (s)
Grafk Titik Beku Asam Cuka Glasial + Naftalen + Zat X
Harga Kf larutan asam cuka glasial yang didapatkan pada percobaan ini adalah 17,46g/mol K. Harga Kf asam asetat secara teori adalah 3,9 K.g/mol (Timothy, 2015). Perbedaan harga Kf disebabkan alat yang kurang baik, sebab larutan tidak ditutup atau diperlakukan dengan keadaan yang vakum. Alat khusus dibutuhkan dalam percobaan ini untuk membuat suhu es benar – benar konstan dan stabil. Perlakuan larutan apabila dalam keadaan terbuka dapat memungkinkan partikel atau zat dalam larutan akan berinteraksi dengan lingkungan membentuk zat baru yang dapat mempengaruhi hasil dari percobaan yang diinginkan. Penyebabab lainnya adalah bahan senyawa atau zat x yang tidak dapat larut pada larutan. Hal tersebut dapat disebabkan oleh zat x sudah dalam keadaan rusak.
Harga ketetapan titik beku suatu larutan dapat digunakan untuk menghitung berat molekul suatu senyawa atau zat yang merupakan suatu pelarut yang ditambahkan dalam larutan. Senyawa atau zat X yang non-volatil memiliki berat molekul 108,69 g/mol. Berat molekul senyawa ini didapatkan dengan menentukan ∆ T ftotal, yaitu jumlah antara ∆ T f1+∆ T f2. ∆ T ftotal kemudian
BAB 5. PENUTUP
5.1 Kesimpulan
Adapun kesimpulan dari percobaan penentuan titik beku larutan adalah : 1. Tetapan penurunan titik beku molal pelarut dapat ditentukan dengan cara
mengukur To
f dan Tf melalui percobaan sehingga dihasilkan nilai
Kf=17,46mol Kg
2. Berat molekul zat X yang digunakan dalam percobaan ini yaitu56,7g/mol.
5.2 Saran
DAFTAR PUSTAKA
Achmad, H. 1996. Kimia Larutan. Bandung: PT. Aditya Bakti.
Anonim. 2016. Material Safety Data Sheet Acetic Acid .[Serial Online].
http://www.sciencelab.com/msds.php?msdsId=99279121.[22 November
2016].
Anonim. 2016. Material Safety Data Sheet Aquades. [Serial Online].
http://www.sciencelab.com/msds.php?msdsId=9924923. [22 November
2016].
Anonim. 2016. Material Safety Data Sheet Naphtalene. [Serial online]. http://www.sciencelab.com/msds.php?msdsId=9927671. [22 November 2016].
Anonim. 2016. Material Safety Data Sheet Natrium Klorida. [Serial online].
http://www.sciencelab.com/msds.php?msdsId=9927593 . [22 November
2016].
Purba, M. 1987. Kimia Dasar. Jakarta: Erlangga.
Syukri, S. 1999. Termodinamika Kimia. Jakarta: Erlangga.
LAMPIRAN
1. Penentuan titik beku larutan Asam Cuka Glasial Diket: V asam cuka = 20 mL
Tof = 17+16
2 =16,5oC
Tf = 10+102 =10oC
Ditanya: a. ΔTf
b. Massa asam cuka c. Kf
Penyelesaian: To
f = 16,5oC = 289,5 K Tf = 10oC = 283 K ΔTf = Tof - Tf
= 289,5 K – 283 K = 6,5 K
ρasam cuka=
wasam cuka
Vasam cuka
wasamcuka=¿ρasam cuka×Vasam cuka
wasamcuka=1,049mL ×g 20mL
wasamcuka=20,98gram
Sehingga:
Kf=wasamcuka1000× Mr×wnaftalen×∆ Tf
naftalen
Kf=
20,98g ×128mol ×g 6,5K
1000×1g
2. Penentuan Massa Zat X Diket :
Tof = 17+16
2 =16,5oC = 289,5 oC
Tf zat X = 10+2 8=9oC = 282 oC
ΔTf 2 = Tof asam cuka – Tof zat X = 289,5 K – 282 k = 7,5 K
∆ T ftotal=∆ T f1+∆ T f2
∆ T ftotal=6,5K+7,5K
∆ T ftotal=14K
Kf=Wlarutan× Mr zatX × ∆ T f1000×WzatX total
Kf=(Wcuka+Wnaphtalen1000× WzatX)× Mr zatX × ∆T ftotal
MrZatX= Kf ×1000×WzatX
(Wcuka+Wnaph)× ∆T ftotal
¿
17,45g
mol K ×1000×1g
(20,98+1)g ×14K