PENURUNAN TITIK BEKU ASAM ASETAT
Khusnul Khotimah, Silvia MarcelianaLab. Kimia Fisika Jurusan Kimia Universitas Negeri Semarang Gedung D8 lt 2 Sekaran Gunungpati Semarang, Indonesia
khusnul4301411010@gmail.com, 087830969081 50225
Abstrak
Tujuan dari percobaan ini adalah untuk mengetahui nilai tetapan penurunan titik beku asam asetat serta menentukan berat molekul suatu sampel zat non elektrolit. Metode yang digunakan yaitu dengan melakukan pengukuran titik beku larutan naftalena dalam asam asetat pada berbagai konsentrasi zat terlarut. Plot molalitas naftalena versus penurunan titik beku larutan akan menghasilkan kurva linear dengan gradien tetapan penurunan titik beku (Kf) asam asetat. Harga Kf yang diperoleh dapat digunakan untuk menentukan berat molekul sampel zat non elektolit yang belum diketahui. Plot versus akan menghasilkan kurva linear dengan gradien berat molekul (Mr). Harga Kf asam asetat menurut teori adalah 3,9000 sedangkan Kf asam asetat yang diperoleh dari percobaan adalah 3,6338 dengan persentase kesalahan sebesar 6,8%. Berdasarkan percobaan, berat molekul sampel zat non elektrolit yang digunakan adalah 132,76 gram/mol dengan persentase kesalahan sebesar 33%. Faktanya, zat non elektrolit yang digunakan adalah glukosa monohidrat dengan berat molekul 198,17 gram/mol. Kesalahan ini terjadi karena glukosa monohidrat memiliki kelarutan yang rendah dalam asam asetat. Kesimpulannya, harga Kf asam asetat berdasarkan percobaan adalah 3,6338 sedangkan berat molekul sampel zat non elektrolit yang digunakan adalah 132,76 gram/mol.
Kata kunci: asam asetat; penurunan titik beku; sifat koligatif.
Abstract
The purpose of this experiment was to determine the freezing point depression constant (Kf) of acetic acid and to determine the molecular weight (Mr) of non-electrolyte substances. The method used is by measuring the freezing point of acetic acid solution at various concentrations of dissolved substances (naphtalene). Plot naphthalene molality versus freezing point depression of the solution would result in a linear curve with gradient Kf of acetic acid. Price Kf obtained can be used to determine the molecular weight of unknown non-electrolyte substance. Plot
versus will produce a linear curve with a gradient of
molecular weight. Price Kf of acetic acid according to the theory is 3.9000 whereas Kf of acetic acid obtained from the experiment is 3.6338 with a percentage error of 6.8%. Based on the experiments, molecular weight of non-electrolyte substances used are 132.76 g/mol with a percentage error of 33%. In fact, non-electrolyte substances used are glucose monohydrate with a molecular weight of 198.17 g/mol. This error occurs because glucose monohydrate has a low solubility in acetic acid. In conclusion, Kf of acetic acid based on experimental is 3.6338 while the molecular
weight of non-electrolyte substance used are 132.76 g/mol. Keywords: acetic acid; colligative properties; freezing point depression.
Pendahuluan
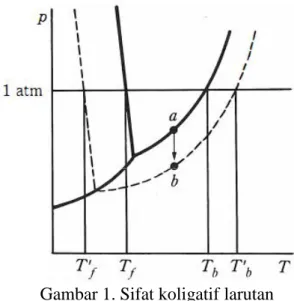
Penambahan zat terlarut tertentu kedalam suatu pelarut murni akan menimbulkan perubahan sifat fisik pelarut tersebut yang besarnya sebanding dengan molalitas zat terlarut yang ditambahkan. Sifat fisik tersebut diantaranya adalah penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmosis. Keempat sifat tersebut biasa disebut dengan sifat koligatif larutan, yaitu sifat-sifat larutan yang hanya ditentukan oleh jumlah partikel dalam larutan dan tidak tergantung jenis partikelnya (Sukardjo, 2004). Perbedaan sifat fisik pelarut murni dengan sifat fisik larutan dapat dilihat dalam gambar 1 yang menunjukkan sifat koligatif larutan.
Gambar 1. Sifat koligatif larutan
Dari gambar 1 dapat dilihat bahwa dengan penambahan zat terlarut tertentu, diagram fasa larutan akan mengalami pergeseran sehingga terjadi perbedaan dengan diagram fasa pelarut murninya. Larutan membeku pada temperatur yang lebih rendah dari titik beku pelarut murninya, selisih temperatur inilah yang disebut dengan penurunan titik beku. Semakin banyak zat terlarut yang ditambahkan, maka pergeseran kurva akan semakin besar, yang artinya penurunan titik beku semakin besar pula. Sifat ini tidak hanya terjadi pada titik beku, penambahan zat terlarut tertentu secara otomatis juga akan menimbulkan sifat koligatif yang lain karena keempat sifat koligatif tersebut merupakan suatu kesatuan yang tidak dapat dipisahkan. Pengukuran salah satu sifat koligatif dapat digunakan untuk menentukan sifat koligatif yang lain.
Sifat koligatif yang akan dibahas dalam percobaan ini adalah penurunan titik beku. Titik beku larutan ialah temperatur pada saat larutan setimbang dengan pelarut padatannya, larutan akan membeku pada temperatur yang lebih rendah (Sukardjo, 2004). Titik beku juga dapat dikatakan sebagai temperatur pada perpotongan antara garis tekanan tetap dengan kurva peleburan, penurunan titik beku larutan sebanding dengan fraksi mol zat terlarutnya (Petruci, 1987).
Pada saat temperatur titik beku atau titik didih tercapai, terjadi kesetimbangan antara pelarut dalam larutan dengan pelarut murni. Oleh karena itu, titik beku dan titik didih larutan tergantung pada kesetimbangan pelarut dalam larutan dengan pelarut padatan murni atau uap pelarut murni, kesetimbangan lain yang mungkin adalah antara pelarut dalam larutan dengan pelarut cairan murni (Wahyuni, 2013). Tetapan Kf menyatakan besarnya penurunan titik beku untuk larutan 1 molal.Tiap pelarut memiliki harga tetapan Kf tertentu. Asam asetat memiliki harga tetapan Kf sebesar 3,9 sedangkan titik bekunya pada tekanan 1 atm adalah 16,7 (Sachri dan Harun, 1982).
Penurunan titik beku relatif lebih banyak digunakan dalam penentuan berat molekul. Hal ini dikarenakan pada umumnya efek penurunan titik beku lebih besar daripada kenaikan titik didih atau penurunan tekanan uap (Jupamahu, 1980). Selain itu, jika pada kenaikan titik didih harus digunakan zat terlarut involatil, untuk penurunan titik beku tidak ada batasan mengenai jenis zat terlarut, asalkan padatan yang terpisah saat larutan membeku adalah padatan pelarut murni (Mulyani dan Hendrawan, 2003).
Harga tetapan penurunan titik beku suatu pelarut dapat ditentukan melalui percobaan. Zat terlarut yang digunakan adalah zat tertentu yang telah diketahui secara pasti berat molekulnya. Harga tetapan titik beku yang diperoleh melalui percobaan dapat digunakan untuk menentukan berat molekul zat lain yang belum diketahui.
Masalah yang akan diselesaikan dalam percobaan ini adalah berapa tetapan penurunan titik beku asam asetat serta berapa berat molekul suatu sampel zat non elektrolit. Tujuan dari percobaan ini adalah menentukan besarnya tetapan penurunan titik beku asam asetat dan menentukan berat molekul suatu zat non elektrolit.
Metode
Alat yang digunakan dalam percobaan penurunan titik beku asam asetat adalah gelas kimia 100 mL dari Pyrex, termometer alkohol, pengaduk, stopwatch, penangas es, serta statif untuk menggantungkan termometer. Bahan yang digunakan yaitu asam asetat p.a produksi dari Merck, naftalena for syn produksi dari Merck, serta glukosa monohidrat for
syn produksi dari Merck yang akan digunakan sebagai zat X, yaitu zat yang akan ditentukan berat molekulnya.
Langkah kerja dalam penentuan tetapan penurunan titik beku asam asetat adalah sebagai berikut: pertama, sebanyak 15 mL asam asetat murni dimasukkan kedalam penangas es dan diukur titik bekunya, titik beku dicapai ketika mulai terbentuk padatan dan terjadi temperatur yang konstan selama beberapa menit. Kedua, asam asetat dibiarkan hingga mencair dan kembali pada temperatur ruang, untuk mempercepat langkah ini dapat digunakan penangas air. Ketiga, kedalam asam asetat ditambahkan 1,000 gram naftalena kemudian larutan dimasukkan kedalam penangas es. Kelima, dilakukan pengukuran temperatur larutan naftalena dalam asam asetat hingga diperoleh temperatur titik bekunya. Keenam, larutan dibiarkan kembali pada temperatur ruang, kemudian 1,000 gram naftalena kembali ditambahkan kedalam larutan untuk diukur titik bekunya, demikian seterusnya hingga penambahan 1,000 gram naftalena sebanyak 6 kali. Langkah kerja dalam penentuan berat molekul zat non elektrolit tidak berbeda dengan langkah kerja penentuan tetapan penurunan titik beku asam asetat, hanya saja zat terlarut naftalena diganti dengan glukosa monohidrat.
Variabel bebas dalam percobaan ini adalah massa zat terlarut, yaitu massa naftalena untuk percobaan penentuan tetapan penurunan titik beku asam asetat dan massa glukosa monohidrat (zat X) untuk percobaan penentuan berat molekul zat non elektrolit. Variabel terikat dalam percobaan ini adalah penurunan titik beku yang nilainya tergantung jumlah partikel zat terlarut. Dalam percobaan ini, variabel kontrol seperti tekanan ruangan, metode percobaan, dan pelarut dibuat sama.
Data yang diperoleh dalam percobaan ini adalah titik beku larutan pada berbagai variasi massa zat terlarut yang ditambahkan. Karena berat molekul zat terlarut (naftalena) diketahui dan massa pelarut dapat dihitung dengan mengalikan volum dan massa jenisnya maka data massa zat terlarut dapat dinyatakan dalam molalitas. Sesuai dengan hukum Roult untuk larutan encer ideal, tetapan penurunan titik beku asam asetat dapat diperoleh dengan mengalurkan kurva molalitas larutan versus penurunan titik beku larutan ( . Gradien yang diperoleh berupa garis linear yang merupakan harga tetapan penurunan titik beku (Kf) asam asetat. Untuk menentukan berat molekul suatu zat non elektrolit dapat digunakan metode yang sama. Karena besaran yang ingin diketahui adalah berat molekul, maka kurva yang digunakan adalah kurva versus . Gradien yang diperoleh berupa garis linear yang merupakan berat molekul zat non elektrolit yang dicari.
Hasil dan Pembahasan
Hasil percobaan menunjukkan asam asetat membeku pada temperatur 16,5 . Penambahan zat terlarut naftalena mengakibatkan titik beku larutan mengalami penurunan. Besarnya penurunan titik beku larutan naftalena dalam pelarut asam asetat sebanding dengan massa naftalena yang ditambahkan. Semakin banyak naftalena yang ditambahkan, penurunan titik beku semakin besar pula. Besarnya penurunan titik beku larutan naftalena dalam asam asetat pada penambahan sejumlah tertentu zat terlarut naftalena dapat dilihat dalam tabel 1.
Tabel 1. Titik beku asam asetat pada berbagai konsentrasi zat terlarut (naftalena) Massa naftalena (gram) Molalitas (molal) Tf ( ∆Tf
1,0179 0,504910714 14,5 2,0 2,0852 1,034325397 13,2 3,3 3,1394 1,557242063 10,5 6,0 4,2174 2,091964286 8,5 8,0 5,3065 2,63219246 7,0 9,5 6,3755 3,162450397 5,3 11,2
Naftalena merupakan hidrokarbon kristalin aromatik berbentuk padatan berwarna putih dengan rumus molekul C10H8. Senyawa ini bersifat volatil, mudah menguap walau dalam bentuk padatan. Naftalena memiliki berat molekul sebesar 128,17 gram/mol. Senyawa ini mudah larut dalam asam asetat sehingga dapat digunakan sebagai zat terlarut dalam percobaan ini. Tabel 1 menunjukkan penambahan zat terlarut naftalena akan mempengaruhi titik beku larutan sehingga titik beku larutan menjadi lebih kecil dari titik beku pelarut murninya. Semakin banyak naftalena yang ditambahkan, titik beku larutan semakin kecil atau penurunan titik beku semakin besar. Hal ini sesuai dengan Hukum Roult untuk larutan non elektrolit encer ideal.
= penurunan titik beku
Kf = konstanta penurunan titik beku m = molalitas larutan
Kf merupakan suatu tetapan yang menyatakan besarnya penurunan titik beku untuk satu molal larutan. Setiap pelarut memiliki harga Kf tertentu yang besarnya tidak sama satu sama lain. Harga Kf dapat juga dicari melalui percobaan, yaitu dengan mengukur besarnya penurunan titik beku pada berbagai konsentrasi zat terlarut yang ditambahkan. Karena
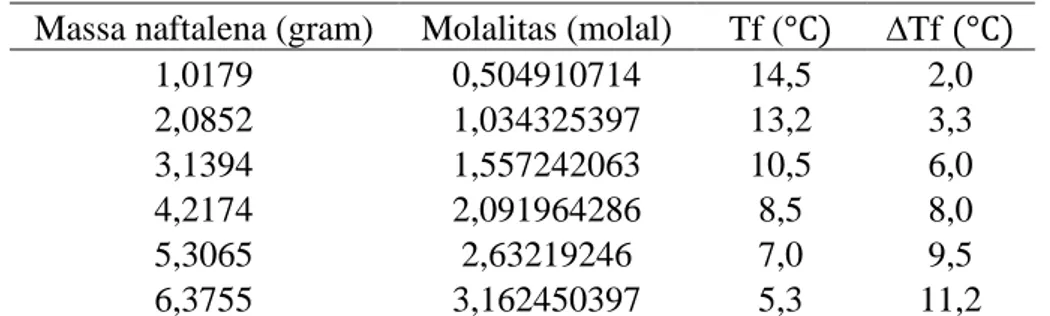
gradien Kf. Harga Kf asam asetat berdasarkan hasil percobaan dapat dilihat dalam gambar 2 berikut ini.
Gambar 2. Hubungan molalitas dengan
Terdapat perbedaan antara harga Kf asam asetat hasil percobaan dengan harga Kf asam asetat menurut teori. Harga Kf asam asetat berdasarkan hasil percobaan adalah 3,6338 dengan R2 sebesar 0,9906 sedangkan harga Kf asam asetat menurut teori adalah 3,9000. Kesalahan relatif dalam percobaan ini sebesar 6,8 %. Kesalahan ini dapat disebabkan oleh kesalahan dalam pembacaan skala nonius termometer.
Harga Kf yang diperoleh dari percobaan pertama, yaitu penurunan titik beku asam asetat pada penambahan zat terlarut yang telah diketahui secara pasti berat molekulnya dapat digunakan untuk menentukan berat molekul suatu zat non elektrolit yang belum diketahui. Percobaan yang dilakukan tidak berbeda dengan percobaan pertama, yaitu dengan melakukan pengukuran besarnya penurunan titik beku larutan tiap penambahan sejumlah tertentu suatu zat non elektrolit yang akan dicari berat molekulnya. Tabel 2 menunjukkan besarnya penurunan titik beku larutan pada penambahan sejumlah tertentu zat terlarut non elektrolit.
Tabel 2. Titik beku asam asetat pada berbagai konsentrasi zat terlarut (zat X) Massa zat X (gram) Tf ∆Tf
1,0646 14,8 1,7 y = 3,6338x R² = 0,9906 0 2 4 6 8 10 12 14 0 0,5 1 1,5 2 2,5 3 3,5 ∆Tf (oC)
2,1556 12,7 3,8
3,1576 10,5 6
4,2361 8,9 7,6
5,3079 7,6 8,9
6,4004 7 9,5
Berat molekul zat terlarut akan mempengaruhi besarnya penurunan titik beku larutan. Dengan massa yang sama, zat terlarut yang memiliki berat molekul lebih kecil akan memberikan efek penurunan titik beku yang lebih besar daripada zat terlarut yang memiliki berat molekul besar. Hal ini dikarenakan pada massa yang sama zat yang memiliki berat molekul lebih kecil memiliki jumlah partikel yang lebih banyak daripada zat yang memiliki berat molekul besar. Fakta ini sesuai dengan Hukum Roult yang menyatakan besarnya penurunan titik beku berbanding terbalik dengan berat molekul zat terlarut.
Dalam percobaan ini harga Kf telah diketahui dari percobaan sebelumnya karena pelarut yang digunakan dibuat sama. Massa pelarut dapat dihitung dengan cara mengalikan volumnya dengan massa jenisnya. Massa zat terlarut juga telah diketahui melalui penimbangan, sedangkan ∆Tf diperoleh secara langsung melalui pengukuran. Karena semua variabel telah diketahui nilainya maka harga berat molekul zat terlarut dapat ditentukan.
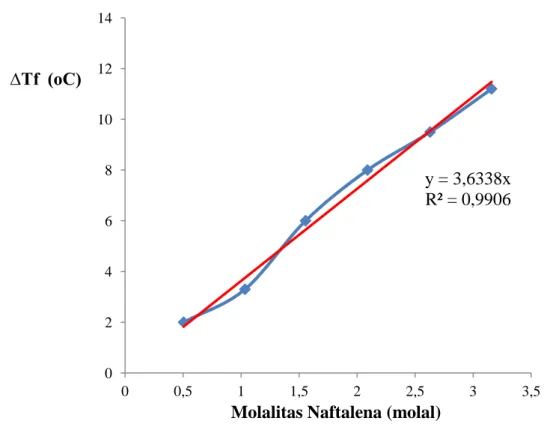
Setiap penambahan sejumlah tertentu zat terlarut non elektrolit kedalam asam asetat akan diperoleh harga ∆Tf. Semakin banyak zat terlarut yanga ditambahkan penurunan titik beku larutan semakin besar pula. Sesuai dengan Hukum Roult, jika dibuat grafik antara
versus maka akan dihasilkan garis linear dengan gradien berat
Gambar 3. Hubungan dengan
Harga berat molekul zat terlarut non elektrolit yang diperoleh melalui percobaan adalah 132,76 gram/mol dengan R2 sebesar 0,9909. Hasil yang diperoleh masih belum sesuai dengan yang diharapkan. Zat terlarut yang digunakan sebagai sampel dalam percobaan ini adalah glukosa monohidrat yang memiliki berat molekul 198,17 gram/mol. Kesalahan relatif dalam percobaan ini adalah sebesar 33%. Kesalahan yang terjadi sangat besar karena terjadi kesalahan yang fatal dalam pelaksanaan percobaan. Larutan yang dapat dihitung sifat koligatifnya menggunakan Hukum Roult adalah larutan encer ideal, zat terlarut yang digunakan harus larut sempurna dalam pelarutnya. Terjadi kesalahan dalam percobaan ini, zat terlarut yang digunakan (glukosa monohidrat) ternyata memiliki kelarutan yang rendah dalam pelarut (asam asetat) sehingga Hukum Roult tidak berlaku bagi larutan ini. Akibatnya, perhitungan menggunakan Hukum Roult tidak dapat digunakan untuk larutan ini.
Kesimpulan
Berdasarkan hasil percobaan dapat disimpulkan nilai tetapan penurunan titik beku (Kf) asam asetat adalah 3,6338 sedangkan berat molekul sampel zat non elektrolit dalam percobaan ini adalah 137,76 gram/mol.
y = 132,76x R² = 0,9909 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0 0,001 0,002 0,003 0,004 0,005 1/∆Tf mp/(mt . Kf . 1000)
Daftar Pustaka
Jupamahu, M.S.. 1980. Kimia Fisika 1. Bandung: Departemen Kimia ITB.
Mulyani, S dan Hendrawan. 2003. Kimia Fisika II. Bandung: Jurusan Pendidikan Kimia Universitas Pendidikan Indonesia.
Petruci, Ralph H. 1987. Kimia Dasar Prinsip dan Terapan Modern. Erlangga. Jakarta. Sachri, S dan Harun. 1982. Buku Tabel Ilmu Fisika dan Kimia. Bandung: Binacipta. Sukardjo. 2004. Kimia Fisika. Jakarta: Rineka Cipta.