LAPORAN KESETIMBANGAN KIMIA PENENTUAN TITK BEKU LARUTAN
Nama : Chanifah Dwi Happy Pratiwi NIM : 151810301010
Kelas/kelompok : Kesetimbangan kimia B / 2 Asisten : Diana Rolis
LABORATORIUM KIMIA FISIK JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
BAB 1. PENDAHULUAN
1.1 Latar Belakang
Larutan adalah campuran yang bersifat homogen antara molekul, atom ataupun ion dari dua zat atau lebih, disebut campuran karena susunannya atau komposisinya dapat berubah. Homogen maksutnya karena susunanya begitu seragam sehingga tidak dapat diamati adanya bagian-bagian yang berlainan, bahkan dengan mikroskop optis sekalipun. Sifat kimia suatu larutan bergantung pada suatu pelarut dan zat terlarut yang terlibat, sedangkan sifat fisikanya dapat diketahui berdasarkan titik beku, titik didih, tekanan uap, dan takanan osmosis. Tekanan uap larutan pada tiap temperatur selalu lebih rendah dari pada tekanan uap pelarut murni. Tekanan uap larutan lebih rendah dari pada tekanan uap pelarut murni pada titik beku nomal. Larutan supaya dapat membeku, haruslah didinginkan ke temperatur yang terletak di bawah titik beku normal.
Sifat koligatif larutan adalah sifat larutan yang tidak tergantung pada jenis zat terlarut tetapi tergantung pada banyaknya partikel zat terlarut dalam larutan. Sifat koligatif larutan dapat dibedakan menjadi dua macam, yaitu larutan elektrolit danlarutan nonelektrolit. Hal itu disebakan zat terlarut dalam larutan elektrolit bertambah jumlahnya karena terurai menjadi ion-ion sesuai dengan hal-hal tersebut. Maka sifat koligatif larutan nonelektrolit lebih rendah daripada koligatif larutan elektrolit. Koligatif larutan memiliki empat jenis sifat larutan yaitu penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmosis.
dinyatakan dengan fraksi mol. Penentuan untuk penurunan titik beku larutan membutuhkan adanya tetapan penurunan titik beku larutan.
Percobaan kali ini yaitu penentuan penurunan titik beku yang akan menjelaskan bagaimana cara menentukan penurunan titik beku dari berbagai larutan yang akan diuji dengan peralatan sederhana dibandingkan dengan penenteuan titik didih yang rumit. Praktikum ini juga dilakukan dengan harapan praktikan dapat menentukan bagaimana cara menentukan tetapan penurunan titik beku suatu larutan, selain itu dengan penurunan titik beku kita dapat menentukan berat molekul (BM) zat non volatil.
1.2 Tujuan Percobaan
a. Menentukan tetapan penurunan titik beku molal pelarut.
BAB 2. TINJAUAN PUSTAKA
2.1 Material Safety Data Sheet (MSDS) 2.1.1 Asam Asetat Glasial (CH3COOH)
Asam asetat merupakan salah satu asam karboksilat yang mudah ditemui. Asam ini memiliki nama lain asam etanoat, asam asetat glasial, asam metanakarboksilat, atau biasa disebut asam cuka. Asam asetat adalah senyawa yang berupa cairan jernih tidak berwarna, berbau tajam dan berwarna asam. Rumus molekul dari asam asetat ini adalah C2H4O2 atau biasa ditulis CH3COOH. Asam asetat mempunyai titik lebur 16,7 oC dan memiliki titik didih pada 118 oC. Asam ini memiliki massa jenis 1,05 g/mL. Massa jenis uap dari asam asetat adalah 2,07 g/L. Tekanan uap dari asam cuka adalah 11 mmHg pada suhu 20 oC dan 30 mmHg pada suhu 30 oC. Asam asetat termasuk zat yang stabil. Bahan ini sangat korosif dan menyebabkan luka bakar yang serius. Zat ini sangat berbahaya jika tertelan dan jika dihirup, lepaskan ke udara segar. Korban yang tidak bernapas, berikan pernapasan buatan dan apabila sulit bernapas, berikan oksigen (Anonim, 2017).
2.1.2 Akuades (H2O)
Akuades biasa disebut dengan air. Akuades yang mengenai mata, kulit, tertelan, atau juga terhisap tidak menimbulkan gejala serius atau tidak berbahaya. Penyimpanan sebaiknya di wadah tertutup rapat. Air dapat bereaksi keras dengan beberapa spesifik bahan. Akuades merupakan cairan tidak berwarna dan tidak berbau. Derajat keasaman (pH) dari akuades adalah netral yaitu 7,0. Titik didih dan titik lebur dari akuades berturut-turut adalah 100 oC dan 0 oC. Tekanan uap dari akuades pada suhu 20 oC adalah 17,5 mmHg. Massa jenis dari akuades adalah 1,00 g/cm3. Rumus formula dari akuades adalah H2O dengan berat molekul 18,0134 g/mol. Air memiliki tegangan permukaan yang besar disebabkan oleh kuatnya sifat kohesi antar molekul-molekul air Air adalah substansi kimia dengan rumus kimia H2O. Air dalam kesetimbangan dinamis antara fase cair dan padat pada kondisi standar, yaitu pada tekanan 100 kPa (1 bar) dan temperatur 273,15 K (0 °C) (Anonim, 2017).
2.1.3 Naftalen (C10H8)
Naftalen sangat sedikit terdispersi dalam air dingin. Identifikasi bahaya untuk naftalen yaitu sangat berbahaya dalam kasus menelan, berbahaya dalam kasus kontak mata (iritan), sedikit berbahaya dalam kasus kontak kulit. Naftalen yang terkontaminasi dengan mata segera basuh menggunakan air bersih dan mengalir selama 15 menit. Naftalen yang terkontaminasi dengan kulit segera basuh menggunakan air bersih dan mengalir selama 15 menit dan bila perlu gunakan desinfektan. Naftalen ayng kontak dengan inhalasi segera pindahkan korban menuju tempat dengan udara yang segar dan terbuka (Anonim, 2017). 2.1.4 Natrium Klorida (NaCl)
Natrium klorida memiliki rumus molekul NaCl. Natrum klorida mempunyai massa molar 58,44 gram/mol. Kerapatan atau massa jenisnya adalah 2,16 gram/cm3 sedangkan titik leleh dan titik didihnya yaitu berturut-turut 801 oC dan 1465 oC. Garam natrium klorida memiliki kelarutan dalam air sebesar 35,9 gram/100 mL air pada suhu 25 oC. Natrium klorida memiliki tingkat osmotik yang tinggi Senyawa berbahaya dalam kasus kontak kulit (iritan), menelan, dan inhalasi. Natrium klorida yang terkontaminasi dengan mata segera basuh menggunakan air bersih dan mengalir selama 15 menit. Natrium klorida yang terkontaminasi dengan kulit cukup dibasuh dengan air bersih dan bila perlu gunakan desinfektan atau sabun untuk mencegah terjadinya iritasi kulit. Natrium klorida yang kontak dengan inhalasi tidak berbahay atau tidak menimbulkan efek samping. Natrium klorida sebaiknya disimpan di dalam wadah yang tertutup dan jauh dari dari sinar matahari. (Anonim, 2017).
2.2 Dasar Teori
Sifat koligatif larutan dapat dibedakan menjadai dua macam, yaitu sifat larutan nonelektrolit dan elektrolit. Hal itu disebabkan zat terlarut dalam larutan elektrolit bertambah jumlahnya karena terurai menjadi ion-ion, sedangkan zat terlarut pada larutan nonelektrolit jumlahnya tetap karena tidak terurai menjadi ion-ion, sesuai dengan hal-hal tersebut maka sifat koligatif larutan nonelektrolit lebih rendah daripada sifat koligatif larutan elektrolit. Larutan merupakan suatu campuran yang homogen dan dapat berwujud padatan, maupun cairan. Akan tetapi larutan yang paling umum dijumpai adalah larutan cair, dimana suatu zat tertentu dilarutkan dalam pelarut berwujud cairan yang sesuai hingga konsentrasi tertentu (Sastrohamidjojo, 2001).
Larutan ideal merupakan larutan yang mengikuti hukum roult. Larutan ideal memiliki molekul zat terlarut dan molekul pelarut yang tersusun sembarang, tidak terjadi efek kalor pada pencampuran dan jumlah volume sebelum pencampuran sama dengan volume pencampurannya. Larutan yang tidak memenuhi hukum Roult disebut larutan tak ideal (Wiryoatmojo, 1998).
Peralihan wujud suatu zat ditentukan oleh suhu dan tekanan, contohnya air pada tekanan 1 atm mempunyai titik beku 0ºC. Air mengandung zat terlarut yang sukar menguap (misalkan gula), maka titik bekunya lebih kecil dari 0ºC. Titik beku larutan lebih rendah dari pada titik beku air murni. Perbedaan itu disebut penurunan titik beku (ΔTf). Besarnya penurunan titik beku larutan bergantung pada konsentrasi zat terlarut. Titik beku larutan dapat diketahui dengan mencari titik beku pelarut murni dikurangi dengan penurunan titik bekunya. Pengukuran penurunan titik beku, seperti halnya peningkatan titik didih, dapat digunakan untuk menentukan massa molar zat yang tidak diketahui
(Syukri, 1999).
Titik beku larutan adalah temperatur pada saat larutan setimbang dengan pelarut padatnya. Larutan akan membeku pada temperatur lebih rendah dari pelarutnya. Pada setiap saat tekanan uap larutan selalu lebih rendah dari pada pelarut murni. Sifat penurunan titik beku bergantung pada jumlah molekul zat terlarut yang ada dan tidak bergantung pada ukuran atau berat molekul zat terlarut. Penentuan penurunan titik beku lebih mudah dilaksanakan daripada untuk menentukan kenaikan titik didih. Dengan peralatan yang lebih sederhana dan dapat dilakukan dengan lebih mudah. Pada suhu tinggi beberapa pelarut bersifat kurang stabil sehingga menyulitkan pengukuran. Pada setiap saat tekanan uap larutan selalu lebih rendah dari pada pelarut murni.
Kf = tetapan penurunan titik beku molal atau tetapan krioskopik m = kemolalan
1. Pada tekanan tetap, penurunan titik beku suatu larutan encer berbanding lurus dengan konsentrasi massa
2. Larutan encer semua zat terlarut yang tidak mengion, dalam pelarut yang sama, dengan konsentrasi molal yang sama, mempunyai titik beku yang sama, pada tekanan yang sama
(Achmad, 1996).
Penurunan titik beku analog dengan peningkatan tiitik didih. Pelarut dalam larutan berada dalam kesetimbangan dengan tekanan tertentu dari uap pelarut. Jika zat terlarut ditambahkan ke dalam larutan, tekanan uap pelarut akan turun dan titik beku juga akan turun
Penurunan titik beku berbanding lurus dengan perubahan tekanan uap. Untuk konsentrasi zat terlarut yang cukup rendah, penurunan titik beku berkaitan dengan molalitas. Pengukurannya dapat digunakan untuk menentukan massa molar zat yang tidak diketahui (Oxtoby, 2001).
Pada tahun 1880-an kimiawan Prancis F. M. Raoult mendapati bahwa melarutkan suatu zat terlarut mempunyai efek penurunan tekanan uap dari pelarut. Banyak penurunan tekanan uap (DP) terbukti sama dengan hasil kali fraksi mol terlarut (XB) dan tekanan uap pelarut murni (PAo), yaitu:
DP = XB.PAo………(2.2)
Dua larutan memiliki komponen, XA + XB = 1, maka XB = 1-XA. Juga apabila tekanan uap pelarut di atas larutan dilambangkan PA, maka P = PAo-PA. Sehingga dapat ditulis kembali menjadi:
PAo - PA = (1-XA) PAo………(2.3)
Suatu zat pelarut yang didalamnya dimasukkan zat lain yang tidak mudah menguap (non volatil), maka tenaga bebas pelarut tersebut akan turun. Penurunan tenaga bebas ini mengikuti persamaan Nernst.
Gº1 - Gº = RT ln x……… (2.4) Gº1 - Gº = Penurunan tenaga bebas pelarut
R = Tetapan gas murni umum T = suhu mutlak
X = konsentrasi zat x
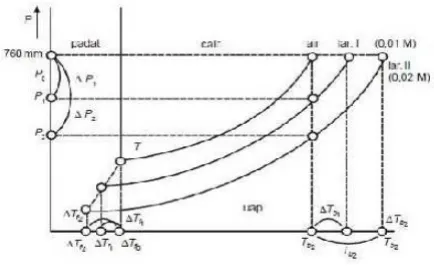
Diagram fase suatu zat memperlihatkan daerah-daerah tekanan dan temperatur dimana berbagai fase bersifat stabil secara termodinamis. Batas-batas antara daerah-daerah itu yaitu batas-batas fase yang memperlihatkan nilai-nilai P dan T dimana dua fase berada dalam kesetimbangan. Tekanan uap yang berada dalam kesetimbangan dan fase embun pada temperatur tertenu disebut tekanan uap zat tersebut pada temperatur itu karena batas-batas fase antara cairan dan uap dan antara padatan dan uap memperlihatkan bagaimana tekanan uap dua fase embun bervariasi berdasarkan temperatur (Atkins, 1990)
Penambahan zat non volati ke dalam larutan maka akan terjadi penurunan energi bebas. Penurunan energi bebas ini akan menurunkan kemampuan zat pelarut untuk berubah menjadi fasa uapnya, sehingga tekanan uap pelarut dalam larutan akan lebih rendah bila dibandingkan dengan tekanan uap pelarut yang sama dalam keadaan murni. Pengaruh penurunan tekanan uap terhadap titik beku larutan mudah dipahami dengan bantuan diagram fasa sebagai berikut.
Gambar 2.1. Diagram fasa
dalam diagram tersebut terlihat bahwa titik beku larutan Tf lebih rendah dibandingkan dengan titik beku pelarut murni Tof. Dari uraian di atas jelas bahwa penurunan titik beku larutan besarnya tergantung pada fraksi mol pelarut:
Tf = Tof -Tf………(2.5)
BAB 3. METODOLOGI PERCOBAAN
3.1 Alat dan Bahan 3.1.1 Alat
- Alat sensor suhu - Batang pengaduk - Gelas beker - Laptop
- Neraca analitik - Pipet volum - Termometer - Pipet tetes - Pipet volume - Pipet mohr - Tabung reaksi 3.1.2 Bahan
- Akuades
- Asam cuka glasial - Es batu
3.2 Prosedur Kerja 3.2.1 Skema Alat
Gambar 1. Desain alat penentuan penurunan titik beku Keterangan:
A. Sensor suhu
B. Gelas beaker 100 mL C. Pengaduk
D. Gelas beaker 250 mL E. Gelas beaker 500 mL 3.2.2 Persiapan
- diambil sebanyak 20 mL kemudian diisikan ke dalam tabung gelas B - diisi tabung gelas E dengan campuran air, garam, dan es secukupnya - diisi tabung D dengan air secukupnya
Asam Cuka Glasial
3.2.3 Penentuan tetapan penurunan titik beku molal
-- dimasukkan kedalam tabung B kemudian didinginkan - dicatat suhunya pada termometer A tiap-tiap menit
- diamati pelarut (sudah membeku atau belum) ketika suhu suda kelihatan tetap
- diulangai percobaan A dan B sekali lagi - ditentukan titik beku pelarut murni To
f
- dibiarkan pelarut mencair kembali
- ditambahkan Naftalen (BM = 128) sebagai zat pelarut - dilakukan hal yang sama seperti percobaan di atas - dicatat Tof (titik beku larutan)
- ditentukan ∆Tf
3.2.4 Penentuan zat X
- dibiarkan mencair kembali kemudian - ditambahkan 2 gram zat X
- diamati perubahan suhunya - dihitung ∆Tf nya
- dihitung BM zat X Asam cuka glasial 20 ml
Larutan A
Larutan A
BAB 4. HASIL DAN PEMBAHASAN
4.1.2 Penentuan Berat Molekul Zat X
No Data Hasil
rendah untuk mencapai susuanan kristal padat dari fase cairnya sehingga akan menyebabkan terjadinya penurunan titik beku suatu larutan yang kedalamnya ditambahkan zat non volatil atau tidak mudah menguap.
Penurunan titik beku termasuk ke dalam sifat koligatif larutan, dimana sifat ini tidak bergantung pada jenisnya namun pada jumlahnya. Sifat koligatif merupakan suatu sifat larutan yang hanya dipengaruhi oleh jumlah zat dan tidak dipengaruhi oleh jenisnya. Penurunan titik beku dari suatu larutan berkaitan dengan sifat non volatil dari zat terlarut dari larutan tersebut. Sifat non volatil dari zat terlarut menyebabkan zat terlarut tersebut tidak berkontribusi terhadap uapnya. Larutan akan membeku ketika temperatur larutan tersebut lebih rendah dari titik beku larutan murninya. Percobaan penurunan titik beku pada percobaan ini menggunakan sensor suhu yang telah dihubungkan dengan komputer yang dilengkapai dengan aplikasi software kimia. Pengukuran dapat dilakukan dengan dengan menekan tombl run yang artinya jalan untuk memulai pengukuran dan tombol stop pada komputer untuk menghentikan pengukuran suhu tersebut. Aplikasi software kimia tersebut dapat menentukan besarnya suhu pada larutan yang dilengkapi dengan waktu yang tergambar dalam bentuk grafik. Sensor suhu setelah digunakan untuk mengukur titik beku larutan maka harus dicuci dengan akudes supaya tidak mempengaruhi pengukuran titik beku larutannya. Sensor suhu dapat diangkat kembali pada saat terdapat garis lurus pada grafik artinya telah menunjukkan pada suhu yang konstan. Asam cuka glasial pada saat pengukuran penurunan titik beku larutannya menunjukkan suhu yang menurun drastis. Suhu tersebut menurun karena asam cuka glasial ditempatkan pada suhu yang dingin sehingga suhu mengalami penurunan.
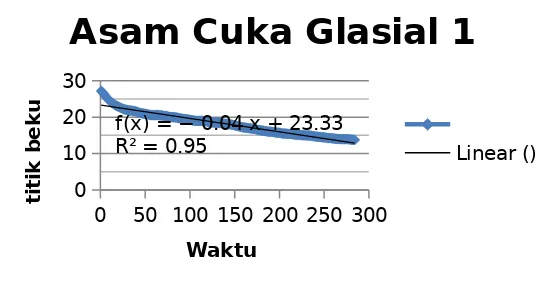
yang diperoleh ditunjukkan dari garfik yang sudah konstan. Titik beku yang diperoleh dari asam cuka glasial ini yaitu 16° C sedangakn titik leburnya yaitu 16,6° C . Grafik yang
dihasilkan dari percobaan ini yaitu sebagai berikut :
0 50 100 150 200 250 300
4.1 Grafik penurunan titik beku asam cuka glasial 1
Grafik tersebut menunjukkan terjadinya penurunan titik beku. Grafik yang dihasilkan linear dimana semakin bayak waktu yang digunakan untuk mengukur nilai titik beku tersebut maka nilai titik beku tersebut semakin turun samapai tercapainya nilai konstan. Suhu tersebut menurun karena asam cuka glasial ditempatkan pada suhu yang dingin sehingga suhu mengalami penurunan. Penurunan suhu yang terus-menerus menyebabkan asam cuka glasial menjadi beku. Asam cuka glasial menjadi beku karena telah mencapai titik bekunya yaitu secara teori sebesar 16,7oC. Asam cuka glasial membeku pada suhu sekitar 15,25oC. Titik beku asam cuka glasial pada praktikum lebih rendah daripada titik beku secara teori. Hal itu dikarenakan asam cuka glasial yang digunakan telah mengalami reaksi dengan zat lain, sehingga apabila asam cuka tersebut telah bereaksi dengan zat lain maka titik bekunya akan berubah menjadi lebih rendah
0 50 100 150 200 250 300
4.2 Grafik penurunan titik beku asam cuka glasial 2
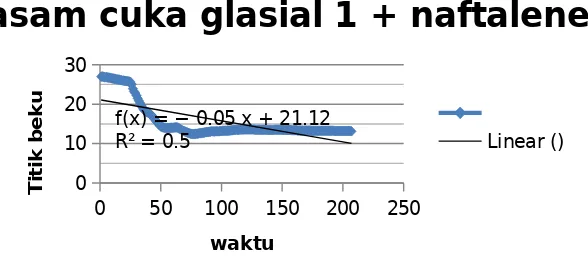
Grafik yang dihasilkan dari percobaan kedua ini juga menunjukkan bahwa terjadi penurunan titik beku larutan sehingga grafik yang dihasilkan berbentuk linear. Percobaan selanjutnya dilakukan pengukuran titik beku pelarut yang ditambahkan dengan naphtalen. Napthalenen merupakan Senyawa yang bersifat volatil atau mudah menguap walau dalam bentuk padatan. Naftalena adalah salah satu komponen yang termasuk benzena aromatik hidrokarbon, tetapi tidak termasuk polisiklik. Penambahan naftalen dapat menurunkan titik beku, hal tersebut yang menyebabkan titik beku asam cuka glasial tidak sesuai dengan literatur. Pengukuran titik beku asam cuka glasial ini dilakukan duplo atau dua kali pengulangan. Tujuan dari duplo tersebut adalah untuk meningkatkan hasil yang presisi, sehingga hasil praktikum yang diperoleh dapat sesuai dengan teori. Nafthalene yang digunakan pada percobaan ini sebanyak 1 gram. Penambahan Naftalen ini menyebabkan titik beku larutan juga turun. Grafik yang dihasilkan dari percobaan ini yaitu :
0 50 100 150 200 250
asam cuka glasial 1 + naftalene
Linear ()
4.2 Grafik Penurunan titik beku setelah penambahan naftalene
untuk mengukur suhu tersebut menyentuh dinding gelas bekernya sehingga hasilnya didapatkan terjadinya penurunaan titik beku yang kurang stabil sehingga tidak grafik yang dihasilkan tidak berkurang. Titik beku yang diukur ketika konstan menunjukkan angka 14,125° C. Penurunan titik beku ini menyebabkan naftalen membeku kembali.
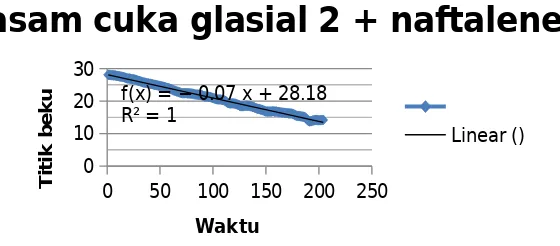
Percobaan selanjutnya yaitu dilakukan pengukuran titik beku larutan terhadap asam cuka glasial 2 yang sudah ditambahkan dengan naftalen. Campuran asam cuka glasial dan naftalen dalam gelas beaker diaduk hingga larut. Tujuan dari pengadukan tersebut adalah untuk mempercepat reaksi atau supaya naftalen cepat larut dalam asam cuka glasial tersebut. Percobaan kedua ini menghasilkan titik beku sebesar 14,125°C. Hasil ini menunjukkan bahwa percobaan 1 dan 2 menghasilkan titik beku yang sama meskipun pada pengukuran yang pertama terjadi human error. Grafik yang dihasilkan pada percobaan ini yaitu sebagai berikut :
asam cuka glasial 2 + naftalene
Linear ()
4.3 Grafik Penurunan titik beku setelah penambahan naftalene 2
Grafik yang dihasilkan di atas berbentuk linier sehingga hal ini menujukkan bahwa terjadi penurunan titik beku yang stabil. Titik beku pada saat asam cuka glasial ditambah naftalen dan sebelum ditambah naftalen memiliki perbedaan. Titik beku pada saat asam cuka glasial ditambahkan naftalen lebih rendah dibandingkan titik beku asam cuka glasial sebelum ditambah naftalen. Hal tersebut dikarenakan penambahan suatu zat dapat menurunkan titik bekunya . Titik beku rata-rata naftalen dari percobaan 1 dan 2 yaitu sebesar 287,125 K. Hasil ini menunjukkan bahwa titik beku larutan naftalen lebih rendah daripada titik beku pelarut murni yaitu asam cuka glasial. Titik beku pelarut murni yaitu sebesar 289,35 K. Hasil percobaan tersebut sesuai dengan teori, dimana dengan adanya penambahan suatu zat terlarut yang non volatil pada pelarut murni, maka titik beku dari larutan akan lebih rendah atau terjadi penurunan titik beku.
Penurunan titik beku yang dihasilkan adalah sebesar 2,225 K. Nilai dari penurunan titik beku ini kemudian digunakan untuk perhitungan tetepan penurunan titik beku (Kf¿
naftalen, penurunan titik beku serta berat naftalen. Nilai Kf molal asam asetat glasial sebesar 5,975 g.K/mol. Nilai Kf berdasarkan literatur adalah 3,9 g.mol-1.K. Hasil yang diperoleh dari percobaan berbeda dengan litetarur. Perbedaan tersebut kemungkinan disebabkan oleh pendinginan yang terlalu cepat pada larutan naftalen dan jumlah naftalen yang digunakan kurang dari jumlah yang ditentukan yang disebabkan karena masih ada naftalen yang tertinggal dalam aluminium foil yang digunakan sebagai alas untuk menimbang, sehingga mempengaruhi besarnya penurunan titik beku dan nilai Kf.
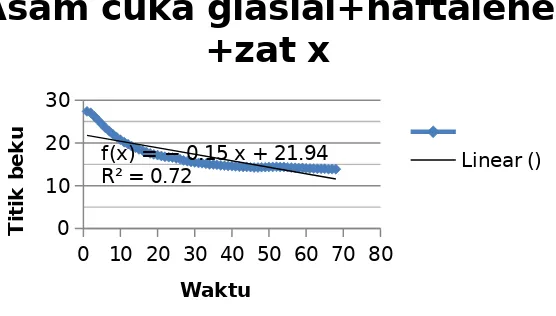
Percobaan selanjutnya yaitu pengukuran titik beku larutan setelah ditambahkannya zat X. Percobaan ini dilakukan dengan mencairkan kembali pelarut yang membeku dengan ditambahkannya naftalen. Proses pencairan tersebut dilakukan dengan menempelkan tisu yang dibasahi dengan air pada dinding gelas tersebut hal ini dilakukan untuk menaikkan suhu dari larutan tersebut sehingga dapat mencair. Campuran asam cuka glasial dan naftalen yang diukur titik bekunya dicairkan terlebih dahulu, kemudian ditambahkan zat X. Pengukuran penurunan titik beku tersebut dilakukan hal yang sama seperti pada pengukuran penurunan titik beku sebelumnya. Suhu pada campuran asam cuka glasial, naftalen dan zat X mengalami penurunan titik bekunya, artinya larutan tersebut membeku pada suhu yang lebih rendah dibandingkan pada suhu sebelum ditambahkan zat X. Larutan yang sudah mencair kemudian ditambahkan zat x sebanyak 2 gram kemudian dientukan titik beku larutannya. Pengukuran titik beku juga dilakukan dengan cara yang sama seperti sebelumnya. Titik beku yang dihasilkan pada pecobaaan ini konstan pada suhu 14,375° C.
Grafik yang dihasilkan pada percobaan ini yaitu sebagai berikut :
0 10 20 30 40 50 60 70 80
4.1 Grafik Penurunan titik beku setelah penambahan zat x
Percobaan selajutnya dilakukan penambahan zat x pada pelarut kedua yang sudah mencair kembali. Titik beku yang dihasilkan pada percobaan ini yaitu 14,437° C. Titik
BAB 5. PENUTUP
5.1 Kesimpulan
Adapun kesimpulan dalam praktikum penentuan titik beku larutan adalah sebagai beikut:
a. Tetapan penurunan titik beku asam cuka glasial adalah 5,98mol Kg .
b. Berat molekul zat X adalah sebesar 294,93 g/mol.
5.2. Saran
DAFTAR PUSTAKA
Achmad, H. 1996. Kimia Larutan. Bandung: PT Citra Aditya Bakti. Anonim. 2017. Material Safety Data Sheet of Aquades.[serial online].
http:www.sciencelab.com/msds.php?msds id: 99276742.(diakses 28 April 2017).
Anonim. 2017. Material Safety Data Sheet of Acetic Acid. [serial online].
http:www.sciencelab.com/msds.php?msds id: 9927421.(diakses 28 April 2017).
Anonim. 2017. Material Safety Data Sheet of Naphtalene . [serial online].
http:www.sciencelab.com/msds.php?msds id: 9927326.(diakses 28 April 2017).
Anonim. 2017. Material Safety Data Sheet of Sodium chloride. [serial online].
http:www.sciencelab.com/msds.php?msds id: 9927421.(diakses 28 April 2017).
Atkins, P.W. 1990. Kimia Fisika jilid 1 edisi keempat. Jakarta: Erlangga. Bird, T. 1993. Kimia Untuk Universitas. Jakarta: PT Gramedia Pustaka Utama. Oxtoby. 2001. Prinsip-prinsip Kimia Modern jilid 1. Jakarta: Erlangga.
Petrucci, R.,H. 1984. Kimia Dasar Prinsip dan Terapan Modern Edisi Keempat Jilid 2.
Jakarta: Erlangga
Sastrohamidjojo,H. 2001. Kimia Dasar. Yogyakarta: UGM Press. Syukri, S. 1999. Kimia Dasar. Bandung: ITB.
Tim Penyusun. 2017. Penuntun Praktikum Kimia Fisik II. Jember: Universitas Jember. Wiryoatmojo. 1998. Kimia Fisik 1. Jakarta: Depdikbud Direktorat Jendral Pendidikan
LAMPIRAN
1. Penentuan Nilai Kf
Nilai Tof (asam cuka)
Tof = 16oC+16,7oC 2 = 16,35 oC = 289,35 K
Nilai Tf (naftalen)
Tf = 14,125oC+214,125oC = 14,125 oC
= 287,125 K
ΔTf = Tof - Tf
= 289,35 K – 287,125 K = 2,225 K
Massa asam cuka
ρasam cuka=Vwasam cuka
asam cuka
wasamcuka=¿ ρasam cuka×Vasam cuka wasamcuka=1,049mL ×g 20mL wasamcuka=20,98gram
Kf
Kf=wasamcuka1000× Mr× wnaftalen×∆ Tf
naftalen
Kf=
20,98g ×128mol ×g 2,225K
1000×1,0g
1,868g Mrzat X−1g Mrzat X=256 g
2
mol
0,868g Mrzat X=256 g
2
mol
Mrzat X=
256molg2 0,868g