LAPORAN PRAKTIKUM KIMIA FISIK PENENTUAN TITIK BEKU LARUTAN
Nama : Luki Aprilliya S
NIM : 121810301026
Kelompok : 6
Asisten : Eka Yustiana
LABORATORIUM KIMIA FISIK JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
BAB 1. PENDAHULUAN
1.1 Latar Belakang
Larutan adalah campuran homogen yang merupakan komponen penyusun (zat terlarut dan zat terlarut) sulit untuk dipisahkan dengan cara fisik. Larutan memiliki jumlah pelarut selalu lebih besar dari zat terlarutnya. Sifat koligatif larutan merupakan salah satu sifat larutan yang dipengaruhi oleh penambahan zat lain yang tidak tergantung pada jenis zatnya namun pada jumlah partikel-partikelnya. Sifat koligatif larutan merupakan salah satu sifat larutan yang dipengaruhi oleh penambahan zat lain yang tidak tergantung pada jenis zatnya namun pada jumlah partikel-partikelnya
Titik beku adalah suhu yang mana tekanan uap cairan sama dengan tekanan uap padatannya. Titik beku larutan lebih rendah daripada titik beku pelarut murni. Hal ini dikarenakan zat pelarutnya harus membeku telebih dahulu dan kemudian baru zat terlarutnya yang akan membeku, sehingga larutan akan membeku lebih lama dibandingkan dengan pelarut. Titik beku suatu cairan akan berubah jika tekanan uap berubah, hal ini terjadi disebabkan oleh masuknya suatu zat terlarut, yaitu jika cairan tersebut tidak murni maka titik bekunya berubah (nilai titik beku akan berkurang). Titik beku pelarut murni berada pada suhu 0 C , tapi dengan adanya zat terlarut maka titik beku larutan tidak ini
tidak akan sama dengan 0 C, tetapi akan turun dibawah 0 C. Hal ini menunjukkan
bahwa penambahan zat terlarut ke dalam zat pelarut murni menyebabkan terjadinya penurunan titik beku.
Penentuan titik beku merupakan suatu proses atau cara yang dilakukan untuk mengetahui nilai penurunan titik beku larutan. Titik beku larutan adalah temperatur pada saat kristal pertama dari pelarut murni mulai terbentuk dalam keseimbangan dengan larutan. Sedangkan penurunan titik beku (∆Tf) adalah perbedaan titik beku akibat adanya partikel-partikel zat terlarut. Penurunan titik beku zat cair terjadi bila suhu diturunkan, sehingga jarak antarpartikel sangat dekat satu sama lain dan membuat gaya tarik menarik antarmolekul sangat kuat.
1.2 Tujuan Praktikum
- Menetukan tetapan penurunan titik beku molal pelarut
BAB 2. TINJAUAN PUSTAKA
2.1 MSDS (Material Safety Data Sheet) 2.1.1 Asam Asetat
Asam asetat merupakan senyawa organik yang rumus molekulnya CH3COOH. Nama IUPAC dari asam asetat adalah asam etanoat. Massa molar asam asetat yaitu 60,05 g/mol. Asam asetat ini berupa cairan yang tidak berwarna dan bersifat higroskopis. Asam asetat ini merupakan asam karboksilat yang sederhana dan memiliki titik didih sebesar 118,1 0C dan titik lebur sebesar 16,5 0C. Larutan asam asetat dalam air merupakan sebuah asam lemah, artinya hanya terdisosiasi sebagian menjadi ion H+ dan CH3COO-. Asam asetat merupakan pereaksi kimia dan bahan baku industri yang penting. Asam asetat digunakan dalam produksi polimer seperti polietilena tereftalat, selulosa asetat, dan polivinil asetat, maupun berbagai macam serat dan kain. Dalam industri makanan, asam asetat digunakan sebagai pengatur keasaman (Anonim, 2015).
2.1.2 Naftalena
Naftalena adalah hidrokarbon kristalin aromatik berbentuk padatan berwarna putih dengan rumus molekul C10H8 dan berbentuk dua cincin benzena yang bersatu. Senyawa ini bersifat volatil, mudah menguap walau dalam bentuk padatan. Uap yang dihasilkan bersifat mudah terbakar. Naftalena paling banyak dihasilkan dari destilasi tar batu bara, dan sedikit dari sisa fraksionasi minyak bumi. Sifat fisika lain dari naftalena yaitu massa molar sebesar 125,17 g/mol dengan kepadatan sebesar 1,14 g/cm3. Naftalena dapat larut dalam air sekitar 30 mg/L dan titik didih serta titik leburnya adalah sebesar 218 oC dan 80,26 oC (Anonim, 2015).
2.1.3 Aquades
Aquades disebut juga Aqua Purificata (air murni) H2O dengan. Air murni adalah air yang dimurnikan dari destilasi. Satu molekul air memiliki dua hidrogen atom kovalen terikat untuk satu oksigen. Aquades merupakan cairan yang jernih, tidak berwarna dan tidak berbau. Aquades juga memiliki berat molekul sebesar 18,0 g/mol dan PH antara 5-7. Rumus kimia dari aquades yaitu H2O. Titik didih aquades sebesar 1000C dan titik bekunya sebesar 00C. Ionisasi aquades menghasilkan ion H3O+ dan ion OH- (Sarjoni, 2003).
Aquades ini memiliki allotrop berupa es dan uap. Senyawa ini tidak berwarna, tidak berbau dan tidak meiliki rasa. Aquasdes merupakan elektrolit lemah. Air dihasilkan dari pengoksidasian hidrogen dan banyak digunakan sebagai bahan pelarut bagi kebanyakan senyawa dan sumber listrik (Sarjoni, 2003).
2.1.4 Garam dapur
2.2 Dasar Teori
Larutan merupakan suatu campuran yang homogen dan dapat berwujud padatan, maupun cairan. Larutan yang paling umum dijumpai adalah larutan cair, dimana suatu zat tertentu dilarutkan dalam pelarut berwujud cairan yang sesuai hingga konsentrasi tertentu (Brady, 2003).
Penurunan energi bebas ini mengikuti persamaan Nernst.
Go1 - Gox = RT ln x ………(1) Go1 - Gox = Penurunan energi bebas pelarut
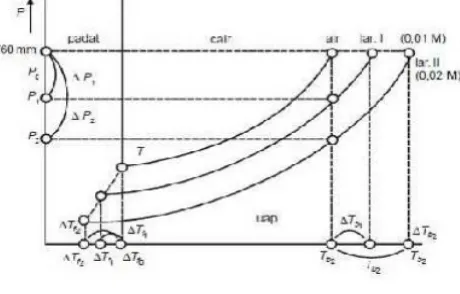
dimana, R= tetapan gas umum, T= suhu mutlak, x= fraksi mol pelarut dalam larutan. Penurunan energi bebas ini akan menurunkan kemampuan zat pelarut untuk berubah menjadi fasa uapnya, sehingga tekanan uap pelarut dalam larutan akan lebih rendah bila dibandingkan dengan tekanan uap pelarut yang sama dalam keadaan murni. Pengaruh penurunan tekanan uap terhadap titik beku larutan mudah dipahami dengan bantuan diagram fasa gambar 2.1.
Gambar 2.1 Diagram fasa
dalam diagram ini terlihat bahwa titik beku larutan Tf lebih rendah dibandingkan dengan titik beku pelarut murni T0f. Dari uraian di atas jelas bahwa penurunan titik beku larutan besarnya tergantung pada fraksi mol pelarut:
Tf = T0f -Tf………(2)
(Tim Kimia Fisik, 2014).
Titik beku adalah suhu pada perpotongan garis tekanan tetap pada 1 atm dengan kurva peleburan. Sedangkan titik didih adalah suhu pada perpotongan garis tekanan tetap pada 1 atm dengan kurva penguapan. Penurunan titik beku dan peningkatan titik didih, sama seperti penurunan tekanan uap sebanding dengan konsentrasi fraksi molnya (Pettruci, 1987).
Suhu dimana fase padat dan fase cair suatu zat dapat berada dalam keadaan seimbang pada tekanan satu atmosfer disebut titik beku cairan. Titik beku larutan lebih rendah daripada titik beku pelarutnya yang murni. Perbedaan titik beku larutan dan pelarut murninya (ΔTf) disebut penurunan titik beku (Arifin, 1993).
ΔTf=(titik beku pelarut – titik beku larutan) ¿K f × m………..(3)
Proses pembekuan suatu zat cair terjadi bila suhu diturunkan sehingga jarak antar partikel sedemikian dekat satu sama lain dan akhirnya bekerja gaya tarik menarik antar molekul yang sangat kuat dan partikel-partikelnya akan tersusun lebih rapat dan sulit untuk dipecah. Adanya partikel-partikel dari zat terlarut akan menghasilkan proses pergerakan molekul-molekul pelarut terhalang, akibatnya untuk mendekatkan jarak antar molekul diperlukan suhu yang lebih rendah. Perbedaan suhu adanya partikel-partikel zat terlarut disebut penurunan titik beku. Ketika zat non volatil ditambahkan ke dalam larutan maka akan terjadi penurunan titik beku larutan tersebut (Kusmawati, 1999).
Zat terlarut harus diketahui agar bisa ditentukan ketergantungan sifat koligatif larutan dengan konsentrasinya. Susunan kimia zat terlarut tidak menjadi masalah, tetapi konsentrasi partikel zat terlarutnya yang penting. Oleh karena itu dapat menggunakan gejala-gejala tersebut untuk menghitung massa molekul zat. Cara untuk mendapatkan massa molekul suatu zat dalam percobaan harus ditentukan dua macam nilai yaitu, massa dari zat dan jumlah molnya. Sesudah diketahui maka perbandingan antara jumlah gram dan molnya merupakan harga dari massa molekul zat (BM). Jika harga penurunan titik beku ∆Tb, serta konstanta penurunan titik beku diketahui maka dapat dihitung molalitas zat dalam larutan dengan menggunakan persamaan:
m=∆ Tb/Kb………(4)
(Brady, 1999).
Larutan yang mengandung zat terlarut non volatil dapat menurunkan tekanan uap pelarut. Semakin tinggi konsentrasinya maka akan semakin besar pula penurunan tekanan uapnya. Biasanya bila berbicara tentang titik beku atau titik didih, orang sepakat bahwa itu berlaku untuk kondisi 1 atm. Istilah yang lebih eksak untuk titik itu adalah titik beku dan titik beku normal. Kita dapat mempunyai harga-harga Tf dan Tb untuk sejumlah zat dalam lampiran. Metode untuk menduga Tb biasanya kurang baik. Seperti yang diungkapkan oleh Bondi sfus lebih besar bila molekul dapat memiliki sejumlah orientasi dalam fase cair dibanding dalam wujud padatnya. Jadi sfus lebih kecil untuk molekul sferik, kauk dan Tf lebih tinggi dari pada untuk molekul berukuran sama yang anisometrik dan lentur. Bagaimanapun Eston mengusulkan penggunaan metode interpolasi untuk mengkorelasikan titik-titik beku pada deret homolog. Deret yang seperti itu, Eston membuat grafik (Tb.Tf) / Tf Vs berat molekul, kecuali untuk anggota pertama deret grafik tersebut menghasilkan sebuah garis lurus (Reis, 1999).
Perubahan suhu berbanding lurus dengan perubahan tekanan uap untuk konsentrasi zat terlarut yang rendah, penurunan titik beku berkaitan dengan molalitas total melalui persamaan berikut ini:
Tf = Tfo
- Tf = Kf m………(5)
Asam Cuka Glasial
Hasil
BAB 3. METODOLOGI PERCOBAAN 3.1 Alat dan Bahan
3.1.1 Bahan
- Asam cuka glasial - Naftalen
- Zat X
- Garam dapur - Es batu - Akuades
3.1.2 Alat
- Gelas beaker - Erlenmeyer - Gelas ukur 100 cc - Stopwatch
- Batang pengaduk - Tabung gelas
3.2 Skema Kerja 3.2.1 Persiapan
- Dimasukkan ke dalam gelas E secukupnya.
- Dimasukkan air secukupnya pada tabung D.
- Diambil pelarut sebanyak 20 mL dan dimasukkan ke dalam tabung gelas B.
- Digunakan pelarut asam cuka glasial.
3.2.2 Penentuan Tetapan Penurunan Titik Beku Molal Air, es, garam
BAB 4 HASIL dan PEMBAHASAN 4.1 Hasil
4.1.1 Pengukuran Titik Beku Asam Asetat Glasial Suhu awal = 27oC
Menit ke- Temperatur (oC)
1 23,5
2 20,5
3 18,5
4 17,5
5 15
6 13,5
7 12,5
8 12
9 15
10 15,8
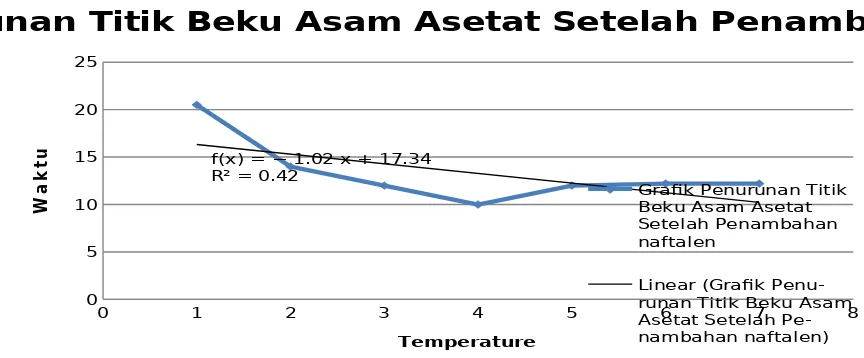
4.1.2 Pengukuran Titik Beku Asam Asetat Galsial Setelah Penambahan Naftalen Suhu awal = 27,5 oC
Menit ke- Temperatur (oC)
1 20,5
2 14
3 12
4 10
5 12
6 12,2
4.1.3 Pengukuran Titik Beku Asam Asetat Glasial Setelah Penambahan Naftalen dan Zat X
Suhu awal = 27,65 oC
Menit ke- Temperatur (oC)
1 20
2 17,3
3 14,3
4 12
5 11,5
6 11,7
7 11,8
8 11,8
4.2 Pembahasan
0 2 4 6 8 10 12
Grafk Penurunan Titik Beku Asam Asetat Glasial
Grafk Penurunan Titik Beku Asam Asetat Glasial Linear (Grafk Penurunan Titik Beku Asam Asetat Glasial ) ditentukan mengalami penurunan temperatur perlahan. Suhu yang dihasilkan yaitu 15,8 °C. Hasil yang didapatkan sedikit lebih rendah dari suhu literatur yaitu 16,7 oC. Hal tersebut bisa terjadi karena es yang di masukkan terlalu banyak sehingga larutan tersebut cepat membeku. Sebab semakin dingin suatu larutan maka akan semakin rendah pula titik beku yang dihasilkan.
Langkah selanjutnya adalah sama dngan langkah sebelumnya, namun pada langkah ini ditambahkan naftalen sebanyak 2 gram dan di homogenkan dengan asam cuka glasial yang sudah mencair setelah diukur titik bekunya tadi. Grafiknya adalah sebagai berikut:
Grafk Penurunan Titik Beku Asam Asetat Setelah Penambahan Naftalen
Grafk Penurunan Titik Beku Asam Asetat Setelah Penambahan naftalen
Linear (Grafk Penu-runan Titik Beku Asam Asetat Setelah
menurunkan titik bekunya menjadi lebih kecil. Dengan ini maka didapatkan perhitungan nilai Kf dari asam asetat glasial sebesar 4,83 g.K/mol dan diperoleh titik beku asam asetat glasial adalah 0,4 K. Harga Kf asam asetat glasial yang didapatkan pada percobaan kali ini mengalami sedikit perbedaan dengan Kf asam asetat menurut literatur yang ada, dimana harga Kf asam asetat menurut literatur adalah 3,9 g.K/mol.
Percobaan selanjutnya dan terakhir yaitu menentukan berat molekul dari zat X. Langkah yang dilakukan dalam percobaan sama dengan perlakuan penambahan naftalen. Bahan yang digunakan adalah asam asetat dan naftalen yang sudah membeku dicairkan kembali dan ditambahkan dengan 2 gram zat X. Grafik dari percobaan kali ini adalah:
Grafk penurunan titik beku larutan asam cuka + naftalena + zat X
Grafk penurunan titik beku larutan asam cuka + naf-talena + zat X
Linear (Grafk penurunan titik beku larutan asam cuka + naftalena + zat X)
Berdasarkan grafik di atas dapat dijelaskan bahwa pada menit pertama suhu larutan 27,65 oC dan suhu konstan diperoleh sekitar pada suhu 11,8 oC. Penambahan zat kembali ke dalam larutan asam asetat glasial yang bercampur dengan naftalena membuat titik beku larutan ini menjadi lebih rendah lagi dari pada sebelumnya. Hasil ini sesuai dengan teori yang ada dimana semakin banyak zat yang terlarut dalam suatu larutan maka semakin menurun titik beku larutannya karena pergerakan molekul dari asam asetatnya akan terganggu untuk memadat.
Penentuan berat molekul zat X dilakukan dengan cara menggunakan data perubahan titik beku di atas dan menggunakan rumus seperti di bawah ini:
∆ Tf=1000w× Kf ×
{
(
Mrwzat x zat x)
+(
wnaftalen
Mrnafatalen
)
}
BAB 5 PENUTUP 5.1 Kesimpulan
Berdasarkan hasil dan pembahasan diatas dapat disimpulkan beberapa hal yaitu: 1. Garam berfungsi sebagai penurun titik beku air.
2. Kf asam asetat sebesar 4,83 g.K.mol-1 dan berat molekul zat X sebesar 115,39 g/mol.
5.2 Saran
DAFTAR PUSTAKA
Anonim. 2015. MSDS Asam Asetat [serial online].http://www.sciencelab.com/msds.php?
msdsId=9922769 [diakses tanggal 28 September 2015].
Anonim. 2015. MSDS Naftalen [serial online]. http://www.sciencelab.com/msds.php?
msdsId=9927671 [diakses tanggal 28 September 2015].
Anonim. 2015. MSDS Natrium Klorida [serial online].
http://www.sciencelab.com/msds.php?msdsId=9927593 [diakses tanggal 28
September 2015].
Arifin. 1993. Diktat Kuliah: Kimia Dasar I (Kimia Anorganik). Banjarbaru: Pustaka. Brady, James.E. 1999. Kimia Universitas Asas dan Struktur. Jakarta: Bina Rupa
Aksara.
Brady, James.E. 2003. Kimia Universitas Asas dan Struktur. Jakarta: Bina Rupa Aksara.
Kusmawati, T.M. 1999. Sains Kimia. Jakarta: Bumi Aksara. Norman. 2001. Prinsip-prinsip Kimia Modern. Jakarta: Erlangga.
Petrucci, Ralph M., 1987. Kimia Dasar Edisi Keempat Jilid 2. Jakarta: Erlangga. Reis. 1999. Sifat-Sifat Gas dan Zat Cair. Jakarta: Gramedia.
Sarjoni, 2003. Kamus Kimia. Jakarta: PT Rineka Cipta.
LAMPIRAN
1. Penentuan titik beku larutan Asam Cuka Glasial + Naftalen
Tof asam cuka = 15,8oC = 288,8 K Tof naftalen = 12,2oC = 285,2 K
ΔTf = Tof asam cuka – Tf naftalen = 288,8 K – 285,2 K = 3,6 K ρasam cuka(literartur)=wVasamcuka
asamcuka
wasamcuka=ρasam cukaxVasam cuka
wasamcuka=¿1,049mLg x 20mL
wasamcuka=20,98g
Sehingga:
Kf=wasamcuka1000× Mr× wnaftalen×∆ Tf naftalen
Kf=
20,98g ×128mol ×g 3,6K
1000×2g
Kf=4,83mol Kg
2. Penentuan Massa Zat X Tof asam cuka = 288,8 K Tf zat x = 11,8 oC = 284,8 K ΔTf2 = Tof asam cuka – Tof zat X ΔTf2 = 288,8 K – 284,8 K = 4 K
∆ T ftotal=∆ T f2−∆ T f1
∆ T ftotal=4K−3,6K
∆ T ftotal=0,4K
∆ Tf=1000W × Kf asamCuka ×
{
(
wzat x
Mrzat x
)
+(
wnaftalen
0,4K=
- Pengukuran titik beku Asam asetat glasial
0 2 4 6 8 10 12
Grafk Penurunan Titik Beku Asam Asetat Glasial
- Pengukuran titik beku Asam asetat glasial setelah penambahan Naftalen
Grafk Penurunan Titik Beku Asam Asetat Setelah Penambahan Naftalen
Grafk Penurunan Titik Beku Asam Asetat Setelah Penambahan naftalen
Linear (Grafk Penu-runan Titik Beku Asam Asetat Setelah
Pe-- Pengukuran titik beku Asam asetat glasial setelah penambahan Naftalen dan Zat X