LAPORAN PRAKTIKUM KIMIA FISIK II PENENTUAN TITIK BEKU LARUTAN
Nama : Marena Thalita Rahma NIM : 121810301031
Kelompok : 5 Kelas : A
Asisten : Hefinda Elfiandika
LABORATORIUM KIMIA FISIK JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
BAB 1. PENDAHULUAN
1.1 Latar Belakang
Titik beku larutan adalah suhu dimana larutan dalam keadaan setimbang dengan pelarut padatnya. Titik beku larutan dapat mengalami penurunan, apabila terjadi peningkatan tekanan dalam cairan yang merupakan selisih antara titik beku awal dengan titik beku setelah terjadi perubahan sistem. Titik beku larutan juga dapat mengalami penurunan ketika suatu zat ditambahkan dalam suatu larutan.
Salah satu aplikasi penurunan titik beku larutan dalam kehidupan sehari-hari adalah cairan pendingin pada radiator kendaraan bermotor. Cairan ini berfungsi mentransformasikan panas mesin ke lingkungan agar mesin dapat tetap bekerja pada suhu optimum. Cairan pada radiator dapat membeku dan dapat mengakibatkan pecahnya saluran radiator serta mesin tidak dapat dihidupkan. Hal yang dilakukan untuk mengatasi permasalahan tersebut adalah pembuatan cairan pendingin “Radiator Coolant” yang dibuat dengan mencampurkan cairan etilen glikol dengan aquadestelata. Etilenglikol berfungsi sebagai anti beku pada kendaraan bermotor yang digunakan di daerah bermusim dingin atau panas.
Percobaan ini akan memepelajari tentang penetapan penurunan titik beku molal pelarut dan diharapkan dapat digunakan untuk menentukan berat molekul senyawa non volatil yang tidak diketahui. Penentuan berat molekul senyawa non volatil tersebut dilakukan dengan membandingkan dengan literatur yang ada berdasarkan titik beku, dan dan perubahan titik bekunya.
1.2 Tujuan
Tujuan dari percobaan ini adalah
1. Menentukan tetapan penurunan titik beku molal pelarut.
BAB 2. TINJAUAN PUSTAKA
2.1 MSDS (Material Safety Data Sheet) 2.1.1 Akuades
Akuades merupakan H2O murni yang terbentuk dari distilasi air. Akuades merupakan cairan tidak berwarna dan tidak berbau. Derajat keasaman (pH) dari akuades adalah netral yaitu 7,0. Titik didih dan titik lebur dari akuades berturut-turut adalah 100oC dan 0oC. Tekanan uap dari akuades pada suhu 20oC adalah 17,5 mmHg. Massa jenis dari akuades adalah 1,00 gram/cm3. Rumus formula akuades adalah H2O dengan berat molekul 18,0134 gram/mol (Sciencelab.com, 2014).
Akuades yang mengenai mata, kulit, tertelan, atau juga terhisap tidak menimbulkan gejala serius atau tidak berbahaya. Namun, jika terjadi iritasi segera dibawa ke pihak medis. Seperti air pada umumnya akuades tidak mudah terbakar. Penyimpanan sebaiknya di wadah tertutup rapat (Sciencelab.com, 2014).
2.1.2 NaCl
NaCl atau Natrium klorida mempunyai massa molar 58,44 gram/mol. Massa jenisnya adalah 2,16 gram/cm3. Titik leleh NaCl adalah 801oC dan titik didih 1465oC. Garam natrium klorida memiliki kelarutan dalam air sebesar 35,9 gram/100 mL air pada suhu 25oC. Natrium klorida (NaCl) yang dikenal sebagai garam adalah zat yang memiliki tingkat osmotik yang tinggi (Sciencelab.com, 2014).
NaCl tidak berbahaya bila tertelan namun jika dalam jumlah banyak dapat menyebabkan penyakit tekanan darah tinggi dalam waktu yang lama. Jika terkena kulit yang teriritasi akan menimbulkan rasa perih. Jika terkena mata dapat menimbulkan iritasi ringan. Pertolongan yang harus dilakukan membilas mata dan kulit yang terkena garam dapur selama kurang lebih 15 menit. Jika terjadi iritasi atau gejala yang lebih parah segera hubungi petugas medis. Penyimpanan seharusnya dilakukan di tempat yang sejuk, kering, dan tertutup
(Sciencelab.com, 2014).
2.1.3 Asam Cuka
Asam asetat merupakan salah satu asam karboksilat yang mudah ditemui. Asam ini memiliki nama lain asam etanoat, asam asetat glasial, asam ethylic, methanecarboxylic acid, atau biasa disebut asam cuka. Rumus molekul dari asam asetat ini adalah C2H4O2 atau biasa ditulis CH3COOH. Asam asetat mempunyai titik lebur 16,7oC dan memiliki titik didih pada
118oC. Asam ini memiliki massa jenis 1,05 gram/mL. Berbeda dengan massa jenis cairannya, massa jenis uap dari asam asetat adalah 2,07 gram/L. Tekanan uap dari asam cuka adalah 11 mmHg pada suhu 20oC, dan 30 mmHg pada suhu 30oC (Sciencelab.com, 2014).
Bahan ini sangat korosif dan menyebabkan luka bakar yang serius. Sangat berbahaya jika tertelan. Asam asetat sebaiknya dijauhkan dari agen oksidator, reduktor, logam, asam, alkali. Asam asetat sebaiknya disimpan di kawasan terpisah dan disetujui. Wadah diletakkan di tempat yang sejuk dan berventilasi baik. Wadah harus tertutup rapat dan disegel sampai siap untuk digunakan. Hindari semua kemungkinan sumber api (Sciencelab.com, 2014).
2.1.4 Naftalen
Naftalen adalah senyawa kimia yang berwujud padat berupa kristal dan berwarna putih, berbau aromatik. Berat molekulnya adalah 128,19 g/mol. Titik didih naftalen adalah 218 oC sedangkan titik leburnya 80,2 oC. Naftalen mudah larut dalam air panas, metanol, n-oktanol. Senyawa ini sangat sedikit terdispersi dalam air dingin. Naftalen sangat berbahaya apabila tertelan, berbahaya bila kasus kontak mata (iritan), dan sedikit berbahaya dalam kasus kontak kulit. Tindakan pertolongan pertama untuk kontak mata yaitu periksa dan lepaskan lensa kontak, segera basuh mata dengan banyak air mengalir selama minimal 15 menit. Apabila kontak dengan kulit segera cuci dengan air yang banyak. Biarkan korban untuk beristirahat di tempat yang berventilasi baik jika terjadi penghirupan dan jangan dimuntahkan jika tertelan, kecuali diarahkan oleh tenanga medis untuk melakukannya (Sciencelab.com, 2014).
2.2 Penentuan Titik Beku Larutan
Titik beku adalah suhu pada pelarut tertentu di mana terjadi perubahan wujud zat cair ke padat. Air membeku pada suhu 0 °C pada tekanan 1 atm, karena pada suhu itu tekanan uap air sama dengan tekanan uap es. Selisih antara titik beku pelarut dengan titik beku larutan disebut penurunan titik beku (Δ Tf = freezing point depression). Penurunan titik beku tidak bergantung pada jenis zat terlarut, tetapi hanya pada konsentrasi partikel dalam larutan. Penurunan titik beku tergolong sifat koligatif (Atkins, 1987).
Penurunan titik beku adalah selisih antara titik beku pelarut dan titik beku larutan dimana titik beku larutan lebih rendah dari titik beku pelarut. Titik beku pelarut murni seperti yang kita tahu adalah 00C dengan adanya zat terlarut misalnya saja gula yang ditambahkan ke dalam air maka titik beku larutan ini tidak akan sama dengan 0oC melainkan akan menjadi lebih rendah di bawah 0oC itulah penyebab terjadinya penurunan titik beku yaitu oleh
masuknya suatu zat terlarut atau dengan kata lain cairan tersebut menjadi tidak murni, maka akibatnya titik bekunya berubah (nilai titik beku akan berkurang) (Chang, 2003).
Partikel zat terlarut yang tidak mudah menguap dalam larutan dapat mengurangi kemampuan zat pelarut untuk menguap, sehingga tekanan uap larutan lebih rendah dari pada tekanan uap pelarut murni. Partikel zat terlarut tersebut akan mengakibatkan kenaikan titik didih dan penurunan titik beku larutan. Menurut hukum Roult, besarnya penurunan tekanan uap larutan, kenaikan titik didih, dan penurunan titik bekularutan yang mengandung zat terlarut tidak mudah menguap dan tidak mengalami disosiasi (larutan non elektrolit), sebanding dengan banyaknya partikel zat terlarut. Besarnya kenaikan titik didih larutan 1 molal disebut kenaikan titik didih molal, Kb, sedangkan besarnya penurunan titik beku larutan 1 molal disebut penurunan titik beku molal, Kf (Castellan, 1983).
Hukum Roult dapat digunakan untuk menentukan larutan encer. rumus yang digunakan adalah
Δ Tb = m x Kb Δ Tf = m x Kf Dimana,
Δ Tb = Kenaikan titik ddih larutan Δ Tf = Penurunan titik beku larutan Kb = Kenaikan titik didih molal Kf = Penurunan titik beku molal m = Molalitas larutan
(Chang, 2003).
Besarnya molalitas larutan yang sejenis sebanding dengan masa zat terlarut dan berbanding terbalik dengan masa molekul zat terlarut. Jika massa zat terlarut dan massa zat pelarut diketahui, maka massa molekul zat terlarut dapat ditentukan berdasarkan sifat koligatif larutan. Larutan yang mengandung zat terlarut tidak mudah menguap dan dapat mengalami disosiasi (larutan elektrolit), besarnya penurunan tekanan uap larutan, kenaikan titik didih, dan penurunan titik beku larutan, dipengaruhi oleh derajat disosiasi larutan (Sukardjo, 1990).
Empat sifat yang berhubungan dengan larutan encer, atau pada larutan yang lebih pekat, yang tergantung pada jumlah partikel terlarut yang ada. Jadi, sifat-sifat tersebut tidak bergantung pada jenis terlarut. Keempat sifat tersebut adalah :
1. Penurunan Tekanan Uap 2. Kenaikan Titik Didih 3. Penurunan titik Beku
4. Tekanan Osmotik
Keempat sifat-sifat tersebut dinamakan sifat-sifat koligatif. Kegunaan sifat koligatif banyak dan beragam. Juga penelitian sifat-sifat koligatif memainkan peranan penting dalam metode penetapan bobot molekul dan pengembangan teori larutan (Brady, 2002).
Suatu zat pelarut jika kedalamnya dimasukkan zat lain yang tidak mudah menguap (non volatil), maka tenaga bebas pelarut tersebut akan turun. Penurunan tenaga bebas ini mengikuti persamaan Nerts.
Gº1 – Gº = RT ln x
Gº1 – Gº = Penurunan tenaga bebas pelarut Keterangan:
R = Tetapan gas murni umum T = suhu mutlak
x = Fraksi mol pelarut dalam larutan (Tim Kimia Fisik, 2014).
Penurunan energi bebas ini akan menurunkan kemampuan zat pelarut untuk berubah menjadi fase uapnya, sehingga tekanan uap pelarut dalam larutan akan lebih rendah bila dibandingkan dengan tekanan uap pelarut yang sama dalam keadaan murni. Pengaruh penurunan tekanan uap terhadap titik beku larutan mudah difahami dengan bantuan diagram fasa. Misalnya, titik beku larutan Tf lebih rendah dibandingkan dengan titik beku pelarut murni Tof. Dari uraian diatas jelas bahwa penurunan titik beku larutan
ΔTf = To f – Tf
Besarnya tergantung pada fraksi mol pelarut. Karena fraksi mol zat terlarut X1 : menurut persamaan X = 1- X1 maka ΔTf dapat dinyatakan sebagai X1 berikut:
ΔTf = (R(To
f )2/ΔHf) X1
ΔHf adalah panas pencairan pelarut. Jika m ml zat terlarut ke dalam 1000 gram zat terlarut, maka di dapat larutan dengan molarutas m, sehingga larutan tersebut mempunyai fraksi mol zat terlarut sebesar
X1 = m / (1000/M)+ m)
M adalah berat molekul zat pelarut. Larutan encer m mendekati 0 (nol), maka X1 = mM/1000, sehingga penurunan titik beku larutan dapat di tulis :
ΔTf = (R(Tof )2 M.m)/1000ΔHf
Bila disubstitusikan Kf = (R(Tof )2 M)/1000ΔHf kedalam persamaan (2.8), maka akan diperoleh persamaan yang sederhana, yaitu
Persamaan X1 = m.M/1000 di atas didapat persamaan m = 1000 X1/M
Sedangkan X1= m1 / (m1 + m) = (W1/M1) / {(W1/M1 + W/M)} W1 = berat zat terlarut
M1 = BM zat terlarut W = berat pelarut
Larutan encer berlaku (W1/M1) >>(W/M), sehingga persamaannya menjadi: X1 = (W1.M) / (W.M1) dan ΔTf = (1000/kf) / M1 x (W1/W)
Rumus untuk menghitung harga kf adalah : kf = (W.M1.ΔTf) / (1000 W1)
Rumus yang digunakan untuk menghitung BM zat terlarurt : M1 = (1000.kf ) / ΔTf x (W1/W)
BAB 3. METODOLOGI PERCOBAAN
3.1 Alat dan Bahan 3.1.1 Alat - Termometer alkohol - Tabung gelas - Pengaduk - Stopwatch - Gelas beker 100 cc - Erlenmeyer - Gelas ukur 100 cc 3.1.2 Bahan - Air - Es - Garam - Asam cuka
- Asam cuka glasial - Naftalen 3.2 Skema Alat Keterangan: A. Termometer B. Tabung gelas 1 C. Pengaduk D. Tabung gelas 2 E D B A C
E. Tabung gelas 3
3.3 Skema Kerja
3.3.1 Penentuan tetapan penurunan titik beku molal
- dimasukkan ke dalam beaker glass - diukur suhu awalnya
- dimasukkan ke dalam beaker glass yang berisi aquades yang diletakkan di dalam beaker glass dingin yang berisi campuran es, air, dan garam
- diamati perubahan suhu, dan dicatat tiap menit - diamati pelarut
- ditentukan Tf
- dicairkan kembali padatan asam cuka glasialnya - dimasukkan naftalen sebanyak 2 gram
- diulangi langkah 2-6, - di hitung Kf
20 mL Asam cuka glasial
3.3.2 Penentuan BM zat x
- dimasukkan ke dalam campuran asam asetat dan naftalen - diaduk hingga homogen
- diukur suhu awalnya
- dimasukkan ke dalam beaker gelas yang didinginkan - diamati perubahan suhunya dan dicatat tiap menit - ditentukan Tºfnya
- dihitung ∆Tfnya - dihitung BM zat x 2 gram sampel garam X
BAB 4. HASIL DAN PEMBAHASAN
4.1 Hasil Percobaan
4.1.1 Pengukuran Titik Beku Asam Cuka Glasial Suhu awal = 28o C t (menit) Temperatur (oC) Awal 28 1 26 2 23 3 20 4 18 5 17 6 17
4.1.2 Pengukuran Titik Beku Asam Cuka Glasial Setelah Penambahan Naftalen t (menit) Temperatur (oC) Awal 27 1 19 2 15 3 13 4 13
4.1.3 Pengukuran Titik Beku Asam Cuka Glasial Setelah Penambahan Naftalen dan Zat X t (menit) Temperatur (oC) Awal 26 1 15 2 11 3 11 4 11
4.2 Pembahasan
Larutan adalah campuran homogen dari dua zat atau lebih. Larutan memiliki sifat yang bergantung pada banyaknya partikel zat terlarut dan tidak bergantung pada jenis terlarutnya. Sifat larutan salah satunya adalah penurunan titik beku. Penurunan titik beku ( ) adalah perbedaan titik beku larutan akibat adanya partikel zat terlarut terhadap titik beku pelarutnya. Pelarut yang ditambahkan adalah pelarut yang non volatil. Partikel yang ditambahkan dalam larutan akan akan menurunkan energi kinetik larutan sehingga akan menurunkan titik beku larutan. Titik beku adalah suhu pada pelarut tertentu dimana terjadi perubahan wujud cair menjadi padat. Percobaan ini membahas penurunan titik beku larutan. Lautan yang ditentukan titik bekunya adalah larutan asam cuka glasial yang ditambahkan naftalen dan zat x.
Tahapan pertama yang dilakukan adalah persiapan alat dengan menggunakan beberapa gelas beker yang disusun. Gelas beker paling bawah diisi dengan es batu dan garam yang dicampur serta ditambahkan dengan air secukupnya. Penambahan garam ini bertujuan mempertahankan suhu di sekitar sistem dan menurunkan titik beku air sehingga es batu tidak cepat mencair. Gelas beker kedua diletakkan di atas gelas beker pertama yang berisi campuran garam, air, dan es. Gelas beker kedua ini diisi dengan aquades yang di atasnya terdapat gelas beker ketiga yang berisi larutan yang diukur. Larutan tersebut adalah asam cuka glasial. Suhu awal asam cuka glasial adalah 28ºC lalu diletakkan di dalam gelas beker kedua. Suhu asam cuka glasial mengalami penurunan dan konstan pada menit keenam yaitu 17ºC. Larutan asam cuka glasial berubah wujud menjadi padatan berupa kristal putih seperti es. Suhu pada 17ºC sebagai titik beku asam cuka glasial.
Grafik 4.1 Hubungan Penurunan Suhu terhadap Waktu Asam Cuka Glasial
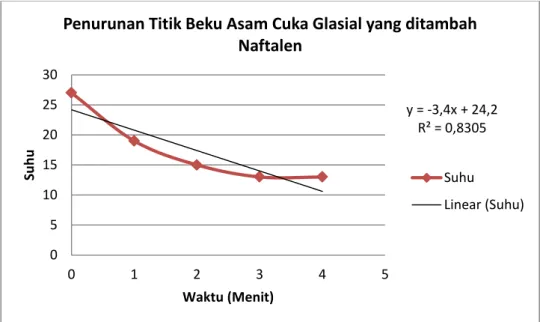
Asam cuka glasial yang telah berubah menjadi padatan kemudian dicairkan kembali kemudian ditambahkan naftalen sebanyak 2 gram. Larutan diaduk hingga homogen lalu
y = -3,4x + 24,2 R² = 0,8305 0 5 10 15 20 25 30 0 2 4 6 Su h u ( ºC) Waktu (Menit)
Penurunan Titik Beku Asam Cuka Glasial
Suhu Linear (Suhu)
diukur suhu awalnya yaitu 27ºC. Suhu awal asam asetat glasial mengalami penurunan 1ºC. Larutan ini kemudian dimasukkan ke dalam gelas beker kedua kemudian diamati perubahan suhunya tiap menit. Suhu larutan ini konstan pada menit keempat menjadi 13ºC. Hal ini disebabkan adanya penambahan zat yang menyebabkan energi bebas pelarut berkurang sehingga kemampuan pelarut untuk menjadi fase uapnya juga berkurang. Hal ini menyebabkan tekanan uap pelarut dalam larutan akan lebih rendah bila dibandingkan dengan tekanan uap pelarut yang sama dalam keadaan murni. Penurunan tekanan uap sebanding dengan penurunan titik beku sehingga suhu mengalami penurunan. Grafik penurunan suhu asam cuka glasial yang ditambahkan naftalen seperti di bawah ini
Grafik 4.1 Hubungan Penurunan Suhu terhadap Waktu Asam Cuka Glasial yang ditambahkan Naftalen
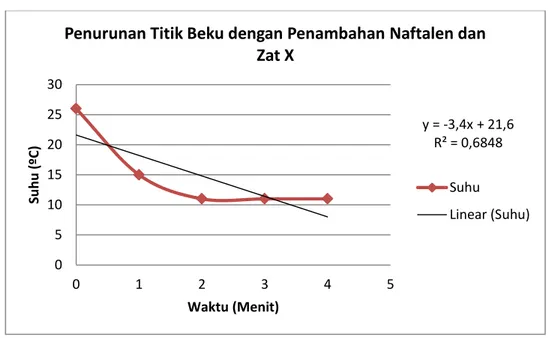
Kristal kemudian dicairkan kembali membentuk fase cairnya. Tahapan ketiga yaitu ditambahkan garam sebanyak 2 gram lalu diaduk hingga homogen. Perubahan suhu diukur tiap menit hingga didapatkan suhu konstan yaitu pada suhu 11ºC. Suhu yang didapatkan ini merupakan titik beku campuran. Penurunan yang terjadi disebabkan bertambahnya jumlah zat terlarut dalam larutan. Penurunan suhu ini semakin bertambah seiring banyaknya jumlah zat yang ditambahkan sebab semakin banyak jumlah partikel di dalamnya maka semakin berkurang energi kinetik yang dihasilkan. Penurunan titik beku yang terjadi dapat mengindikasikan bahwa larutan tersebut bukan merupakan larutan murni yang disebabkan adanya penambahan zat terlarut. Pengukuran temperatur pada campuran naftalen dan zat x dalam pelarut asam asetat glasial didapatkan titik bekunya adalah 11ºC. Pengukuran suhu
y = -3,4x + 24,2 R² = 0,8305 0 5 10 15 20 25 30 0 1 2 3 4 5 Su h u Waktu (Menit)
Penurunan Titik Beku Asam Cuka Glasial yang ditambah Naftalen
Suhu Linear (Suhu)
pada percobaan ini menggunakan termometer alkohol disebabkan rentang suhu yang didapatkan pada percobaan tidak terlalu tinggi dan berada pada rentang skala suhu pada termometer alkohol.
Grafik 4.3 Penurunan Titik Beku setelah Penambahan Naftalen dan Zat X
Reaksi yang terjadi pada peristiwa ini adalah reaksi endodermis karena sistem mendapatkan energi dari lingkungan yang berupa panas. Panas yang diterima digunakan oleh sistem untuk berubah wujud menjadi padat dengan menurunkan suhunya. Persamaan reaksi yang terjadi pada perubahan wujud larutan asam cuka glasial menjadi bentuk padatan adalah sebagai berikut
CH3COOH (aq) + CH3COOH (s)
Harga Kf larutan asam cuka glasial yang didapatkan pada percobaan ini adalah 5.370 gK/mol. Harga Kf asam asetat secara teori adalah 3,9 KKg/mol. Perbedaan harga Kf disebabkan alat yang kurang baik, sebab larutan tidak ditutup atau diperlakukan dengan keadaan yang vakum. Perlakuan larutan apabila dalam keadaan terbuka dapat memungkinkan partikel atau zat dalam larutan akan berinteraksi dengan lingkungan membentuk zat baru yang dapat mempengaruhi hasil dari percobaan yang diinginkan. Harga ketetapan titik beku suatu larutan dapat digunakan untuk menghitung berat molekul suatu senyawa atau zat yang merupakan suatu pelarut yang ditambahkan dalam larutan. Rumus yang sudah ada dapat membantu dalam penentuan berat molekul suatu zat terlarut,. Percobaan ini menggunakan penambahan 2 gram naftalen dan zat x yang merupakan senyawa garam yang tidak diketahui.
y = -3,4x + 21,6 R² = 0,6848 0 5 10 15 20 25 30 0 1 2 3 4 5 Su h u (ºC) Waktu (Menit)
Penurunan Titik Beku dengan Penambahan Naftalen dan Zat X
Suhu Linear (Suhu)
Senyawa atau zat x yang non-volatil memiliki berat molekul 85,5 g/mol. Berat molekul senyawa ini didapatkan dengan menghitung dari persamaan penurunan titik beku. Senyawa ion atau garam yang mungkin ditambahkan adalah magnesium klorida yang memiliki berat molekul 95 g/mol. Hasil yang didapatkan apabila dibandingkan dengan MaCl2 memiliki perbedaan yang cukup besar. Hal ini bisa terjadi sebab senyawa yang dihasilkan dari campuran naftalen dan zat x dalam pelarut asam asetat glasial bukanlan senyawa murni magnesium klorida yang mengandung zat pengotor dan dapat mempengaruhi berat suatu molekul.
BAB 5. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Adapun kesimpulan yang didapatkan dalam percobaan ini adalah 1. Penambahan zat terlarut dapat menurunkan titik beku larutan.
2. Harga Kf larutan asam cuka glasial yang didapatkan pada percobaan ini adalah 5.370 gK/mol, sedangkan berat molekul senyawa X yang dihasilkan adalah 85,5 g/mol.
5.2 Saran
Adapun saran yang dapat dianjurkan adalah
1. Praktikan harus mengaduk larutan secara homogen dengan sabar dalam penurunan suhu awal. 2. Pengukuran suhu harus dilakukan secara hati-hati dan teliti hingga didapatkan hasil yang
DAFTAR PUSTAKA
Atkins, P.W. 1987. Kimia Fisika. Jakarta : Erlangga.
Brady. 2002. Kimia Universitas Asas dan Struktur. Jakarta : Binarupa Aksara.
Castellan, G.W. 1983. Physical Chemistry. 2nd edition. Massachussets: Adisson-Wesley. Chang, Raymon. 2003. Kimia Dasar. Jakarta : Erlangga
Material Safety Data Sheet: Akuades MSDS. 2014. http://www.sciencelab.com/msds.php?
msdsId=9927062. [Diakses 8 Oktober 2014].
Material Safety Data Sheet: CH3COOH MSDS. 2014. http://www.sciencelab.com/msds.php? msdsId=9927572. [Diakses 8 Oktober 2014].
Material Safety Data Sheet: NaCl MSDS. 2014. http://www.sciencelab.com/msds.php?
msdsId=9879065. [Diakses 8 Oktober 2014].
Material Safety Data Sheet: Naftalen MSDS. 2014. http://www.sciencelab.com/msds.php?
msdsId=9909065. [Diakses 8 Oktober 2014]. Sukardjo. 1990. Kimia Anorganik. Jakarta : Rineka Cipta
Tim Kimia Fisik. 2014. Penuntuk Praktikum Kimia Fisik I. Jember : FMIPA Universitas Jember.
LAMPIRAN
1. Penentuan nilai Kf
T°f asam cuka = 17°C = 290 K
T°f naphtalen = 13°C = 286 K
ΔTf 1 = T°f asam cuka - T°f naphtalen
= 290 K – 286 K = 4 K 2. Penentuan Mr zat X T°f asam cuka = 17°C = 290 K T°f zat X = 11°C = 284 K
ΔTf 2 = T°f asam cuka - T°f zat X
=290 K – 284 K = 6 K ΔTf total = ΔTf 2 + ΔTf 1 = 6 K + 4 K = 10 K ( ) {( ) ( )} ( ) {( ) ( )} = ⁄ ( ⁄ ) 0,039 = ( ) 0,0234 = , = 85,5 ⁄
y = -3,4x + 21,6 R² = 0,6848 0 5 10 15 20 25 30 0 1 2 3 4 5 Su h u Waktu (Menit)
Penurunan Titik Beku Asam Cuka Glasial yang ditambah Naftalen Suhu Linear (Suhu) y = -3,4x + 21,6 R² = 0,6848 0 5 10 15 20 25 30 0 1 2 3 4 5 Su h u Waktu (Menit)
Penurunan Titik Beku Asam Cuka Glasial yang ditambah Naftalen
Suhu Linear (Suhu)
y = -3,4x + 21,6 R² = 0,6848 0 5 10 15 20 25 30 0 1 2 3 4 5 Su h u ( ºC) Waktu (Menit)
Penurunan Titik Beku dengan Penambahan Naftalen dan Zat X
Suhu Linear (Suhu)