LAPORAN RESMI
PRAKTIKUM KIMIA FISIKA
TEGANGAN PERMUKAAN
KELOMPOK A - 4 :
Setiawan Limantoro
6103011071
Felisia Puspitaningsih
6103011086
PROGRAM STUDI TEKNOLOGI PANGAN
FAKULTAS TEKNOLOGI PERTANIAN
I. TUJUAN
Menentukan tegangan permukaan cairan secara relative dengan air sebagai zat pembanding dan menentukan pengaruh konsentrasi zat terlarut terhadap tegangan permukaan
II. DASAR TEORI
Menurut Glasstone (1961), tegangan permukaan merupakan besarnya gaya yang bekerja tegak lurus per satuan panjang permukaan. Volume per unit molekul dalam fase uap lebih kecil daripada fase cair, sehingga zat cair berusaha memperkecil luas permukaan, yaitu dengan menarik molekul-molekul di permukaan cairan lebih tertarik ke dalam cairan sehingga mengakibatkan tegangan permukaan.
Berikut ini adalah tabel tegangan permukaan cairan di berbagai suhu dalam dyne/cm
Zat cair yang bersentuhan dengan
udara
Suhu (oC) Tegangan Permukaan (mN/m = dyn/cm)
Air
0 75,60
Air 20 72,80
Air
25 72,20
Air 60 66,20
Air
80 62,60
Air 100 58,90
(http://dani-sains.blogspot.com/2010/03/tegangan-permukaan.html)
Terdapat 4 metode untuk menentukan tegangan permukaan cairan, yaitu:
Metode kenaikan kapiler (capillary-rise method)
Metode ini diadasarkan pada kenyataan bahwa kebanyakan cairan dalam pipa kapiler mempunyai permukaan lebih tinggi daripada permukaan di luar pipa. Metode ini dilakukan dengan cara membenamkan kapiler ke dalam larutan.The height at which the solution reaches inside the capillary is related to the surface tension by the equation . Tinggi dimana mencapai solusi di dalam kapiler berhubungan dengan tekanan pada permukaan. (Sukardjo, 2002).
Metode ini merupakan metode tradisional untuk menghitung tegangan permukaan. Metode cincin Du-Nouy bisa digunakan untuk mengukur tegangan permukaan ataupun tegangan antar muka. Prinsip dari metode ini adalah gaya yang diperlukan untuk memisahkan suatu cincin Pt, yang dimasukkan dalam cairan yang diselidiki, dari permukaan cairan diukur. Gaya yang diperlukan untuk melepaskan cincin sebanding dengan tegangan permukaan atau tegangan antar muka dari cairan tersebut (Sukardjo, 2002).
Metode tetes (drop-weight method)
Sebuah metode untuk menentukan tegangan permukaan sebagai fungsi antarmuka. Liquid of one density is pumped into a second liquid of a different density and time between drops produced is measured. Cairan dari konsentrasi tertentu akan dipompa ke dalam cairan yang lain dan waktu yang berbeda saat tetes dihasilkan diukur (Daniels, 1956).
Tekanan maksimal gelembung (bubble-pressure method)
Sebuah metode universal terutama cocok untuk memeriksa tekanan pada permukaan atas interval waktu panjang.A vertical plate of known perimeter is attached to a balance, and the force due to wetting is measured. Sebuah vertikal sepiring dikenal perimeter terlampir untuk keseimbangan, dan memaksa karena pembasahan diukur (Daniels, 1956).
Kenaikan Kapiler
Dalam penentuan tegangan permukaan, cara yang paling sering digunakan adalah metode kenaikan kapilaritas. Kapilaritas adalah gejala naik atau turunnya zat cair dalam tabung kapiler yang dimasukkan sebagian ke dalam zat cair karena ada pengaruh adhesi dan kohesi. Kohesi adalah gaya tarik-menarik antar molekul yang sama jenisnya. Gaya kohesi yang kuat pada permukaan merupakan tegangan permukaan. Ketika gaya tarik-menarik terjadi antar molekul yang berbeda disebut gaya adhesi. Gaya adhesi terjadi antara molekul air dan dinding pada pipa kaca yang menyebabkan kenaikan cairan ke atas.
Gambar Penetapan dengan cara Kenaikan kapiler (Sukardjo,2002)
Apabila cairan sudut kontak antara cairan dan dinding tabung kurang dari 900, cairan dikatakan
membasahi permukaan dan cairan akan membentuk miniskus cekung (concave). Jika sudutnya 900
miniskus datar, jika sudut kontaknya lebih dari 900 maka akan membentuk miniskus cembung
(convex). Jika gaya adhesi antara cairan dan materi dinding kapiler dinding lebih lemah daripada kohesi cairan maka cairan dalam pipa akan menarik diri dan menyebabkan permukaannya melengkung dan mempunyai tekanan tinggi dibagian bawah dan menyamakan tekanan pada kedalaman yang sama diseluruh bagian cairan. Hal ini mengakibatkan penurunan kapiler (Atkins, 1999)
F1 = 2πr γ cosθ
Keterangan: F1 = gaya ke atas
γ = tegangan permukaan r = jari-jari kapiler θ = sudut kontak
Pada keseimbangan, gaya ke atas dan ke bawah setara, sehingga :
2π.r.γ. cos θ = π.r2.ρ.h.g → γ = (ρ.h.g.r) / 2 cos θ
Menurut Daniels (1956), untuk sebagian besar cairan, termasuk air, sudut kontaknya sangat kecil, θ mendekati 0, cos θ = 1 sehingga
γ = ½ ρ.h.g.r
Dalam percobaan ini dilakukan dengan membandingkan cairan yang diketahui (air) dengan cairan yang tidak diketahui tegangan permukaannya (sirup).
γx = ( hx . ρx . γair) / (hair . ρair)
Keterangan:
hx = kenaikan zat x (mL)
γx = tegangan permukaan zat x (dyne/cm)
γair = tegangan permukaan zat cair (dyne/cm)
hair = kenaikan air (mL)
ρair = berat jenis air (g/mL)
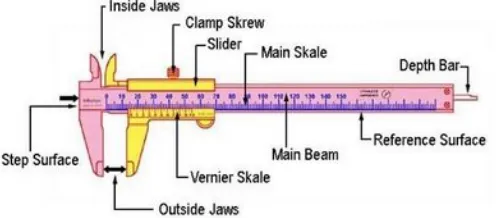
Jangka Sorong
Gambar 1 : 2.bp.blogspot.com
Cara membaca jangka sorong
Jangka sorong biasanya digunakan untuk mengukur diameter suatu benda. Jika jangka sorongnya mempunyai ekor, maka ekor tersebut dapat digunakan untuk mengukur kedalaman. Jangka sorong mempunyai 2 skala yaitu skala utama dan skala nonius. Jangka sorong memiliki ketelitian hingga 0.1mm=0.01 cm.
Cara membaca diameternya (X): X= Skala utama + Skala nonius Ket:
X= diameter benda yang diukur (cm)
Dalam membaca nilai di skala utama lihatlah angka sebelum/sama dengan angka 0 yang terdapat di skala nonius. Angka 1 di skala utama bernilai 1 cm jadi garis-garis sebelum angka satu masing-masing bernilai 0.1 cm.
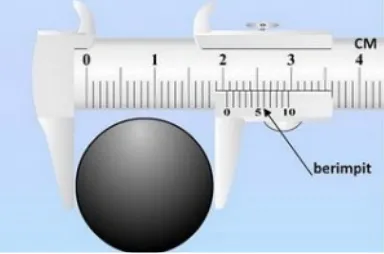
Contoh 1:
Gambar 2. (sumber gambar: noor-ridhwan.blogspot.com) X = skala utama + skala nonius
Skala utama= 2 cm (lihat angka diskala utama sebelum angka 0 di skala nonius) Skala nonius= 0.06 cm (lihat garis diskala nonius yang berhimpit dengan skala utama) X= 2 cm + 0.06 cm
= 2.06 cm
contoh 2:
lihat gambar 3 dibawah ini!
gambar 3 (Sumber gambar: adiwarsito.wordpress.com)
X = skala utama + skala nonius
Skala utama= 5.3 cm (lihat angka diskala utama sebelum angka 0 di skala nonius) Skala nonius= 0.05 cm (lihat garis diskala nonius yang berhimpit dengan skala utama) X= 5.3 cm + 0.05 cm
= 5.35 cm
Yang diatas adalah jangka sorong manual, terdapat juga jangka sorong digital dengan display digital perhitungannya sehingga kita tidak perlu lagi menghitungnya, cukup dengan menggesernya sesuai dengan diameternya.
Kita bisa menurunkan tegangan permukaan dengan cara menggunakan air panas. Makin tinggi suhu air, maka baik karena semakin tinggi suhu air, semakin kecil tegangan permukaan (agnes-sahabat.blogspot.com).
2. Konsentrasi zat terlarut
Telah diamati bahwa solut yang ditambahkan kedalam larutan dapat menurunkan tegangan permukaan, karena mempunyai konsentrasi dipermukaan yang lebih besar daripada didalam larutan. Sebaliknya solut yang penambahannya kedalam larutan dapat menaikkan tegangan muka mempunyai konsentrasi dipermukaan yang lebih kecil daripada didalam larutan (Moore, 1962).
3. Massa jenis zat
Semakin besar masa jenis zat maka semakin besar pula konsentrasi zat terlarut dan semakin kecil tegangan permukaan zat tersebut.
III. ALAT DAN BAHAN Alat :
Pipet ukur 0,1 mL
Beker gelas 100 mL
Stopwatch
Labu takar 50 mL
Corong gelas
Pipet volume 5 mL
Pipet volume 15 mL
Pipet volume 25 mL
Sirup konsentrasi 10%, 30% dan 50%
Akuades
Es batu
IV. CARA KERJA
Penentuan densitas masing – masing jenis cairan yang akan dianalisis menggunakan piknometer (akuades, sirup 10%, sirup 30%, dan sirup 50%)
Pengisian pipet ukur 0,1 mL dengan akuades (menggunakan bantuan bulb) hingga tepat pada garis batas
Pemasukkan pipet ukur 0,1 mL yang sudah terisi akuades ke dalam beker gelas yang sudah berisi 25 mL akuades
Akuades dalam pipet ukur tersebut akan turun sampai pada batas tertentu
Pengukuran tinggi permukaan akuades pada pipet ukur dan pada beker gelas (menggunakan jangka sorong)
Hitung selisih tingginya sebagai h
Pengulangan 3x
Penggantian akuades dengan sirup dengan konsentrasi 10%, 30% dan 50% (Ulangi percobaan di atas (*) pada masing-masing konsentrasi sebanyak 3x)
Penentuan Densitas Zat
Penimbangan piknometer kosong (bersih dan kering) secara analitis
Pengisisan piknometer menggunakan zat yang hendak di ukur densitasnya sebanyak 10 mL
Diamkan pada suhu 20°C (± 2 menit)
Penimbangan kembali piknometer yang berizi zat tersebut
Hitung densitas menggunakan rumus ρ=m
v
Pembuatan Sirup Konsentrasi 10%, 30% dan 50%
Pemasukan sirup tersebut dalam labu takar 50 mL
Penambahan akuades hingga tepat 50 mL
Homogenkan
V. HASIL PENGAMATAN DAN PERHITUNGAN
DENSITAS
Akuades Sirup 10% Sirup 30% Sirup 50%
Piknometer kosong (g) 12,8720 16,2447 11,5958 11,8492
Piknometer + zat (g) 22,6829 26,3326 22,5650 23,6488
Volume (mL) 10 10 10 10
Berat zat (g) 9,8109 10,0879 10,9692 11,7996
ρ g/cm3 (suhu 20°C) 0,9811 1,0088 1,0969 1,1799 ρ g/cm3 (suhu ruang
33°C) 0,9948 1,0229 1,1122 1,1964
Contoh Perhitungan Densitas (Suhu 20°C)
ρ=m
Contoh Perhitungan Densitas (Suhu ruang 33°C)
ρzat=mzat20° C
mair20° C
× ρakuades suhuruang(33° C)
Interpolasi ρakuades Pada suhu 33°C :
Sirup 30% 10,9692
9,8109 ×0,9948=1,1122g/cm
3
Sirup 50% 11,79969,8109 ×0,9948=1,1964g/cm3
Tegangan Permukaan
SAMPEL h PIPET(cm) h BEKER(cm) SELISIH(cm)
RATA-Interpolasi γakuades Pada suhu 32°C :
x−x1
Menggunakan Densitas pada suhu 20°C
Sirup 10% 1,00880,9811×2,9327×3,392×71,46=63,53dyne/cm
Sirup 30% 1,0969×2,76×71,46
0,9811×3,392 =65,01dyne/cm Sirup 50% 1,17990,9811×2,596×3,392×71,46=65,77dyne/cm
Menggunakan Densitas pada suhu ruang 33°C
Sirup 10% 1,0229×2,9327×71,46
Sirup 30% 1,1122×2,76×71,46
0,9948×3,392 =65,01dyne/cm Sirup 50% 1,19640,9948×2,596×3,392×71,46=65,77dyne/cm
VI. PEMBAHASAN
Dalam percobaan ini larutan yang dipakai adalah larutan sirup dengan konsentrasi tertentu yaitu 10%, 30%, 50%. Terdapat pula sampel 100% air murni (aquades) yang digunakan sebagai pembanding. Sebelum dilakukan percobaan untuk mengukur tegangan permukaan, harus ditentukan terlebih dahulu densitas dari sampel yang dipakai dalam percobaan yaitu air dan sirup dengan konsentrasi 10%, 30% dan 50% dengan menggunakan piknometer. Saat menggunakan piknometer, larutan yang ditentukan densitasnya harus dijaga agar suhunya tetap 20oC sebelum ditimbang
analitis, hal tersebut karena prinsip kerja dari piknometer yaitu 10 mL larutan 20oC, suhu
mempengaruhi volume larutan. Kemudian setelah didapatkan berat analitis dari larutan, maka akan
diperoleh densitas dengan rumus ρ=
massa
volume , untuk volume = 10 mL. Dari hasil perhitungan,
densitas air, sirup 10%, 30%, dan 50% berturut-turut adalah 0,9811 g/cm3, 1,0088 g/cm3, 1,0969
g/cm3, 1,1799 g/cm3. Hasil tersebut sesuai dengan teori dimana teori menyatakan semakin banyak
konsentrasi zat terlarut maka semakin tinggi pula densitasnya. Karena konsentrasi sirup yang semakin tinggi maka semakin banyak jumlah molekul dalam larutan sehingga larutan akan semakin rapat (densitasnya meningkat).
Setelah densitas telah ditentukan, selanjutnya adalah membuat larutan sirup konsentrasi 10%, 30% dan 50%. Untuk menghitung banyaknya sirup yang ditambahkan pada masing-masing
konsentrasi digunakan rumus
=v sirup v total
, dengan volume total adalah 50 mL karena larutan sirup yang akan dibuat untuk masing-masing konsentrasi adalah 5 mL untuk sirup konsentrasi 10%, 15 mL untuk sirup konsentrasi 30% dan 25 mL untuk sirup konsentrasi 50%. Kemudian di homogenkan dengan akuades pada labu takar 50 mL. Larutan yang telah dibuat dan juga akuades masing-masing dituang ke gelas beker yang terpisah sebanyak 25 mL. Setelah itu dilakukan pengukuran tegangan permukaan untuk masing-masing larutan maupun akuades.
karena adanya tegangan permukaan. Tegangan permukaan ini terjadi karena molekul berkohesi sangat kuat dengan molekul lain pada permukaan.
Kohesi adalah gaya tarik-menarik antar molekul yang sama jenisnya. Gaya kohesi yang kuat pada permukaan merupakan tegangan permukaan. Ketika gaya tarik-menarik terjadi antar molekul yang berbeda disebut gaya adhesi. Gaya adhesi terjadi antara molekul air dan dinding pada pipa kaca yang menyebabkan kenaikan cairan ke atas.
Pengukuran tegangan permukaan dilakukan dengan meletakkan pipa kapiler (pipet ukur 0,1 mL) pada beker yang telah berisi akuades atau sirup dengan berbagai konsentrasi. Pipa kapiler kemudian diberi tekanan dengan menggunakan bulb sehingga cairan naik sampai batas (skala 0). Tekanan kemudian dilepaskan (bulb dilepas) sehingga permukaan cairan pada pipa kapiler akan turun sampai ketinggian tertentu. Kemudian ketinggian cairan pada pipa kapiler serta ketinggian cairan pada beker gelas diukur menggunakan jangka sorong. Selisih antara ketinggian cairan pada pipa kapiler dan pada beker gelas adalah h.
Pengukuran tinggi cairan dalam pipa kapiler maupun tinggi cairan dalam beker glass diukur dengan menggunakan jangka sorong. Tinggi permukaan cairan dalam kapiler dan beker glass, diukur dengan bagian depth bar (mendorong bagian slider sehingga tinggi dept bar sama dengan tinggi cairan. Setelah tinggi telah sama maka clamp screw diputar agar slider tidak dapat bergerak lagi. Kemudian skala dibaca.
Pada data percobaan, tinggi cairan dalam kapiler selalu lebih besar dari tinggi cairan dalam beker glass. Hal tersebut dipengaruhi oleh diameter wadah. Meskipun pada kapiler volumenya lebih kecil dari beker glass, namun karena diameter wadah dari kapiler lebih kecil dari beker maka tinggi cairan didalamnya juga lebih besar.
Faktor-faktor yang dapat mempengaruhi tegangan permukaan,antara lain:
Suhu
Suhu merupakan salah satu faktor yang mempengaruhi tegangan permukaan. Pada saat percobaan, suhu akuades adalah 32oC. Menurut teori hanya didapat tegangan permukaan akuades
pada suhu 40oC dan 30°C yang besarnya adalah 70,1 dyne/cm dan 71,8 dyne/cm. Semakin tinggi
suhu maka semakin rendah tegangan permukaan (agnes-sahabat.blogspot.com). Untuk memperoleh tegangan permukaan akuades pada suhu 32oC maka digunakan teknik interpolasi. Sedangkan untuk
perhitungan tegangan permukaan sirup digunakan rumus
γx=hx⋅ρx⋅γair
hair⋅ρair ,
γ
x adalah teganganpermukaan sirup yang dicari,
h
x adalah selisih tinggi cairan (sirup) dalam kapiler dan cairandidapat dari interpolasi,
h
air adalah selisih tinggi cairan (akuades) dalam kapiler dan cairan dalambeker glass,
ρ
air adalah masa jenis air yang didapat dari pengukuran dengan piknometer. Massa jenis zat
Masa jenis zat juga dapat mempengaruhi tegangan permukaan (
γ
x ). Semakin besar masajenis zat maka semakin besar pula konsentrasi zat terlarut dan semakin kecil tegangan permukaan zat tersebut.
Berdasarkan hasil percobaan dapat dilihat bahwa semakin tinggi konsentrasi zat terlarut maka akan semakin rendah rata-rata h nya. Hal tersebut sebanding dengan tinggi cairan dalam kapiler. Semakin tinggi konsentrasi zat terlarut akan meningkatkan viskositas larutan dan menyebabkan meningkatnya gaya kohesi antar molekul sirup sehingga gaya adhesi antara larutan dan dinding pipa kapiler berkurang. Gaya adhesi yang berkurang menyebabkan cairan lebih mudah turun dalam pipa kapiler. Nilai rata-rata h juga sebanding dengan tegangan permukaan zat serta berbanding terbalik dengan konsentrasi zat terlarut. Semakin tinggi konsentrasi sirup maka semakin banyak pula zat terlarut (gula) yang terkandung di dalamnya. Hal ini menyebabkan gugus hidrofilik (pada gula) menjadi banyak dan terjadi ikatan hidrogen antara gugus -H pada air dan gugus -OH pada senyawa gula. Ikatan ini mengakibatkan berkurangnya gaya tarik-menarik antar molekul air (polar) sehingga tegangan permukaan dari larutan berkurang (Moore, 1962). Pada hasil percobaan,didapatkan bahwa tegangan permukaan air ke sirup konsentrasi 30% dan 50% mengalami peningkatan. Hal ini tidak sesuai dengan teori yang menyebutkan bahwa semakin tinggi konsentrasi maka tegangan permukaan semakin rendah. Ketidaksesuaian ini mungkin disebabkan karena ketidaktelitian praktikan dalam membaca skala pada jangka sorong dan kurang tepatnya konsentrasi larutan yang dibuat dapat menyebabkan ketidaksesuaian hasil perhitungan tegangan permukaan.
VII. KESIMPULAN
Semakin tinggi konsentrasi sirup semakin tinggi pula densitasnya.
Faktor-faktor yang mempengaruhi tegangan permukaan adalah suhu, konsentrasi dan massa jenis.
Semakin tinggi suhu maka tegangan maka semakin rendah tegangan permukaan.
Semakin besar masa jenis zat semakin kecil tegangan permukaan zat tersebut.
VIII. DAFTAR PUSTAKA
Atkins, P. W. 1999. Kimia Fisika jilid 1. Jakarta : Erlangga.
Daniels, F. & Robert A.A. 1955. Physical Chemistry. Japan : John Wiley & Son, Inc.
Glasstone, S. 1961. Textbook of Physical Chemistry 2ed. New York: D.Van Nostrand Company, Inc.
Moore, W. 1962. Physical Chemistry 3rd. Englwood Clift : Prentice Hall. Inc.
Sukardjo. 2002. Kimia Fisika: Jakarta: PT Rineka Cipta.
http://agnes-sahabat.blogspot.com/2011/03/tegangan-permukaan.html