LAPORAN PRAKTIKUM FARMASI
FISIKA
PERCOBAAN 2 : PENGARUH PELARUT CAMPUR TERHADAP
KELARUTAN ZAT
Disusun oleh,
Kelompok 5
Ashry Nurrachmah
31113007
Ina Lisnawati
31113021
Irfan Maulana
31113023
Novia Hergiani
31113035
Tia Sulistiani
31113049
PROGRAM STUDI S1 FARMASI
STIKes BAKTI TUNAS HUSADA TASIKMALAYA
2015
PENDAHULUAN
A. Latar Belakang
Kelarutan suatu senyawa dalam zat pelarut tergantung sifat fisik dan kimia dari zat terlarut tersebut. Salah satu sifat fisika yang dapat kita amati setiap saat adalah peristiwa larutnya suatu zat padat dalam pelarut air. Konsentrasi zat terlarut dalam larutan jenuh pada temperatur tertentu disebut sebagai kelarutan.
Larutan merupakan suatu campuran homogen antara 2 zat dari molekul, atom ataupun ion dimana zat yang dimaksud disini adalah zat padat, minyak larut dalam air. Secara kuantitatif, kelarutan suatu zat dinyatakan sebagai konsentrasi zat terlarut di dalam larutan jenuhnya pada suhu dan tekanan tertentu.
Kelarutan mempunyai peranan yang sangat penting dalam dunia farmasi karena suatu obat baru dapat diabsorbsi setelah zat aktifnya terlarut dalam cairan usus, sehingga salah satu usaha mempertinggi efek farmakologi dari sediaan adalah dengan menaikkan kelarutan zat aktifnya. Selain itu dapat membantu para ahli farmasi dalam membantunya memilih medium pelarut yang paling baik untuk obat atau kombinasi obat, dapat membantu mengatasi kesulitan-kesulitan tertentu yang timbul pada waktu pembuatan larutan farmasetis dan lebih jauh lagi dapat bertindak sebagai standar uji kemurnian, pengetahuan yang lebih mendetail mengenai kelarutan dan sifat-sifat yang berhubungan dengan itu juga memberikan informasi mengenai struktur obat dan gaya antarmolekul obat. Kelarutan dari suatu senyawa bergantung pada sifat kimia dan fisika zat terlarut dan pelarut, juga bergantung pada factor temperatur, tekanan, pH dan untuk jumlah yang lebih kecil bergantung pada hal terbaginya zat terlarut. Dalam percobaan ini akan dilakukan uji kelarutan asam benzoat dan asam borat dalam pelarut air.
B. Tujuan
Adapun tujuan praktikum ini adalah untuk :
a. Menentukan kelarutan suatu zat secara kuantitatif
b. Mengetahui pengaruh pelarut campur terhadap kelarutan zat
BAB II
TINJAUAN PUSTAKA
A. Dasar Terori
dibedakan antara larutan dari gas, cairan dan bahan padat dalam cairan. Disamping itu terdapat larutan dalam keadaan padat (misalnya gelas, pembentukan kristal campuran) (Voight, 1994).
Kelarutan dalam Farmakope Indonesia, diartikan dengan kelarutan pada suhu 200C
(FI III) atau 250C (FI IV) dinyatakan dalam satu bagian bobot zatpadat atau 1 bagian volume
zat cair dalam bagian volume tertentu pelarut, kecuali dinyatakan lain.
Perubahan kelarutan dengan tekanan tak mempunyai arti penting yang praktis dalam analisis anorganik kualitatif, karena semua pekerjaan dilakukan dalam bejana terbuka pada tekanan atmosfer, perubahan yang sedikit daritekanan atmosfer tak mempunyai pengaruh yang berarti atas kelarutan. Terlebih penting adalah perubahan kelarutan dengan suhu (Svehla, 1979).
Kelarutan suatu senyawa dinyatakan dalam gr/lt. Besarnya kelarutan suatu senyawa adalah jumlah maksimal senyawa bersangkutan yang larut dalam sejumlah pelarut tertentu pada suatu suhu tertentu dan merupakan larutan jenuh yang ada dalam kesetimbangan dengan bentuk padatnya (Roth, 1988).
Kelarutan suatu bahan dalam suatu pelarut tertentu menunjukkan konsentrasi maksimum larutan yang dapat dibuat dari bahan dan pelarut tersebut. Bila suatu pelarut pada suhu tertentu melarutkan semua zat terlarut sampai batas daya melarutnya, larutan ini disebut larutan jenuh. Agar supaya diperhatikan berbagai kemungkinan kelarutan diantara dua macam bahan kimia yang menentukan jumlah masing-masing yang diperlukan untuk membuat larutan jenuh, disebutkan dua contoh sediaan resmi larutan jenuh dalam air, yaitu larutan Topical Kalsium HIdroksida, USP (Calcium Hydroxide Topical Solution, USP), dan larutan oral Kalium Iodida, USP (Potassium Iodida Oral Solution, USP). Larutan yang pertama dibuat dengan mencampur kalisihidroksida dalam jumlah yang tepat dengan air murni, mengandung hanya 140 mg zat terlarut yang larut per 100 ml. Lrutan pada suhu 250
C, sedangkan larutan yang berikutnya mengandung kira-kira 100 g zat terlarut per 100 ml larutan, lebih dari 700 kali sebanyak zat terlarut yang terdapat dalam larutan topikal kalsium hidroksida (Ansel, 1989).
Dalam istilah fisika kimia, larutan dipersiapkan dari campuran yang mana saja dari tiga keadaaan zat yaitu padat, cair, dan gas. Dalam istilah farmasi, larutan yang didefinisikan sebagai sediaan cair yang mengandung satu atau lebih zat kimia yang dapat larut, biasanya dilarutkan dalam air yang karena bahannya, cara peracikan atau penggunaannya dalam golongan produk lainnya. Sesungguhnya banyak produk farmasi melarut prinsip kimia fisika merupakan campuran homogen dari zat terlarut yang dilarutkan dalam pelarut, menurut prinsip farmasi digolongkan ke dalam jenis produk lain (Ansel, 1989).
Metode sederhana untuk menentukan kelarutan sebagian besar senyawa atau bahan campuran adalah mengocok dengan lama zat bubuk halus dengan zat terlarut pada temperatur yang diperlukan hingga tercapai keseimbangan. Larutan itu kemudian disaring dan untuk menentukan bahan yang melarutkan dengan metode yang cocok seperti metode fisika dan kimia atau dengan menggunakan sifat fisika, larutan sebagai indeks bias.
Kelarutan obat sebagian besar disebabkan oleh poaritas dari pelarut, yaitu oleh dipol momennya. Pelarut polar melarutkan zat terlarut ionik dan zat polar lainnya. Sesuai dengan itu, air bercampur dengan alkohol dalam segala perbandingan dan melarutkan gula dan senyawa polihidroksi yang lain (Martin, 2008).
Aksi pelarut dari cairan nonpolar, seperti hidrokarbon, berbeda dengan zat polar. Pelarut nonpolar tidak dapat mengurangi gaya tarik-menarik antara ion-ion elektrolit kuat dan lemah, karena tetapan dielektrik pelarut yang rendah. Pelarut juga tidak dapat memecahkan ikatan kovalen dan elektrolit yang berionisasi lemah karena pelarut aprotik, dan tidak dapat membentuk jembatan hidrogen dengan nonelektrolit. Oleh karena itu zat terlarut ionik dan polar tidak larut atau hanya dapat larut sedikit dalam pelarut nonpolar (Martin, 2008).
Pelarut semipolar seperti keton dan alkohol dapat menginduksi suatu derajat polaritas tertentu dalam molekul pelarut nonpolar, sehingga menjadi dapat larut dalam alkohol, contohnya benzena yang mudah dapat dipolarisasikan. Kenyataanya, senyawa semipolar dapat bertindak sebagai pelarut perantara yang dapat menyebabkan bercampurnya cairan polar dan nonpolar. Sesuai dengan itu, aseton menaikkan kelarutan eter di dalam air (Martin, 2008).
Nama lain : Air suling RM / BM : H2O / 18,02
Pemerian : Cairan jernih, tidak berwarna, tidak berbau, tidak mempunyai rasa. Penyimpanan : Dalam wadah tertutup rapat
Kegunaan : Sebagai pelarut
2. Alkohol (Ditjen POM, FI IV: 63)
Nama resmi : AETHANOLUM Sinonim : Etanol, etil alcohol Rumus Molekul : C2H6O
Berat Molekul : 46,07
Pemerian : cairan mudah menguap,tidak berwarna, jernih,. Bau khas dan menyebabkan rasa terbakar pada lidah, mudah terbakar.
Kelarutan : bercampur dengan air dan praktis bercampur dengan pelarut organik lain.
Penyimpanan : Dalam wadah tertutup rapat Kegunaan : Sebagai pelarut
3. Propilen glikol (Ditjen POM, FI IV : 712)
Nama resmi : PROPYLENGLYCOLUM Sinonim : Propilen glikol
Rumus Molekul : C3H8O2
Berat Molekul : 76,09
Pemerian : cairan kental, jernih, tidak berwarna, rasa khas, praktis tidak berbau, menyerap air pada udara lembab
Kelarutan : dapat bercampur dengan air, dengan aseton, dan dengan kloroform, larut dalam eter dan beberapa minyak esensial tetapi tidak dapat bercampur dengan minyak lemak.
Penyimpanan : Dalam wadah tertutup baik Kegunaan : Sebagai pelarut
4. Luminal (Ditjen POM, FI IV : 659)
Pemerian : hablur kecil atau serbuk hablur putih berkilat; tidak berbau; tidak berasa; dapat terjadi polimorfisma. Stabil di udara; pH larutan jenuh lebih kurang 5
Kelarutan : sangat sukar larut dalam air; larut dalam etanol, dalam eter, dan dalam larutan alkali hidroksida dan dalam alkali karbonat; agak sukar larut dalam kloroform
Penyimpanan : Dalam wadah tertutup baik Kegunaan : Sebagai sampel
5. Natrium Hidroksida (FI Edisi III Hal 412)
Nama Resmi : NATRII HYDROXYDUM Nama Lain : Natrium Hidroksida
Rumus Molekul : NaOH Berat Molekul : 40,00
Pemerian : Bentuk batang, butiran, massa hablur atau keeping, kering, keras, rapuh dan menunjukkan susunan hablur; putih, mudah meleleh basah. Sangat alkalis dan korosif. Segera menyerap karbondioksida.
Kelarutan : Sangat mudah larut dalam air dan etanol (95%) P. Penyimpanan : Dalam wadah tertutup baik
6. Indikator PP (FI Edisi III hal : 675)
Nama Resmi : FENOLFTALEIN
Nama Lain : Fenolftalein, Indikator PP RM : C20H14O4
BM : 318,33
Pemerian : Serbuk hablur putih atau putih kekuningan lemah, tidak beberbau, stabil di udara.
Kelarutan : Praktis tidak larut dalam air, larut dalam etanol Penyimpana : Dalam wadah tertutup rapat
K/P : Zat tambahan, indicator
C. Prinsip Percobaan
larutannya dengan cara titrasi alkalimetri. Pentiter yang digunakan adalah larutan NaOH 0,1 N yang sebelumnya telah dibakukkan terlebih dahulu. Dan digunakan indikator Phenolftalen, sehingga diperoleh titik akhir titrasi dari warna bening menjadi warna merah muda.
BAB III
METODE PRAKTIKUM A. Waktu dan Tempat
Praktikum kelarutan ini berlangsung pada hari Senin tanggal 23 Februari 2015 di Laboratorium Farmakologi Farmasi STIKes BTH Tasikmlaya.
B. Alat dan Bahan
a. Alat
Alat-alat yang digunakan dalam praktikum ini adalah Erlenmeyer, buret, gelas ukur b. Bahan
Bahan-bahan yang digunakan dalam percobaan ini adalah aquades, alkohol, propilen glikol, NaoH 0,1 N , indikator PP , Luminal
C. Prosedur Kerja
Buat campuran pelarut seperti dibawah ini :
Larutkan luminal sedikit demi sedikit kedalam masing masing larutan lalu kocok sampai larutan jenuh
Saring masing-masing larutan
Tentukan kadar luminal dengan menitrasi filtrate masing masing larutan menggunakan peniter NaOH 0,1 N dan indicator Phenolftalein
1ml NaOH ~ 23,22 mg luminal
BAB IV
HASIL DAN PEMBAHASAN
10 ml alkohol 1,25 ml
propilenglik ol
A B C D E F G H
A B C D
H G
A. Data Hasil Pengamatan
a. Hasil Pengamatan
- Pembakuan NaOH 0,1 N
Titrasi Ke Berat Asam oksalat (mg) Volume NaOH (ml)
I 60 mg 9,9 ml
II 60 mg 10,7 ml
III 60 mg 10,3 ml
- Pengaruh pelarut campur terhadap kelarutan Luminal
Larutan Air
Pembakuan NaOH 0,1 N
VNaOH = 9,9+10,73 +10,3 = 10,3 ml
VNaOH x N NaOH = mg asamoksalat
BE asam oksalat
Penentuan kadar luminal (mg) 1 ml NaOH ~ 23,22 mg Luminal
A. Kadar luminal (mg) = V NaOH x mg Luminal
Pelarut Campur(ml)
= 185,825mgml/ml
= 7,43 mg/ml
B. Kadar luminal (mg) = V NaOH x mg Luminal
Pelarut Campur(ml)
= 8,2ml x23,22mg 25ml
= 190,425mgml/ml
= 7,61 mg/ml
C. Kadar luminal (mg) = V NaOH x mg Luminal
Pelarut Campur(ml)
= 8,2ml x23,22mg 25ml
= 190,425mgml/ml
= 7,62 mg/ml
D. Kadar luminal (mg) = V NaOH x mg Luminal
Pelarut Campur(ml)
H. Kadar luminal (mg) = V NaOH x mg LuminalPelarut Campur
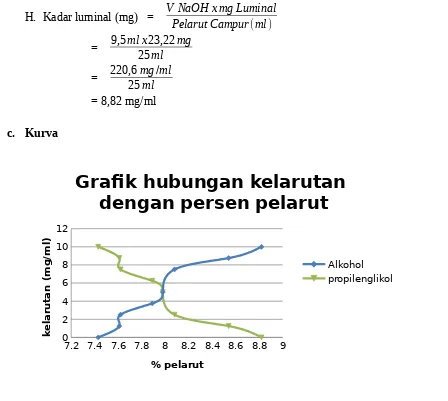
Kelarutan luminal dalam pelarut Alkohol
7.2 7.4 7.6 7.8 8 8.2 8.4 8.6 8.8 9
Kelarutan luminal dalam pelarut Pelarut Propilenglikol
%propilenglikol
Kelarutan dalam besaran kuantitatif didefinisikan sebagai konsentrasi zat terlarut dalam larutan jenuh pada temperatur tertentu, sedangkan secara kualitatif didefinisikan sebagai interaksi spontan dari dua atau lebih zat untuk membentuk dispersi molekuler homogen. Menurut U.S. Pharmacopeia dan National Formulary definisi kelarutan obat adalah jumlah ml pelarut di mana akan larut 1 gram zat terlarut.
partikel zat maka akan mempercepat kelarutan zat, dan dengan adanya garam akan mengurangi kelarutan zat.
Praktikum ini dilakukan untuk mengetahui kelarutan luminal pada pelarut campur. Dalam pengaruh pelarut campur terhadap kelarutan zat, dibuat 25 ml campuran bahan pelarut air, alkohol, dan propilen glikol. Pada percobaan ini, Luminal akan dilarutkan dalam volume air, alkohol dan propilenglikol yang berbeda volume. Pada percobaan pertama, 15 ml air dan 10 ml propilenglikol dicampurkan kemudian ditambahkan luminal, semua campuran itu dikocok selama satu jam hingga larutan jenuh dan timbul endapan, jika campuran setelah dikocok secara mekanik masih berwarna bening, ditambahkan luminal terus menerus. Dilakukan juga dengan campuran : Luminal dan air 15 ml, 1,25 ml alkohol dan 8,75 ml propilenglikol; luminal dan air 15 ml, 2,5 ml alkohol dan 7,5 ml propilenglikol; Luminal dan air 15 ml, 3,75 ml alkohol dan 6,25 ml propilenglikol; Luminal dan air 15 ml, 5 ml alkohol dan 5 ml propilenglikol; Luminal dan air 15 ml, 7,5 ml alkohol dan 2,5 ml propilenglikol; Luminal dan air 15 ml, 8,75 ml alkohol dan 1,25 ml propilenglikol; Luminal dan air 60 ml, 10 ml alkohol dan 0 ml propilenglikol.
Sebelum dilakukan titrasi luminal, dilakukan pembakuan NaOH terlebih dahulu, dengan mentitrasi asam oksalat 60 mg ditambahkan dengan 20 ml air dan 2 tetes phenofthalien. Pembakuan dilakukan sebanyak tiga kali. Setelah delapan campuran diatas dikocok selama 1 jam, kemudian disaring dan dilakukan titrasi dengan NaOH, masing-masing campuran ditambahkan dengan 3 tetes indikator phenofthalien sampai terjadi perubahan warna merah muda. Pada titik ekivalen atau perubahan warna dititik akhir titrasi sangat penting untuk diperhatikan, jika sudah timbul perubahan warna, titrasi harus segera dihentikan, jika tidak, pH dalam larutan tersebut akan berubah dan melampaui pH yang seharusnya.
Luminal ditambahkan agar larutan menjadi lewat jenuh. Menurut Martin, suatu larutan dikatakan lewat jenuh apabila larutan tersebut mengandung zat terlarut dalam konsentrasi lebih banyak daripada yang seharusnya ada pada temperature tertentu, terdapat juga zat terlarut yang tidak larut. Keadaan lewat jenuh mungkin terjadi apabila inti kecil zat terlarut yang dibutuhkan untuk pembentukan Kristal permulaan adalah lebih mudah larut daripada Kristal besar, sehingga menyebabkan sulitnya inti terbentuk dan tumbuh dengan akibat kegagalan kristalisasi.
menjadi jenuhh. Jika zat itu ditambahkan ke dalam pelarut tidak tercampur dalam jumlah yang tidak cukup untuk menjenuhkan larutan, maka zat tersebut tetap berdistribusi diantara kedua lapisan dengan perbandingan konsentrasi tertentu.
Luminal atau phenobarbital adalah salah satu contoh bahan obat. Menurut Martin ada faktor yang mempengaruhi kelarutan suatu obat. Elektrolit lemah dapat bersifat seperti elektrolit kuat dan seperti non elektrolit dalam larutan. Apabila larutan berada pada pH di mana obat seluruhnya berbentuk ion, maka larutan tersebut berbentuk ion, sehingga larutan tersebut bersifat sebagai larutan elektrolit kuat dan kelarutan merupakan masalah yang tidak serius. Tetapi, apabila pH disesuaikan pada harga pH di mana molekul tidak terdisosiasi diproduksi dalam konsentrasi yang cukup untuk mencapai kelarutan dalam bentuk ini, terjadilah pengendapan.
Seringkali zat terlarut lebih lebih larut dalam campuran pelarut daripada dalam satu pelarut saja. Gejala ini dikenal dengan melarut bersama (cosolvency), dan pelarut yang dalam kombinasi menaikkan kelatutan zat disebut cosolvent. Cairan propelien glikol memiliki sifat yang lebih kental cairannya dibandingkan air dan alkohol. Pada saat pencampuran ketiga cairan, propilen glikol tidak bisa cepat larut dalam air jadi harus diperlukan bantuan pengocokan untuk menghomogenkan ketiga campuran tersebut,
Dari hasil kurva hubungan antara kelarutan luminal dengan campuran pelarut air, alkohol dan propilenglikol, didapatkan hasil yang signifikan. Dari kurva kelarutan luminal dalam pelarut alkohol, didapatkan bentuk kurva yang naik. Karena kurang polar dibandingkan air, alkohol menurunkan disosiasi elektrolit lemah, dan kelarutan obat turun apabila tetapan disosiasi turun (pKa naik). Walaupun penambahan alkohol menaikkan pKa, penambahan itu juga menaikkan kelarutan bentuk obat yang tidak terionisasi secara cukup dalam air sehingga pH dapat berkurang sebelum terjadi pengendapan.
Berbeda halnya dengan hasil kurva kealrutan luminal dalam pelarut propilenglikol. Dari kurva kelarutan luminal dalam pelarut alkohol, didapatkan bentuk kurva yang turun. Ini membuktikan bahwa kelarutan luminal pada alkohol lebih baik dari pada kealrutan luminal pada propilenglikol.
BAB III
PENUTUP
A. Kesimpulan
Dari hasil praktikum dapat disimpulkan :
1. Larutan jenuh adalah larutan yang mengandung zat terlarut dalam konsentrasi lebih banyak daripada yang seharusnya ada pada temperature tertentu, terdapat juga zat terlarut yang tidak larut.
2. Kelarutan pelarut campur terhadap kelarutan luminal : Larutan A = 7,43 (mg/ml)
Larutan B = 7,61 (mg/ml) Larutan C = 7,62 (mg/ml) Larutan D = 7,89 (mg/ml) Larutan E = 7,98 (mg/ml) Larutan F = 8,08 (mg/ml) Larutan G = 8,54 (mg/ml) Larutan H = 8,82 (mg/ml)
B. Saran
Sebaiknya dalam parktikum ini menggunakan alat khusus untuk pengocokkan (Orbital Shaker) sehingga didapatkan hasil yang sempurna, dan kesalahan pada saat praktikum dapat diperkecil.
DAFTAR PUSTAKA
Ansel, Howart C . 1989 . Pengantar Bentuk Sediaan Farmasi . Jakarta : Universitas
Indonesia.
Ditjen POM . 1979. Farmakope Indonesia Edisi III. Jakarta : Departemen Kesehatan RI.
Dirjen POM. 1995. Farmakope Indonesia Edisi IV. Jakarta : Departemen Kesehatan RI
Anief, M . 2003 . Ilmu Meracik Obat Teori dan Praktik . Yogyakarta : UGM-Press.
R. Voight . 1994 . Buku Pelajaran Teknologi Farmasi, Edisi Kelima . Yogyakarta : Gadjah
Mada University Press.
Roth, Hermann, J . 1988 . Analisis Farmasi . Yogyakarta : UGM-Press
Ansel C. Howard.1989 . Pengantar Bentuk Sediaan Farmasi. Jakarta : Universitas Indonesia
Press.
Underwood, A,L. 1993 . Analisa Kimia Kuantitatif . Surabaya : Erlangga.
LAMPIRAN
Pembuatan campuran larutan
Penyaringan larutan Penentuan kadar larutan dengan titrasi