UIN SYARIF HIDAYATULLAH JAKARTA
PENGARUH SUHU TERHADAP DAYA TAHAN
HIDUP BAKTERI PADA SEDIAAN PROBIOTIK
SKRIPSI
FAUZIAH UTAMI
109102000004
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
UIN SYARIF HIDAYATULLAH JAKARTA
PENGARUH SUHU TERHADAP DAYA TAHAN
HIDUP BAKTERI PADA SEDIAAN PROBIOTIK
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
FAUZIAH UTAMI
109102000004
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
Skripsi ini adalah hasil karya saya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama : Fauziah Utami NIM : 109102000004 Tanda tangan :
Nama : Fauziah Utami
NIM : 109102000004
Program Studi : Farmasi
Judul Skripsi : Pengaruh Suhu Terhadap Daya Tahan Hidup Bakteri pada Sediaan Probiotik
Menyetujui
Pembimbing I Pembimbing II
Ofa Suzanti Betha, M.Si.,Apt Yuni Anggraeni, M.Farm., Apt
NIP. 19750104 200912 001 NIP. 19831028 200901 2 008
Mengetahui,
Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif idayatullah
HALAMAN PENGESAHAN
Skripsi ini diajukan oleh :
Nama : Fauziah Utami
NIM : 109102000004
Program Studi : Farmasi
Judul : Pengaruh Suhu Terhadap Daya Tahan Hidup Bakteri pada Sediaan Probiotik
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
DEWAN PENGUJI
Pembimbing 1 : Ofa Suzanti Betha, M.Si., Apt ( )
Pembimbing 2 : Yuni Anggraeni, M.Farm., Apt ( )
Penguji 1 : Prof.Dr.Atiek Soemiati M.Si., Apt ( )
Penguji 2 : Nelly Suryani, Ph.D., Apt ( )
Ditetapkan di : Ciputat
Program Studi : Farmasi
Judul : Pengaruh Suhu Terhadap Daya Tahan Hidup Bakteri pada Sediaan Probiotik
Penggunaan probiotik pada sediaan farmasi dipercaya dapat menyeimbangkan flora normal usus, meningkatkan sistem imun dan sebagai antikarsinogenik. Agar dapat memberikan manfaat, probiotik harus memiliki viabilitas yang baik selama proses pembuatan hingga penyimpanan, namun suhu penyimpanan seringkali menjadi aspek yang terlupakan oleh konsumen dalam menyimpan probiotik. Penelitian ini bertujuan untuk mengetahui pengaruh suhu penyimpanan terhadap viabilitas tiga sediaan probiotik yaitu sampel X yang mengandung Lactobacillus achidophilus, sampel Y yang mengandung Lactobacillus reuteri dan sampel Z yang mengandung Lactobacillus sporogenes. Ketiga sampel disimpan pada suhu 4○C, 25○C dan 44○C selama 28 hari penyimpanan. Pengujian dilakukan dengan menggunakan metode standar plate count dengan interval waktu pengujian 0, 1, 2, 3 dan 4 minggu penyimpanan. Hasil penelitian menunjukkan bahwa suhu penyimpanan 4○C dapat mempertahankan viabilitas sampel X, Y dan Z. Namun, suhu penyimpanan 25○C hanya dapat mempertahankan viabilitas sampel X dan Z. Sedangkan suhu penyimpanan 44○C menurunkan viabilitas sampel X, Y dan Z.
Name : Fauziah Utami Programme Study : Pharmacy
Tittle : Effect of Temperature on The Viability of Bacteria in Probiotic Preparations
Use of probiotics in pharmaceutical preparations can reliably balance the normal intestinal flora, improve the immune system and as an anticarcinogenic. To be able provide benefits, probiotics must have good viability during process of manufacture to storage. However, the storage temperature is often a forgotten aspect of a consumer store probiotics. The objective of this research is determine effect of storage temperatures on the survival of bacteria in three samples probiotic preparations are sample X containing Lactobacillus achidophilus, sample Y containing Lactobacillus reuteri and sample Z containing Lactobacillus sporogenes. All samples were stored at 4○C, 25○C and 44○C for 28 days of storage. Tests performed by using standard plate count method with interval testing 0, 1, 2, 3 and 4 weeks of storage. The results showed that the storage temperature at 4○C can maintain viability of the samples X, Y and Z. However, the storage temperature at 25○C can only maintain viability of the sample X and Z While storage temperature at 44○C decrease viability of samples X, Y and Z.
Puji dan syukur saya panjatkan kehadirat Allah SWT, atas segala limpahan
nikmat, rahmat, dan karunia yang telah diberikan kepada saya sehingga dapat
menyelesaikan skripsi dengan judul Pengaruh Suhu terhadap Daya Tahan Hidup Bakteri pada Sediaan Probiotik dalam rangka menyelesaikan tugas akhir pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas
Islam Negeri Syarif Hidayatullah Jakarta.
. Keberhasilan dalam penyelesaian skripsi ini tidak lepas dari bantuan
serta dukungan orang-orang yang telah banyak berjasa. Pada kesempatan kali ini,
penulis ucapkan terimakasih dan penghargaan sebesar-besarnya kepada :
1. Bapak Prof.Dr.(hc) dr.M.K Tadjudin Sp.And, selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatulah Jakarta.
2. Bapak Drs. Umar Mansur, M.Sc, selaku Ketua Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatulah Jakarta
3. Ibu Yuni Anggraeni M.Farm.,Apt selaku dosen pembimbing akademik
yang telah memberi arahan dan saran selama perkuliahan.
4. Ibu Ofa Suzanti Betha M.Si.,Apt, selaku Pembimbing I yang telah
memberi arahan, masukan dan bimbingan dalam penulisan skripsi ini.
5. Ibu Yuni Anggraeni M.Farm.,Apt selaku Pembimbing II yang telah
memberi masukan, arahan dan motivasi dalam penulisan skripsi ini
6. Kedua Orangtua dan kakak saya yang selalu menyebut saya daam doanya,
yang selalu memberi motivasi dan menjadi semangat dalam penulisan
skripsi ini.
7. Para dosen yang telah membantu penulis selama mengikuti perkuliahan di
Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN
Syarif Hidayatulah Jakarta
8. Sahabat-Sahabat tercinta yang menjadi teman satu bimbingan, tempat
bertukar pikiran dan berbagi ide dalam penulisan skripsi ini yaitu Warda
Nabiela dan Nadya Zahrayny dan yang selalu membantu dalam
9. Sahabat Alfrida Tatsa Haifa yang dengan ikhlas menjadi notulen dalam
seminar proposal penulis
10.Sahabat Indah Fadlul Maula yang meluangkan waktu untuk memberi
masukan dan saran penulisan.
11.Sahabat Gian Pertela yang mengajari cara mengolah data dengan SPSS 20.
12.Sahabat Muhammad Arif yang dengan ikhlas mengantarkan membeli alat
dan bahan penelitian.
13.Para Laboran yang senantiasa membantu penulis dalam penelitian ini
yaktu kak Lisna, Kak Rani, Kak Yopi, Kak Eris, Kak Liken, Kak
Rahmadi, dan Kak Tiwi.
14.Sahabat Sahabat teman satu perjuangan yang senantiasa selalu ada
menemani saya baik dalam suka maupun duka dan selalu menghibur
dalam kebersamaan yaitu Qaffah Silma Azas, Widya Larasaty, Andy
Risky, Sonia Zulfa, Hani Haifa, Evira Vivikananda, Siti Zamilatul
Azkiyah, Mutia Sari Wardhana, Agung Priyanto, RisdaYulianti, Hissi
Fitriyah, Dina permata, Nurul Fitrializa, Nova Yanti, Vita Fitria, Putri
Assifa, Maulida Putri, Istiqomah, Muhammad Irsyad, Nurfitriyani,
Chairunnisa.
15.Dan sahabat-sahabat Farmasi Angkatan 2009 yang tak bisa disebutkan
satu per satu dan menemani perjuangan menuntut ilmu selama 4 tahun ini.
Dan kepada semua pihak yang tidak dapat penulis sebutkan satu
per satu, penulis juga menyampaikan terimakasih dan penghargaan yang
setinggi-tingginya. Karya ini merupakan persembaan terbaik penulis,
namun tiada luput dari kekurangan walau demikian penulis tetap berharap
semoga karya ini dapat bermanfaat bagi yang membacanya.
Jakarta, 30 Juli 2013
TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah
Jakarta, saya yang bertanda tangan di bawah ini :
Nama : Fauziah Utami
NIM : 109102000004
Program Studi : Farmasi
Fakultas : Fakultas Kedokteran dan Ilmu Kesehatan (FKIK)
Jenis Karya : Skripsi
demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah
saya, dangan judul :
PENGARUH SUHU TERHADAP DAYA TAHAN HIDUP BAKTERI PADA SEDIAAN PROBIOTIK
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital
Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah
Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang
Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan
sebenarnya.
Dibuat di : Ciputat
Pada Tanggal : 30 Juli 2013
Yang menyatakan,
DAFTAR ISI
Hal
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN SKRIPSI ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... vii
HALAMAN PERSETUJUAN PUBLIKASI ILMIAH ... x
DAFTAR ISI ... xi
2.2.1 Lactobacillus sp ... 7
2.2.2 Bifidobacteria sp ... 8
2.2.3 Enterococcus sp ... 8
2.2.4 Streptococcus sp ... 9
2.3 Terapi Probiotik ... 9
2.4 Dosis Probiotik ... 13
2.5 Faktor-Faktor yang Mempengaruhi Viabilitas Probiotik ... 16
BAB 3 METODE PENELITIAN ... 19
3.3.1 Preparasi Alat dan Bahan yang Digunakan ... 19
3.3.1.1 Preparasi Alat... 20
3.3.3 Pengujian Viabilitas Bakteri pada Sampel X, Y dan Z .... 21
3.4 Analisa Data ... 21
BAB 4 HASIL DAN PEMBAHASAN ... 22
4.1 Pemilihan dan Preparasi Sampel ... 22
4.2 Pertumbuhan Koloni Bakteri Sampel X, Y dan Z pada Medium MRSA ... 23
4.3 Identifikasi Bakteri Sampel X, Y dan Z dengan Pewarnaan Gram ... 23
4.4 Hasil Pengujian dan Analisa Data Viabilitas Sampel X pada Penyimpanan Suhu 4○, 25○ dan 44○C ... 24
4.5 Hasil Pengujian dan Analisa Data Viabilitas Sampel Y pada Penyimpanan Suhu 4○, 25○ dan 44○C ... 26
4.6 Hasil Pengujian dan Analisa Data Viabilitas Sampel Z pada Penyimpanan Suhu 4○, 25○ dan 44○C ... 28
BAB 5 KESIMPULAN DAN SARAN ... 33
5.1 Kesimpulan ... 33
5.2 Saran ... 33
Hal
Gambar 4.1 Koloni Sampel X, Y dan Z ... 23
Gambar 4.2 Pewrnaan Gram Sampel X, Y dan Z ... 24
Gambar 4.3 Hubungan Antara Waktu Penyimpanan dengan Viabilitas Sampel
X pada Penyimpanan Suhu 4○, 25○ dan 44○C ... 26 Gambar 4.4 Hubungan Antara Waktu Penyimpanan dengan Viabilitas Sampel
Y pada Penyimpanan Suhu 4○, 25○ dan 44○C ... 28 Gambar 4.5 Hubungan Antara Waktu Penyimpanan dengan Viabilitas Sampel
Hal
Tabel 2.1 Beberapa Mikroorganisme yang Berperan Sebagai Probiotik ... 6 Tabel 2.2 Variasi Dosis Probiotik dengan Berbagai Kondisi Kesehatan ... 14 Tabel 4.1 Jumlah Total Bakteri Sampel X Selama Periode Penyimpanan ... 24 Tabel 4.2 Hasil Analisa Data Jumlah Bakteri Sampel X dengan Menggunakan
Metode Uji One Way Repeated Measures Anova ... 25 Tabel 4.3 Jumlah Total Bakteri Sampel Y Selama Periode Penyimpanan ... 26 Tabel 4.4 Hasil Analisa Data Jumlah Bakteri Sampel Y dengan Menggunakan
Metode Uji One Way Repeated Measures Anova ... 27 Tabel 4.5 Jumlah Total Bakteri Sampel Z Selama Periode Penyimpanan ... 28 Tabel 4.6 Hasil Analisa Data Jumlah Bakteri Sampel Z dengan Menggunakan
Hal
Lampiran 1. Alur Penelitian ... 37
Lampiran 2. Media perbenihan Man De Rogosa Sharpe Agar ... 38
Lampiran 3 Cerficate of Analysis Medium MRSA ... 39
Lampiran 4. Data Sampel X ... 40
Lampiran 5. Data Sampel Y ... 41
Lampiran 6. Data Sampel Z ... 42
Lampiran 7. Skema Kerja Viabilitas Bakteri Sampel X ... 43
Lampiran 8. Skema Kerja Viabilitas Bakteri Sampel Y ... 44
Lampiran 9. Skema Kerja Viabilitas Bakteri Sampel Z ... 45
Lampiran 10. Perhitungan Jumlah Total Bakteri Sampel X ... 46
Lampiran 11. Perhitungan Jumlah Total Bakteri Sampel Y ... 47
Lampiran 12. Perhitungan Jumlah Total Bakteri Sampel Z ... 48
Lampiran 13. Koloni Bakteri yang Tumbuh pada Sampel X ... 59
Lampiran 14. Koloni Bakteri yang Tumbuh pada Sampel Y ... 51
Lampiran 15. Koloni Bakteri yang Tumbuh pada Sampel Z ... 52
Lampiran 16. Perbandingan Jumlah Total Bakteri Sampel X pada Suhu 4○ C dengan One Way Repeated Measures Anova ... 53
Lampiran 17. Perbandingan Jumlah Total bakteri Sampel X pada Suhu 25○ C dengan One Way Repeated Measures Anova ... 54
Lampiran 18. Perbandingan Jumlah Total bakteri Sampel X pada Suhu 44○ C dengan One Way Repeated Measures Anova ... 55
Lampiran 19. Perbandingan Jumlah Total bakteri Sampel Y pada Suhu 4○ C dengan One Way Repeated Measures Anova ... 56
Lampiran 20. Perbandingan Jumlah Total bakteri Sampel Y pada Suhu 25○ C dengan One Way Repeated Measures Anova ... 57
Lampiran 21. Perbandingan Jumlah Total bakteri Sampel Y pada Suhu 44○ C dengan One Way Repeated Measures Anova ... 58
Lampiran 22. Perbandingan Jumlah Total bakteri Sampel Z pada Suhu 4○ C dengan One Way Repeated Measures Anova ... 59
Lampiran 23. Perbandingan Jumlah Total bakteri Sampel Z pada Suhu 25○ C dengan One Way Repeated Measures Anova ... 60
1.1 Latar Belakang
Probiotik didefinisikan sebagai mikroorganisme hidup non-patogenik,
yang jika dikonsumsi dalam jumlah tertentu akan memberikan efek
menguntungkan bagi inang. Probiotik dapat dikonsumsi setiap hari sebagai
suplemen makanan yang dapat menjaga keseimbangan dalam ekosistem
mikrobiota usus (WHO, 2001). Probiotik juga dapat memberikan manfaat
kesehatan seperti meningkatkan resistensi terhadap penyakit infeksi seperti diare
(WHO, 2001), menurunkan tekanan darah dan kolesterol (Yulinery, et al,. 2006),
mereduksi alergi, intoleransi laktosa (Simadibrata, 2011), meningkatkan sistem
imun tubuh (Prasetyo dan dan Purwanto, 2010) dan manfaat lainnya.
Pada dasarnya konsumsi probiotik dapat diperoleh dari tiga sumber yaitu
produk-produk susu fermentasi seperti yogurt yang mengandung sel Lactobacillus
bulgaricus dan Streptococcus termophilus, suplemen makanan dan minuman yang
mengandung satu atau beberapa macam mikroba yang bermanfaat seperti
L.acidophilus, L.reuteri, L.casei dan Bifidobacteria serta produk farmasi seperti
tablet, kapsul atau granula yang mengandung konsentrat sel bakteri (Harmayani,
et al., 2001).
Sediaan probiotik relatif mudah ditemukan di pasaran, namun hal yang
harus diperhatikan oleh konsumen adalah belum adanya jaminan mutu sediaan,
ditinjau dari jumlah probiotik sesuai dengan komposisi yang tercantum dalam
kemasan dan tetap hidupnya probiotik tersebut saat mencapai usus. Hal ini
dikarenakan jaminan mutu sediaan pada dasarnya dipengaruhi oleh karakteristik
dari probiotik itu sendiri. Untuk mengetahui jaminan mutu suatu sediaan terdapat
beberapa kriteria yang harus dipenuhi untuk suatu produk probiotik di antaranya
adalah sifat fisik yang baik dan dapat stabil selama proses pembuatan hingga
penyimpanan. Syarat lainnya adalah tidak bersifat patogen dan aman untuk
dikonsumsi. Strain probiotik juga harus tahan dan tetap hidup selama proses
makanan serta tahan terhadap proses fisika kimia pada makanan (Saarela, et al.,
2000).
Salah satunya dilihat dari aspek viabilitas sediaan yang baik. Viabilitas
merupakan jumlah sel hidup yang diperkirakan sebagai ukuran konsentrasi sel
yang ada dalam produk (Yulinery, et al., 2009). Viabilitas yang stabil
menunjukkan ketahanan yang baik terhadap pengaruh lingkungan. Hal ini
diperlukan untuk memastikan bahwa probiotik tetap hidup dalam produk selama
masa simpan. Sayangnya aspek ini tidak selalu diperhatikan, sebagaimana
diketahui terdapat laporan yang mengatakan bahwa dalam sejumlah produk
komersial, tingkat probiotik yang layak tidak memenuhi kriteria peraturan dalam
masa penyimpanan (Malago, et al., 2011). Faktor-faktor yang mempengaruhi
pertumbuhan dan viabilitas bakteri probiotik diantaranya kondisi fisiologis, suhu,
pH, aktivitas air, dan oksigen. Sejumlah faktor-faktor tersebut perlu diperhatikan
untuk mendapat efek maksimal dari probiotik yang dikonsumsi ( Neha, et al.,
2012).
Seperti disebutkan diatas, suhu penyimpanan menjadi salah satu faktor
penting yang mempengaruhi ketahanan hidup bakteri. Selama proses pembuatan,
penggunaan suhu melebihi 45-50○C akan merusak kelangsungan hidup bakteri probiotik karena viabilitas bubuk probiotik menurun dengan meningkatnya suhu
penyimpanan. Sedangkan pada suhu rendah (4-7○C) kelangsungan hidup bakteri dapat dipertahankan (Yuan Kun Lee et dan Seppo Salminen, 2009). Oleh karena
itu, dibutuhkan kondisi penyimpanan yang ideal untuk mempertahankan viabilitas
probiotik sehingga memberikan efek terapeutik. Secara umum nilai minimum
yang harus dipenuhi sekitar 1x107 cfu/ml bakteri dalam sediaan (WHO, 2001). Berdasarkan definisi probiotik yang telah disebutkan di awal, uji viabilitas
sangat diperlukan untuk menyatakan kelayakan sediaan dianggap sebagai
probiotik. Suhu penyimpanan merupakan salah satu faktor yang mempengaruhi
viabilitas bakteri dalam sediaan. Oleh karena itu, uji ketahanan hidup bakteri
selama penyimpanan dalam jangka waktu tertentu dengan memperhatikan
pengaruh suhu perlu dilakukan sebagai skrining kelayakan produk untuk dapat
memberikan efek optimal. Penelitian kali ini difokuskan untuk mengetahui
pada saat produk yang beredar sudah berada di tangan konsumen. Hal ini
didasarkan pada sejumlah fakta yang ditemui di masyarakat dimana terdapat
kelalaian dalam menyimpan produk–produk probiotik. Padahal, suhu
penyimpanan yang ideal adalah salah satu syarat penting yang harus dipenuhi
untuk mendapatkan manfaat dari kerja suatu probiotik.
1.2 Rumusan Masalah
1. Bagaimana pengaruh suhu penyimpanan terhadap viabilitas bakteri pada
beberapa sediaan probiotik yang beredar ?
2. Bagaimana pengaruh lama waktu penyimpanan terhadap viabilitas bakteri
pada beberapa sediaan probiotik yang beredar ?
1.3 Tujuan Penelitian
3. Untuk mengetahui pengaruh suhu penyimpanan terhadap viabilitas bakteri
pada beberapa sediaan probiotik yang beredar ?
4. Untuk mengetahui pengaruh lama waktu penyimpanan terhadap viabilitas
bakteri pada beberapa sediaan probiotik yang beredar ?
1.4 Manfaat Penelitian
Memberikan informasi mengenai kondisi suhu penyimpanan
optimal yang dapat mempertahankan kelangsungan hidup bakteri dari
sediaan probiotik sehingga dapat memberikan efek yang optimal bagi
TINJAUAN PUSTAKA
2.1 Probiotik
Probiotik berasal dari bahasa Yunani yang berarti hidup. Probiotik adalah
mikroorganisme hidup non patogenik, yang jika dikonsumsi dalam jumlah
tertentu akan memberikan efek menguntungkan bagi inangnya (WHO, 2001).
Probiotik adalah suplemen makanan yang berisi mikroba hidup yang bermanfaat
bagi kesehatan konsumen dengan mempertahankan keseimbangan mikroba usus
(Saarela, et al., 2000). Suatu probiotik dapat dikatakan bermanfaat bagi kesehatan
jika memenuhi kriteria, seperti memiliki teknologi dengan metode pengolahan
yang baik sehingga dapat diimpelementasikan dalam produksi dan disatukan ke
dalam produk makanan tanpa menghilangkan fungsi dan viabilitas dan tidak
mengakibatkan rasa atau tekstur yang tidak disukai. Probiotik ini tersedia dalam
berbagai jenis produk seperti makanan, obat-obatan, dan suplemen makanan
bakteri asam laktat.
Dengan didasarkan pada “Guideline on probiotics and prebiotics” yang disusun oleh FAO/WHO sifat–sifat dari probiotik dapat dijelaskan sebagai
berikut :
1. Tidak kehilangan sifat aslinya selama masa penyimpanan
2. Secara normal berada di saluran pencernaan manusia
3. Harus dapat bertahan hidup, dapat melawan pertahanan barrier
lambung, tahan terhadap kerja pencernaan dari getah lambung, enzim
pencernaan dan garam empedu dan berkoloni di usus. Untuk alasan
inilah, dosis efektif minimal yang sangat indikatif karena sangat
bergantung pada biakan dan preparat yang digunakan, yakni 107 cfu/hari
4. Harus bisa melekat dan berkoloni dengan sel intestinal. Struktur
membran bakteri berperan dalam mekanisme perlekatan dan
berpasangan langsung dengan mukosa, pemukaan protein dan
5. Harus menimbulkan fungsi metabolik pada level pencernaan, yang
bermanfaat bagi kesehatan manusia, dan antagonis mikroorganisme
patogen dengan memproduksi zat anti mikrobial.
6. Tidak menimbulkan reaksi berbahaya (tidak patogen) terhadap sistem
imun atau bahaya lainnya dan juga dinyatakan aman (melalui status
GRAS tertulis “dinyatakan aman”)
7. Resistensi terhadap antibiotik
8. Harus dikelola dalam dosis yang adekuat dan memiliki rasio efikasi
biaya yang tepat dan seimbang (Malago, et al., 2011).
Mekanisme probiotik melindungi atau memperbaiki kondisi kesehatan
yaitu dengan menghambat pertumbuhan bakteri patogen melalui beberapa cara
antara lain :
1. Memproduksi substansi-substansi penghambat. Probiotik mampu
memproduksi zat-zat penghambat pertumbuhan bakteri Gram positif
maupun negatif. Zat-zat ini termasuk asam organik, hidrogen
peroksida (H2O2), bakteriosin yang mampu menghambat tidak hanya
bakteri hidup namun juga memproduksi toksin.
2. Menghambat pertumbuhan bakteri patogen dalam mukosa usus
dengan cara kompetisi untuk mengadakan perekatan dengan enterosit
(sel epitel mukosa), enterosit yang telah jenuh dengan bakteri
probiotik tidak dapat lagi mengadakan perlekatan dengan bakteri yang
lain.
3. Kompetisi nutrisi. Bakteri-bakteri yang menguntungkan (probiotik)
akan berkompetisi dengan bakteri patogen dalam hal memperebutkan
nutrisi pada saluran cerna.
4. Kemampuan untuk mendegradasi prokarsinogen, senyawa
antimutagenik, memodulasi enzim karsinogenik dalam usus, dan
menekan tumor dengan mekanisme respon imun.
5. Memperbaiki respon imun melalui peningkatan ekspresi dari limfosit
B dan sekresi imunoglobulin A baik secara lokal maupun sistemik.
Ketika probiotik berkontak dengan usus yang berasosiasi dengan
dengan menstimulasi respon IgA dan merangsang aktivitas fagositosis
(Simadibrata, 2011).
2.2 Strain Bakteri Probiotik
Strain utama yang digunakan sebagai probiotik untuk manusia adalah
bakteri dari genus Lactobacillus, Bifidobacterium, Enteroccocus, Streptoccocus
dan ragi Saccharomyces. Di antara berbagai mikroorganisme, bakteri dari genus
Lactobacillus dan Bifidobacterium yang paling sering digunakan sebagai
probiotik (Malago, et al., 2011).
Bakteri asam laktat merupakan bakteri yang biasa digunakan sebagai
probiotik. Bakteri ini bersifat nonpatogenik, nontoksikogenik, Gram positif, tidak
menghasilkan spora, bakteri fermentasi yang berkaitan dengan produksi asam
laktat dari karbohidrat (Desai, 2008).
Tabel 2.1 Beberapa Mikroorganisme yang Berperan Sebagai Probiotik
Lactobacillus Bifidobacteria Enterococcus Streptococcus Lactococcus
L.acidophilus
Sumber: (Baffoni dan Biavati, 2008)
Klasifikasi bakteri asam laktat dalam genus yang berbeda sebagian besar
didasarkan pada perbedaan morfologi, cara fermentasi glukosa, pertumbuhan pada
untuk tumbuh pada konsentrasi garam tinggi, dan toleransi terhadap asam atau
basa (Desai, 2008).
Karakteristik penting yang digunakan untuk membedakan genus bakteri
asam laktat yaitu dengan cara fermentasi glukosa yaitu pada saat keterbatasan
konsentrasi glukosa dan faktor pertumbuhan (asam amino, vitamin dan prekursor
asam nukleat) serta terbatasnya ketersediaan oksigen. Dengan kondisi tersebut,
bakteri asam laktat dapat dibagi menjadi dua kelompok yaitu bersifat
homofermentatif (yang mengubah glukosa hampir seluruhnya menjadi asam
laktat) dan heterofermentatif (yang mengubah glukosa fermentasi menjadi asam
laktat, etanol / asam asetat, dan CO2) (Desai, 2008). 2.2.1 Lactobacillus sp
Lactobacillus merupakan bakteri Gram positif fakultatif, tidak membentuk
spora, berbentuk batang atau coccobacilli dan tidak berflagela. Lactobacilli
berbentuk batang yang merupakan bakteri filogenetis yang masuk ke dalam filum
Firmicutes (De vos, et al., 2009). Bakteri ini ditemukan pada tumbuhan dan
berperan penting dalam memberikan kontribusi proses pengasaman dan
pengawetan, aroma dan pengembangan tekstur pada fermentasi makanan namun
kebanyak strain Lactobacillus ini berasal dari manusia. Bakteri ini memiliki
kemampuan untuk memfermentasi laktosa dan monosakarida lainnya menjadi
asam laktat. Contoh bakteri golongan Lactobacillus yang digunakan sebagai
probiotik yaitu L. acidophilus, L. delbrueckii subsp. bulgaricus, L. casei, L.
fermentum, L. plantarum, L. reuteri.
Namun, yang paling banyak digunakan sebagai probiotik adalah
Lactobacillus acidophilus yang bersifat homofermentatif. L. acidophilus bersifat
non motil, tidak berflagela, dan tidak berspora. Bakteri ini merupakan anaerob
fakultatif dan berbentuk batang Gram positif. Bakteri ini memiliki lebar sekitar
0,6-0,9 μm dan panjang 1,5-6,0 μm dengan ujung bulat. Sel mungkin muncul
dalam bentuk tunggal atau berpasangan serta dalam rantai pendek. Pertumbuhan
optimal terjadi pada suhu 35-40°C tetapi dapat mentoleransi suhu sampai 45°C.
2.2.2 Bifidobacteria sp
Bifidobacteria merupakan bagian utama dari flora normal usus yang ada di
sepanjang hidup manusia. Mereka muncul dalam tinja beberapa hari setelah
kelahiran dan meningkat jumlahnya setelah bayi menyusui. Mereka dominan
berada dalam usus besar yang berkontribusi sekitar 6-36% dari mikroflora usus
pada orang dewasa, namun Bifidobacteria jumlahnya menurun dengan
meningkatnya usia.
Bifidobacteria memiliki ciri-ciri seperti non-motil, tidak bersporulasi,
berbentuk batang Gram positif dengan berbagai penampilan, termasuk batang
melengkung pendek, batang berbentuk club dan batang bercabang Y.
Kebanyakan dari bakteri ini bersifat anaerob, namun beberapa dapat mentoleransi
oksigen. Contoh spesies Bifidobacteria seperti B. adolescentis, B. angulatum, B.
bifidum, B. breve, B. catenulatum, B. denticolens, B. dentium, B. gallicum, B.
infantis, B. inopinatum, B. lactis, B. longum, B. Pseudocarenulatum.
Bifidobacteria memproduksi asam asetat dan laktat dalam proses
fermentasi di mana dua mol glukosa menghasilkan tiga mol asetat dan dua mol
laktat. Mereka dapat memfermentasi galaktosa, laktosa dan fruktosa karena
memiliki enzim fruktosa 6 phosphoketolase fosfat.
Bifidobacteria masuk ke dalam kelompok probiotik karena memiliki efek
menguntungkan pada kesehatan inang, termasuk sintesis vitamin. pH optimum
untuk pertumbuhannya adalah 6-7, namun Bifidobacteria lactis BB12
menunjukkan kemampuan untuk tumbuh sampai pH 4,2. Suhu optimum untuk
pertumbuhan adalah 37-41°C (Desai, 2008).
2.2.3 Enterococcus sp
Genus bakteri ini kurang dikenal karena hanya memiliki kurang dari 20
spesies. Sel cenderung membentuk rantai dan bersifat aerotolerant anaerob/
fermentor obligat dan katalase negatif. Bakteri ini Gram positif dengan sel
berbentuk seperti telur dalam bentuk tunggal, berpasangan atau rantai pendek dan
tidak membentuk spora. Strain bakteri yang paling sering digunakan adalah
Enterococcus faecalis. Pertumbuhan optimal pada suhu 35-37°C dan kebanyakan
spesies dapat tumbuh pada suhu 42-45°C. Bakteri ini bersifat homofermetatif
Strain Enterococci kebanyakan digunakan sebagai nutrisi untuk babi dan unggas.
Namun, tersedia pula produk farmasi yang mengandung Enterococcus sebagai
probiotik bagi manusia dalam terapi klinis. Genus Enterococcus memiliki spesies
yang berbeda-beda tetapi hanya dua dari mereka yang penting sebagai probiotik
yaitu Enterococcus faecium diaplikasikan pada manusia dan hewan dan
sementara Enterococcus faecalis terutama digunakan sebagai probiotik untuk
manusia (Bhantinon dan Anthimia, 2010).
2.2.4 Streptococcus sp
Genus ini memiliki kurang dari 20 spesies dan kurang dikenal. Yang
termasuk pada spesies ini adalah Streptococcus thermophilus, Streptococcus mitis,
Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus salivarius,
Streptococcus agalactiae. Streptococcus merupakan Gram positif dalam bentuk
cocci dengan diameter 0,5-2,0 μm, bentuknya tunggal, berpasangan, atau rantai.
Bakteri ini tidak membentuk spora, non motil dan katalase negatif. Bersifat
Kemo-organotrofik (metabolisme fermentasi memproduksi terutama laktosa
secara anaerob). Pertumbuhan optimum pada suhu 37°C, kebanyak bersifat
komensal pada manusia dan hewan. Pada umumnya semua spesies bersifat
anaerob fakultatif dan beberapa membutuhkan CO2 untuk pertumbuhan (De vos,
et al., 2009).
2.3 Terapi Probiotik
Probiotik dapat digunakan untuk mengatasi berbagai gangguan kesehatan
seperti :
1. Diare
Beberapa penelitian menunjukan bahwa probiotik dapat
mereduksi gejala diare. Hal ini telah dibuktikan dengan mengkonsumsi
probiotik yang mengandung strain Lactobacillus rhamnosus GG dan
Bifidobacterium lactis BB-12 dapat mencegah dan menjadi pilihan
terapi diare akut pada anak yang disebabkan oleh rotavirus. Selain
rotavirus, probiotik juga dapat menghambat bakteri patogen lain
dalam mukosa usus dengan cara kompetisi dalam mengadakan
perlekatan dengan enterosit (sel epitel mukosa) dengan bakteri patogen
(WHO, 2001).
2. Melawan infeksi Helicobacter pylori
Helicobacter pylori adalah bakteri Gram negatif yang
menyebabkan gastritis tipe B, tukak lambung dan kanker lambung.
Penggunaan bakteri asam laktat dapat menghambat pertumbuhan
bakteri patogen ini dengan menurunkan aktivitas enzim urease yang
diperlukan patogen untuk tetap berada di lingkungan asam lambung
(WHO, 2001). Adanya asam organik, hidrogen peroksida dan
bakteriosin yang diproduksi oleh bakteri asam laktat di duga menjadi
zat anti mikroba yang digunakan untuk melawan Helicobacter pylori
(WHO, 2001).
3. Kanker
Mikroorganisme probiotik dapat mencegah atau menunda
timbulnya kanker tertentu. Hal ini berdasarkan bahwa mikroflora usus
dapat menghasilkan zat karsinogen seperti nitrosamin. Oleh karena itu,
pemberian Lactobacillus dan Bifidobacteria secara teoritis dapat
memodifikasi flora yang mengarah ke penurunan β- glukuronidase.
Penurunan resiko kanker usus besar mungkin diperoleh
melalui kontrol pertumbuhan bakteri patogen seperti E.coli, S. faecalis
dan C. paraputrificum pada usus melalui kompetisi alat penempelan
dan nutrisi. Dinding sel bakteri asam laktat menunjukan
kemampuannya menstimulir fagositosis dari magrofag sehingga
menekan terbentuknya tumor dan kanker usus. Enzim-enzim yang
berperan untuk mengubah komponen-komponen prokarsinogen
menjadi komponen karsinogen seperti β-glukosidase, β-glukoronidase,
nitroreduktase, dan azoreduktase terbukti ditekan jumlahnya dengan
konsumsi susu fermentasi yang mengandung Bifidobacteria longum
dan Lactobacillus acidophilus. Namun, masih terlalu dini untuk
membuat kesimpulan klinis definitif mengenai kemampuan probiotik
4. Gejala IBS (Irritable Bowel Sindrome)
Ada beberapa mekanisme yang diduga menjelaskan
pengurangan gejala IBS dengan probiotik. Probiotik dapat
mempengaruhi gejala dengan menyeimbangkan mikrobiota, dan
dengan mengembalikan kemungkinan penyimpangan produksi gas
atau produksi asam lemak rantai pendek. Banyak probiotik dapat
memodulasi sistem kekebalan tubuh misalnya dengan
menyeimbangkan rasio antara pro-inflamasi dan anti-inflamasi sitokin,
sehingga dapat mengurangi kemungkinan tingkat peradangan. Selain
menyeimbangkan mikrobiota dan efek imunomodulator, studi terbaru
juga menunjukkan bahwa probiotik dapat mempengaruhi motilitas
usus. Penelitian secara in vitro pada usus yang diisolasi dari kelinci
percobaan telah menunjukan bahwa probiotik, khususnya
Bifidobacteria memiliki efek relaksasi pada usus (WHO, 2001).
5. Konstipasi
Beberapa mekanisme probiotik dan prebiotik diketahui berperan
dalam menimbulkan efek pencahar. Probiotik dan prebiotik dapat
memodulasi flora normal usus. Flora normal usus dan komposisinya
diketahui mempengaruhi fungsi usus terutama motilitas usus. Namun
mekanime dibalik ini belum diketahui secara jelas. Modulasi dari flora
normal usus juga mengubah aktivitas metabolisme usus, seperti
produksi gas dan asam lemak rantai pendek. Ada bukti yang
menunjukkan bahwa asam lemak rantai pendek berkorelasi dengan
waktu transit usus (Yuan Kun Lee dan Seppo Salminen, 2009).
6. Meningkatkan Imunitas saluran Cerna
Probiotik akan berinteraksi dengan sistem imunitas saluran cerna
dengan menimbulkan respon imun lokal. Pada dua penelitian terpisah
L. johnsonii LJ-1 (previously L. acidophilus LA1) dan L. salivarius
UCC 118 terbukti dapat menstimulasi respon IgA mukosa dan
meningkatkan aktivitas makrofag (WHO, 2001).
Sekitar 80% dari total sel yang memproduksi imunoglobulin
imunokompeten saluran pencernaan yang beperan pada berbagai reaksi
lokal terhadap mikroorganisme patogen. Interaksi antara enterosit dan
faktor di sekitarnya akan mengaktivasi ekspresi molekul adhesi, MHC
kelas I dan II, presentasi antigen terhadap limfosit, produksi sitokin,
transportasi sIg, dan kompleks sIgA. Probiotik akan memicu aktivasi
sel imunokompeten baik makrofag maupun sel dendrit sehingga
jaringan limfoid (gut-associated lymphoid tissues/ GALT) yang ada
pada lamina propia akan memicu sel plasma untuk memproduksi IgA
yang berperan dalam sistem imun mukosa (Prasetyo dan Purwanto,
2010).
7. Alergi
Mekanisme probiotik dalam mengatasi alergi diduga dengan
meningkatan permeabilitas usus, meningkatkan respon spesifik IgA,
meningkatkan penghalang usus melalui restorasi mikroba normal, dan
meningkatkan faktor pertumbuhan beta dan produksi interleukin 10
dan sitokin yang mempengaruhi peningkatan produksi antibodi IgE
(WHO,2001).
8. Sistem Kardiovaskular
Ada bukti awal bahwa penggunaan probiotik Lactobacillus
berpotensi memberi manfaat bagi jantung, termasuk pencegahan dan
terapi berbagai sindrom iskemik jantung dan menurunkan serum
kolesterol (WHO, 2001).
Lactobacillus dapat mengurangi kadar kolesterol serum
melalui asimilasi dan dekonjugasi garam empedu. Asam lemak rantai
pendek yang dihasilkan oleh Lactobacillus juga dapat menghambat
sintesis kolesterol hati dan distribusi kolesterol dalam plasma dan hati.
Akibat kekurangan asam empedu ini maka Lactobacillus acidophilus
akan memetabolisme kolesterol dalam darah menjadi asam empedu
sehingga menurunkan konsentrasi kolesterol darah (Yulinery, et al.,
9. Intoleransi Laktosa
Probiotik sebagai bakteri asam laktat secara aktif merubah
laktosa menjadi asam laktat. Oleh karena itu, probiotik dapat
memperbaiki pencernaan laktosa dengan mengurangi gejala intoleransi
dan memperlambat waktu transit makanan. Pemberian probiotik juga
dapat meningkatkan enzim laktase di lumen usus sehingga
memfasilitasi proses pencernaan dan memperbaiki intoleransi laktosa
(Simadibrata, 2011).
10. Bakteri Vaginosis
Ada beberapa penelitian klinik menunjukkan bahwa pemberian
oral dan vaginal Lactobacillus dapat membasmi asimtomatik dan
gejala bakteri vaginosis. Sediaan oral Lactobacillus acidophilus dan
yogurt telah digunakan dalam pencegahan dan terapi vaginitis
kandidiasis). Diduga karena bakteri probiotik menghasilkan hidrogen
peroksida yang mampu membunuh bakteri penyebab vaginosis (WHO,
2001).
2.4 Dosis Probiotik
Bentuk yang paling umum dalam produk probiotik adalah susu fermentasi
dan probiotik dalam makanan. Namun ada pula probiotik dalam bentuk tablet,
kapsul, dan sachet yang mengandung bakteri dalam bentuk beku-kering. Dosis
yang dibutuhkan untuk probiotik sangat bervariasi tergantung pada strain dan
produk. Sejumlah penelitian klinis yang telah terbukti menunjukan bahwa strain
probiotik dapat bermanfaat dan efektif untuk kesehatan dan terapi beberapa
penyakit. Dosis probiotik dapat bervariasi pada indikasi yang berbeda. (Yuan Kun
Lee dan Seppo Salminen, 2009)
Probiotik dapat diberikan dengan berbagai variasi berdasarkan :
1. Tipe Probiotik ( Lactobacilli, Bifidobacteria, Yeast, atau Enterococcus)
2. Dosis Harian (107-1010 cfu) 3. Frekuensi pemberian 1-4x sehari
4. Waktu pemberian (sebelum,selama, atau setelah makan)
6. Bentuk sediaan (makanan fermentasi, minuman, kapsul, tablet atau
serbuk)
7. Viabilitas
Tabel 2.2 Variasi Dosis Probiotik dengan Berbagai Kondisi Kesehatan
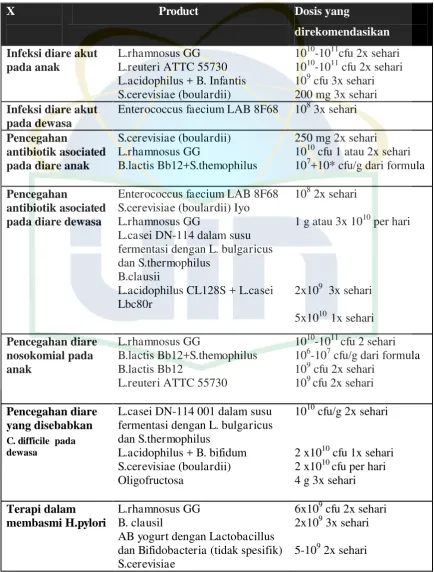
X Product Dosis yang
Enterococcus faecium LAB 8F68 108 3x sehari
Pencegahan
L.casei DN-114 001 dalam susu fermentasi dengan L. bulgaricus dan S.thermophilus
Sumber: Guarner, et al., 2008 (World Gastroenterology Organisation Practice Guideline)
Untuk meningkatkan efek probiotik, maka dibutuhkan jumlah yang tepat
untuk sampai pada saluran cerna. Bentuk sediaan yang berbeda dengan dosis yang
sama dilaporkan dapat memberikan efek kesehatan yang sama. Durasi pemberian
sebagian besar bergantung dari penyakit yang diderita. Namun belum ada
informasi mengenai waktu terbaik untuk pemberian probiotik.
Secara logika, probiotik diberikan secara oral sebelum makan untuk
mampu bertahan pada kondisi pH ekstrim dan enzim pencernaan serta adanya
garam empedu pada saluran pencernaan. Probiotik yang diberikan beserta L.casei DN-114 001 dalam susu
fermentasi dengan L. bulgaricus
yogurt dengan L. bulgaricus dan S.thermophilus susu fermentasi dengan dengan L. bulgaricus dan S.thermophilus
V8L#3 dicampur dalam 8 strain (1 S. thermophilus, 4 Lactobacillus,
makanan akan mencair dengan bahan makanan dan mampu mereduksi
kesempatan dan frekuensi paparan antara bakteri probiotik dan mukosa reseptor.
Matriks makanan juga bisa menghalangi probiotik untuk melekat dengan mukosa
reseptor. Untuk itu dibutuhkan waktu yang tepat untuk mengkonsumsi probiotik
yaitu diantara dua waktu makan (Yuan Kun Lee dan Salminen Seppo, 2009).
2.5 Faktor yang Mempengaruhi Viabilitas Probiotik
Sebagaimana telah disebutkan di atas, probiotik berisi mikroorganisme
hidup, oleh karena itu kelangsungan hidup bakteri tersebut harus dipertahankan
selama proses produksi dan bahkan ketika sampai di saluran gastrointestinal (GI).
Kehilangan viabilitas merupakan hal yang tidak terhindarkan selama proses
tahapan pembuatan. Masalah-masalah yang terjadi dalam teknologi pembuatan
probiotik yaitu kesulitan dalam memperoleh konsentrasi sel yang tinggi selama
masa pertumbuhan, dan mempertahankan kelangsungan hidup selama proses hilir,
proses pengolahan dan formulasi dalam bentuk produk akhir (Malago, et al.,
2011).
Faktor –faktor yang mempengaruhi viabilitas bakteri probiotik yaitu :
1. Kondisi fisiologis
Kondisi fisiologis bakteri ketika dipreparasi dan terkandung dalam
produk itu sendiri merupakan faktor penting dalam ketahanan probiotik.
Pengeringan dalam produk makanan dapat menjaga stabilitas bakteri selama
penyimpanan, sedangkan produk dalam bentuk cair memungkinan adanya
aktivitas metabolit aktif dari bakteri. Keadaan lingkungan bakteri akan
mempengaruhi masa simpan bakteri tersebut, contohnya pada suhu rendah
dapat memperpanjang ketahanan dari bakteri (Neha, 2012).
2. Suhu
Suhu untuk pertumbuhan optimum probiotik dibutuhkan dalam proses
fermentasi makanan. Suhu optimum probiotik antara 37-43○C. Selama proses pembuatan, penggunaan suhu melebihi 45-50○C akan merusak daya tahan hidup bakteri, penggunaan suhu yang lebih tinggi memungkinkan pemaparan
pada periode waktu yang lebih pendek dapat menurunkan jumlah bakteri
yang kedua kalinya. Oleh karena itu, jelaslah bahwa probiotik seharusnya
ditambahkan sedikit demi sedikit selama proses pembuatan atau pasteurisasi
(Yuan Kun Lee dan Seppo Salminen, 2009).
3. pH
Beberapa bakteri seperti Lactobacillus dan Bifidobacteria dapat
bertahan pada pH rendah karena menghasilkan senyawa organik dari
metabolisme karbohidrat. Sejumlah penelitian membuktikan bahwa pada
cairan lambung bakteri probiotik dapat bertahan hidup di mana bakteri
terpapar pH yang rendah yakni 2.0 dalam waktu 1 sampai 2 jam. Pada produk
makanan, Lactobacillus dan Bifidobacteria dapat tumbuh dan bertahan
dengan pH diantara 3,7 dan 4,3. Namun Bifidobacteria cenderung kurang
dapat mentoleransi asam pada produk fermentasi (Neha, 2012).
4. Aktivitas Air
Kadar kelembaban dan aktivitas air yang tinggi akan menurunkan
daya tahan probiotik. Adanya interaksi antara aktivitas air dengan suhu yang
mempengaruhi kehidupan probiotik. Sediaan probiotik dapat memiliki masa
simpan yang lama pada bentuk kering ketika disimpan pada suhu kamar jika
kadar kelembabannya rendah (dibawah 0,2-0,3). Pada umumnya aktivitas air
yang rendah akan memberikan ketahanan hidup yang baik. Ketahanan
probiotik dalam makanan dapat dipertahankan dengan adanya aktivitas air
sekitar 0,4-0,7. Solusi yang dapat dilakukan dalam meningkatkan ketahanan
bakteri terhadap aktivitas air yaitu dengan cara mikroenkapsulasi.
5. Oksigen
Lactobacillus dan Bifidobacteria tidak dapat tumbuh dengan baik
karena adanya oksigen. Walau bagaimanapun tingkat sensitivitas terhadap
oksigen akan berbeda-beda tiap strain bakteri. Sebagian besar Lactobacillus
merupakan aerofilik, yang lebih mentoleransi oksigen dibanding
Bifidobacteria. Walaupun Bifidobacteria memiliki mekanisme enzimatik
(melalui NADH-oksidase dan NADH peroxidase) untuk membatasi toksisitas
oksigen (Neha, 2012).
Untuk strain bakteri yang sensitif terhadap oksigen ada beberapa
makanan. Bahan antioksidan seperti asam askorbat atau sistein serta
penggunaan penghalang oksigen dalam imodifikasi kemasan telah terbukti
dapat meningkatkan kelangsungan hidup probiotik karena toksisitas oksigen
ini kadang-kadang bisa mempengaruhi kelangsungan hidup probiotik,
disarankan untuk meminimalkan proses aerasi, terutama dalam penggunaan
3.1 Waktu dan Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Pharmacy Sterile Technology
(PST), Laboratorium Pharmacy Solid Preparation (PSO), Laboratorium
Pharmacy Natural Product Chemistry (PNA), Laboratorium Mikrobiologi dan
Laboratorium Biologi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif
Hidayatullah Jakarta. Penelitian berlangsung selama bulan April-Mei 2013.
3.2 Alat dan Bahan
Alat dan bahan yang digunakan adalah sebagai berikut:
3.2.1 Alat
Cawan petri, batang spreader, labu ukur, erlemeyer 1000 ml, spuit, gelas
piala 250 ml, tabung reaksi (pyrex), kaca objek, jarum ose, batang pengaduk,
spatula, mikropipet, alumunium foil, vortex, neraca analitik, oven (Memmert),
autoklaf, termometer, termohigrometer, inkubator (France Etuvers/C3000),
refrigerator (Sanyo Medicool), api bunsen, Laminar air flow (Clean Beach),
Mikroskop (Olympus CX21).
3.2.2 Bahan
Sampel dari 3 macam produk probiotik yang berisi strain tunggal bakteri probiotik yaitu sampel X yang berisi Lactobacillus acidophilus (3 x 108 cfu/g), sampel Y yang berisi Lactobacillus reuteri ( 1x 108 cfu/g) dan sampel Z yang berisi Lactobacillus sporogenes (5 x 107 cfu/g), medium MRSA (Oxoid), NaCl fisiologis 0,9%, kristal violet, lugol, alkohol 96%, dan safranin.
3.3Prosedur Kerja
Prosedur kerja yang akan dilakukan adalah sebagai berikut :
3.3.1.1Preparasi Alat
Peralatan gelas seperti cawan petri, batang spreader, batang pengaduk,
spatula, erlemeyer 500 ml, gelas piala 250 ml dibungkus dengan kertas roti dan
kemudian disterilkan dengan menggunakan oven pada suhu 180○C selama 120 menit (Collin, et al., 2004).
3.3.1.2Preparasi Sampel
Tiga produk (sampel X, Y dan Z) disimpan dalam kemasan asli pada tiga
kondisi suhu 4○C (di lemari pendingin ), 25○C (di ruangan yang diatur suhunya) dan 44○C (di oven) selama 4 minggu dengan interval pengujian viabilitas 0, 1, 2, 3, dan 4 minggu.
3.3.1.3Pembuatan Medium MRSA (DeMan Rogosa Sharpe)
Sejumlah 62 gram serbuk MRS ditimbang dan kemudian dilarutan dalam
1 liter air destilasi dan dipanaskan pada suhu 60○C. Lalu media disterilkan menggunakan autoklaf pada suhu 115○C, tekanan 1 atm selama 30 menit. Setelah dikeluarkan dari autoklaf, media didiamkan beberapa saat hingga suhunya
menurun sampai sekitar 45○C kemudian media dituangkan ke dalam cawan petri steril yang dilakukan di dalam Laminar Air Flow (Bridson, 1998).
3.3.2 Identifikasi Bakteri pada Sampel X, Y dan Z dengan Pewarnaan Gram
Ketiga sampel disuspensikan dalam NaCl fisiologis 0,9% dan dibuat
konsentrasi 10-1. Kemudian disebar pada medium MRSA dan diinkubasi selama 24 jam. Isolat bakteri yang terbentuk dari masing-masing sampel diletakkan
pada kaca objek dan dibuat film tipis lalu dibiarkan kering (Collins, et al., 2004).
Permukaan preparat diberi tetesan kristal violet dan dibiarkan selama 1 menit
lalu dibilas dengan air mengalir. Preparat diberi tetesan lugol dan dibiarkan
selama 1 menit lalu dibilas dengan air mengalir. Kemudian preparat dicuci
dengan alkohol 96% sampai kristal violet pada preparat tidak luntur lagi lalu
dibilas dengan air mengalir. Selanjutnya preparat diberi tetesan zat warna
dikeringkan dengan membiarkan didekat nyala api atau menekan-nekan preparat
secara perlahan-lahan dengan tissue. Selanjutnya preparat diamati di bawah
mikroskop cahaya dengan perbesaran 1000x.
3.3.2 Pengujian Viabilitas Bakteri pada Sampel X, Y dan Z
Viabilitas bakteri diamati berdasarkan metode Standart Plate Count (S.
Mulyani, et al., 2008). Sampel dari masing-masing suhu penyimpanan
disuspensikan dalam NaCl Fisiologis 0,9% secara aseptis dan dibuat konsentrasi
10-1. Untuk sampel X yakni sebanyak 1 gram di cukupkan sampai 10 ml NaCl fisiologis Kemudian dibuat pengenceran sampai 10-10, untuk sampel Y yakni sebanyak 0,5 gram sampel dicukupkan sampai 5 ml NaCl fisiologis dan dibuat
pengenceran sampai 10-8,10-7 untuk sampel Z. Dari masing-masing pengenceran diambil 1 ml untuk sampel X dan 0,5 ml untuk sampel Y dan Z kemudian di
masukkan ke cawan petri, dan dilakukan dengan tiga kali pengulangan. Kemudian
disebar ke MRS agar. Sampel diratakan di permukaan agar menggunakan
spreader. Dibiarkan hingga cairan dalam cawan petri membeku, semua cawan
petri dimasukkan dengan posisi terbalik ke dalam inkubator dan diinkubasi pada
suhu 37○C ± 1○C selama 24 jam. Pertumbuhan bakteri koloni dicatat, pada setiap cawan petri yang mengandung 30-300 koloni. Kemudian dilakukan perhitungan
jumlah total koloni dengan rumus (Depson, 2012). :
Kemudian jumlah bakteri setelah perlakuan dibandingkan dengan komposisi
jumlah bakteri pada produk sampel yang tercantum dalam kemasan.
3.4Analisa Data
Data jumlah total Koloni dari masing-masing sampel dianalisis secara
statistik dengan menggunakan perangkat lunak SPSS 20.0 for windows dengan
metode One Way Repeated Measures Anova untuk mengetahui perbandingan dari
penggunaan ketiga suhu penyimpanan.
Cfu/gram = total koloni x 1
HASIL DAN PEMBAHASAN
4.1 Pemilihan dan Preparasi Sampel
Pada dasarnya probiotik merupakan makhluk hidup, di mana daya tahan
hidupnya dipengaruhi oleh faktor lingkungan. Salah satu faktor tersebut adalah
suhu penyimpanan. Berdasarkan laporan menyebutkan bahwa suhu seringkali
menjadi aspek yang terlupakan oleh konsumen dalam menyimpan produk
probiotik dan beberapa laporan mengatakan bahwa dalam beberapa produk
komersial, tingkat probiotik yang layak tidak memenuhi kriteria peraturan pada
akhir penyimpanan (Mallago, et al., 2011). Oleh karena itu, dilakukan penelitian
terhadap 3 produk probiotik yang beredar di Apotek yang berada di wilayah
Ciputat. Produk probiotik yang dipilih adalah sampel X yang berisi Lactobacillus
achidophilus dengan jumlah bakteri 3,0 x 1010 cfu dalam bentuk granul, sampel Y berisi Lactobacillus reuteri dengan jumlah bakteri 1 x 108 cfu dalam bentuk tablet kunyah dan sampel Z yang berisi Lactobacillus sporogenes dengan jumlah
bakteri 5 x 107 cfu dalam bentuk tablet.
Penelitian terhadap ketiga sampel dilakukan pada tiga suhu yang berbeda
yaitu pada suhu 4○C, 25○C dan 44○C. Suhu 4○C merupakan suhu penyimpanan ideal probiotik pada lemari pendingin, suhu 25○C dikondisikan sebagai suhu ruangan, dan suhu 44○C diadaptasi dengan kondisi iklim terpanas yang pernah terjadi di Indonesia yakni di Bojonegoro pada tahun 2010.
Medium yang digunakan untuk menumbuhkan bakteri yaitu MRSA
dengan komposisi pepton, lab-lemco powder, yeast extract, glukosa, sorbitan
mono-oleat, dipotassium hidrogen posfat, sodium asetat 3H2O, triamonium sitrat,
magnesium sulfat 7H2O, mangan sulfat 4H2O. MRS Agar merupakan medium
selektif yang digunakan untuk menumbuhkan Lactobacillus (De vos, et al., 2009).
Metode yang digunakan untuk menghitung viabilitas atau ketahanan hidup
bakteri pada penelitian ini adalah metode Standart Plate Count dengan prinsip
maka sel bakteri akan berkembang biak dan membentuk koloni yang dapat terlihat
langsung oleh mata sehingga bisa langsung dihitung (Collin, et al., 2004).
4.2 Pertumbuhan Koloni Bakteri Sampel X, Y dan Z pada Medium MRSA
Pengamatan visual terhadap koloni bakteri yang terbentuk dari
masing-masing sampel yaitu berbentuk bulat dengan tepi menyeluruh, halus, berwarna
putih keruh dan tidak menimbulkan aroma. Dari ketiga sampel terbentuk koloni
yang hampir sama karena ketiga sampel ini berasal dari keluarga Lactobacillus
yang secara morfologi memiliki bentuk yang sama.
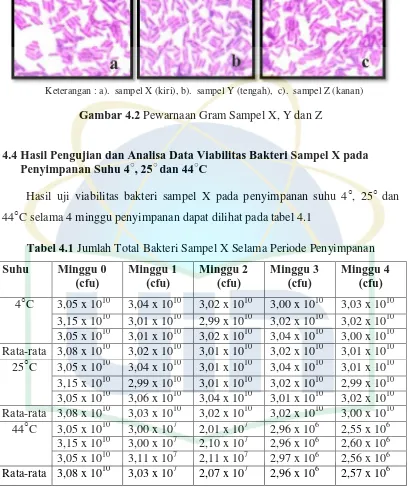
Keterangan : a). koloni sampel X (kiri), b). koloni sampel Y(tengah), c). koloni sampel Z (kanan)
Gambar 4.1 Koloni Sampel X, Y dan Z
4.3 Identifikasi Bakteri Sampel X, Y dan Z dengan Pewarnaan Gram
Pewarnaan Gram yang dilakukan menunjukkan bahwa ketiga sampel
berbentuk batang dan merupakan kelompok bakteri Gram positif yang
menghasilkan warna ungu. Mekanisme pewarnaan Gram didasarkan pada
perbedaan permeabilitas di antara kedua kelompok dinding sel bakteri. Dinding
sel bakteri Gram negatif mengandung peptidoglikan jauh lebih sedikit dan kurang
ekstensif dibandingkan dinding sel bakteri Gram positif, sehingga pori-pori pada
peptidoglikan bakteri Gram negatif tetap cukup besar dan tidak dapat
mempertahankan kompleks Ungu Kristal-Yodium (UKY). Sedangkan pada
bakteri Gram positif, kompleks Ungu Kristal-Yodium terperangkap di dalam
Keterangan : a). sampel X (kiri), b). sampel Y (tengah), c). sampel Z (kanan)
Gambar 4.2 Pewarnaan Gram Sampel X, Y dan Z
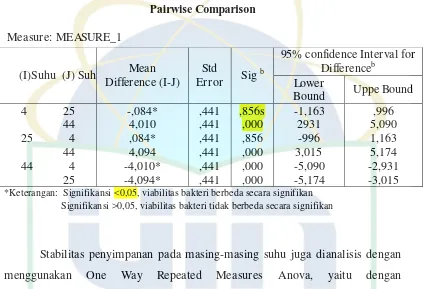
4.4Hasil Pengujian dan Analisa Data Viabilitas Bakteri Sampel X pada Penyimpanan Suhu 4○, 25○ dan 44○C
Hasil uji viabilitas bakteri sampel X pada penyimpanan suhu 4○, 25○ dan 44○C selama 4 minggu penyimpanan dapat dilihat pada tabel 4.1
Tabel 4.1 Jumlah Total Bakteri Sampel X Selama Periode Penyimpanan
Suhu Minggu 0
Measures Anova dengan membandingkan perbedaan penggunaan ketiga suhu
penyimpanan yang berpengaruh pada sampel X. Penyimpanan pada suhu 4○C dan 25○C tidak menunjukkan perubahan jumlah total bakteri yang signifikan (p>0,05), yang berarti penyimpanan pada suhu 4○C dan 25○C dapat mempertahankan jumlah total bakteri. Hasil yang berbeda secara signifikan tampak ketika
juga ditemui ketika membandingkan penyimpanan suhu 44○C dengan suhu 25○C, menunjukkan hasil yang signifikan berbeda (p<0,05) di mana pada penyimpanan
suhu 44○C terjadi perubahan jumlah total bakteri selama periode 4 minggu penyimpanan. Hal ini dapat dilihat pada tabel 4.2.
Tabel 4.2 Hasil Analisa Data Viabilitas Bakteri Sampel X dengan Menggunakan Metode Uji One Way Repeated Measures ANOVA
Pairwise Comparison
Measure: MEASURE_1
*Keterangan: Signifikansi <0,05, viabilitas bakteri berbeda secara signifikan Signifikansi >0,05, viabilitas bakteri tidak berbeda secara signifikan
Stabilitas penyimpanan pada masing-masing suhu juga dianalisis dengan
menggunakan One Way Repeated Measures Anova, yaitu dengan
membandingkan antara jumlah total koloni dari awal pengujian yakni sebelum
penyimpanan sampai dengan 4 minggu periode penyimpanan. Hasil analisa
penyimpanan sampel X pada suhu 4○C tidak mengalami perubahan jumlah total koloni dari awal pengujian sampai dengan akhir pengujian. Begitu pula yang
terjadi dengan penyimpanan pada suhu 25○C. Sedangkan stabilitas penyimpanan suhu 44○C mengalami penurunan jumlah total bakteri yang signifikan dari awal pengujian sampai dengan minggu ke empat, hal ini tampak pada Lampiran 16, 17
Grafik 4.3 Hubungan Antara Waktu Penyimpanan dengan Viabilitas Sampel X pada Penyimpanan Suhu 4○, 25○ dan 44○C
4.5Hasil Pengujian dan Analisa Data Viabilitas Bakteri Sampel Y pada Penyimpanan Suhu 4○, 25○ dan 44○C
Hasil uji viabilitas bakteri sampel Y pada penyimpanan suhu 4○, 25○ dan 44○C selama 4 minggu penyimpanan dapat dilihat pada tabel 4.3
Tabel 4.3 Jumlah Total Bakteri Sampel Y Selama Periode Penyimpanan
Suhu Minggu 0
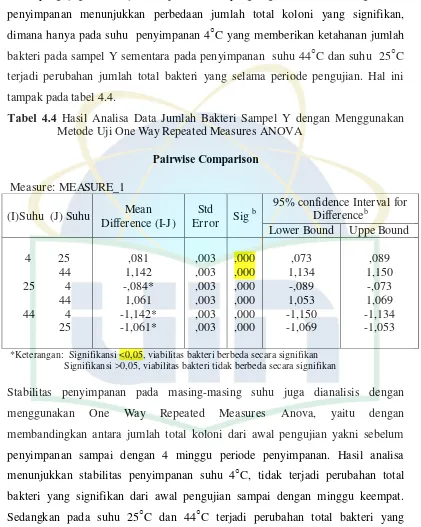
Measures ANOVA membandingkan perbedaan penggunaan ketiga suhu
penyimpanan yang berpengaruh pada sampel Y. Perbandingan antara penggunaan
(p<0,05). Begitu pula dengan perbandingan antara penggunaan suhu 25○C dan 44○C yang juga menunjukkan perbedaaan yang signifikan. Dari ketiga suhu penyimpanan menunjukkan perbedaan jumlah total koloni yang signifikan,
dimana hanya pada suhu penyimpanan 4○C yang memberikan ketahanan jumlah bakteri pada sampel Y sementara pada penyimpanan suhu 44○C dan suhu 25○C terjadi perubahan jumlah total bakteri yang selama periode pengujian. Hal ini
tampak pada tabel 4.4.
Tabel 4.4 Hasil Analisa Data Jumlah Bakteri Sampel Y dengan Menggunakan Metode Uji One Way Repeated Measures ANOVA
Pairwise Comparison
Measure: MEASURE_1
*Keterangan: Signifikansi <0,05, viabilitas bakteri berbeda secara signifikan Signifikansi >0,05, viabilitas bakteri tidak berbeda secara signifikan
Stabilitas penyimpanan pada masing-masing suhu juga dianalisis dengan
menggunakan One Way Repeated Measures Anova, yaitu dengan
membandingkan antara jumlah total koloni dari awal pengujian yakni sebelum
penyimpanan sampai dengan 4 minggu periode penyimpanan. Hasil analisa
menunjukkan stabilitas penyimpanan suhu 4○C, tidak terjadi perubahan total bakteri yang signifikan dari awal pengujian sampai dengan minggu keempat.
Sedangkan pada suhu 25○C dan 44○C terjadi perubahan total bakteri yang signifikan pada perbandingan 0 minggu penyimpanan sampai dengan minggu
keempat penyimpanan. Hal ini dapat dilihat pada Lampiran 19, 20 dan 21.
(I)Suhu (J) Suhu Mean
Lower Bound Uppe Bound
Grafik 4.4 Hubungan Antara Waktu Penyimpanan dengan Viabilitas Sampel Y pada Penyimpanan Suhu 4○, 25○ dan 44○C
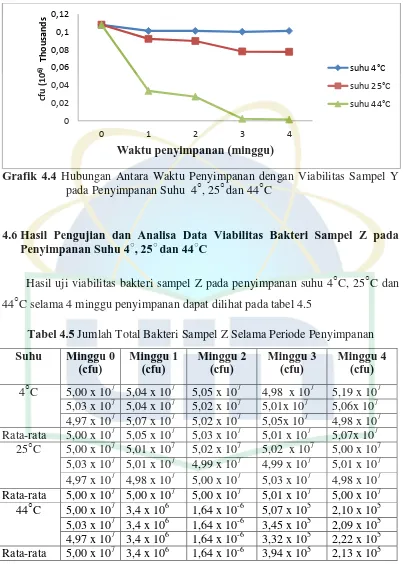
4.6Hasil Pengujian dan Analisa Data Viabilitas Bakteri Sampel Z pada Penyimpanan Suhu 4○, 25○ dan 44○C
Hasil uji viabilitas bakteri sampel Z pada penyimpanan suhu 4○C, 25○C dan 44○C selama 4 minggu penyimpanan dapat dilihat pada tabel 4.5
Tabel 4.5 Jumlah Total Bakteri Sampel Z Selama Periode Penyimpanan
Suhu Minggu 0
Measures ANOVA membandingkan perbedaan penggunaan ketiga suhu
penyimpanan yang berpengaruh pada sampel Z. Penyimpanan pada suhu 4○C dan 25○C tidak menunjukan perubahan jumlah total bakteri yang signifikan (p>0,05),
yang berarti penyimpanan pada suhu 4○C dan 25○C dapat mempertahankan jumlah bakteri. Hasil yang berbeda secara signifikan tampak ketika
membandingkan antara penyimpanan suhu 44○C dengan suhu 4○C. Hal yang sama juga ditemui ketika membandingkan penyimpanan suhu 44○C dengan suhu 25○C, menunjukkan hasil yang signifikan berbeda (p<0,05) dimana pada penyimpanan
suhu 44○C terjadi perubahan jumlah total bakteri selama periode 4 minggu penyimpanan. Hal ini tampak pada tabel 4.6.
Tabel 4.6 Hasil Analisa Data Jumlah Bakteri Sampel Z dengan Menggunakan Metode Uji One Way Repeated Measures ANOVA
Pairwise Comparison
Measure: MEASURE_1
*Keterangan: Signifikansi <0,05, viabilitas bakteri berbeda secara signifikan Signifikansi >0,05, viabilitas bakteri tidak berbeda secara signifikan
Stabilitas penyimpanan pada masing-masing suhu juga dianalisis dengan
menggunakan One Way Repeated Measures Anova, yaitu dengan
membandingkan antara jumlah total koloni dari awal pengujian yakni sebelum
penyimpanan sampai dengan 4 minggu periode penyimpanan. Hasil analisa
penyimpanan sampel Z pada suhu 4○C dan 25○C tidak mengalami perubahan jumlah total koloni dari awal pengujian sampai dengan akhir pengujian.
Sedangkan stabilitas penyimpanan suhu 44○C mengalami penurunan jumlah total bakteri yang signifikan dari awal pengujian sampai dengan minggu ke empat, hal
ini tampak pada Lampiran 22, 23 dan 24. (I)Suhu (J) Suhu Mean
Difference (I-J) Std Error
Sig b 95% confidence Interval for Differenceb
Grafik 4.5 Hubungan Antara Waktu Penyimpanan dengan Viabilitas Sampel Z pada Penyimpanan Suhu 4○, 25○ dan 44○C
Penggunaan suhu 4○C dapat mempertahankan viabilitas dari ketiga sampel. Suhu 4○C merupakan suhu yang dianjurkan untuk penyimpanan probiotik karena pada suhu ini dapat menghambat reaksi-reaksi enzimatis,
kimiawi dan biokimia sel. Dalam buku Bergey Manual of Sistematic Bacteriology
disebutkan bahwa untuk pemeliharaan dan penyimpanan bakteri Lactobacillus
dianjurkan pada suhu 4-7○C. Karena sejumlah alasan inilah yang diduga menyebabkan ketiga sampel dapat mempertahankan jumlah bakteri yang
terkandung di dalamnya.
Pengujian sampel pada suhu ruang dapat mempertahankan viabilitas
sampel X dan Z akan tetapi sampel Y mengalami penurunan jumlah total bakteri.
Menurut buku Handbook of Probiotic, sediaan probiotik dalam bentuk kering,
bakteri berada dalam keadaan immobilisasi, dimana viabilitas bakteri dapat dijaga
pada temperatur kamar selama 12 bulan atau lebih. Sediaan probiotik dalam
bentuk kering diolah dengan pengawetan kultur bakteri dengan metode
pengeringan. Prinsip metode pengeringan kultur bakteri probiotik ini adalah
mengeluarkan sebagian besar air dari bahan sehingga air yang tertinggal
merupakan air ikatan yang tidak dapat berperan dalam reaksi-reaksi kimia dalam
sel, pada saat ini semua aktivitas metabolisme dan respirasi akan berhenti.
Apabila kondisi kering dapat dipertahankan maka viabilitas kultur kering dapat
terjaga namun apabila terjadi peningkatan kadar air maka proses metabolisme
itu kadar kelembaban ruangan juga harus tetap terjaga untuk menghindari
peningkatan kadar air sediaan karena pengaruh lembab ruangan.
Pengukuran kadar kelembaban dengan menggunakan termohigrometer dan
di dapat nilai kelembaban ruang sebesar 65%. Penelitian yang dilakukan Bora
dengan mengkondisikan kelembaban relatif dari 20 sampai 100 %, diketahui
bahwa kelembaban relatif 75 % terjadi menurunkan viabilitas Lactobacillus sp.
Jadi diketahui bahwa suhu ruangan dengan kelembaban 65% masih dapat
mempertahankan viabilitas bakteri sediaan probiotik. Namun penurunan jumlah
bakteri sampel Y pada suhu ruang tidak diketahui penyebabnya.
Penurunan jumlah bakteri yang terjadi pada ketiga sampel saat
penyimpanan 44○C diduga karena adanya peningkatan suhu penyimpanan. Peningkatan suhu penyimpanan akan memberikan efek merusak pada stabilitas
selama produk dalam proses pengiriman dan penyimpanan. Pada penyimpanan
suhu 44○C menyebabkan tablet mengalami perubahan warna menjadi agak kekuningan dan granul menjadi lebih kering. Selama penyimpanan pada suhu
44○C diduga terjadi pengeringan bahan dan rusaknya eksipien yang melindungi bakteri sehingga terjadi pemaparan langsung antara panas dan bakteri.
Menurut Desmond (dikutip dalam penelitian Rizqiati, et al., 2008),
viabilitas bubuk probiotik menurun dengan meningkatnya suhu penyimpanan.
Pada peningkatan panas terjadi dehidrasi sel yang mengakibatkan sel menderita
shock osmotik dan terjadinya kebocoran sel. Panas telah dilaporkan merusak
berbagai stuktur sel termasuk kerusakan membran sel, ribosom, DNA, RNA dan
enzim. DNA masih ditetapkan sebagai molekul sasaran letal. Oleh karena itu
penyimpanan pada suhu tinggi tidak dianjurkan pada produk probiotik baik dalam
bentuk cair ataupun yang kering.
Menurut International Dairy Federation, jumlah minimal sel probiotik
hidup yang dapat berperan dalam meningkatkan kesehatan pencernaan adalah
sebanyak 106-107 cfu/gram (Puspawati, 2008). Penyimpanan pada suhu 44○C pada sampel X dan Y tetap memberikan manfaat kesehatan seperti meningkatnya
sistem imun saluran cerna sampai 4 minggu penyimpanan, sementara sampel Z
dapat memberikan manfaat sampai 2 minggu penyimpanan. Namun manfaat
ini, karena menurut Yuan Kun Lee, untuk mengobati diare dibutuhkan dosis 4 x
5.1 Kesimpulan
1. Penyimpanan ketiga sampel probiotik pada suhu 4○C dapat mempertahankan viabilitas dari ketiga sampel selama 4 minggu periode
pengujian.
2. Penyimpanan ketiga sampel probiotik pada suhu 25○C menunjukkan viabilitas yang baik pada sampel X dan Z, sedangkan sampel Y
memperlihatkan penurunan selama 4 minggu periode pengujian.
3. Penyimpanan ketiga sampel probiotik pada suhu 44○C menunjukkan penurunan viabilitas bakteri sampel X, Y dan Z selama 4 minggu periode
penyimpanan.
5.2 Saran
Pada penelitian selanjutnya, Penulis menyarankan untuk melakukan
adanya uji identifikasi spesies bakteri pada sampel probiotik sebelum melakukan
DAFTAR PUSTAKA
Batrinon, Anthimia. (2010). The Use of Lactic Acid Bacteria in Probiotic
Bacteria. Thei of Athena.
Bora S Pushpak. Puri V, Bansal A. (2009). Physicochemical properties and
excipient compatibility studies of probiotic Bacillus coagulan spores.
Scientia Pharmaceutica, 627.
Bridson, E.Y. (1998). The Oxoid Manual 8th Edition. Oxoid Limited Wade Road.
Basingstoke Hamshire RG24 8PW : England
Collin and Lyne’s. (2004). Microbiological Methods Eight Edition. Arnold, a member of the Hodder Headline Group, 338 Euston Road, London NW1
3BH
Depson, Ronald. (2012). Identifikasi molekular dan pengaruh pemberian
potensial probiotik bakteri asam laktat asal dadih terhadap kolesterol
daging itik bayang sumber daya genetik Sumatera Barat.Universitas
Andalas, 6.
Desai, Ankur. (2008). Strain Identification, Viability and Probiotics Properties of
Lactobacillus casei.School of Biomedical and Health Science Victoria
University, Werribee Campus Victoria Australia.
De Vos P, Garrity M G, Jones D, Krieg N, Ludwig W, Rainey A, Scleifer H Karl,
Witman W. (2009). Bergey’s Manual of Systematic Bacteria Second
Edition. Springer Dordrecht Heidelberg London New York.
Food and Agriculture Organisation of the United Nations and World Health
Organization. (2001). Health and Nutrition Properties of Probiotics in
Food including Powder Milk with Live Lactic Acid Bacteria. Report of a
joint FAO/WHO Expert Concultation on Evaluation of Health and
Nutrition Properties of Probiotics in Food including Powder Milk with
Live Lactic Acid Bacteria. World Health Organization.
Guarner F, Khan A, Garisch J, Gangl A, Eliakim R, Gang A, Tomson A,
Krabshuis J, Le Mair T. (2008). World Gastroenterology Organisation