ABSTRAK
RAHMAH FAUZIAH. Studi Kasus Patologi Mikobakteriosis pada Ikan Paradise (Macropodus opercularis). Dibimbing oleh SRI ESTUNINGSIH dan DEWI RATIH AGUNGPRIYONO.
Ikan Paradise (Macropodus opercularis) yang diperoleh dari distributor ikan hias di Ciluar, Bogor ditemukan dalam keadaan ascites dan terdapat banyak ulkus pada kulit. Pada pemeriksaan histopatologi, terdapat peradangan granuloma yang ditemukan pada insang, subkutis, usus, hati, dan ginjal. Koloni bakteri ditemukan di dalam granuloma. Pewarnaan Gram menunjukkan bahwa bakteri memiliki sifat Gram positif. Pewarnaan Ziehl Neelsen (ZN) menunjukkan bahwa bakteri masuk ke dalam bakteri batang tahan asam. Berdasarkan sifat dari pewarnaan bakteri, diduga Mycobacterium sp. merupakan agen dari kasus ini. Mycobacterium sp. dilaporkan sebagai agen patogen yang menyebabkan radang granuloma pada ikan air tawar dan air laut. Spesies Mycobacterium yang dapat menginfeksi ikan diantaranya M. marinum, M. fortuitum, dan M. chelonae. Bakteri ini dapat berjalan hematogen sehingga menghasilkan infeksi sistemik dan berpotensi zoonosis.
Kata kunci: Fish tank granuloma, lesio granuloma oleh bakteri, mikobakteriosis pada ikan, penyakit ikan
ABSTRACT
RAHMAH FAUZIAH. Case Report Pathology of Mycobacteriosis in Paradise Fish (Macropodus opercularis). Supervised by SRI ESTUNINGSIH and DEWI RATIH AGUNGPRIYONO.
Paradise fish (Macropodus opercularis) from ornamental fish distributor Ciluar, Bogor were found with ascites and dermal ulcer. Histopathologically, granulomatous inflammation in various phase was found in gill, subcutis, intestine, liver, and kidney. Some bacteria were observed in those granuloma. The characteristic Gram staining was positive for the bacteria. Ziehl Neelsen (ZN) staining was revealed the acid fast rods bacteria. With these characters of bacteria, Mycobacterium sp. was suspected as a pathogen in this case. Mycobacterium sp. is reported as a pathogen causing granulomatous disease in freshwater and saltwater fish. Mycobacterium species which cause a disease in fish are M. marinum, M. fortuitum, and M. chelonae. Those hematogenous route produce systemic infection and potensial to be zoonotic.
STUDI KASUS PATOLOGI MIKOBAKTERIOSIS
PADA IKAN PARADISE (Macropodus opercularis)
RAHMAH FAUZIAH
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Studi Kasus Patologi Mikobakteriosis pada Ikan Paradise (Macropodus opercularis) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
RAHMAH FAUZIAH. Studi Kasus Patologi Mikobakteriosis pada Ikan Paradise (Macropodus opercularis). Dibimbing oleh SRI ESTUNINGSIH dan DEWI RATIH AGUNGPRIYONO.
Ikan Paradise (Macropodus opercularis) yang diperoleh dari distributor ikan hias di Ciluar, Bogor ditemukan dalam keadaan ascites dan terdapat banyak ulkus pada kulit. Pada pemeriksaan histopatologi, terdapat peradangan granuloma yang ditemukan pada insang, subkutis, usus, hati, dan ginjal. Koloni bakteri ditemukan di dalam granuloma. Pewarnaan Gram menunjukkan bahwa bakteri memiliki sifat Gram positif. Pewarnaan Ziehl Neelsen (ZN) menunjukkan bahwa bakteri masuk ke dalam bakteri batang tahan asam. Berdasarkan sifat dari pewarnaan bakteri, diduga Mycobacterium sp. merupakan agen dari kasus ini. Mycobacterium sp. dilaporkan sebagai agen patogen yang menyebabkan radang granuloma pada ikan air tawar dan air laut. Spesies Mycobacterium yang dapat menginfeksi ikan diantaranya M. marinum, M. fortuitum, dan M. chelonae. Bakteri ini dapat berjalan hematogen sehingga menghasilkan infeksi sistemik dan berpotensi zoonosis.
Kata kunci: Fish tank granuloma, lesio granuloma oleh bakteri, mikobakteriosis pada ikan, penyakit ikan
ABSTRACT
RAHMAH FAUZIAH. Case Report Pathology of Mycobacteriosis in Paradise Fish (Macropodus opercularis). Supervised by SRI ESTUNINGSIH and DEWI RATIH AGUNGPRIYONO.
Paradise fish (Macropodus opercularis) from ornamental fish distributor Ciluar, Bogor were found with ascites and dermal ulcer. Histopathologically, granulomatous inflammation in various phase was found in gill, subcutis, intestine, liver, and kidney. Some bacteria were observed in those granuloma. The characteristic Gram staining was positive for the bacteria. Ziehl Neelsen (ZN) staining was revealed the acid fast rods bacteria. With these characters of bacteria, Mycobacterium sp. was suspected as a pathogen in this case. Mycobacterium sp. is reported as a pathogen causing granulomatous disease in freshwater and saltwater fish. Mycobacterium species which cause a disease in fish are M. marinum, M. fortuitum, and M. chelonae. Those hematogenous route produce systemic infection and potensial to be zoonotic.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
STUDI KASUS PATOLOGI MIKOBAKTERIOSIS
PADA IKAN PARADISE (Macropodus opercularis)
RAHMAH FAUZIAH
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Studi Kasus Patologi Mikobakteriosis pada Ikan Paradise (Macropodus opercularis)
Nama : Rahmah Fauziah NIM : B04080176
Disetujui oleh
Dr. drh. Sri Estuningsih, MSi, APVet Pembimbing I
drh. Dewi Ratih, Ph.D, APVet Pembimbing II
Diketahui oleh
drh. Agus Setiyono, MS, Ph.D, APVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2012 ini ialah studi kasus patologi ikan dengan judul Studi Kasus Patologi Mikobakteriosis pada Ikan Paradise (Macropodus opercularis).
Terima kasih penulis ucapkan kepada Dr. drh. Sri Estuningsih, M.Si, APVet dan drh. Dewi Ratih Agungpriyono, Ph.D, APVet selaku pembimbing skripsi atas motivasi, dukungan, dan kasih sayangnya selama membimbing penulis. Di samping itu, penghargaan penulis sampaikan kepada perusahaan budidaya ikan hias di Ciluar Bogor, CV. Taufan’s Fish Farm yang telah mengizinkan penulis mengambil sampel ikan dan memberikan informasi pada penelitian ini.
Ungkapan terima kasih juga disampaikan kepada ayah, ibu atas segala doa dan kasih sayangnya, serta orang-orang yang mendukung dan membantu penulis dalam menyusun skripsi: drh. Andriyanto, drh. Mawar Subangkit, drh. Wahono Esthi Prasetyaningtyas, drh. Elok Budi Retnani, Bapak Kasnadi, Bapak Sholeh, Mbak Kikie, dan seluruh staf Bagian Patologi FKH IPB. Ucapan terima kasih juga disampaikan kepada orang-orang terkasih penulis: Desray, Fatma, Bolas, Ambar, Ara, Elok, Anita, Jami, Andi, Fathia, Afifah, dan teman-teman Avenzoar lainnya yang tidak bisa penulis cantumkan semua.
Semoga karya ilmiah ini bermanfaat dan dapat dijadikan penelitian lebih lanjut untuk memperkaya ilmu pengetahuan serta dapat memperbaiki manajemen pemeliharaan ikan hias di Indonesia. Akhir kata penulis memohon maaf atas segala kekurangan dan kesalahan penulis dalam karya ilmiah ini.
Bogor, Januari 2013
DAFTAR ISI
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 1
METODE 2
Waktu dan Tempat 2
Alat dan Bahan 2
Metode Penelitian 2
Studi manajemen budidaya ikan hias 2
Pengambilan sampel 2
Transportasi sampel ke laboratorium 2
Pencatatan data sampel 3
Euthanasi 3
Nekropsi 3
Pemeriksaan patologi anatomi 3
Fiksasi 3
Pembuatan sediaan histopatologi 3
Analisis data 3
HASIL DAN PEMBAHASAN 4
Hasil 4
Ikan paradise 4
Pengamatan gejala klinis 4
Pemeriksaan patologi anatomi 5
Pemeriksaan histopatologi 6
Pembahasan 15
SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 19
LAMPIRAN 22
DAFTAR TABEL
1 Rangkuman hasil pemeriksaan patologi anatomi (PA) 6 2 Rangkuman hasil pemeriksaan sediaan histopatologi 7
DAFTAR GAMBAR
1 Ikan paradise 4
2 Ikan yang mengalami pembesaran abdomen dan yang tidak mengalami
pembesaran abdomen 5
3 Multifokus berwarna putih pada organ interna dan masa cairan pada
ikan yang mengalami pembesaran abdomen 5
4 Ulkus pada kulit 6
5 Granuloma yang ditemukan pada subkutis 7
6 Degenerasi dan mekrosis pada otot 7
7 Brankhitis pada insang 8
8 Granuloma yang ditemukan pada serosa saluran pencernaan ikan 8 9 Granuloma yang ditemukan pada mukosa saluran pencernaan ikan 9
10 Organ hati yang mengalami lesio granuloma 9
11 Organ ginjal yang mengalami lesio granuloma 10
12 Pola susunan granuloma pada sampel 11
13 Hasil pewarnaan Gram pada bakteri di dalam granuloma 11
14 Koloni bakteri pada pembuluh darah insang 12
15 Koloni bakteri di dalam granuloma pada sediaan dermis 12 16 Koloni bakteri pada mukosa dan submukosa salura pencernaan 13 17 Koloni bakteri di dalam granuloma pada ginjal 13
18 Koloni bakteri di dalam granuloma pada hati 13
19 Pola susunan granuloma tipe kaseosa dan granuloma tipe kaseosa pada
sampel 14
20 Pola susunan granuloma tipe nekrotik dan granuloma tipe
non-nekrotik pada sampel. 14
21 Pola susunan granuloma tipe fibrosis 17
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Indonesia memiliki keanekaragaman ikan hias baik air tawar maupun air laut, yaitu lebih kurang 450 spesies dari total 1.100 spesies ikan hias air tawar di dunia dan 700 spesies ikan hias air laut yang hanya terdapat di Indonesia (Wijaya 2011). Hal ini menjadi potensi ekonomi bagi bangsa Indonesia. Potensi ini apabila ditangani secara serius akan mampu bersaing di pasar internasional dan Indonesia dapat menjadi eksportir terbesar di dunia.
Usaha budidaya perikanan di Indonesia yang makin intensif, membuat masalah penyakit ikan meminta lebih banyak perhatian. Menurut Supriyadi dan Hardjamulia (1986), negara Indonesia memiliki masalah penyakit pada ikan, baik penyakit parasit maupun non parasit. Pada saat ini sangat sedikit literatur yang ditemukan di perpustakaan-perpustakaan yang memberikan gambaran patologi penyakit serta pencegahan yang dilakukan dalam menghadapi penyakit-penyakit hewan pada ikan. Begitu banyaknya penyakit ikan dan perlunya penanganan yang lebih lanjut akan membutuhkan tenaga yang ahli di bidang kesehatan. Dokter hewan memiliki peranan besar untuk mengatasi penyakit-penyakit tersebut. Ilmu patologi juga dapat mendukung dalam membantu mengetahui penyakit lebih lanjut serta tata cara penanganan penyakit tersebut.
Patologi adalah ilmu yang mempelajari proses kejadian suatu penyakit (Sobel 2006) yaitu dengan mendiagnosis suatu penyakit melalui pengamatan pada jaringan hewan dan cairan tubuh. Diagnosis patologi terhadap penyakit dilakukan berdasarkan pengamatan makroskopis, mikroskopis, pemeriksaan kimiawi cairan tubuh, serta pemeriksaan molekular organ, jaringan, dan sel yang dilakukan saat post mortem. Pemeriksaan post mortem merupakan prosedur penting dalam mendiagnosis penyakit ikan (Reimschuessel 1993), oleh karena itu penelitian mengenai penyakit ikan dirasa penting untuk mengurangi masalah penyakit budidaya ikan hias air tawar.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mendalami kasus penyakit ikan hias air tawar (ikan paradise) yang ditemukan di budidaya ikan hias sehingga diharapkan studi kasus ini dapat memberikan masukan dalam diagnosis, penanganan, dan pencegahan dari penyakit yang ditemukan bagi pihak pengelolaan budidaya ikan hias air tawar.
Manfaat
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan selama 6 bulan, dimulai dari bulan Januari sampai Juli 2012. Pengambilan sampel ikan hias air tawar (ikan paradise) dilakukan di perusahaan budidaya ikan hias air tawar di Ciluar Bogor. Pembuatan sediaan histopatologi, pemeriksaan, dan interpretasi dilakukan di Laboratorium Diagnostik Patologi dan Histopatologi, Bagian Patologi, Departemen Klinik Reproduksi dan Patologi (KRP), Fakultas Kedokteran Hewan, Institut Pertanian Bogor (FKH IPB).
Alat dan Bahan
Alat yang digunakan adalah kantong plastik atau kontainer, ember, gunting bedah, pinset anatomis, pinset fisiologis, freezer, kaset jaringan, inkubator, automatic tissue processor, tissue embedding console Sakura®, mikrotom, gelas objek, mikroskop cahaya Olympus CH-1®, kamera, dan eye piece camera microscope. Bahan yang digunakan adalah ikan paradise sebanyak 3 ekor, oksigen, Neutral Buffer Formalin (NBF) 10%, alkohol dengan konsentrasi bertingkat (70%, 80%, 90%, 95%, dan absolut), xylol, parafin, Sodium Thiosulfat 5%, Lithium Carbonat, asam periodik, air sulfit, asam asetat, reagen Schiff, Ponceau Xylidine Fuchsin, asam alkohol 3%, pewarna Hematoksilin C.I. 75290, Eosin C.I. 45380, Carazzi’s Hematoksilin, Aniline Blue C.I. 42755, Carbol Fuchsin, dan Methylene Blue C.I 52015.
Metode Penelitian
Studi manajemen budidaya ikan hias
Sebelum dilakukan pengamatan dan pengambilan sampel, dipelajari manajemen budidaya ikan untuk mengetahui tata cara pembenihan dan perawatan ikan yang baik agar dapat mengenali gejala klinis yang terjadi pada ikan serta memahami adanya penyakit infeksius ataupun non infeksius.
Pengambilan sampel
Pengambilan sampel dilakukan pada ikan paradise yang ditemukan mengalami kelainan di dalam satu akuarium. Kelainan pada ikan yang terjadi adalah perubahan warna atau bentuk tubuh, hilang keseimbangan, lemah, nafsu makan turun, kerusakan pada jaringan insang atau kulit ikan, dan terdapat pendarahan pada organ atau jaringan.
Transportasi sampel ke laboratorium
3
Euthanasi
Ikan di-euthanasi dengan cara dimasukkan ke dalam wadah berisi air, kemudian diletakkan ke dalam freezer dengan suhu -18°C selama 20 menit. Pendinginan ini akan menurunkan metabolisme dan tidak meningkatkan ambang nyeri (Noga 2011).
Nekropsi
Ikan yang sudah dieuthanasi diletakkan dengan posisi lateral recumbency, lalu diinsisi secara longitudinal di garis tengah ventral tubuh, mulai dari lubang anal sampai ruang insang. Kemudian dilanjutkan dengan menginsisi secara melintang pada kedua ujung dari potongan sebelumnya ke arah dorsal tubuh ikan, sehingga terlihat organ interna dan diamati apakah terdapat perubahan atau abnormalitas (Noga 2011). Pengamatan insang dilakukan dengan menggunting operkulum sehingga insang dapat diamati perubahannya.
Pemeriksaan patologi anatomi
Ikan yang sudah dinekropsi diamati lesio dan abnormalitas lainnya dari jaringan eksterna serta organ interna. Semua lesio dan abnormalitas didokumentasi dengan kamera. Penggaris diposisikan di samping ikan terlebih dahulu agar ukuran ikan dapat diketahui.
Fiksasi
Ikan yang sudah dinekropsi dan didokumentasi kemudian difiksasi menggunakan NBF 10% selama 24 jam. Ikan dapat langsung dimasukkan ke dalam wadah NBF 10% tanpa memisahkan organ-organ karena ukurannya yang relatif kecil atau kurang dari 10 cm.
Pembuatan sediaan histopatologi
Tubuh ikan yang sudah difiksasi kemudian dipotong (grossing) melintang dan dibagi atas lima sampai enam bagian, lalu dimasukkan ke dalam kaset jaringan. Hal ini dimaksudkan agar seluruh bagian ikan mulai dari insang hingga ginjal posterior dapat terlihat dalam pemeriksaan histopatologi (Bacha dan Bacha 2000). Potongan kemudian diproses menjadi sediaan histopatologi dengan pewarnaan Hematoksilin Eosin (HE) (Bancroft dan Stevens 1990), Gram (Rao 2010), Ziehl Neelsen (ZN) (Crookham dan Dapson 1991), dan Masson Trichrome (MT) (Rosen Lab 2005)(Lampiran 1).
Analisis data
4
HASIL DAN PEMBAHASAN
Hasil
Ikan paradise
Sampel yang digunakan pada penelitian adalah ikan paradise. Ikan paradise merupakan ikan tropis yang memiliki ukuran tubuh mencapai lebih kurang 5 cm dengan pola tubuh bergaris-garis yang diisi oleh dua macam warna (Gambar 1) (Aquatic Community 2004). Sirip dorsal dan sirip lateral berwarna gelap dan memudar berjalan seiring ke arah sirip kaudal. Warna tubuh ikan betina lebih pudar daripada warna ikan jantan.
Pengamatan gejala klinis
Sampel ikan paradise yang digunakan dalam penelitian ini diambil dari perusahaan budidaya ikan hias di daerah Ciluar, Bogor. Ikan ini ditempatkan dalam akuarium berukuran 0.8 x 0.4 x 0.4 m dengan kepadatan sekitar 150 ekor ikan paradise (ukuran 5 cm) dalam satu akuarium. Air untuk pemeliharaan ikan ini berasal dari air sumur setempat dengan suhu sekitar 27°C.
Saat pengamatan gejala klinis, ditemukan ikan yang mengalami pembesaran abdomen (ascites). Ikan yang mengalami ascites berenang tidak selincah ikan lainnya, sehingga terlihat lebih lamban dan berenang lebih ke bawah.
Pemeriksaan patologi anatomi
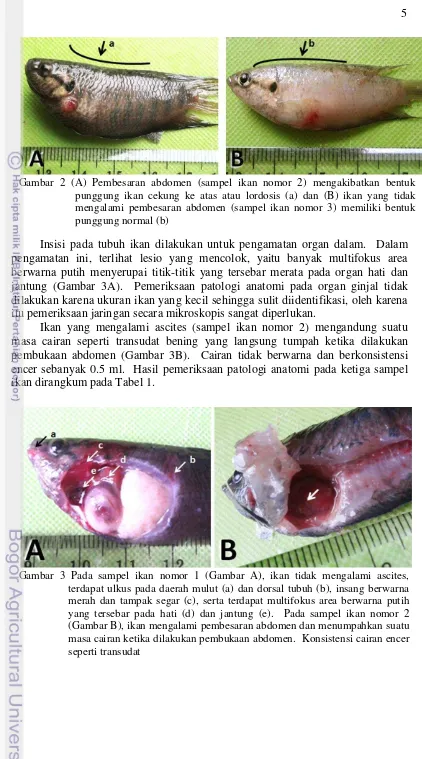
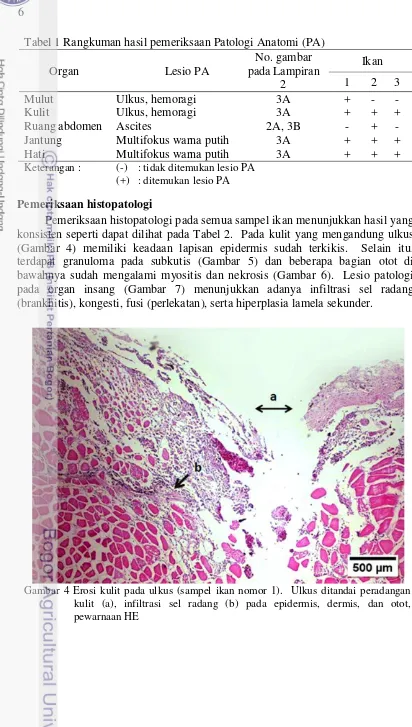
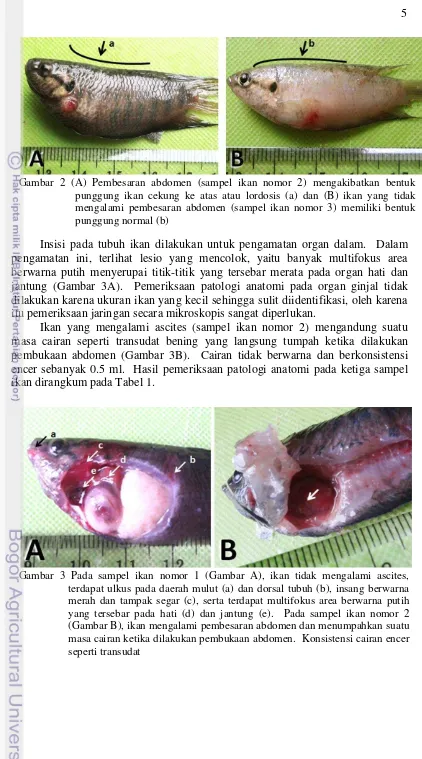
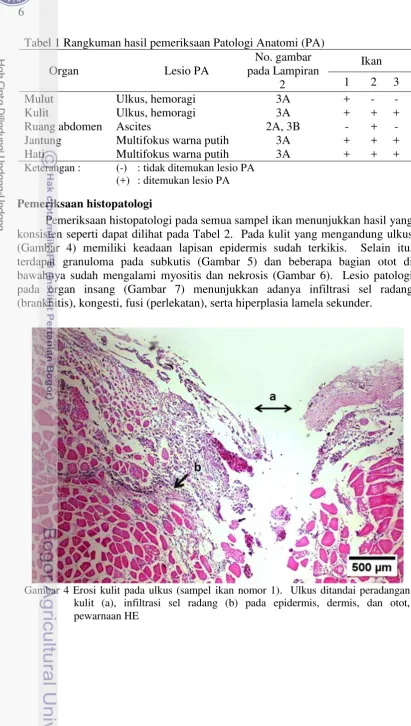
Pemeriksaan patologi anatomi pada semua sampel ikan (3 ekor) menunjukkan adanya lesio berupa ulkus di beberapa tempat, diantaranya kulit daerah abdomen dan sekitar mulut (Gambar 3). Pada daerah ulkus terdapat hemoragi yang ditunjukkan dengan warna merah pada lesio. Insang pada sampel ikan ini berwarna merah dan tampak segar (Gambar 3). Sampel ikan nomor 2 yang mengalami pembesaran abdomen memiliki bentuk punggung yang berbeda, yaitu lordosis (Gambar 2).
Gambar 1. Ikan paradise dengan pola tubuh bergaris-garis yang diisi oleh dua macam
5
Insisi pada tubuh ikan dilakukan untuk pengamatan organ dalam. Dalam pengamatan ini, terlihat lesio yang mencolok, yaitu banyak multifokus area berwarna putih menyerupai titik-titik yang tersebar merata pada organ hati dan jantung (Gambar 3A). Pemeriksaan patologi anatomi pada organ ginjal tidak dilakukan karena ukuran ikan yang kecil sehingga sulit diidentifikasi, oleh karena itu pemeriksaan jaringan secara mikroskopis sangat diperlukan.
Ikan yang mengalami ascites (sampel ikan nomor 2) mengandung suatu masa cairan seperti transudat bening yang langsung tumpah ketika dilakukan pembukaan abdomen (Gambar 3B). Cairan tidak berwarna dan berkonsistensi encer sebanyak 0.5 ml. Hasil pemeriksaan patologi anatomi pada ketiga sampel ikan dirangkum pada Tabel 1.
Gambar 2 (A) Pembesaran abdomen (sampel ikan nomor 2) mengakibatkan bentuk punggung ikan cekung ke atas atau lordosis (a) dan (B) ikan yang tidak mengalami pembesaran abdomen (sampel ikan nomor 3) memiliki bentuk punggung normal (b)
6
Pemeriksaan histopatologi
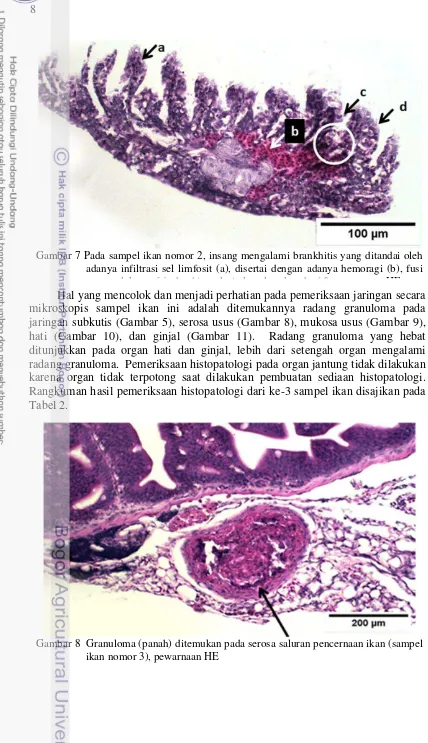
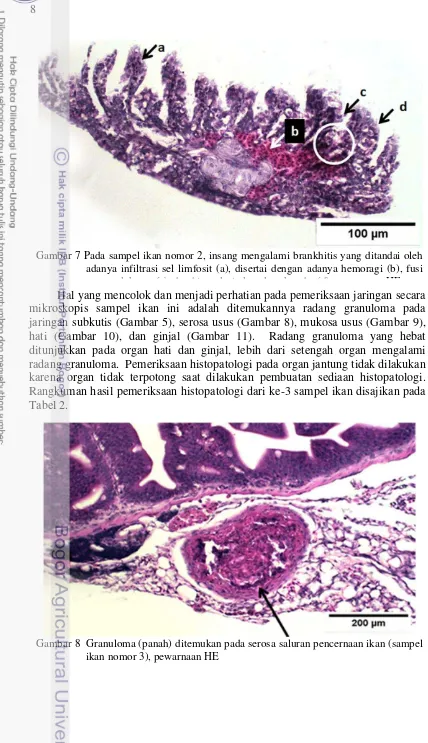
Pemeriksaan histopatologi pada semua sampel ikan menunjukkan hasil yang konsisten seperti dapat dilihat pada Tabel 2. Pada kulit yang mengandung ulkus (Gambar 4) memiliki keadaan lapisan epidermis sudah terkikis. Selain itu, terdapat granuloma pada subkutis (Gambar 5) dan beberapa bagian otot di bawahnya sudah mengalami myositis dan nekrosis (Gambar 6). Lesio patologi pada organ insang (Gambar 7) menunjukkan adanya infiltrasi sel radang (brankhitis), kongesti, fusi (perlekatan), serta hiperplasia lamela sekunder.
Tabel 1 Rangkuman hasil pemeriksaan Patologi Anatomi (PA)
7
Gambar 5 Granuloma (panah) yang ditemukan pada subkutis (sampel ikan nomor 2), pewarnaan HE
8
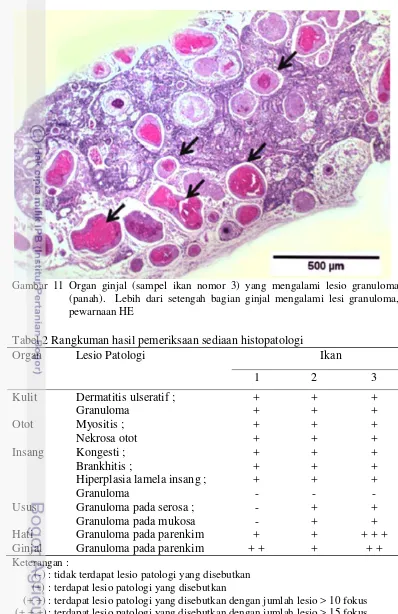
Hal yang mencolok dan menjadi perhatian pada pemeriksaan jaringan secara mikroskopis sampel ikan ini adalah ditemukannya radang granuloma pada jaringan subkutis (Gambar 5), serosa usus (Gambar 8), mukosa usus (Gambar 9), hati (Gambar 10), dan ginjal (Gambar 11). Radang granuloma yang hebat ditunjukkan pada organ hati dan ginjal, lebih dari setengah organ mengalami radang granuloma. Pemeriksaan histopatologi pada organ jantung tidak dilakukan karena organ tidak terpotong saat dilakukan pembuatan sediaan histopatologi. Rangkuman hasil pemeriksaan histopatologi dari ke-3 sampel ikan disajikan pada Tabel 2.
Gambar 7 Pada sampel ikan nomor 2, insang mengalami brankhitis yang ditandai oleh adanya infiltrasi sel limfosit (a), disertai dengan adanya hemoragi (b), fusi atau perlekatan (c), dan hiperplasia lamela sekunder (d), pewarnaan HE
Gambar8 Granuloma (panah) ditemukan pada serosa saluran pencernaan ikan (sampel
9
Gambar 9 Granuloma (panah) ditemukan pada mukosa saluran pencernaan ikan (sampel ikan nomor 3), pewarnaan HE
10
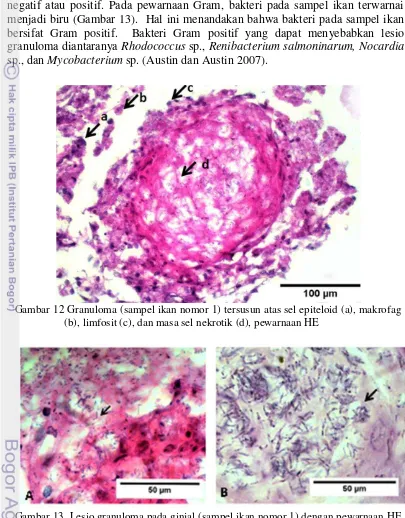
Granuloma yang terdapat pada sampel ikan ini tersusun atas sel radang kronis; sel epiteloid, makrofag, dan limfosit (Gambar 12). Berdasarkan pengamatan di bawah mikroskop dengan perbesaran 1000 kali, ditemukan bakteri Gambar 11 Organ ginjal (sampel ikan nomor 3) yang mengalami lesio granuloma
(panah). Lebih dari setengah bagian ginjal mengalami lesi granuloma, pewarnaan HE
Tabel 2 Rangkuman hasil pemeriksaan sediaan histopatologi
Organ Lesio Patologi Ikan
1 2 3
Kulit Dermatitis ulseratif ; Granuloma Usus Granuloma pada serosa ;
Granuloma pada mukosa
11 berbentuk batang di dalam granuloma (Gambar 13) dengan ukuran panjang 2-10 µm dan diameter 0.5-0.7 µm. Untuk mengkarakterisasi sifat pewarnaan bakteri, maka dilakukan pewarnaan Gram dan ZN.
Pewarnaan Gram berguna untuk mengetahui sifat bakteri, yaitu Gram negatif atau positif. Pada pewarnaan Gram, bakteri pada sampel ikan terwarnai menjadi biru (Gambar 13). Hal ini menandakan bahwa bakteri pada sampel ikan bersifat Gram positif. Bakteri Gram positif yang dapat menyebabkan lesio granuloma diantaranya Rhodococcus sp., Renibacterium salmoninarum, Nocardia sp., dan Mycobacterium sp. (Austin dan Austin 2007).
Pewarnaan ZN dilakukan untuk mengetahui genus bakteri tersebut. Pada pewarnaan ZN, bakteri pada sampel ikan dapat mempertahankan warna merah ketika dibilas dengan asam, sehingga dapat dikelompokkan dalam bakteri tahan Gambar 12 Granuloma (sampel ikan nomor 1) tersusun atas sel epiteloid (a), makrofag
(b), limfosit (c), dan masa sel nekrotik (d), pewarnaan HE
12
asam. Dari hasil pengamatan tersebut, dapat dilihat bahwa sampel ikan memiliki ciri khas agen yang mirip dengan Mycobacterium sp, yaitu berbentuk batang, memiliki sifat Gram positif, tahan asam, serta memiliki panjang 1-10 µm dan diameter 0.2-0.6 µm (Tappin 2011). Pewarnaan ZN dilakukan pada beberapa organ, diantaranya pada sediaan insang (Gambar 14), dermis (Gambar 15), usus (Gambar 16), ginjal (Gambar 17), dan hati (Gambar 18) untuk melihat perjalanan bakteri. Pewarnaan ZN pada organ-organ tersebut menunjukkan adanya koloni bakteri dengan bentuk dan sifat ketahanan asam yang sama.
Gambar 14 Pembuluh darah insang (sampel ikan nomer 1) berisi bakteri tahan asam (panah), pewarnaan ZN
13
Gambar 16 Koloni bakteri tahan asam (panah) terdeteksi pada mukosa dan submukosa saluran pencernaan (sampel ikan nomor 3), perwarnaan ZN
Gambar 17 Koloni bakteri tahan asam (panah) terdeteksi dalam granuloma pada ginjal (sampel ikan nomor 1), perwarnaan ZN
14
Granuloma pada sampel ikan ini memiliki bentuk dan diameter yang berbeda-beda. Diameter granuloma terkecil berukuran 44 µm hingga yang terbesar berukuran 1.599 µm. Menurut Scanga dan Flynn (2010), infeksi Mycobacterium sp. menghasilkan 3 macam tipe granuloma berdasarkan respon kekebalan inang, diantaranya adalah tipe kaseosa, tipe non nekrotik, dan fibrotik. Granuloma tipe kaseosa dan fibrotik dibatasi oleh jaringan ikat. Penyebaran jaringan ikat dapat dilihat dengan melakukan pewarnaan MassonTrichrome(MT). Hasil pengamatan menunjukkan terdapat 2 tipe dari 3 tipe granuloma menurut Scanga dan Flynn (2010) pada sampel ikan ini, yaitu tipe kaseosa (sampel ikan nomor 2 dan 3) (Gambar 19) dan tipe non-nekrotik (sampel ikan nomor 1) (Gambar 20).
Gambar 19 (A) Pola susunan granuloma tipe kaseosa (Scanga dan Flynn 2010). (B) Granuloma tersusun atas jaringan ikat (a), makrofag (b), serta lesio nekrosis dan sel debri (c), pewarnaan MT
Gambar 20 (A) Pola susunan granuloma tipe non-nekrotik (Scanga dan Flynn 2010). (B) Granuloma tidak dibatasi oleh jaringan ikat, tersusun atas limfosit (a), koloni bakteri (b) dan makrofag (c), pewarnaan HE
15
Pembahasan
Satu dari tiga ekor sampel ikan mengalami ascites. Di dalam rongga abdomen, terdapat genangan cairan bening seperti transudat. Ascites seperti ini dapat terjadi akibat kerusakan ginjal atau hati. Kerusakan ginjal berpengaruh terhadap osmoregulasi. Osmoregulasi adalah proses fisiologi pada ikan dalam mengatur keseimbangan air dan garam dalam tubuh (Burgess 2011). Organ ginjal harus mempertahankan keseimbangan garam yang ditangkap oleh sel kloride pada insang dan melalui makanan, serta mengeluarkan kelebihan air dan garam melalui urin (Hammerschlag 1999). Kerusakan ginjal menyebabkan osmoregulasi pada tubuh ikan terganggu, sehingga terjadi retensi air yang seharusnya diekskresikan.
Ascites dapat juga disebabkan oleh hipertensi portal pada kasus sirosis hati. Terjadi hambatan aliran darah di sinusoid-sinusoid hati akibat kondisi sirosis atau terbentuknya fibrosis di tepi granuloma sehingga darah yang masuk ke hati melalui vena porta mengalami retensi atau hambatan. Hambatan ini menyebabkan tingginya tekanan darah menuju hati sehingga terjadi kongesti pada vena porta (Cardenas dan Arroyo 2003). Kongesti ini mengakibatkan perubahan permeabilitas pembuluh darah sehingga protein keluar dari pembuluh darah dan terjadilah penimbunan cairan pada rongga abdomen. Selain itu, hati merupakan organ yang mensintesis protein. Kerusakan pada sebagian besar parenkim hati, mengakibatkan produksi protein menjadi rendah sehingga ikan mengalami hipoproteinemia. Hipoproteinemia dapat menurunkan daya ikat protein plasma sehingga plasma darah merembes keluar dari pembuluh darah dan terjadi penimbunan cairan di rongga abdomen (Isselbacher et al. 1999). Kasus ascites pada ikan yang parah dapat menyebabkan sisik ikan menjadi tegang sehingga mirip seperti biji pinus (Meyer 2011). Pada sampel ikan ini tidak terjadi hal demikian, diduga karena ascites pada ikan belum parah (abdomen tidak terlalu besar).
Ascites adalah penimbunan cairan secara abnormal di rongga abdomen. Perut ikan berada pada bagian ventral tubuhnya, sehingga pada kasus ascites, pengaruh gaya gravitasi sangat berarti. Akibat yang ditimbulkan dari ascites adalah kelainan bentuk tulang punggung yang dipengaruhi gaya gravitasi terhadap beratnya penimbunan cairan di peritoneum. Tulang punggung juga ikut tertarik ke bawah, sehingga mengalami lordosis (Cameron et al. 2006).
16
Berdasarkan pengamatan di bawah mikroskop pada fokus granuloma menggunakan perbesaran 1000 kali, ditemukan adanya kumpulan bakteri berbentuk batang dengan panjang 2-10 µm dan diameter 0.5-0.7 µm. Lesio granuloma yang bersifat sistemik seperti pada sampel ikan ini biasanya disebabkan oleh bakteri yang terdistribusi secara sistemik melalui peredaran darah, diantaranya adalah Mycobacterium sp., Nocardia sp., Francisella sp., Rhodococcus sp., Renibacterium salmoninarum, Citrobacter freundii, Photobacterium damselae, Vibrio sp., Seriola liquefaciens, Edwardsiella tarda, dan Flavobacterium sp. (Hawke et al. 2011). Untuk mengidentifikasi jenis bakteri yang menginfeksi, maka dilakukan pewarnaan Gram.
Hasil dari pewarnaan Gram menunjukkan bahwa bakteri bersifat Gram positif. Bakteri batang dengan sifat Gram positif yang menimbulkan radang granuloma sistemik diantaranya ialah Rhodococcus sp., Renibacterium salmoninarum, Nocardia sp., dan Mycobacterium sp. (Austin dan Austin 2007).
Pewarnaan ZN dilakukan untuk mengetahui genus bakteri tersebut. Bakteri pada sampel ikan dapat mempertahankan warna merah ketika dibilas dengan asam, sehingga dapat dikelompokkan dalam bakteri tahan asam. Bakteri Gram positif dan tahan asam yang dapat menimbulkan radang granuloma sistemik diantaranya ialah Nocardia sp. dan Mycobacterium sp. (Scanga dan Flynn 2010). Keduanya memiliki banyak persamaan, namun Nocardia sp. bersifat tahan terhadap asam alkohol 1% sedangkan Mycobacterium sp. bersifat tahan terhadap asam alkohol 3% (Davis dan Ramakrishnan 2008). Hasil pewarnaan ZN menggunakan asam alkohol 3% menunjukkan bahwa bakteri yang menginfeksi sampel ikan merupakan bakteri yang tahan terhadap asam alkohol 3%.
Hasil pengamatan menunjukkan bahwa sampel ikan memiliki ciri khas agen yang mirip dengan Mycobacterium sp., yaitu berbentuk batang, memiliki sifat Gram positif, tahan asam, serta memiliki panjang 1-10 µm dan diameter 0,2-0,6 µm (Tappin 2011). Gejala klinis serta lesio yang dihasilkan juga mirip dengan infeksi Mycobacterium sp., yang telah dilaporkan antara lain terdapat pembesaran abdomen, kelainan bentuk tulang punggung, kematian yang banyak, serta terdapat radang granuloma pada organ internal (Abowei dan Briyai 2011). Berdasarkan pengamatan gejala klinis, lesio patologi anatomi, lesio histopatologi, dan berbagai pewarnaan bakteri, dapat diteguhkan bahwa sampel ikan mengalami infeksi Mycobacterium sp.
Mycobacterium sp. merupakan agen yang paling umum diketahui sebagai penyebab radang granuloma pada ikan. Bakteri ini dapat menyerang spesies ikan yang hidup di air tawar maupun air laut. Bakteri ini masuk ke dalam genus Mycobacterium, ordo Actinomycetales, sub ordo Corynebacterineae, dan famili Mycobacteriaceae (Decostere et al. 2003).
17 ikan nomor 1 (Gambar 20). Tipe fibrotik (Gambar 21) terdiri atas sel radang (limfosit dan makrofag) dan dibatasi oleh jaringan ikat namun tidak membentuk sel debri. Tipe granuloma ini tidak ditemukan pada sampel ikan.
Infeksi Mycobacterium sp. ditularkan terutama melalui konsumsi pakan yang terkontaminasi, melalui kanibalisme dari ikan yang terinfeksi, atau air yang terkontaminasi. Potensi sumber infektif dapat berasal dari tanah atau air, karena di dalam tanah dan air, bakteri ini dapat bertahan hidup selama 2 tahun atau lebih. Rute penularan lain dapat melalui luka (Descostere et al. 2003).
Sampel ikan pada penelitian ini memiliki ulserasi pada mulut dan daerah tubuh lainnya. Pemeriksaan histopatologi menunjukkan adanya koloni bakteri pada sediaan dermis (Gambar 15), sehingga dikatakan bahwa luka dapat menjadi salah satu jalur masuk Mycobacterium sp. pada sampel ikan. Jalur masuk lain yang mungkin terjadi pada infeksi Mycobacterium sp. pada sampel ikan ini adalah melalui ingesti karena ikan memiliki kebiasaan memakan ikan mati yang mungkin terinfeksi Mycobacterium sp. Jika kemungkinan hal tersebut terjadi, maka Mycobacterium sp. dapat masuk sampai ke dalam lambung karena bakteri ini merupakan bakteri yang tahan terhadap asam.
Insang merupakan salah satu organ yang menghubungkan lingkungan luar dengan organ dalam ikan, oleh karena itu insang sering menunjukkan reaksi peradangan pada benda asing seperti bakteri atau polutan yang masuk. Pemeriksaan patologi anatomi pada insang sampel ikan, tidak menunjukkan adanya perubahan patologi, namun pemeriksaan histopatologi menunjukkan adanya lesio brankhitis, kongesti, fusi, serta hiperplasia lamela sekunder (Gambar 7) disertai temuan bakteri pada pembuluh darah (Gambar 14). Hal ini menunjukkan bahwa penularan melalui insang dapat terjadi apabila jumlah bakteri di lingkungan cukup tinggi atau ikan memiliki kekebalan tubuh yang buruk (Floyd dan Yanong 2002).
Mycobacterium sp. menjadi perhatian umum pada budidaya ikan karena kerugian yang diakibatkan oleh morbiditasnya cukup tinggi. Mycobacterium sp. yang patogen pada ikan saat ini diantaranya M. marinum, M. fortuitum, dan M. chelonae (Gauthier dan Rhodes 2008). M. marinum merupakan spesies yang paling banyak diisolasi dari ikan, M. fortuirum jarang dilaporkan namun dapat terjadi di daerah tropis dan subtropis, dan M. chelonae sering ditemukan di spesies ikan salmonid yang berada pada air dingin (Descostere, et al. 2003).
18
Mikobakteriosis pernah dilaporkan sebagai penyakit yang berpotensi merugikan pada budidaya ikan gurame di Indonesia yang mengakibatkan kematian secara persisten hingga mencapai 40% dengan pola kronik (Purwaningsih dan Taukhid 2010). Akibat infeksi bakteri ini, reproduksi ikan terganggu, produksi benih menurun, dan kondisi benih yang dihasilkan lemah. Hal ini menjadi masalah yang berarti pada pengusaha budidaya ikan.
Mycobacterium sp. banyak ditemukan dalam berbagai sumber air, sehingga ikan sering terpapar dari lingkungan mereka. Stress, gizi yang kurang, dan lesio eksternal dapat melemahkan sistem kekebalan ikan sehingga membuatnya lebih rentan terinfeksi. Pencegahan adalah cara terbaik untuk melindungi infeksi ini, diantaranya dengan membuat ikan-ikan tetap sehat dengan kualitas gizi yang baik, memantau parameter kualitas air, dan mengganti air secara teratur. Ikan yang sakit atau mati dipisahkan dari tangki untuk dikarantina atau dimusnahkan. Selain itu, peralatan yang digunakan untuk membersihkan tangki harus didesinfeksi sebelum dan sesudah digunakan (Center for Food Security and Public Health 2006).
Pada umumnya, sejumlah antibiotik seperti Penicillin dan Bacitracin dapat digunakan untuk mengendalikan bakteri patogen Gram positif karena dapat merusak dinding sel bakteri, namun Mycobacterium sp. dilaporkan merupakan bakteri yang resisten pada beberapa bakterisida pada tingkat dosis standar (Irianto 2005). Sifat resisten tersebut menyebabkan belum ada pengobatan pada kasus infeksi ini selain depopulasi pada kelompok ikan yang terinfeksi. Sangat dianjurkan untuk melakukan desinfeksi kolam dan peralatan budidaya setelah melakukan depopulasi. Sebanyak 10.000 ppm senyawa amonium atau 60-85% alkohol diketahui dapat membunuh Mycobacterium sp. (Floyd dan Yanong 2002).
Berdasarkan penelitian Somsiri et al. (2005), jumlah organisme Mycobacterium sp. lebih tinggi pada daerah rawa karena berkorelasi dengan kondisi lingkungannya, yaitu kadar oksigen yang rendah, kandungan organik yang tinggi, pH rendah, serta air yang hangat. Kondisi ini sering ditemui pada sistem akuakultur. Kondisi lain yang ditemukan pada sistem akuakultur air tawar ialah adanya kaitan salinitas yang rendah dengan peningkatan prevalensi Mycobacterium non TB.
19
SIMPULAN DAN SARAN
Simpulan
Simpulan yang didapat dari penelitian ini ialah berdasarkan dari gejala klinis, lesio patologi anatomi, lesio histopatologi, serta bentuk dan sifat pewarnaan agen yang terdapat pada jaringan, sampel ikan didiagnosis mengalami infeksi Mycobacterium sp. Infeksi Mycobacterium sp. pada sampel ini bersifat sistemik yang transmisi awalnya dapat melalui ingesti, insang, dan kulit.
Saran
Perlu dilakukan isolasi dan identifikasi dari spesies Mycobacterium sp. yang sering menyerang ikan hias air tawar, studi potensi zoonosis, serta studi mengenai transmisi penyakit melalui insang, kulit, dan ingesti pada kasus mikobakteriosis.
DAFTAR PUSTAKA
Abowei JFN, Briyai OF. 2011. A review of some bacteria disease in Africa culture fisheries. Asian Journal of Medical Sciences 3(5): 206-207.
Anonim. 2012. Anatomi eksternal ikan teleost. [terhubung berkala]. www3. telus. net. [14 Februari 2012].
Aquatic Community. 2004. Paradise fish - Macropodus opercularis. [terhubung berkala]. http://www. aquaticcommunity. com/fish/paradisefish. php. [25 Februari 2012].
Austin B, Austin D. 2007. Bacterial Fish Pathogens. UK: Praxis Publishing Ltd. Hlm: 63-64.
Bancroft J, Stevens A. 1990. Theory and Practice of Histological Technique. New York: Churchill livingstone. Hlm: 97-100.
Burgess P. 2011. Dedicated to fancy guppy breeding in the UK. [terhubung berkala]. http://www.fancyguppies.co.uk/page42.htm. [27 November 2012]. Cameron JR, Skofronick JG, Grant RM. 2006. Fisika Tubuh Manusia. Jakarta:
Penerbit Buku Kedokteran EGC. Hlm: 47-49.
Cardenas A, Arroyo V. 2003. Mechanisms of water and sodium retention in cirrhosis and the pathogenesis of ascites. Best Practice and Research Clinical Endocrinology and Metabolism17 (14): 607-622.
Center for Food Security and Public Health. 2006. Mycobacteriosis in fish. Transmissible Disease Fact Sheet No. 90: 1-3.
Crookham J, Dapson R. 1991. Hazardous chemicals in the histopathology. Anatechnology: 1-3.
Davis JM. Ramakrishnan L. 2008. The very pulse of the machine: the tuberculous granuloma in motion. Immunity 28: 146-148.
20
Floyd RF. Yanong R. 2002. Mycobacterium in fish. Florida Cooperation Extension Service 96: 1-4.
Gauthier DT, Rhodes WR. 2008. Mycobacteriosis in fishes: a review. The Veterinary Journal 180: 33-47.
Hammerschlag N. 1999. Marine and Freshwater Behaviour and Physiology. Canada: Institut of Miami. Hlm: 1-7.
Hawke J, Crowder C, Soto E. 2011. Bacterial ganulomatous disease in fish. Baton Rouge: Louisiana State University: 10-22.
Irianto A. 2005. Patologi Ikan Teleostei. Yogyakarta: Gadjah Mada University Press. Hlm: 156-158.
Isselbacher KJ, Braunwald E, Martin JB, Fauci AS, Kasper DL. 1999. Harrison Prinsip-Prinsip Ilmu Penyakit Dalam. Jakarta: Penerbit Buku Kedokteran EGC. Hlm: 217.
Juarez JLS, Ganguli S, Kirschner D. 2004. Identifying control mechanisms of granuloma formation during M. tuberculosis infection using an agent-based model. Journal of Thereotical Biology 231: 359-360.
Maryland Departement of Health and Mental Hygiene. 2002. Mycobacterium marinum fact sheet. Epidemiology and Disease Control Program.
Meyer SM. 2011. Cause of dropsy symptoms. [terhubung berkala]. www.fishchannel.com. [25 November 2012].
Noga EJ. 2011. Fish Disease : Diagnosis and Treatment Second Edition. Iowa: Wiley-Blackwell. Hal: 107-267.
Panek FM, Bobo T. 2006. Zoonotic fish disease and adaptive fishery management: considerations for striped bass (Morone saxatilis) from the chesapeake bay. Fish and Wild Agencies60: 140-144.
Purwaningsih U, Taukhid. 2010. Diagnosa penyakit mikobakteriosis, Mycobacterium fortuitum pada ikan gurame (Osphronemus gouramy) dengan teknik Polymerase Chain Reaction (PCR). Prosiding Forum Inovasi Teknologi Akuakultur: 969-970.
Rao S. 2010. Gram’s staining. [terhubung berkala]. www.microrao.com. [30 Mei 2012].
Reimschuessel R. 1993. Postmortem Examination. Di dalam: Stoskopf MK, editor. 1993 Fish Medicine. Philadelphia: W B Saunders Company. Hal: 161.
Rosen Lab. 2005. Masson Trichrome staining. [terhubung berkala]. http://www.bcm.edu/rosenlab. [1 November 2012].
Scanga CA, Flynn JL. 2010. Mycobacterial infections and the inflammatory seesaw. Cell Host and Microbe7: 177-178.
Sobel ME. 2006. Pathology a Career in Medicine. Bethesda: Intersociety Council for Pathology Information (ICPI). Hlm: 1.
Somsiri T, Puttinaowarat A, Soontornwit S, Lacharoje S. 2005. Contamination of Micobacterium spp. in live feeds. Disease in Asian Aquaculture V: 231-235. Stoskopf MK. 1993. Fish Medicine. Philadelphia: W B Saunders Company.
21 Tappin AR. 2011. A Fishkeeper’s Guide to Mycobacteriosis. London: Art
Publications. Hal: 4-7.
22
LAMPIRAN
Lampiran 1
Pembuatan Sediaan Histopatologi
Pembuatan sediaan histopatologi berdasarkan Bacha dan Bacha (2000) pada organ ikan dapat dilakukan dengan prosedur sebagai berikut :
1. Grossing
Sediaan organ ikan yang sudah direndam dalam larutan Neutral Buffer Formalin (NBF) 10%, kemudian dipotong dengan ketebalan + 3 mm dan potongannya dimasukkan ke dalam kaset jaringan.
2. Dehidrasi
Organ yang ada dalam kaset jaringan dimasukkan ke dalam gelas-gelas mesin autotechnicon untuk dilakukan dehidrasi. Dehidrasi ini dilakukan bertahap dengan menggunakan alkohol yang konsentrasinya bertingkat, dimulai dari konsentrasi 70%, 80%, 90%, 95%, alkohol absolut 1, alkohol absolut 2. Setelah itu dilakukan proses penjernihan (clearing) dengan memasukkan sediaan ke dalam xylol, dua kali ulangan.
3. Infiltrasi Parafin
Jaringan diinfiltrasi dalam parafin dengan merendamnya dalam parafin cair sebanyak tiga kali ulangan.
4. Penanaman (embedding) dan pencetakan (blok)
Sediaan yang telah diinfiltrasi parafin ditanam dalam cetakan yang telah berisi parafin cair setengah dari dinding cetakan, kemudian setelah mulai membeku ditambahkan lagi dengan parafin cair sampai penuh. Proses ini dilakukan di mesin tissue embedding console (Sakura®). Sediaan tersebut diatur letaknya kemudian diberi label lalu dibekukan dalam lemari es untuk memudahkan pemotongan.
5. Pemotongan
Jaringan dipotong 3-5 µm dengan mikrotom (Spencer®). Hasil potongan diletakkan di atas air hangat untuk mencegah terjadinya lipatan saat dibentangkan. Sediaan dilekatkan di atas gelas objek kemudian dikeringkan dalam hot plate.
Pewarnaan Hematoksilin Eosin (HE)
Pewarnaan HE termasuk dalam jenis pewarnaan ganda (double staining) karena menggunakan 2 jenis zat warna. Pada pewarnaan ganda, umumnya pewarnaan yang digunakan satu bersifat asam dan yang lain bersifat basa. Paduan sifat tersebut menyebabkan bagian-bagian yang bersifat asidofilik dan basofilik dapat ditonjolkan. Penggunaan pewarna ganda bertujuan agar terjadi kekontrasan antara bagian yang bersifat asidofilik dan basofilik, sehingga pengenalan bagian tertentu dapat lebih cepat dan jelas terlihat.
23 tiosulfat 2-3 menit. Sediaan dicuci kembali dalam air mengalir selama 3-5 menit. Sediaan diwarnai dengan pewarna hematoksilin Mayer selama 8 menit, kemudian dicuci dengan air mengalir, direndam dalam Lithium Carbonat selama 15-30 detik, kemudian dicuci kembali dalam air mengalir. Sediaan diwarnai dengan pewarna eosin selama 2-3 menit, setelah itu sediaan dicuci dalam air mengalir untuk membersihkan warna eosin yang berlebihan. Selanjutnya sediaan didehidrasi dengan memasukkannya ke dalam alkohol 70%, alkohol 95%, alkohol absolut dua kali ulangan masing selama 2-3 menit, xylol dua kali ulangan masing-masing selama 2 menit. Setelah semuanya selesai, sediaan dikeringkan kemudian ditetesi dengan mounting solution dan ditutup dengan gelas penutup dan siap untuk diperiksa di bawah mikroskop (Bancroft dan Stevens 1990).
Pewarnaan Gram pada Jaringan
Sediaan yang siap diwarnai diletakkan pada rak, kemudian diteteskan pewarna kristal violet selama 1 menit. Sediaan jaringan kemudian dibilas pada air mengalir. Sediaan jaringan dibersihkan menggunakan tetesan aseton sampai tidak ada warna yang mengalir dari tetesan tersebut. Sediaan jaringan kemudian direndam dalam air mengalir dan diletakkan kembali pada rak, lalu diteteskan pewarna Basic fuchsin selama 3 menit. Kemudian sediaan jaringan kembali dibersihkan dengan menggunakan rendaman aseton secara cepat sebanyak 2 kali rendaman, kemudian direndam pada campuran aseton dan asam pikrat sampai terbentuk warna salmon, lalu direndam lagi ke dalam aseton yang baru. Pewarnaan Gram selesai dilakukan, setelah itu preparat dikeringkan lalu direndam dalam xylene dan ditutup dengan cover glass.
Pewarnaan Gram berguna untuk melihat sifat Gram dari bakteri dengan warna latar belakang kuning dan nukleus merah. Apabila bakteri terwarnai biru, maka bakteri tersebut termasuk ke dalam Gram positif. Apabila bakteri tersebut terwarnai merah, maka memiliki sifat Gram negatif (Rao 2010).
Pewarnaan Ziehl Niehlsen (ZN) pada Jaringan
Pewarnaan ZN pada jaringan digunakan untuk mewarnai preparat histopatologi yang telah dideparafinisasi dan hidrasi sampai tahap perendaman pada aquades. Preparat yang siap diwarnai diletakkan pada rak, kemudian diteteskan pewarna Carbol Fuchsin selama 30 menit. Setelah itu, preparat dicuci dengan cara diteteskan dengan asam alkohol 3%sampai tidak ada lagi warna yang mengalir dari tetesan tersebut. Preparat kemudian diwarnai kembali dengan Methylene Blue selama 15 menit, kemudian dicuci pada air mengalir. Setelah itu preparat kembali didehidrasi dan ditutup degan cover glass.
Pewarnaan ZN berguna untuk melihat ketahanan bakteri terhadap asam, dengan warna latar belakang biru. Apabila hasil pewarnaan menunjukkan warna bakteri yang merah, maka bakteri tersebut merupakan bakteri yang tahan asam (Crookham dan Dapson 1991).
Pewarnaan Masson Trichrome(MT) pada Jaringan
24
Proses pewarnaan MT diawali dengan deparafinisasi. Kemudian dicelup di dalam larutan Mordant selama 30-40 menit. Pencelupan dilanjutkan ke dalam Carazzi’s Hematoksilin selama 40 menit. Kemudiaan sediaan dimasukkan ke dalam orange G 0,75% selama 1-2 menit. Setelah itu, dicelupkan ke dalam asam asetat 1% sebanyak dua kali. Lalu, sediaan dimasukkan ke dalam larutan Ponceau Xylidine Fuchsin selama 15 menit. Selanjutnya larutan kembali dicelup dalam asam asetat 1% selama dua kali. Kemudian sediaan dimasukkan ke dalam asam fosfotungstik 2,5% selama 10 menit. Sediaan kembali dibilas ke dalam asam asetat 1% sebanyak dua kali. Selanjutnya sediaan diwarnai dalam pewarna anilin blue selama 15 menit. Sediaan kembali dibilas dengan asam asetat 1% sebanyak dua kali dan dicelup dalam alkohol 95% selama 3 menit. Setelah sediaan telah terwarnai, sediaan kemudian didehidrasi dan ditutup dengan cover glass (Rosen Lab 2005).
Pemeriksaan Histopatologi
25
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada 14 Agustus 1991. Penulis merupakan putri ke empat dari empat bersaudara dari pasangan Ahmad Labib dan Mukminatus Sholihah. Penulis mengenyam pendidikan formal di SD Pemuda Bangsa Depok (2002), SMP Negeri 4 Depok (2005), dan SMA Negeri 3 Depok (2008).
1
PENDAHULUAN
Latar Belakang
Indonesia memiliki keanekaragaman ikan hias baik air tawar maupun air laut, yaitu lebih kurang 450 spesies dari total 1.100 spesies ikan hias air tawar di dunia dan 700 spesies ikan hias air laut yang hanya terdapat di Indonesia (Wijaya 2011). Hal ini menjadi potensi ekonomi bagi bangsa Indonesia. Potensi ini apabila ditangani secara serius akan mampu bersaing di pasar internasional dan Indonesia dapat menjadi eksportir terbesar di dunia.
Usaha budidaya perikanan di Indonesia yang makin intensif, membuat masalah penyakit ikan meminta lebih banyak perhatian. Menurut Supriyadi dan Hardjamulia (1986), negara Indonesia memiliki masalah penyakit pada ikan, baik penyakit parasit maupun non parasit. Pada saat ini sangat sedikit literatur yang ditemukan di perpustakaan-perpustakaan yang memberikan gambaran patologi penyakit serta pencegahan yang dilakukan dalam menghadapi penyakit-penyakit hewan pada ikan. Begitu banyaknya penyakit ikan dan perlunya penanganan yang lebih lanjut akan membutuhkan tenaga yang ahli di bidang kesehatan. Dokter hewan memiliki peranan besar untuk mengatasi penyakit-penyakit tersebut. Ilmu patologi juga dapat mendukung dalam membantu mengetahui penyakit lebih lanjut serta tata cara penanganan penyakit tersebut.
Patologi adalah ilmu yang mempelajari proses kejadian suatu penyakit (Sobel 2006) yaitu dengan mendiagnosis suatu penyakit melalui pengamatan pada jaringan hewan dan cairan tubuh. Diagnosis patologi terhadap penyakit dilakukan berdasarkan pengamatan makroskopis, mikroskopis, pemeriksaan kimiawi cairan tubuh, serta pemeriksaan molekular organ, jaringan, dan sel yang dilakukan saat post mortem. Pemeriksaan post mortem merupakan prosedur penting dalam mendiagnosis penyakit ikan (Reimschuessel 1993), oleh karena itu penelitian mengenai penyakit ikan dirasa penting untuk mengurangi masalah penyakit budidaya ikan hias air tawar.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mendalami kasus penyakit ikan hias air tawar (ikan paradise) yang ditemukan di budidaya ikan hias sehingga diharapkan studi kasus ini dapat memberikan masukan dalam diagnosis, penanganan, dan pencegahan dari penyakit yang ditemukan bagi pihak pengelolaan budidaya ikan hias air tawar.
Manfaat
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan selama 6 bulan, dimulai dari bulan Januari sampai Juli 2012. Pengambilan sampel ikan hias air tawar (ikan paradise) dilakukan di perusahaan budidaya ikan hias air tawar di Ciluar Bogor. Pembuatan sediaan histopatologi, pemeriksaan, dan interpretasi dilakukan di Laboratorium Diagnostik Patologi dan Histopatologi, Bagian Patologi, Departemen Klinik Reproduksi dan Patologi (KRP), Fakultas Kedokteran Hewan, Institut Pertanian Bogor (FKH IPB).
Alat dan Bahan
Alat yang digunakan adalah kantong plastik atau kontainer, ember, gunting bedah, pinset anatomis, pinset fisiologis, freezer, kaset jaringan, inkubator, automatic tissue processor, tissue embedding console Sakura®, mikrotom, gelas objek, mikroskop cahaya Olympus CH-1®, kamera, dan eye piece camera microscope. Bahan yang digunakan adalah ikan paradise sebanyak 3 ekor, oksigen, Neutral Buffer Formalin (NBF) 10%, alkohol dengan konsentrasi bertingkat (70%, 80%, 90%, 95%, dan absolut), xylol, parafin, Sodium Thiosulfat 5%, Lithium Carbonat, asam periodik, air sulfit, asam asetat, reagen Schiff, Ponceau Xylidine Fuchsin, asam alkohol 3%, pewarna Hematoksilin C.I. 75290, Eosin C.I. 45380, Carazzi’s Hematoksilin, Aniline Blue C.I. 42755, Carbol Fuchsin, dan Methylene Blue C.I 52015.
Metode Penelitian
Studi manajemen budidaya ikan hias
Sebelum dilakukan pengamatan dan pengambilan sampel, dipelajari manajemen budidaya ikan untuk mengetahui tata cara pembenihan dan perawatan ikan yang baik agar dapat mengenali gejala klinis yang terjadi pada ikan serta memahami adanya penyakit infeksius ataupun non infeksius.
Pengambilan sampel
Pengambilan sampel dilakukan pada ikan paradise yang ditemukan mengalami kelainan di dalam satu akuarium. Kelainan pada ikan yang terjadi adalah perubahan warna atau bentuk tubuh, hilang keseimbangan, lemah, nafsu makan turun, kerusakan pada jaringan insang atau kulit ikan, dan terdapat pendarahan pada organ atau jaringan.
Transportasi sampel ke laboratorium
3
Euthanasi
Ikan di-euthanasi dengan cara dimasukkan ke dalam wadah berisi air, kemudian diletakkan ke dalam freezer dengan suhu -18°C selama 20 menit. Pendinginan ini akan menurunkan metabolisme dan tidak meningkatkan ambang nyeri (Noga 2011).
Nekropsi
Ikan yang sudah dieuthanasi diletakkan dengan posisi lateral recumbency, lalu diinsisi secara longitudinal di garis tengah ventral tubuh, mulai dari lubang anal sampai ruang insang. Kemudian dilanjutkan dengan menginsisi secara melintang pada kedua ujung dari potongan sebelumnya ke arah dorsal tubuh ikan, sehingga terlihat organ interna dan diamati apakah terdapat perubahan atau abnormalitas (Noga 2011). Pengamatan insang dilakukan dengan menggunting operkulum sehingga insang dapat diamati perubahannya.
Pemeriksaan patologi anatomi
Ikan yang sudah dinekropsi diamati lesio dan abnormalitas lainnya dari jaringan eksterna serta organ interna. Semua lesio dan abnormalitas didokumentasi dengan kamera. Penggaris diposisikan di samping ikan terlebih dahulu agar ukuran ikan dapat diketahui.
Fiksasi
Ikan yang sudah dinekropsi dan didokumentasi kemudian difiksasi menggunakan NBF 10% selama 24 jam. Ikan dapat langsung dimasukkan ke dalam wadah NBF 10% tanpa memisahkan organ-organ karena ukurannya yang relatif kecil atau kurang dari 10 cm.
Pembuatan sediaan histopatologi
Tubuh ikan yang sudah difiksasi kemudian dipotong (grossing) melintang dan dibagi atas lima sampai enam bagian, lalu dimasukkan ke dalam kaset jaringan. Hal ini dimaksudkan agar seluruh bagian ikan mulai dari insang hingga ginjal posterior dapat terlihat dalam pemeriksaan histopatologi (Bacha dan Bacha 2000). Potongan kemudian diproses menjadi sediaan histopatologi dengan pewarnaan Hematoksilin Eosin (HE) (Bancroft dan Stevens 1990), Gram (Rao 2010), Ziehl Neelsen (ZN) (Crookham dan Dapson 1991), dan Masson Trichrome (MT) (Rosen Lab 2005)(Lampiran 1).
Analisis data
4
HASIL DAN PEMBAHASAN
Hasil
Ikan paradise
Sampel yang digunakan pada penelitian adalah ikan paradise. Ikan paradise merupakan ikan tropis yang memiliki ukuran tubuh mencapai lebih kurang 5 cm dengan pola tubuh bergaris-garis yang diisi oleh dua macam warna (Gambar 1) (Aquatic Community 2004). Sirip dorsal dan sirip lateral berwarna gelap dan memudar berjalan seiring ke arah sirip kaudal. Warna tubuh ikan betina lebih pudar daripada warna ikan jantan.
Pengamatan gejala klinis
Sampel ikan paradise yang digunakan dalam penelitian ini diambil dari perusahaan budidaya ikan hias di daerah Ciluar, Bogor. Ikan ini ditempatkan dalam akuarium berukuran 0.8 x 0.4 x 0.4 m dengan kepadatan sekitar 150 ekor ikan paradise (ukuran 5 cm) dalam satu akuarium. Air untuk pemeliharaan ikan ini berasal dari air sumur setempat dengan suhu sekitar 27°C.
Saat pengamatan gejala klinis, ditemukan ikan yang mengalami pembesaran abdomen (ascites). Ikan yang mengalami ascites berenang tidak selincah ikan lainnya, sehingga terlihat lebih lamban dan berenang lebih ke bawah.
Pemeriksaan patologi anatomi
Pemeriksaan patologi anatomi pada semua sampel ikan (3 ekor) menunjukkan adanya lesio berupa ulkus di beberapa tempat, diantaranya kulit daerah abdomen dan sekitar mulut (Gambar 3). Pada daerah ulkus terdapat hemoragi yang ditunjukkan dengan warna merah pada lesio. Insang pada sampel ikan ini berwarna merah dan tampak segar (Gambar 3). Sampel ikan nomor 2 yang mengalami pembesaran abdomen memiliki bentuk punggung yang berbeda, yaitu lordosis (Gambar 2).
Gambar 1. Ikan paradise dengan pola tubuh bergaris-garis yang diisi oleh dua macam
5
Insisi pada tubuh ikan dilakukan untuk pengamatan organ dalam. Dalam pengamatan ini, terlihat lesio yang mencolok, yaitu banyak multifokus area berwarna putih menyerupai titik-titik yang tersebar merata pada organ hati dan jantung (Gambar 3A). Pemeriksaan patologi anatomi pada organ ginjal tidak dilakukan karena ukuran ikan yang kecil sehingga sulit diidentifikasi, oleh karena itu pemeriksaan jaringan secara mikroskopis sangat diperlukan.
Ikan yang mengalami ascites (sampel ikan nomor 2) mengandung suatu masa cairan seperti transudat bening yang langsung tumpah ketika dilakukan pembukaan abdomen (Gambar 3B). Cairan tidak berwarna dan berkonsistensi encer sebanyak 0.5 ml. Hasil pemeriksaan patologi anatomi pada ketiga sampel ikan dirangkum pada Tabel 1.
Gambar 2 (A) Pembesaran abdomen (sampel ikan nomor 2) mengakibatkan bentuk punggung ikan cekung ke atas atau lordosis (a) dan (B) ikan yang tidak mengalami pembesaran abdomen (sampel ikan nomor 3) memiliki bentuk punggung normal (b)
6
Pemeriksaan histopatologi
Pemeriksaan histopatologi pada semua sampel ikan menunjukkan hasil yang konsisten seperti dapat dilihat pada Tabel 2. Pada kulit yang mengandung ulkus (Gambar 4) memiliki keadaan lapisan epidermis sudah terkikis. Selain itu, terdapat granuloma pada subkutis (Gambar 5) dan beberapa bagian otot di bawahnya sudah mengalami myositis dan nekrosis (Gambar 6). Lesio patologi pada organ insang (Gambar 7) menunjukkan adanya infiltrasi sel radang (brankhitis), kongesti, fusi (perlekatan), serta hiperplasia lamela sekunder.
Tabel 1 Rangkuman hasil pemeriksaan Patologi Anatomi (PA)
7
Gambar 5 Granuloma (panah) yang ditemukan pada subkutis (sampel ikan nomor 2), pewarnaan HE
8
Hal yang mencolok dan menjadi perhatian pada pemeriksaan jaringan secara mikroskopis sampel ikan ini adalah ditemukannya radang granuloma pada jaringan subkutis (Gambar 5), serosa usus (Gambar 8), mukosa usus (Gambar 9), hati (Gambar 10), dan ginjal (Gambar 11). Radang granuloma yang hebat ditunjukkan pada organ hati dan ginjal, lebih dari setengah organ mengalami radang granuloma. Pemeriksaan histopatologi pada organ jantung tidak dilakukan karena organ tidak terpotong saat dilakukan pembuatan sediaan histopatologi. Rangkuman hasil pemeriksaan histopatologi dari ke-3 sampel ikan disajikan pada Tabel 2.
Gambar 7 Pada sampel ikan nomor 2, insang mengalami brankhitis yang ditandai oleh adanya infiltrasi sel limfosit (a), disertai dengan adanya hemoragi (b), fusi atau perlekatan (c), dan hiperplasia lamela sekunder (d), pewarnaan HE
Gambar8 Granuloma (panah) ditemukan pada serosa saluran pencernaan ikan (sampel
9
Gambar 9 Granuloma (panah) ditemukan pada mukosa saluran pencernaan ikan (sampel ikan nomor 3), pewarnaan HE
10
Granuloma yang terdapat pada sampel ikan ini tersusun atas sel radang kronis; sel epiteloid, makrofag, dan limfosit (Gambar 12). Berdasarkan pengamatan di bawah mikroskop dengan perbesaran 1000 kali, ditemukan bakteri Gambar 11 Organ ginjal (sampel ikan nomor 3) yang mengalami lesio granuloma
(panah). Lebih dari setengah bagian ginjal mengalami lesi granuloma, pewarnaan HE
Tabel 2 Rangkuman hasil pemeriksaan sediaan histopatologi
Organ Lesio Patologi Ikan
1 2 3
Kulit Dermatitis ulseratif ; Granuloma Usus Granuloma pada serosa ;
Granuloma pada mukosa
11 berbentuk batang di dalam granuloma (Gambar 13) dengan ukuran panjang 2-10 µm dan diameter 0.5-0.7 µm. Untuk mengkarakterisasi sifat pewarnaan bakteri, maka dilakukan pewarnaan Gram dan ZN.
Pewarnaan Gram berguna untuk mengetahui sifat bakteri, yaitu Gram negatif atau positif. Pada pewarnaan Gram, bakteri pada sampel ikan terwarnai menjadi biru (Gambar 13). Hal ini menandakan bahwa bakteri pada sampel ikan bersifat Gram positif. Bakteri Gram positif yang dapat menyebabkan lesio granuloma diantaranya Rhodococcus sp., Renibacterium salmoninarum, Nocardia sp., dan Mycobacterium sp. (Austin dan Austin 2007).
Pewarnaan ZN dilakukan untuk mengetahui genus bakteri tersebut. Pada pewarnaan ZN, bakteri pada sampel ikan dapat mempertahankan warna merah ketika dibilas dengan asam, sehingga dapat dikelompokkan dalam bakteri tahan Gambar 12 Granuloma (sampel ikan nomor 1) tersusun atas sel epiteloid (a), makrofag
(b), limfosit (c), dan masa sel nekrotik (d), pewarnaan HE
12
asam. Dari hasil pengamatan tersebut, dapat dilihat bahwa sampel ikan memiliki ciri khas agen yang mirip dengan Mycobacterium sp, yaitu berbentuk batang, memiliki sifat Gram positif, tahan asam, serta memiliki panjang 1-10 µm dan diameter 0.2-0.6 µm (Tappin 2011). Pewarnaan ZN dilakukan pada beberapa organ, diantaranya pada sediaan insang (Gambar 14), dermis (Gambar 15), usus (Gambar 16), ginjal (Gambar 17), dan hati (Gambar 18) untuk melihat perjalanan bakteri. Pewarnaan ZN pada organ-organ tersebut menunjukkan adanya koloni bakteri dengan bentuk dan sifat ketahanan asam yang sama.
Gambar 14 Pembuluh darah insang (sampel ikan nomer 1) berisi bakteri tahan asam (panah), pewarnaan ZN
13
Gambar 16 Koloni bakteri tahan asam (panah) terdeteksi pada mukosa dan submukosa saluran pencernaan (sampel ikan nomor 3), perwarnaan ZN
Gambar 17 Koloni bakteri tahan asam (panah) terdeteksi dalam granuloma pada ginjal (sampel ikan nomor 1), perwarnaan ZN
14
Granuloma pada sampel ikan ini memiliki bentuk dan diameter yang berbeda-beda. Diameter granuloma terkecil berukuran 44 µm hingga yang terbesar berukuran 1.599 µm. Menurut Scanga dan Flynn (2010), infeksi Mycobacterium sp. menghasilkan 3 macam tipe granuloma berdasarkan respon kekebalan inang, diantaranya adalah tipe kaseosa, tipe non nekrotik, dan fibrotik. Granuloma tipe kaseosa dan fibrotik dibatasi oleh jaringan ikat. Penyebaran jaringan ikat dapat dilihat dengan melakukan pewarnaan MassonTrichrome(MT). Hasil pengamatan menunjukkan terdapat 2 tipe dari 3 tipe granuloma menurut Scanga dan Flynn (2010) pada sampel ikan ini, yaitu tipe kaseosa (sampel ikan nomor 2 dan 3) (Gambar 19) dan tipe non-nekrotik (sampel ikan nomor 1) (Gambar 20).
Gambar 19 (A) Pola susunan granuloma tipe kaseosa (Scanga dan Flynn 2010). (B) Granuloma tersusun atas jaringan ikat (a), makrofag (b), serta lesio nekrosis dan sel debri (c), pewarnaan MT
Gambar 20 (A) Pola susunan granuloma tipe non-nekrotik (Scanga dan Flynn 2010). (B) Granuloma tidak dibatasi oleh jaringan ikat, tersusun atas limfosit (a), koloni bakteri (b) dan makrofag (c), pewarnaan HE
15
Pembahasan
Satu dari tiga ekor sampel ikan mengalami ascites. Di dalam rongga abdomen, terdapat genangan cairan bening seperti transudat. Ascites seperti ini dapat terjadi akibat kerusakan ginjal atau hati. Kerusakan ginjal berpengaruh terhadap osmoregulasi. Osmoregulasi adalah proses fisiologi pada ikan dalam mengatur keseimbangan air dan garam dalam tubuh (Burgess 2011). Organ ginjal harus mempertahankan keseimbangan garam yang ditangkap oleh sel kloride pada insang dan melalui makanan, serta mengeluarkan kelebihan air dan garam melalui urin (Hammerschlag 1999). Kerusakan ginjal menyebabkan osmoregulasi pada tubuh ikan terganggu, sehingga terjadi retensi air yang seharusnya diekskresikan.
Ascites dapat juga disebabkan oleh hipertensi portal pada kasus sirosis hati. Terjadi hambatan aliran darah di sinusoid-sinusoid hati akibat kondisi sirosis atau terbentuknya fibrosis di tepi granuloma sehingga darah yang masuk ke hati melalui vena porta mengalami retensi atau hambatan. Hambatan ini menyebabkan tingginya tekanan darah menuju hati sehingga terjadi kongesti pada vena porta (Cardenas dan Arroyo 2003). Kongesti ini mengakibatkan perubahan permeabilitas pembuluh darah sehingga protein keluar dari pembuluh darah dan terjadilah penimbunan cairan pada rongga abdomen. Selain itu, hati merupakan organ yang mensintesis protein. Kerusakan pada sebagian besar parenkim hati, mengakibatkan produksi protein menjadi rendah sehingga ikan mengalami hipoproteinemia. Hipoproteinemia dapat menurunkan daya ikat protein plasma sehingga plasma darah merembes keluar dari pembuluh darah dan terjadi penimbunan cairan di rongga abdomen (Isselbacher et al. 1999). Kasus ascites pada ikan yang parah dapat menyebabkan sisik ikan menjadi tegang sehingga mirip seperti biji pinus (Meyer 2011). Pada sampel ikan ini tidak terjadi hal demikian, diduga karena ascites pada ikan belum parah (abdomen tidak terlalu besar).
Ascites adalah penimbunan cairan secara abnormal di rongga abdomen. Perut ikan berada pada bagian ventral tubuhnya, sehingga pada kasus ascites, pengaruh gaya gravitasi sangat berarti. Akibat yang ditimbulkan dari ascites adalah kelainan bentuk tulang punggung yang dipengaruhi gaya gravitasi terhadap beratnya penimbunan cairan di peritoneum. Tulang punggung juga ikut tertarik ke bawah, sehingga mengalami lordosis (Cameron et al. 2006).
16
Berdasarkan pengamatan di bawah mikroskop pada fokus granuloma menggunakan perbesaran 1000 kali, ditemukan adanya kumpulan bakteri berbentuk batang dengan panjang 2-10 µm dan diameter 0.5-0.7 µm. Lesio granuloma yang bersifat sistemik seperti pada sampel ikan ini biasanya disebabkan oleh bakteri yang terdistribusi secara sistemik melalui peredaran darah, diantaranya adalah Mycobacterium sp., Nocardia sp., Francisella sp., Rhodococcus sp., Renibacterium salmoninarum, Citrobacter freundii, Photobacterium damselae, Vibrio sp., Seriola liquefaciens, Edwardsiella tarda, dan Flavobacterium sp. (Hawke et al. 2011). Untuk mengidentifikasi jenis bakteri yang menginfeksi, maka dilakukan pewarnaan Gram.
Hasil dari pewarnaan Gram menunjukkan bahwa bakteri bersifat Gram positif. Bakteri batang dengan sifat Gram positif yang menimbulkan radang granuloma sistemik diantaranya ialah Rhodococcus sp., Renibacterium salmoninarum, Nocardia sp., dan Mycobacterium sp. (Austin dan Austin 2007).
Pewarnaan ZN dilakukan untuk mengetahui genus bakteri tersebut. Bakteri pada sampel ikan dapat mempertahankan warna merah ketika dibilas dengan asam, sehingga dapat dikelompokkan dalam bakteri tahan asam. Bakteri Gram positif dan tahan asam yang dapat menimbulkan radang granuloma sistemik diantaranya ialah Nocardia sp. dan Mycobacterium sp. (Scanga dan Flynn 2010). Keduanya memiliki banyak persamaan, namun Nocardia sp. bersifat tahan terhadap asam alkohol 1% sedangkan Mycobacterium sp. bersifat tahan terhadap asam alkohol 3% (Davis dan Ramakrishnan 2008). Hasil pewarnaan ZN menggunakan asam alkohol 3% menunjukkan bahwa bakteri yang menginfeksi sampel ikan merupakan bakteri yang tahan terhadap asam alkohol 3%.
Hasil pengamatan menunjukkan bahwa sampel ikan memiliki ciri khas agen yang mirip dengan Mycobacterium sp., yaitu berbentuk batang, memiliki sifat Gram positif, tahan asam, serta memiliki panjang 1-10 µm dan diameter 0,2-0,6 µm (Tappin 2011). Gejala klinis serta lesio yang dihasilkan juga mirip dengan infeksi Mycobacterium sp., yang telah dilaporkan antara lain terdapat pembesaran abdomen, kelainan bentuk tulang punggung, kematian yang banyak, serta terdapat radang granuloma pada organ internal (Abowei dan Briyai 2011). Berdasarkan pengamatan gejala klinis, lesio patologi anatomi, lesio histopatologi, dan berbagai pewarnaan bakteri, dapat diteguhkan bahwa sampel ikan mengalami infeksi Mycobacterium sp.
Mycobacterium sp. merupakan agen yang paling umum diketahui sebagai penyebab radang granuloma pada ikan. Bakteri ini dapat menyerang spesies ikan yang hidup di air tawar maupun air laut. Bakteri ini masuk ke dalam genus Mycobacterium, ordo Actinomycetales, sub ordo Corynebacterineae, dan famili Mycobacteriaceae (Decostere et al. 2003).