1 1.1. Latar Belakang
Indonesia merupakan negara bahari yang kaya akan keanekaragaman hayati terutama yang dihasilkan dari organisme laut. Banyak manfaat yang diambil dari invertebrata laut seperti spons. Spons merupakan salah satu biota laut yang menghasilkan senyawa bioaktif terbesar diantara invertebrata laut lainnya. Senyawa bioaktif dari spons banyak dieksplorasi sebagai bahan obat antitumor. Pembentukan senyawa bioaktif pada spons sangat ditentukan oleh prekursor enzim, nutrien, serta hasil simbiosis dengan biota yang mengandung bioaktif yaitu kapang, mikroalga (zoohanthella), dan beberapa jenis dinoflagellata yang dapat memacu pembentukan senyawa bioaktif (Sheur, 1978 in Anggraini, 2008).
yang dihasilkan oleh spons berguna bagi dirinya sendiri untuk mencegah dan mempertahankan diri dari serangan predator, media kompetisi, mencegah infeksi bakteri, membantu proses reproduksi, dan mencegah sengatan ultraviolet.
Penelitian yang dilakukan oleh Haefner, 2003 in Rasyid, 2009 spons Petrosia nigricans telah terbukti khasiatnya sebagai sitotoksik dan anti jamur (Soediro, 1999 in Suparno, 2005). Spons ini dipilih karena relatif mudah
beradaptasi terhadap lingkungan dan mudah didapatkan di perairan laut Indonesia termasuk Kepulauan Seribu.
Mengingat kondisi perairan Indonesia yang kian memburuk akibat eksploitasi secara besar – besaran mengakibatkan populasi ikan, karang, maupun spons menurun. Fragmentasi merupakan salah satu usaha untuk menghindari hal tersebut yaitu dengan usaha perbanyakan individu atau koloni dan pengembangan secara aseksual. Dengan ini diharapkan populasi spons dapat bertambah dan dapat diambil manfaatnya. Untuk itu diharapkan hasil penelitian ini dapat memberikan informasi mengenai kandungan antioksidan pada spons untuk pengembangan ilmu di bidang bioteknologi dan penyediaan spons sebagai bahan dasar antioksidan.
1.2. Tujuan
3 2.1. Spons
2.1.1. Morfologi Spons
Spons dapat berbentuk sederhana seperti tabung dengan dinding tipis, atau massif bentuknya dan agak tidak teratur. Banyak spons juga terdiri atas segumpal jaringan yang tak tentu bentuknya, menempel dan membuat kerak pada batu, cangkang, tongggak, atau tumbuh – tumbuhan. Kelompok spons lain mempunyai bentuk lebih teratur dan melekat pada dasar perairan melalui sekumpulan spikula. Bentuk – bentuk yang dimiliki spons dapat beragam. Beberapa jenis bercabang seperti pohon, lainnya berbentuk seperti sarung tinju yaitu, cawan, atau seperti kubah. Ukuran spons Petrosia sp. juga beragam, mulai jenis berukuran sebesar jarum pentul, sampai ke jenis yang ukuran garis tengahnya 0,9 m dan tebalnya 30,5 cm. Jenis – jenis spons tertentu nampak berbulu getar karena spikulanya menyembul keluar dari badannya (Romimohtarto & Juwana 2001).
Gambar 1. Spons Petrosia sp. (www.flickr.com)
2.1.2. Klasifikasi Spons
Menurut Lindgren (1897), klasifikasi spons laut Petrosia nigricans adalah sebagai berikut:
Kingdom : Animalia Filum : Porifera
Kelas : Demospongia Ordo : Haplosclerida
Sub Ordo : Petrosina Famili : Petrosiidae
Genus : Petrosia sp.
plana), kuning kehijauan hingga menjadi cokelat (Petrosia carcicata), dan cokelat tua hingga hitam (Petrosia strongylata). Spons Petrosia ini biasanya terdapat di perairan dangkal hingga perairan sampai kedalamannya 45 meter. Spons ini juga dapat hidup pada habitat berkarang baik karang hidup maupun mati, habitat rubble (pecahan karang), dan habitat berpasir (De Voogd, 2005).
2.1.3. Makanan dan Cara Makan Spons
2.1.4. Reproduksi Spons
Reproduksi spons dapat secara seksual maupun aseksual. Pada reproduksi seksual umumnya spons berkelamin ganda (hermaprodit), tetapi sel telur dan sel sperma diproduksi pada waktu yang berbeda. BERQUIST (1978) in Amir dan Budiyanto (1996) melaporkan, dalam reproduksi spons pejantan akan melepaskan spermanya melalui oskula, kemudian mengalir dan masuk ke dalam saluran masuk (ostia). Kemudian sperma tersebut ditangkap oleh Chaonocyt dan bertemu dengan telur dalam mesohil. Sedangkan pada reproduksi aseksual umumnya dengan fragmentasi. Potongan – potongan dari spons yang patah dapat hidup dengan cadangan makanan yang ada di tubuhnya, kemudian beregenerasi membentuk tunas baru untuk menjadi spons.
2.2. Senyawa Bioaktif Spons
yang masuk ke dalam pori- porinya karena mikroorganisme menyediakan sumber makanan atau produk metabolit tertentu yang bermanfaat untuk spons (Guyot, 2000; Faulkner, 2000 in Munifah et al., 2008).
Proses metabolisme hewan spons dipengaruhi oleh beberapa faktor lingkungan, antara lain suhu, kekeruhan, kekuatan arus, cahaya, salinitas, serta faktor kimiawi lainnya. Sehingga jenis spons yang sama tetapi masing – masing hidup pada kondisi lingkungan yang berbeda, dapat memiliki keaktifan metabolit sekunder yang berbeda pula (Amir dan Budiyanto, 1996).
2.3. Radikal Bebas
Radikal bebas merupakan suatu atom, molekul, atau senyawa yang mengandung satu atau lebih elektron yang tidak berpasangan sehingga sangat reaktif. Tipe radikal bebas turunan oksigen reaktif sangat signifikan dalam tubuh. Oksigen reaktif ini mencakup superoksida (O`2), hidroksil (`OH), peroksil
(ROO`), hidrogen peroksida (H2O2), singlet oksigen (O2), oksida nitrit (NO`), peroksinitrit (ONOO`) dan asam hipoklorit (HOCl). Radikal bebas memiliki reaktivitas yang sangat tinggi. Reaktivitas radikal bebas merupakan upaya untuk mencari pasangan elektron. Dampak dari kerja radikal bebas akan terbentuk radikal bebas baru yang berasal dari atom atau molekul yang elektronnya diambil untuk berpasangan dengan radikal sebelumnya. Bila dua senyawa radikal bertemu, elektron-elektron yang tidak berpasangan dari kedua senyawa tersebut akan
berpasangan (reduktor) kepada senyawa bukan radikal bebas, (2) radikal bebas menerima elektron (oksidator) dari senyawa bukan radikal bebas, (3) radikal bebas bergabung dengan senyawa bukan radikal bebas (Winarsi, 2007).
Radikal bebas diproduksi dalam sel yang secara umum melalui reaksi pemindahan elektron, menggunakan mediator enzimatik atau
non-enzimatik. Produksi radikal bebas dalam sel dapat terjadi secara rutin maupun sebagai reaksi terhadap rangsangan. Secara rutin adalah superoksida yang dihasilkan melalui aktivasi fagosit dan reaksi katalisa 6 seperti ribonukleotida reduktase. Pembentukan melalui rangsangan adalah kebocoran superoksida, hidrogen peroksida dan kelompok oksigen reaktif lainnya pada saat bertemunya bakteri dengan fagosit teraktivasi. Sumber utama radikal bebas pada keadaan normal adalah kebocoran elektron yang terjadi dari rantai transport elektron, misalnya yang ada dalam mitokondria dan retikulum endoplasma serta molekul oksigen yang menghasilkan superoksida. Radikal bebas yang berada dalam tubuh manusia berasal dari dua sumber, endogen dan eksogen. Sumber endogen antara lain autoksidasi, oksidasi enzimatik, dan respiratory burst. Sumber eksogen terdapat pada obat-obatan, radiasi, dan asap rokok (Arief, 2005).
2.4. Antioksidan
Antioksidan merupakan senyawa yang dapat menghambat oksigen reaktif/spesies nitrogen reaktif (ROS/RNS) dan juga radikal bebas sehingga antioksidan dapat mencegah penyakit-penyakit yang berhubungan dengan radikal bebas yaitu karsinogenesis, kardiovaskuler dan penuaan (Halliwell dan
menetralisir radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas dengan melengkapi kekurangan elektrolit yang dimiliki radikal bebas dan menghambat terjadinya reaksi berantai dari pembentukan radikal bebas.
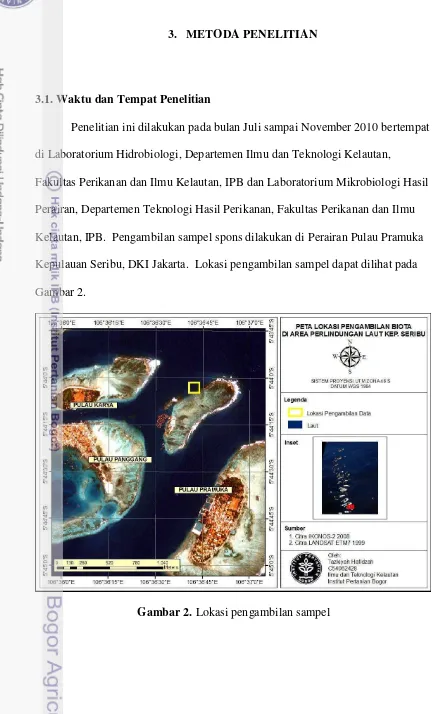
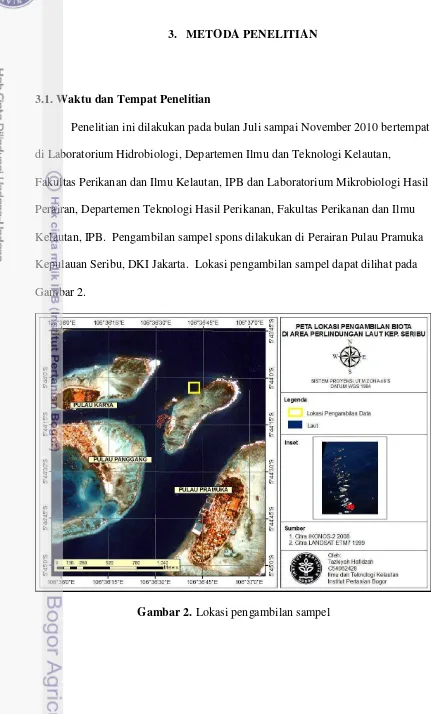
10 3.1. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Juli sampai November 2010 bertempat di Laboratorium Hidrobiologi, Departemen Ilmu dan Teknologi Kelautan,
Fakultas Perikanan dan Ilmu Kelautan, IPB dan Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, IPB. Pengambilan sampel spons dilakukan di Perairan Pulau Pramuka Kepulauan Seribu, DKI Jakarta. Lokasi pengambilan sampel dapat dilihat pada Gambar 2.
Sampel spons Petrosia nigricans yang digunakan dalam penelitian ini merupakan spons Petrosia nigricans yang berada pada kedalaman 7 meter, baik alami maupun tranplantasi yang di ambil pada bulan Juni 2010.
3.2. Alat dan Bahan
Alat yang digunakan untuk mengambil data lapang dan sampel spons adalah peralatan SCUBA, cool box, alat tulis, pisau selam untuk mengambil sampel. Sedangkan alat yang digunakan dalam laboratorium antara lain orbital shaker, spektrofotometer UV – VIS Hitachi U - 2800, kertas saring kasar, kertas whatman, labu erlenmeyer, timbangan digital, freezer, tabung reaksi, gelas ukur, pipet tetes, dan evaporator.
Bahan yang digunakan adalah spons jenis Petrosia nigricans, methanol p.a, etil asetat p.a, heksana p.a, radikal bebas DPPH (1,1 –difenil– 2 –
pikrilhidrazil) dan pereaksi uji fitokimia.
3.3. Metode
3.3.1.Pengambilan Sampel
Spons Petrosia nigricans di ambil pada kedalaman 7 meter di Perairan Pulau Pramuka, Kepulauan Seribu dengan menggunakan SCUBA dan pisau untuk memotong spons dari substrat. Sampel yang diambil dari Pulau Pramuka
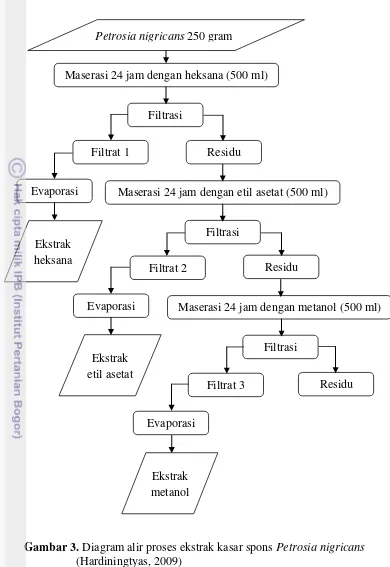
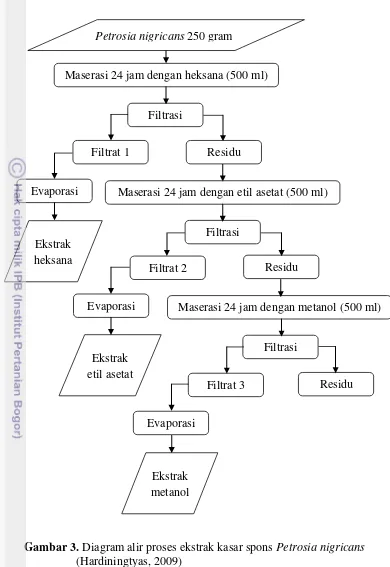
3.3.2.Ekstraksi Kasar
Ekstraksi adalah proses penarikan komponen atau zat aktif suatu simplisia dengan menggunakan pelarut tertentu. Proses ekstraksi bertujuan mndapatkan bagian – bagian tertentu dari bahan yang mengandung komponen – komponen akif. Pelarut organik yang biasa digunakan adalah yang bersifa polar seperti metanol, etanol, dan etil asetat. Struktur kimia beberapa senyawa aktif yang diisolasi dari biota ini mempunyai gugus polar, menyebabkan senyawa-senyawa tersebut larut dalam pelarut polar. Selain itu, senyawanon polar dan polar yag terkandung dalam sampel akan ikut terlarut (Murniasih, 2003).
Gambar 3. Diagram alir proses ekstrak kasar spons Petrosia nigricans (Hardiningtyas, 2009)
Maserasi 24 jam dengan metanol (500 ml) Evaporasi
Residu Filtrasi
Filtrat 3
Evaporasi Evaporasi
Filtrasi
Maserasi 24 jam dengan etil asetat (500 ml)
Residu Filtrat 2
Filtrasi
Maserasi 24 jam dengan heksana (500 ml)
Filtrat 1 Residu
Petrosia nigricans 250 gram
Ekstrak heksana
Ekstrak etil asetat
Sebelum memasuki tahap ekstraksi bertingkat, sampel Petrosia nigricans ini diambil 250 gram dan dipotong kecil-kecil untuk dimaserasi selama 24 jam menggunakan larutan metanol (500 ml) dengan tujuan agar komponen bioaktif pada spons Petrosia nigricans terlarut dalam pelarut. Kemudian hasil maserasi disaring menggunakan kertas saring hingga diperoleh filtrat dan residu. Filtrat hasil maserasi dievaporasi hingga didapatkan pelarut dan ekstrak yang terpisah (ekstrak metanol). Residunya dimaserasi selama 24 jam dengan etil asetat dan setelah itu hasil maserasinya disaring hingga didapatkan filtrat dan residunya. Filtrat yang dihasilkan dievaporasi sehingga didapatkan ekstrak etil asetat, sedangkan residunya dimaserasi dengan heksana selama 24 jam. Hasil maserasi ini disaring dan filtrat yang dihasilkan kemudian dievaporasi sehingga didapatkan ekstrak heksana. Hasil ekstrak yang diperoleh dalam bentuk pasta (cair).
3.3.3. Uji Aktivitas Antioksidan (DPPH)
BHT dengan konsentrasi 5, 10, 25, 50, 100 ppm. Hambatan (dalam persen) dihitung dengan rumus :
Keterangan : I = % Inhibisi
ab = Absorbansi blanko as = Aabsorbansi sampel
Nilai konsentrasi dan hambatan ekstrak diplot masing – masing pada sumbu x dan y. Persamaan garis yang diperoleh dalam bentuk y = b Ln(x) + a digunakan untuk mencari Inhibition Concentration 50% (IC50) dengan
memasukkan angka 50 sebagai y sehingga didapatkan nilai x sebagai IC50. Pengujian dilakukan sebanyak dua kali ulangan.
3.3.4. Uji Fitokimia
Identifikasi senyawa kimia yang berperan sebagai antioksidan dalam spons dilakukan terhadap senyawa – senyawa :
a. Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N
kemudian diuji dengan tiga pereaksi alkaloid, yaitu pereaksi Dragendroff, Meyer dan Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer membentuk endapan putih kekuningan, dengan pereaksi Wagner membentuk endapan cokelat dan dengan pereaksi Dragendroff membentuk endapan merah sampai jingga.
Pereaksi Meyer dibuat dengan cara menambahkan 1,36 HgCl2 dengan 0,5 gram kalium iodida lalu dilarutkan dan diencerkan dengan akuades menjadi 100ml dengan labu takar. Pereaksi tidak berwarna.
Pereaksi Wagner dibuat dengan cara 10 ml akuades dipipet kemudian 2,5 gram iodin dan 2 gram kalium iodida lalu dilarutkan dan diencerkan dengan akuades menjadi 200 ml dalam labu takar. Pereaksi ini berwarna coklat.
Pereaksi Dragendroff dibuat dengan cara 0,8 bimut subnitrat ditambahkan 10 ml asam asetat dan 40 ml air. Larutan ini dicampur dengan larutan yang dibuat dari 8 gram kalium iodida dalam 20 ml air. Sebelum digunakan, 1 volume
campuran ini diencerkan dengan 2,3 volume campuran 20 ml asam asetat glacial dan 100 ml air. Pereaksi berwarna jingga.
b. Steroid / triterpenoid
steroid atau triterpenoid yaitu terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
c. Flavonoid
Sejumlah sampel ditambah serbuk magnesium 0,1 mg dan 0,4 ml amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 ml alkohol, kemudian campuran dikocok. Hasil uji positif sampel
mengandung flavonoid yaitu terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
d. Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N
menunjukkan sampel mengandung saponin. e. Fenol Hidrokuinon (pereaksi FeCl3)
Sebanyak 1 gram sampel spons diekstrak dengan 20 ml etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3 5%. Hasil uji positif sampel mengandung senyawa fenol yaitu terbentuknya larutan berwarna hijau atau hijau biru.
f. Uji Molisch
Sebanyak 1 ml larutan sampel ditambahkan 2 tetes pereaksi molisch dan 1 ml asam sulfat pekat melalui dinding tabung. Hasil uji positif sampel mengandung karbohidrat ditandai oleh terbentuknya kompleks berwarna ungu diantara 2 lapisan cairan.
Larutan sampel sebanyak 8 tetes dimasukkan kedalam 5 ml pereaksi benedict. Campuran dikocok dan didihkan selama 5 menit. Hasil uji positif sampel mengandung gula pereduksi yaitu terbentuknya larutan berwarna hijau, kuning atau endapan merah bata.
h. Uji Biuret
Larutan sebanyak 1 ml ditambahkan pereaksi biuret sebanyak 4 ml. campuran dikocok dengan seksama. Hasil uji positif sampel mengandung senyawa peptida yaitu terbentuknya larutan berwarna ungu.
i. Uji Ninhidrin
19
4. HASIL DAN PEMBAHASAN
4.1. Ekstrak Kasar Petrosia nigricans dan Nilai Rendemen
Proses ekstraksi meliputi penghancuran sampel, maserasi dalam pelarut dengan penggoyangan menggunakan orbital shaker, penyaringan, dan evaporasi. Proses ini dilakukan untuk mendapatkan bagian – bagian tertentu dari bahan yang mengandung komponen – komponen aktif (Harborne, 1984). Metode yang digunakan dalam ekstraksi ini adalah ekstraksi bertingkat menggunakan 3 pelarut yang memiliki tingkat kepolaran yang berbeda, yaitu heksan (non polar), etil asetat (semi polar), dan metanol (polar).
Ekstrak kasar yang dihasilkan spons Petrosia nigricans berupa serbuk berwarna coklat tua pada ekstrak metanol, sedangkan ekstrak etil asetat dan heksan berupa pasta berwarna hitam yang memiliki aroma khas, baik ekstrak kasar dari spons Petrosia nigricans alami maupun transplantasi. Bobot ekstrak kasar dari tiap pelarut dari spons Petrosia nigricans alami maupun hasil transplantasi dapat dilihat pada Tabel 1.
Tabel 1. Bobot ekstrak kasar dan rendemen spons Petrosia nigricans Jenis Sampel Pelarut
Bobot ekstrak kasar dari sampel spons Petrosia nigricans alami maupun hasil transplantasi beragam, berkisar antara 0,41 – 15,01 gram. Bobot terbesar pada masing – masing spons Petrosia nigricans alami dan transplantasi terdapat pada ekstrak metanol yaitu sebesar 7,42 gram pada spons Petrosia nigricans alami dan 15,016 gram pada spons Petrosia nigricans transplantasi. Bobot ekstrak etil asetat alami dan transplantasi juga tidak berbeda jauh, secara berurutan 4,17 gram dan 4,79 gram. Sama halnya dengan ekstrak etil asetat, ekstrak heksan antara spons Petrosia nigricans alami dan transplantasi tidak berbeda jauh, yaitu 0,41 gram pada Petrosia nigricans alami dan 0,53 gram pada spons Petrosia nigricans transplantasi.
Hasil bobot ekstrak yang berbeda menyebabkan nilai rendemen yang berbeda pula untuk setiap larutan. Rendemen ekstrak merupakan perbandingan antara julah ekstrak yang dihasilkan dengan jumlah sampel awal yang diekstrak. Rendemen ekstrak dinyatakan dalam bentuk persen (%). Hasil bobot ekstrak yang dihasilkan bervariasi menyebabkan nilai rendemen yang yang dihasilkan pun berbeda pada tiap larutan. Rendemen ekstrak merupakan perbandingan antara bobot ekstrak yang dihasilkan dengan bobot sampel awal yang diekstrak. Nilai rendemen ekstrak dinyatakan dalam persen. Analisis statistik dengan uji
kelompok menunjukkan Fhit > Ftab, dapat disimpulkan bahwa perbedaan larutan memberikan pengaruh yang nyata terhadap bobot ekstrak maupun rendemen. Perhitungannya dapat dilihat pada Lampiran 1.
Perbedaan tingkat kepolaran jenis pelarut yang digunakan akan
sedangkan nilai rendemen terkecil terdapat pada ekstrak heksan sampel alami yaitu sebesar 0,16%. Nilai rendemen ekstrak metanol yang dihasilkan paling tinggi, sehingga menunjukkan bahwa komponen bioaktif yang terkandung dalam spons Petrosia nigricans bersifat polar karena mampu larut dalam larutan
metanol. Metanol merupakan larutan yang dapat melarutkan hampir semua senyawa organic yang ada pada sampel baik senyawa polar maupun non polar. Namun, semakin besar bobot ekstrak dan rendemennya tidak dapat diasumsikan bahwa bioaktif yang terkandung didalamnya besar pula.
4.2. Kandungan Antioksidan
Peranan antioksidan dalam tubuh sangat penting dalam menetralkan dan menghancurkan radikal bebas yang dapat menyebabkan kerusakan sel dan juga merusak biomolekul, seperti DNA, protein, dan lipoprotein di dalam tubuh yang akhirnya dapat memicu terjadinya penyakit degeneratif,seperti kanker, jantung, artritis, katarak, diabetes dan hati (Soeksmanto et al, 2007). Keberadaan senyawa antioksidan pada suatu bahan dapat diketahui dengan melakukan uji aktivitas antioksidan. Uji aktivitas antioksidan yang digunakan pada sampel spons Petrosia nigricans adalah dengan menggunakan radikal bebas
Gambar 4. Uji Antioksidan dengan DPPH
Metode ini dipilih karena sederhana, mudah, dan menggunakan sampel dalam jumlah yang sedikit dengan waktu yang singkat. Perubahan warna ungu menjadi warna kuning pada larutan menunjukkan adanya aktivitas antioksidan yang terjadi. Pengukuran aktivitas antioksidan dengan metode DPPH
menggunakan prinsip spektrofotometri dengan panjang gelombang 517 nm. Contoh perhitungan konsentrasi uji aktivitas antioksidan dapat dilihat pada Lampiran 2. Hasil pengukuran absorbansi metode DPPH dengan menggunakan spektrofotometer dapat dilihat pada Tabel 2.
Tabel 2. Nilai absorbansi spons Petrosia nigricans Jenis Sampel Pelarut
Nilai absorbansi spons Petrosia nigricans yang ditampilkan Tabel 2 menunjukkan bahwa nilai absorbansi secara keseluruhan memiliki pola yang berbeda beda, hal ini dipengaruhi oleh tingkat penghambatan radikal bebas DPPH oleh ekstrak kasar spons pada tiap konsentrasinya. Dalam perhitungannya
dilakukan uji kuantitatif metode DPPH dengan cara menghitung nilai persen inhibisi dan dilanjutkan dengan perhitungan nilai IC50. Persen inhibisi adalah kemampuan suatu bahan untuk menghambat aktivitas radikal bebas, yang berhubungan dengan konsentrasi suatu bahan. Nilai IC50 diartikan sebagai
konsentrasi substrat yang dapat menyebabkan berkurangnya 50% aktivitas DPPH. Aktivitas antioksidan akan semakin tinggi seiring dengan mengecilnya nilai IC50 (Molyneux, 2004). Proses perhitungan % inhibisi dapat dilihat pada Lampiran 3. Nilai IC50 ulangan pertama dari sampel spons Petrosia nigricans alami dan transplantasi dapat dilihat pada Gambar 5.
Diagram batang diatas dapat dilihat nilai IC50 dari ekstrak sampel spons Petrosia nigricans dalam tiga jenis pelarut. Ekstrak etil asetat pada sampel transplantasi memiliki aktivitas antioksidan yang lebih tinggi dibandingkan dengan dua pelarut lainnya, hal ini ditandai dengan nilai IC50 yang dihasilkan kecil, yaitu sebesar 0,2328 ppm sedangkan esktrak heksan pada sampel alami memiliki nilai IC50 terbesar yaitu sebesar 12.1508 ppm yang mengindikasikan aktivitas antioksidan yang dimilikinya lemah. Ekstrak spons Petrosia nigricans transplantasi memiliki aktivitas antioksidan yang tinggi dibandingkan dengan yang alami.
Menurut Nurhayati et al. (2009), aktivitas antioksidan ekstrak etil asetat dari spons Petrosia sp. mempunyai aktivitas antioksidan yang lebih tinggi atau nilai IC50 yang lebih rendah dibandingkan dengan aktivitas antioksidan yang berasal dari tumbuh- tumbuhan maupun dengan antioksidan dari spons jenis lain.
Rendemen ekstrak etil asetat lebih sedikit dari rendemen ekstrak metanol, namun aktivitas antioksidannya lebih kuat. Hal ini diduga karena pada ekstrak etil asetat terdapat komponen flavonoid yang terdeteksi melalui uji fitokimia.
Flavonoid sangat efektif untuk digunakan sebagai antioksidan (Astawan dan Kasih, 2008).
diduga semakin tidak seimbang lingkungan perairan tempat habitatnya,
banyaknya predator, dan kompetitor maka semakin tinggi senyawa bioaktif yang dihasilkan. Analisis statistik faktorial uji antioksidan menunjukkan bahwa kedua sampel yang digunakan (alami dan transplantasi) tidak memberikan pengaruh yang nyata terhadap aktivitas antioksidan, sedangkan untuk pelarut yang digunakan serta ulangan yang dilakukan memberikan pengaruh yang nyata terhadap aktivitas antioksidan yang dihasilkan. Analisis ini dapat dilihat pada Lampiran 4.
4.3. Kandungan Bioaktif
Untuk mengetahui komponen – komponen bioakif yang terdapat dalam spons Petrosia nigricans dilakukan uji fitokimia. Uji ini dapat mendeteksi komponen bioaktif yang tidak terbatas hanya pada metabolit sekunder saja, tetapi juga termasuk metabolit primer yang memberikan aktivitas biologis fungsional , seperti protein dan peptide (Kannan et al, 2009). Uji Fiokimia yang dilakukan dalam penelitian ini meliputi meliputi uji alkaloid, uji steroid, uji flavonoid, uji saponin, uji fenol hidrokuinon, uji molisch, uji benedict, uji biuret dan uji ninhidrin. Uji ini dilakukan terhadap dua jenis sampel, yaitu alami dan
Tabel 3. Hasil uji fitokimia spons Petrosia nigricans
Uji Fitokimia Jenis Sampel Standar
Alami Transplantasi
Alkaloid
a. Dragendorff +++ ++ Endapan merah atau jingga
b. Meyer ++ ++ Endapan putih kekuningan
c. Wagner + ++ Endapan coklat
Steroid +++ +++ Perubahan dari merah ke biru/hijau Flavonoid + + Lapisan amil alkohol berwarna
merah/kuning/hijau
Saponin + + Terbentuk busa
Fenol
Hidrokuinon ++ ++ Warna hijau atau biru
Molisch + + Warna ungu antara 2 lapisan
Benedict - - Warna hijau/kuning/endapan merah bata
Biuret - - Warna ungu
Ninhidrin - - Warna biru
Keterangan:
+++ sangat kuat, ++ kuat, + lemah, - tidak terdeteksi
Hasil pengujian fitokimia pada Tabel 3 menunjukkan bahwa dari sembilan uji yang dilakukan, terdapat enam yang menghasilkan reaksi positif. Keenam uji tersebut terdapat dalam kedua sampel spons Petrosia nigricans baik alami maupun hasil transplantasi. Keenam uji tersebut antara lain uji alkaloid, steroid, flavonoid, saponin, fenol hidrokuinon, dan molisch. Dari uji ini dapat
disimpulkan bahwa senyawa bioaktif yang terkandung dalam spons Petrosia nigricans alami dan transplantasi relatif sama sekali berbeda pada tingkat kekuatannya. Hasil transplantasi menunjukkan kandungan bioaktif spons terutama pada uji alkaloid lebih stabil sehingga memiliki kekuatan yang lebih besar dibandingkan dengan spons Petrosia nigricans alami.
tirosin yang menurunkan alkaloid jenis isokuinolin dan triptopan yang
menurunkan alkaloid indol. Reaksi utama yang mendasari biosintesis senyawa alkaloid adalah reaksi mannich, dimana menurut reaksi suatu aldehid
berkondensasi dengan suatu amina menghasilkan suatu ikatan karbon-nitrogen dalam bentuk imina tau garam iminium, diikuti oleh serangan suatu atom karbon nukleofilik yang dapat berupa suatu enol atau fenol (Lenny, 2006 in Susanto, 2010). Senyawa kimia dalam spons yang mempunyai aktivitas antioksidan secara kualitatif dan lanjutan yaitu alkaloid (Hanani et al., 2005).
Komponen steroid atau triterpenoid merupakan senyawa yang kerangka karbonnya berasal dari enam satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik, yaitu skualena. Senyawa ini berstruktur siklik yang umumnya berupa alkohol, aldehida, atau asam karboksilat. Senyawa tersebut tidak berwarna, kristalin, memiliki titik lebur yang tinggi, dan umumya sulit untuk dikarakterisasi karena secara kimia tidak reaktif (Harborne, 1984). Selain itu, steroid juga dapat digunakan sebagai antiinflamatori dan untuk konsumsi minum, pembius lokal, insektisida, serta relaksan oto yang digunakan pada operasi bedah (Houghton dan Raman, 1998).
Keberadaan saponin sangat mudah diketahui dengan pembentukan larutan koloidal dengan air yang apabila dikocok menimbulkan buih yang stabil. Saponin dapat berfungsi sebagai antimikroba, antiinflamatori, serta mempunyai toksisitas rendah. Selain itu, saponin juga diketahui mempunyai aktifitas melawan luka nanah dan patogenik pada Candida spp. Pada manusia (Ruiz et al., 2005 in Nurhayati, 2009).
Fenol meliputi berbagai senyawa yang berasal dari tumbuhan dan
mempunyai ciri sama yaitu cincin aromatik yang mengandung satu atau dua gugus hidroksil. Flavonoid merupakan golongan fenol yang terbesar, selain itu juga terdapat fenol monosiklik sederhana, fenilpropanoid, dan kuinon fenolik (Harborne, 1984). Peranan beberapa golongan fenol sudah diketahui, isalnya lignin sebagai bahan pembangun dinding sel, antosianin sebagai pigmen bunga, selain itu dengan mengkonsumsi fenol dipercaya dapat mengurangi resiko beberapa penyakit kronis karena bersifat sebagai antioksidan, anti-inflamasi, detoksifikasi karsinogen, dan antikolesterol (Chen dn Blumberg, 2007 in Andriyanti 2009).
Reaksi positif yang terjadi pada uji molisch menunjukkan adanya
karbohidrat. Karbohidrat berperan dalam penyimpanan energi (pati), transportasi energi (sukrosa), serta membangun dinding sel (selulosa) (Harborne, 1984) dan menurut Winarno (2008) in Susanto (2010) pada tubuh manusia, karbohidrat berguna untuk mencegah ketosis, pemecahan protein tubuh yang berlebihan, kehilangan mineral dan berguna untuk membantu metabolisme lemak dan protein.
yang berpotensi sebagai antimikroba, antifungi, antifouling, inhibitor TP-ase dan inhibitor HIV, selain itu metabolit sekunder yang dihasilkan oleh spons memiliki keragaman yang sangat tinggi. Senyawa – senyawa tersebut antara lain adalah deriva asam amino, dan nukleosida hingga makrolida, porphyrine, terpenoid, hingga ikatan alifaik peroksida, dan sterol (Ismet, 2007). Penelitian yang dilakukan Rasyid (2009) menunjukkan bahwa spons Petrosia nigricans mengandung senyawa bioakif petrocortynes dan petrosiacetylenes yangdapat berfungsi sebagai sitotoksik.
4.4. Pengaruh Transplantasi
Pengujian antioksidan pada penelitian ini menggunakan dua jenis sampel (alami dan transplantasi) spons Petrosia nigricans untuk membandingkan antara perlakuan transplantasi dengan alami terhadap antioksidan yang dihasilkan. Hasil pengujian yang didapatkan dengan metode DPPH yaitu aktivitas antioksidan tertinggi terdapat pada spons Petrosia nigricans hasil transplantasi ekstrak etil asetat baik pada ulangan pertama maupun kedua. Hal ini membuktikan besarnya nilai rendemen tidak membuktikan aktifitas antioksidan yang terjadi besar pula, mengingat ekstrak metanol spons Petrosia nigricans hasil transplantasi memiliki nilai rendemen tertinggi. Perlakuan transplantasi pada spons diduga dapat
meningkatkan aktivitas antioksidan.
Metabolit sekunder yang terbentuk pada spons Petrosia nigricans
dan sengatan sinar ultraviolet. Selain itu, lingkungan perairan yang sebagai habitatnya juga dapat memberikan pengaruh. Pada perairan dangkal, spons berkompetisi dengan alga dan karang untuk mendapat ruang dan cahaya, sehingga spons harus beradaptasi dengan perairan yang lebih dalam (Lesser, 2005 in
Suparno et al., 2009).
Pengujian fitokimia dilakukan pada ekstrak etil asetat spons Petrosia nigricans alami dan transplantasi. Hasil pengujian dari kedua sampel tersebut bereaksi positif terhadap uji alkaloid, steroid, flavonoid, saponin, fenol
hidrokuinon, dan molisch. Kandungan bioaktif seperti komponen karbohidrat, gula pereduksi, peptida, dan asam amino merupakan hasil metabolit primer sedangkan alkaloid, steroid, flavonoid, saponin, dan fenol hidrokuinon termasuk metabolit sekunder. Dapat disimpulkan bahwa spons Petrosia nigricans memiliki kandungan senyawa metabolit sekunder. Hal ini serupa dengan hasil penelitian yang dilakukan Nurhayati et al. (2009) bahwa spons Petrosia nigricans
mengandung senyawa kimia alkaloid, flavonoid, dan karbohidrat. Namun tidak ditemukan adanya kandungan asam amino.
a. Masing-masing senyawa metabolit sekunder dihasilkan oleh beberapa organisme tertentu saja
b. Metabolit sekunder bukan merupakan senyawa yang essensial bagi pertumbuhan dan reproduksi.
c. Pembentukan senyawa metabolit sekunder sangat dipengaruhi oleh kondisi lingkungan organisme.
d. Beberapa senyawa metabolit sekunder yang dihasilkan organisme merupakan kelompok senyawa yang berkerabat (memiliki kesamaan struktur).
e. Beberapa organisme membentuk berbagai substansi yang berbeda sebagai metabolit sekundernya.
f. Regulasi biosintesis metabolit sekunder sangat berbeda dengan metabolit primer.
g. Produksi metabolit sekunder seringkali dapat terjadi secara berlebihan jika terkait dengan produksi metabolit primer.
h. Produk metabolit sekunder dapat berasal dari hasil samping produk
32 5.1. Kesimpulan
Spons Petrosia nigricans memiliki aktivitas antioksidan, baik alami maupun hasil transplantasi. Nilai IC50 terkecil terdapat pada spons Petrosia nigricans hasil transplantasi yaitu sebesar 0, 2328 ppm.
Uji fitokimia terhadap kedua jenis spons pada ekstrak etil asetat menunjukkan bahwa golongan bioaktif dari hasil transplantasi dan alami mengandung; alkaloid, steroid, flavonoid, saponin, fenol hidrokuinon, dan karbohidrat.
5.2. Saran
PERAIRAN PULAU PRAMUKA, KEP. SERIBU
TAZKIYAH HAFIDZAH
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
iii
RINGKASAN
TAZKIYAH HAFIDZAH. Kandungan Senyawa Bioaktif Antioksidan Spons Petrosia nigricans Alami dan Transplantasi di Perairan Pulau Pramuka, Kep. Seribu. Dibimbing oleh DEDI SOEDHARMA dan NURJANAH.
Penelitian ini dilaksanakan pada bulan Juli-November 2010. Pengambilan sampel spons Petrosia nigricans alami dan transplantasi di area Perlindungan Laut Pulau Pramuka, Kepulauan Seribu. Penelitian laboratorium dimulai dari Agustus hingga November 2010 bertempat di Laboratorium Kering, Bagian Hidrobiologi, Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, IPB. Penelitian dilanjutkan di laboratorium Produktivitas
Lingkungan, Departemen Manajemen Sumberdaya Perairan dan Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, IPB. Transplantasi spons Petrosia nigricans dilakukan pada bulan September 2009 pada kedalaman 7 meter. Spons yang didapat diamati rendemen, kandungan senyawa antioksidan dan senyawa bioaktif yang terkandung didalamnya dengan menggunakan tiga pelarut dengan tingkat kepolaran yang berbeda, yaitu metanol (polar), etil asetat (semi polar), dan heksan (non polar).
Bobot ekstrak spons Petrosia nigricans berkisar 0,4069-15,0096 gram sehingga didapatkan nilai rendemen ekstrak yang berkisar 0,1628-6,0038%. Spons Petrosia nigricans hasil transplantasi memiliki aktivitas antioksidan yang lebih tinggi dibandingkan dengan yang alami baik pada ulangan 1 maupun ulangan 2 pada pelarut etil asetat.
PERAIRAN PULAU PRAMUKA, KEP.SERIBU
TAZKIYAH HAFIDZAH
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
ii
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
KANDUNGAN SENYAWA BIOAKTIF ANTIOKSIDAN
SPONS
Petrosia
nigricans
ALAMI DAN TRANSPLANTASI DI
PERAIRAN PULAU PRAMUKA,
KEP. SERIBU
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir skripsi ini.
Bogor, Desember 2010
©
Hak cipta milik IPB, tahun 2011
Hak Cipta Dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
vi
Judul Skripsi : KANDUNGAN SENYAWA BIOAKTIF
ANTIOKSIDAN SPONS Petrosia nigricans ALAMI DAN TRANSPLANTASI DI PERAIRAN PULAU PRAMUKA, KEP. SERIBU
Nama Mahasiswa : Tazkiyah Hafidzah Nomor Pokok : C54062428
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui,
Pembimbing I Pembimbing II
Prof. Dr. Ir. Dedi Soedharma, DEA Dr. Ir. Nurjanah, MS NIP. 19460218 197301 1 001 NIP. 19591013 198601 2 002
Mengetahui, Ketua Departemen
Prof. Dr. Ir. Setyo Budi Susilo, M.Sc NIP. 19580909 198303 1 003
vii
Puji syukur kehadirat Allah SWT atas segala limpahan rahmat, hidayah, serta inayah yang diberikan, sehingga penulis dapat menyelesaikan penelitian yang berjudul “Kandungan Senyawa Aktif Antioksidan dari Spons Petrosia nigricans Alami dan Transplantasi di Pulau Pramuka, Kep.Seribu ”.
Penulis mengucapkan terima kasih kepada :
1. Kedua Orang Tua penulis dan adik yang telah memberikan kasih sayang, semangat, motivasi, doa, dukungan moril, serta materi sehingga penulis dapat menyelesaikan penelitian ini.
2. Prof. Dr. Ir. Dedi Soedharma, DEA dan Dr. Ir. Nurjanah, MSselaku Dosen
Pembimbing yang telah memberikan bimbingan, saran, dan motivasi kepada penulis dengan penuh kesabaran.
3. Beginner Subhan, S.Pi, M.Si selaku penguji, Citra Satrya, S.Pi serta Safrina Dyah Hardiningtyas, S.Pi atas bantuan dan saran yang telah diberikan selama penulis bergabung di Lab. Biologi Laut.
4. Proyek Hibah Pasca Ditjen Dikti yang diketuai oleh Prof. Ir. Dedi Soedharma, DEA yang telah mendanai sebagian besar penelitian ini.
5. Bapak Ir. Suparno, M.si yang telah memberikan kesempatan kepada penulis untuk menjadi bagian kecil dari penelitian beliau sehingga memudahkan penulis dalam menyelesaian penelitian ini.
6. Bu Ema, mba Silvi, dan mba Lastri, atas kerjasamanya yang diberikan selama penulis bergabung di laboratorium Departemen Teknologi Hasil Perairan, FPIK IPB .
viii
S.Kom yang telah memberikan motivasi, bantuan, keceriaan, kekompakan, kebersamaan, dan pengalaman berharga selama perkuliahan.
9. Seluruh warga dan staf Program Studi Ilmu dan Teknologi Kelautan atas dukungan serta kerjasamanya.
Akhir kata, penulis berharap agar tulisan ini dapat memberikan rmanfaat bagi semua pihak yang memerlukan.
Bogor, Januari 2011
ix
x
DAFTAR GAMBAR
Gambar 1. Spons Petrosia nigricans. ... 4 Gambar 2. Lokasi pengambilan sampel ... 10 Gambar 3. Diagram alir proses ekstrak kasar spons Petrosia nigricans
xi
DAFTAR TABEL
1 1.1. Latar Belakang
Indonesia merupakan negara bahari yang kaya akan keanekaragaman hayati terutama yang dihasilkan dari organisme laut. Banyak manfaat yang diambil dari invertebrata laut seperti spons. Spons merupakan salah satu biota laut yang menghasilkan senyawa bioaktif terbesar diantara invertebrata laut lainnya. Senyawa bioaktif dari spons banyak dieksplorasi sebagai bahan obat antitumor. Pembentukan senyawa bioaktif pada spons sangat ditentukan oleh prekursor enzim, nutrien, serta hasil simbiosis dengan biota yang mengandung bioaktif yaitu kapang, mikroalga (zoohanthella), dan beberapa jenis dinoflagellata yang dapat memacu pembentukan senyawa bioaktif (Sheur, 1978 in Anggraini, 2008).
yang dihasilkan oleh spons berguna bagi dirinya sendiri untuk mencegah dan mempertahankan diri dari serangan predator, media kompetisi, mencegah infeksi bakteri, membantu proses reproduksi, dan mencegah sengatan ultraviolet.
Penelitian yang dilakukan oleh Haefner, 2003 in Rasyid, 2009 spons Petrosia nigricans telah terbukti khasiatnya sebagai sitotoksik dan anti jamur (Soediro, 1999 in Suparno, 2005). Spons ini dipilih karena relatif mudah
beradaptasi terhadap lingkungan dan mudah didapatkan di perairan laut Indonesia termasuk Kepulauan Seribu.
Mengingat kondisi perairan Indonesia yang kian memburuk akibat eksploitasi secara besar – besaran mengakibatkan populasi ikan, karang, maupun spons menurun. Fragmentasi merupakan salah satu usaha untuk menghindari hal tersebut yaitu dengan usaha perbanyakan individu atau koloni dan pengembangan secara aseksual. Dengan ini diharapkan populasi spons dapat bertambah dan dapat diambil manfaatnya. Untuk itu diharapkan hasil penelitian ini dapat memberikan informasi mengenai kandungan antioksidan pada spons untuk pengembangan ilmu di bidang bioteknologi dan penyediaan spons sebagai bahan dasar antioksidan.
1.2. Tujuan
3 2.1. Spons
2.1.1. Morfologi Spons
Spons dapat berbentuk sederhana seperti tabung dengan dinding tipis, atau massif bentuknya dan agak tidak teratur. Banyak spons juga terdiri atas segumpal jaringan yang tak tentu bentuknya, menempel dan membuat kerak pada batu, cangkang, tongggak, atau tumbuh – tumbuhan. Kelompok spons lain mempunyai bentuk lebih teratur dan melekat pada dasar perairan melalui sekumpulan spikula. Bentuk – bentuk yang dimiliki spons dapat beragam. Beberapa jenis bercabang seperti pohon, lainnya berbentuk seperti sarung tinju yaitu, cawan, atau seperti kubah. Ukuran spons Petrosia sp. juga beragam, mulai jenis berukuran sebesar jarum pentul, sampai ke jenis yang ukuran garis tengahnya 0,9 m dan tebalnya 30,5 cm. Jenis – jenis spons tertentu nampak berbulu getar karena spikulanya menyembul keluar dari badannya (Romimohtarto & Juwana 2001).
Gambar 1. Spons Petrosia sp. (www.flickr.com)
2.1.2. Klasifikasi Spons
Menurut Lindgren (1897), klasifikasi spons laut Petrosia nigricans adalah sebagai berikut:
Kingdom : Animalia Filum : Porifera
Kelas : Demospongia Ordo : Haplosclerida
Sub Ordo : Petrosina Famili : Petrosiidae
Genus : Petrosia sp.
plana), kuning kehijauan hingga menjadi cokelat (Petrosia carcicata), dan cokelat tua hingga hitam (Petrosia strongylata). Spons Petrosia ini biasanya terdapat di perairan dangkal hingga perairan sampai kedalamannya 45 meter. Spons ini juga dapat hidup pada habitat berkarang baik karang hidup maupun mati, habitat rubble (pecahan karang), dan habitat berpasir (De Voogd, 2005).
2.1.3. Makanan dan Cara Makan Spons
2.1.4. Reproduksi Spons
Reproduksi spons dapat secara seksual maupun aseksual. Pada reproduksi seksual umumnya spons berkelamin ganda (hermaprodit), tetapi sel telur dan sel sperma diproduksi pada waktu yang berbeda. BERQUIST (1978) in Amir dan Budiyanto (1996) melaporkan, dalam reproduksi spons pejantan akan melepaskan spermanya melalui oskula, kemudian mengalir dan masuk ke dalam saluran masuk (ostia). Kemudian sperma tersebut ditangkap oleh Chaonocyt dan bertemu dengan telur dalam mesohil. Sedangkan pada reproduksi aseksual umumnya dengan fragmentasi. Potongan – potongan dari spons yang patah dapat hidup dengan cadangan makanan yang ada di tubuhnya, kemudian beregenerasi membentuk tunas baru untuk menjadi spons.
2.2. Senyawa Bioaktif Spons
yang masuk ke dalam pori- porinya karena mikroorganisme menyediakan sumber makanan atau produk metabolit tertentu yang bermanfaat untuk spons (Guyot, 2000; Faulkner, 2000 in Munifah et al., 2008).
Proses metabolisme hewan spons dipengaruhi oleh beberapa faktor lingkungan, antara lain suhu, kekeruhan, kekuatan arus, cahaya, salinitas, serta faktor kimiawi lainnya. Sehingga jenis spons yang sama tetapi masing – masing hidup pada kondisi lingkungan yang berbeda, dapat memiliki keaktifan metabolit sekunder yang berbeda pula (Amir dan Budiyanto, 1996).
2.3. Radikal Bebas
Radikal bebas merupakan suatu atom, molekul, atau senyawa yang mengandung satu atau lebih elektron yang tidak berpasangan sehingga sangat reaktif. Tipe radikal bebas turunan oksigen reaktif sangat signifikan dalam tubuh. Oksigen reaktif ini mencakup superoksida (O`2), hidroksil (`OH), peroksil
(ROO`), hidrogen peroksida (H2O2), singlet oksigen (O2), oksida nitrit (NO`), peroksinitrit (ONOO`) dan asam hipoklorit (HOCl). Radikal bebas memiliki reaktivitas yang sangat tinggi. Reaktivitas radikal bebas merupakan upaya untuk mencari pasangan elektron. Dampak dari kerja radikal bebas akan terbentuk radikal bebas baru yang berasal dari atom atau molekul yang elektronnya diambil untuk berpasangan dengan radikal sebelumnya. Bila dua senyawa radikal bertemu, elektron-elektron yang tidak berpasangan dari kedua senyawa tersebut akan
berpasangan (reduktor) kepada senyawa bukan radikal bebas, (2) radikal bebas menerima elektron (oksidator) dari senyawa bukan radikal bebas, (3) radikal bebas bergabung dengan senyawa bukan radikal bebas (Winarsi, 2007).
Radikal bebas diproduksi dalam sel yang secara umum melalui reaksi pemindahan elektron, menggunakan mediator enzimatik atau
non-enzimatik. Produksi radikal bebas dalam sel dapat terjadi secara rutin maupun sebagai reaksi terhadap rangsangan. Secara rutin adalah superoksida yang dihasilkan melalui aktivasi fagosit dan reaksi katalisa 6 seperti ribonukleotida reduktase. Pembentukan melalui rangsangan adalah kebocoran superoksida, hidrogen peroksida dan kelompok oksigen reaktif lainnya pada saat bertemunya bakteri dengan fagosit teraktivasi. Sumber utama radikal bebas pada keadaan normal adalah kebocoran elektron yang terjadi dari rantai transport elektron, misalnya yang ada dalam mitokondria dan retikulum endoplasma serta molekul oksigen yang menghasilkan superoksida. Radikal bebas yang berada dalam tubuh manusia berasal dari dua sumber, endogen dan eksogen. Sumber endogen antara lain autoksidasi, oksidasi enzimatik, dan respiratory burst. Sumber eksogen terdapat pada obat-obatan, radiasi, dan asap rokok (Arief, 2005).
2.4. Antioksidan
Antioksidan merupakan senyawa yang dapat menghambat oksigen reaktif/spesies nitrogen reaktif (ROS/RNS) dan juga radikal bebas sehingga antioksidan dapat mencegah penyakit-penyakit yang berhubungan dengan radikal bebas yaitu karsinogenesis, kardiovaskuler dan penuaan (Halliwell dan
menetralisir radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas dengan melengkapi kekurangan elektrolit yang dimiliki radikal bebas dan menghambat terjadinya reaksi berantai dari pembentukan radikal bebas.
10 3.1. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Juli sampai November 2010 bertempat di Laboratorium Hidrobiologi, Departemen Ilmu dan Teknologi Kelautan,
Fakultas Perikanan dan Ilmu Kelautan, IPB dan Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, IPB. Pengambilan sampel spons dilakukan di Perairan Pulau Pramuka Kepulauan Seribu, DKI Jakarta. Lokasi pengambilan sampel dapat dilihat pada Gambar 2.
Sampel spons Petrosia nigricans yang digunakan dalam penelitian ini merupakan spons Petrosia nigricans yang berada pada kedalaman 7 meter, baik alami maupun tranplantasi yang di ambil pada bulan Juni 2010.
3.2. Alat dan Bahan
Alat yang digunakan untuk mengambil data lapang dan sampel spons adalah peralatan SCUBA, cool box, alat tulis, pisau selam untuk mengambil sampel. Sedangkan alat yang digunakan dalam laboratorium antara lain orbital shaker, spektrofotometer UV – VIS Hitachi U - 2800, kertas saring kasar, kertas whatman, labu erlenmeyer, timbangan digital, freezer, tabung reaksi, gelas ukur, pipet tetes, dan evaporator.
Bahan yang digunakan adalah spons jenis Petrosia nigricans, methanol p.a, etil asetat p.a, heksana p.a, radikal bebas DPPH (1,1 –difenil– 2 –
pikrilhidrazil) dan pereaksi uji fitokimia.
3.3. Metode
3.3.1.Pengambilan Sampel
Spons Petrosia nigricans di ambil pada kedalaman 7 meter di Perairan Pulau Pramuka, Kepulauan Seribu dengan menggunakan SCUBA dan pisau untuk memotong spons dari substrat. Sampel yang diambil dari Pulau Pramuka
3.3.2.Ekstraksi Kasar
Ekstraksi adalah proses penarikan komponen atau zat aktif suatu simplisia dengan menggunakan pelarut tertentu. Proses ekstraksi bertujuan mndapatkan bagian – bagian tertentu dari bahan yang mengandung komponen – komponen akif. Pelarut organik yang biasa digunakan adalah yang bersifa polar seperti metanol, etanol, dan etil asetat. Struktur kimia beberapa senyawa aktif yang diisolasi dari biota ini mempunyai gugus polar, menyebabkan senyawa-senyawa tersebut larut dalam pelarut polar. Selain itu, senyawanon polar dan polar yag terkandung dalam sampel akan ikut terlarut (Murniasih, 2003).
Gambar 3. Diagram alir proses ekstrak kasar spons Petrosia nigricans (Hardiningtyas, 2009)
Maserasi 24 jam dengan metanol (500 ml) Evaporasi
Residu Filtrasi
Filtrat 3
Evaporasi Evaporasi
Filtrasi
Maserasi 24 jam dengan etil asetat (500 ml)
Residu Filtrat 2
Filtrasi
Maserasi 24 jam dengan heksana (500 ml)
Filtrat 1 Residu
Petrosia nigricans 250 gram
Ekstrak heksana
Ekstrak etil asetat
Sebelum memasuki tahap ekstraksi bertingkat, sampel Petrosia nigricans ini diambil 250 gram dan dipotong kecil-kecil untuk dimaserasi selama 24 jam menggunakan larutan metanol (500 ml) dengan tujuan agar komponen bioaktif pada spons Petrosia nigricans terlarut dalam pelarut. Kemudian hasil maserasi disaring menggunakan kertas saring hingga diperoleh filtrat dan residu. Filtrat hasil maserasi dievaporasi hingga didapatkan pelarut dan ekstrak yang terpisah (ekstrak metanol). Residunya dimaserasi selama 24 jam dengan etil asetat dan setelah itu hasil maserasinya disaring hingga didapatkan filtrat dan residunya. Filtrat yang dihasilkan dievaporasi sehingga didapatkan ekstrak etil asetat, sedangkan residunya dimaserasi dengan heksana selama 24 jam. Hasil maserasi ini disaring dan filtrat yang dihasilkan kemudian dievaporasi sehingga didapatkan ekstrak heksana. Hasil ekstrak yang diperoleh dalam bentuk pasta (cair).
3.3.3. Uji Aktivitas Antioksidan (DPPH)
BHT dengan konsentrasi 5, 10, 25, 50, 100 ppm. Hambatan (dalam persen) dihitung dengan rumus :
Keterangan : I = % Inhibisi
ab = Absorbansi blanko as = Aabsorbansi sampel
Nilai konsentrasi dan hambatan ekstrak diplot masing – masing pada sumbu x dan y. Persamaan garis yang diperoleh dalam bentuk y = b Ln(x) + a digunakan untuk mencari Inhibition Concentration 50% (IC50) dengan
memasukkan angka 50 sebagai y sehingga didapatkan nilai x sebagai IC50. Pengujian dilakukan sebanyak dua kali ulangan.
3.3.4. Uji Fitokimia
Identifikasi senyawa kimia yang berperan sebagai antioksidan dalam spons dilakukan terhadap senyawa – senyawa :
a. Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N
kemudian diuji dengan tiga pereaksi alkaloid, yaitu pereaksi Dragendroff, Meyer dan Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer membentuk endapan putih kekuningan, dengan pereaksi Wagner membentuk endapan cokelat dan dengan pereaksi Dragendroff membentuk endapan merah sampai jingga.
Pereaksi Meyer dibuat dengan cara menambahkan 1,36 HgCl2 dengan 0,5 gram kalium iodida lalu dilarutkan dan diencerkan dengan akuades menjadi 100ml dengan labu takar. Pereaksi tidak berwarna.
Pereaksi Wagner dibuat dengan cara 10 ml akuades dipipet kemudian 2,5 gram iodin dan 2 gram kalium iodida lalu dilarutkan dan diencerkan dengan akuades menjadi 200 ml dalam labu takar. Pereaksi ini berwarna coklat.
Pereaksi Dragendroff dibuat dengan cara 0,8 bimut subnitrat ditambahkan 10 ml asam asetat dan 40 ml air. Larutan ini dicampur dengan larutan yang dibuat dari 8 gram kalium iodida dalam 20 ml air. Sebelum digunakan, 1 volume
campuran ini diencerkan dengan 2,3 volume campuran 20 ml asam asetat glacial dan 100 ml air. Pereaksi berwarna jingga.
b. Steroid / triterpenoid
steroid atau triterpenoid yaitu terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
c. Flavonoid
Sejumlah sampel ditambah serbuk magnesium 0,1 mg dan 0,4 ml amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 ml alkohol, kemudian campuran dikocok. Hasil uji positif sampel
mengandung flavonoid yaitu terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
d. Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N
menunjukkan sampel mengandung saponin. e. Fenol Hidrokuinon (pereaksi FeCl3)
Sebanyak 1 gram sampel spons diekstrak dengan 20 ml etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3 5%. Hasil uji positif sampel mengandung senyawa fenol yaitu terbentuknya larutan berwarna hijau atau hijau biru.
f. Uji Molisch
Sebanyak 1 ml larutan sampel ditambahkan 2 tetes pereaksi molisch dan 1 ml asam sulfat pekat melalui dinding tabung. Hasil uji positif sampel mengandung karbohidrat ditandai oleh terbentuknya kompleks berwarna ungu diantara 2 lapisan cairan.
Larutan sampel sebanyak 8 tetes dimasukkan kedalam 5 ml pereaksi benedict. Campuran dikocok dan didihkan selama 5 menit. Hasil uji positif sampel mengandung gula pereduksi yaitu terbentuknya larutan berwarna hijau, kuning atau endapan merah bata.
h. Uji Biuret
Larutan sebanyak 1 ml ditambahkan pereaksi biuret sebanyak 4 ml. campuran dikocok dengan seksama. Hasil uji positif sampel mengandung senyawa peptida yaitu terbentuknya larutan berwarna ungu.
i. Uji Ninhidrin
19
4. HASIL DAN PEMBAHASAN
4.1. Ekstrak Kasar Petrosia nigricans dan Nilai Rendemen
Proses ekstraksi meliputi penghancuran sampel, maserasi dalam pelarut dengan penggoyangan menggunakan orbital shaker, penyaringan, dan evaporasi. Proses ini dilakukan untuk mendapatkan bagian – bagian tertentu dari bahan yang mengandung komponen – komponen aktif (Harborne, 1984). Metode yang digunakan dalam ekstraksi ini adalah ekstraksi bertingkat menggunakan 3 pelarut yang memiliki tingkat kepolaran yang berbeda, yaitu heksan (non polar), etil asetat (semi polar), dan metanol (polar).
Ekstrak kasar yang dihasilkan spons Petrosia nigricans berupa serbuk berwarna coklat tua pada ekstrak metanol, sedangkan ekstrak etil asetat dan heksan berupa pasta berwarna hitam yang memiliki aroma khas, baik ekstrak kasar dari spons Petrosia nigricans alami maupun transplantasi. Bobot ekstrak kasar dari tiap pelarut dari spons Petrosia nigricans alami maupun hasil transplantasi dapat dilihat pada Tabel 1.
Tabel 1. Bobot ekstrak kasar dan rendemen spons Petrosia nigricans Jenis Sampel Pelarut
Bobot ekstrak kasar dari sampel spons Petrosia nigricans alami maupun hasil transplantasi beragam, berkisar antara 0,41 – 15,01 gram. Bobot terbesar pada masing – masing spons Petrosia nigricans alami dan transplantasi terdapat pada ekstrak metanol yaitu sebesar 7,42 gram pada spons Petrosia nigricans alami dan 15,016 gram pada spons Petrosia nigricans transplantasi. Bobot ekstrak etil asetat alami dan transplantasi juga tidak berbeda jauh, secara berurutan 4,17 gram dan 4,79 gram. Sama halnya dengan ekstrak etil asetat, ekstrak heksan antara spons Petrosia nigricans alami dan transplantasi tidak berbeda jauh, yaitu 0,41 gram pada Petrosia nigricans alami dan 0,53 gram pada spons Petrosia nigricans transplantasi.
Hasil bobot ekstrak yang berbeda menyebabkan nilai rendemen yang berbeda pula untuk setiap larutan. Rendemen ekstrak merupakan perbandingan antara julah ekstrak yang dihasilkan dengan jumlah sampel awal yang diekstrak. Rendemen ekstrak dinyatakan dalam bentuk persen (%). Hasil bobot ekstrak yang dihasilkan bervariasi menyebabkan nilai rendemen yang yang dihasilkan pun berbeda pada tiap larutan. Rendemen ekstrak merupakan perbandingan antara bobot ekstrak yang dihasilkan dengan bobot sampel awal yang diekstrak. Nilai rendemen ekstrak dinyatakan dalam persen. Analisis statistik dengan uji
kelompok menunjukkan Fhit > Ftab, dapat disimpulkan bahwa perbedaan larutan memberikan pengaruh yang nyata terhadap bobot ekstrak maupun rendemen. Perhitungannya dapat dilihat pada Lampiran 1.
Perbedaan tingkat kepolaran jenis pelarut yang digunakan akan
sedangkan nilai rendemen terkecil terdapat pada ekstrak heksan sampel alami yaitu sebesar 0,16%. Nilai rendemen ekstrak metanol yang dihasilkan paling tinggi, sehingga menunjukkan bahwa komponen bioaktif yang terkandung dalam spons Petrosia nigricans bersifat polar karena mampu larut dalam larutan
metanol. Metanol merupakan larutan yang dapat melarutkan hampir semua senyawa organic yang ada pada sampel baik senyawa polar maupun non polar. Namun, semakin besar bobot ekstrak dan rendemennya tidak dapat diasumsikan bahwa bioaktif yang terkandung didalamnya besar pula.
4.2. Kandungan Antioksidan
Peranan antioksidan dalam tubuh sangat penting dalam menetralkan dan menghancurkan radikal bebas yang dapat menyebabkan kerusakan sel dan juga merusak biomolekul, seperti DNA, protein, dan lipoprotein di dalam tubuh yang akhirnya dapat memicu terjadinya penyakit degeneratif,seperti kanker, jantung, artritis, katarak, diabetes dan hati (Soeksmanto et al, 2007). Keberadaan senyawa antioksidan pada suatu bahan dapat diketahui dengan melakukan uji aktivitas antioksidan. Uji aktivitas antioksidan yang digunakan pada sampel spons Petrosia nigricans adalah dengan menggunakan radikal bebas
Gambar 4. Uji Antioksidan dengan DPPH
Metode ini dipilih karena sederhana, mudah, dan menggunakan sampel dalam jumlah yang sedikit dengan waktu yang singkat. Perubahan warna ungu menjadi warna kuning pada larutan menunjukkan adanya aktivitas antioksidan yang terjadi. Pengukuran aktivitas antioksidan dengan metode DPPH
menggunakan prinsip spektrofotometri dengan panjang gelombang 517 nm. Contoh perhitungan konsentrasi uji aktivitas antioksidan dapat dilihat pada Lampiran 2. Hasil pengukuran absorbansi metode DPPH dengan menggunakan spektrofotometer dapat dilihat pada Tabel 2.
Tabel 2. Nilai absorbansi spons Petrosia nigricans Jenis Sampel Pelarut
Nilai absorbansi spons Petrosia nigricans yang ditampilkan Tabel 2 menunjukkan bahwa nilai absorbansi secara keseluruhan memiliki pola yang berbeda beda, hal ini dipengaruhi oleh tingkat penghambatan radikal bebas DPPH oleh ekstrak kasar spons pada tiap konsentrasinya. Dalam perhitungannya
dilakukan uji kuantitatif metode DPPH dengan cara menghitung nilai persen inhibisi dan dilanjutkan dengan perhitungan nilai IC50. Persen inhibisi adalah kemampuan suatu bahan untuk menghambat aktivitas radikal bebas, yang berhubungan dengan konsentrasi suatu bahan. Nilai IC50 diartikan sebagai
konsentrasi substrat yang dapat menyebabkan berkurangnya 50% aktivitas DPPH. Aktivitas antioksidan akan semakin tinggi seiring dengan mengecilnya nilai IC50 (Molyneux, 2004). Proses perhitungan % inhibisi dapat dilihat pada Lampiran 3. Nilai IC50 ulangan pertama dari sampel spons Petrosia nigricans alami dan transplantasi dapat dilihat pada Gambar 5.
Diagram batang diatas dapat dilihat nilai IC50 dari ekstrak sampel spons Petrosia nigricans dalam tiga jenis pelarut. Ekstrak etil asetat pada sampel transplantasi memiliki aktivitas antioksidan yang lebih tinggi dibandingkan dengan dua pelarut lainnya, hal ini ditandai dengan nilai IC50 yang dihasilkan kecil, yaitu sebesar 0,2328 ppm sedangkan esktrak heksan pada sampel alami memiliki nilai IC50 terbesar yaitu sebesar 12.1508 ppm yang mengindikasikan aktivitas antioksidan yang dimilikinya lemah. Ekstrak spons Petrosia nigricans transplantasi memiliki aktivitas antioksidan yang tinggi dibandingkan dengan yang alami.
Menurut Nurhayati et al. (2009), aktivitas antioksidan ekstrak etil asetat dari spons Petrosia sp. mempunyai aktivitas antioksidan yang lebih tinggi atau nilai IC50 yang lebih rendah dibandingkan dengan aktivitas antioksidan yang berasal dari tumbuh- tumbuhan maupun dengan antioksidan dari spons jenis lain.
Rendemen ekstrak etil asetat lebih sedikit dari rendemen ekstrak metanol, namun aktivitas antioksidannya lebih kuat. Hal ini diduga karena pada ekstrak etil asetat terdapat komponen flavonoid yang terdeteksi melalui uji fitokimia.
Flavonoid sangat efektif untuk digunakan sebagai antioksidan (Astawan dan Kasih, 2008).
diduga semakin tidak seimbang lingkungan perairan tempat habitatnya,
banyaknya predator, dan kompetitor maka semakin tinggi senyawa bioaktif yang dihasilkan. Analisis statistik faktorial uji antioksidan menunjukkan bahwa kedua sampel yang digunakan (alami dan transplantasi) tidak memberikan pengaruh yang nyata terhadap aktivitas antioksidan, sedangkan untuk pelarut yang digunakan serta ulangan yang dilakukan memberikan pengaruh yang nyata terhadap aktivitas antioksidan yang dihasilkan. Analisis ini dapat dilihat pada Lampiran 4.
4.3. Kandungan Bioaktif
Untuk mengetahui komponen – komponen bioakif yang terdapat dalam spons Petrosia nigricans dilakukan uji fitokimia. Uji ini dapat mendeteksi komponen bioaktif yang tidak terbatas hanya pada metabolit sekunder saja, tetapi juga termasuk metabolit primer yang memberikan aktivitas biologis fungsional , seperti protein dan peptide (Kannan et al, 2009). Uji Fiokimia yang dilakukan dalam penelitian ini meliputi meliputi uji alkaloid, uji steroid, uji flavonoid, uji saponin, uji fenol hidrokuinon, uji molisch, uji benedict, uji biuret dan uji ninhidrin. Uji ini dilakukan terhadap dua jenis sampel, yaitu alami dan
Tabel 3. Hasil uji fitokimia spons Petrosia nigricans
Uji Fitokimia Jenis Sampel Standar
Alami Transplantasi
Alkaloid
a. Dragendorff +++ ++ Endapan merah atau jingga
b. Meyer ++ ++ Endapan putih kekuningan
c. Wagner + ++ Endapan coklat
Steroid +++ +++ Perubahan dari merah ke biru/hijau Flavonoid + + Lapisan amil alkohol berwarna
merah/kuning/hijau
Saponin + + Terbentuk busa
Fenol
Hidrokuinon ++ ++ Warna hijau atau biru
Molisch + + Warna ungu antara 2 lapisan
Benedict - - Warna hijau/kuning/endapan merah bata
Biuret - - Warna ungu
Ninhidrin - - Warna biru
Keterangan:
+++ sangat kuat, ++ kuat, + lemah, - tidak terdeteksi
Hasil pengujian fitokimia pada Tabel 3 menunjukkan bahwa dari sembilan uji yang dilakukan, terdapat enam yang menghasilkan reaksi positif. Keenam uji tersebut terdapat dalam kedua sampel spons Petrosia nigricans baik alami maupun hasil transplantasi. Keenam uji tersebut antara lain uji alkaloid, steroid, flavonoid, saponin, fenol hidrokuinon, dan molisch. Dari uji ini dapat
disimpulkan bahwa senyawa bioaktif yang terkandung dalam spons Petrosia nigricans alami dan transplantasi relatif sama sekali berbeda pada tingkat kekuatannya. Hasil transplantasi menunjukkan kandungan bioaktif spons terutama pada uji alkaloid lebih stabil sehingga memiliki kekuatan yang lebih besar dibandingkan dengan spons Petrosia nigricans alami.
tirosin yang menurunkan alkaloid jenis isokuinolin dan triptopan yang
menurunkan alkaloid indol. Reaksi utama yang mendasari biosintesis senyawa alkaloid adalah reaksi mannich, dimana menurut reaksi suatu aldehid
berkondensasi dengan suatu amina menghasilkan suatu ikatan karbon-nitrogen dalam bentuk imina tau garam iminium, diikuti oleh serangan suatu atom karbon nukleofilik yang dapat berupa suatu enol atau fenol (Lenny, 2006 in Susanto, 2010). Senyawa kimia dalam spons yang mempunyai aktivitas antioksidan secara kualitatif dan lanjutan yaitu alkaloid (Hanani et al., 2005).
Komponen steroid atau triterpenoid merupakan senyawa yang kerangka karbonnya berasal dari enam satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik, yaitu skualena. Senyawa ini berstruktur siklik yang umumnya berupa alkohol, aldehida, atau asam karboksilat. Senyawa tersebut tidak berwarna, kristalin, memiliki titik lebur yang tinggi, dan umumya sulit untuk dikarakterisasi karena secara kimia tidak reaktif (Harborne, 1984). Selain itu, steroid juga dapat digunakan sebagai antiinflamatori dan untuk konsumsi minum, pembius lokal, insektisida, serta relaksan oto yang digunakan pada operasi bedah (Houghton dan Raman, 1998).
Keberadaan saponin sangat mudah diketahui dengan pembentukan larutan koloidal dengan air yang apabila dikocok menimbulkan buih yang stabil. Saponin dapat berfungsi sebagai antimikroba, antiinflamatori, serta mempunyai toksisitas rendah. Selain itu, saponin juga diketahui mempunyai aktifitas melawan luka nanah dan patogenik pada Candida spp. Pada manusia (Ruiz et al., 2005 in Nurhayati, 2009).
Fenol meliputi berbagai senyawa yang berasal dari tumbuhan dan
mempunyai ciri sama yaitu cincin aromatik yang mengandung satu atau dua gugus hidroksil. Flavonoid merupakan golongan fenol yang terbesar, selain itu juga terdapat fenol monosiklik sederhana, fenilpropanoid, dan kuinon fenolik (Harborne, 1984). Peranan beberapa golongan fenol sudah diketahui, isalnya lignin sebagai bahan pembangun dinding sel, antosianin sebagai pigmen bunga, selain itu dengan mengkonsumsi fenol dipercaya dapat mengurangi resiko beberapa penyakit kronis karena bersifat sebagai antioksidan, anti-inflamasi, detoksifikasi karsinogen, dan antikolesterol (Chen dn Blumberg, 2007 in Andriyanti 2009).
Reaksi positif yang terjadi pada uji molisch menunjukkan adanya
karbohidrat. Karbohidrat berperan dalam penyimpanan energi (pati), transportasi energi (sukrosa), serta membangun dinding sel (selulosa) (Harborne, 1984) dan menurut Winarno (2008) in Susanto (2010) pada tubuh manusia, karbohidrat berguna untuk mencegah ketosis, pemecahan protein tubuh yang berlebihan, kehilangan mineral dan berguna untuk membantu metabolisme lemak dan protein.
yang berpotensi sebagai antimikroba, antifungi, antifouling, inhibitor TP-ase dan inhibitor HIV, selain itu metabolit sekunder yang dihasilkan oleh spons memiliki keragaman yang sangat tinggi. Senyawa – senyawa tersebut antara lain adalah deriva asam amino, dan nukleosida hingga makrolida, porphyrine, terpenoid, hingga ikatan alifaik peroksida, dan sterol (Ismet, 2007). Penelitian yang dilakukan Rasyid (2009) menunjukkan bahwa spons Petrosia nigricans mengandung senyawa bioakif petrocortynes dan petrosiacetylenes yangdapat berfungsi sebagai sitotoksik.
4.4. Pengaruh Transplantasi
Pengujian antioksidan pada penelitian ini menggunakan dua jenis sampel (alami dan transplantasi) spons Petrosia nigricans untuk membandingkan antara perlakuan transplantasi dengan alami terhadap antioksidan yang dihasilkan. Hasil pengujian yang didapatkan dengan metode DPPH yaitu aktivitas antioksidan tertinggi terdapat pada spons Petrosia nigricans hasil transplantasi ekstrak etil asetat baik pada ulangan pertama maupun kedua. Hal ini membuktikan besarnya nilai rendemen tidak membuktikan aktifitas antioksidan yang terjadi besar pula, mengingat ekstrak metanol spons Petrosia nigricans hasil transplantasi memiliki nilai rendemen tertinggi. Perlakuan transplantasi pada spons diduga dapat
meningkatkan aktivitas antioksidan.
Metabolit sekunder yang terbentuk pada spons Petrosia nigricans
dan sengatan sinar ultraviolet. Selain itu, lingkungan perairan yang sebagai habitatnya juga dapat memberikan pengaruh. Pada perairan dangkal, spons berkompetisi dengan alga dan karang untuk mendapat ruang dan cahaya, sehingga spons harus beradaptasi dengan perairan yang lebih dalam (Lesser, 2005 in
Suparno et al., 2009).
Pengujian fitokimia dilakukan pada ekstrak etil asetat spons Petrosia nigricans alami dan transplantasi. Hasil pengujian dari kedua sampel tersebut bereaksi positif terhadap uji alkaloid, steroid, flavonoid, saponin, fenol
hidrokuinon, dan molisch. Kandungan bioaktif seperti komponen karbohidrat, gula pereduksi, peptida, dan asam amino merupakan hasil metabolit primer sedangkan alkaloid, steroid, flavonoid, saponin, dan fenol hidrokuinon termasuk metabolit sekunder. Dapat disimpulkan bahwa spons Petrosia nigricans memiliki kandungan senyawa metabolit sekunder. Hal ini serupa dengan hasil penelitian yang dilakukan Nurhayati et al. (2009) bahwa spons Petrosia nigricans
mengandung senyawa kimia alkaloid, flavonoid, dan karbohidrat. Namun tidak ditemukan adanya kandungan asam amino.
a. Masing-masing senyawa metabolit sekunder dihasilkan oleh beberapa organisme tertentu saja
b. Metabolit sekunder bukan merupakan senyawa yang essensial bagi pertumbuhan dan reproduksi.
c. Pembentukan senyawa metabolit sekunder sangat dipengaruhi oleh kondisi lingkungan organisme.
d. Beberapa senyawa metabolit sekunder yang dihasilkan organisme merupakan kelompok senyawa yang berkerabat (memiliki kesamaan struktur).
e. Beberapa organisme membentuk berbagai substansi yang berbeda sebagai metabolit sekundernya.
f. Regulasi biosintesis metabolit sekunder sangat berbeda dengan metabolit primer.
g. Produksi metabolit sekunder seringkali dapat terjadi secara berlebihan jika terkait dengan produksi metabolit primer.
h. Produk metabolit sekunder dapat berasal dari hasil samping produk
32 5.1. Kesimpulan
Spons Petrosia nigricans memiliki aktivitas antioksidan, baik alami maupun hasil transplantasi. Nilai IC50 terkecil terdapat pada spons Petrosia nigricans hasil transplantasi yaitu sebesar 0, 2328 ppm.
Uji fitokimia terhadap kedua jenis spons pada ekstrak etil asetat menunjukkan bahwa golongan bioaktif dari hasil transplantasi dan alami mengandung; alkaloid, steroid, flavonoid, saponin, fenol hidrokuinon, dan karbohidrat.
5.2. Saran