BAGAN PERCOBAAN
P0 P0 P0 P0
P1 P1 P1 P1
P2 P2 P2 P2
P3 P3 P3 P3
P4 P4 P4 P4
P5 P5 P5 P5
P6 P6 P6 P6
Lampiran 1. Mortalitas Aphis glycinesBerdasarkan Hari Pengamatan(%)
Lampiran 2. Mortalitas Aphis glycines (%) Berdasarkan Perlakuan
Perlakuan Ulangan Total Rataan
1 2 3 4
Lampiran 3. Analisis Keragaman Mortalitas Aphis glycines
Lampiran 4. Uji Duncan Multiple Range Test (SPSS 21)Mortalitas Aphis
Means for groups in homogeneous subsets are displayed. Based on observed means.
The error term is Mean Square(Error) = ,002. a. Uses Harmonic Mean Sample Size = 4,000. b. Alpha = 0,05.
Lampiran 5. Waktu Kematian Aphis glycines Setelah Aplikasi (hari)
1 2 3 4 5 6 7
Ulangan 1 0,00 0,00 3,00 1,71 1,11 0,60 0,00 6,43 0,92
Ulangan 2 0,00 0,00 3,00 1,33 1,67 0,00 0,00 6,00 0,86
Ulangan 3 0,00 0,00 3,00 1,14 1,11 0,00 0,00 5,25 0,75
Ulangan 4 0,00 0,00 3,00 1,33 1,25 0,00 0,00 5,58 0,80
Ulangan 1 0,00 0,00 0,00 4,00 1,25 0,00 0,00 5,25 0,75
Ulangan 2 0,00 0,00 0,00 4,00 0,00 2,00 1,75 7,75 1,11 Ulangan 3 0,00 0,00 0,00 4,00 1,67 0,00 0,00 5,67 0,81 Ulangan 4 0,00 0,00 0,00 4,00 1,67 1,50 0,00 7,17 1,02
Ulangan 1 0,00 0,00 3,00 1,14 0,00 0,00 0,00 4,14 0,59
Ulangan 2 0,00 0,00 3,00 1,33 0,71 0,75 0,00 5,80 0,83
Ulangan 3 0,00 0,00 3,00 0,80 0,83 0,00 0,00 4,63 0,66
Ulangan 4 0,00 0,00 3,00 1,60 0,83 0,00 0,00 5,43 0,78
P4
Lampiran 6. Waktu Kematian Aphis glycinesBerdasarkan Perlakuan
Perlakuan Ulangan Total Rataan
1 2 3 4
Lampiran 7. Analisis Keragaman Waktu Kematian Aphis glycines
SK db JK KT F Hit. F.05 Ket.
Lampiran 8. Uji Duncan Multiple Range Test (SPSS 21) Waktu KematianAphis glycines
Uji Patogenitas Jamur Entomopatogen Terhadap Aphis glycines
Means for groups in homogeneous subsets are displayed. Based on observed means.
Lampiran 10. Deskripsi Varietas Kedelai Varietas Kedelai : Wilis
SK Mentan : TP240/519/Kpts/7/1983
Nomor induk : B 3034
Asal : Hasil seleksi keturunan
persilangan Orba x No.1682 Hasil rata-rata : 1,6 t/ha
Warna hipokotil : Ungu
Warna batang : Hijau Tipe tumbuh : Determinit Umur berbunga : ± 39 hari Umur matang : 85-90 hari Tinggi tanaman : ± 50 cm
Bentuk biji : oval, agak pipih Bobot 100 biji : ± 10 g
Kandungan protein : 37,0% Kandungan minyak : 18,0%
Kerebahan : Tahan rebah
Ketahanan thd penyakit : Agak tahan karat daun dan virus Benih penjenis : Dipertahankan di Balittan Bogor dan
BalittanMalang
Pemulia : Sumarno, Darman M Arsyad., Rodiah, dan OnoSutrisno
∗ Balittan Bogor, kini berganti menjadi Balai Penelitian Bioteknologi dan Sumberdaya Genetika (Balitbiogen)
Lampiran 11. Foto Penelitian
Lahan Penelitian
Perlakuan Kontrol Aphis glycines terinfeksi
Pergantian instar(a), A. glycines instar 2(b), A. glycines instar 4(c)
Foto mikroskopis Aphisglycines yang terinfeksi Lecanicillium lecanii
Foto mikroskopis Aphisglycines yang terinfeksi Beauveria bassiana
Foto mikroskopis Aphisglycines yang terinfeksi Metarhizium anisopliae
DAFTAR PUSTAKA
Adisarwanto, T. 2010. Strategi Peningkatan Produksi Kedelai Sebagai Upaya Untuk Memenuhi Kebutuhan Di Dalam Negeri Dan Mengurangi Impor.
Jurnal Pengembangan Inovasi Pertanian 3(4): 319-331.
Afifah, L. 2011. Pertumbuhan Cendawan Entomopatogen Lecanicillium lecanii Pada Berbagai Media Serta Infektivitasnya Terhadap Kutu Daun KedelaiAphis glycines Matsumura (Hemiptera: Aphididae). Skripsi. Fakultas Pertanian Institut Pertanian Bogor.
Alavo TBC, Sermann H, &Bochow H. 2002. Biocontrol of aphid using
Verticillium lecanii in greenhouse: Factor reducing the effectiveness of
the entomopathogenic fungus. Arch Phytopathol and Plant Protect 34(6):407- 424.
Apriliana L.S., & Trianik W. 2014. Uji Patogenitas Spora Jamur Metarhizium
anisopliae Terhadap Mortalitas Hama Hypothenemus hampei (Ferrari)
Sebagai Bahan Ajar Biologi SMA Kelas X. Jupemasi-Pbio 1(1): 26-32.
Arifin, M. 2012. Bioinsektisida S/NPV Untuk Mengendalikan Ulat Grayak Mendukung Swasembada Kedelai. Balai Besar Pengkajian dan Pengembangan Teknologi Pertanian, Bogor. Jurnal Pengembangan Inovasi Pertanian 5(1): 19-31
Arsyiogi, B. 2014. Mortalitas Aphis craccivora Koch. Pada Beberapa Konsentrasi
Beauveria bassiana Balsamo. Pada Tanaman Kacang Panjang.
Skripsi. Fakultas Pertanian Universitas Bengkulu.
Baliadi, Y. 2007. Management of Soybean Whitefly: Biology, Economic Importance and Control Methods. Di dalam: Harnowo, D et al. (eds). Peningkatan Produksi Kacang-kacangan dan Umbi-umbian Mendukung Kemandirian Pangan. Puslitbangtan, Bogor. hlm. 474-485. Bernardi, E., Pinto, DM., do Nascimento, JS., Ribeiro, PB., & da Silva CI. 2006.
Effect of The Entomopathogenic Fungi Metarhizium anisopliae and
Beauveria bassianaon TheDevelopment of Musca domestica L.
(Diptera: Muscidae) in The Laboratory. Arq. Inst. Biol. 73(1):127-129.
Blackman RL, &Eastop VF. 2000. Aphids on the World’s Crop: an
Identificationand Information Guide. 2nd edition. Chichester (GB):
Wiley.
Cloyd, R. 2003. The entomopathogen Verticillium lecanii. Midwest Biological Control News. University of Illinois. http://www.extension.umm. Edu/distribution/horticulture/DG7373.html [27 April 2015].
Evi, SY. 2006. Beauveria bassiana Pengendali Hama Tanaman. Warta Penelitian
dan Pengembangan Pertanian Vol. 28 No. 1. Pacet-Cianjur.
Gallegos, RP., Cesar A., Roger W., Anibal M., &German A. 2003. Control of the Larvae of the Beetle Phyllophaga sp. with Biological Products (Metarhiziumanisopliae and Beauveria sp.) in the Blackberry Crop
Rubus glaucus Benth. Ohio State University.
Hardiyanti, DW. 2006. Kajian Penyebaran Miselium Jamur Beauveria bassiana dan Kerusakan Terhadap Epitel Saluran Pencernaan Makanan Larva
Plutellaxylostella (Lepidoptera: Plutellidae).Undergraduate Theses dari JBPTITBBI,Sekolah Ilmu dan Teknologi Hayati, Institut Teknologi Bandung.
Haryono, H., S. Nuraiani & Riyatno. 1993. Prospek Penggunaan
Beauveria bassiana untuk Pengendalian Hama Tanaman Perkebunan.
Symposium Patologi Serangga. Yogyakarta 12-13 oktober 1993.
Herlinda, S., Hamadiyah, Triani A.,& Rosdah T. 2006. Toksisitas Isolat-isolat
Beauveria bassiana (Bals.) Vuill. Terhadap Nimfa Erydema pulchrum (Wetw.) (Hemiptera: Pentatomidae). Agria 2(2):34-37.
Jauharlina & Hendrival. 2003. Toksisitas (LC50 dan LT50) Jamur Entomopatogen B. bassiana (Bals.) Vuill. Terhadap Ulat Grayak
Spodoptera litura F. Jurnal Agrista. 7(3): 295-301.
Kauvelis, VN., Zare, R., Bridge, PD., &Typas, MA. 1999. Differentation of mitochondrial subgroups in the Verticillium lecanii species complex. Letter in Appl Microbial 28:263-268.
Karmila, Y. 2006. Patogenisitas Beauveria bassiana (Bals.) Vuill. Pada Kumbang Penggerek Ubi Jalar Cylas formicarius Fabr. Skripsi. Program Studi Ilmu Hama Penyakit Tumbuhan. Fakultas Pertanian. Universitas Bengkulu. Krutmuang, P., &Supamit, M. 2005. Pathogenicity of Entomopathogenic Fungi
Metarhizium anisopliae Against Termites. In: Conference on
International
Macedo, T.B., Bastos, C.S., Higley, L.G., Ostlie, K.R. & Madhavan, S. 2003. Photosynthetic Response To Soybean Aphid (Homoptera: Aphididae) injury. J. Econ. Entomol. 96: 188–193.
McCornack, B.P., Costamagna, A.C. & Ragsdale, D.W. 2008. Within-plant Distribution of Soybean Aphid (Hemiptera: Aphididae) And Development of Node-Based Sample Units For Estimating Whole-Plant Densities In Soybean. J. Econ. Entomol. 101: 1488–500.
Mahr, SER., Cloyd, RA., Mahr, DL., &Sadof, CS. 2001. Biology Control of Insects And The Other Pest of The Greenhouse Crop.North Central
Regional Publication 581. Univesity of Wisconsin Exstention,
Cooperative Extention.
Marwoto. 2007. Dukungan Pengendalian Hama Terpadu Dalam Program Bangkit Kedelai. Iptek Tanaman Pangan 2(1) : 79-92.
Meyling, NV. 2007. Methods for Isolation of Entomopathogenic Fungi From The
Soil Environment. Laboratory manual. Department of Ecology, Faculty of Life Sciences, University of Copenhagen, Thorvaldsensvej 40, DK-1871 Frederiksberg C, Denmark.
Mulyono. 2008. Kajian Patogenisitas Cendawan Metarhiziujm anisopliae Terhadap Hama Oryctes rhinoceros L. Tanaman Kelapa Pada Berbagai Teknik Aplikasi. Surakarta: Universitas Sebelas
O`Neal, M., & Hodgson, E. 2000. Soybean Aphid management field guide. Iowa State University: University Extention.
Pracaya. 2009. Hama dan Penyakit Tanaman (Edisi Revisi seri Agriwawasan). Penebar Swadaya. Jakarta.
Prayogo, Y. 2004. Keefektifan lima jenis cendawan entomopatogen terhadap hama pengisap polong kedelai Riptortus linearis (L.) (Hemiptera: Alydidae) dan dampaknya terhadap predator
Oxyopes javanus Thorell (Araneida: Oxyopidae). [Tesis]. Sekolah
Pascasarjana. Institut Pertanian Bogor. 51hlm.
__________.2006. Upaya Mempertahankan Keefektifan Cendawan Entomopatogen untuk Mengendalikan Hama Tanaman Pangan.
J.Litbang Pertanian, 25(2):47-54.
Robert, D. W. 1981. Toxins of Entomopathogenic Fungi. In H.D. Burges (ed.).
Microbial Control of Pest and Plant Disease.1970-1980. First ed.
London: Academic Press.
Rohajati, A. 1976. Biologi Aphis craccivora dan Aphis glycines Matsamura (Homoptera: Aphididae) pada Tiga Varietas Kedelai. Laporan masalah khusus, Jurusan Hama dan Penyakit Tumbuhan Fakultas Pertanian-IPB. 73 hlm.
Scholte EJ, Knols BGJ, Samson RA, Takken W. 2004. Entomopathogenic fungi for mosquito control: A Review. J Sci 4(19): 1-24.
Schroer, S, D. Sulistyanto & R.U. Ehrers. 2005. Control of Plutella xylostella using polymer formulated Steinernema carpocapsae and Bacillus
thuringiensis in cabbage fields. Journal Entonomol. 129 : 198-204. Soetopo & Indrayani. 2007. Status Teknologi dan Prospek Beauveria bassiana
untuk Pengujian Serangga Hama Tanaman Perkebunan yang Ramah Lingkungan. Perspektif, 6(1): 29-46.
Sri R.U., Isnawati, &R. Ambarwati. 2014. Eksplorasi dan Karakterisasi Cendawan Entomopatogen Beauveria bassianadari Kabupaten Malang dan Magetan.Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Surabaya. Jurnal LenteraBio 3(1): 59–66
Sudarmadji, D. 1996. Pemanfaatan Jamur Beauveria bassiana Untuk Pengendalian Helopeltis antonii. Warta Pusat Penelitian Bioteknologi Perkebunan, II (1). Hlm 36–42.
Sun, Z., P.Z. Tian, & J. Wang. 1990. Study on the uses of aphid-resistant character in wild soybean. I. Aphid resistance performance of F2 generation from crosses between-cultivated and wild soybean. Soybean
Genet. Newsl. 17:43-48.
Sumartini, Y. Prayogo, S.W. Indiati, & S. Hardaningsih. 2001. Pemanfaatan Jamur Metarhizium anisopliae Untuk Pengendalian Pengisap Polong (Riptortus linearis) Pada Kedelai. hlm. 154−157. Dalam S.E.Baehaki,
E. Santosa, Hendarsih, S.T. Suryana, N. Widarta, dan Sukrino (Ed.). Simposium Pengendalian Hayati Serangga, Balai Penelitian Tanaman Padi Sukamandi.
Tanada, Y.&H.K. Kaya. 1993. Insect Pathology. Academic Press, Inc., California. 666 pp.
Thungrabeab, M., Peter, B., &Cetin, S. 2006. Possibilities for biocontrol of the onion thrips Thrips tabaci Lindeman (Thys.,Thripidae) using different entomopathogenic fungi from Thailand. J. Mitt. Dtsch. Ges.
Allg. Angew. Ent. 15:299-304.
Tilmon, K.J., Hodgson, E.W., O’Neal, M.E., & Ragsdale, D.W. 2011. Biology of the soybean aphid, Aphis glycines (Hemiptera: Aphididae) in the United States. J. Integ. PestMngmt. 2(2): 2–7.
Trizelia. 2005. Cendawan Entomopatogen Beauveria bassiana (Bals) Vuill. (Deuteromycotina:Hyphomycetes): Keragaman Genetik, Karakteristik Fisiologi, dan Virulensinya Terhadap Croccidolomia pavonana (F.) (Lepidoptera: Pyralidae) Disertasi. Bogor: Institut Pertanian Bogor, Fakultas Pertanian, Program studi Hama dan Penyakit Tumbuhan.
Trizelia, T. Santoso, Sosromarsono, A. Rauf & L.I. Sudirman. 2005. Persistence of Beauveria bassiana (Bals.) Vuill. Conidia (Deuteromycotina: Hypotemycetes) on cabbage plant and in the soil . paper presented at the 1st International Conference of Crop Security for Food Safety. Malang, 20-22 September 2005.
Tsakadze, T., Abashidze, E., Samadashvili, D., &Odikadze, K. 2003. Fungi of
Genus Metarhizium as Pathogens Attacking Locust. L. Kanchaveli
Georgian Plant Protection Institute.
Tyrrell D, &MacLeod DM. 1975. In vitro Germination of Entomophthora Aphidis Resting Spores. Can J Bot (53):1.188−1.191.
Wang, X.B., Fang, Y.H., Lin, S.Z., Zhang, L.R., & Wang, H.D. 1994. A Study on The Damage And Economic Threshold 0f The Soybean Aphid At The Seedling Stage. PlantProt 20:12–13.
Widiyanti, N.L.P.M., & S. Muyadihardja. 2004. Uji Toksisitas Jamur
Metarhizium anisopliae terhadap Larva nyamuk Aedes aegypti.Media Litbang Kesehatan 14 (3): 25-30.
Wiludjeng, & Widawati. 2007. Penggunaan Nematoda Entomopatogen
Steinernema carpocapsae (All strain) dan Tanaman Sela Bawang Merah
Dalam Pengendalian Hama Pada Tanaman Kubis. J. Pertanian Mapeta 10(1):60-65.
Winarto, L., & Darmawati, N. 2004. Teknologi Pengendalian Hama Plutella
xylostella dengan Insektisida dan Agensia Hayati Pada Kubis di
METODOLOGI PENELITIAN Tempat dan Waktu Penelitian
Peneltian ini dilaksanakan di Lahan Percobaan Fakultas Pertanian Universitas Sumatera Utara, dengan ketinggian tempat ± 25 meter di atas permukaan laut, pada bulan Desember 2015sampai dengan Februari 2016.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini antara lain, tanaman kedelai sehat,kutu daun A. glycines,L.lecanii, M. anisopliae, dan B. bassiana, PDA (Potato Dextrose Agar), cling wrap, kapas, alumunium foil, kertas stensil, air steril, aquades, alkohol 96%, kloroks, polibagukuran 15x20cm, kertas label.
Alat yang digunakan pada penelitian ini antara lain, sungkup, cawan petri diameter 9 cm, erlemeyer, gelas ukur, tabung reaksi, hot plate, jarum inokulum,
micropipet, microscope compound, kaca pembesar, autoclave, timbangan analitik,
laminar air flow, haemocytometer, lemari pendingin dan alat tulis.
Metode Penelitian
Penelitian ini menggunakan metode Rancangan Acak Kelompok (RAK) yang terdiri dari 12 perlakuan dan tiga ulangan. Adapun perlakuannya adalah:
P0 : (Kontrol) kutu instar 4 tanpa perlakuan Entomopathogen P1 : Kutu instar 2 + Lecanicillium lecanii 107
Jumlah ulangan diperoleh dengan rumus: (t-1) (r-1) ≥ 15
(6) (r-1) ≥ 15 6r – 6 ≥ 15
6r ≥ 21
r ≥ 21/6
r ≥ 3,5
Ulangan yang digunakan adalah sebanyak 4 ulangan, yaitu: Total unit percobaan : 7 x 4 = 28 unit percobaan
Pelaksanaan Penelitian
Pemeliharaan Serangga Aphis glycines
Aphis glycines dikembangbiakkan pada tanaman kedelai dilaboratorium.
Perkembangbiakkan serangga dilakukan terus menerus dan diupayakan serangga dapat tumbuh dan berkembang secara optimal dengan tujuan dapat memperoleh populasi A.glycines dalam jumlah yang banyak dan umur yang seragam.
Pemeliharaan Tanaman Kedelai di Lahan Percobaan
Kedelai varietas Wilis ditanam di dalam polybagberukuran 15x20cm yang berisi top soil, tiap polybag diisi dua biji.
Perbanyakan dan Persiapan Formulasi Cendawan Entomopatogen (Lecanicilliumlecanii, Metharizium anisopliae, dan Beauveria bassiana)
Cendawan entomopatogen Metarhizium anisopliae dan B. bassiana diperoleh dari isolat yang sudah tersedia di Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara, sedangkan isolatLecanicillium
Universitas Brawijaya Malang. Cendawan entomopatogen dikulturkan pada media tumbuh potato dextrose agar (PDA) di dalam cawan petri. Pada umur 21 hari setelah inokulasi (HSI), setiap biakan cendawan yang ada di dalam cawan petri ditambahkan air 10 ml kemudian konidia yang terbentuk diambil menggunakan kuas halus dan dikerok pada bagian permukaan koloni bagian atas. Suspensi konidia cendawan yang diperoleh dihitung menggunakan haemocytometer hingga memperoleh kerapatan konidia sesuai dengan perlakuan yang sudah ditentukan. Aplikasi Cendawan Entomopatogen dan Investasi Aphis glycines
Kedelai yang berumur 21 hari setelah tanam (HST), diinfestasi dengan A.
glycines sebanyak 10 ekor tiap tanamansesuai perlakuan dan diberi sungkup.
Setiap tanaman kemudian disemprot suspensi konidia cendawan entomopatogen dengan kerapatan 107konidia/ml. Suspensi konidia cendawan diaplikasikan dengan dosis5 ml/tanaman.
PeubahAmatan Mortalitas A. glycines
Persentase mortalitas A. glycinesdihitung dengan menggunakan rumus sebagai berikut :
P = �
� � 100%
Keterangan : P = Mortalitas (%)
Waktu Kematian A. glycinesSetelah PerlakuanEntomopatogen
Waktu kematian adalah waktu yang dibutuhkan oleh entomopatogenuntuk mematikan serangga A. glycines. Waktu kematian diamati setiap hari sampai 7 hari setelah aplikasi (HSA) dihitung dengan menggunakan rumus :
W= ∑(��ℎ������ ���� ���� ℎ������ ×ℎ�������� ℎ������ ������ ℎ��������) ∑ ��ℎ������ ����
Keterangan :
W = waktu kematian Aphis (Karmila, 2006)
Gejala A. glycinesyang Terinfeksi Cendawan Entomopatogen
Pengamatan dilakukan setiap hari pada sore hari sampai nimfaA. glycines mati terinfeksi cendawan entompatogen.
Analisis Data
HASIL DAN PEMBAHASAN Persentase Mortalitas Aphis glycines
Hasil uji patogenisitas beberapa cendawan entomopatogenL. Lecanii, B.
Bassiana, dan M. anisopliae terhadap A. glycinesdengan perlakuan beberapa jenis
cendawan dan instar serangga uji menunjukkan bahwa,hanya beberapa perlakuan yang dapat mematikanA. glycines(Tabel 1). Dan berdasarkan analisis statistik, mortalitas A.glycinespada beberapa perlakuan berbeda nyata pada taraf 5% (Lampiran 3).
Tabel 1. Rerata mortalitas A. glycines pada beberapa perlakuan stadia dan Cendawan Entomopatogen
Perlakuan Mortalitas (%)
P0 (kontrol) 0d
P1 (A. glycines instar 2 + L. lecanii) 0d P2 (A. glycines instar 2 + B. bassiana) 0d P3 (A. glycines instar 2 + M. Anisopliae) 0d P4 (A. glycines instar 4 + L. lecanii) 90,0a P5 (A. glycines instar 4 + B. bassiana) 37,5c P6 (A. glycines instar 4 + M. Anisopliae) 67,5b
Keterangan: angka yang diikuti oleh huruf kecil yang sama berbeda tidak nyata pada uji jarak duncan taraf 5%.
Pada tabel 1 terlihat perlakuan tertinggi dalam mematikan A. glycine secara berurut yaitu P4(Kutu instar 4 + L. lecanii) 90,0%, P6(Kutu instar 4 + M.
anisopliae) 67,5%, dan P5(Kutu instar 4 + B. bassiana)37,5%. Sedangkan pada
Tabel menunjukkan perlakuan P4(Kutu instar 4 + L. lecanii), P5(Kutu instar 4 + B.bassiana), dan P6(Kutu instar 4 + M. anisopliae) berbeda dalam mematikan A. glycines, dan berbeda nyata dengan perlakuan P3(Kutu instar 2 +
M. anisopliae), P2(Kutu instar 2 + B. bassiana), P1(Kutu instar 2 + L. lecanii)
maupun kontrol.
Pada perlakuanP4 (Kutu instar 4 + L. lecanii) dan P6 (Kutu instar 4 + M.
anisopliae)terlihat bahwa cendawan L. Lecanii danM. anisopliae mampu dan
efektif dalam mematikan A. glycines, sedangkan cendawan B. bassiana mampu dalam mematikanA. glycines namun masih belum efektif karena tingkat mortalitasnya masih rendah. Sama halnya dengan penelitian Arsyiogi (2014), bahwa secara keseluruhan perlakuan konsentrasi jumlah konidia/ml B. bassiana yang diaplikasikan pada A. craccivora mampu mematikan serangga uji akan tetapi tidak efektif untuk mematikan A. craccivora secara keseluruhan karena tingkat mortalitasnya di bawah 50%.
Rendahnya tingkat kematian A. glycines salah satunya terjadi karena cendawan entomopatogenmemiliki sifat yang spesifik dalam menginfeksi serangga. Cendawan ini akan efektif jika diisolasi dari isolat yang sama. Pada penelitian ini isolat yang digunakan diperoleh dari laboratorium. Menurut Trizelia
et al.(2005), patogenisitas konidia cendawan entomopatogen yang baik adalah
isolat berasal dari inang yang sama dengan serangga uji yang berasal dari ekosistem yang sama.
Wiludjeng & Widawati (2007), perbedaan tinggi rendahnya mortalitas serangga yang terinfeksi dipengaruhi oleh patogenisitas entomopatogen, juga umur dan kerentanan serangga uji itu sendiri.
Berdasarkan uji yang dilakukan A. glycinesdinilai tahan terhadap infeksi cendawan entomopatogen pada instar tertenetu, terlihat pada perlakuan P1,P2, dan P3 dengan nilai mortalitas 0%, hal ini disebabkan karena proses pergantian kulit dari A. glycines lebih cepat dibandingkan dengan waktu yang di butuhkan jamur untuk melakukan penetrasi. Menurut Alavo et al. (2002) meskipun stadia inang rentan terhadap infeksi cendawan entomopatogen, akan tetapi jika serangga inang tersebut mengalami ganti kulit maka infektifitas cendawan jadi sangat rendah, hal ini disebabkan konidia akan terlepas bersama kutikula sebelum menginfeksi inang.
Secara keseluruhan perlakuan di lapangan menunjukkan nilai mortalitaslebih rendah dibandingkan dengan perlakuan cendawan entomopatogen
L. Lecanii (Afifah, 2011), B. bassiana (Arsyiogi, 2014) dan M.
Anisopliae(Apriliana & Trianik, 2014) yang diuji di laboratorium, hal ini
dikarenakan faktor lingkungan di laboratorium lebih stabil dan homogen dalam mendukung perkembangan jamur entomopatogen. Schroer et al. (2005), mengemukakan bahwa keberhasilan aplikasi cendawan entomopatogenpada serangga di batasi oleh pengaruh lingkungan seperti suhu, kekeringan dan sinar ultra violet.
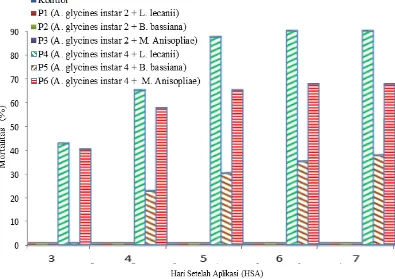
Gambar 1. Histogram perkembangan mortalitas A. glycines
Gambar1 terlihat bahwa perlakuan P4 (Kutu instar 4 + L.
lecanii)menunjukkan persentase kematian A. glycines90,0% tertinggi dibanding
perlakuan lain. Kemudian diikuti perlakuan P6 (Kutu instar 4 + M. anisopliae) 67,5%, P5 (Kutu instar 4 + B. bassiana) 37,5%, lalu perlakuan lainnya P3, P2, P1, dan kontrol memiliki nilai mortalitas 0%. Mortalitas serangga ujimulai terlihat pada hari ke 3 sampai ke 7. Menurut MacLeod (1963) dalam Tanada & Kaya (1993), periode proses awal infeksi sampai kematian serangga terjadi dalam kurun waktu yang singkat yaitu hanya 3 hari dan selambat-lambatnya 12 hari, namun pada umumnya terjadi dalam waktu 5-8 hari dan periode tersebut dapat berbeda tergantung pada ukuran inang.
Hasil menunjukkan perlakuan yang diuji memberikan pengaruh yang nyata (Lampiran 7) terhadap waktu kematian A. glycines.
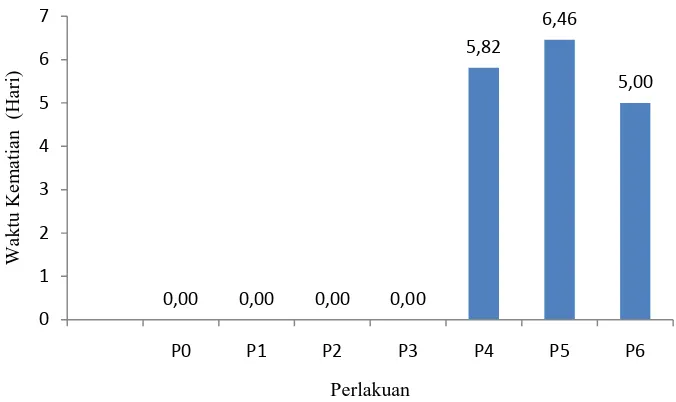
Gambar 2. Histogram waktu kematian A. glycines
Gambar 2 menunjukkan bahwa waktu kematian Aphis yang paling lambat mati terjadi pada perlakuan P5 yaitu 6,46 HSA, diikuti perlakuan P4 yaitu 5,82 HSA, dan P6 yaitu 5,00 HSA, selanjutnya perlakuan P3, P2, P1, dan kontrol masing-masing 0 HSA karena tidak ada serangga uji yang mati (Lampiran 6). Antara perlakuan tertinggi maupun terendah berbeda nyata terhadap waktu kematian setelah dianalisis dengan analisis varian.
Pengaruh nyata dari beberapa perlakuan yang diuji terhadap mortalitas A.
glycinesdisebabkan oleh jamur entomopatogenmembutuhkan waktu untuk bisa
menginfeksi dan mematikan A. glycines. Menurut MacLeod (1963) dalam Tanada & Kaya (1993), periode proses awal infeksi sampai kematian serangga terjadi dalam kurun waktu yang singkat yaitu hanya 3 hari dan selambat-lambatnya 12 hari, namun pada umumnya terjadi dalam waktu 5-8 hari dan periode tersebut dapat berbeda tergantung pada ukuran inang.
Menurut Scholte et al. (2004), proses serangan cendawan entomopatogen hingga menyebabkan inangnya mati adalah sebagai berikut: konidia kontak pada integumen serangga kemudian menempel serta berkecambah dan melakukan penetrasi dengan membentuk tabung kecambah (appresorium), setelah masuk ke dalam hemosel, cendawan membentuk blastospora yang beredar dalam hemolimfa dan membentuk hifa sekunder untuk menyerang jaringan lain seperti sistem syaraf, trakea, dan saluran pencernaan. Terjadinya defisiensi nutrisi, adanya toksin yang dihasilkan oleh cendawan, dan terjadinya kerusakan jaringan dalam tubuh serangga akan menyebabkan terjadinya paralisis dan kematian pada serangga. Gejala A. glycines yang terinfeksi Cendawan Entomopatogen
Berdasarkan hasil pengamatan terhadap A. glycine yang terinfeksi jamur entomopatogen umumnya menunjukan gejala yang sama yaitu tubuh kaku, mengeras, dan mengering seperti mumi (mumifikasi). Perbedaannya terlihat dari miselia yang menyelimuti serangga uji, seperti yang dapat terlihat pada gambar 3.
Gambar 3. A. glycines yang terinfeksi Jamur Entomopatogen ; L. Lecanii (a),
B. bassiana (b), M. Anisopliae (c).
A. glycines yang terinfeksi cendawan dan mati, pada awalnya berwarna
kehitaman. Infeksi cendawan pada kutudaun mulai terjadi pada waktu dua hari setelah perlakuan (HSA). Pada 3 HSA serangga mulai menunjukkan tanda
b
terinfeksi yaitu ditumbuhi oleh miselia cendawan bewarna putih. Mula-mula miselia cendawan hanya pada bagian tertentu saja, tetapi lama-kelamaan miselia cendawan tersebut menyebar ke seluruh bagian kutudaun, sehingga seluruh bagian kutu daun terkolonisasi oleh miselia cendawan.
Tubuh Aphis glycines yang mati terinfeksi cendawan entomopatogen terlihat mengering dan mengeras, hal ini terjadi karena seluruh cairan pada tubuh
A. glycines digunakan untuk pertumbuhan cendawan entomopatoen. Sesuai
dengan pernyataan Santoso (1994) dalam Jauharlina & Hendrival (2003) menyatakan bahwa pada umumnya semua jaringan dan cairan tubuh serangga habis digunakan oleh cendawan entomopatogen untuk pertumbuhan dan perkembangannya, akibatnya serangga mati dengan tubuh mengeras seperti mumi. Jika keadaan mendukung, cendawan menembus keluar tubuh serangga terutama pada artikulasi embelan tubuh dan alat mulut.
Cendawan L. lecanii memproduksi dua senyawa metabolit, yaitu
dipicolonic acid dan cyclodepsipeptide (Cloyd, 2003). Pada proses penetrasi
senyawa mukopolisakarida tersebut memegang peranan sangat penting. Selanjutnya cendawan melakukan penetrasi dan menembus integumen, cendawan membentuk tabung kecambah (appresorium) (Tyrrell & MacLeod, 1975).
Menurut Robert (1981), setelah melakukan penetrasi ke dalam tubuh
serangga, hifa cendawan B. bassiana berkembang dan memasuki pembuluh darah,
selain itu cendawan ini juga menghasilkan beberapa toksin yaitu beauvericin,
beauverolit, bassianolit dan isorolit, yang dapat menaikkan pH dan penggumpalan
darah, serta terhentinya peredaran darah. Cendawan tersebut juga menyebabkan
pernafasan. Keseluruhan proses tersebut akhirnya menyebabkan matinya serangga
tersebut.
Mulyono (2008), menyatakan bahwa kematian serangga akibat jamurM.
anisopliae terjadi karena konidia cendawan M. anisopliae mengandung
KESIMPULAN DAN SARAN Kesimpulan
1. Mortalitas tertinggi A. glycine secara berurut yaitu P4 (Kutu instar 4 + L.
lecanii) 90,0%, P6 (Kutu instar 4 + M. anisopliae) 67,5%, dan P5 (Kutu
instar 4 + B. bassiana) 37,5%, sedangkan perlakuan P3, P2, P1, dan Kontrol tidak ada A. glycines yang mati.
2. Waktu kematian Aphis yang paling cepat terjadi pada perlakuan P6 yaitu 5,00 HSA, diikuti perlakuan P4 yaitu 5,82 HSA, dan P6 yaitu 6,46 HSA, selanjutnya perlakuan P3, P2, P1, dan kontrol masing-masing 0,00 HSA karena tidak ada serangga uji yang mati.
3. A. glycine yang terinfeksi jamur entomopatogen menunjukan gejala seperti
tubuh kaku, mengeras, dan mengering seperti mumi (mumifikasi).
4. A. glycines dinilai tahan terhadap infeksi cendawan entomopatogen, hal ini
disebabkan karena proses pergantian kulit dari A. glycines lebih cepat dibandingkan dengan waktu yang di butuhkan jamur untuk melakukan penetrasi.
5. Lecanicillium lecanii dan Metarhizium anisopliae efektif dalam
mengendalikan Aphis glycines di lapangan, tidak sama halnya dengan
Beauveria bassiana dengan tingkat mortalitas di bawah 50%.
Saran
TINJAUAN PUSTAKA Kutu Daun Kedelai (Aphis glycines)
Menurut Blackman dan Eastop (2000), adapun klasifikasi kutu daun kedelai adalah sebagai berikut:
Kingdom : Animalia Filum : Arthropoda Kelas : Insekta Ordo : Hemiptera Famili : Aphididae Genus : Aphis
Spesies : Aphis glycinesMatsumura.
Kata aphididae berasal dari bahasa Yunani yang artinya mengisap cairan. Hal ini menunjukkan bahwa hama ini mengisap cairan dari tanaman sebagai nutrisi makanannya (O`Neal & Hodgson, 2000).
Kutudaun tergolong serangga yang berukuran kecil. Tubuh betina yang tidak bersayap bewarna kuning pucat atau kuning kehijauan, panjang tubuh 1.0-1.6 mm, kornikel hitam dan seringkali dengan dasar kauda yang pucat. Marginal
tubercles kecil, terdapat pada ruas abdomen kesatu dan ketujuh. Antenal tubercles
menyebabkan populasi kutudaun dapat meningkat dengan cepat jika dalam kondisi yang baik (Afifah, 2011).
Siklus hidup A. glycines satu minggu dengan rincian: stadium nimfa instar satu selama satu hari, instar dua, tiga, dan empat masing-masing dua hari. Nimfa dengan cepat (lebih kurang seminggu) menjadi dewasa dan siap melahirkan generasi baru. Pada kedelai varietas Orba rata-rata lama hidup dan keperidian berturut-turut adalah 15 hari dan 21 nimfa (Rohajati, 1976).
Aphis glycines menyerang bagian daun tanaman kedelai dengan cara
menusukkan alat mulutnya yang seperti jarum (stylet). Alat mulut kutu ini mampu menusuk epidermis daun maupun batang tanaman kedelai dan juga mengisap cairan serta nutrisi tanaman sehingga lambat laun tanaman kedelai akan kehilangan cairan nutrisi. Kerusakan tanaman disebabkan oleh fase nimfa dan imago A. glycines (Pracaya, 2009).
Aphisglycines menyerang tanaman kedelai sejak awalpertumbuhan hingga
masa panen. Selain sebagai hama, serangga ini dapat jugaberperan sebagai vektor yang dapat menularkan virus dari tanaman satu ke tanaman lainnya melalui aktivitas makannya. Kerugian lain yang diakibatkan A. glycinesadalah adanya embun jelaga berwarna hitam yang dapat menutupi permukaan daunkedelai sehingga fotosintesis terganggu (Tilmon et al., 2011)
CendawanLecanicillium lecanii
Cendawan Lecanicillium lecanii (Zimm.) (Viegas) (Zare and Gams) digolongkan divisi Deuteromycotina kelas Hyphomycetes yang tergolong
imperfect fungi atau cendawan yang memiliki siklus tidak sempurna. L. lecanii
Zimmermann pada tahun 1898 dengan nama Chephalosporium lecanii. Pada tahun 1939, Viegas mengubah nama menjadi Verticillium lecanii berdasarkan studi kisaran inang (Kauvelis et al.,1999).
Pengamatan lebih lanjut terhadap sifat morfologi dan analisis molekuler, cendawan berubah nama menjadi L. lecanii sampai sekarang(Zare and Gams, 2001). Cendawan L. lecanii digunakan untuk mengendalikan hama terutama Hemiptera dengan tingkat mortalitas yang bervariasi (Prayogo, 2004).
Cendawan ini mudah tumbuh pada berbagai media, terutama pada media
potato dextrose agar (PDA) dan beras. Di dalam cawan petri, diameter koloni
dapat mencapai 4–5,50 cm pada 3 hari setelah inokulasi. Koloni cendawan berwarna putih pucat. Kumpulan konidia ditopang oleh tangkai konidiofor yang membentuk fialid seperti huruf L. Setiap konidiofor menopang 5−10 konidia yang terbungkus dalam kantong lendir. Konidia berbentuk silinder hingga elip, terdiri atas satu sel, tidak berwarna (hialin), berukuran 2,30−10 x 1−2,60 μm (Tanada & Kaya, 1993).
Cendawan entomopatogen memerlukan kelembaban yang tinggi untuk tumbuh dan berkembang, hal tersebut diperlukan selama proses pembentukan tabung kecambah (germ tube), sebelum terjadi penetrasi ke integumen serangga. Cendawan L. lecanii tumbuh baik pada suhu 18-30ºC dan kelembaban minimal 80%. Pada kelembaban lebih dari 90% cendawan tumbuh sangat baik (Cloyd, 2003).
sisa-sisa hasil pertanian. Cendawan L. lecanii mampu hidup pada bahan organik yang mati dalam rentang waktu yang sangat panjang (Tanada and Kaya, 1993).
CendawanBeauveria bassiana
Beauveria bassiana adalah cendawan entomopatogen yang terbukti
memiliki daya bunuh tinggi terhadap serangga hama terutama ordo Lepidoptera, Hemiptera dan Coleoptera. Pertumbuhan dalam media berbentuk koloni putih seperti kapas, konidiofor yang fertile bercabang-cabang secara zig-zag dan pada bagian ujungnya terbentuk konidia. Konidia bersel satu berbentuk bulat sampai oval, hialin, berukuran 2-3 mikron (Haryono et al.,1993).
Pengendalian hayati dengan menggunakan jamur entomopatogen saat ini menjadi pilihan utama. B. bassiana ialah jamur entomopatogen dapat membunuh serangga antara lain Lepidoptera (Winarto dan Darmawati, 2004), Thysanoptera (Ludwig and Ronald, 2002), Hemiptera (Herlinda et al., 2006), Homoptera (Evi, 2006), Orthoptera (Thompson, 2006) dan Diptera (Bernardi et al., 2006).
Jamur B.bassiana mempunyai kapasitas reproduksi yang tinggi, mudah diproduksi dan pada kondisi yang kurang menguntungkan dapat membentuk spora yang mampu bertahan lama di alam (Widayat dan Dini, 1993 dalamSudarmadji, 1996).
Di Indonesia, hasil-hasil penelitian B. bassiana juga telah banyak dipublikasikan, terutama terkait aplikasinya pada tanaman pangan untuk mengendalikan hama, misalnya hama jagung, yaitu Spodoptera litura,
Helicoverpa armigera, dan Ostrinia furnacalis, hama kedelai (R. linearis dan S.
Crocidolomia pavonana pada sayur-sayuran kubis (Trizelia, 2005) dan penggerek
buah kakao Hypothenemus hampei(Prayogo, 2006).
Untuk memperoleh isolat B. bassiana yang dapat mapan untuk diaplikasikan di lapangan diperlukan eksplorasi B. bassiana pada berbagai lokasi, kemudian dikarakterisasi secara morfologi (warna koloni, ukuran konidia, dan kerapatan hifa), serta ditinjau viabilitassetiap isolat. Selain itu, perlu diuji efektivitas setiap isolat untuk mengendalikan hama serangga sebelum diformulasi menjadi bioinsektisida (Sri et al.,2014).
Beauveria bassiana dapat diisolasi dari serangga yang mati karena
terinfeksi B. bassianadan dari tanaman maupun tanah (Soetopo & Indrayani, 2007). Metode yang direkomendasikan untuk mengisolasi cendawan entomopatogen dari populasi asli atau lokal adalah metode pemancingan dengan serangga (insect bait method) yang digunakan untuk mengisolasi cendawan dari tanah (Meyling, 2007).
CendawanMetarhizium anisopliae
Jamur M. anisopliae termasuk dalam kelas Hyphomycetes, ordo Moniliales dan famili Monileaceae. Jamur M. anisopliae mampu menginfeksi hama yang mempunyai tipe mulut menusuk dan mengisap (haustelata), seperti golongan Aphis sp. baik stadia nimfa maupun imago (Sumartini et al.,2001). Disamping itu, M. anisopliae juga mampu menginfeksi hama yang mempunyai tipe mulut menggigit mengunyah (mandibulata), seperti Spodoptera
litura(Prayogo et al., 2005).
tingkat perkembangan serangga mulai dari telur, larva, pupa dan imago (Prayogo, 2004).
Jamur M. anisopliae memiliki beberapa kelebihan antara lain berkapasitas reproduksi tinggi, relatif aman, siklus hidupnya pendek, selektif, mudah diproduksi, serta dapat bertahan dalam kondisi yang tidak menguntungkan (Prayogo et al., 2005).
Jamur M. anisopliae memiliki aktivitas larvisidal karena menghasilkan
cyclopeptida, destruxin A, B, C, D, E dan desmethyldestruxin. Destruxin telah
dipertimbangkan sebagai bahan insektisida generasi baru. Efek destruxin berpengaruh pada organella sel target (mitokondria, retikulum endoplasma dan
membran nukleus), menyebabkan paralisa sel dan kelainan fungsi
PENDAHULUAN Latar Belakang
Kedelai (Glycine max (L.) Meriill) merupakan salah satu komoditi tanaman yang penting dalam pertanian di Indonesia karena memiliki berbagai manfaat, baik dalam penyediaan pangan, pakan, dan bahan baku industri. Penggunaan kedelai terus meningkat sejalan dengan pertambahan penduduk sehingga produksi nasional harus dapat memenuhi kebutuhan masyarakat Indonesia. Namun, pada kenyataannya produksikedelai dalam negeri belum mampu mencukupi permintaan tersebut(Adisarwanto, 2010).
Indonesia merupakan salah satu negara utama pengimpor kedelai. Produksi kedelai nasional sampai saat ini masih di bawah 2,5 ton/ha. Padatahun 2014 Indonesia mengimpor kedelai sebanyak 348.000 ton, dengan produksidalam negeri berkisar di bawah 1 juta ton. Hal ini disebabkan karenatingginya kebutuhan kedelai di Indonesia, sementara produksi kedelai nasional masih lebih rendah dibanding kebutuhan masyarakat(BPS, 2014).
Pertanaman kedelai di Indonesia menghadapi permasalahan utama, antara lain: meningkatnya impor kedelai untuk memenuhi kebutuhan nasional, lebarnya senjang produktivitas di tingkat petani dengan potensi genetik kedelai karena sebagian besar petani belum menggunakan varietas unggul baru yang toleran terhadap cekaman abiotik, serta teknik pengelolaan lahan, air, tanaman, yang belum tepat dan serangan organisme pengganggu tanaman yang sangat tinggi (Arifin, 2012).
tanaman kedelaimulai dari awal tanam hingga panen antara lain : lalat bibit (Ophiomy paseoli), lalatbatang (Melanogromyza sojae), lalat pucuk (Melanogromyza dolichostigma), Agrotisspp, Longitarsus suturellinus, Phaedonia
inclusa,Spodoptera litura, Chrysodeixis chalcites,Lamprosema indicata,
Helicoverpa sp,Etiella spp, Riptortus linearis,Nezara viridula, Piezodorus
hybneri, lalat kacang (Agromyza sp), ulat pemakan daun (Lamprosema litura),
wereng kedelai (Phaedonia inclusa), pengisap polong (Riptortus linearis), penggerek polong (Etiella zinckenelo), pengisap dan penggerek polong (Nezara
viridula), Bemisia tabaci, Aphis glycines(Marwoto, 2007).
Kutu daun Aphis glycines (soybean aphid) merupakan salah satu hama kedelai yang berkembang dalam koloni besar dan menyebabkan kehilangan hasil mencapai 58% pada tanaman kedelai (Wang et al., 1994). A. glycines kedelai memiliki tipe mulut menusuk mengisap yang digunakan untuk mengambil cairan dari jaringan floem. A. glycines mengisap cairan tanaman pada daun, batang, dan polong. Namun demikian A. glycines banyak dijumpai pada permukaan bawah daun (Tilmon et al., 2011). A. glycines yang menyerang tanaman kedelai dapat menyebabkan penurunan kapasitas fotosintesis(Macedo et al., 2003).
Populasi A. glycines yang tinggi dapat mengurangi produksi kedelai secara langsung melalui beberapa kerusakan. Gejala serangannya seperti kerdil, distorsi daun, dan mengurangi kualitas polong yang dihasilkan (Sun et al., 1990). Jumlah polong yang terbentuk berkurang, berukuran kecil, dan berbelang (Baliadi, 2007).
menginfeksi Aphisadalah Beauveria bassiana, Metarhizium anisopliae, Paecilomyces fumosoroceus dan Verticillium lecanii(Mahr et al.,2001).
Pada penelitian sebelumnya (Prayogo, 2004) berhasil mengidentifikasi cendawan entomopatogen Lecanicillium lecanii dari walang sangit (Leptocoriza
oratoria) yang efektif untuk mengendalikan hama pengisap polong (Riptortus
linearis) pada kedelai. Cendawan L. lecanii juga dapat digunakan untuk
mengendalikan serangga hama terutama ordo Homoptera (Cloyd, 2003) dan Hemiptera (Prayogo, 2004).
SelainLecanicillium lecanii, jamur entomopatogen seperti M. anisopliae dan B. bassianajuga berperan sebagai agen hayati pengendali hama. Metarhizium efektif membunuh serangga, antara lain ordo Coleoptera (Gallegos et al.,2003), Lepidoptera (Prayogo et al., 2005), Isoptera (Krutmuang & Supamit, 2005), Thysanoptera (Thungrabeab et al.,2006), dan Orthoptera (Tsakadze et al.,2003). Berdasarkan penelitian diketahui bahwaB. bassiana (Deuteromycetes: Moniliceae) efektif dalam menekan perkembangan Hemiptera (Herlinda et al., 2006), Homoptera (Evi, 2006), Orthoptera (Thompson, 2006) dan Diptera (Bernardi et al., 2006).
Berbagai kelebihan pemanfaatan jamur entomopatogen dalam pengendalian hama ialah mempunyai kapasitas reproduksi yang tinggi, siklus hidupnya pendek, dapat membentuk spora yang tahan lama di alam walaupun dalam kondisi yang tidak menguntungkan, relatif aman, bersifat selektif, relatif mudah diproduksi, dan sangat kecil kemungkinan terjadi resistensi (Prayogo et
cendawan entomopatogen yang efektif dalam pengendalian hama kutu daun (A.
glycines)pada tanaman kedelai.
Tujuan Penelitian
Untuk mengetahui efektifitas cendawan entomopatogen (L.lecanii, M.
anisopliae, dan B. bassiana) terhadap hama kutu daun (A.glycines) pada tanaman
kedelai dilapangan. Hipotesis Penelitian
Cendawan entomopatogen (L. lecanii, M. anisopliae, dan B. bassiana) efektif dalam mengendalikan kutu daun (A. glycines) pada tanaman kedelai di lapangan.
Kegunaan Penelitian
ABSTRACT
Riri Widariyanto, " Pathogenicity of Some Entomophatogen’s Fungus
(Lecanicillium Lecanii, Metarhizium Anisopliae, and Beauveria bassiana) to Aphis glycines at Soybean", supervised by Ir. Mukhtar Iskandar Pinem, M.Agr. and Ir. Fatimah Zahara. The objectives of the research were to study the
effectiveness of entomopatogen’s fungus ( L. Lecanii, M. Anisopliae, and B. bassiana) to Aphis glycines in soybean on field. Research done at Farm of
Faculty of Agriculture of University of Sumatera Utara, Medan from December 2015 until Februari 2016. The method used Randomized Block Design by seven treatment that is : P0/control (Instar 4 of Aphis glycines without treatment Entomopathogen), P1 (Instar 2 of Aphis glycines + Lecanicillium lecanii 107), P2 (Instar 2 of Aphis glycines + Beauveria bassiana 107), P3 (Instar 2 of Aphis glycines + Metarhizium anisopliae 107), P4(Instar 4 of Aphis glycines +
Lecanicillium lecanii 107), P5 (Instar 4 of Aphis glycines + Beauveria bassiana 107), P6 (Instar 4 of Aphis glycines + Metarhizium anisopliae 107).
The results showed that the treatment significantly effected the percentage of mortality and death time. The highest percentage of mortality (90,00%) at P4, then (67,50%) at P6, and lowest (37,50%) at P5. P3, P2, P1, and control mortality is 0%. The best of death time at P6 (5,00day), then P4 ( 5,82day), and P6 (6,46day). Level of instar have an effect on effectiveness in infection of entomophatogen’s fungus.
ABSTRAK
Riri Widariyanto, “Patogenitas Beberapa Cendawan Entomopatogen (Lecanicillium lecanii, Metarhizium anisopliae, dan Beauveria bassiana) Terhadap Aphis glycines Pada Tanaman Kedelai”, di bawah bimbingan Ir. Mukhtar Iskandar Pinem, M.Agr. dan Ir. Fatimah Zahara. Penelitian ini bertujuan untuk mengetahui efektivitas cendawan entomopatogen (Lecanicillium lecanii,
Metarhizium anisopliae, dan Beauveria bassiana) terhadap hama kutu daun
(Aphis glycines) pada tanaman kedelai di lapangan. Penelitian dilakukan di Lahan Percobaan Fakultas Pertanian Universitas Sumatera Utara, Medan pada bulan
Desember 2015 sampai Februari 2016. Penelitian ini mengguanakan rancangan acak kelompok dengan 7 perlakuan yaitu : P0/Kontrol (Kutu instar 4
tanpa perlakuan Entomopathogen), P1(Kutu instar 2 + Lecanicillium lecanii 107), P2(Kutu instar 2 + Beauveria bassiana 107), P3(Kutu instar 2 + Metarhizium
anisopliae 107), P4(Kutu instar 4 + Lecanicillium lecanii 107), P5 (Kutu instar 4 + Beauveria bassiana 107), P6(Kutu instar 4 + Metarhizium anisopliae 107).
Hasil penelitian menunjukkan bahwa perlakuan berpengaruh nyata terhadap persentase mortalitas dan waktu kematian. Persentase mortalitas tertinggi (90,00%) pada P4, kemudian(67,50%) pada P6, dan terendah(37,50%) pada P5.
P3, P2, P1, dan Kontrol mortalitas 0%. Waktu kematian tercepat pada P6 (5,00 HSA), kemudian P4 (5,82 HSA), dan P6 (6,46 HSA). Tingkat instar
berpengaruh terhadap efektivitas cendawan entomopatogen dalam menginfeksi. Kata kunci : Aphis glycines, Lecanicillium lecani, Beauveria bassiana,
PATOGENITAS BEBERAPA CENDAWAN ENTOMOPATOGEN (Lecanicilliumlecanii, Metarhizium anisopliae, dan Beauveria
bassiana)TERHADAP Aphis glycines PADA TANAMAN KEDELAI
S K R I P S I
Oleh:
RIRI WIDARIYANTO
110301109 /AGROEKOTEKNOLOGI
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
PATOGENITAS BEBERAPA CENDAWAN ENTOMOPATOGEN (Lecanicilliumlecanii, Metarhizium anisopliae, dan Beauveria
bassiana)TERHADAP Aphis glycines PADA TANAMAN KEDELAI
S K R I P S I
Oleh:
RIRI WIDARIYANTO
110301109/ AGROEKOTEKNOLOGI
Skripsi Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana di Program Studi Agroekoteknologi Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul Skripsi : Patogenitas Beberapa Cendawan Entomopatogen (Lecanicillium lecanii, Metarhizium anisopliae, dan
Beauveria bassiana)terhadap Aphis glycines pada
Tanaman Kedelai
Nama : Riri Widariyanto
Nim : 110301109
Program Studi : Agroekoteknologi
Minat : Hama dan Penyakit Tumbuhan
Disetujui oleh Komisi Pembimbing
(Ir. Mukhtar Iskandar Pinem, M.Agr) (Ir. Fatimah Zahara)
Ketua Anggota
Mengetahui,
(Prof. Ir. T. Sabrina, M. Agr, Sc, Ph. D Ketua Program Studi Agroekoteknologi
ABSTRACT
Riri Widariyanto, " Pathogenicity of Some Entomophatogen’s Fungus
(Lecanicillium Lecanii, Metarhizium Anisopliae, and Beauveria bassiana) to Aphis glycines at Soybean", supervised by Ir. Mukhtar Iskandar Pinem, M.Agr. and Ir. Fatimah Zahara. The objectives of the research were to study the
effectiveness of entomopatogen’s fungus ( L. Lecanii, M. Anisopliae, and B. bassiana) to Aphis glycines in soybean on field. Research done at Farm of
Faculty of Agriculture of University of Sumatera Utara, Medan from December 2015 until Februari 2016. The method used Randomized Block Design by seven treatment that is : P0/control (Instar 4 of Aphis glycines without treatment Entomopathogen), P1 (Instar 2 of Aphis glycines + Lecanicillium lecanii 107), P2 (Instar 2 of Aphis glycines + Beauveria bassiana 107), P3 (Instar 2 of Aphis glycines + Metarhizium anisopliae 107), P4(Instar 4 of Aphis glycines +
Lecanicillium lecanii 107), P5 (Instar 4 of Aphis glycines + Beauveria bassiana 107), P6 (Instar 4 of Aphis glycines + Metarhizium anisopliae 107).
The results showed that the treatment significantly effected the percentage of mortality and death time. The highest percentage of mortality (90,00%) at P4, then (67,50%) at P6, and lowest (37,50%) at P5. P3, P2, P1, and control mortality is 0%. The best of death time at P6 (5,00day), then P4 ( 5,82day), and P6 (6,46day). Level of instar have an effect on effectiveness in infection of entomophatogen’s fungus.
ABSTRAK
Riri Widariyanto, “Patogenitas Beberapa Cendawan Entomopatogen (Lecanicillium lecanii, Metarhizium anisopliae, dan Beauveria bassiana) Terhadap Aphis glycines Pada Tanaman Kedelai”, di bawah bimbingan Ir. Mukhtar Iskandar Pinem, M.Agr. dan Ir. Fatimah Zahara. Penelitian ini bertujuan untuk mengetahui efektivitas cendawan entomopatogen (Lecanicillium lecanii,
Metarhizium anisopliae, dan Beauveria bassiana) terhadap hama kutu daun
(Aphis glycines) pada tanaman kedelai di lapangan. Penelitian dilakukan di Lahan Percobaan Fakultas Pertanian Universitas Sumatera Utara, Medan pada bulan
Desember 2015 sampai Februari 2016. Penelitian ini mengguanakan rancangan acak kelompok dengan 7 perlakuan yaitu : P0/Kontrol (Kutu instar 4
tanpa perlakuan Entomopathogen), P1(Kutu instar 2 + Lecanicillium lecanii 107), P2(Kutu instar 2 + Beauveria bassiana 107), P3(Kutu instar 2 + Metarhizium
anisopliae 107), P4(Kutu instar 4 + Lecanicillium lecanii 107), P5 (Kutu instar 4 + Beauveria bassiana 107), P6(Kutu instar 4 + Metarhizium anisopliae 107).
Hasil penelitian menunjukkan bahwa perlakuan berpengaruh nyata terhadap persentase mortalitas dan waktu kematian. Persentase mortalitas tertinggi (90,00%) pada P4, kemudian(67,50%) pada P6, dan terendah(37,50%) pada P5.
P3, P2, P1, dan Kontrol mortalitas 0%. Waktu kematian tercepat pada P6 (5,00 HSA), kemudian P4 (5,82 HSA), dan P6 (6,46 HSA). Tingkat instar
berpengaruh terhadap efektivitas cendawan entomopatogen dalam menginfeksi. Kata kunci : Aphis glycines, Lecanicillium lecani, Beauveria bassiana,
RIWAYAT HIDUP
Riri Widariyanto, dilahirkan di Pekanbaru, Riau, pada tanggal 26 Juli 1993 dari pasangan Ayahanda Sutimin dan Ibunda Prisetiawati. Penulis
merupakan anak tunggal.
Pendidikan formal yang pernah ditempuh :
- Lulus dari Sekolah Dasar Negeri 014722Sumber Makkur pada tahun 2005. - Lulus dari Sekolah Menengah Pertama Swasta Taman Ilmu Perlanaan, pada
tahun 2008.
- Lulus dari Sekolah Menengah Atas Negeri 1 Perdagangan pada tahun 2011. - Pada tahun 2011 diterima di Fakultas Pertanian Universitas Sumatera Utara
Medan, Program Studi Agroekoteknologi melalui jalur SNMPTN Tertulis. Pendidikan informal yang pernah ditempuh diantaranya :
- Tahun 2013-2015 menjadi Asisten Laboratorium Penyakit Tumbuhan di Fakultas Pertanian USU, Medan.
- Tahun 2014-2015 menjadi Asisten Laboratorium Pengelolaan Hama Terpadu di Fakultas Pertanian USU, Medan.
- Tahun 2014 menjadi Asisten Laboratorium Dasar Perlindungan Tanaman, dan Pestisida dan Teknik Aplikasi, di Fakultas Pertanian USU, Medan.
- Tahun 2014 mengikuti kompetisi nasional “Palnt Protection Day” di Fakultas Pertanian Universitas Padjajaran, Bandung.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa karena
rahmat dan hidayah-Nya penulis dapat menyelesaikan penelitian ini.
Adapun judul dari penelitian ini adalah “Patogenitas Beberapa
Cendawan Entomopatogen (Lecanicillium lecanii, Metarhizium anisopliae, dan
Beauveria bassiana)TerhadapAphis glycines Pada Tanaman Kedelai”yang
merupakan salah satu syarat untuk dapat memperoleh gelar sarjana di Fakultas
Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Komisi
Pembimbing Ir. Mukhtar Iskandar Pinem, M.Agr. sebagai Ketua dan
Ir. Fatimah Zahara sebagai Anggota, yang telah membimbing penulis selama
penelitian hingga penyelesaian skripsi ini.
Penulis menyadari bahwa skripsi ini masih belum sempurna. Oleh karena itu,
penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan
usulan penelitian ini.
Akhir kata penulis mengucapkan terima kasih kepada semua pihak yang
membantu. Semoga bermanfaat bagi pihak yang membutuhkan.
Medan, Mei 2016
DAFTAR ISI Kutu Daun Kedelai (Aphis glycines) ...5
Cendawan Lecanicillium lecanii...6
Cendawan Beauveria bassiana ...8
Cendawan Metarhizium anisopliae ...9
METODOLOGI PENELITIAN Tempat dan Waktu Penelitian ...11
Bahan dan Alat ...11
Metode Penelitian ...11
Pelaksanaan Penelitian...12
Pemeliharaan Serangga Aphis glycines ...12
Pemeliharaan Tanaman Kedelai di Lahan Percobaan ...12
Perbanyakan Cendawan Entomopatogen (Lecanicillium lecanii, Metarhizium anisopliae, dan Beauveria bassiana ...12
Aplikasi Cendawan Entomopatogen dan Investasi A. glycines ...13
Peubah Amatan ...13
Mortalitas A. glycines...13
Waktu Kematian A. glycines ...14
Gejala A. glyccines yang Terinfeksi Cendawan Entomopatogen (Lecanicillium lecanii, Metarhizium anisopliae, dan Beauveria bassiana) ...14
HASIL DAN PEMBAHASAN
Persentase Mortalitas Aphis glycine ...15 Waktu Kematian A. glycines...18 Gejala A. glyccines yang Terinfeksi Cendawan Entomopatogen
(Lecanicillium lecanii, Metarhizium anisopliae,
dan Beauveria bassiana)...20 KESIMPULAN DAN SARAN
Kesimpulan ...23 Saran ...23 DAFTAR PUSTAKA
DAFTAR TABEL
No. Keterangan Hlm
Tabel 1. Rerata mortalitas A. glycines pada beberapa perlakuan stadia
DAFTAR GAMBAR
No. Keterangan Hlm
1. Histogram perkembangan mortalitas A. glycines ... 18 2. Histogram waktu kematian A. glycines ... 19
DAFTAR LAMPIRAN
No. Keterangan Hlm
1. MortalitasAphis glycinesberdasarkan hari pengamatan(%) ... 31
2. Mortalitas Aphis glycines berdasarkan perlakuan(%) ... 31
3. Analisis keragaman persentase mortalitas Aphis glycines ... 31
4. Uji Duncan Multiple Range Test (SPSS 21) Mortalitas Aphis glycines ... 32
5. Waktu Kematian Aphis glycines Setelah Aplikasi (hari) ... 32
6. Waktu Kematian Aphis glycines Berdasarkan Perlakuan ... 33
7. Analisis Keragaman Waktu Kematian Aphis glycines ... 33
8. Uji Duncan Multiple Range Test (SPSS 21) Waktu Kematian Aphis glycines ... 33
9. Deskripsi Varietas Kedelai... 34