AKTIVITAS ANTIFERTILITAS EKSTRAK
ETANOL 70% DAUN PACING (
Costus spiralis
)
PADA TIKUS
SPRAGUE-DAWLEY
JANTAN
SECARA
IN VIVO
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
RIANISA KARUNIA DEWI
NIM: 1111102000064
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
AKTIVITAS ANTIFERTILITAS EKSTRAK
ETANOL 70% DAUN PACING (
Costus spiralis
)
PADA TIKUS
SPRAGUE-DAWLEY
JANTAN
SECARA
IN VIVO
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
RIANISA KARUNIA DEWI
NIM: 1111102000064
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
Nama : Rianisa Karunia Dewi Program Studi : Farmasi
Judul : Aktivitas Antifertilitas Ekstrak Etanol 70%
Daun Pacing (Costus spiralis) pada Tikus Sprague- Dawley Jantan secara In Vivo
Tanaman pacing (Costus spiralis) termasuk genus costus yang merupakan salah satu sumber senyawa diosgenin yang berpotensi sebagai agen antifertilitas. Penelitian ini bersifat eksperimental. Hewan uji tikus Sprague-Dawley jantan dibagi menjadi empat kelompok yaitu kontrol Na CMC 0,5%, dosis 12,5mg/kgBB, 25mg/kgBB, dan 37,5mg/kgBB. Ekstrak etanol 70% daun pacing (Costus spiralis) diberikan selama 48 hari. Parameter antifertilitas yang dilakukan adalah konsentrasi spermatozoa, morfologi spermatozoa, konsenterasi testosteron dan jumlah spermatosit pakiten. Hasil penelitian mengunakan analisa data ANOVA menunjukkan penurunan konsentrasi spermatozoa pada ketiga dosis secara tidak bermakna (p≥0,05) terhadap kelompok kontrol. Abnormalitas morfologi spermatozoa menunjukkan peningkatan secara bermakna (p≤0,05) pada hewan uji yang diberikan ekstrak etanol 70% daun pacing (Costus spiralis) terhadap kelompok kontrol. Analisa data Paired-Sample T-Test untuk konsentrasi testosteron mengalami peningkatan pada dosis 25mg/kgBB dan 37,5mg/kgBB dan penurunan terjadi pada kelompok 12,5mg/kgBB pada hari ke-49 dibandingkan pada hari ke-0, tetapi tidak bermakna (p≥0,05). Konsentrasi testosteron pada penelitian ini masih dalam rentang konsentrasi serum testosteron normal pada tikus. Jumlah spermatosit pakiten pada tahap VII-VIII mengalami penurunan secara bermakna (p≤0,05) terhadap kontrol. Berdasarkan data di atas ekstrak etanol 70% daun pacing (Cotus spiralis) berpotensi sebagai agen antifertilitas.
Name : Rianisa Karunia Dewi Programme of Study : Pharmacy
Title : Antifertility Activity of 70% Ethanol Extract of Pacing Leaves (Costus spiralis) in Male Sprague- Dawley Rats In Vivo
Pacing (Costus spiralis) belongs to costus genus which is one of the sources of diosgenin that can potentially be an antifertility agent. This research on experimental. Male Sparague-Dawley rats are divided into four groups such as control Na CMC 0,5%, 12,5mg/kg body weight , 25mg/kg body weight, and 37,5mg/kg body weight. The 70% ethanol extract of pacing leaves (Costus spiralis) was given orally once a day in 48 days. Antifertility parameters such as spermatozoa concentration, abnormalities of spermatozoa morphology, testosterone concentration, and spermatocyte pachytene count are examined. The results are analyzed by ANOVA. The result showed spermatozoa concentration reduction was not significant (p≥0,05) against the control group. Abnormalities of spermatozoa morphology were significantly increased (p≤0,05) in male Sprague-Dawley rats which were given 70% ethanol extract of pacing leaves (Costus spiralis) orally against the control group. Paired- Samples T Test of testosterone concentration serum was increased at 25mg/kg body weight and 37,5mg/kg body weight and decreased at 12,5mg/kg body weight. The results showed the difference of testosterone concentrations serum between 0 and 49 days were not significant. Testosterone concentration serum in this research is still classified as normal. Number of spermatocyte pachytene at stage VIII-VIII showed significant reduction (p≤0,05) between control group and treatment group. Based on the results, the 70% ethanol extract of pacing leaves (Costus spiralis) is a potentially antifertility agent.
Alhamdulillahirabbil’alamin, segala puji bagi Allah SWT yang telah memberikan rahmat, taufik an Hidayah-Nya, sehingga penullis dapat menyelesaikan penelitian dan menyusun skripsi dengan judul “Aktivitas Antifertilitas Daun Pacing (Costus spiralis) pada Tikus Sprague-Dawley Jantan secara In Vivo. Shalawat serta salam penulis curahkan kepada junjungan kita Nabi Muhammad SAW beserta Keluarga, para sahabat serta kita sebagai umatnya.
Penulis menyadari bahwa dalam penelitian dan penyusunan skripsi ini tidak akan terwujud tanpa adanya bantuan, bimbingan, dan dukungan dari berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Dr. Azrifitria M.Si., Apt dan Puteri Amelia M.Farm., Apt sebagai dosen pembimbing yang dengan sabar telah memberikan banyak masukan, bimbingan, dan dukungan kepada penulis.
2. Drs. Arif Sumantri., M.Kes Selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
3. Drs. Umar Mansur, M.Sc., Apt selaku Ketua dan Ofa Suzanti Betha, M.Si, Apt. selaku Sekertaris Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
4. Ayahanda Darto Yudhi P. dan Ibunda Siti Sawaliah yang selalu memberikan kasih sayang, doa, dukungan moral dan materi, dan semangat yang tak terhingga disetiap langkah penulis.
5. Kakak dan Adiku Erlangga P.W. dan Sarah S. yang telah mendukung penulis dalam menyelesaikan skripsi ini.
6. Bapak dan Ibu dosen yang telah memberikan ilmu dan pengetahuan hingga penulis dapat menyelesaikan studi di Program Studi Farmasi FKIK UIN Syarif Hidayatullah Jakarta.
7. Teman seperjuangan penulis “Mamarons” Rian Destiyani, Fio Noviany, Astri Dwi Z., Nurhafiza, Tia Monica, Maharani Pratiwi, dan Rifda Naulil atas kebersamaan, bantuan dan motivasi sejak awal hingga terselesaikannya skripsi ini.
8. Teman-teman yang sudah membantu selama proses penelitan dan skripsi Sry Wardiah, Brasti Eka P., Meri Rahmawati, Umniyati Mufidah, Vernanda, Rhesa Ramadhan, M. Reza, Sutar, M. Haidar Ali, M. Syahid Ali, dan Aziz Iqbal.
bahan selama penelitian.
11.Semua pihak yang telah membantu selama penelitian dan penyelesaian skripsi baik secara langsung maupun tidak langsung yang namanya tidak dapat penulis sebutkan satu persatu.
Semoga Allah SWT memberikan balasan yang berlipat ganda atas semua bantuan, dan dukungan yang diberikan.
Akhir kata, penulis menyadari bahwa penyusunan skripsi ini masih belum sempurna dan banyak kekurangan. Oleh karena itu, saran serta kritik yang membangun sangat diharapkan. Semoga skripsi ini bermanfaat bagi penulis dan pembaca. Amin Ya Rabbal’ alamiin.
Jakarta, Mei 2015
HALAMAN PERSYRATAN ORISINILITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
BAB 1 PENDAHULUAN... 1
1.1Latar Belakang ... 1
1.2Rumusan Masalah ... 3
1.3Tujuan Penelitian ... 3
1.3.1 Tujuan Umum ... 3
1.3.2 Tujuan Khusus ... 3
1.4Hipotesis ... 4
1.5Manfaat Penelitian ... 4
BAB 2 TINJAUAN PUSTAKA ... 5
2.1Tinjauan Botani Tanaman Pacing ... 5
2.1.1 Klasifikasi Tanaman ... 5
2.1.2 Nama Daerah ... 6
2.1.3 Deskripsi Tanaman ... 6
2.1.4 Keanekaragaman Tanaman ... 6
2.1.5 Kandungan Kimia Daun Pacing (Costus spiralis) ... 6
2.1.6 Khasiat dan Kegunaan ... 7
2.1.7 Penelitian Tanaman Pacing (Costus speciosus) ... 7
2.2Sistem Reproduksi Tikus Jantan ... 8
2.2.1 Spermatozoa ... 9
2.2.2 Spermatogenesis ... 10
2.3Hormon yang Mempengaruhi Spermatogenesis ... 12
2.4Karakteristik Tikus Sprague-Dawley ... 15
2.5Simplisia ... 15
2.5.1 Definisi Simplisia ... 15
2.5.2 Pengelolaan Simplisia ... 16
2.6Ekstrak dan Metode Ekstraksi ... 18
2.6.1 Definisi Ekstrak ... 18
2.6.2 Metode Ekstraksi ... 18
2.6.3 Proses Pembuatan Ekstrak ... 20
2.7ELISA (Enzym Linked Immunosorbent Assay) ... 21
BAB 3 METODE PENELITIAN ... 24
3.1Waktu dan Lokasi Penelitian ... 24
3.2Alat dan Bahan... 24
3.3.1 Besar Sampel ... 25
3.3.2 Dosis Perlakuan ... 25
3.4Prosedur Kerja ... 26
3.4.1 Penyiapan Simplisia dan Pembuatan Ekstrak ... 26
3.4.2 Penapisan Fitokimia ... 27
3.4.3 Pengujian Parameter Spesifik dan Non Spesifik... 28
3.4.4 Penyiapan Hewan Uji ... 29
3.4.5 Pembuatan Preparat ... 29
3.4.6 Pengukuran Parameter ... 31
3.5Analisa Data ... 34
BAB 4 HASIL DAN PEMBAHASAN ... 35
4.1Hasil Penelitian ... 35
4.1.1 Determinasi Tanaman ... 35
4.1.2 Ekstraksi ... 35
4.1.3 Penapisan Fitokimia ... 35
4.1.4 Pengujian Parameter Ekstrak ... 36
4.1.5 Perhitungan Konsentrasi Spermatozoa ... 36
4.1.6 Perhitungan Morfologi Spermatozoa ... 38
4.1.7 Perhitungan Konsentrasi Testosteron ... 39
4.1.8 Perhitungan Jumlah Spermatosit Pakiten ... 40
4.2Pembahasan ... 42
BAB 5 KESIMPULAN DAN SARAN ... 51
5.1Kesimpulan ... 51
5.2Saran ... 51
DAFTAR PUSTAKA ... 52
Tabel Halaman
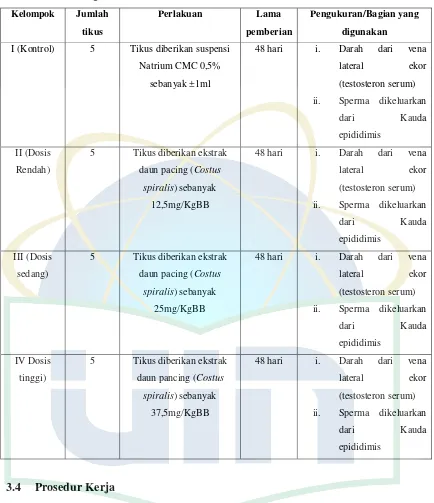
3.1. Rancangan Percobaan ... 26
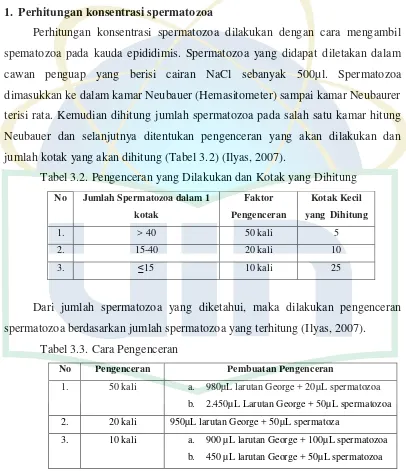
3.2. Pengenceran yang Dilakukan dan Kotak Hitung ... 31
3.3. Cara Pengenceran ... 31
3.4. Rumus Konsentrasi Spermatozoa ... 32
4.1 Hasil Penapisan Fitokimia ... 36
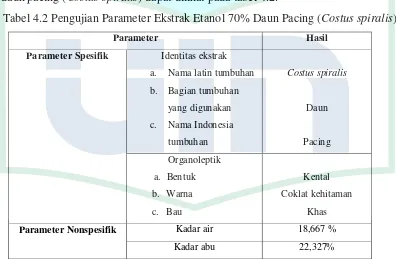
4.2 Pengujian Parameter Ekstrak ... 36
4.3 Konsentrasi Spermatozoa ... 37
4.4 Morfologi Spermatozoa ... 38
4.5 Konsentrasi Testosteron ... 39
4.6 Jumlah Spermatosit Pakiten... 41
Gambar 2.1. Daun, Pacing (Costus spiralis) ... 5
Gambar 2.2. Penampang Ventral Sistem Urogenital Tikus Jantan ... 8
Gambar 2.3. Morfologi Sperma Tikus ... 10
Gambar 2.4. Spermatozoa pada Perbesaran 400x ... 10
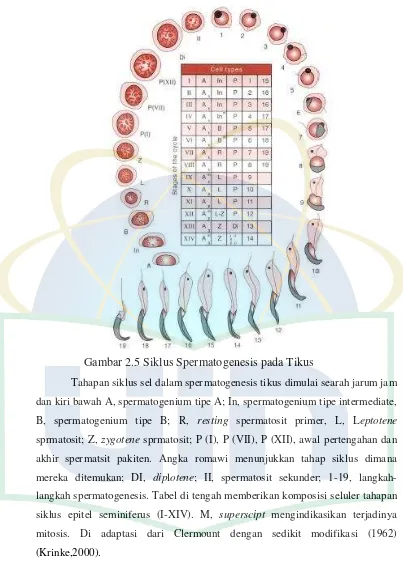
Gambar 2.5. Siklus Spermatogenesis pada Tikus ... 12
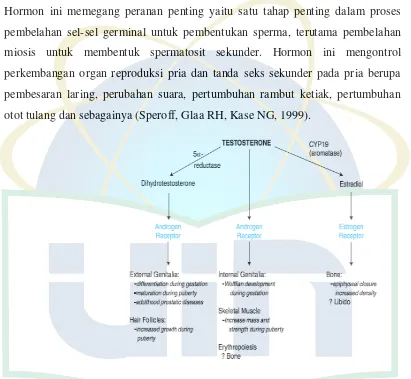
Gambar 2.6. Testosteron ... 13
Gambar 4.1 Konsentrasi Spermatozoa ... 37
Gambar 4.2 Morfologi Spermatozoa ... 38
Gambar 4.3 Konsentrasi Testosteron ... 40
Gambar 4.4 Jumlah Spermatosit Pakiten ... 41
Gambar 4.5. Proses Spermatogenesis ... 48
Gambar 5.1. Pohon pacing (Cotus spiralis) ... 67
Gambar 5.2. Serbuk daun pacing (Cotus spiralis) ... 67
Gambar 5.3. Serbuk daun pacing (Cotus spiralis) dimaserasi ... 67
Gambar 5.4. Proses penyaringan hasil maserasi... 67
Gambar 5.5. Hasil maserasi daun pacing (Cotus spiralis) ... 67
Gambar 5.6. Pemekatan ekstrak dengan vacuum rotary evaporator ... 67
Gambar 5.7. Pemekatan ekstrak dengan freeze dry ... 67
Gambar 5.8. Ekstrak kental etanol 70% daun pacing (Cotus spiralis) ... 67
Gambar 5.9 . Suspensi Na CMC 0,5% ... 67
Gambar 5.10. Suspensi dosis 12,5 mg/kgBB ... 67
Gambar 5.11. Suspensi dosis 25 mg/kgBB ... 67
Gambar 5.12. Suspensi dosis 37,5 mg/kgBB ... 67
Gambar 5.13. Hewan uji ... 68
Gambar 5.14. Hewan uji ditimbang ... 68
Gambar 5.15. Penyondean ekstrak etanol 70% daun pacing (Costus spiralis) ... 68
Gambar 5.16. Hewan uji dikorbankan ... 68
Gambar 5.17. Pembedahan hewan uji... 68
Gambar 5.18. Kauda epididimis ... 68
Gambar 5.19. Pengambilan darah ... 68
Gambar 5.20. Serum belum dipisahkan ... 68
Gambar 5.21. Serum dipisahkan... 68
Gambar 5.22. Spermatozoa dikeluarkan dari kauda epididimis ... 68
Gambar 5.23. Spermatozoa diteteskan pada bilik Neubaurer ... 69
Gambar 5.24. Spermatozoa dihitung dalam 1 kotak besar... 69
Gambar 5.25. Pengenceran spermatozoa ... 69
Gambar 5.26. Pengenceran spermatozoa pada bilik Neubaurer ... 69
Gambar 5.27. Perhitungan konsentrasi spermatozoa ... 69
Gambar 5.28. Spermatozoa dikeluarkan dari kauda epididimis ... 70
Gambar 5.29. Pewarnaan dengan larutan Eosin Y 1% ... 70
Gambar 5.30. Pembuatan preparat apus ... 70
Gambar 5.31. Flattened head ... 70
Gambar 5.32. Normal ... 70
Gambar 5.33. Ekor patah ... 70
Gambar 5.38 .Standar, kontrol, dan sampel dimasukkan ke masing-masing well 71 Gambar 5.39. Enzyme conjugate ditambahkan dan diinkubasi selama 60 menit . 71
Gambar 5.40. Proses pembuangan isi well ... 71
Gambar 5.41. Penambahan wash solution sebanyak 3x ... 71
Gambar 5.42 .Proses pembuangan isi well ... 71
Gambar 5.43. Penambahan substrate solution dan diinkubasi selama 15 menit... 71
Gambar 5.44. Penambahan stop solution ... 71
Gambar 5.45. Pembacaan dengan ELISA Reader ... 71
Gambar 5.46. Testis dipisahkan dari kauda epididimis ... 72
Gambar 5.47. Testis dimasukkan dalam formalin ... 72
Gambar 5.48 .Histologi testis dilihat di bawah mikroskop ... 72
Gambar 5.49. Perhitungan jumlah sel spermatosit pakiten ... 72
Halaman
Lampiran 1. Hasil Determinasi Tanaman ... 58
Lampiran 2. Surat Keterangan Tikus ... 59
Lampiran 3. Alur Penelitian ... 60
Lampiran 4. Perhitungan Dosis Ekstrak Daun Pacing ... 62
Lampiran 5 Hasil Penapisan Fitokimia Ekstrak Etanol 70% Daun Pacing ... 64
Lampiran 6. Perhitungan Rendemen, Kadar Air dan Kadar Abu ... 66
Lampiran 7. Gambar Kegiatan Penelitian ... 67
Lampiran 8. Rerata Berat Badan Tikus ... 73
Lampiran 9. Hasil Perhitungan Konsentrasi Spermatozoa ... 75
Lampiran 10. Analisis Statistik Data Konsentrasi Spermatozoa ... 76
Lampiran 11. Perhitungan Morfologi Spermatozoa ... 79
Lampiran 12. Analisis Statistik Data Morfologi Spermatozoa ... 80
Lampiran 13. Pengukuran Konsentrasi Testosteron ... 84
Lampiran 14. Analisis Statistik Data Konsentrasi Testosteron ... 86
Lampiran 15. Perhitungan Jumlah Spermatosit Pakiten ... 94
BAB I PENDAHULUAN
1.1 Latar Belakang
Keluarga Berencana (KB) merupakan salah satu program yang digalakkan
pemerintah untuk menekan laju pertumbuhan penduduk Indonesia. Kondisi
kependudukan saat ini membutuhkan penurunan jumlah penduduk lebih besar dari
sebelumnya (Tuti Nuraini, 2012). Berdasarkan Kementerian Kesehatan RI (2014),
diketahui bahwa pertumbuhan penduduk Indonesia tahun 2013 sejumlah 248,4
juta orang. Angka fertilitas atau total fertiity rate (TFR) di Indonesia yaitu 2,6
dimana Indonesia berada diatas rata-rata angka antifertilitas negara ASEAN yaitu
2,4. Keberhasilan KB sangat terkait dengan penggunaan kontrasepsi. Faktor
penyebab kurangnya keikutsertaan pria dalam kontrasepsi antara lain kurangnya
pilihan jenis kontrasepsi pria yang memenuhi persyaratan (Tuti Nuraini,2012).
Hasil penelitian Dahliana (2009), sebagian besar responden masih mempunyai
sikap negatif terhadap kontrasepsi pria khususnya kondom. Sebagian besar
responden mengatakan bahwa pemakaian kondom merupakan hal yang tidak
mudah, mudah bocor, dan menyebabkan alergi.
Sediaan antifertilitas yang bersumber dari alam yang pernah di uji adalah
pil kontrasepsi laki-laki dengan bahan dasar gandarusa (Justicia gendarussa Burm F.) dan tablet ekstrak Gossypium herba (Handayani, 2007; Rudiawati , 2006).
Indonesia memiliki sumber daya alam yang luas. Sumber daya alam ini dapat
menunjang masyarakat Indonesia dalam bidang kesehatan. Obat herbal lebih
dipercayai oleh sebagian masyarakat Indonesia dibandingkan obat sintetik.
Keuntungan Indonesia yang memiliki banyak sumber daya alam yang luas
termasuk tanaman-tanaman yang dilaporkan memiliki efek antifertilitas yang
dapat dikembangkan sebagai obat kontrasepsi adalah Kapas (Countinho, 2002).
Di Indonesia beberapa tanaman juga diteliti sebagai calon obat kontrasepsi antara
lain Pepaya, Gandarusa, Pare dan Pacing (Sari, 2013).
Menurut Asosiasi Herbalis Nusantra (2015), tanaman pacing terdiri dari tiga
spesies yaitu Costus spiralis, Costus speciosus, dan Costus megalobrachtea.
kembung, antibakteri, dan antiurolithiatic (Perez, 2008). Berdasarkan
etnofarmakologi, tanaman pacing Costus speciosus secara empiris digunakan oleh
masyarakat sebagai kontrasepsi tradisional, contohnya di Pulau Wawonii
Sulawesi Tenggara. Daun pacing (Costus speciosus) digunakan untuk KB dan
perawatan pasca persalinan dengan cara direbus (Rahayu dkk, 2006).
Senyawa kimia yang diduga mampu bersifat antispermatogenesis adalah
diosgenin yang terdapat pada beberapa bagian tanaman pacing. Aglikon diosgenin
(saponin) merupakan bahan utama untuk memproduksi hormon steroid dan
merupakan prekusor hemisintetis pil kontrasepsi (P.S.Shajeela dkk, 2011).
Saponin pada Costus spiralis dapat terditeksi menggunakan pelarut etanol dan air
(Verma, 2012). Costus spiralis mengandung alkaloid, fenol, tanin, flavon, xanton,
flavonoid, flavonol, flavononols, flavonon, dan saponin (Britto,2011; Asmaliyah,
2010). Alkaloid dan tanin memiliki efikasi untuk antifertilitas dan ditemukan aktif
untuk aktivitas respon estrogen dan memiliki aktivitas kontrasepsi. Diosgenin
merupakan prekusor progesteron yang dapat meningkatkan level plasma
progesteron di dalam darah melalui mekanisme umpan balik negatif yang dapat
menghambat pertumbuhan folikel telur pada tikus betina. (Adnan dan Halifah P.,
2000).
Penelitian aktivitas antifertilitas daun pacing Costus spiralis belum pernah
dilakukan sebelumnya. Penelitian yang pernah dilakukan adalah penelitian aktivitas spermatozoa daun pacing Costus speciosus yang dilakukan Sari (2013)
menggunakan metode infusa 10%. Pada penelitian tersebut daun Costus speciosus
diberikan kepada mencit jantan dengan pemberian oral dosis 275, 550 dan
1.100mg/kg BB selama 14 hari. Penelitian Adnan (2000) tentang pengaruh
ekstrak etanol 50% rimpang pacing Costus speciosus terhadap antifertilitas
dengan dosis 25, 50, dan 75mg/kgBB pada mencit jantan selama 18 hari. Hasil
penelitian Sari (2013) telah menunjukkan bahwa infusa 10% daun pacing Costus
speciosus mampu menurunkan jumlah spermatozoa 16-38%, tetapi tidak
mengubah viabilitas maupun terjadinya abnormalitas morfologi spermatozoa
secara bermakna. Hasil penelitian Adnan (2000) menunjukan bahwa ekstrak
etanol 50% rimpang pacing Costus speciosus dapat menurunkan berat testis,
Peneliti mencoba untuk menggali dan memperlihatkan aktivitas
antifertilitas pada reproduksi tikus galur Sprague-Dawley jantan dengan
pemberian daun pacing (Costus spiralis) dengan metode maserasi etanol 70 %
dalam pengujian. Pemberian ekstrak etanol 70% daun pacing (Costus spiralis)
dilakukan selama 48 hari.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah dipaparkan diatas, maka dapat
diambil rumusan masalah sebagai berikut:
Apakah ada pengaruh pemberian ekstrak etanol 70% daun pacing (Costus
spiralis) terhadap konsentrasi testosteron, konsentrasi spermatozoa, morfologi
sperma, dan jumlah spermatosit pakiten pada tikus Sprague-Dawley jantan secara
in vivo?
1.3 Tujuan Penelitian 1.3.1 Tujuan Umum
Untuk menguji aktivitas antifertilitas ekstrak etanol 70% daun pacing
(Costus spiralis) pada tikus Sprague-Dawley jantan
1.3.2 Tujuan Khusus
a. Untuk menguji apakah ekstrak etanol 70% daun pacing (Costus spiralis) dapat menurunkan konsentrasi spermatozoa pada tikus pada tikus
Sprague-Dawley jantan
b. Untuk menguji apakah ekstrak etanol 70% daun pacing (Costus spiralis)
dapat meningkatkan abnormalitas spermatozoa pada tikus pada tikus
Sprague-Dawley jantan
c. Untuk menguji apakah ekstrak etanol 70% daun pacing (Costus spiralis)
dapat menurunkan konsentrasi testosteron pada tikus pada tikus
Sprague-Dawley jantan
d. Untuk menguji apakah ekstrak etanol 70% daun pacing (Costus spiralis)
dapat menurunkan jumlah spermatosit pakiten pada tikus Sprague-Dawley
1.4 Hipotesis
a. Ekstrak etanol 70% daun pacing (Costus spiralis) dapat menurunkan
konsentrasi spermatozoa pada tikus pada tikus Sprague-Dawley jantan
b. Ekstrak etanol 70% daun pacing (Costus spiralis) dapat meningkatkan
abnormalitas spermatozoa pada tikus pada tikus Sprague-Dawley jantan
c. Ekstrak etanol 70% daun pacing (Costus spiralis) dapat menurunkan
konsentrasi testosteron pada tikus pada tikus Sprague-Dawley jantan
d. Ekstrak etanol 70% daun pacing (Costus spiralis) dapat menurunkan
jumlah spermatosit pakiten pada tikus pada tikus Sprague-Dawley jantan
1.5 Manfaat Penelitian
Manfaat penelitian uji aktivitas antifertilitas ekstrak etanol 70% daun
pacing (Costus spiralis) terhadap konsentrasi testosteron, konsentrasi
spermatozoa, morfologi sperma, dan jumlah spermatosit pakiten pada tikus jantan
BAB II
TINJAUAN PUSTAKA
2.1 Tinjauan Botani Tanaman Pacing 2.1.1 Klasifikasi Tanaman
Menurut Asosiasi Herbalis Nusantara (2015), klasifikasi botani tanaman
pacing adalah sebagai berikut :
Kingdom : Plantae (tumbuh-tumbuhan)
Divisi : Spermatophyta
Sub-divisi : Angiospermae
Kelas : Monocotyledonae
Ordo : Zingiberales
Famili : Zingiberaceae
Genus : Costus
Spesies : Costus spiralis (Jacq) Roscoe.
Gambar 2.1. Daun Pacing (Costus spiralis) (Asosiasi
2.1.2 Nama Daerah (Asosiasi Herbalis Nusantara, 2015)
Di Indonesia tanaman Costus spiralis dikenal dengan beberapa nama daerah
yaitu pacing (Jawa dan Sunda), dan sitawar (Sumatera).
2.1.3 Deskripsi Tanaman (Asosiasi Herbalis Nusantara (2015)
Habitus berupa semak tegak, tinggi 1-1,5m. Batang tegak, slindris, tidak
bercabang, lunak, batang dalam tanah membentuk rimpang, dan hijau pucat. Daun
tunggal, berseling, bulat telur, berpelepah, tepi rata, ujung meruncing, pangkal
tumpul, panjang 7-13cm, lebar 3,5-5 cm, pertulangan melengkung, dan hijau
pucat. Bunga majemuk, bentuk tandan, di ujung batang, kelopak lonjong, ungu,
benang sari panjang 3-5cm, putih, kepala putik bentuk corong, putih keunguan,
mahkota bentuk tabung, panjang ± 7cm, dan putih. Buah kotak, bulat, diameter +
1,5mm, dan merah. Biji persegi, diameter ± 0,5mm, dan hitam. Akar serabut,
putih.
2.1.4 Keanekaragaman Tanaman
Costus spiralis merupakan tanaman obat yang ditemukan di negara Amerika
Selatan (Britto, 2011). Zingeberaceae merupakan familia dari 52 jenis dan lebih
dari 1.300 spesies yang tersebar di Afrika, Asia, dan Amerika (Pawar,
2014).Menurut Djufri (2013), hasil penelitian yang berhasil ditemukan sebanyak 41 tumbuhan kelompok herba pada kawasan Rawa Gambut Tripa Provinsi Aceh
salah satunya adalah Costus spiralis.
2.1.5 Kandungan Kimia Daun Pacing (Costus spiralis)
Analisis fitokimia menunjukkan tanaman pacing (Costus spiralis)
mengandung alkaloid, fenol, tanin, flavon, xanton, flavonoid, flavonol,
2.1.6 Khasiat dan Kegunaan
Berdasarkan Natural Standard (2015), genus Costus merupakan salah satu
sember penghasil diosgenin yang dapat mempengaruhi efek antifertilitas. Manfaat
tanaman pacing (Costus spiralis) menurut Perez (2008); Asosiasi Herbalis
Nusantara (2015)sebagai berikut:
1. Obat diare
2. Obat perut kembung
3. Antibakteri
4. Antiurolithiatic
2.1.7 Penelitian Tanaman Pacing (Costus speciosus)
Penelitian yang pernah dilakukan adalah penelitian aktivitas spermatozoa
daun pacing Costus speciosus yang dilakukan Sari (2013) menggunakan metode
infusa 10%. Pada penelitian tersebut infusa 10% daun Costus speciosus diberikan
kepada mencit jantan dengan pemberian oral dosis 275, 550 dan 1.100mg/kg BB
selama 14 hari. Hasil penelitian menunjukkan bahwa infusa 10% daun pacing
Costus speciosus mampu menurunkan jumlah spermatozoa 16-38%, tetapi tidak
mengubah viabilitas maupun terjadinya abnormalitas morfologi spermatozoa
secara bermakna. Pada dosis 275 dan 375mg/kgBB infusa daun pacing (Costus speciosus) dapat menurunkan motilitas spermatozoa sebesar 36-39%.
Kemampuan infusa daun pacing (Costus speciosus) bersifat reversibel (Sari,
2013). Penelitian Adnan (2000) tentang pengaruh ekstrak etanol 50% rimpang
pacing Costus speciosus terhadap antifertilitas dengan dosis 25, 50, dan
75mg/kgBB pada mencit jantan selama 18 hari. Hasil penelitian Adnan (2000)
menunjukan bahwa ekstrak etanol 50% rimpang pacing Costus speciosus dapat
menurunkan berat testis, epididimis dan berpengaruh nyata terhadap jumlah
produksi sperma
Penelitian Kariardi (1996), uji toksisitas akut dari infusa rimpang pacing
dilakukan melalui parameter LD50 pada mencit betina secara intraperitoneal.
Hasil penelitian dan perhitungan dengan Thompson dan Weil diperoleh harga
LD50 = 2,0561g/kgBB dan interval kepercayaan 1,6793 g/kgBB sampai
interval kepercayaan 1,6025g/kgBB sampai 2,4975g/kgBB. Harga LD50 infusa
rimpang pacing masuk dalam kategori praktis tidak beracun.
2.2 Sistem Reproduksi Tikus Jantan
Tikus merupakan salah satu hewan penelitian yang paling banyak digunakan
dalam fisiologi reproduksi. Testis tikus jantan terdapat pada dua kantung skortum
yang dipisahkan oleh membran tipis yang terletak antara anus dan preputium.
Testis tersebut turun dari hari ke 30-40 masa hidupnya dari rongga perut ke
kantung skortum melalui kanalis inguinal terbuka. Jarak dubur kelamin pada tikus
jantan lebih jauh daripada betina (Suckow,2006). Testis terdiri dari tubulus
seminiferus yang panjang dan berkelok-kelok, yang pada epitelnya merupakan
tempat berlangsungnya spermatogenesis. Ujung dari tubulus seminiferus ini
kemudian bermuara menuju epididimis (Barret et al, 2010).
Gambar 2.2 Penampang Ventral Sistem Urogenital Tikus Jantan
(Suckow,2006)
Pada mamalia, spermatozoa setelah meninggalkan testis melalui saluran
panjang menuju epidididimis dimana terjadinya perkembangan motilitas secara
potensial dan terjadinya pembuahan ovum (Breed B., 2007). Epididimis terdiri
dari tiga bagian yaitu kaput epididimis yang membesar di ujung proksial pada Kidney
Ureter
Coagulation Gland Vesicular Gland
Ampullary Gland Prostate Gland
Cowfers Gland
Urinary Bladder
Preputial Gland Vas Deferens
Urethra
Corpus Epididymis Caput Epididymis
Testis
testis, yang terdapat di sekitar dorsomedial testis serta kauda epididmis pada ujung
distal testis, merupakan tempat pematangan spermatozoa, yang kemudian
bermuara ke vas deferens (Suckow, 2006).
Menurut Harvad-MIT Division of Health Science and Technology (1979),
Sperma di dalam vas deferens yang diikuti dengan sekresi vesikel seminal karena
sperma keluar melalui prostat dengan bantuan saluran ejakulasi ke uretra. Tubulus
seminiferus terdiri atas sel Sertoli dan sel germinal. Tight junction antara sel
Sertoli membentuk barier blood-testis, dan memisahkan epitelium germinal
menjadi dua bagian yaitu kompartemen basal dan adluminal. Hanya sel germinal
yang belum berkembang terlihat pada kompartemen basal, sedangakan sel yang
sudah berkembang terdapat pada kompartemen adluminal. Fungsi sel Sertoli
termasuk memberikan nutrisi sel germinal, melepaskan sel germinal yang sudah
matang ke dalam lumen, translokasi perkembangan sel germinal pada adluminal
direction, sekresi ikatan protein androgen, transferin, penghambat, komunikasi
sel-sel melalui gap junctions untuk mengkoordinasikan spermatogenesis, dan
barier blood-testis. Sel Sertoli mengandung aromatase, yaitu enzim yang berperan
dalam perubahan androgen menjadi estrogen (Barret et al, 2010).
Menurut Harvad-MIT Division of Health Science and Technology (1979)
Sel Leydig pada interstinum testis antara tubulus seminiferus dan mempunyai
fungsi untuk memproduksi testosteron untuk tujuan lokal dan jauh (distant). Distant effect dari testesteron yaitu termasuk pematangan jaringan reproduksi
internal dan eksternal (dengan bantuan metabolit DHT ataupun tidak), purbetas
yang mengubah suara menjadi rendah, bentuk rambut pada muka dan seterusnya,
dan aksi CNS mempengaruhi libido dan kegiatan seksual. Efek lokal muncul
untuk menstimulasi dan membantu fungsi sel Sertoli untuk mengembangkan sel
germinal. Testosteron berikatan dengan ikatan protein androgen yang disekresi
oleh sel Sertoli ke dalam testis, dan sirkulasi menggunakan afinitas plasma
globulin yang tinggi (testosteron berikatan dengan globulin).
2.2.1 Spermatozoa
Proses produksi spermatozoa di dalam testis disebut spermatogenesis.
termasuk manusia dan hewan domestik pada umumnya (Krinke, 2000).
Morfologi sperma tikus diperlihatkan pada gambar 2.3 Kepala sperma tikus
berbentuk kait, seperti pada hewan pengerat lainnya (Gambar 2.4).
Gambar 2.3 Morfologi Sperma Tikus (Fauzi,2009).
Gambar 2.4 Spermatozoa pada Perbesaran 400x
Sumber : Rat Sperm Morphological Assesment, Guideline Document
Ed.1. Oktober 2000.
2.2.2 Spermatogenesis
Spermatogenesis merupakan proses sel germinal yang belum matang
bediferensasi dan bermeoisis menjadi haploid. Spermatogenesis terjadi pada
tubulus seminiferus testis yang dinduksi dengan sel somatik epitelium sel
seminiferus, dan sel Sertoli. Hasil dari spermatogenesis, spermatid yang sudah
mengalami pematangan dikeluarkan oleh sel Sertoli ke dalam lumen tubulus
seminiferus (Knobil,2006). Spermatogenesis pada tikus terdiri dari 3 fase yaitu
mitosis, meiosis dan spermiogenesis (Hess, 1999). Pada tikus perkembangan
spermatogenium, spermatosit atau spermatid saling terintergrasi dan terorganisasi
dengan baik pada daerah yang sama dalam tubulus. Siklus epitel seminiferus
dengan asosiasi sel yang jelas disebut “stage of the cyle” yang dilambangkan
dengan huruf romawi I-XIV dan spermiogenesis dibagi atas 1-19 tahap (Krinke,
2000).
Spermatogenium secara garis besar diklasifikasikan ke dalam tiga jenis: tipe
A, tipe intermediet dan tipe B. tipe spermatogonia tipe A ini dibagi menjadi tipe
membran basal di tubulus seminiferus dan memiliki kemampuan untuk membelah
mejadi dua sel anak, salah satunya menjadi spermatogonium A1, yang seterusnya
lebih lanjut dalam proses spermatogenesis, sedangkan yang lainnya sebagai sel
induk. Pada tikus, spermatogonium AI kemudian memiliki enam pembelahan
mitosis, dan kemudian mereka menjadi spermatosit prelepton. Spermatosit dalam
fase meiosis, dimana berkembang menjado leptolene, zygoten dan pakiten untuk
menjadi spermatosit sekunder di komponen adluminal dari sel Sertoli dalam
tubulus seminiferus. Selama fase meiosis, masing-masing spermatosit membelah
menjadi satu dari empat spermatid haploid, yang kemudian memasuki fase
akrosom. Kondensasi inti dan perpanjangan terjadi berikutnya, diikuti oleh fase
eliminasi dan pelepasan sitoplasma.
Pada tikus, 14 tahapan siklus spermatogenesis terjadi di dalam tubulus
seminiferus. Tubulus memiliki susunan ruas, dan setiap potongan melintang
tubula menunjukkan tahapan yang seragam yang melibatkan empat atau lima
generasi di sel germinal dengan sesuai. Tubulus seminiferus di tikus
dikarakterisasi oleh struktur ruas, sedangkan pada manusia dan hewan domestik
lainnya biasanya menunjukkan pola mosaik dibeberapa tahap. Pada tikus,
dibutuhkan 12 hari untuk menyelesaikan satu siklus yang terdiri dari 14 tahap.
Spermatogenium tikus membutuhkan empat siklus sampai akhirnya membentuk
Gambar 2.5 Siklus Spermatogenesis pada Tikus
Tahapan siklus sel dalam spermatogenesis tikus dimulai searah jarum jam
dan kiri bawah A, spermatogenium tipe A; In, spermatogenium tipe intermediate,
B, spermatogenium tipe B; R, resting spermatosit primer, L, Leptotene
sprmatosit; Z, zygotene sprmatosit; P (I), P (VII), P (XII), awal pertengahan dan
akhir spermatsit pakiten. Angka romawi menunjukkan tahap siklus dimana
mereka ditemukan; DI, diplotene; II, spermatosit sekunder; 1-19,
langkah-langkah spermatogenesis. Tabel di tengah memberikan komposisi seluler tahapan
siklus epitel seminiferus (I-XIV). M, superscipt mengindikasikan terjadinya
mitosis. Di adaptasi dari Clermount dengan sedikit modifikasi (1962)
(Krinke,2000).
2.3 Hormon yang Mempengaruhi Spermatogenesis
Proses spermatogenesis dipengaruhi oleh hormon-hormon yang dihasilkan
oleh hipotalamus, hipofisis dan testis sendiri. Hormon yang terlibat adalah
Stimulating Hormone), estrogen, dan hormon pertumbuhan lainnya. Testis selain
sebagai organ penghasil sperma juga menghasilkan hormon-hormon seperti
testosteron, dihidrotestosteron, estradiol, progesteron dan lain-lain (Speroff, Glaa
RH, Kase NG, 1999).
a. Testosteron
Sekresi hormon ini oleh sel-sel Leydig yang terletak di intersisium testis.
Hormon ini memegang peranan penting yaitu satu tahap penting dalam proses
pembelahan sel-sel germinal untuk pembentukan sperma, terutama pembelahan
miosis untuk membentuk spermatosit sekunder. Hormon ini mengontrol
perkembangan organ reproduksi pria dan tanda seks sekunder pada pria berupa
pembesaran laring, perubahan suara, pertumbuhan rambut ketiak, pertumbuhan
otot tulang dan sebagainya (Speroff, Glaa RH, Kase NG, 1999).
Gambar 2.6 Testosteron (Goodman and Ghilman, 2006)
b. Hormon Lutein (LH)
Hormon ini disekresikan oleh sel bagian anterior. LH pada sel Leydig
menstimulasi sintesis androgen melaui jalur de novo, khususnya testosteron dari
kolesterol (Speroff, Glaa RH, Kase NG, 1999; Goodman and Ghilman, 2006).
Reseptor LH dan FSH menunju Gs mengaktivasi siklus adenilil siklase melalui
theca unruk menstimulasi sintesis androstenedion melaui jalur de novo.
Androstenedion merupakan perekusor 17β-estradiol pada wanita premenopause (Goodman and Ghilman, 2006).
c. FSH (Follicle Stimulating Hormone)
Tempat kerja utama FSH pada epitel seminiferus ada di dalam sel Sertoli.
FSH dikirim ke daerah interstisial testis melalui arteriol kecil. Kemudian FSH
berdifusi melalui membran basal tubulus seminiferus dan berikatan dengan
reseptor membran plasma spesifik pada sel Sertoli. Aktivitas reseptor FSH
menyebabkan terjadinya sintetis reseptor androgen intraseluler dan protein
pengikat androgen (androgen binding protein, ABP). ABP disekresikan oleh sel
Sertoli dan mengikat androgen yang telah diproduksi oleh sel Leydig dan
berdifusi dari tempat produksinya di interstisial ke dalam tubulus seminiferus.
ABP mentransfer androgen-androgen ini ke sel germinal. Androgen akan ditahan
di dalam sel germinal promeiotik yang mengandung reseptor androgen. Setelah
FSH memulai spermatogenesis, proses ini akan berlangsung terus selama
persediaan testosteron cukup dan terus-menerus (Heffner, 2006). FSH juga
mengatur aktivitas aromatase pada sel granulosa yang menstimulasi produksi 17β -estradiol (Goodman and Ghilman, 2006).
d. Estrogen
Dibentuk oleh sel-sel Sertoli ketika sedang di stimulasi oleh FSH. Hormon ini kemungkinan diperlukan pada proses spermiasi. Sel-sel Sertoli juga
mengekskresikan suatu protein androgen. Yang mengikat baik testosteron dan
estrogen maupun keduanya ke dalam cairan tubulus seminiferus, yang diperlukan
untuk maturasi sperma (Speroff, Glaa RH, Kase NG, 1999).
e. Hormon pertumbuhan lainnya
Seperti juga pada sebagian hormon lainnya diperlukan untuk mengatur latar
belakang fungsi metabolisme testis. hormon pertumbuhan secara khusus
meningkatkan pembelahan awal spermatogenesis (Speroff, Glaa RH, Kase NG,
2.4 Karakteristik Tikus Sprague-Dawley
Sprague Dawley adalah sejenis spesies tikus. Tikus Sprague Dawley dipilih
karena ia mempunyai sifat yang tenang dan mudah dikendalikan dibandingkan
dengan jenis-jenis lain (Fauzi Mohd, 2009). Jumlah anak rata-rata 6-12 ekor
dengan berat 5-6 gram saat lahir (SAGE®Labs, 2015). Berat tikus adalah 250-300 gram (betina); 450-520 gram (jantan). Rentang hidup 2,5-3,5 tahun. Laju
pernafasan: 70-115 nafas/menit. Denyut jantung: 250-450 denyut/ menit. Gigi seri
open-rooted dan tumbuh terus-menurus. (SAGE®Labs, 2015).
Rekomendasi diet: DietLab #5R24 (RMH2500) tikus sebaiknya diberi
makanan tikus atau rodent komersial dan air ad lib. Pola diet ini adalah nutrisi
lengkap dan tidak memerlukan suplemen. Asupan makanan sekitar
5g/100gBB/hari, asupan air sekitar 10-12 ml/100 BB/ hari (SAGE®Labs, 2015).
2.5 Simplisia
2.5.1 Definisi Simplisia (Depkes RI, 2000)
Simplisia adalah bahan alami yang digunakan untuk obat dan belum
mengalami perubahan proses apapun, dan kecuali dinyatakan lain umumnya
beruapa bahan yang telah dikeringkan. Simplisia tumbuhan obat merupakan bahan
baku proses pembuatan ekstrak, baik sebagai bahan obat atau produk.
Berdasarkan hal tersebut maka simplisia dibagi menjadi tiga golongan yaitu simplisia nabati, simplisia hewani, dan simplisia pelikan atau mineral.
1. Simplisia nabati
Simplisia nabati adalah simplisia berupa tanaman utuh, bagian tanaman dan
eksudat tanaman. Eksudat tanaman adalah isi sel yang secara spontan keluar dari
tanaman atau isi sel dikeluarkan dari selnya dengan cara tertentu atau zat yang
dipisahkan dari tanaman dengan cara tertentu yang masih belum berupa zat kimia
murni.
2. Simplisia Hewani
Simplisia hewani adalah simplisia hewan utuh, bagian hewan, atau belum
3. Simplisia mineral
Simplisia mineral adalah simplisia berasal dari bumi, baik telah diolah atau
belum, tidak berupa zat kimia murni.
2.5.2 Pengelolaan Simplisia (Agoes, 2007; T.E. Wallis, 1960) a. Pengumpulan Sampel
Tahap pengumpulan atau tahap pemanenan terkadang dianggap sebagai
suatu hal yang dihiraukan. Padahal, tahap ini merupakan tahap yang sangat
menentukan untuk mendapatkan simplisia dengan kualitas yang memenuhi
standar. Terdapat beberapa faktor yang perlu diperhatikan dalam pemanenan suatu
simplisia nabati:
i. Bagian tanaman yang dipanen
ii. Waktu pemanenan
iii. Cara pemanenan
b. Sortasi Basah
Sortasi basah dilakukan unuk memisahkan cemaran dan kotoran dari
simplisia yang baru dipanen. Sortasi ini dapat mengurangi jumlah kontaminasi
mikroba.
c. Pencucian
Dilakukan dengan menggunakan air yang bersih (air sumur, PDAM, air dari mata air). Pencucian secara signifikan mampu mengurangi mikroba yang terdapat
dalam simplisia. Penggunaan air harus diperhatikan . Beberapa mikroba lazim
terdapat di air yaitu: Pseudomonas, Proteus, Micrococcus, Bacillus,
Streptococcus, Enterobacter, serta E.coli pada simplisia akar, batang, atau buah.
Untuk mengurangi jumlah mikroba awal dapat dilakukan pengupasan kulit luar
terlebih dahulu.
d. Perajangan
Dilakukan untuk mempermudah dalam proses pengeringan, pengepakan,
dan penggilingan. Perajangan harus memperhatikan senyawa yang terkandung
dalam simplisia. Untuk lebih amannya, gunakan pisau atau pemotong yang terbuat
e. Pengeringan
Setelah suatu simplisia nabati dipanen, umumnya simplisia tersebut akan
dikeringkan, jika memang tidak akan digunakan secara segar. Pengeringan
merupakan suatu hal yang sangat krusial karena beberapa metabolit sangat rentan
terhadap sinar matahari. Pengeringan berfungsi untuk mengurangi kadar air
hingga kada tertentu, umumnya tidak boleh lebih dari 10%. Dengan berkurangnya
kadar air, diharapkan akan lebih tahan terhadap pertumbuhan kapang serta
kemungkinan reaksi kimia yang diperantarai oleh air, contoh reaksi redoks atau
reaksi enzimatis. Proses pengeringan yang baik dilakukan pada suhu 30°C-90°C
(terbaik 60°C). Namun pada kondisi bahan aktif tidak tahan terhadap panas atau
mengandung bahan yang mudah untuk menguap, dilakukan pada suhu 30°C-45°C
atau dilakukan dengan menggunakan oven vakum. Umumnya, senyawa-senyawa
yang berwarna memiliki kerentanan terhadap sinar matahari.Terdapat beberapa
metode pengeringan yaitu:
a. Pengeringan secara langsung di bawah sinar matahari
Pengeringan dengan metode ini dilakukan pada tanaman yang tidak sensitif
terhadap cahaya matahari. Pengeringan terhadap sinar matahari sangat umum
untuk bagian daun, korteks, biji, serta akar. Bagian tanaman yang mengandung
flavonoid, kuinon, kurkuminoid, karotenoid, serta beberapa alkaloid yang cukup
mudah terpengaruh cahaya, umumnya tidak boleh dijemur di bawah sinar matahari secara langsung. Kadangkala suatu simplisia dijemur terlebih dahulu
untuk mengurangi sebagian besar kadar air, baru kemudian dikeringkan dengan
panas atau digantung di dalam ruangan. Pengeringan dengan menggunakan sinar
matahari secara langsung memiliki keuntungan yaitu ekonomis. Namun lama
pengeringan sangat bergantung pada kondisi cuaca.
b. Pengeringan di ruangan yang terlindung dari cahaya matahari namun tidak lembab
Umumnya dipakai untuk bagian simplisia yang tidak tahan terhadap cahaya
matahari. Pengeringan dengan metode ini harus memperhatikan sirkulasi udara
dari ruangan. Sirkulasi yang baik akan menunjang proses pengeringan yang
optimal. Pengeringan dengan cara ini memiliki keuntungan yaitu ekonomis, serta
Namun demikian, pengeringan dengan cara ini cenderung membutuhkan waktu
yang lama dan jika tidak dilakukan dengan baik, akan mengakibatkan tumbuhnya
kapang.
c. Pengeringan dengan menggunakan oven
Pengeringan menggunakan oven, umumnya akan menggunakan suhu antara
30°-90°C. Terdapat berbagai macam jenis oven, tergantung pada sumber panas.
Pengeringan dengan menggunakan oven memiliki keuntungan berupa: waktu
yang diperlukan relatif cepat, panas yang diberikan relatif konstan. Kekurangan
dari teknik ini adalah biaya yang cukup mahal.
2.6 Ekstrak dan Metode Ekstraksi 2.6.1 Definisi Ekstrak
Ekstrak menurut Farmakope Edisi III adalah sediaan kering, kental atau
cair dengan menyari simplisia nabati atau hewani menurut cara yang cocok, di
luar pengaruh cahaya langsung.
2.6.2 Metode Ekstraksi (BPOM RI, 2010; Depkes RI, 2000) Cara Panas
a. Infus
Infus adalah sediaan cair yang dibuat dengan cara mengekstraksi simplisia
nabati dengan air pada suhu 90oC selama 15 menit.
b. Dekokta
Dekok adalah sediaan cair yang dibuat dengan mengekstraksi sediaan herbal
dengan air pada 90 oC selama 30 menit.
c. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu
pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
d. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang
umunya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan
ditempatkan dalam wadah soklet yang dibuat dengan kertas saring, melalui alat ini
pelarut akan terus direfluks, alat soklet akan mengkosongkan isinya ke dalam labu
dasar bulat setelah pelarut mencapai kadat tertentu. Setelah pelarut segar melewati
alat ini melalui pendingin refluks, ekstraksi berlangsung sangat efisien dean
senyawa dari biomasa secara efektif ditarik ke dalam pelarut karena konsentrasi
awalnya rendah dalam pelarut.
e. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur
40-50oC.
f. Destilasi Uap
Destilasi uap adalah ekstraksi senyawa kandungan menguap (minyak atsiri)
dari bahan (segar atau simplisia) dengan uap air berdasarkan peristiwa tekanan
parsial senyawa kandungan menguap dengan fase uap air dari ketel secara kontinu
sampai sempurna diakhiri dengan kondensasi uap campuran (senyawa kandungan
menguap ikut terdestilasi) menjadi destilat air bersama senyawa kandungan yang
memisah sempurna atau memisah sebagian.
Destilasi uap, bahan simplisia benar-benar tidak tercelup ke air yang
mendidih, namun dilewati uap air sehingga senyawa kandungan menguap ikut
terdestilasi. Destilasi uap dan air, bahan (simplisia) bercampur sempurna atau dengan air mendidih, senyawa kandungan menguap tetap kontinu ikut terdestilasi.
Cara dingin a. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur
ruangan (kamar). Maserasi bertujuan untuk menarik zat-zat brkhasiat yang tahan
pemanasan maupun yang tidak tahan pemanasan. Secara teknologi maserasi
termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi pada
keseimbangan. Maserasi dilakukan dengan beberapa kali pengocokan atau
Dasar dari maserasi adalah melarutnya bahan kandungan simplisia dari sel
rusak, yang terbentuk pada saat penghalusan, ekstraksi (difusi) bahan kandungan
dari sel yang masih utuh (Voight,1995).
Kerugian metode maserasi yaitu pengerjaanya lama dan penyarian kurang
sempurna. Secara teknologi termasuk ekstraksi dengan prinsip metode pencapaian
konsentrasi pada keseimbangan. Maserasi kinetik berarti dilakukan pengulangan
penambahan pelarut setelah dilakukan penyarian maserat pertama, dan seterusnya
(Depkes RI, 2000; Depkes RI 1995).
b. Perkolasi (Depkes RI, 2000)
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru dan sempurana
(Exhaustiva extraction) yang umumnya dilakukan pada temperatur ruangan.
Prinsip perkolasi adalah dengan menempatkan serbuk simplisia pada suatu bejana
slinder, yang bagian bawahnya diberi sekat berpori. Proses terdiri dari tahap
pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan ekstrak), terus menerus sampai diperoleh ekstrak
(perkolat) yang jumlahnya 1-5 kali bahan.
2.6.3 Proses Pembuatan Ekstrak
Pembuatan ekstrak melalui tahap-tahap sebagai berikut :
a. Pembasahan(Depkes RI 2000)
Pembasahan serbuk dilakukan pada penyarian, dimaksudkan memberikan
kesempatan sebesar-besarnya kepada cairan penyari memasuki pori-pori dalam
simplisia sehingga mempermudah penyarian selanjutnya.
b. Penyari/ Pelarut(Depkes RI 2000)
Cairan penyari yang digunakan dalam proses pembuatan ekstrak adalah
penyari yang baik untuk senyawa kandungan berkhasiat atau aktif. Penyari
tersebut dapat dipisahkan dari bahan dan dari senyawa kandungan lainnya. Faktor
utama yang menjadi pertimbangan dalam pemilihan cairan penyari adalah
selektifitas, ekonomis, kemudahan bekerja, ramah lingkungan dan aman. Sampai
saat ini berlaku aturan bahwa pelarut yang diperbolehkan adalah air, alkohol
c. Pemisahan dan Pemurnian(Depkes RI, 2000)
Tujuannya adalah untuk menghilangkan senyawa yang ridak dikehendaki
semaksimal mungkin tanpa pengaruh pada senyawa kandungan yang dikehendaki,
sehingga diperoleh ekstrak yang lebih murni. Proses-proses pada tahap ini adalah
pengendapan, pemisahan dua cairan tak bercampur, sentrifugasi, dekantasi,
filtrasi, serta poses absropsi dua penukar ion.
d. Pemekatan/penguapan(Depkes RI, 2000)
Pemekatan berarti peningkatan jumlah partikel solut (senywat terlarut)
dengan cara penguapan pelarut tanpa sampai menjadi kering tetapi ekstrak hanya
menjadi kental/pekat.
2.7 ELISA (Enzym Linked Immunosorbent Assay)
ELISA (Enzym Linked Immunosorbent Assay) merupakan suatu tes yang
cepat untuk menditeksi dan kuantifikasi antibodi atau antigen against viruses,
bakteri, dan bahan lainnya. Metode ini dapat digunakan untuk menditeksi infeksi
yang memiliki efek poultry dan livestock (Idexx, 1986).
Teknologi ELISA menggunakan fase padat yang mengandung plat
polistiren 96-well, walaupun penggunaan bahan lain dapat digunakan. Kegunaan
fase padat untuk imobilisasi antigen atau antibodi pada sampel dimana keduanya
dapat terikat pada fase padat. Setelah inkubasi, plate dicuci untuk menghilangkan bahan yang tidak berikatan. Pada beberapa assay konjugat ditambahkan ke dalam
plate dan diperbolehkan untuk diinkubasi (Idexx, 1986).
Konjugat mengandung antigen atau antibodi yang telah diikat dengan
enzim. Pengikatan konjugat degan fase padat atau sampel tergantung pada format
assay. Bagian enzim pada konjugat dapat diditeksi. Plate dicuci kembali dan
substrat enzim (hidrogen peroksida dan kromogen) ditambahkan dan
diperbolehkan untuk dinkubasi. Warna akan terlihat pada ikatan enzim dan
densitas optik dibaca dengan ELISA plate reader (Idexx, 1986). Prinsip-prinsip
ELISA yaitu (Walker, 2008):
a. Penempelan protein terhadap plastics secara pasif.
c. Penambahan antibodi spesifik untuk berikatan dengan enzim pada
beberapa tahap.
d. Penggunaan competing inert protein untuk pencegahan reaksi
nonspesifik dengan plastics.
e. Tahap pencucian untuk memisahkan reagen yang berikatan dengan yang
tidak berikatan.
f. Penambahan substrat spesifik yang memberikan perubahan warna dengan
katalis enzim atau substrat dan colorless chromophore (larutan pewarna)
yang menunjukan pembentukan warna pada katalis enzim.
g. Tahap inkubasi untuk proses reaksi imunologi.
h. Pemberhentiaan katalis enzim.
i. Pembacaan warna dengan spektrofotometer
ELISA terdiri dari tiga sistem yaitu direct ELISA, inderect ELISA,dan
sandwich ELISA. Semua sistem ini dapat digunakan untuk memperlihatkan
kompetisi pengahambatan ELISA (Walker, 2008). Tahap-tahap masing-masing
sistem ELISA yaitu:
a. Direct ELISA(Crowter, 2009)
1. Antigen ditambahkan pada fase padat dan adsorbsi secara pasif pada saat
inkubasi.
2. Setelah inkubasi, antigen yan tidak berikatan dibersihkan dari fase padat. 3. Spesifik antibodi ditambahkan untuk antigen dan berikatan dengan enzim
(konjugat) dan inkubasi.
4. Ikatan konjugasi dengan antigen pada fase padat. Kemudian konjugat
yang tidak berikatan dibersihkan.
5. Substrat atau larutan kromofor dan reaksi katalis enzim ditambahkan
untuk memberikan produk yang berwarna. Reaksi diakhiri pada waktu
yang tepat dan kuantifikasi warna dibaca menggunakan spektrofotmeter.
b. Indirect ELISA(Walker, 2008)
1. Lapiskan wells dengan antigen kemudian diinkubasi.
2. Wells dibersihkan untuk menghilangkan antigen yang tidak berikatan.
3. Antibodi yang berlawanan dengan antigen ditambahkan dan kemudian
4. Antibodi yang tidak bereaksi dibersihkan.
5. Konjugat anti-species ditambahkan dan kemudian diinkubasi.
Substrat / kromofor ditambahkan dan kemudian pembacaan warna yang
tebentuk.
c. Sandwich ELISA(Walker, 2008)
Sandwich direct
1. Wells dilapisi dengan antibodi
2. Wells dicuci
3. Antigen ditambahkan dengan imobilisasi antibodi dan kemudian
diinkubasi
4. Antigen yang tidak bereaksi dibersihkan
5. Antibodi yang sama berikatan dengan enzim atau antibodi yang bebeda
yang berikatan dengan enzim tetapi antibodi yang masih spesifik untuk
mengenali antigen ditambahkan. Dan kemudian diinkubasi.
6. Substrat / kromofor ditambahkan dan kemudian diinkubasi.
Sandwich Inderect
1. Wells dilapisi dengan antibodi.
2. Antibodi yang berlebih dicuci.
3. Antigen ditambahkan dimana antigen dikenali oleh antibodi dan
kemudian diinkubasi. Antibodi yang tidak berikatan dengan antigen dicuci.
4. Antibodi dari spesies berbeda ditambahkan untuk menghasilkan reaksi
dengan antigen. Kemudian diinkubasi. Antibodi yang tidak berikatan
dengan antigen dicuci.
5. Tambahkan konjugat antispesies spesifik yang tidak mengikat antibodi
kedua, dimana hal ini tidak terjadi reaksi dengan antibodi yang ada di
well. Kemudian di inkubasi. Konjugat antispesies yang tidak berikatan
dicuci.
6. Sistem substrat / kromofor ditambahkan.
BAB III
METODE PENELITIAN
3.1 Waktu dan Lokasi Penelitian
Penelitian dilaksanakan pada bulan November 2014 hingga April 2015.
Pembuatan ekstrak dilakukan di Laboratorium Farmakognosi dan Fitokimia,
penapisan fitokimia di Laboratorium Kimia Obat, pengujian parameter di
Laboratorium Penelitian II dan Laboratorium Riset, pemeliharaan dan perlakuan
hewan uji di Animal House (AH) Fakultas Kedokteran dan Ilmu Kesehatan,
Universitas Islam Negeri Syarif Hidayatullah Jakarta, pembuatan histologi di
Laboratorium Histologi Universitas Indonesia serta pemakaian freeze dry di
Laboratorium Fitokimia Universitas Indonesia.
3.2 Alat dan Bahan 3.2.1 Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah blender (Philips),
timbangan analitik (AND GH-202 dan Wiggen Hauser), botol maserasi, vacum
rotary evaporator (EYELA), erlenmeyer, beaker glass, batang pengaduk, spatula,
kertas saring, kapas, corong gelas, tabung reaksi, pipet tetes, cawan penguap,
botol timbang, kurs silikat, oven (Memmert), tanur (Thermo Scientific), freeze dry, alumunium foil, timbangan, kandang tikus beserta tempat makanan dan
minuman, sonde oral, syringe, wadah pembiusan, alat bedah minor, kaca objek
dan cover glass, mikropipet (Eppendrof Research Plus), Effendrof tube,
centrifuge, vortex, mikroskop cahaya (Motic dan Epson), Hemositometer
Improved Neubaurer (NESCO), Freezer, water bath, desikator, dan ELISA
reader.
3.2.2 Bahan Penelitian
Bahan uji yang digunakan dalam penelitian adalah ekstrak daun pacing
(Costus spiralis). Daun pacing yang digunakan diperoleh dari Mega Mendung
dideterminasi di Pusat Konservasi Tumbuhan Kebun Raya, LIPI Bogor untuk
menentukan kebenaran bahan uji.
Bahan kimia yang digunakan dalam penelitian adalah etanol70%, pereaksi
untuk penapisan fitokimia (HCl 2N, HCl pekat, Aquadest, Pereaksi
Libermann-Bouchard, Pereaksi Bouchard LP, Pereaksi Mayer LP, Pereaksi Dragendorf LP,
Etil Asetat, asam sulfat (H2SO4) pekat, Asam Asetat Anhidrat, Serbuk Magnesium
P, Kit ELISA, FeCl3 0,1%, Kloroform, dan eter). Natrium kabonil metil selulosa
untuk penyiapan suspensi zat aktif. Penyiapan sperma (normal saline water);
larutan George; NaCl fisiologis; larutan Eosin Y 1%, larutan Xilol, Larutan Bouin
(asam pikrat, formaldehid 4%, asam asetat), larutan benzoil, benzoat, dan Larutan
Hematoksilin.
3.2.3 Hewan Uji
Hewan uji yang akan digunakan dalam penelitian ini adalah tikus putih
jantan strain Sprague Dawley yang sehat dan fertil 2,5-3 bulan dengan berat badan
250-350 gram yang diperoleh dari Animal Facility and Modeling Provider Insitut
Pertanian Bogor (IPB).
3.3 Rancangan Peneiltian 3.3.1 Besar Sampel
Penelitian ini bersifat eksperimental yang terbagi dalam 4 kelompok
perlakuan yang masing-masing kelompok terdiri dari 5 ekor tikus putih jantan
strain Sparague Dawley (WHO,2000).
3.3.2 Dosis Perlakuan
Dosis yang digunakan 12,5mg/kgBB, 25mg/KgBB, dan 37,5mg/KgBB.
Perhitungan dosis yang diberikan dapat dilihat dari lampiran 3. Pemberian ekstrak
Tabel 3.1. Rancangan Percobaan
I (Kontrol) 5 Tikus diberikan suspensi Natrium CMC 0,5%
sebanyak ±1ml
48 hari i. Darah dari vena lateral ekor (testosteron serum) ii. Sperma dikeluarkan
dari Kauda epididimis
II (Dosis Rendah)
5 Tikus diberikan ekstrak daun pacing (Costus
spiralis) sebanyak 12,5mg/KgBB
48 hari i. Darah dari vena lateral ekor (testosteron serum) ii. Sperma dikeluarkan
dari Kauda epididimis
III (Dosis sedang)
5 Tikus diberikan ekstrak daun pacing (Costus
spiralis) sebanyak 25mg/KgBB
48 hari i. Darah dari vena lateral ekor (testosteron serum) ii. Sperma dikeluarkan
dari Kauda epididimis
IV Dosis tinggi)
5 Tikus diberikan ekstrak daun pancing (Costus
spiralis) sebanyak 37,5mg/KgBB
48 hari i. Darah dari vena lateral ekor (testosteron serum) ii. Sperma dikeluarkan
dari Kauda epididimis
3.4 Prosedur Kerja
3.4.1 Penyiapan Simplisia dan Pembuatan Ekstrak
Sebanyak 8 kg daun pacing (Costus spiralis) dikumpulkan dan kemudian
dicuci bersih dengan air mengalir dan dikering anginkan. Daun pacing yang telah
kering di haluskan dengan blender hingga menjadi serbuk sebanyak 1 kg dan
diayak dengan ukuran 40 mesh. Kemudian serbuk daun pacing ditimbang dan
dimaserasi dengan menggunakan etanol 70% selama 72 jam kemudian disaring
hingga dihasilkan maserat yang berwarna pucat (mendekati tidak berwarna).
Filtrat yang diperoleh dipekatkan dengan vacuum rotary evaporator dengan suhu
40oC sampai diperoleh ekstrak kental. Apabila ekstrak kental belum didapatkan,
maka dapat dilanjutkan dengan freeze dry dan kemudian ekstrak kental ditimbang.
3.4.2 Penapisan Fitokimia
Pengujian golongan metabolit sekunder dilakukan terhadap golongan:
a. Alkaloid(Depkes RI, 1995)
Sebanyak 100 mg ekstrak dalam tabung reaksi ditambahkan 1ml etanol
70% kemudian ditambahkan 1 ml asam klorida 2N dan 9ml aquades, dipanaskan
di penangas air selama 2 menit, dan didinginkan. Kemudian disaring dan
ditampung filtratnya. Filtrat digunakan sebagai larutan percobaan selanjutnya:
i. Larutan percobaan ditambahkan 2 tetes Dragendrof, terbentuk
endapan jingga coklat (positif alkaloid).
ii. Larutan percobaan ditambahkan 2 tetes Mayer LP, terbentuk
endapan menggumpal putih atau kuning yang larut dalam metanol
(positif alkaloid).
b. Identifikasi Flavonoid(Arifin Helmi, 2006)
Sebanyak 100 mg ekstrak dalam tabung reaksi ditambahkan 1ml etanol 70%
kemudian ditambahkan serbuk Mg, lalu ditambahkan asam klorida pekat. Apabila terbentuk warna orange, merah, atau kuning, berarti positif flavonoid.
c. Identifikasi Terpen(Famsworth,1966)
Sebanyak 100 mg ekstrak dalam cawan penguap ditambahkan 1ml etanol
70% kemudian dilarutkan dalam 5ml eter. Kemudian diuapkan hingga kering.
Larutan pereaksi yang terdiri dari campuran 10 tetes asam asetat anhidrat, dan 5
tetes asam sulfat pekat disiapkan. Kemudian, larutan pereaksi ditambahkan ke
dalam residu. Ekstrak mengandung terpen apabila terbentuk warna
merah-hijau-violet-biru.
d. Identifikasi Tanin (Ramya, B. Shiney dan P. Ganesh, 2012)
Sebanyak 500 mg ekstrak dalam tabung reaksi ditambahkan 2ml etanol 70%
kemudian ekstrak ditambahkan 0,1% FeCl3. Apabila terbentuk warna hijau
e. Identifikasi Saponin(Depkes RI, 1995)
Sebanyak 100 mg ekstrak dalam tabung reaksi ditambahkan 1ml etanol 70%
kemudian ditambahkan 10ml air panas dan didinginkan. Kemudian dikocok
vertikal selama 10 detik dan didiamkan selama 10 menit. Terbentuk buih setinggi
1 cm. Pada penambahan 1 tetes asam klorida 2 N buih tidak hilang.
f. Identifikasi Steroid dan Triterpenoid (Fransworth, 1996)
Sebanyak 100 mg ekstrak dalam tabung reaksi ditambahkan 1ml etanol 70%
kemudian ditambahkan pereaksi Lieberman-Buchard, adanya steroid menunjukan
warna biru-kehijauan sedangkan triterpenoid menunjukkan warna merah, merah
muda, atau ungu.
3.4.3 Pengujian Parameter Spesifik dan Non Spesifik 1. Parameter Spesifik (Depkes RI, 2000)
a. Identitas
Meliputi deskripsi tata nama (nama ekstrak, nama latin tumbuhan, bagian
tumbuhan yang digunakan, nama tumbuhan Indonesia) dan dapat mempunyai
senyawa identitas. Tujuannya untuk memberikan identitas objektif dari nama dan
spesifik dari senyawa identitas.
b. Organoleptik
Meliputi penggunaan panca indra untuk mendeskripsikan bentuk (padat, serbuk-kering, kental, cair, dll), warna (kuning, coklat, dll), bau (aromatic, tidak
berbau, dll), rasa (pahit, manis, kelat, dll). Dengan tujuan untuk pengenalan awal
yang sederhana.
2. Parameter Non Spesifik Ekstrak (Farmakope Herbal, 2009; Depkes RI,2000)
a. Parameter Kadar Air
Pengukuran kandungan air yang berada didalam bahan, dilakukan dengan
cara yang tepat diantara cara titrasi, destilasi atau gravimetrik. Cara kerja
menggunakan gravimetri yaitu masukan 1,5 gram ekstrak dan ditimbang saksama
dalam wadah yang telah ditara. Keringkan pada suhu 105oC selama 5 jam dan
ditimbang. Lanjutkan pengeringan dan timbang setelah 1 jam sampai perbedaan
% Kadar air = � � � � − � � � ℎ�
� � � � 100% b. Kadar abu
Bahan dipanaskan pada temperatur dimana senyawa organik dan turunannya
terdestruksi dan menguap, sehingga menyisakan unsur mineral dan anorganik.
Ditimbang 2 gram ekstrak dengan seksama ke dalam krus yang telah ditara,
dipijarkan perlahan-lahan hingga arang habis, diinginkan dan ditimbang. Jika
dengan cara ini arang tidak dapat dihilangkan, tambahkan air panas, aduk, saring
melalui kertas saring bebas abu. Pijarkan kertas saring beserta sisa penyaringan
dalam krus yang sama. Masukan filtrat ke dalam krus, uapkan dan pijarkan hingga
bobot tetap, timbang. Kadar abu total dihitung terhadap berat bahan uji.
% Kadar Abu Total = � � �
� � � ��
100%
3.4.4 Penyiapan Hewan Uji
Tikus jantan galur Sprague-Dawley diaklimatisasi di Animal House
Fakultas Kedokteran dan Ilmu Kesehatan UIN Jakarta selama 1 minggu.
Diberikan makan dan minum ad libitum. Ekstrak etanol 70% daun pacing (Costus
spiralis) diberikan secara oral menggunakan sonde sekali setiap hari selama 48
hari dengan dosis seperti tertera pada tabel rancangan percobaan (Tabel 3.1).
Dosis yang tertera merupakan hasil konversi dosis 25,50, dan 75 mg/kgBB pada
mencit ke tikus (Adnan, 2000).
1. Kelompok I diberikan suspensi Natrium CMC 0,5%.
2. Kelompok II ekstrak etanol 70% daun pacing 12,5mg/kgBB yang
disuspensikan ke dalam Natrium CMC 0,5%.
3. Kelompok III ekstrak etanol 70% daun pacing 25mg/kgBB yang disuspensikan
ke Natrium CMC 0,5%.
4. Kelompok IV ekstrak etanol 70% daun pacing 37,5mg/kgBB yang
disuspensikan ke dalam Natrium CMC 0,5%.
3.4.5 Pembuatan Preparat
Setelah 48 hari, masing-masing hewan coba dikorbankan untuk diambil