IDENTIFIKASI DAN KARAKTERISASI BEBERAPA VIRUS
YANG MENGINFEKSI TANAMAN ANGGREK DI JAWA
SERTA INDUKSI KETAHANAN SISTEMIK
TANAMAN ANGGREK DENGAN ASAM SALISILAT
IRWAN LAKANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi yang berjudul Identifikasi dan Karakterisasi Beberapa Virus yang Menginfeksi Tanaman Anggrek di Jawa Serta Induksi Ketahanan Sistemik Tanaman Anggrek dengan Asam Salisilat adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun pada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Februari 2012
IRWAN LAKANI. Identification and Characterization of Viruses Infecting Orchids in Java and Induced Systemic Resistance of Orchid Using Salicylic acid. Supervised by GEDE SUASTIKA, NURHAJATI MATTJIK, and TRI ASMIRA DAMAYANTI
Indonesia has a tremendous potency to develop orchid widely, due to the abundance of orchid germplasms. Several viruses infecting orchids were reported elsewhere. However, the presence of viruses infecting orchid in Indonesia is unknown. Thus, the aim of the researches were to identify viruses infecting orchids, its distribution in Java, its resistance response and to induced systemic resistance of susceptible orchid against Odontoglossum ringspot virus (ORSV) by using salicylic acid. Detection and identification of samples obtained from several survey locations by serological test and RT-PCR found that ORSV was detected mainly in samples from West Java (Taman anggrek Indonesia, Kebun Raya-Bogor, Gunung sindur-Bogor, Cianjur, Lembang). Cymbidium mosaic virus (CymMV) was detected mainly in central and East Java (Magelang, Malang, Surabaya). Cucumber mosaic virus
(CMV), and Potyvirus were detected from all samples tested, however Tospovirus
was undetectable from all samples by RT-PCR. Dual infection of ORSV and CymMV was found only in several samples from West Java. The nucleotide and amino acid sequences analysis of coat protein (CP) gene of six Java isolates of CymMV showed high homology with corresponding other 10 isolates elsewhere ranging from 95.8 to 98.8%, and 97.3 to 100%. The homology of nucleotide and amino acid sequences Java isolates of ORSV to other 11 isolates elsewhere ranging from 96.8 to 99.7% and 94.9 to 99.3%, respectively. These indicating that CymMV, ORSV, CMV and
Potyvirus were present infecting orchids in Java, Indonesia. The ORSV could infect all indicator plants tested with incidence ranging from 60-100% and varied symptoms. The resistance response of 13 species of commercial orchids against ORSV showed that 61.54% of species was categorized as susceptible, and 38.46% was resistant based on type of symptoms, incubation period, disease incidence and virus accumulation. To increase the systemic resistance against ORSV infection, the susceptible orchid Dendrobium nindii was treated by using Salicylic acid (SA) on tissue culture media at concentration 1, 2, 4, 8, and 16 ppm. The SA on tissue culture media did not have any adverse effect on growth parameters and had decreased incidence, symptom expression and ORSV accumulation at concentration from 4-16 ppm. The SA treatment in plants at concentration 8-16 ppm increased total SA, and increased Phenylalanine ammonialyase (PAL) enzyme activity in compared with untreated plants. Among tested concentration, SA at concentration16 ppm was successfully able to increased D. nindii systemic resistance against ORSV with efficiency up to 93.75%. This is the first report of utilizing SA in orchid tissue culture media to increase systemic resistance against ORSV.
IRWAN LAKANI. Identifikasi dan Karakterisasi Beberapa Virus yang Menginfeksi Tanaman Anggrek di Jawa serta Induksi Ketahanan Sistemik Tanaman Anggrek dengan Asam Salisilat. Dibimbing oleh GEDE SUASTIKA, NURHAJATI MATTJIK, dan TRI ASMIRA DAMAYANTI.
Indonesia mempunyai potensi luar biasa dalam mengembangkan tanaman anggrek, karena banyaknya spesifikasi plasma nutfah, namun Indonesia tertinggal dari negara lain terkait hal tersebut. Banyak anggrek asli Indonesia yang dikembangkan dan disilangkan di negara lain, kemudian diimpor kembali. Masalah yang dikhawatirkan dalam kegiatan ekspor impor bahan tanaman adalah terbawanya patogen tertentu termasuk virus. Dua virus utama yang banyak menginfeksi anggrek adalah Cymbidium mosaic virus (CymMV) dan Odontoglossum ringspot virus (ORSV), selain Cucumber mosaic virus, Potyvirus dan Tospovirus. Virus-virus tersebut telah banyak dilaporkan keberadaannya di beberapa negara, namun informasinya di Indonesia belum banyak diketahui. Untuk itu perlu dilakukan penelitian yang seksama menyangkut deteksi dan identifikasi virus-virus yang menginfeksi tanaman anggrek.
Infeksi CymMV berhasil terdeteksi pada tanaman anggrek dari beberapa lokasi pertanaman di Jawa yaitu di Surabaya, Malang, Magelang, Lembang, dan Bogor (Gunung Sindur dan Kebun Raya). Virus ini menunjukkan gejala khas berupa nekrosis, klorosis dan mosaik pada daun yang terinfeksi dan gejala ini bervariasi pada tiap lokasi pengamatan. Infeksi ORSV terdeteksi melalui metode serologi pada tanaman anggrek dari Jakarta, Cianjur dan Bogor. Gejala infeksi ORSV yang ditemukan pada daun dan bunga berupa belang, mosaik, dan nekrosis. Infeksi ganda kedua virus ditemukan hanya pada sampel-sampel dari Jawa Barat (Cianjur dan Bogor).
Hasil RT-PCR menggunakan primer universal untuk CMV subgrup IB, Potyvirus dan Tospovirus berhasil mengamplifikasi CMV dan Potyvirus dengan pita DNA berukuran masing-masing 382 bp dan 327 bp, dan tidak teramplifikasi Tospovirus pada semua sampel dari lokasi survei. Hasil amplifikasi menggunakan primer spesifik untuk gen CP CymMV didapatkan DNA berukuran 672 bp pada sampel dari lokasi Gunung Sindur-Bogor, Kebun Raya-Bogor, Lembang, Magelang, Malang dan Surabaya.
Homologi sekuen enam isolat CymMV yang berasal dari Gunung Sindur-Bogor, Kebun Raya-Sindur-Bogor, Lembang Bandung (Jawa Barat), Magelang (Jawa Tengah) dan Surabaya, Malang (Jawa Timur) dengan 10 isolat CymMV dari beberapa negara lain menunjukkan homologi sebesar 95,8-98,8% pada tataran nukleotida dan 97,3-100% pada tataran asam amino. Analisis filogenetik enam isolat CymMV asal Pulau Jawa dan beberapa isolat dari negara lain memperlihatkan keenam isolat terpisah dalam tiga kelompok yang berbeda untuk masing-masing isolat.
membentuk satu kelompok yang sama. Analisis lebih lanjut terhadap sekuen asam amino dari empat isolat ORSV dan enam isolat CymMV asal Pulau Jawa memperlihatkan terjadinya mutasi pada beberapa posisi yang berbeda. Mutasi yang terjadi diduga berhubungan dengan gejala yang ditimbulkan.
Hasil penularan secara mekanis pada delapan tanaman indikator (Datura stramonium, Nicotiana tabacum cv. Xanthi, N. benthamiana, Chenopodium amaranticolor, C. quinoa, Gomphrena globosa, Cassia occidentalis dan Physalis floridana) menunjukkan bahwa ORSV mampu menginfeksi semua jenis tanaman indikator dengan kejadian penyakit 60-100%. Kejadian penyakit dikonfirmasi secara serologi pada daun bergejala dan beberapa yang tidak bergejala
Pengujian ketahanan beberapa jenis anggrek terhadap infeksi ORSV menunjukkan adanya variasi respon masing-masing jenis anggrek. Gejala yang umum berupa lesio lokal, nekrotik, klorotik serta adanya bercak cincin pada permukaan daun. Gejala mulai muncul 4-54 hari setelah inokulasi pada anggrek yang rentan, sedangkan pada anggrek yang tahan gejala mulai muncul pada 10-90 hari setelah inokulasi. Kejadian penyakit berkisar dari 40% pada anggrek tahan, hingga 100% pada anggrek rentan. Nilai absorbansi enzyme linked-immunosorbant assay (ELISA) berkisar dari 1,5-13 kali nilai kontrol tanaman sehat. Berdasarkan gejala, masa inkubasi, kejadian penyakit, dan nilai absorbansi ELISA dapat diketahui bahwa sebagian besar anggrek yang diinokulasi ORSV rentan (61,54%) dan sebagian lagi agak tahan (38,46%). Salah satu jenis anggrek yang rentan berdasarkan hasil penelitian ini yaitu Dendrobium nindii ditingkatkan ketahanannya terhadap infeksi ORSV menggunakan senyawa asam salisilat.
Pemberian asam salisilat (SA) dalam media kultur jaringan dengan konsentrasi 1, 2, 4, 8 dan 16 ppm memberikan pengaruh yang sama terhadap variabel pertumbuhan (tinggi plantlet, jumlah tunas, pertambahan jumlah daun, lebar daun, jumlah dan panjang akar) dengan kontrol tanaman anggrek yang tidak diberi SA. Hal ini menunjukkan bahwa pemberian SA sampai konsentrasi 16 ppm tidak berpengaruh negatif pada pertumbuhan tanaman anggrek. Inokulasi ORSV pada bibit anggrek yang diberi perlakuan SA pada konsentrasi 4-16 ppm menunjukkan kejadian penyakit, keparahan dan akumulasi ORSV yang rendah, dan ORSV gagal menginfeksi secara sistemik. Gejala yang timbul pada bibit anggrek tersebut adalah lesio lokal, yang merupakan salah satu ciri respon ketahanan tanaman terhadap infeksi virus. Akumulasi SA dan aktivitas enzim phenilalanine ammonialyase (PAL) pada jaringan tanaman meningkat pada konsentrasi SA 8-16 ppm. Pemberian SA pada konsentrasi 4-16 ppm menunjukkan akumulasi SA pada infeksi awal (6 jam setelah inokulasi virus) menghambat replikasi virus yang lebih baik dibanding perlakuan 0-2 ppm. Diantara semua perlakuan, pemberian SA pada konsentrasi 16 ppm pada D.nindii mampu ditingkatkan ketahanannya terhadap ORSV dengan efisiensi hingga mencapai 93,75%.
©Hak cipta milik IPB, tahun 2012
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebut sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
SERTA INDUKSI KETAHANAN SISTEMIK
TANAMAN ANGGREK DENGAN ASAM SALISILAT
IRWAN LAKANI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Entomologi dan Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : 1. Dr. Ir. Budi Marwoto, M.Sc.
2. Dr. Ir. Kikin Hamzah Mutaqin, M.Si.
Ketahanan Sistemik Tanaman Anggrek dengan Asam Salisilat
Nama : Irwan Lakani
NIM : A461060021
Disetujui
Komisi Pembimbing
Dr.Ir. Gede Suastika, M.Sc. Ketua
Prof. Dr. Ir. Nurhayati Mattjik, M.S. Dr. Ir. Tri Asmira Damayanti, M.Agr Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. Dr. Ir. Dahrul Syah, M.Sc. Agr.
Puji serta syukur dihaturkan ke hadirat Allah SWT atas limpahan ilmu pengetahuan dan pemahaman-Nya yang diberikan sehingga penelitian untuk menyelesaikan studi doktoral dapat diselesaikan. Penelitian ini berjudul Identifikasi dan Karakterisasi Beberapa Virus yang Menginfeksi Tanaman Anggrek di Jawa serta Induksi Ketahanan Sistemik Tanaman Anggrek Dengan Asam Salisilat, yang dilakukan pada kurun waktu tahun 2008-2011.
Salah satu bagian disertasi ini telah diterbitkan pada Hayati Journal of Bioscience 17 (2): 101-104 tahun 2010 dengan judul “Identification and molecular characterization of odontoglosum ringspot virus (ORSV) from Bogor, Indonesia”. Bagian penelitian ini juga telah disajikan pada empat seminar internasional yaitu, (1) Seminar Internasional dan Kongres Perhimpunan Fitopatologi Indonesia di Makasar tahun 2009 dengan judul “ Studi Virus Menginfeksi Tanaman Anggrek di Indonesia : Odontoglossum ringspot virus”; (2) Kongres ISSAAS di Bali tahun 2010 dengan judul “Molecular Characterization of Cymbidium Mosaic Virus (CymMV) Infecting Orchids In Java, Indonesia”; (3) Konggres ISSAAS di Bogor tahun 2011 dengan judul “Induced Systemic Resistance of Orchid Against Odontoglossum Ringspot Virus Using Salicylic Acid”; dan (4) Seminar Internasional dan Konggres Perhimpunan Fitopatologi Indonesia di Solo tahun 2011 dengan judul “Resistance Response of Several Orchids Against Odontoglossum ringspot virus Infection ”,
Sekuen gen CP CymMV telah didaftarkan pada GeneBank dengan nomor aksesi AB693982 (isolat Gunung Sindur), AB693983 (isolat Kebun Raya Bogor), AB693984 (isolat Lembang-Bandung), AB693985 (isolat Magelang), AB693986 (isolat Malang), dan AB693987 (isolat Surabaya). Sekuen gen CP ORSV juga telah didaftarkan pada GeneBank dengan nomor aksesi AB693988 (isolat Gunung Sindur), AB693989 (isolat Kebun Raya Bogor), AB693990 (isolat TAIP-Jakarta) dan AB693991 (isolat Cipanas-Cianjur).
Ungkapan rasa terima kasih yang tak terhingga disampaikan kepada komisi pembimbing, Bapak Dr.Ir. Gede Suastika, M.Sc., Ibu Prof.Dr.Ir. Nurhajati Matjjik, M.Si., dan Ibu Dr.Ir. Tri Asmira Damayanti, M.Agr. atas segala bimbingan, arahan, kritik, saran serta dukungan moril dan materil yang diberikan selama penelitian hingga penyelesaian disertasi ini. Terima kasih pula disampaikan kepada Bapak Dr. Ir. Budi Marwoto, Bapak Dr. Ir. Kikin Hamzah Mutaqin, M.Si, Ibu Dr. Ir. Sri Hendrastuti Hidayat, M.Sc dan Bapak Prof. Dr. Ir. H. Alam Anshary, M.Si yang telah meluangkan kesediaannya menjadi penguji luar komisi pada sidang tertutup dan terbuka. Segala saran dan pertanyaan telah banyak membantu untuk penyempurnaan disertasi ini.
rekan-rekan tim peneliti bersama virus anggrek, Khamdan, Leny, Fitri Menisa, dan Putri Syahierah atas kerjasamanya selama pelaksanaan penelitian. Terima kasih pula atas peran serta dan diskusinya pada Tuti Legiastuti yang banyak membantu dalam teknis pelaksanaan beberapa bagian penelitian di Laboratorium Virology Tumbuhan. Juga ucapan terima kasih kepada teman-teman peneliti di Lab. Virologi, Pak Rai Maya Temaja, Ibu Ifa Manzilla, Pak Jumsu, Ibu Rita Noveriza, Pipit, Miftah, Melinda, Ita, Sherly, Rita, kepada rekan-rekan lainnya yang tidak dapat disebut satu per satu. Ucapan Terima kasih pula pada teknisi pranata pak Edi Supandi. Ucapan terima kasih secara khusus disampaikan kepada Bapak Ir. Yoyo Sulyo, MS, atas informasi awal adanya virus pada anggrek di Jawa. Terima kasih juga kepada para petani dan pengusaha anggrek yang bersedia untuk diambil contoh tanaman anggreknya untuk keperluan penelitian ini. Kepada teman-teman serumah, Pak Nur Sangaji, Ibu Rostiati, Pak Iskandar, Pak Wahid, rekan-rekan Himpunan Mahasiswa Pascasarjana Sulawesi Tengah (HIMPAST), dan Dewan Mahasiswa Pascasarjana IPB (2010/2011) serta Forum Wacana Ento-Fito, terima kasih atas dukungannya.
Rasa rindu dan sayang serta hormat sedalam-dalamnya penulis sampaikan kepada kedua orang tua ibunda Sun Lasori (Alm) dan ayahanda Hamzah Lakani (Alm) serta nenek tersayang Wau Lamaga (Alm), terima kasih atas curahan kasih sayang dan bekal kekuatan mental yang sempat diberikan selama hidup untuk dapat terus mencapai cita-cita pendidikan. Semoga Allah SWT menyayangi mereka sebagaimana sayangnya mereka kepada penulis. Kepada paman dan bibi serta kakak-kakak dan adikku, Djal, Yam, Yuyi, Yun, Sukri dan Ti’, terima kasih telah menyemangati kuliahku.
Kepada ibu dan bapak mertua tersayang Dra. Farida S. Amu, M.Si dan Subandjar Suhadi, penulis mengucapkan terima kasih atas segala do’a serta bantuan moril dan materil selama mengikuti pendidikan pascasarjana. Juga kepada kakak dan adik ipar, Susi Handayani, Yayuk, Gunawan, Nunung, dihaturkan terima kasih atas dukungannya kepada penulis.
Kepada istri tercinta Dian Astuti, SP, terima kasih atas kesabaran, cinta, sayang, dan kesetiaan, serta do’anya yang tak henti-hentinya untuk suamimu ini. Kesabarannya merawat suami dan anak-anak ditengah kesibukan bekerja, memberi arti besar pada diri penulis. Kepada anak-anakku tersayang Afiqa Syazana, Muh.Rasyal Zulfahri dan Kaisya Mazaya, mohon maaf sedalam-dalamnya karena tidak dapat menunjukkan secara maksimal rasa sayang Ayah pada kalian karena terpisah selama kuliah. Ayah sangat menyayangi kalian walau tidak sering bersama-sama.
Akhirnya, semoga hasil penelitian ini dapat memberi manfaat untuk pembaca dan pencari informasi.
Bogor, Februari 2012
Penulis dilahirkan di Luwuk (Sulawesi Tengah), 15 Oktober 1970. Penulis merupakan anak ke enam dari tujuh bersaudara dari pasangan Hamzah Lakani (Alm) dan Sun Lasori (Almh). Penulis menikah dengan Dian Astuti, SP dan dikaruniai tiga orang putra yaitu Afiqah Syazana (6 tahun), Muhammad Rasyal Zulfahri (4 tahun) dan Kaisya Mazaya (2 tahun).
Penulis menempuh pendidikan sarjana pada Jurusan Budidaya Pertanian, Fakultas Pertanian, Universitas Tadulako, lulus pada tahun 1996. Pendidikan Magister ditempuh di Program Studi Entomologi dan Fitopatologi, Sekolah Pascasarjana Institut Pertanian Bogor dan menyelesaikan studi pada tahun 2006. Pada tahun 2006, penulis melanjutkan studi Doktoral pada program studi yang sama di IPB.
Sejak tahun 2000 penulis diangkat sebagai staf pengajar tetap pada Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas Tadulako, Palu.
DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN I. PENDAHULUAN
Latar Belakang... 1
Tujuan ... 6
Hipotesis... 7
Strategi Penelitian ... 7
II. TINJAUAN PUSTAKA Budidaya Tanaman Anggrek... 9
Kultur Jaringan Tanaman Anggrek... 12
Kultur Jaringan dan Virus Tumbuhan... 14
Beberapa Virus Tanaman yang Menginfeksi Anggrek... 15
Induksi Ketahanan secara Sistemik ... 23
Mekanisme Induksi Asam Salisilat... 28
Daftar Pustaka... 33
III. IDENTIFIIKASI DAN KARAKTERISASI BEBERAPA VIRUS YANG MENGINFEKSI TANAMAN ANGGREK DI PULAU JAWA Abstrak 41 Abstract 42 Pendahuluan ... 43
Bahan dan Metode... 47
Hasil... 53
Pembahasan... 74
Kesimpulan ... 83
Daftar Pustaka... 84
IV. RESPON KETAHANAN BEBERAPA JENIS ANGGREK
TERHADAP INFEKSI ODONTOGLOSSUM RINGSPOT VIRUS Abstrak 89 Abstract 90 Pendahuluan ... 91Bahan dan Metode... 94
Hasil... 96
Pembahasan... 99
Kesimpulan ... 102
Abstrak 105
Abstract 106
Pendahuluan ... 107
Bahan dan Metode... 111
Hasil... 114
Pembahasan... 119
Kesimpulan ... 123
Daftar Pustaka... 124
VI. PEMBAHASAN UMUM 127
VII. KESIMPULAN DAN SARAN 135
DAFTAR PUSTAKA 137
1.1 Data perkembangan volume dan nilai ekspor - impor
anggrek 2005 – 2008 ... 2
2.1 Organisasi genom CMV... 16
2.2 Organisasi genom Potyvirus... 18
2.3 Organisasi genom CymMV ... 21
2.4 Organisasi genom ORSV…..... 22
3.1 Komposisi reagen untuk reaksi reverse trancription (RT)... 48
3.2 Komposisi bahan untuk reaksi PCR... 48
3.3 Sekuen primer yang digunakan untuk deteksi virus pada anggrek... 49
3.4 Kondisi PCR untuk deteksi virus pada anggrek... 49
3.5 Isolat ORSV dari beberapa negara dan TMV pada GeneBank yang dibandingkan dengan enam isolat CymMV asal Indonesia... 50
3.6 Isolat CymMV dari beberapa negara dan PVX pada GeneBank yang dibandingkan dengan enam isolat CymMV asal Indonesia... 51
3.7 Deteksi serologi CymMVdan ORSV pada beberapa jenis anggrek bergejala asal lokasi survei... 58
3.8 Perbandingan hasil ELISA CymMV terhadap sampel anggrek yang dikumpulkan dari beberapa lokasi survei... 59
3.9 Rekapitulasi hasil deteksi RT-PCR virus anggrek dari lokasi survei…... 59
3.10 Homologi beberapa isolat CymMV asal Pulau Jawa dan negara yang berbeda berdasarkan sekuen nukleotida gen CP... 64
3.11 Homologi beberapa isolat CymMV asal Pulau Jawa dan negara yang berbeda berdasarkan sekuen asam amino gen CP... 64
3.12 Mutasi titik yang terjadi pada enam isolat CymMV asal Pulau Jawa yang dibandingkan dengan 10 isolat CymMV dari beberapa negara lain... 65
3.13 Perbedaan posisi asam amino pada gen CP enam isolat CymMV asal Pulau Jawa dengan 10 isolat CymMV dari beberapa negara lain... 65
3.14 Homologi nukleotida gen CP ORSV isolat Pulau Jawa dengan isolat-isolat dari beberapa negara lain... 69
3.15 Homologi asam amino gen CP ORSV isolat Bogor dengan isolat-isolat dari beberapa negara lain... 69
3.16 Mutasi titik yang terjadi pada enam isolat ORSV asal Pulau Jawa yang dibandingkan dengan 10 isolat ORSV dari beberapa negara lain……… 70
3.17 Perbedaan asam amino pada gen CP empat isolat ORSV asal Pulau Jawa dengan 11 isolat ORSV dari beberapa negara lain……….. 70
3.18 Hasil uji penularan dan NAE ORSV pada beberapa tanaman indikator 73 4.1 Kategori respon ketahanan beberapa jenis anggrek terhadap ORSV…. 95 4.2 Respon berbagai jenis anggrek terhadap infeksi ORSV... 98
Halaman
1.1 Alur penelitian virus pada tanaman anggrek... 8 2.1 Skema representasi organisasi genom CMV... 16 2.2 Skema representasi organisasi genom Potyvirus... 18 2.3 Skema representasi organisasi genom CymMV... 21 2.4 Skema representasi organisasi genom ORSV...... 23
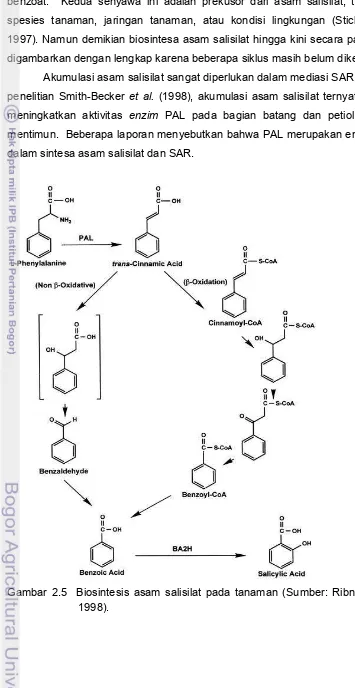
2.5 Biosintesis asam salisilat pada tanaman……… 27
2.6 Alur transduksi signal yang mengatur terjadinya ketahanan………….. 30 3.1 Sebaran sampel anggrek yang terinfeksi ORSV, CymMV, CMV dan
Potyvirus di Pulau Jawa... 53 3.2 Variasi gejala infeksi CymMV pada tanaman anggrek di beberapa
lokasi pengamatan... 55 3.3 Kemiripan gejala pada anggrek Cymbidium yang diamati
pada tiga lokasi... 55 3.4 Perbandingan gejala pada tanaman anggrek yang terinfeksi
CymMV... 56 3.5 Gejala pada tanaman anggrek Dendrobium yang terinfeksi ORSV…... 57 3.6 Gejala pada tanaman anggrek Dendrobium yang terinfeksi ganda
CymMV dan ORSV... 57 3.7 Hasil visualisasi pita DNA CMV pada gel agarose 1,2% TBE... 60 3.8 Hasil visualisasi pita DNA Potyvirus pada gel agarose 1,2% TBE... 60 3.9 Hasil visualisasi pita DNA Tospovirus pada gel agarose 1,2% TBE... 61 3.10 Hasil visualisasi pita DNA CymMV pada gel agarose 1,2% TBE... 61 3.11 Hasil visualisasi DNA gen CP ORSV pada gel agarose 1,2% TBE... 62 3.12 Pohon filogenetika CymMV berdasarkan sekuen nukleotida dan
asam amino... 67 3.13 Pohon filogenetika ORSV berdasarkan nukleotida dan asam amino.... 72 3.14 Gejala penularan ORSV pada tanaman indikator... 73 4.1 Gejala hasil penularan ORSV pada beberapa jenis anggrek... 97 5.1 Plantlet hasil kultur jaringan pada media perakaran siap untuk
diaklimatisasi... 114 5.2 Pengaruh pemberian asam salisilat (SA) pada beberapa parameter
pertumbuhan plantlet anggrek... 115 5.3 Gejala yang muncul pada tanaman anggrek hasil perlakuan SA
Halaman
1 Hasil alignment nukleotida dan asam amino genom ORSV... 141 2 Hasil alignment nukleotida dan asam amino genom CymMV... 144 3 Data pengamatan dan anova kultur jaringan anggrek ... 148
I. PENDAHULUAN
Latar Belakang
Anggrek adalah salah satu tanaman hias yang banyak diminati masyarakat. Saat ini, anggrek sudah menjadi bagian dari kebutuhan masyarakat perkotaan, sehingga anggrek merupakan komoditas ekonomi dalam perdagangan lokal maupun internasional. Namun demikian kebutuhan pasar lokal belum dapat dipenuhi karena produksi bibit, bunga potong maupun tanaman anggrek masih rendah dan jenisnya terbatas. Pasar tanaman anggrek (pot plant) di Indonesia 75% didominasi oleh tanaman dari Thailand dan Taiwan (Suharto 2002). Potensi pasar anggrek dalam negeri cukup besar karena jika 10 persen saja orang Indonesia yang menyukai anggrek dari total penduduk Indonesia yang mencapai lebih dari 240 juta jiwa, maka secara ekonomi potensinya besar.
Perkembangan produksi tanaman anggrek sejak tahun 2005 hingga 2009 cenderung meningkat. Meskipun pada tahun 2007 produksi tanaman anggrek mengalami penurunan, namun pada tahun 2008 dan 2009 produksinya kembali meningkat. Tahun 2005 produksi anggrek nasional sebesar 7902,4 tangkai meningkat menjadi 10 903,4 tangkai, pada tahun 2006 menurun menjadi 9484,4 tangkai dan kembali meningkat menjadi 16 205,9 pada tahun 2009 (Mattjik 2011). Jika dibandingkan dengan data ekspor-impor anggrek Indonesia tahun 2005-2008 berdasarkan bentuk bahan tanaman anggrek menunjukkan angka fluktuatif (Tabel 1). Sejak tahun 2005 Indonesia mengalami defisit dalam hal ekspor benih sehingga Indonesia banyak mengimpor dari negara lain. Masuknya benih dari berbagai negara membawa implikasi terhadap penyebaran penyakit baru ke Indonesia.
Tabel 1.1 Data perkembangan volume dan nilai ekspor - impor anggrek dari tahun 2005 – 2008
Tahun
No. Komoditi 2005 2006 2007 2008
Volume Nilai Volume Nilai Volume Nilai Volume Nilai
(Kg) (US $) (Kg) (US $) (Kg) (US $) (Kg) (US $)
EKSPOR
1 Anggrek potong,stek tanpa akar 184 027 130 682 537 949 743 704 10 398 231 416 3140 8796 2 Anggrek potong, stek berakar 438 457 1 405 252 361 839 1 222 587 190 412 918 666 152 025 718 910 3 Bibit anggrek 87 011 25 044 866 9612 413 1329 10 000 535 4 Bunga anggrek segar 139 154 321 171 1 719 461 597 276
5 Bunga segar untuk rangkaian dan
penggunaan lain 1581 15 260 1765 12 510
Jumlah 848 649 1 882 149 2 620 115 2 573 179 202 804 1 166 671 166 930 740 751
IMPOR
1 Anggrek potong, stek tanpa akar 17 726 14 776 231 993 171 798 1617 8394 2 Anggrek potong, stek berakar 4358 13 341 600 7065
3 Bibit anggrek 117 813 524 409 70 248 327 719 70 895 471 381 34 551 78 215 4 Bunga anggrek segar 16 291 59 038 6206 42 019
5 Bunga segar untuk rangkaian dan
penggunaan lain 177 429 100 50
Jumlah 156 188 611 564 309 047 548 601 72 689 480 204 34 651 78 265 DEFISIT/ SURPLUS
1 Anggrek potong, stek tanpa akar 166 301 115 906 305 956 571 906 8781 223 022 3140 8796 2 Anggrek potong, stek berakar 434 099 1 391 911 361 239 1 215 522 190 412 918 666 152 025 718 910 3 Bibit anggrek (30 802) (499 365) (69 382) (318 107) (70 482) (470 052) (24 551) (77 680)
4 Bunga anggrek segar 122 863 262 133 1 713 255 555 257 - - - - 5 Bunga segar untuk rangkaian dan
penggunaan lain - - - - 1404 14 831 1665 12 460 Jumlah 92 461 1 270 585 2 311 068 2 024 578 130 115 686 467 132 279 662 486
Kendala usahatani anggrek salah satunya adalah serangan hama dan penyakit. Khusus menyangkut serangan penyakit, salah satu diantaranya adalah infeksi virus yang telah banyak dilaporkan di beberapa negara. Tanaman anggrek dapat terinfeksi lebih kurang 50 jenis virus (Chang et al. 2005; Zettler et al. 1990; Navalienskiene et al. 2005). Dua jenis virus penting yang menyerang anggrek dan vanili serta penyebarannya yang luas di dunia adalah Cymbidium mosaic virus (CymMV) dan Odontoglossum ringspot virus (ORSV) (Zettler et al. 1990; Wisler 1989; Sherpa et al. 2004 ; Grisoni et al. 2004). Selain kedua virus tersebut beberapa virus lain yang juga dilaporkan menginfeksi tanaman anggrek adalah Cucumber mosaic virus (CMV) dan virus dari genus Potyvirus. CMV dilaporkan menginfeksi tanaman anggrek di Taiwan, China, USA (Florida) dan Puerto Rico (Elliott et al. 1996). Beberapa jenis Potyvirus yaitu Bean yellow mosaic virus, Turnip mosaic virus, dan Dendrobium mosaic virus dilaporkan menginfeksi tanaman anggrek di Hawaii (Hu et al. 1993), juga dilaporkan menginfeksi anggrek Phalaenopsis di Taiwan (Zheng et al. 2008a). Virus lain yang juga ditemukan yaitu Tospovirus dilaporkan menginfeksi tanaman anggrek Phalaenopsis di Taiwan (Zheng et al. 2008b) dan Amerika Serikat (Baker et al. 2007). Baru-baru ini Lakani et al. (2010) melaporkan adanya ORSV di Indonesia berdasarkan pengamatan gejala pada beberapa kebun petani dan kebun koleksi
anggrek. Hal ini dikhawatirkan dapat mengancam plasma nutfah anggrek asli
Indonesia jika penyebarannya tidak dikendalikan.
CymMV dan ORSV sudah dilaporkan sangat merugikan budidaya
anggrek di dunia (Zettler et al. 1990; Francki et al. 1985). Kultivar anggrek yang terinfeksi CymMV selalu menunjukkan gejala nekrosis, ukuran lebih kecil, dan cacat bentuk pada bunga, sehingga menyebabkan kehilangan nilai ekonomi
(Seoh et al. 1998). Infeksi ganda kedua virus dapat menyebabkan bunga anggrek bergejala bercak nekrosis bergaris coklat (Eun et al. 2002). CymMV dan ORSV diperkirakan menginfeksi sekitar 14% tanaman anggrek budidaya di
seluruh dunia (Wong et al. 1997). Infeksi CMV pada tanaman anggrek menyebabkan gejala kuning bergaris pada daun anggrek dan pada bunga gejala berupa breaking color (Chang 2010). Gejala yang ditimbulkan pada tanaman anggrek Phalaenopsis yang diinfeksi Potyvirus berupa bercak klorotik pada daun (Zheng et al. 2008a).
Infeksi virus pada anggrek sangat mempengaruhi produksi secara
infeksi virus pada pengusahaan anggrek di Indonesia belum pernah dilaporkan
secara resmi. Namun hasil pengamatan di beberapa lokasi pengembangan
anggrek menunjukkan potensi kerugian yang cukup besar jika tidak segera
dilakukan pengendalian.
Perdagangan anggrek secara internasional tidak begitu memperhatikan
keberadaan CymMV, ORSV, CMV dan Potyvirus, sehingga peluang penyebaran
virus lintas negara melalui kegiatan ekspor-impor dapat terjadi. Hal ini
merupakan peristiwa yang tidak dapat dihindari. Survei pendahuluan terhadap penyakit pada tanaman anggrek yang pernah dilakukan oleh peneliti pada tahun 2007 dan awal 2008 menemukan adanya kejadian penyakit dengan ciri-ciri seperti yang disebabkan oleh CymMV dan ORSV di daerah Gunung Sindur (Bogor), Cianjur (Cipanas) dan Kebun Raya Bogor. Berdasarkan deteksi serologi dengan metode enzyme linked-immunosorbent assay (ELISA) dan reverse transcriptase-polymerase chain reaction (RT-PCR) menggunakan primer spesifik CymMV, Khalimi (2008) memastikan identitas virus tersebut pada sampel asal Cipanas (Cianjur).
Deteksi dan identifikasi virus yang menginfeksi tanaman anggrek telah
dilakukan di beberapa negara untuk mengetahui karakter spesifik masing-masing
virus. Analisis dilakukan untuk mengetahui karakter biologi dan molekuler agar
informasinya dapat digunakan sebagai dasar penentuan strategi pengendalian
yang spesifik. CymMV pertama kali dideteksi oleh Jensen (1950) pada tanaman anggrek Cymbidium di California, sedangkan ORSV pertama kali diisolasi dan
dikarakterisasi dari anggrek Odontoglossum grande oleh Jensen & Gold (1951). Deteksi yang dilakukan pada berbagai isolat menunjukkan adanya perbedaan
antar isolat di berbagai negara. Berdasarkan keragaman sekuen nukleotida gen
coat protein (CP) 85 isolat CymMV dan 37 isolat CymMV gen RdRp, asal
Perancis, Fiji, Madagaskar, Polynesia dan Reunion Island menunjukkan
terbentuk dua subgrup CymMV (Moles et al. 2007). Ikegami & Inouye (1996) menemukan adanya perbedaan yang kecil antara isolat CymMV Jepang dan
Korea berdasarkan sekuen nukleotida seluruh genom dengan homologi sebesar
96%. Deteksi CMV dan Potyvirus pada anggrek dilakukan dengan metode yang umum seperti ELISA, SDS immunodiffusion, Immunoblotting, RT-PCR, dan analisis sekuen nukleotida dan asam amino (Elliott et al. 1996; Hsu et al. 2005).
prioritas sasaran deteksi pada anggrek impor. Hal tersebut menyebabkan masuknya beberapa virus anggrek ke Indonesia melalui bibit anggrek yang terinfeksi.
Pengendalian yang mungkin dapat dilakukan untuk penyakit ini adalah dengan eradikasi (pemusnahan). Namun, pada kasus kejadian penyakit yang tinggi cara ini tidak mungkin dilakukan karena petani akan menderita kerugian. Penggunaan varietas tahan merupakan upaya pengendalian yang terbaik, tetapi kenyataannya varietas tahan sulit ditemukan, apalagi CymMV, ORSV, CMV dan Potyvirus dapat menginfeksi berbagai jenis anggrek (Sherpa et al. 2006; Hu et al. 1993). Jika ada jenis anggrek yang tahan, biasanya konsumen kurang menyukai jenis tersebut antara lain karena bunganya kurang menarik atau alasan lain berdasarkan selera. Oleh karena itu perlu dicari alternatif upaya pengendalian yang tepat sehingga virus-virus tersebut tidak mengancam pertanaman anggrek ataupun mengancam keberadaan plasma nutfah anggrek Indonesia.
Salah satu metode yang dapat digunakan untuk meningkatkan ketahanan tanaman yaitu melalui induksi ketahanan. Induksi ketahanan atau imunisasi atau ketahanan buatan merupakan suatu proses stimulasi ketahanan sistemik tanaman inang tanpa introduksi gen-gen baru. Induksi ketahanan menyebabkan kondisi fisiologis yang mengatur sistem ketahanan menjadi aktif dan atau menstimulasi mekanisme ketahanan alami yang dimiliki oleh inang (Stomberg 1994). Ketahanan tanaman melawan infeksi mikroba dapat diperoleh dengan penggunaan senyawa kimia, sehingga muncul pertahanan fisik tanaman sebagai reaksi yang diinduksi ketika terjadi kontak dengan patogen potensial. Gen ketahanan pada tanaman berhubungan dengan patogen spesifik yang sesuai dengan gen ketahanan tersebut. Aktivasi gen ketahanan setelah diinduksi oleh patogen dalam respon ketahanan dapat berupa programmed cell death (reaksi hipersensitif), sintesis pathogenesis related (PR)-protein dan induksi systemic acquired resistance/ketahanan sistemik terinduksi (SAR) (Schneider et al. 1996; Murphy et al. 1999).
SAR yang mensintesis SA terjadi setelah adanya invasi mikroorganisme. Respon yang terjadi oleh adanya invasi mikroorganisme dapat berupa kematian sel secara cepat pada sel-sel di sekitar titik masuk patogen yang disebut reaksi hipersensitif.
Tanaman anggrek umumnya diperbanyak dengan cara vegetatif dan
teknik kultur jaringan mata tunas dan biji. Kedua organ tanaman ini merupakan
tempat bertahan virus. Belum ada laporan yang menyatakan bahwa CymMV dan
ORSV ditularkan oleh serangga vektor, tetapi kedua virus ini dapat ditularkan
secara mekanis melalui kontaminasi peralatan dan pot selama pemisahan
tanaman dan pemanenan bunga (Zettler et al. 1990). Oleh karena itu penyebaran virus pada saat pemisahan untuk perbanyakan bibit menjadi periode
kritis penularan. Proses pemindahan dari bibit botolan ke media aklimatisasi
banyak bersentuhan dengan peralatan yang memungkinkan terjadinya penularan
bila peralatan tersebut sudah terkontaminasi oleh virus.
Salah satu upaya untuk menekan infeksi virus adalah melalui kombinasi teknik kultur jaringan dan induksi ketahanan sistemik menggunakan bahan kimia asam salisilat. Kombinasi kedua cara ini diharapkan akan dapat menghasilkan tanaman anggrek dalam jumlah yang banyak yeng lebih tahan terhadap infeksi virus. Aplikasi kedua cara ini cocok untuk meningkatkan ketahanan jenis anggrek yang digemari konsumen namun rentan terhadap infeksi patogen.
Tujuan
1. Mendeteksi beberapa virus yang menginfeksi tanaman anggrek pada beberapa daerah sentra produksi anggrek di Pulau Jawa.
2. Mendeteksi secara spesifik virus yang menginfeksi tanaman anggrek di Indonesia dan mengkarakterisasi secara terperinci dua virus yang penting. 3. Mengetahui respon ketahanan beberapa jenis anggrek komersial terhadap
infeksi ORSV.
4. Meningkatkan ketahanan sistemik anggrek Dendrobium nindii terhadap ORSV melalui pemberian senyawa asam salisilat.
Hipotesis
2. CymMV dan ORSV isolat Indonesia memiliki ciri-ciri khusus dibandingkan dengan isolat dari negara lain.
3. Tiap jenis anggrek memiliki ketahanan yang berbeda terhadap infeksi ORSV. 4. Ketahanan anggrek D. nindii terhadap infeksi ORSV dapat ditingkatkan
dengan pemberian asam salisilat pada media kultur jaringan.
Strategi Penelitian
Serangkaian penelitian yang saling terkait dilakukan untuk mendapatkan informasi dan data yang diperlukan. Adapun rangkaian percobaan tersebut terdiri dari :
1. Koleksi contoh tanaman bergejala melalui survei pada beberapa sentra produksi anggrek. Melalui survei ini akan diperoleh data keberadaan
CymMV, ORSV, CMV dan Potyvirus pada beberapa sentra anggrek di pulau Jawa, jenis anggrek yang terinfeksi virus dan gejala spesifik infeksi virus.
2. Mendeteksi CMV, Potyvirus, Tospovirus dan CymMV yang menginfeksi tanaman anggrek di Pulau Jawa berdasarkan RT-PCR.
3. Mendeteksi dan identifikasi secara serologi dan molekuler, kajian penularan, dan kisaran inang ORSV.
4. Uji respon ketahanan beberapa jenis anggrek terhadap infeksi ORSV. Percobaan ini dilakukan untuk melihat tingkat ketahanan beberapa jenis anggrek terhadap ORSV dan menentukan salah satu jenis anggrek yang rentan untuk diinduksi ketahanannya.
5. Induksi ketahanan tanaman anggrek terhadap ORSV. Percobaan ini dilakukan untuk menghasilkan tanaman anggrek yang lebih tahan terhadap salah satu jenis virus dengan perlakuan penambahan asam salisilat pada media kultur jaringan.
PASAR
PRODUK
TEKNOLOGI
RISET &
PEN
GE
MB
ANGAN
[image:32.595.41.782.106.476.2]TAHUN I (2008) TAHUN II (2009) TAHUN III (2010) Gambar 1.1 Alur penelitian virus pada tanaman anggrek
PENGUSAHA DAN PETANI ANGGREK
ANGGREK TAHAN TERHADAP ORSV
KULTUR JARINGAN ANGGREK INDUKSI KETAHANAN ANGGREK TERHADAP
ORSV DENGAN ASAM SALISILAT
IDENTIFIKASI BIOLOGI & ATAU MOLEKULER ISOLASI & PEMURNIAN ORSV
SURVEI VIRUS PADA ANGGREK
II. TINJAUAN PUSTAKA
Budidaya Tanaman Anggrek
Anggrek secara taksonomi diklasifikasikan ke dalam Phylum Spermatopytha, yaitu digolongkan ke dalam tumbuhan berbiji, Kelas Angiospermae atau berbiji tertutup, Subkelas Monokotiledonae atau bijinya berkeping satu, Ordo Gynandrae karena alat reproduksi jantan dan betina bersatu sebagai tugu bunga, Famili Orchidaceae atau keluarga anggrek (Puspitaningtyas et al. 2003). Orchidaceae merupakan famili tanaman terbesar, terdiri dari sekitar 900 genera dan hampir 35.000 spesies. Dendrobium, genus terbesar dalam famili Orchidaceae terdiri dari sekitar 1100 spesies (Cordel 1999).
Anggrek dapat diperbanyak secara generatif dari biji atau secara vegetatif (konvensional dan kultur in vitro). Tanaman anggrek hibrida diperoleh dari biji hasil silangan dan perbanyakannya dilakukan secara vegetatif untuk mempertahankan hibrida yang telah diseleksi. Penggunaan teknik pembiakan vegetatif konvensional, potensinya terbatas karena hanya sejumlah kecil tanaman yang dapat dihasilkan dalam satu kurun waktu tertentu (George 1996). Beberapa jenis tanaman anggrek yang populer di masyarakat antara lain: Oncidium, Cattleya, Phalaenopsis, Dendrobium, Vanda dan Aranthera. Anggrek
dipasarkan dalam bentuk bunga potong maupun tanaman dalam pot. Anggrek dari genus Dendrobium menghasilkan anakan dari umbi semu yang disebut dengan keiki yang seringkali berakar tapi masih melekat pada tanaman, dan hanya membutuhkan pemisahan untuk ditanam untuk mendapatkan tanaman baru (George 1996).
Dendrobium
Dendrobium adalah salah satu genus dari Famili Orchidaceae. Genus Dendrobium memiliki lebih dari 600 spesies yang menyebar di daerah tropis Asia
ditemukan antara lain adalah D. aureum, D. brymerianum, D. chrysotoxum, D. jamesianum, D. phalaenopsis, D. saisar.
Anggrek Dendrobium tumbuh menyebar di Asia Selatan, India, dan Srilanka. Di Asia Timur bunga ini banyak dibudidayakan oleh masyarakat Jepang, Taiwan dan Korea. Kebanyakan anggrek Dendrobium tumbuh liar di daerah tropis seperti Asia. Di Asia Tenggara, tanaman ini menjadi andalan Negara Thailand, Singapura, Indonesia dan Filipina. Sebarannya pun meluas ke Papua, Selandia Baru dan Tahiti. Dalam jumlah terbatas ditemukan di Selatan Amerika Serikat, dan daerah jajahan Inggris. Di Indonesia, Dendrobium banyak ditemukan di hutan Pulau Jawa, Kalimantan, Sulawesi, Sumatera, Papua, Maluku dan Nusa Tenggara. Beberapa spesies menyebar secara sangat luas, diantaranya D. anosmum, tersebar dari India sampai Papua (Chan et al. 1994).
Dendrobium termasuk anggrek epifit (menempel pada tanaman lain tetapi
Phalaenopsis
Salah satu genus yang ada pada Famili Orchidaceae adalah Phalenopsis. Genus Phalaenopsis terdiri atas 60 spesies yang menyebar dari Himalaya ke berbagai negara seperti Thailand, Indo-Cina, Malaysia, Indonesia, New Guinea, Australia, Taiwan dan Cina Selatan. Di Indonesia, plasma nutfah anggrek Phalaenopsis tumbuh secara alami dalam habitat hutan di berbagai wilayah,
misalnya Maluku, Sulawesi, Pulau Seram, Ambon, Buru, Kalimantan, Sumatra dan Jawa (Setiawan 2002).
Pada tahun 1753, Linnaeus memberikan nama Epidendrum amabila pada spesies anggrek bulan di Nusa Kambangan. Pada tahun 1825 spesies ini diberi nama P. amabilis oleh seorang ahli botani Belanda yang bernama Prof.C.L. Blume, karena beliau melihat sekumpulan kupu-kupu yang hinggap di dahan dan tidak mau bergerak dari tempatnya, ketika didekati ternyata sekumpulan anggrek kupu-kupu atau anggrek bulan. Sejak saat itu hingga sekarang, anggrek bulan dikategorikan dalam genus Phalaenopsis (Rukmana 2000).
Phalaenopsis tumbuh monopodial yang berarti hanya mempunyai batang utama yang tumbuh terus ke atas dan tidak terbatas. Batang pendek dan tidak mempunyai pseudobulb. Akar berdaging muncul dari batang atau buku bagian bawah. Tangkai bunga tumbuh menembus upih daun, seringkali bercabang, agak pendek atau panjang, berbunga sedikit atau banyak. Bunga mekar bersamaan atau tidak, ukuran kecil, sedang atau besar, tidak berbau atau berbau harum, warna putih, kuning atau ungu (Nursandi 1997).
Oncidium
Oncidium merupakan genus yang terdiri dari lebih 750 spesies, terbanyak
ditemukan di Amerika Selatan, beberapa di Amerika Tengah dan Kepulauan
Karibia, dan sedikIt di Florida. Oncidium pada umumnya epifit dan beberapa diantaranya merupakan anggrek tanah. Oncidium memiliki pseudobulb, tetapi beberapa diantaranya tidak memiliki psudobulb (Shuttleworth et al. 1970). Menurut Morrison (2000) genus Oncidium dikarakterisasi oleh adanya pseudobulb unifoliat dan bifoliat dari internode tunggal yang terlindung oleh
pelepah daun yang menggelembung. Infloresens dihasilkan dari ujung pelepah
tersebut, bagian dasar dari tangkai keluar dari pseudobulb. Spesies dari genus
Bunga umumnya berwarna kuning, namun terdapat juga yang berwana
merah muda dan coklat. Ukuran bunga bervariasi antara ¼ inchi sampai di atas
4 inchi. Beberapa dari spesies Oncidium disebut sebagai dancing ladies sebab
memiliki rangkaian tangkai bunga yang panjang dengan membentuk formasi
seperti kelompok penari balet. Beberapa contoh jenis Oncidium diantaranya
adalah O. nubigenum dari Kolombia, O. triquetrum dari Jamaika, O. bicallosum
dari Meksiko dan Guatemala serta O. cebolleta dari Meksiko dan Paraguay
(Shuttleworth et al. 1970).
Kultur Jaringan Tanaman Anggrek
Kultur jaringan secara luas dapat didefinisikan sebagai usaha mengisolasi, menumbuhkan, memperbanyak, dan meregenerasikan protoplast, sel utuh atau bagian tanaman seperti meristem, tunas, daun muda, batang muda, ujung akar, kepala sari, dan bakal buah dalam suatu lingkungan aseptik yang terkendali. Pada awalnya metode ini merupakan penelitian laboratorium sebagai bagian dari penelitian fisiologi tentang pertumbuhan dan perkembangan tanaman (Gunawan 1992). Kultur jaringan menggunakan teori sel seperti yang dikemukakan oleh Schleiden & Schwann pada tahun 1839. Menurut kedua ahli itu, sel mempunyai kemampuan otonom (mampu tumbuh mandiri), bahkan mempunyai kemampuan totipotensi yaitu kemampuan sel atau jaringan untuk tumbuh dan berkembang seperti sel zigot karena memiliki susunan genetik yang sama (Wattimena et al. 1992).
Seiring dengan perkembangan ilmu dan teknologi dan dengan ditemukannya auksin dan sitokinin serta prinsip pengaturan perimbangan kedua zat pengatur tumbuh tersebut, regenerasi dari sel menjadi tanaman lengkap pada banyak spesies sudah berhasil dilakukan (Gunawan 1992). Dewasa ini kultur jaringan telah digunakan untuk tujuan perbanyakan tanaman seperti kentang, jahe, pisang, asparagus, dan beberapa tanaman hias seperti anggrek, krisan, dan Dianthus (Wattimena et al. 1992). Beberapa kebun pembibitan dan pengembangan anggrek kemudian menerapkan metode ini untuk memperoleh klon-klon anggrek yang sangat eksklusif.
Perbanyakan anggrek secara kultur jaringan dapat dilakukan melalui eksplan berupa mata tunas, biji, dan meristem untuk tujuan tertentu. Perbanyakan vegetatif anggrek melalui kultur meristem dapat dibagi dalam tiga tahap yaitu transformasi meristem menjadi protocorm like body (plb), perbanyakan protocorm dengan memotongnya menjadi potongan yang lebih kecil, dan perkembangan protocorm-protocorm tersebut berakar dan berpucuk (Pierik 1987). Istilah plb merupakan istilah untuk struktur yang mirip protocorm yang terbentuk dari jaringan tanaman dan atau kalus secara in vitro. Istilah ini pertama kali diperkenalkan oleh Georges Morel (Arditti & Ernst 1992). Sumber lain menyebutkan bahwa istilah protocorm diperkenalkan pertama kali oleh Melchior Trueb, yang pernah menjabat sebagai direktur Botanical Gardens di Bogor (sekarang Kebun Raya Bogor), untuk menggambarkan suatu tahap dalam perkembangan lumut (Arditti & Ernst 1992). Kemudian Noel Bernard menggunakan istilah tersebut untuk anggrek antara tahun 1899 dan 1910. Istilah tersebut sekarang digunakan untuk menggambarkan suatu badan yang mirip bulatan-bulatan umbi kecil yang terbentuk pada biji-biji anggrek yang berkecambah (Arditti & Ernst 1992; Ratnadewi et al. 1991).
Individu Protocorm saat dipisah-pisahkan dan disubkultur sering menghasilkan protocorm adventif (George 1996). Massa protocorm yang dipisah-pisahkan dan ditumbuhkan di media serupa yang baru akan memperbanyak diri menjadi massa protocorm yang baru. Bila pisahan protocorm tersebut ditumbuhkan dalam media lain yang mengarah ke proses pendewasaan dan perakaran, maka protocorm akan tumbuh menjadi tanaman baru yang sempurna dan siap dipindahlapangkan (Gunawan 1992).
akan membentuk protocorm, suatu struktur seperti corm yang berwarna hijau dan mampu melakukan fotosintesis. Tunas dan akar akan terbentuk bila kandungan senyawa-senyawa organik dalam protocorm cukup, dan kecambah normal terbentuk (Wattimena et al. 1992).
Kultur Jaringan dan Virus Tumbuhan
Kultur jaringan tanaman sejak lama telah digunakan untuk mengatasi penyebaran penyakit. Penghambatan penyebaran penyakit dapat dilakukan dengan menghasilkan plantlet yang bebas penyakit dengan perlakuan tertentu pada eksplan. Teknik kultur jaringan menjadi metode yang sering digunakan untuk manipulasi genetik dan eliminasi virus melalui kultur meristem apikal. Pemanfaatan kultur jaringan untuk pengendalian virus dilakukan dalam hal tahapan untuk perlakuan lain yang akan dilakukan. Misalnya untuk menghasilkan tanaman tahan terhadap virus dengan memberikan perlakuan pada kalus yang ditumbuhkan pada kultur menggunakan kemoterapi (actinomycin-D, Ribavirin, 2-thiouracil) (Srivastava et al. 1999). Hal lain yang dilakukan adalah perlakuan
seleksi kalus yang diberikan perlakuan penyinaran sinar Gamma seperti dilaporkan Mukerji et al. (1999) untuk ketahanan terhadap TMV. Untuk perlakuan mediasi menggunakan Agrobacterium, DNA transfer langsung, electroporation, microprojectil, juga menggunakan kultur jaringan pada tahapan penumbuhan kalus (Srivastava et al. 1999).
Wattimena et al. (1992) menyatakan bahwa tanaman hasil kultur jaringan dapat dinyatakan bebas penyakit sistemik tertentu jika telah diidentifikasi dan telah dihilangkan dari tanaman. Hal ini dilakukan pada penyakit yang bersifat sistemik yang disebabkan oleh virus dan mikoplasma. Eliminasi patogen dapat dilakukan melalui termoterapi, kultur meristem, kombinasi keduanya, pembentukan tunas adventif dan teknik penyambungan mikro (Pierik 1987). Eliminasi dengan termoterapi dan kultur meristem paling umum dilakukan. Tanaman hasil perlakuan kemudian diuji telah terbebas dari virus dengan menggunakan tanaman indikator, serologi dan mikroskop elektron. Tanaman kultur jaringan yang bebas virus akan menjadi sumber bahan tanaman baik untuk keperluan penukaran plasma nutfah, pelestarian plasma nutfah, bahan perbanyakan dan bahan untuk pemuliaan.
menunjukkan konsentrasi ribavirin 30 mg/l cukup efektif mengeleminasi Potato virus X (PVX), Potato virus Y (PVY), Potato leaf roll virus, Potato virus S, dan
Potato virus M. Lopez-Delgado et al. (2004) mengkombinasikan perlakuan asam salisilat dan termoterapi untuk mengeliminasi PVX pada umbi mikro kentang. Hasil yang diperoleh menunjukkan bahwa umbi mikro yang diberi perlakuan asam salisilat dengan konsentrasi 10-5 M dapat meningkatkan toleransi terhadap paparan pemanasan hingga 42 oC selama 30 hari. Toleransi ini menyebabkan dapat mengeliminasi PVX yang tidak tahan terhadap suhu tinggi. Paludan (1985) melaporkan bahwa perlakuan pendinginan (5 oC) pada titik tumbuh kultur meristem tanaman Chrysanthemum morifolium selama satu bulan dapat meningkatkan keberhasilan menghasilkan tanaman bebas dari Chrysanthemum chlorotic mottle viroid. Perlakuan pendinginan juga dilaporkan Lizarraga et al. (1980) pada kultur jaringan awal tanaman kentang dengan perlakuan 5 oC-15 oC dapat mengeliminasi Potato spindle tuber viroid.
Beberapa Virus Tanaman yang Menginfeksi Anggrek
Cucumber mosaic virus (CMV)
Cucumber mosaic virus (CMV) pertama kali deskripsi secara rinci pada tahun 1916 pada tanaman mentimun dan Cucurbitaceae lainnya oleh Doolittle dan Jagger. Saat ini diketahui bahwa CMV menginfeksi banyak tanaman pertanian dan hortikultura di seluruh dunia pada iklim sedang maupun tropis. Perkembangan ketahanan genetik untuk CMV pada sayuran telah memberi kontribusi yang berharga bagi manajemen penyakit virus yang penting ini (Zitter & Murphy 2009). CMV dilaporkan mampu menginfeksi lebih dari 40 famili tanaman dikotil maupun monokotil (Gibbs & Harrison 1970 ).
sebagai RNA subgenomic, terdiri dari untai RNA yang dihasilkan terpisah selama replikasi (Zitter & Murphy 2009).
Tanaman dapat mengaktivasi mekanisme ketahanan ketika CMV menginfeksi sehingga dapat menghambat pergerakan virus untuk menginvasi jaringan baru. Tipe ketahanan ini disebut sebagai gene silencing, namun protein CMV 2b mampu menghambat inisiasi sinyal gene silencing (silencing suppressor) pada tanaman di bagian jaringan yang jauh dari titik infeksi, sehingga memungkinkan CMV untuk terus menginvasi dan menginfeksi jaringan muda tanaman yang berkembang. Gen CP merupakan protein yang hanya berasosiasi dengan partikel virus dan merupakan satu-satunya penentu untuk transmisi oleh vektor kutu dan. Mutasi pada gen 1a, 2a dan 2b berpengaruh pada pergerakan virus dalam beberapa inang (Zitter & Murphy 2009).
Tabel 2.1 Organisasi genom CMV
Genom (Protein)
Ukuran nukleotida
(basa)
Fungsi
RNA1 (1a) 3.350 Replikasi, methyltransferase, helikase RNA2 (2a, 2b) 3.050 N-proksimal, replikasi, RNA-dependent
RNA polimerase
RNA3 (3a) 2.200 Protein movement berperan dalam
pergerakan virus dari sel ke sel ataupun dalam pembuluh tanaman
RNA4 (CP) 1.030 Protein selubung (CP)
(Sumber: ICTVdB Management 2006b)
Gambar 2.1 Skema representasi organisasi genom CMV (Sumber: Zitter & Murphy 2009).
CP 1a
2a
MP
2b
RNA 1
RNA 2 RNA 3
Beberapa strain CMV memiliki RNA satelit (RNA 5 atau satRNA). satRNA adalah molekul untai tunggal berukuran panjang sekitar 332-342 nukleotida dan benar-benar tergantung pada CMV untuk replikasi. Selain itu, satRNA dienkapsidasi dalam partikel CMV, yang memungkinkan menyebar dari satu tanaman ke tanaman bersama dengan CMV, oleh vektor kutudaun. satRNA, tidak memberikan fungsi yang penting pada CMV (helper virus). Adanya CMV satRNA kemungkinan tidak berpengaruh pada gejala atau dapat memperparah gejala klorosis atau nekrosis sistemik atau sebaliknya mungkin menyamarkan gejala (Zitter & Murphy 2009).
Sejumlah strain CMV di seluruh dunia diklasifikasi ke dalam dua subgrup, I dan II, berdasarkan kriteria berbagai variasi gejala, serologi (Wahyuni et al. 1992; Hu et al. 1995; Ilardi et al. 1995), hibridisasi asam nukleat (Owens & Palukaitis 1988, Palukaitis et al. 1992), sekuen gen (Owens et al. 1990; Szilassy et al. 1999), dan restriction fragment length polymorphism (RFLP) (Rizos et al.
1992; Sialer et al. 1999). Subgrup strain I dibagi lagi menjadi IA dan IB, berdasarkan perbedaan patogenisitas pada kacang tunggak (Vigna unguiculata). Strain IA menginduksi gejala-gejala mosaik sistemik dan strain IB menginduksi lesio lokal nekrotik pada daun yang diinokulasi. Selain berdasarkan gejala, CMV subgrup I sekarang ini dibagi menjadi IA dan IB berdasarkan sekuen gen CP strain CMV dan analisis filogenetik. Strain CMV Asia dikelompokkan dalam subgrup IB (Palukaitis & Zaitlin 1997; Roossinck et al. 1999; Roossinck 2002). Beberapa strain CMV yang spesifik inang, menginfeksi inang tertentu dalam famili yang sama seperti strain CMV legum. CMV secara serologi berhubungan dengan Tomato aspermy virus dan Peanut stunt virus (Zitter & Murphy 2009).
Potyvirus
Potyvirus adalah merupakan grup terbesar dari 34 grup virus tanaman
dan famili saat ini diketahui (Ward & Shukla 1991). Genus ini terdiri dari setidaknya 180 anggota definitif (91 spesies resmi dan 89 spesies tentatif). Sebanyak 30% dari semua virus tanaman yang diketahui menyebabkan kerugian signifikan dalam bidang pertanian, tanaman pakan ternak, tanaman hortikultura dan tanaman hias (Ward & Shukla 1991; van Regenmortel et al. 2000).
RNA terdiri dari satu open reading frame (ORF) yang mengekspresikan satu poliprotein prekusor berukuran 350 kDa. Prekursor poliprotein tersebut kemudian ditranslasi menjadi tujuh protein kecil yang memiliki berbagai fungsi, dinotasikan sebagai P1, helper component (HC), P3, cylindrical inclusion (CI), nuclear inclusion A (NIa), nuclear inclusion B (NIb), capsid protein (CP), serta dua protein putatif kecil yang dikenal sebagai 6K1 dan 6K2 (Shukla et al. 1994) (Tabel 2.4
dan Gambar 2.4). Pada bagian terminal 3’ diakhiri dengan motif poly-A tail (Hari et al. 1979; Takahashi et al. 1997).
Untuk menghasilkan protein utama, genom virus mengkode poliprotein dengan diproses oleh tiga proteinase virus. Dua proteinase diantaranya, P1 dan helper HC-Pro (Helper componen-proteinase) yang mengkatalisis reaksi autoproteolitik masing-masing hanya pada Terminal C (Carrington et al. 1989; Verchot et al. 1991). Satu proteinase lainnya reaksinya dikatalisis oleh NIA-Pro (nuclear inclusion protein) melalui mekanisme trans-proteolitik atau autoproteolitik (Carrington & Dougherty 1987).
Tabel 2.2 Organisasi genom Potyvirus
Protein Fungsi
P1 Proteinase;pergerakan antar sel.
HC-Pro transmisi oleh kutudaun; Proteinase; pergerakan antar sel.
P3 Belum diketahui
CI Replikasi genom (RNA helikase); membran pengikat; stimulasi asam nukleat aktivitas ATPase ; pergerakan antar sel.
CP Encapsidasi RNA; berperan dalam transmisi oleh vektor; pergerakan antar sel.
NIa-VPg Replikasi genom (Primer untuk inisiasi sintesis RNA). NIa-Pro Proteinase
NIb Replikasi genom (RNA-dependent RNA polimerase [RdRp]).
6K1 & 6K2 Belum diketahui, namun diduga berperan pada: Replikasi RNA, pengatur untuk penghambatan translokasi nuclear NIa, membran pengikat proses replikasi.
(Sumber: Winterhalter 2005).
P1 HC-Pro P3 CI NIa
VPg NIb
Pro NIb CP
Gambar 2.2 Skema representasi organisasi genom Potyvirus (Sumber: Winterhalter 2005)
33kDA 32kDA 41kDA 6kDA 71kDA 6kDA 22kDA 27kDA 59kDA 31kDA
Tospovirus
Virus dalam genus Tospovirus menyebabkan kerugian yang signifikan pada pertanian di seluruh dunia. Nama genus ini berasal dari nama anggota pertama yaitu Tomato spotted wilt virus (TSWV). Awal infeksi virus ini terjadi pada penyakit layu tanaman tomat di Australia pada tahun 1915, kemudian dibuktikan dengan identifikasi penyebabnya adalah TSWV. TSWV awalnya dianggap sebagai satu-satunya anggota kelompok TSWV sampai awal 1990-an. Namun saat ini berdasarkan identifikasi dan karakterisasi beberapa virus, ternyata beberapa jenis virus lain mirip TSWV sehingga digolongkan dalam genus Tospovirus bagian dari famili Bunyaviridae. Lebih dari 12 jenis virus yang masuk dalam genus ini seperti Impatiens necrotic spot virus (INSV), Peanut bud necrosis virus (PBNV), Groundnut ringspot virus (GRV), Watermelon silver mottle virus (WSMV), Zucchini lethal chlorosis virus (ZLCV) dan Iris yellow spot virus (IYSV) (Adkins et al. 2005; Baker et al. 2007).
TSWV memiliki kisaran inang yang besar (800 spesies tanaman) dan sebagian besar penyakit yang disebabkan virus ini ditemukan pada tanaman di lapangan. INSV memiliki kisaran inang yang lebih kecil dan sebagian besar virus yang ditemukan menginfeksi tanaman hias di rumah kaca (Baker et al. 2007). Kedua virus telah dilaporkan menginfeksi tanaman anggrek sejak awal 1990-an (Hu et al. 1993, Koike & Mayhew 2001).
Di antara virus tanaman, Tospovirus memiliki morfologi partikel, organisasi genom dan strategi ekspresi yang unik. Partikel virus berbentuk pleomorfik berukuran 80-120 nm dan memiliki envelop pada permukaan yang terdiri dari lipid dan dua glikoprotein. Genom Tospovirus terdiri atas tiga ssRNA negatif sense utas tunggal RNA. Setiap genom RNA dienkapsidasi oleh banyak salinan protein nukleokapsid virus untuk membentuk struktur ribonucleoprotein juga dikenal sebagai nukleokapsid (Adkins et al. 2005; Hull 2002)
Anggrek Phalaenopsis yang bergejala infeksi virus seperti klorosis bercak cincin telah diamati dan berhasil diisolasi di Taiwan pada tahun 1998 (Chen et al. 1998). Virus yang telah diisolasi tersebut, ketika diinokulasi kembali ke jenis
yang menyebabkan klorosis bercak cincin pada Phalaenopsis anggrek di Taiwan ini berhasil diidentifikasi penyebabnya adalah Tospovirus .
Cymbidium Mosaic Potexirus (CymMV)
CymMV saat ini oleh sebagian ahli dimasukkan dalam Famili
Flexyvirideae dan sebagian ahli menyatakan tidak mempunyai famili yang tepat,
sehingga langsung tergolong dalam genus Potexvirus (Adams et al. 2004; Fauquet & Mayo 1999). Partikel Potexvirus berbentuk filamen lentur dengan ukuran panjang 470-580 nm dan diameter 13 nm. Partikel virus ini mengandung
linear, positive-sense, single stranded (ss)-RNA dengan ukuran 5,9-7,0 kb,
dibungkus oleh banyak subunit coat protein (CP) berukuran 18-27 kDa. RNA
diakhiri dengan polyadenilasi pada terminal 3’. Genom dari beberapa anggota
genus ini telah berhasil disekuen dan memperlihatkan adanya 5 open reading
frame (ORF). Beberapa diantaranya memiliki ORF keenam yang kecil yang
melengkapi ORF kelima, namum fungsi dari protein yang dikode oleh ORF ini belum diketahui seperti pada Cassava common mosaic virus (CsCMV),
Narcissus mosaic virus (NMV), Strawberry mild yellow edge virus (SMYEV), dan
White clover mosaic virus (WClMV) (Hull 2002). Saat ini sudah 11 spesies dari genus Potexvirus, termasuk CymMV, telah berhasil disekuen secara lengkap seperti NMV, PVX, WClMV, Bamboo mosaic virus (BaMV), Clover yellow mosaic virus (ClYMV), Foxtail mosaic virus (FoMV), Potato acuba mosaic virus (PAMV),
Papaya mosaic virus (PapMV), Plantago asiatica mosaic virus (PlAMV) dan Strawberry mild yellow edge virus (SMYEaV) (Wong et al. 1997). CymMV
termasuk ke dalam kelompok Potexvirus dengan partikel berbentuk memanjang
lentur dengan ukuran panjang ± 475-490 nm (Frowd & Tremaine 1977; Steinhart & Oshiro 1990).
Genom CymMV berukuran kira-kira 6-7 kb (Srifah et al 1996). Protein CP terdiri atas 257 asam amino dengan berat molekul 27.600 dalton, dengan
perbandingan komposisi basa (G, A, C dan U) RNA virus yaitu 21,1 : 28,9 : 24,4 :
Tabel 2.3 Organisasi genom CymMV
Genom (Protein)
Ukuran protein (kDa)
Posisi
nukleotida Fungsi
gp1 160 1-4326 Pengkode untuk produksi RNA polimerase,
Methyltransferase, helikase gp2 26 4333-5022 RNA helikase
gp3 13 5010-5348 Pergerakan antar sel dan pergerakan melalui pembuluh tanaman
gp4 10 5203-5478 Protein selubung (CP) gp5 24 5481-6152 Protein selubung (CP) (Sumber: Wong et al. 1997; ICTVdB Management 2006a)
Gambar 2.3 Skema representasi organisasi genom CymMV. Terminal 5’ dan 3’ noncoding region terletak pada bagian ujung. Angka-angka menunjukkan posisi awal dan akhir urutan genom (ICTVdB Management 2006a).
Gejala infeksi virus ini pada helaian daun muda dicirikan berupa adanya area klorotik yang tersamar. Kemudian bercak kecil tersebut membesar dan berubah menjadi bercak mosaik hijau cerah. Kontras antara area bercak cerah dan gelap menjadi lebih nyata ketika daun menjadi tua dan gejala menjadi lebih menyolok. Bercak nekrosis ditemukan pada daun kultivar tertentu, gejala pada bunga jarang terjadi tetapi ditemukan pada beberapa kultivar berupa bercak nekrosis coklat pada kultivar Cymbidium hibrida.
Odontoglossum ringspot virus (ORSV)
ORSV pertama kali diisolasi dan dikarakterisasi dari spesies anggrek Odontoglossum grande yang memperlihatkan gejala bercak cincin (ringspot)
pada daun. Virus ini juga menyebabkan gejala belang (mottle) berbentuk berlian, mosaik dan warna bunga pecah pada Cymbidium serta gejala warna bunga pecah pada Cattleya (Jensen & Gold, 1951). Warna bunga pecah (color break) pada anggrek juga dilaporkan terjadi pada jenis Odontoglossum, Cymbidium, Vanilla, Epidendrum, Encyclia, Oncidium, Phalaenopsis dan beberapa genus
RdRp
TGB CP
gp1
gp2
gp3 gp5
gp4
5’‐ ‐3’ Poly A
1 4326
4333
5203 5022 5010 5348
5478
anggrek lainnya. Warna pecah dapat terjadi bila disebabkan infeksi dua strain virus berbeda, yang lemah dan ganas. Pecah warna dikarakterisasi dengan variasi warna pada bunga, warna normal pada petal dan sepal diselingi oleh bagian warna yang lebih terang atau redup tidak beraturan (Burnett 1965). ORSV dapat menyebabkan nekrosis coklat bergaris dan malformasi serta distorsi pada rangkaian bunga Cattleya (Afieri et al. 1991; McMillan & Vendrame 2005). ORSV diketahui dapat menginfeksi pada 31 genus anggrek lainnya (Chen et al. 2006).
ORSV merupakan anggota genus Tobamovirus famili Virgaviridae. Anggota Tobamovirus lainnya yaitu Cucumber green mottle mosaic virus (CGMMV), Cucumber green mottle mosaic virus (CGMMV), Cucumber virus 4 (CV4), Frangipani virus (FV), Ribgrass mosaic virus (HRV), Sammons' opuntia virus (SOV), Sunn-hemp mosaic virus (SHMV), Tobacco mosaic virus (TMV) dan Tomato mosaic virus (ToMV) (Sammons & Chessin 1961; Siegel & Wildman
1954).
Partikel ORSV berbentuk batang kaku memanjang, tidak diselubungi envelop, terdiri atas molekul ssRNA berukuran 6 kb. Ukuran partikel virus ini 300 nm x 18 nm, sama seperti TMV (Paul 1975). Organisasi genom ORSV terdiri dari 6.618 nt dengan 5 ORF (Tabel 2.2 dan Gambar 2.2).
ORSV dapat dibedakan dari TMV dan Tobamovirus lainnya berdasarkan kisaran inang, serologi dan urutan nukleotida pada daerah terminal 3' (Ikegami & Inouye 1996). Uji proteksi silang pada tanaman tomat dengan strain TMV lemah menunjukkan pengurangan suseptibilitas tanaman terhadap strain virulen TMV lainnya, hal ini diduga berhubungan dengan terjadinya mutasi pada coat protein (Zaitlin 1976).
Tabel 2.4 Organisasi genom ORSV
Genom (Protein)
Ukuran protein (kDa)
Posisi
nukleotida Fungsi
gp1 181 1-4860 Methyltransferase, RNA helikase, RdRP-2 (RNA dependent RNA polimerase)
gp2 126 70-3408 RNA replikase
gp3 52 3484-4860 Belum diketahui
gp4 34 4814-5725 pergerakan virus antar sel dan dalam pembuluh tanaman
Gambar 2.4 Skema representasi organisasi genom ORSV (Sumber: ICTVdB Management 2006b) .
Induksi Ketahanan Secara Sistemik
Induksi ketahanan secara sistemik dengan agen penginduksinya patogen atau bahan kimia (systemic acquired resistance/SAR) merupakan metode yang telah lama dikembangkan untuk menghasilkan tanaman yang lebih tahan terhadap penyakit. Induksi ketahanan atau imunisasi atau ketahanan buatan adalah suatu proses stimulasi ketahanan tanaman inang tanpa introduksi gen-gen baru. Induksi ketahanan menyebabkan kondisi fisiologis yang mengatur sistem ketahanan menjadi aktif dan atau menstimulasi mekanisme ketahanan alami yang dimiliki oleh inang. Imunisasi tidak menghambat pertumbuhan tanaman, tetapi dapat meningkatkan hasil pada beberapa tanaman meskipun tanpa adanya patogen dan memberikan suatu cara bertahan terhadap tekanan lingkungan (Stomberg 1994; Tuzun & Kuc 1991).
Perlakuan dengan agen penginduksi dapat mengaktifkan secara cepat berbagai mekanisme ketahanan tanaman. Diantaranya akumulasi fitoaleksin dan peningkatan aktivias enzim kitinase, β-1,3-glukanase, dan β -1,4-glukosidase. Salah satu senyawa fenol yang sangat sederhana, 2-hydroxybenzoic acid atau asam salisilat, telah diketahui berperan penting sebagai molekul sinyal dari beberapa respon ketahanan tanaman (Smith-Becker et al. 1998).
Asam salisilat ditemukan secara tidak sengaja untuk pertama kali oleh White pada tahun 1979 yang mengamati aspirin (acetylsalicylic acid) yang dapat menginduksi ketahanan pada tembakau (Sticher et al. 1997). Dari semua derivat asam benzoat yang terhidroksilasi, hanya asam salisilat dan 2-dihidroxybenzoic acid yang aktif sebagai agen penginduksi. Ekspresi SAR sangat tergantung dari
4814
Subunit replikasi kecil
Gp3 gp 1
gp2
gp4
5’‐ ‐3’
gp5
Subunit replikasi besar
Subgenomic RNA
‐3’
‐3’ 5’‐
5’‐ 1
4860
70 3408
5725
adanya akumulasi asam salisilat dan berasosiasi dengan pathogenesis-related protein (PR protein) yang mempunyai aktivitas sebagai anti patogen (van Loon
2000). Asam salisilat adalah komponen yang dibutuhkan dalam jalur sinyal transduksi untuk induksi SAR sebagai bentuk peningkatan ketahanan tanaman melawan patogen berspektrum luas. Invasi oleh mikroorganisme menyebabkan gen penghasil ketahanan terinduksi untuk mensintesis asam salisilat dan mengaktifkan SAR. Seringkali pengenalan ini disertai oleh respon hipersensitif; suatu bentuk kematian sel inang secara cepat pada bagian sekitar titik masuk patogen.
Ketahanan terinduksi pertama kali diteliti secara sistematik oleh Ros pada tahun 1961, yang melakukan pengamatan terhadap tembakau yang terinfeksi TMV. Pengamatan dilakukan terhadap gejala yang ditimbulkan, yakni terjadi reaksi hipersensitif yang tidak terbatas pada sekitar bercak lokal nekrosis tetapi meluas pada bagian tanaman lainnya. Jaringan di sekitar perkembangan bercak sepenuhnya sukar ditembus oleh infeksi berikutnya. Asam salisilat diduga memegang peran dalam sinyal SAR dan ketahanan terhadap patogen. Hal ini terbukti dari adanya peningkatan konsentrasi asam salisilat yang dijumpai pada ratusan tembakau atau mentimun setelah diinfeksi patogen (Huang 2001).
Beberapa penelitian menunjukkan bahwa terdapat korelasi antara konsentrasi asam salisilat dengan peningkatan ketahanan tanaman terhadap penyakit. Salah satu bukti terhadap hal tersebut adalah dengan menginduksi tanaman Arabidopsis thaliana dan tembakau dengan cara transfer gen bakteri Pseoudomonas putida penghasil gen NahG yang mengkode enzim salisilat hidroksilase. NahG yang diketahui sebagai katalisator perubahan asam salisilat menjadi komponen inaktif yang dikenal sebagai Catechol. Berdasarkan hasil percobaan tersebut tanaman yang disisipkan gen NahG dan diinfeksi patogen tidak mengakumulasi asam salisilat, juga tidak mampu meningkatkan respon SAR tarhadap patogen. Hal ini menunjukkan bahwa untuk induksi SAR diperlukan konsentrasi asam salisilat yang tinggi (Delaney 1997).
Strategi pengendalian dengan mediasi CP membutuhkan tahapan awal kultur jaringan untuk penumbuhan kalus maupun tahapan multiplikasi kalus. Kultur jaringan juga sekaligus digunakan dalam tahapan seleksi in vitro hasil transformasi gen CP untuk mengetahui keberhasilan insersi gen. Seleksi pada tahap in vitro dapat mengurangi biaya dan waktu seleksi yang lama dibandingkan seleksi di lapangan. Seleksi in vitro telah dilakukan pada semua kalus/plantlet hasil transformasi gen. Metode ini didasari pada pemikiran bahwa kultur sel tanaman menyediakan suatu populasi ideal materi genetik yang homogen. Satu botolan kultur suspensi sel embriogenik secara teoritis menghasilkan jutaan tanaman yang dapat secara efektif diseleksi. Seleksi in vitro untuk ketahanan penyakit pertama kali dicobakan untuk tanaman tembakau tahan terhadap wildfire menggunakan methionine sulfoximine yang memiliki struktur analog dengan toksin wildfire (Jayasankar & Gray 2003).
Komponen utama yang berperan dalam SAR
Sinyal transduksi SAR berfungsi sebagai modulator mekanisme ketahanan penyakit. Pada saat SAR aktif, terjadi interaksi patogen dengan inang secara kompatibel, sebaliknya pada saat SAR inaktif interaksi inkompatibel bisa menjadi interaksi yang kompatibel. Mekanisme bagaimana modulasi ini terjadi masih belum diketahui. Namun sedikitnya sebagian dari respon ketahanan yang dimiliki tanaman dapat diekspresikan oleh gen SAR.
Ada dua komponen utama yang berperan dalam mekanisme SAR, yaitu gen penanda molekuler SAR dan asam salisilat. Meskipun kajian tentang SAR telah dilakukan selama hampir 100 tahun, namun demikian informasi tentang SAR kurang terungkap bagaimana secara kuantitatif respon SAR dianalisa. Untuk itu sangat penting dilakukan studi tentang identifikasi dan isolasi senyawa-senyawa yang terlibat dalam SAR, yang dapat digunakan sebagai penanda spesifik SAR. Penanda tersebut kemudian disebut sebagai gen SAR, dan telah diidentifikasi sebagai penginduksi yang erat hubungannya dengan awal terjadinya SAR pada daun yang tidak terinfeksi.
diekspresikan pada saat ketahanan tanaman secara sistemik, dimana pengkodean protein oleh gen-gen tersebut berperan, maka dapat dikatakan bahwa protein yang dikode oleh gen-gen SAR selalu berasosiasi dengan ketahanan penyakit.
Komponen kedua yang bertanggung jawab terhadap kejadian SAR adalah