IDENTIFIKASI DAN KARAKTERISASI BEBERAPA VIRUS
YANG MENGINFEKSI TANAMAN ANGGREK DI JAWA
SERTA INDUKSI KETAHANAN SISTEMIK
TANAMAN ANGGREK DENGAN ASAM SALISILAT
IRWAN LAKANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2012
Dengan ini saya menyatakan bahwa disertasi yang berjudul Identifikasi dan Karakterisasi Beberapa Virus yang Menginfeksi Tanaman Anggrek di Jawa Serta Induksi Ketahanan Sistemik Tanaman Anggrek dengan Asam Salisilat adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun pada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Februari 2012
Irwan Lakani NIM A461060021
IRWAN LAKANI. Identification and Characterization of Viruses Infecting Orchids in Java and Induced Systemic Resistance of Orchid Using Salicylic acid. Supervised by GEDE SUASTIKA, NURHAJATI MATTJIK, and TRI ASMIRA DAMAYANTI
Indonesia has a tremendous potency to develop orchid widely, due to the abundance of orchid germplasms. Several viruses infecting orchids were reported elsewhere. However, the presence of viruses infecting orchid in Indonesia is unknown. Thus, the aim of the researches were to identify viruses infecting orchids, its distribution in Java, its resistance response and to induced systemic resistance of susceptible orchid against Odontoglossum ringspot virus (ORSV) by using salicylic acid. Detection and identification of samples obtained from several survey locations by serological test and RT-PCR found that ORSV was detected mainly in samples from West Java (Taman anggrek Indonesia, Kebun Raya-Bogor, Gunung sindur-Bogor, Cianjur, Lembang). Cymbidium mosaic virus (CymMV) was detected mainly in central and East Java (Magelang, Malang, Surabaya). Cucumber mosaic virus
(CMV), and Potyvirus were detected from all samples tested, however Tospovirus
was undetectable from all samples by RT-PCR. Dual infection of ORSV and CymMV was found only in several samples from West Java. The nucleotide and amino acid sequences analysis of coat protein (CP) gene of six Java isolates of CymMV showed high homology with corresponding other 10 isolates elsewhere ranging from 95.8 to 98.8%, and 97.3 to 100%. The homology of nucleotide and amino acid sequences Java isolates of ORSV to other 11 isolates elsewhere ranging from 96.8 to 99.7% and 94.9 to 99.3%, respectively. These indicating that CymMV, ORSV, CMV and
Potyvirus were present infecting orchids in Java, Indonesia. The ORSV could infect all indicator plants tested with incidence ranging from 60-100% and varied symptoms. The resistance response of 13 species of commercial orchids against ORSV showed that 61.54% of species was categorized as susceptible, and 38.46% was resistant based on type of symptoms, incubation period, disease incidence and virus accumulation. To increase the systemic resistance against ORSV infection, the susceptible orchid Dendrobium nindii was treated by using Salicylic acid (SA) on tissue culture media at concentration 1, 2, 4, 8, and 16 ppm. The SA on tissue culture media did not have any adverse effect on growth parameters and had decreased incidence, symptom expression and ORSV accumulation at concentration from 4-16 ppm. The SA treatment in plants at concentration 8-16 ppm increased total SA, and increased Phenylalanine ammonialyase (PAL) enzyme activity in compared with untreated plants. Among tested concentration, SA at concentration16 ppm was successfully able to increased D. nindii systemic resistance against ORSV with efficiency up to 93.75%. This is the first report of utilizing SA in orchid tissue culture media to increase systemic resistance against ORSV.
Keywords : Orchid, CMV, Potyvirus, CymMV, ORSV, Induced systemic resistance, SAR, Salicylic acid, Phenylalanine ammonialyase
Tanaman Anggrek di Jawa serta Induksi Ketahanan Sistemik Tanaman Anggrek dengan Asam Salisilat. Dibimbing oleh GEDE SUASTIKA, NURHAJATI MATTJIK, dan TRI ASMIRA DAMAYANTI.
Indonesia mempunyai potensi luar biasa dalam mengembangkan tanaman anggrek, karena banyaknya spesifikasi plasma nutfah, namun Indonesia tertinggal dari negara lain terkait hal tersebut. Banyak anggrek asli Indonesia yang dikembangkan dan disilangkan di negara lain, kemudian diimpor kembali. Masalah yang dikhawatirkan dalam kegiatan ekspor impor bahan tanaman adalah terbawanya patogen tertentu termasuk virus. Dua virus utama yang banyak menginfeksi anggrek adalah Cymbidium mosaic virus (CymMV) dan Odontoglossum ringspot virus (ORSV), selain Cucumber mosaic virus, Potyvirus dan Tospovirus. Virus-virus tersebut telah banyak dilaporkan keberadaannya di beberapa negara, namun informasinya di Indonesia belum banyak diketahui. Untuk itu perlu dilakukan penelitian yang seksama menyangkut deteksi dan identifikasi virus-virus yang menginfeksi tanaman anggrek.
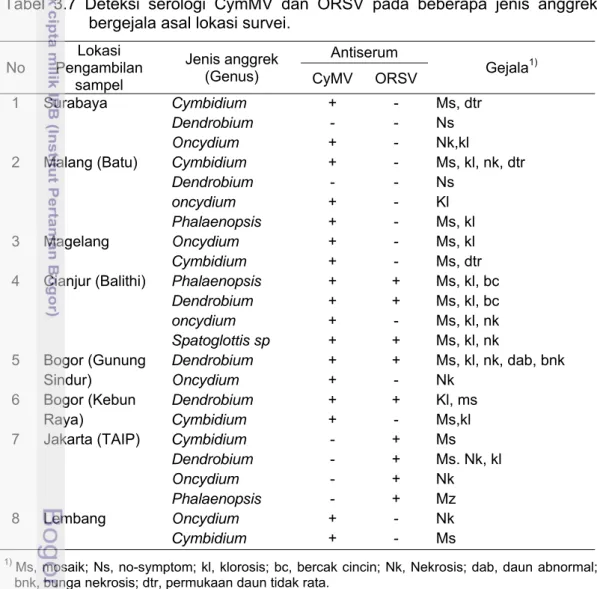
Infeksi CymMV berhasil terdeteksi pada tanaman anggrek dari beberapa lokasi pertanaman di Jawa yaitu di Surabaya, Malang, Magelang, Lembang, dan Bogor (Gunung Sindur dan Kebun Raya). Virus ini menunjukkan gejala khas berupa nekrosis, klorosis dan mosaik pada daun yang terinfeksi dan gejala ini bervariasi pada tiap lokasi pengamatan. Infeksi ORSV terdeteksi melalui metode serologi pada tanaman anggrek dari Jakarta, Cianjur dan Bogor. Gejala infeksi ORSV yang ditemukan pada daun dan bunga berupa belang, mosaik, dan nekrosis. Infeksi ganda kedua virus ditemukan hanya pada sampel-sampel dari Jawa Barat (Cianjur dan Bogor).
Hasil RT-PCR menggunakan primer universal untuk CMV subgrup IB, Potyvirus dan Tospovirus berhasil mengamplifikasi CMV dan Potyvirus dengan pita DNA berukuran masing-masing 382 bp dan 327 bp, dan tidak teramplifikasi Tospovirus pada semua sampel dari lokasi survei. Hasil amplifikasi menggunakan primer spesifik untuk gen CP CymMV didapatkan DNA berukuran 672 bp pada sampel dari lokasi Gunung Sindur-Bogor, Kebun Raya-Bogor, Lembang, Magelang, Malang dan Surabaya.
Homologi sekuen enam isolat CymMV yang berasal dari Gunung Sindur-Bogor, Kebun Raya-Sindur-Bogor, Lembang Bandung (Jawa Barat), Magelang (Jawa Tengah) dan Surabaya, Malang (Jawa Timur) dengan 10 isolat CymMV dari beberapa negara lain menunjukkan homologi sebesar 95,8-98,8% pada tataran nukleotida dan 97,3-100% pada tataran asam amino. Analisis filogenetik enam isolat CymMV asal Pulau Jawa dan beberapa isolat dari negara lain memperlihatkan keenam isolat terpisah dalam tiga kelompok yang berbeda untuk masing-masing isolat.
Hasil RT-PCR gen CP dengan primer spesifik ORSV berhasil mengamplifikasi DNA berukuran 500 bp pada sampel anggrek dari lokasi Gunung Sindur-Bogor, Kebun Raya-Bogor, Cipanas-Cianjur dan Taman Anggrek Indonesia Permai (TAIP)-Jakarta. Hasil analisis sekuen nukleotida gen CP ORSV isolat Gunung Sindur-Bogor, Kebun Raya-Bogor, Cipanas-Cianjur, dan Jakarta menunjukkan homologi berkisar 96,8-100%. Persentase tingkat kesamaan nukleotida ORSV tertinggi (100%) yaitu antara isolat Cipanas-Cianjur dengan isolat Gunung Sindur-Bogor. Sedangkan homologi berdasarkan urutan nukleutida dan asam amino antara isolat Pulau Jawa dengan 11 sekuen pada
membentuk satu kelompok yang sama. Analisis lebih lanjut terhadap sekuen asam amino dari empat isolat ORSV dan enam isolat CymMV asal Pulau Jawa memperlihatkan terjadinya mutasi pada beberapa posisi yang berbeda. Mutasi yang terjadi diduga berhubungan dengan gejala yang ditimbulkan.
Hasil penularan secara mekanis pada delapan tanaman indikator (Datura stramonium, Nicotiana tabacum cv. Xanthi, N. benthamiana, Chenopodium amaranticolor, C. quinoa, Gomphrena globosa, Cassia occidentalis dan Physalis floridana) menunjukkan bahwa ORSV mampu menginfeksi semua jenis tanaman indikator dengan kejadian penyakit 60-100%. Kejadian penyakit dikonfirmasi secara serologi pada daun bergejala dan beberapa yang tidak bergejala
Pengujian ketahanan beberapa jenis anggrek terhadap infeksi ORSV menunjukkan adanya variasi respon masing-masing jenis anggrek. Gejala yang umum berupa lesio lokal, nekrotik, klorotik serta adanya bercak cincin pada permukaan daun. Gejala mulai muncul 4-54 hari setelah inokulasi pada anggrek yang rentan, sedangkan pada anggrek yang tahan gejala mulai muncul pada 10-90 hari setelah inokulasi. Kejadian penyakit berkisar dari 40% pada anggrek tahan, hingga 100% pada anggrek rentan. Nilai absorbansi enzyme linked-immunosorbant assay (ELISA) berkisar dari 1,5-13 kali nilai kontrol tanaman sehat. Berdasarkan gejala, masa inkubasi, kejadian penyakit, dan nilai absorbansi ELISA dapat diketahui bahwa sebagian besar anggrek yang diinokulasi ORSV rentan (61,54%) dan sebagian lagi agak tahan (38,46%). Salah satu jenis anggrek yang rentan berdasarkan hasil penelitian ini yaitu Dendrobium nindii ditingkatkan ketahanannya terhadap infeksi ORSV menggunakan senyawa asam salisilat.
Pemberian asam salisilat (SA) dalam media kultur jaringan dengan konsentrasi 1, 2, 4, 8 dan 16 ppm memberikan pengaruh yang sama terhadap variabel pertumbuhan (tinggi plantlet, jumlah tunas, pertambahan jumlah daun, lebar daun, jumlah dan panjang akar) dengan kontrol tanaman anggrek yang tidak diberi SA. Hal ini menunjukkan bahwa pemberian SA sampai konsentrasi 16 ppm tidak berpengaruh negatif pada pertumbuhan tanaman anggrek. Inokulasi ORSV pada bibit anggrek yang diberi perlakuan SA pada konsentrasi 4-16 ppm menunjukkan kejadian penyakit, keparahan dan akumulasi ORSV yang rendah, dan ORSV gagal menginfeksi secara sistemik. Gejala yang timbul pada bibit anggrek tersebut adalah lesio lokal, yang merupakan salah satu ciri respon ketahanan tanaman terhadap infeksi virus. Akumulasi SA dan aktivitas enzim phenilalanine ammonialyase (PAL) pada jaringan tanaman meningkat pada konsentrasi SA 8-16 ppm. Pemberian SA pada konsentrasi 4-16 ppm menunjukkan akumulasi SA pada infeksi awal (6 jam setelah inokulasi virus) menghambat replikasi virus yang lebih baik dibanding perlakuan 0-2 ppm. Diantara semua perlakuan, pemberian SA pada konsentrasi 16 ppm pada D.nindii mampu ditingkatkan ketahanannya terhadap ORSV dengan efisiensi hingga mencapai 93,75%.
Kata Kunci : Anggrek , Cucumber mosaic virus, Potyvirus, Cymbidium mosaic virus, Odontoglossum ringspot virus, Salicylic acid, Induksi ketahanan sistemik, SAR, Phenylalanine ammonialyase.
©Hak cipta milik IPB, tahun 2012
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebut sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
SERTA INDUKSI KETAHANAN SISTEMIK
TANAMAN ANGGREK DENGAN ASAM SALISILAT
IRWAN LAKANI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Entomologi dan Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2012
Penguji pada Ujian Tertutup : 1. Dr. Ir. Budi Marwoto, M.Sc.
2. Dr. Ir. Kikin Hamzah Mutaqin, M.Si.
Penguji pada Ujian Terbuka : 1. Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. 2. Prof. Dr. Ir. H. Alam Anshary, M.Si.
Salisilat Nama : Irwan Lakani NIM : A461060021
Disetujui
Komisi Pembimbing
Dr.Ir. Gede Suastika, M.Sc. Ketua
Prof. Dr. Ir. Nurhayati Mattjik, M.S. Dr. Ir. Tri Asmira Damayanti, M.Agr Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. Dr. Ir. Dahrul Syah, M.Sc. Agr.
Puji serta syukur dihaturkan ke hadirat Allah SWT atas limpahan ilmu pengetahuan dan pemahaman-Nya yang diberikan sehingga penelitian untuk menyelesaikan studi doktoral dapat diselesaikan. Penelitian ini berjudul Identifikasi dan Karakterisasi Beberapa Virus yang Menginfeksi Tanaman Anggrek di Jawa serta Induksi Ketahanan Sistemik Tanaman Anggrek Dengan Asam Salisilat, yang dilakukan pada kurun waktu tahun 2008-2011.
Salah satu bagian disertasi ini telah diterbitkan pada Hayati Journal of Bioscience 17 (2): 101-104 tahun 2010 dengan judul “Identification and molecular characterization of odontoglosum ringspot virus (ORSV) from Bogor, Indonesia”. Bagian penelitian ini juga telah disajikan pada empat seminar internasional yaitu, (1) Seminar Internasional dan Kongres Perhimpunan Fitopatologi Indonesia di Makasar tahun 2009 dengan judul “ Studi Virus Menginfeksi Tanaman Anggrek di Indonesia : Odontoglossum ringspot virus”; (2) Kongres ISSAAS di Bali tahun 2010 dengan judul “Molecular Characterization of Cymbidium Mosaic Virus (CymMV) Infecting Orchids In Java, Indonesia”; (3) Konggres ISSAAS di Bogor tahun 2011 dengan judul “Induced Systemic Resistance of Orchid Against Odontoglossum Ringspot Virus Using Salicylic Acid”; dan (4) Seminar Internasional dan Konggres Perhimpunan Fitopatologi Indonesia di Solo tahun 2011 dengan judul “Resistance Response of Several Orchids Against Odontoglossum ringspot virus Infection ”,
Sekuen gen CP CymMV telah didaftarkan pada GeneBank dengan nomor aksesi AB693982 (isolat Gunung Sindur), AB693983 (isolat Kebun Raya Bogor), AB693984 (isolat Lembang-Bandung), AB693985 (isolat Magelang), AB693986 (isolat Malang), dan AB693987 (isolat Surabaya). Sekuen gen CP ORSV juga telah didaftarkan pada GeneBank dengan nomor aksesi AB693988 (isolat Gunung Sindur), AB693989 (isolat Kebun Raya Bogor), AB693990 (isolat TAIP-Jakarta) dan AB693991 (isolat Cipanas-Cianjur).
Ungkapan rasa terima kasih yang tak terhingga disampaikan kepada komisi pembimbing, Bapak Dr.Ir. Gede Suastika, M.Sc., Ibu Prof.Dr.Ir. Nurhajati Matjjik, M.Si., dan Ibu Dr.Ir. Tri Asmira Damayanti, M.Agr. atas segala bimbingan, arahan, kritik, saran serta dukungan moril dan materil yang diberikan selama penelitian hingga penyelesaian disertasi ini. Terima kasih pula disampaikan kepada Bapak Dr. Ir. Budi Marwoto, Bapak Dr. Ir. Kikin Hamzah Mutaqin, M.Si, Ibu Dr. Ir. Sri Hendrastuti Hidayat, M.Sc dan Bapak Prof. Dr. Ir. H. Alam Anshary, M.Si yang telah meluangkan kesediaannya menjadi penguji luar komisi pada sidang tertutup dan terbuka. Segala saran dan pertanyaan telah banyak membantu untuk penyempurnaan disertasi ini.
Ucapan terima Kasih disampaikan kepada institusi asal penulis, Rektor Universitas Tadulako, Dekan Fakultas Pertanian dan Ketua Jurusan Hama dan Penyakit Tumbuhan, atas izin yang diberikan untuk mengikuti program strata tiga (doktoral) di Program Studi Entomologi dan Fitopatologi, Sekolah Pascasarjana Institut Pertanian Bogor. Ucapan terima kasih yang sama disampaikan kepada Rektor IPB, Dekan Sekolah Pascasarjana IPB, Ketua Departemen Proteksi Tanaman, Ketua Program studi Entomologi–Fitopatologi dan staf pengajar Mayor Fitopalogi dan Entomologi, serta staf administrasi Pascasarjana dan Departemen Proteksi Tanaman, atas kelancaran selama penulis menempuh pendidikan di IPB. Tak lupa dihaturkan terima kasih kepada manajemen program Beasiswa Program Pascasarjana (BPPS) dan Program Hibah Penelitian Disertasi,
rekan-rekan tim peneliti bersama virus anggrek, Khamdan, Leny, Fitri Menisa, dan Putri Syahierah atas kerjasamanya selama pelaksanaan penelitian. Terima kasih pula atas peran serta dan diskusinya pada Tuti Legiastuti yang banyak membantu dalam teknis pelaksanaan beberapa bagian penelitian di Laboratorium Virology Tumbuhan. Juga ucapan terima kasih kepada teman-teman peneliti di Lab. Virologi, Pak Rai Maya Temaja, Ibu Ifa Manzilla, Pak Jumsu, Ibu Rita Noveriza, Pipit, Miftah, Melinda, Ita, Sherly, Rita, kepada rekan-rekan lainnya yang tidak dapat disebut satu per satu. Ucapan Terima kasih pula pada teknisi pranata pak Edi Supandi. Ucapan terima kasih secara khusus disampaikan kepada Bapak Ir. Yoyo Sulyo, MS, atas informasi awal adanya virus pada anggrek di Jawa. Terima kasih juga kepada para petani dan pengusaha anggrek yang bersedia untuk diambil contoh tanaman anggreknya untuk keperluan penelitian ini. Kepada teman-teman serumah, Pak Nur Sangaji, Ibu Rostiati, Pak Iskandar, Pak Wahid, rekan-rekan Himpunan Mahasiswa Pascasarjana Sulawesi Tengah (HIMPAST), dan Dewan Mahasiswa Pascasarjana IPB (2010/2011) serta Forum Wacana Ento-Fito, terima kasih atas dukungannya.
Rasa rindu dan sayang serta hormat sedalam-dalamnya penulis sampaikan kepada kedua orang tua ibunda Sun Lasori (Alm) dan ayahanda Hamzah Lakani (Alm) serta nenek tersayang Wau Lamaga (Alm), terima kasih atas curahan kasih sayang dan bekal kekuatan mental yang sempat diberikan selama hidup untuk dapat terus mencapai cita-cita pendidikan. Semoga Allah SWT menyayangi mereka sebagaimana sayangnya mereka kepada penulis. Kepada paman dan bibi serta kakak-kakak dan adikku, Djal, Yam, Yuyi, Yun, Sukri dan Ti’, terima kasih telah menyemangati kuliahku.
Kepada ibu dan bapak mertua tersayang Dra. Farida S. Amu, M.Si dan Subandjar Suhadi, penulis mengucapkan terima kasih atas segala do’a serta bantuan moril dan materil selama mengikuti pendidikan pascasarjana. Juga kepada kakak dan adik ipar, Susi Handayani, Yayuk, Gunawan, Nunung, dihaturkan terima kasih atas dukungannya kepada penulis.
Kepada istri tercinta Dian Astuti, SP, terima kasih atas kesabaran, cinta, sayang, dan kesetiaan, serta do’anya yang tak henti-hentinya untuk suamimu ini. Kesabarannya merawat suami dan anak-anak ditengah kesibukan bekerja, memberi arti besar pada diri penulis. Kepada anak-anakku tersayang Afiqa Syazana, Muh.Rasyal Zulfahri dan Kaisya Mazaya, mohon maaf sedalam-dalamnya karena tidak dapat menunjukkan secara maksimal rasa sayang Ayah pada kalian karena terpisah selama kuliah. Ayah sangat menyayangi kalian walau tidak sering bersama-sama.
Akhirnya, semoga hasil penelitian ini dapat memberi manfaat untuk pembaca dan pencari informasi.
Bogor, Februari 2012
Penulis dilahirkan di Luwuk (Sulawesi Tengah), 15 Oktober 1970. Penulis merupakan anak ke enam dari tujuh bersaudara dari pasangan Hamzah Lakani (Alm) dan Sun Lasori (Almh). Penulis menikah dengan Dian Astuti, SP dan dikaruniai tiga orang putra yaitu Afiqah Syazana (6 tahun), Muhammad Rasyal Zulfahri (4 tahun) dan Kaisya Mazaya (2 tahun).
Penulis menempuh pendidikan sarjana pada Jurusan Budidaya Pertanian, Fakultas Pertanian, Universitas Tadulako, lulus pada tahun 1996. Pendidikan Magister ditempuh di Program Studi Entomologi dan Fitopatologi, Sekolah Pascasarjana Institut Pertanian Bogor dan menyelesaikan studi pada tahun 2006. Pada tahun 2006, penulis melanjutkan studi Doktoral pada program studi yang sama di IPB.
Sejak tahun 2000 penulis diangkat sebagai staf pengajar tetap pada Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas Tadulako, Palu.
Selama mengikuti program S3, penulis menjadi pengurus Dewan Mahasiswa Pascasarja Institut Pertanian Bogor tahun 2010/2011 dan Ketua Himpunan Mahasiswa Pascasarjana Entomologi-Fitopatologi tahun 2010-2012.
DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN I. PENDAHULUAN Latar Belakang... 1 Tujuan ... 6 Hipotesis... 7 Strategi Penelitian ... 7
II. TINJAUAN PUSTAKA Budidaya Tanaman Anggrek... 9
Kultur Jaringan Tanaman Anggrek... 12
Kultur Jaringan dan Virus Tumbuhan... 14
Beberapa Virus Tanaman yang Menginfeksi Anggrek... 15
Induksi Ketahanan secara Sistemik ... 23
Mekanisme Induksi Asam Salisilat... 28
Daftar Pustaka... 33
III. IDENTIFIIKASI DAN KARAKTERISASI BEBERAPA VIRUS YANG MENGINFEKSI TANAMAN ANGGREK DI PULAU JAWA Abstrak 41 Abstract 42 Pendahuluan ... 43
Bahan dan Metode... 47
Hasil... 53
Pembahasan... 74
Kesimpulan ... 83
Daftar Pustaka... 84
IV. RESPON KETAHANAN BEBERAPA JENIS ANGGREK
TERHADAP INFEKSI ODONTOGLOSSUM RINGSPOT VIRUS Abstrak 89 Abstract 90 Pendahuluan ... 91Bahan dan Metode... 94
Hasil... 96
Pembahasan... 99
Kesimpulan ... 102
Abstrak 105
Abstract 106
Pendahuluan ... 107
Bahan dan Metode... 111
Hasil... 114
Pembahasan... 119
Kesimpulan ... 123
Daftar Pustaka... 124
VI. PEMBAHASAN UMUM 127
VII. KESIMPULAN DAN SARAN 135
DAFTAR PUSTAKA 137
1.1 Data perkembangan volume dan nilai ekspor - impor
anggrek 2005 – 2008 ... 2
2.1 Organisasi genom CMV... 16
2.2 Organisasi genom Potyvirus... 18
2.3 Organisasi genom CymMV ... 21
2.4 Organisasi genom ORSV…..... 22
3.1 Komposisi reagen untuk reaksi reverse trancription (RT)... 48
3.2 Komposisi bahan untuk reaksi PCR... 48
3.3 Sekuen primer yang digunakan untuk deteksi virus pada anggrek... 49
3.4 Kondisi PCR untuk deteksi virus pada anggrek... 49
3.5 Isolat ORSV dari beberapa negara dan TMV pada GeneBank yang dibandingkan dengan enam isolat CymMV asal Indonesia... 50
3.6 Isolat CymMV dari beberapa negara dan PVX pada GeneBank yang dibandingkan dengan enam isolat CymMV asal Indonesia... 51
3.7 Deteksi serologi CymMVdan ORSV pada beberapa jenis anggrek bergejala asal lokasi survei... 58
3.8 Perbandingan hasil ELISA CymMV terhadap sampel anggrek yang dikumpulkan dari beberapa lokasi survei... 59
3.9 Rekapitulasi hasil deteksi RT-PCR virus anggrek dari lokasi survei…... 59
3.10 Homologi beberapa isolat CymMV asal Pulau Jawa dan negara yang berbeda berdasarkan sekuen nukleotida gen CP... 64
3.11 Homologi beberapa isolat CymMV asal Pulau Jawa dan negara yang berbeda berdasarkan sekuen asam amino gen CP... 64
3.12 Mutasi titik yang terjadi pada enam isolat CymMV asal Pulau Jawa yang dibandingkan dengan 10 isolat CymMV dari beberapa negara lain... 65
3.13 Perbedaan posisi asam amino pada gen CP enam isolat CymMV asal Pulau Jawa dengan 10 isolat CymMV dari beberapa negara lain... 65
3.14 Homologi nukleotida gen CP ORSV isolat Pulau Jawa dengan isolat-isolat dari beberapa negara lain... 69
3.15 Homologi asam amino gen CP ORSV isolat Bogor dengan isolat-isolat dari beberapa negara lain... 69
3.16 Mutasi titik yang terjadi pada enam isolat ORSV asal Pulau Jawa yang dibandingkan dengan 10 isolat ORSV dari beberapa negara lain……… 70
3.17 Perbedaan asam amino pada gen CP empat isolat ORSV asal Pulau Jawa dengan 11 isolat ORSV dari beberapa negara lain……….. 70
3.18 Hasil uji penularan dan NAE ORSV pada beberapa tanaman indikator 73 4.1 Kategori respon ketahanan beberapa jenis anggrek terhadap ORSV…. 95 4.2 Respon berbagai jenis anggrek terhadap infeksi ORSV... 98
Halaman
1.1 Alur penelitian virus pada tanaman anggrek... 8 2.1 Skema representasi organisasi genom CMV... 16 2.2 Skema representasi organisasi genom Potyvirus... 18 2.3 Skema representasi organisasi genom CymMV... 21 2.4 Skema representasi organisasi genom ORSV...... 23
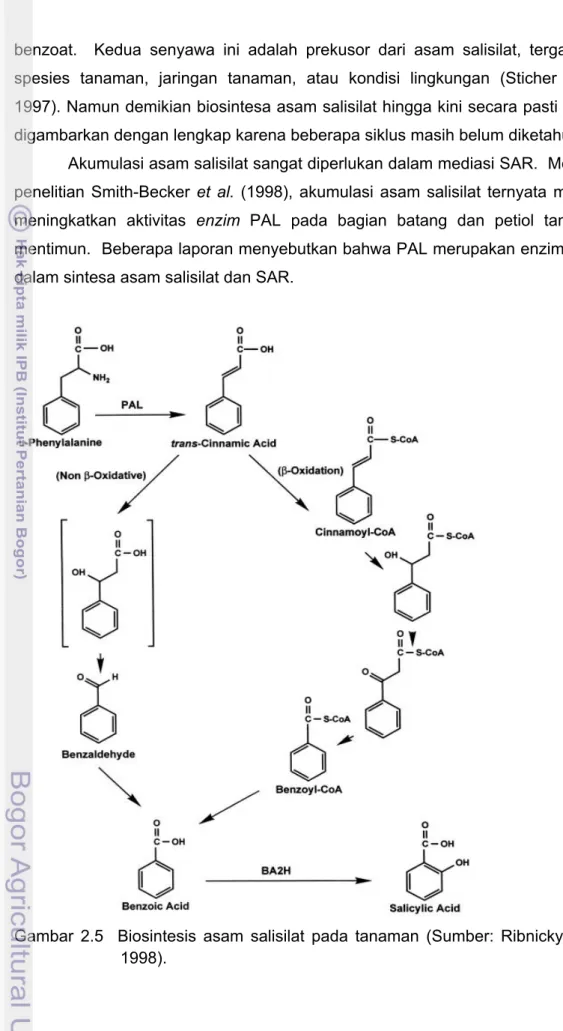
2.5 Biosintesis asam salisilat pada tanaman……… 27
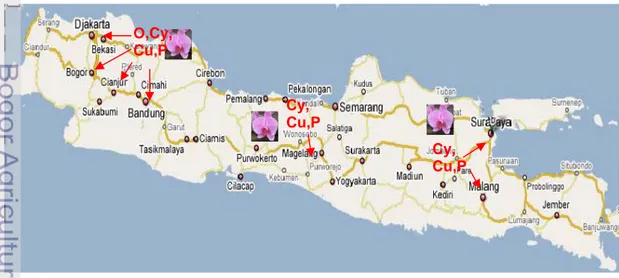
2.6 Alur transduksi signal yang mengatur terjadinya ketahanan………….. 30 3.1 Sebaran sampel anggrek yang terinfeksi ORSV, CymMV, CMV dan
Potyvirus di Pulau Jawa... 53 3.2 Variasi gejala infeksi CymMV pada tanaman anggrek di beberapa
lokasi pengamatan... 55 3.3 Kemiripan gejala pada anggrek Cymbidium yang diamati
pada tiga lokasi... 55 3.4 Perbandingan gejala pada tanaman anggrek yang terinfeksi
CymMV... 56 3.5 Gejala pada tanaman anggrek Dendrobium yang terinfeksi ORSV…... 57 3.6 Gejala pada tanaman anggrek Dendrobium yang terinfeksi ganda
CymMV dan ORSV... 57 3.7 Hasil visualisasi pita DNA CMV pada gel agarose 1,2% TBE... 60 3.8 Hasil visualisasi pita DNA Potyvirus pada gel agarose 1,2% TBE... 60 3.9 Hasil visualisasi pita DNA Tospovirus pada gel agarose 1,2% TBE... 61 3.10 Hasil visualisasi pita DNA CymMV pada gel agarose 1,2% TBE... 61 3.11 Hasil visualisasi DNA gen CP ORSV pada gel agarose 1,2% TBE... 62 3.12 Pohon filogenetika CymMV berdasarkan sekuen nukleotida dan
asam amino... 67 3.13 Pohon filogenetika ORSV berdasarkan nukleotida dan asam amino.... 72 3.14 Gejala penularan ORSV pada tanaman indikator... 73 4.1 Gejala hasil penularan ORSV pada beberapa jenis anggrek... 97 5.1 Plantlet hasil kultur jaringan pada media perakaran siap untuk
diaklimatisasi... 114 5.2 Pengaruh pemberian asam salisilat (SA) pada beberapa parameter
pertumbuhan plantlet anggrek... 115 5.3 Gejala yang muncul pada tanaman anggrek hasil perlakuan SA
setelah diinokulasi ORSV... 116 5.4 Akumulasi SA dan aktivitas enzim PAL... 119
Halaman
1 Hasil alignment nukleotida dan asam amino genom ORSV... 141 2 Hasil alignment nukleotida dan asam amino genom CymMV... 144 3 Data pengamatan dan anova kultur jaringan anggrek ... 148
I. PENDAHULUAN
Latar Belakang
Anggrek adalah salah satu tanaman hias yang banyak diminati masyarakat. Saat ini, anggrek sudah menjadi bagian dari kebutuhan masyarakat perkotaan, sehingga anggrek merupakan komoditas ekonomi dalam perdagangan lokal maupun internasional. Namun demikian kebutuhan pasar lokal belum dapat dipenuhi karena produksi bibit, bunga potong maupun tanaman anggrek masih rendah dan jenisnya terbatas. Pasar tanaman anggrek (pot plant) di Indonesia 75% didominasi oleh tanaman dari Thailand dan Taiwan (Suharto 2002). Potensi pasar anggrek dalam negeri cukup besar karena jika 10 persen saja orang Indonesia yang menyukai anggrek dari total penduduk Indonesia yang mencapai lebih dari 240 juta jiwa, maka secara ekonomi potensinya besar.
Perkembangan produksi tanaman anggrek sejak tahun 2005 hingga 2009 cenderung meningkat. Meskipun pada tahun 2007 produksi tanaman anggrek mengalami penurunan, namun pada tahun 2008 dan 2009 produksinya kembali meningkat. Tahun 2005 produksi anggrek nasional sebesar 7902,4 tangkai meningkat menjadi 10 903,4 tangkai, pada tahun 2006 menurun menjadi 9484,4 tangkai dan kembali meningkat menjadi 16 205,9 pada tahun 2009 (Mattjik 2011). Jika dibandingkan dengan data ekspor-impor anggrek Indonesia tahun 2005-2008 berdasarkan bentuk bahan tanaman anggrek menunjukkan angka fluktuatif (Tabel 1). Sejak tahun 2005 Indonesia mengalami defisit dalam hal ekspor benih sehingga Indonesia banyak mengimpor dari negara lain. Masuknya benih dari berbagai negara membawa implikasi terhadap penyebaran penyakit baru ke Indonesia.
Untuk meningkatkan produksi tanaman dan bunga anggrek yang rata-rata produktifitasnya saat ini masih tergolong rendah bila dibandingkan potensinya, diperlukan upaya meningkatkan potensi genetik. Sehingga pengembangan kawasan sentra untuk meningkatkan produksi dapat ditingkatkan sehingga mencapai 2-3 kali lipat produksi dari yang dicapai saat ini. Berdasarkan proyeksi produksi tahun 2010, produktifitas anggrek diharapkan mencapai 8-10 tangkai pertanaman (Direktorat Jenderal Pengolahan dan Pemasaran Hasil Departemen Pertanian 2005).
2
Tabel 1.1
Data perkembangan vo
lume dan nilai ekspor - impor anggrek dari tahu
n 2005 – 20 08 Tahun No. Komoditi 2005 2006 2007 2008 Volume Nilai Volume N ilai Volume Nilai Volume Nilai (Kg) (US $) (Kg) (US $) (Kg) (US $) (Kg) (US $) EKSPOR 1 Anggre k pot ong,ste k tanp a aka r 184 02 7 130 682 537 949 743 704 10 398 231 416 3140 8796 2 Anggre k pot ong, ste k beraka r 438 45 7 1 405 25 2 361 839 1 222 58 7 190 412 918 666 152 025 718 91 3 Bibit anggre k 87 011 25 044 866 9612 413 1329 10 000 535 4 Bunga ang grek sega r 139 15 4 321 171 1 719 46 1 597 276 5 Bunga se ga r untuk rang ka ian dan peng guna an l a in 1581 15 260 1765 12 510 Jumla h 848 64 9 1 882 14 9 2 620 11 5 2 573 17 9 202 80 4 1 166 67 1 166 93 0 740 75 IMPOR 1 Anggre k pot ong, ste k tan pa akar 17 726 14 776 231 993 171 798 1617 8394 2 Anggre k pot ong, ste k beraka r 4358 13 341 600 7065 3 Bibit anggre k 117 81 3 524 409 70 248 327 719 70 895 471 381 34 551 78 215 4 Bunga ang grek sega r 16 291 59 038 6206 42 019 5 Bunga se ga r untuk rang ka ian dan peng guna an l a in 177 429 100 Jumla h 156 18 8 611 564 309 047 548 601 72 689 480 204 34 651 78 265 DEFISIT/ SURPL U S 1 Anggre k pot ong, ste k tan pa akar 166 30 1 115 906 305 956 571 906 8781 223 022 3140 8796 2 Anggre k pot ong, ste k beraka r 434 09 9 1 391 91 1 361 239 1 215 52 2 190 412 918 666 152 02 5 718 91 3 Bibit anggre k (30 80 2) (499 3 65 ) (69 382 ) (318 1 07 ) (70 482 ) (470 0 52 ) (24 55 1) (77 68 4 Bunga ang grek sega r 122 86 3 262 133 1 713 25 5 555 257 5 Bunga se ga r untuk rang ka ian dan peng guna an l a in -- - 1404 14 831 1665 12 460 Jumla h 92 461 1 270 58 5 2 311 06 8 2 024 57 8 130 115 686 467 132 27 9 662 48
Kendala usahatani anggrek salah satunya adalah serangan hama dan penyakit. Khusus menyangkut serangan penyakit, salah satu diantaranya adalah infeksi virus yang telah banyak dilaporkan di beberapa negara. Tanaman anggrek dapat terinfeksi lebih kurang 50 jenis virus (Chang et al. 2005; Zettler et al. 1990; Navalienskiene et al. 2005). Dua jenis virus penting yang menyerang anggrek dan vanili serta penyebarannya yang luas di dunia adalah Cymbidium mosaic virus (CymMV) dan Odontoglossum ringspot virus (ORSV) (Zettler et al. 1990; Wisler 1989; Sherpa et al. 2004 ; Grisoni et al. 2004). Selain kedua virus tersebut beberapa virus lain yang juga dilaporkan menginfeksi tanaman anggrek adalah Cucumber mosaic virus (CMV) dan virus dari genus Potyvirus. CMV dilaporkan menginfeksi tanaman anggrek di Taiwan, China, USA (Florida) dan Puerto Rico (Elliott et al. 1996). Beberapa jenis Potyvirus yaitu Bean yellow mosaic virus, Turnip mosaic virus, dan Dendrobium mosaic virus dilaporkan menginfeksi tanaman anggrek di Hawaii (Hu et al. 1993), juga dilaporkan menginfeksi anggrek Phalaenopsis di Taiwan (Zheng et al. 2008a). Virus lain yang juga ditemukan yaitu Tospovirus dilaporkan menginfeksi tanaman anggrek Phalaenopsis di Taiwan (Zheng et al. 2008b) dan Amerika Serikat (Baker et al. 2007). Baru-baru ini Lakani et al. (2010) melaporkan adanya ORSV di Indonesia berdasarkan pengamatan gejala pada beberapa kebun petani dan kebun koleksi anggrek. Hal ini dikhawatirkan dapat mengancam plasma nutfah anggrek asli Indonesia jika penyebarannya tidak dikendalikan.
CymMV dan ORSV sudah dilaporkan sangat merugikan budidaya anggrek di dunia (Zettler et al. 1990; Francki et al. 1985). Kultivar anggrek yang terinfeksi CymMV selalu menunjukkan gejala nekrosis, ukuran lebih kecil, dan cacat bentuk pada bunga, sehingga menyebabkan kehilangan nilai ekonomi
(Seoh et al. 1998). Infeksi ganda kedua virus dapat menyebabkan bunga
anggrek bergejala bercak nekrosis bergaris coklat (Eun et al. 2002). CymMV dan ORSV diperkirakan menginfeksi sekitar 14% tanaman anggrek budidaya di
seluruh dunia (Wong et al. 1997). Infeksi CMV pada tanaman anggrek
menyebabkan gejala kuning bergaris pada daun anggrek dan pada bunga gejala berupa breaking color (Chang 2010). Gejala yang ditimbulkan pada tanaman anggrek Phalaenopsis yang diinfeksi Potyvirus berupa bercak klorotik pada daun (Zheng et al. 2008a).
Infeksi virus pada anggrek sangat mempengaruhi produksi secara langsung sehingga merugikan petani. Data kerugian yang ditimbulkan akibat
infeksi virus pada pengusahaan anggrek di Indonesia belum pernah dilaporkan secara resmi. Namun hasil pengamatan di beberapa lokasi pengembangan anggrek menunjukkan potensi kerugian yang cukup besar jika tidak segera dilakukan pengendalian.
Perdagangan anggrek secara internasional tidak begitu memperhatikan
keberadaan CymMV, ORSV, CMV dan Potyvirus, sehingga peluang penyebaran
virus lintas negara melalui kegiatan ekspor-impor dapat terjadi. Hal ini merupakan peristiwa yang tidak dapat dihindari. Survei pendahuluan terhadap penyakit pada tanaman anggrek yang pernah dilakukan oleh peneliti pada tahun 2007 dan awal 2008 menemukan adanya kejadian penyakit dengan ciri-ciri seperti yang disebabkan oleh CymMV dan ORSV di daerah Gunung Sindur (Bogor), Cianjur (Cipanas) dan Kebun Raya Bogor. Berdasarkan deteksi serologi dengan metode enzyme linked-immunosorbent assay (ELISA) dan reverse transcriptase-polymerase chain reaction (RT-PCR) menggunakan primer spesifik CymMV, Khalimi (2008) memastikan identitas virus tersebut pada sampel asal Cipanas (Cianjur).
Deteksi dan identifikasi virus yang menginfeksi tanaman anggrek telah dilakukan di beberapa negara untuk mengetahui karakter spesifik masing-masing virus. Analisis dilakukan untuk mengetahui karakter biologi dan molekuler agar informasinya dapat digunakan sebagai dasar penentuan strategi pengendalian yang spesifik. CymMV pertama kali dideteksi oleh Jensen (1950) pada tanaman
anggrek Cymbidium di California, sedangkan ORSV pertama kali diisolasi dan
dikarakterisasi dari anggrek Odontoglossum grande oleh Jensen & Gold (1951).
Deteksi yang dilakukan pada berbagai isolat menunjukkan adanya perbedaan antar isolat di berbagai negara. Berdasarkan keragaman sekuen nukleotida gen coat protein (CP) 85 isolat CymMV dan 37 isolat CymMV gen RdRp, asal Perancis, Fiji, Madagaskar, Polynesia dan Reunion Island menunjukkan
terbentuk dua subgrup CymMV (Moles et al. 2007). Ikegami & Inouye (1996)
menemukan adanya perbedaan yang kecil antara isolat CymMV Jepang dan Korea berdasarkan sekuen nukleotida seluruh genom dengan homologi sebesar 96%. Deteksi CMV dan Potyvirus pada anggrek dilakukan dengan metode yang umum seperti ELISA, SDS immunodiffusion, Immunoblotting, RT-PCR, dan analisis sekuen nukleotida dan asam amino (Elliott et al. 1996; Hsu et al. 2005).
Tindakan eksklusi melalui peraturan dan karantina nampaknya belum begitu efektif karena virus yang menginfeksi anggrek tersebut belum menjadi
prioritas sasaran deteksi pada anggrek impor. Hal tersebut menyebabkan masuknya beberapa virus anggrek ke Indonesia melalui bibit anggrek yang terinfeksi.
Pengendalian yang mungkin dapat dilakukan untuk penyakit ini adalah dengan eradikasi (pemusnahan). Namun, pada kasus kejadian penyakit yang tinggi cara ini tidak mungkin dilakukan karena petani akan menderita kerugian. Penggunaan varietas tahan merupakan upaya pengendalian yang terbaik, tetapi kenyataannya varietas tahan sulit ditemukan, apalagi CymMV, ORSV, CMV dan Potyvirus dapat menginfeksi berbagai jenis anggrek (Sherpa et al. 2006; Hu et al. 1993). Jika ada jenis anggrek yang tahan, biasanya konsumen kurang menyukai jenis tersebut antara lain karena bunganya kurang menarik atau alasan lain berdasarkan selera. Oleh karena itu perlu dicari alternatif upaya pengendalian yang tepat sehingga virus-virus tersebut tidak mengancam pertanaman anggrek ataupun mengancam keberadaan plasma nutfah anggrek Indonesia.
Salah satu metode yang dapat digunakan untuk meningkatkan ketahanan tanaman yaitu melalui induksi ketahanan. Induksi ketahanan atau imunisasi atau ketahanan buatan merupakan suatu proses stimulasi ketahanan sistemik tanaman inang tanpa introduksi gen-gen baru. Induksi ketahanan menyebabkan kondisi fisiologis yang mengatur sistem ketahanan menjadi aktif dan atau menstimulasi mekanisme ketahanan alami yang dimiliki oleh inang (Stomberg 1994). Ketahanan tanaman melawan infeksi mikroba dapat diperoleh dengan penggunaan senyawa kimia, sehingga muncul pertahanan fisik tanaman sebagai reaksi yang diinduksi ketika terjadi kontak dengan patogen potensial. Gen ketahanan pada tanaman berhubungan dengan patogen spesifik yang sesuai dengan gen ketahanan tersebut. Aktivasi gen ketahanan setelah diinduksi oleh patogen dalam respon ketahanan dapat berupa programmed cell death (reaksi hipersensitif), sintesis pathogenesis related (PR)-protein dan induksi systemic acquired resistance/ketahanan sistemik terinduksi (SAR) (Schneider et al. 1996; Murphy et al. 1999).
Salah satu senyawa fenol yang sangat sederhana yang dapat digunakan untuk menginduksi ketahanan sistemik tanaman adalah, 2-hydroxybenzoic atau salicylic acid (asam salisilat, SA). Asam salisilat diketahui berperan penting sebagai molekul signal beberapa respon ketahanan tanaman dan merupakan komponen yang dibutuhkan dalam jalur signal transduksi SAR; suatu bentuk peningkatan ketahanan tanaman melawan patogen berspektrum luas. Induksi
SAR yang mensintesis SA terjadi setelah adanya invasi mikroorganisme. Respon yang terjadi oleh adanya invasi mikroorganisme dapat berupa kematian sel secara cepat pada sel-sel di sekitar titik masuk patogen yang disebut reaksi hipersensitif.
Tanaman anggrek umumnya diperbanyak dengan cara vegetatif dan teknik kultur jaringan mata tunas dan biji. Kedua organ tanaman ini merupakan tempat bertahan virus. Belum ada laporan yang menyatakan bahwa CymMV dan ORSV ditularkan oleh serangga vektor, tetapi kedua virus ini dapat ditularkan secara mekanis melalui kontaminasi peralatan dan pot selama pemisahan
tanaman dan pemanenan bunga (Zettler et al. 1990). Oleh karena itu
penyebaran virus pada saat pemisahan untuk perbanyakan bibit menjadi periode kritis penularan. Proses pemindahan dari bibit botolan ke media aklimatisasi banyak bersentuhan dengan peralatan yang memungkinkan terjadinya penularan bila peralatan tersebut sudah terkontaminasi oleh virus.
Salah satu upaya untuk menekan infeksi virus adalah melalui kombinasi teknik kultur jaringan dan induksi ketahanan sistemik menggunakan bahan kimia asam salisilat. Kombinasi kedua cara ini diharapkan akan dapat menghasilkan tanaman anggrek dalam jumlah yang banyak yeng lebih tahan terhadap infeksi virus. Aplikasi kedua cara ini cocok untuk meningkatkan ketahanan jenis anggrek yang digemari konsumen namun rentan terhadap infeksi patogen.
Tujuan
1. Mendeteksi beberapa virus yang menginfeksi tanaman anggrek pada beberapa daerah sentra produksi anggrek di Pulau Jawa.
2. Mendeteksi secara spesifik virus yang menginfeksi tanaman anggrek di Indonesia dan mengkarakterisasi secara terperinci dua virus yang penting. 3. Mengetahui respon ketahanan beberapa jenis anggrek komersial terhadap
infeksi ORSV.
4. Meningkatkan ketahanan sistemik anggrek Dendrobium nindii terhadap ORSV melalui pemberian senyawa asam salisilat.
Hipotesis
1. ORSV, CymMV, CMV dan Potyvirus telah ada dan menyebar di beberapa sentra produksi anggrek di Pulau Jawa.
2. CymMV dan ORSV isolat Indonesia memiliki ciri-ciri khusus dibandingkan dengan isolat dari negara lain.
3. Tiap jenis anggrek memiliki ketahanan yang berbeda terhadap infeksi ORSV. 4. Ketahanan anggrek D. nindii terhadap infeksi ORSV dapat ditingkatkan
dengan pemberian asam salisilat pada media kultur jaringan.
Strategi Penelitian
Serangkaian penelitian yang saling terkait dilakukan untuk mendapatkan informasi dan data yang diperlukan. Adapun rangkaian percobaan tersebut terdiri dari :
1. Koleksi contoh tanaman bergejala melalui survei pada beberapa sentra produksi anggrek. Melalui survei ini akan diperoleh data keberadaan CymMV, ORSV, CMV dan Potyvirus pada beberapa sentra anggrek di pulau Jawa, jenis anggrek yang terinfeksi virus dan gejala spesifik infeksi virus. 2. Mendeteksi CMV, Potyvirus, Tospovirus dan CymMV yang menginfeksi
tanaman anggrek di Pulau Jawa berdasarkan RT-PCR.
3. Mendeteksi dan identifikasi secara serologi dan molekuler, kajian penularan,
dan kisaran inang ORSV.
4. Uji respon ketahanan beberapa jenis anggrek terhadap infeksi ORSV. Percobaan ini dilakukan untuk melihat tingkat ketahanan beberapa jenis anggrek terhadap ORSV dan menentukan salah satu jenis anggrek yang rentan untuk diinduksi ketahanannya.
5. Induksi ketahanan tanaman anggrek terhadap ORSV. Percobaan ini dilakukan untuk menghasilkan tanaman anggrek yang lebih tahan terhadap salah satu jenis virus dengan perlakuan penambahan asam salisilat pada media kultur jaringan.
Kelima tahapan penelitian tersebut diharapkan akan dapat mencapai tujuan yang diinginkan dan menjawab hipotesis (Gambar 1.1).
8
PASAR PRODUK TEKNOLOGI
RISET & PENGE MBANGAN TAHUN I (2008) TAHUN II (2009) TA HUN III (20 Gambar 1.1 Alur penelit ian virus pa da tanaman anggrek PENGUSAHA DAN PET ANI ANGGREK T A HAN T ERHADAP ORSV KULT UR JARINGAN ANGGREK
INDUKSI KETAHANAN ANG
G
ORSV DENGAN ASAM SALISILAT
IDENT
IFIKASI BIOLOGI
& A
T
AU MOLEKULER
ISOLASI & PEMURNIAN OR
SV
SURVEI VIRUS PADA ANGGREK
PENGUJIAN KET
AHANAN
T
ANAMAN AN
II. TINJAUAN PUSTAKA
Budidaya Tanaman Anggrek
Anggrek secara taksonomi diklasifikasikan ke dalam Phylum Spermatopytha, yaitu digolongkan ke dalam tumbuhan berbiji, Kelas Angiospermae atau berbiji tertutup, Subkelas Monokotiledonae atau bijinya berkeping satu, Ordo Gynandrae karena alat reproduksi jantan dan betina bersatu sebagai tugu bunga, Famili Orchidaceae atau keluarga anggrek (Puspitaningtyas et al. 2003). Orchidaceae merupakan famili tanaman terbesar, terdiri dari sekitar 900 genera dan hampir 35.000 spesies. Dendrobium, genus terbesar dalam famili Orchidaceae terdiri dari sekitar 1100 spesies (Cordel 1999).
Anggrek dapat diperbanyak secara generatif dari biji atau secara vegetatif (konvensional dan kultur in vitro). Tanaman anggrek hibrida diperoleh dari biji hasil silangan dan perbanyakannya dilakukan secara vegetatif untuk mempertahankan hibrida yang telah diseleksi. Penggunaan teknik pembiakan vegetatif konvensional, potensinya terbatas karena hanya sejumlah kecil tanaman yang dapat dihasilkan dalam satu kurun waktu tertentu (George 1996). Beberapa jenis tanaman anggrek yang populer di masyarakat antara lain: Oncidium, Cattleya, Phalaenopsis, Dendrobium, Vanda dan Aranthera. Anggrek dipasarkan dalam bentuk bunga potong maupun tanaman dalam pot. Anggrek dari genus Dendrobium menghasilkan anakan dari umbi semu yang disebut dengan keiki yang seringkali berakar tapi masih melekat pada tanaman, dan hanya membutuhkan pemisahan untuk ditanam untuk mendapatkan tanaman baru (George 1996).
Dendrobium
Dendrobium adalah salah satu genus dari Famili Orchidaceae. Genus Dendrobium memiliki lebih dari 600 spesies yang menyebar di daerah tropis Asia Selatan dan Tenggara, mulai dari Himalaya, Filipina sampai ke Australia.
Dendrobium dibedakan menjadi dua macam yaitu evergreen Dendrobium atau
Dendrobium yang selalu berwarna hijau berasal dari Australia dan deciduous
Dendrobium atau yang berganti daun berasal dari sebelah utara Equator (Logan & Lloyd 1955). Saat ini sudah banyak jenis Dendrobium spesies yang telah
ditemukan antara lain adalah D. aureum, D. brymerianum, D. chrysotoxum, D. jamesianum, D. phalaenopsis, D. saisar.
Anggrek Dendrobium tumbuh menyebar di Asia Selatan, India, dan Srilanka. Di Asia Timur bunga ini banyak dibudidayakan oleh masyarakat Jepang, Taiwan dan Korea. Kebanyakan anggrek Dendrobium tumbuh liar di daerah tropis seperti Asia. Di Asia Tenggara, tanaman ini menjadi andalan Negara Thailand, Singapura, Indonesia dan Filipina. Sebarannya pun meluas ke Papua, Selandia Baru dan Tahiti. Dalam jumlah terbatas ditemukan di Selatan Amerika Serikat, dan daerah jajahan Inggris. Di Indonesia, Dendrobium banyak ditemukan di hutan Pulau Jawa, Kalimantan, Sulawesi, Sumatera, Papua, Maluku dan Nusa Tenggara. Beberapa spesies menyebar secara sangat luas, diantaranya D. anosmum, tersebar dari India sampai Papua (Chan et al. 1994).
Dendrobium termasuk anggrek epifit (menempel pada tanaman lain tetapi tidak merugikan tanaman induk yang ditumpanginya) (Ashari 1997). Dendrobium tergolong anggrek simpodial, yaitu anggrek dengan pertumbuhan ujung batang yang akan terhenti bila telah mencapai maksimum dan pertumbuhan anggrek akan dilanjutkan dengan pertumbuhan anakan baru. Batang anggrek Dendrobium berbentuk menggelembung dan berdaging, karena batang ini berfungsi sebagai tempat penyimpanan cadangan makanan dan air (Arditi 1984). Batang anggrek ini berbentuk gada, pada bagian pangkal kecil dan pada bagian tengah membesar kemudian bagian ujung batang anggrek ini mengecil lagi. Daun berbentuk lanset dengan ujung yang tidak simestris, panjang daun sekitar 12 cm dengan lebar 2 cm. Bunga tersusun dalam satu rangkaian yang berbentuk tandan yang tumbuh pada buku batangnya dan agak menggantung dengan panjang tandan sekitar 60 cm, jumlah bunga dalam tiap tandan sekitar 6-24 kuntum dengan diameter sekitar 6 cm (Sastrapraja et al. 1976). Akar anggrek umumnya lunak dan mudah patah. Ujung akar meruncing, licin, sedikit lengket dan berwarna putih. Akar anggrek mempunyai lapisan velamen yang mengandung klorofil dan berongga sebagai tempat penyimpanan air. Akar memiliki daya lekat pada bagian yang bentuknya agak pipih mengikuti permukaan batang penyangga dan terdapat rambut-rambut yang pendek untuk menyerap air dan makanan (Arditi 1984; Puspitaningtyas et al. 2003).
Phalaenopsis
Salah satu genus yang ada pada Famili Orchidaceae adalah Phalenopsis. Genus Phalaenopsis terdiri atas 60 spesies yang menyebar dari Himalaya ke berbagai negara seperti Thailand, Indo-Cina, Malaysia, Indonesia, New Guinea, Australia, Taiwan dan Cina Selatan. Di Indonesia, plasma nutfah anggrek Phalaenopsis tumbuh secara alami dalam habitat hutan di berbagai wilayah, misalnya Maluku, Sulawesi, Pulau Seram, Ambon, Buru, Kalimantan, Sumatra dan Jawa (Setiawan 2002).
Pada tahun 1753, Linnaeus memberikan nama Epidendrum amabila pada spesies anggrek bulan di Nusa Kambangan. Pada tahun 1825 spesies ini diberi nama P. amabilis oleh seorang ahli botani Belanda yang bernama Prof.C.L. Blume, karena beliau melihat sekumpulan kupu-kupu yang hinggap di dahan dan tidak mau bergerak dari tempatnya, ketika didekati ternyata sekumpulan anggrek kupu-kupu atau anggrek bulan. Sejak saat itu hingga sekarang, anggrek bulan dikategorikan dalam genus Phalaenopsis (Rukmana 2000).
Phalaenopsis tumbuh monopodial yang berarti hanya mempunyai batang utama yang tumbuh terus ke atas dan tidak terbatas. Batang pendek dan tidak mempunyai pseudobulb. Akar berdaging muncul dari batang atau buku bagian bawah. Tangkai bunga tumbuh menembus upih daun, seringkali bercabang, agak pendek atau panjang, berbunga sedikit atau banyak. Bunga mekar bersamaan atau tidak, ukuran kecil, sedang atau besar, tidak berbau atau berbau harum, warna putih, kuning atau ungu (Nursandi 1997).
Oncidium
Oncidium merupakan genus yang terdiri dari lebih 750 spesies, terbanyak
ditemukan di Amerika Selatan, beberapa di Amerika Tengah dan Kepulauan Karibia, dan sedikIt di Florida. Oncidium pada umumnya epifit dan beberapa diantaranya merupakan anggrek tanah. Oncidium memiliki pseudobulb, tetapi beberapa diantaranya tidak memiliki psudobulb (Shuttleworth et al. 1970).
Menurut Morrison (2000) genus Oncidium dikarakterisasi oleh adanya
pseudobulb unifoliat dan bifoliat dari internode tunggal yang terlindung oleh
pelepah daun yang menggelembung. Infloresens dihasilkan dari ujung pelepah tersebut, bagian dasar dari tangkai keluar dari pseudobulb. Spesies dari genus ini dapat tumbuh pada ketinggian 4000 m dpl.
Bunga umumnya berwarna kuning, namun terdapat juga yang berwana merah muda dan coklat. Ukuran bunga bervariasi antara ¼ inchi sampai di atas 4 inchi. Beberapa dari spesies Oncidium disebut sebagai dancing ladies sebab memiliki rangkaian tangkai bunga yang panjang dengan membentuk formasi seperti kelompok penari balet. Beberapa contoh jenis Oncidium diantaranya adalah O. nubigenum dari Kolombia, O. triquetrum dari Jamaika, O. bicallosum
dari Meksiko dan Guatemala serta O. cebolleta dari Meksiko dan Paraguay (Shuttleworth et al. 1970).
Kultur Jaringan Tanaman Anggrek
Kultur jaringan secara luas dapat didefinisikan sebagai usaha mengisolasi, menumbuhkan, memperbanyak, dan meregenerasikan protoplast, sel utuh atau bagian tanaman seperti meristem, tunas, daun muda, batang muda, ujung akar, kepala sari, dan bakal buah dalam suatu lingkungan aseptik yang terkendali. Pada awalnya metode ini merupakan penelitian laboratorium sebagai bagian dari penelitian fisiologi tentang pertumbuhan dan perkembangan tanaman (Gunawan 1992). Kultur jaringan menggunakan teori sel seperti yang dikemukakan oleh Schleiden & Schwann pada tahun 1839. Menurut kedua ahli itu, sel mempunyai kemampuan otonom (mampu tumbuh mandiri), bahkan mempunyai kemampuan totipotensi yaitu kemampuan sel atau jaringan untuk tumbuh dan berkembang seperti sel zigot karena memiliki susunan genetik yang sama (Wattimena et al. 1992).
Pertumbuhan dan perkembangan tanaman secara in vitro ditentukan oleh faktor yang kompleks, meliputi hara anorganik, faktor fisik, dan substansi organik. Faktor bahan tanaman yang turut menentukan keberhasilan kultur jaringan antara lain genotipe tanaman, status fisiologi, ukuran, sumber, dan umur eksplan (Pierik 1987). Keberhasilan pertumbuhan jaringan juga sangat dipengaruhi oleh adanya hubungan timbal balik antara tanaman itu sendiri dengan faktor lingkungan, seperti komposisi media dan pH, cahaya, suhu, kelembaban, dan kadar oksigen. Selain itu, juga diperlukan keahlian dalam memotong bahan tanaman yang akan ditanam dalam media steril dan dalam mendesinfeksi jaringan, dasar pengetahuan Kimia dan Biologi yang memadai, serta ketekunan dan ketelitian kerja yang tinggi. Kelengkapan sarana yang memadai juga dapat meningkatkan persentase jaringan yang tumbuh (Widiastoety 1997).
Seiring dengan perkembangan ilmu dan teknologi dan dengan ditemukannya auksin dan sitokinin serta prinsip pengaturan perimbangan kedua zat pengatur tumbuh tersebut, regenerasi dari sel menjadi tanaman lengkap pada banyak spesies sudah berhasil dilakukan (Gunawan 1992). Dewasa ini kultur jaringan telah digunakan untuk tujuan perbanyakan tanaman seperti kentang, jahe, pisang, asparagus, dan beberapa tanaman hias seperti anggrek, krisan, dan Dianthus (Wattimena et al. 1992). Beberapa kebun pembibitan dan pengembangan anggrek kemudian menerapkan metode ini untuk memperoleh klon-klon anggrek yang sangat eksklusif.
Perbanyakan anggrek secara kultur jaringan dapat dilakukan melalui eksplan berupa mata tunas, biji, dan meristem untuk tujuan tertentu. Perbanyakan vegetatif anggrek melalui kultur meristem dapat dibagi dalam tiga tahap yaitu transformasi meristem menjadi protocorm like body (plb), perbanyakan protocorm dengan memotongnya menjadi potongan yang lebih kecil, dan perkembangan protocorm-protocorm tersebut berakar dan berpucuk (Pierik 1987). Istilah plb merupakan istilah untuk struktur yang mirip protocorm yang terbentuk dari jaringan tanaman dan atau kalus secara in vitro. Istilah ini pertama kali diperkenalkan oleh Georges Morel (Arditti & Ernst 1992). Sumber lain menyebutkan bahwa istilah protocorm diperkenalkan pertama kali oleh Melchior Trueb, yang pernah menjabat sebagai direktur Botanical Gardens di Bogor (sekarang Kebun Raya Bogor), untuk menggambarkan suatu tahap dalam perkembangan lumut (Arditti & Ernst 1992). Kemudian Noel Bernard menggunakan istilah tersebut untuk anggrek antara tahun 1899 dan 1910. Istilah tersebut sekarang digunakan untuk menggambarkan suatu badan yang mirip bulatan-bulatan umbi kecil yang terbentuk pada biji-biji anggrek yang berkecambah (Arditti & Ernst 1992; Ratnadewi et al. 1991).
Individu Protocorm saat dipisah-pisahkan dan disubkultur sering menghasilkan protocorm adventif (George 1996). Massa protocorm yang dipisah-pisahkan dan ditumbuhkan di media serupa yang baru akan memperbanyak diri menjadi massa protocorm yang baru. Bila pisahan
protocorm tersebut ditumbuhkan dalam media lain yang mengarah ke proses
pendewasaan dan perakaran, maka protocorm akan tumbuh menjadi tanaman baru yang sempurna dan siap dipindahlapangkan (Gunawan 1992).
Biji-biji anggrek mengandung embrio berdiameter kurang Iebih 0,1 mm, tidak mengandung endosperm atau kotiledon. Saat berkecambah, embrio ini
akan membentuk protocorm, suatu struktur seperti corm yang berwarna hijau dan mampu melakukan fotosintesis. Tunas dan akar akan terbentuk bila kandungan senyawa-senyawa organik dalam protocorm cukup, dan kecambah normal terbentuk (Wattimena et al. 1992).
Kultur Jaringan dan Virus Tumbuhan
Kultur jaringan tanaman sejak lama telah digunakan untuk mengatasi penyebaran penyakit. Penghambatan penyebaran penyakit dapat dilakukan dengan menghasilkan plantlet yang bebas penyakit dengan perlakuan tertentu pada eksplan. Teknik kultur jaringan menjadi metode yang sering digunakan untuk manipulasi genetik dan eliminasi virus melalui kultur meristem apikal. Pemanfaatan kultur jaringan untuk pengendalian virus dilakukan dalam hal tahapan untuk perlakuan lain yang akan dilakukan. Misalnya untuk menghasilkan tanaman tahan terhadap virus dengan memberikan perlakuan pada kalus yang ditumbuhkan pada kultur menggunakan kemoterapi (actinomycin-D, Ribavirin, 2-thiouracil) (Srivastava et al. 1999). Hal lain yang dilakukan adalah perlakuan seleksi kalus yang diberikan perlakuan penyinaran sinar Gamma seperti dilaporkan Mukerji et al. (1999) untuk ketahanan terhadap TMV. Untuk perlakuan mediasi menggunakan Agrobacterium, DNA transfer langsung,
electroporation, microprojectil, juga menggunakan kultur jaringan pada tahapan
penumbuhan kalus (Srivastava et al. 1999).
Wattimena et al. (1992) menyatakan bahwa tanaman hasil kultur jaringan dapat dinyatakan bebas penyakit sistemik tertentu jika telah diidentifikasi dan telah dihilangkan dari tanaman. Hal ini dilakukan pada penyakit yang bersifat sistemik yang disebabkan oleh virus dan mikoplasma. Eliminasi patogen dapat dilakukan melalui termoterapi, kultur meristem, kombinasi keduanya, pembentukan tunas adventif dan teknik penyambungan mikro (Pierik 1987). Eliminasi dengan termoterapi dan kultur meristem paling umum dilakukan. Tanaman hasil perlakuan kemudian diuji telah terbebas dari virus dengan menggunakan tanaman indikator, serologi dan mikroskop elektron. Tanaman kultur jaringan yang bebas virus akan menjadi sumber bahan tanaman baik untuk keperluan penukaran plasma nutfah, pelestarian plasma nutfah, bahan perbanyakan dan bahan untuk pemuliaan.
Purwito & Wattimena (1991) menggunakan kombinasi ribavirin dan kultur meristem untuk eliminasi virus pada tanaman kentang. Hasil yang diperoleh
menunjukkan konsentrasi ribavirin 30 mg/l cukup efektif mengeleminasi Potato virus X (PVX), Potato virus Y (PVY), Potato leaf roll virus, Potato virus S, dan Potato virus M. Lopez-Delgado et al. (2004) mengkombinasikan perlakuan asam salisilat dan termoterapi untuk mengeliminasi PVX pada umbi mikro kentang. Hasil yang diperoleh menunjukkan bahwa umbi mikro yang diberi perlakuan asam salisilat dengan konsentrasi 10-5 M dapat meningkatkan toleransi terhadap paparan pemanasan hingga 42 oC selama 30 hari. Toleransi ini menyebabkan dapat mengeliminasi PVX yang tidak tahan terhadap suhu tinggi. Paludan (1985) melaporkan bahwa perlakuan pendinginan (5 oC) pada titik tumbuh kultur meristem tanaman Chrysanthemum morifolium selama satu bulan dapat meningkatkan keberhasilan menghasilkan tanaman bebas dari Chrysanthemum chlorotic mottle viroid. Perlakuan pendinginan juga dilaporkan Lizarraga et al. (1980) pada kultur jaringan awal tanaman kentang dengan perlakuan 5 oC-15 oC dapat mengeliminasi Potato spindle tuber viroid.
Beberapa Virus Tanaman yang Menginfeksi Anggrek Cucumber mosaic virus (CMV)
Cucumber mosaic virus (CMV) pertama kali deskripsi secara rinci pada tahun 1916 pada tanaman mentimun dan Cucurbitaceae lainnya oleh Doolittle dan Jagger. Saat ini diketahui bahwa CMV menginfeksi banyak tanaman pertanian dan hortikultura di seluruh dunia pada iklim sedang maupun tropis. Perkembangan ketahanan genetik untuk CMV pada sayuran telah memberi kontribusi yang berharga bagi manajemen penyakit virus yang penting ini (Zitter & Murphy 2009). CMV dilaporkan mampu menginfeksi lebih dari 40 famili tanaman dikotil maupun monokotil (Gibbs & Harrison 1970 ).
CMV merupakan anggota genus Cucumovirus famili Bromoviridae. Partikel CMV terdiri dari tiga partikel berbentuk bulat, masing-masing berukuran diameter sekitar 28 nm. Genom CMV terdiri dari tiga molekul RNA beruntai tunggal (ssRNA), dengan berbagai ukuran (Tabel 2.3 dan Gambar 2.3). Setiap molekul RNA dienkapsisasi dalam CP dengan masing-masing menjadi satu partikel berbentuk bulat. Jadi CMV terdiri dari tiga partikel, satu partikel mengandung RNA 1, partikel yang lain mengandung RNA 2 dan yang ketiga mengandung RNA 3. Partikel RNA 3 dapat berisi untai RNA keempat, disebut sebagai RNA 4, yang mengkode gen CP. Jenis strategi translasi CMV disebut
sebagai RNA subgenomic, terdiri dari untai RNA yang dihasilkan terpisah selama replikasi (Zitter & Murphy 2009).
Tanaman dapat mengaktivasi mekanisme ketahanan ketika CMV menginfeksi sehingga dapat menghambat pergerakan virus untuk menginvasi jaringan baru. Tipe ketahanan ini disebut sebagai gene silencing, namun protein CMV 2b mampu menghambat inisiasi sinyal gene silencing (silencing suppressor) pada tanaman di bagian jaringan yang jauh dari titik infeksi, sehingga memungkinkan CMV untuk terus menginvasi dan menginfeksi jaringan muda tanaman yang berkembang. Gen CP merupakan protein yang hanya berasosiasi dengan partikel virus dan merupakan satu-satunya penentu untuk transmisi oleh vektor kutu dan. Mutasi pada gen 1a, 2a dan 2b berpengaruh pada pergerakan virus dalam beberapa inang (Zitter & Murphy 2009).
Tabel 2.1 Organisasi genom CMV Genom
(Protein)
Ukuran nukleotida
(basa) Fungsi
RNA1 (1a) 3.350 Replikasi, methyltransferase, helikase RNA2 (2a, 2b) 3.050 N-proksimal, replikasi, RNA-dependent
RNA polimerase
RNA3 (3a) 2.200 Protein movement berperan dalam
pergerakan virus dari sel ke sel ataupun dalam pembuluh tanaman
RNA4 (CP) 1.030 Protein selubung (CP)
(Sumber: ICTVdB Management 2006b)
Gambar 2.1 Skema representasi organisasi genom CMV (Sumber: Zitter & Murphy 2009). CP 1a 2a MP 2b RNA 1 RNA 2 RNA 3 RNA 4 CP
Beberapa strain CMV memiliki RNA satelit (RNA 5 atau satRNA). satRNA adalah molekul untai tunggal berukuran panjang sekitar 332-342 nukleotida dan benar-benar tergantung pada CMV untuk replikasi. Selain itu, satRNA dienkapsidasi dalam partikel CMV, yang memungkinkan menyebar dari satu tanaman ke tanaman bersama dengan CMV, oleh vektor kutudaun. satRNA, tidak memberikan fungsi yang penting pada CMV (helper virus). Adanya CMV satRNA kemungkinan tidak berpengaruh pada gejala atau dapat memperparah gejala klorosis atau nekrosis sistemik atau sebaliknya mungkin menyamarkan gejala (Zitter & Murphy 2009).
Sejumlah strain CMV di seluruh dunia diklasifikasi ke dalam dua subgrup, I dan II, berdasarkan kriteria berbagai variasi gejala, serologi (Wahyuni et al. 1992; Hu et al. 1995; Ilardi et al. 1995), hibridisasi asam nukleat (Owens & Palukaitis 1988, Palukaitis et al. 1992), sekuen gen (Owens et al. 1990; Szilassy et al. 1999), dan restriction fragment length polymorphism (RFLP) (Rizos et al. 1992; Sialer et al. 1999). Subgrup strain I dibagi lagi menjadi IA dan IB, berdasarkan perbedaan patogenisitas pada kacang tunggak (Vigna unguiculata). Strain IA menginduksi gejala-gejala mosaik sistemik dan strain IB menginduksi lesio lokal nekrotik pada daun yang diinokulasi. Selain berdasarkan gejala, CMV subgrup I sekarang ini dibagi menjadi IA dan IB berdasarkan sekuen gen CP strain CMV dan analisis filogenetik. Strain CMV Asia dikelompokkan dalam subgrup IB (Palukaitis & Zaitlin 1997; Roossinck et al. 1999; Roossinck 2002). Beberapa strain CMV yang spesifik inang, menginfeksi inang tertentu dalam famili yang sama seperti strain CMV legum. CMV secara serologi berhubungan dengan Tomato aspermy virus dan Peanut stunt virus (Zitter & Murphy 2009).
Potyvirus
Potyvirus adalah merupakan grup terbesar dari 34 grup virus tanaman dan famili saat ini diketahui (Ward & Shukla 1991). Genus ini terdiri dari setidaknya 180 anggota definitif (91 spesies resmi dan 89 spesies tentatif). Sebanyak 30% dari semua virus tanaman yang diketahui menyebabkan kerugian signifikan dalam bidang pertanian, tanaman pakan ternak, tanaman hortikultura dan tanaman hias (Ward & Shukla 1991; van Regenmortel et al. 2000).
Partikel Potyvirus berbentuk filamen lentur, tanpa envelop berukuran panjang 680-900 nm dan lebar 11-15 nm. Material genetik Potyvirus berupa poliprotein tunggal, untai tunggal, utas positif dengan panjang 10 kb. Genom
RNA terdiri dari satu open reading frame (ORF) yang mengekspresikan satu poliprotein prekusor berukuran 350 kDa. Prekursor poliprotein tersebut kemudian ditranslasi menjadi tujuh protein kecil yang memiliki berbagai fungsi, dinotasikan sebagai P1, helper component (HC), P3, cylindrical inclusion (CI), nuclear inclusion A (NIa), nuclear inclusion B (NIb), capsid protein (CP), serta dua protein putatif kecil yang dikenal sebagai 6K1 dan 6K2 (Shukla et al. 1994) (Tabel 2.4 dan Gambar 2.4). Pada bagian terminal 3’ diakhiri dengan motif poly-A tail (Hari et al. 1979; Takahashi et al. 1997).
Untuk menghasilkan protein utama, genom virus mengkode poliprotein dengan diproses oleh tiga proteinase virus. Dua proteinase diantaranya, P1 dan helper HC-Pro (Helper componen-proteinase) yang mengkatalisis reaksi autoproteolitik masing-masing hanya pada Terminal C (Carrington et al. 1989; Verchot et al. 1991). Satu proteinase lainnya reaksinya dikatalisis oleh NIA-Pro (nuclear inclusion protein) melalui mekanisme trans-proteolitik atau autoproteolitik (Carrington & Dougherty 1987).
Tabel 2.2 Organisasi genom Potyvirus
Protein Fungsi
P1 Proteinase;pergerakan antar sel.
HC-Pro transmisi oleh kutudaun; Proteinase; pergerakan antar sel.
P3 Belum diketahui
CI Replikasi genom (RNA helikase); membran pengikat; stimulasi asam
nukleat aktivitas ATPase ; pergerakan antar sel.
CP Encapsidasi RNA; berperan dalam transmisi oleh vektor; pergerakan
antar sel.
NIa-VPg Replikasi genom (Primer untuk inisiasi sintesis RNA).
NIa-Pro Proteinase
NIb Replikasi genom (RNA-dependent RNA polimerase [RdRp]).
6K1 & 6K2 Belum diketahui, namun diduga berperan pada: Replikasi RNA,
pengatur untuk penghambatan translokasi nuclear NIa, membran pengikat proses replikasi.
(Sumber: Winterhalter 2005).
P1 HC-Pro P3 CI NIa
VPg NIb
Pro NIb CP
Gambar 2.2 Skema representasi organisasi genom Potyvirus (Sumber: Winterhalter 2005)
33kDA 32kDA 41kDA 6kDA 71kDA 6kDA 22kDA 27kDA 59kDA 31kDA
Tospovirus
Virus dalam genus Tospovirus menyebabkan kerugian yang signifikan pada pertanian di seluruh dunia. Nama genus ini berasal dari nama anggota pertama yaitu Tomato spotted wilt virus (TSWV). Awal infeksi virus ini terjadi pada penyakit layu tanaman tomat di Australia pada tahun 1915, kemudian dibuktikan dengan identifikasi penyebabnya adalah TSWV. TSWV awalnya dianggap sebagai satu-satunya anggota kelompok TSWV sampai awal 1990-an. Namun saat ini berdasarkan identifikasi dan karakterisasi beberapa virus, ternyata beberapa jenis virus lain mirip TSWV sehingga digolongkan dalam genus Tospovirus bagian dari famili Bunyaviridae. Lebih dari 12 jenis virus yang masuk dalam genus ini seperti Impatiens necrotic spot virus (INSV), Peanut bud necrosis virus (PBNV), Groundnut ringspot virus (GRV), Watermelon silver mottle
virus (WSMV), Zucchini lethal chlorosis virus (ZLCV) dan Iris yellow spot virus
(IYSV) (Adkins et al. 2005; Baker et al. 2007).
TSWV memiliki kisaran inang yang besar (800 spesies tanaman) dan sebagian besar penyakit yang disebabkan virus ini ditemukan pada tanaman di lapangan. INSV memiliki kisaran inang yang lebih kecil dan sebagian besar virus yang ditemukan menginfeksi tanaman hias di rumah kaca (Baker et al. 2007). Kedua virus telah dilaporkan menginfeksi tanaman anggrek sejak awal 1990-an (Hu et al. 1993, Koike & Mayhew 2001).
Di antara virus tanaman, Tospovirus memiliki morfologi partikel, organisasi genom dan strategi ekspresi yang unik. Partikel virus berbentuk pleomorfik berukuran 80-120 nm dan memiliki envelop pada permukaan yang terdiri dari lipid dan dua glikoprotein. Genom Tospovirus terdiri atas tiga ssRNA negatif sense utas tunggal RNA. Setiap genom RNA dienkapsidasi oleh banyak salinan protein nukleokapsid virus untuk membentuk struktur ribonucleoprotein juga dikenal sebagai nukleokapsid (Adkins et al. 2005; Hull 2002)
Anggrek Phalaenopsis yang bergejala infeksi virus seperti klorosis bercak cincin telah diamati dan berhasil diisolasi di Taiwan pada tahun 1998 (Chen et al. 1998). Virus yang telah diisolasi tersebut, ketika diinokulasi kembali ke jenis anggrek yang sama tidak berhasil menimbulkan gejala dan perunutan gen nukleokapsid untuk taksonomi virus belum dilakukan pada saat itu. Patogen penyebab penyakit pada anggrek ini belum jelas sehingga saat itu dideskripsikan sebagai “virus Taiwan”. Hasil penelitian yang dilakukan Zheng et al. (2008) berdasarkan isolasi, inokulasi kembali, serologi dan karakterisasi molekuler, virus
yang menyebabkan klorosis bercak cincin pada Phalaenopsis anggrek di Taiwan ini berhasil diidentifikasi penyebabnya adalah Tospovirus .
Cymbidium Mosaic Potexirus (CymMV)
CymMV saat ini oleh sebagian ahli dimasukkan dalam Famili
Flexyvirideae dan sebagian ahli menyatakan tidak mempunyai famili yang tepat,
sehingga langsung tergolong dalam genus Potexvirus (Adams et al. 2004; Fauquet & Mayo 1999). Partikel Potexvirus berbentuk filamen lentur dengan ukuran panjang 470-580 nm dan diameter 13 nm. Partikel virus ini mengandung
linear, positive-sense, single stranded (ss)-RNA dengan ukuran 5,9-7,0 kb,
dibungkus oleh banyak subunit coat protein (CP) berukuran 18-27 kDa. RNA diakhiri dengan polyadenilasi pada terminal 3’. Genom dari beberapa anggota genus ini telah berhasil disekuen dan memperlihatkan adanya 5 open reading
frame (ORF). Beberapa diantaranya memiliki ORF keenam yang kecil yang
melengkapi ORF kelima, namum fungsi dari protein yang dikode oleh ORF ini
belum diketahui seperti pada Cassava common mosaic virus (CsCMV),
Narcissus mosaic virus (NMV), Strawberry mild yellow edge virus (SMYEV), dan
White clover mosaic virus (WClMV) (Hull 2002). Saat ini sudah 11 spesies dari
genus Potexvirus, termasuk CymMV, telah berhasil disekuen secara lengkap seperti NMV, PVX, WClMV, Bamboo mosaic virus (BaMV), Clover yellow mosaic virus (ClYMV), Foxtail mosaic virus (FoMV), Potato acuba mosaic virus (PAMV), Papaya mosaic virus (PapMV), Plantago asiatica mosaic virus (PlAMV) dan
Strawberry mild yellow edge virus (SMYEaV) (Wong et al. 1997). CymMV
termasuk ke dalam kelompok Potexvirus dengan partikel berbentuk memanjang lentur dengan ukuran panjang ± 475-490 nm (Frowd & Tremaine 1977; Steinhart & Oshiro 1990).
Genom CymMV berukuran kira-kira 6-7 kb (Srifah et al 1996). Protein CP terdiri atas 257 asam amino dengan berat molekul 27.600 dalton, dengan perbandingan komposisi basa (G, A, C dan U) RNA virus yaitu 21,1 : 28,9 : 24,4 : 25,6 (Frowd & Tremaine 1977). Seperti halnya kelompok utas positif RNA
monopartit, ORF yang mengkode CP berada pada terminal 3’ (Chia et al. 1992).
Sinyal polyadenylasi bermotif AATAAA ditemukan pada terminal 3’-UTR (Ryu et
al. 1995). Organisasi genom CymMV terdiri dari 5 ORF dengan berbagai fungsi
Tabel 2.3 Organisasi genom CymMV Genom (Protein) Ukuran protein (kDa) Posisi nukleotida Fungsi
gp1 160 1-4326 Pengkode untuk produksi RNA polimerase, Methyltransferase, helikase
gp2 26 4333-5022 RNA helikase
gp3 13 5010-5348 Pergerakan antar sel dan pergerakan melalui pembuluh tanaman
gp4 10 5203-5478 Protein selubung (CP) gp5 24 5481-6152 Protein selubung (CP)
(Sumber: Wong et al. 1997; ICTVdB Management 2006a)
Gambar 2.3 Skema representasi organisasi genom CymMV. Terminal 5’ dan 3’
noncoding region terletak pada bagian ujung. Angka-angka menunjukkan
posisi awal dan akhir urutan genom (ICTVdB Management 2006a).
Gejala infeksi virus ini pada helaian daun muda dicirikan berupa adanya area klorotik yang tersamar. Kemudian bercak kecil tersebut membesar dan berubah menjadi bercak mosaik hijau cerah. Kontras antara area bercak cerah dan gelap menjadi lebih nyata ketika daun menjadi tua dan gejala menjadi lebih menyolok. Bercak nekrosis ditemukan pada daun kultivar tertentu, gejala pada bunga jarang terjadi tetapi ditemukan pada beberapa kultivar berupa bercak nekrosis coklat pada kultivar Cymbidium hibrida.
Odontoglossum ringspot virus (ORSV)
ORSV pertama kali diisolasi dan dikarakterisasi dari spesies anggrek Odontoglossum grande yang memperlihatkan gejala bercak cincin (ringspot) pada daun. Virus ini juga menyebabkan gejala belang (mottle) berbentuk berlian, mosaik dan warna bunga pecah pada Cymbidium serta gejala warna bunga pecah pada Cattleya (Jensen & Gold, 1951). Warna bunga pecah (color break) pada anggrek juga dilaporkan terjadi pada jenis Odontoglossum, Cymbidium,
Vanilla, Epidendrum, Encyclia, Oncidium, Phalaenopsis dan beberapa genus
RdRp TGB CP gp1 gp2 gp3 gp5 gp4 5’‐ ‐3’ Poly A 1 4326 4333 5203 5022 5010 5348 5478 6125 5481