PENGGUNAAN EKSTRAK KULIT
BATANG JALOH (
Salix tetrasperma
Roxb)
UNTUK MENGURANGI DAMPAK
CEKAMAN PANAS PADA AYAM BROILER
SUGITO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Penggunaan Ekstrak Kulit Batang Jaloh (Salix tetrasperma Roxb) untuk Mengurangi Dampak Cekaman Panas pada Ayam Broiler adalah karya saya beserta komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Maret 2007
Mengurangi Dampak Cekaman Panas pada Ayam Broiler. Dibimbing oleh WASMEN MANALU, DEWI APRI ASTUTI, EKOWATI HANDHARYANI, dan CHAIRUL.
Peningkatan suhu lingkungan menyebabkan cekaman panas dan penurunan produktivitas ayam broiler. Ekstrak tanaman jaloh berpotensi digunakan untuk mengurangi dampak cekaman panas karena mengandung senyawa yang bersifat sebagai penurun panas. Telah dilakukan penelitian penggunaan ekstrak kulit batang jaloh pada ayam broiler yang diberi cekaman panas. Penelitian ini bertujuan menentukan fraksi ekstrak kulit batang jaloh yang dapat mengurangi dampak cekaman panas, mengetahui dosis efektif, kandungan senyawa ekstrak jaloh, dan mempelajari kemungkinan jalur mekanisme kerjanya.
Penelitian ini dilakukan dalam tiga tahap. Tahap I adalah penentuan jenis ekstrak jaloh yang dapat mengurangi dampak cekaman panas pada suhu kandang 33 ± 1oC. Jenis fraksi ekstrak jaloh yang digunakan adalah etanol, etil asetat, dan n-heksan dengan dosis masing-masing 10 mg/kg BB. Tahap II adalah penentuan dosis efektif ekstrak jaloh dengan menggunakan dosis 5, 10, dan 20 mg/kg BB. Parameter yang digunakan untuk mengevaluasi efek proteksi ekstrak jaloh dalam mengurangi cekaman panas adalah perubahan suhu tubuh, nilai rasio heterofil:limfosit, kadar kortisol dalam feses, pertambahan bobot badan, nilai rasio konversi pakan, dan perubahan tingkah laku. Tahap III adalah mengetahui respons dosis efektif ekstrak jaloh terhadap kadar kalsium dalam serum, tingkah laku, dan ekspresi enzim inducible nitric oxide synthase (iNOS) dalam jaringan paru.
Hasil penelitian pada tahap I menunjukkan bahwa jenis fraksi ekstrak n-heksan jaloh dapat memperbaiki kinerja pertumbuhan dan mengurangi stres berdasarkan indikator yang diukur. Pada tahap II, diketahui bahwa dosis efektif ekstrak n-heksan jaloh adalah 10 mg/kg BB. Pada tahap III, hasil penelitian menunjukkan bahwa ekstrak n-heksan jaloh dosis 10 mg/kg BB tidak mempengaruhi kadar kalsium dan glukosa dalam serum serta penurunan suhu tubuh, tetapi dapat mengurangi stres dan meningkatkan jumlah sel yang positif iNOS pada paru. Kandungan senyawa kimia yang terbanyak dalam ekstrak n-heksan kulit batang jaloh adalah asam lemak palmitat sebesar 35,91% dan asam linoleat sebesar 14,76%.
Dari hasil penelitian ini dapat disimpulkan bahwa ekstrak n-heksan jaloh dosis 10 mg/kg BB dapat digunakan untuk mengurangi dampak cekaman panas pada ayam broiler. Mekanisme kerja ekstrak n-heksan jaloh dalam mengurangi dampak cekaman panas diduga terkait dengan peran asam-asam lemak (terutama asam linoleat) yang terkandung dalam ekstrak n-heksan jaloh sebagai senyawa yang bertanggung jawab dalam aktivasi iNOS pada jaringan paru.
Detrimental Effects of Heat Stress in Broilers Chicken. Under the direction of WASMEN MANALU, DEWI APRI ASTUTI, EKOWATI HANDHARYANI, and CHAIRUL.
Increasing ambient temperature could cause heat stress on broiler and result in decreasing productivity. Extract jaloh potentially reducing the detrimental effect of heat stress since it contain compound which decreases body temperature. The research was done to use jaloh bark extract to reduce detrimental effect of heat stress on broiler chicken. The purpose of the study was to determine fraction types of jaloh bark extract which could reduce heat stress impact, effective dose, to analyze extract jaloh chemical compounds, and its mechanism activity pathways.
The study consisted of three steps. The first step was to determine fraction types of jaloh bark extract which could reduce detrimental effect of heat stress in cage temperature 33 ± 1oC. Ethanol, ethyl acetate, and n-hexane fractions were used at each dose 10 mg/kg BW. The second step was to determine the effective dose of the n-hexane fraction which used doses 5, 10, and 20 mg/kg BW. Parameters used to evaluate the reducing detrimental effect stress of extract jaloh were body temperature, ratio of heterophil and lymphocyte, cortisol level in feces, gain of body weight, feed conversion ratio, and change of behaviors. The third step was to study the response of the effective dose of n-hexane extract jaloh on calcium and glucose concentration in serum and the expression of inducible nitric oxide synthase (iNOS) at lung tissue.
The result of the first step indicated that fraction of n-hexane solution could improve performance and lessen stress which based on indicator stress measured. At second step was found that effective dose of n-hexane jaloh bark extract was 10 mg/kg BW. At third step, the n-hexane jaloh bark extract at dose 10 mg/kg BW was not change significantly the calcium and glucose concentration in serum, and decreasing body temperature. However, it could lessen stress, and increase the number of lung cells were positive iNOS. The highest chemical compound in n-hexane jaloh bark extract were two major fatty acids i.e., palmitic acid (35.91%) and linoleic acid (14.76%).
This research concluded that n-hexane jaloh bark extract at the dose of 10 mg/kg BW could be used in reducing detrimental effect of heat stress on broiler. Mechanism of n-hexane jaloh bark extract in reducing detrimental effect of heat stress assumed, related to the role of fatty acids (linoleic acid) which responsible to activate iNOS at lung tissue.
©
Hak cipta milik Institut Pertanian Bogor, tahun 2007
Hak cipta dilindungi
BATANG JALOH (
Salix tetrasperma
Roxb)
UNTUK MENGURANGI DAMPAK
CEKAMAN PANAS PADA AYAM BROILER
SUGITO
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Progam Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
karunia dan hidayah-Nya sehingga karya ilmiah ini dapat diselesaikan. Ruang lingkup penelitian ini adalah mempelajari penggunaan ekstrak kulit batang tanaman jaloh untuk mengurangi dampak stres karena cekaman panas pada ayam broiler.
Dengan selesainya karya ilmiah ini penulis menyampaikan ucapan terima kasih yang sedalam-dalamnya kepada Bapak Wasmen Manalu, Ibu Dewi Apri Astuti, Ibu Ekowati Handharyani, dan Bapak Haji Chairul selaku pembimbing yang dengan sangat sabarnya telah banyak memberikan masukan, nasehat, dan dorongan semangat serta dengan tulus telah mengorbankan waktu selama pelaksanaan penelitian dan penulisan disertasi. Di samping itu, penghargaan penulis sampaikan kepada seluruh staf dan pegawai di Laboratorium Fitokimia Biologi LIPI Kebun Raya Bogor dan Laboratorium Toksikologi Balai Besar Penelitian Veteriner (BBalitvet) Bogor yang telah memberikan banyak saran dan mengizinkan pemakaian fasilitas selama pelaksanaan penelitian.
Penghargaan dan ucapan terima kasih penulis sampaikan kepada Bapak-bapak dan Ibu-ibu dosen serta para laboran di Laboratorium Patologi dan Fisiologi Fakultas Kedokteran Hewan (FKH) Institut Pertanian Bogor (IPB) yang telah banyak membantu selama pelaksanaan penelitian.
Ucapan terima kasih juga penulis sampaikan kepada Rektor Universitas Syiah Kuala (Unsyiah), Dekan FKH Unsyiah, Dekan FKH IPB, serta Ketua Program Studi Sains Veteriner (SVT), Pemerintah Daerah Nanggroe Aceh Darussalam (NAD), Yayasan Pendidikan Putera Mama, Deutscher Akademischer Austausch Dienst (DAAD) Jerman, serta semua pihak atas segala bantuan yang diberikan.
Ucapan terima kasih yang tak terhingga disampaikan kepada Ibunda Sudiyem, istri, anak, dan seluruh keluarga, atas segala doa dan kasih sayangnya. Ucapan yang sama penulis sampaikan juga kepada teman-teman dan pihak-pihak yang telah banyak memberikan dorongan, baik materi maupun moral sehingga pelaksanaan penelitian dan penulisan disertasi ini dapat diselesaikan.
Bogor, Maret 2007
pada tanggal 15 Februari 1961 dari ayah Muhammad Syarief (almarhum) dan ibu Sudiyem. Penulis merupakan anak keempat dari sembilan bersaudara. Pendidikan sarjana ditempuh pada program studi Kedokteran Hewan, Fakultas Kedokteran Hewan (FKH) Universitas Syiah Kuala Banda Aceh, lulus tahun 1986 dan pada tahun 1988 pada fakultas yang sama lulus pendidikan dokter hewan. Pada tahun 1991, penulis diterima di Program Studi Sains Veteriner pada Program Pascasarjana IPB dan menamatkannya pada tahun 1994. Kesempatan melanjutkan studi ke program doktor pada program studi dan perguruan tinggi yang sama diperoleh pada tahun 2002. Beasiswa pendidikan pascasarjana diperoleh dari Departemen Pendidikan Nasional (BPPS-Diknas) Republik Indonesia. Sejak tahun 1989 penulis bekerja sebagai dosen pada FKH Unsyiah Darussalam Banda Aceh.
DAFTAR TABEL ... xii
Penggunaan Tanaman Jaloh sebagai Bahan Obat Tradisional ... 7
Komposisi Senyawa Bioaktif Tanaman Jaloh ... 7
Efek Farmakologis Senyawa Bioaktif Tanaman Jaloh ... 8
Lipida pada Tanaman ... 10
Cekaman (Stres) pada Ayam …... 11
Cekaman Panas pada Ayam …... 12
Pengaruh Cekaman Panas pada Jalur Hipotalamu-Hipofisa-Adrenal Ayam ………... 15
Evaluasi Pengaruh Pemberian Ekstrak Jaloh (Salix tetrasperma Roxb) pada Performans dan Indikator Stres pada Ayam Broiler yang Diberi Cekaman Panas
Perubahan Kadar Hormon Kortisol, Triiodotironin-bebas dan Hematologi pada Ayam Broiler yang Diberi Cekaman Panas dan Ekstrak Heksan Jaloh
Abstrak ... 53
Pendahuluan ... 54
Bahan dan Metode ... 55
Hasil dan Pembahasan ... 58
Simpulan ... 64
Daftar Pustaka ... 64
Performans dan Morfometrik Jaringan Usus pada Ayam Broiler yang Diberi Cekaman Panas dan Ekstrak n-Heksan Jaloh Abstrak ... 68
Pendahuluan ... 68
Bahan dan Metode ... 70
Hasil dan Pembahasan ... 72
Simpulan ... 77
Daftar Pustaka ... 78
Efek Pemberian Ekstrak n-Heksan Tanaman Jaloh terhadap Kadar Kalsium dan Glukosa Serum serta Ekspresi Nitrat Oksida Sintase Indusibel Paru Ayam Broiler yang Diberi Cekaman Panas Abstrak ... 80
Pendahuluan ... 81
Bahan dan Metode ... 82
Hasil dan Pembahasan ... 85
Simpulan ... 92
Daftar Pustaka …... 92
PEMBAHASAN UMUM ... 95
SIMPULAN DAN SARAN ... 104
1. Kisaran suhu lingkungan yang direkomendasikan untuk produksi optimum pertumbuhan pada berbagai tingkat umur ayam broiler (sumber: Kuczynski 2002)... 12
2. Keadaan rata-rata (±SD) suhu di luar dan dalam kandang percobaan selama pelaksanaan penelitian... 33
3. Rata-rata (±SD) bobot badan, pertambahan bobot badan (PBB), konsumsi pakan (KP), dan rasio konversi pakan (RKP) pada ayam broiler yang diberi perlakuan fraksi ekstrak jaloh selama 14 hari... 36
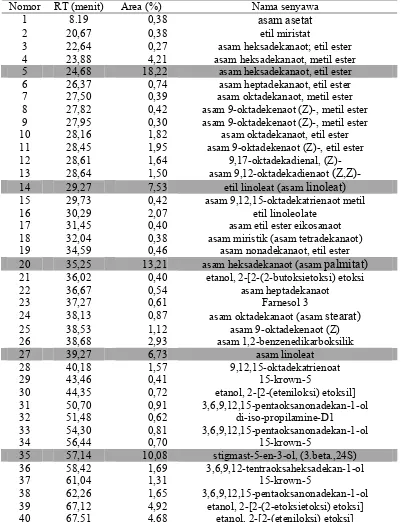
4. Waktu retensi (RT = retention time), peak area, dan nama-nama senyawa hasil analisis ekstrak kulit batang tanaman jaloh dengan alat GC-MS... 47
5. Rata-rata (±SD) kadar kortisol (ug/dl) dalam feses yang diambil pada 3 periode waktu pengambilan, yaitu pengambilan I (feses dikumpulkan antara 1 sampai 2 jam sebelum penelitian dimulai), pengambilan II (feses dikumpulkan antara 3 sampai 4 jam setelah ayam diberi perlakuan cekaman panas), pengambilan III (feses dikumpulkan antara 2 sampai 3 jam setelah suhu dalam kandang berpemanas diturunkan)... 59
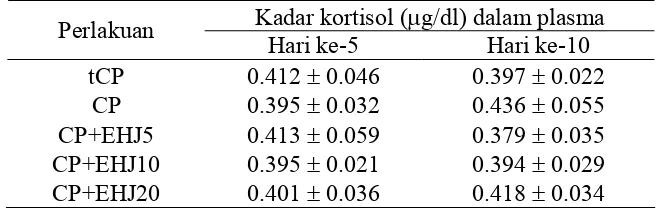
6. Rata-rata (±SD) kadar kortisol dalam plasma (μg/dl) ayam broiler yang diambil pagi pada hari ke-5 dan ke-10 dari pelaksanaan penelitian... 60
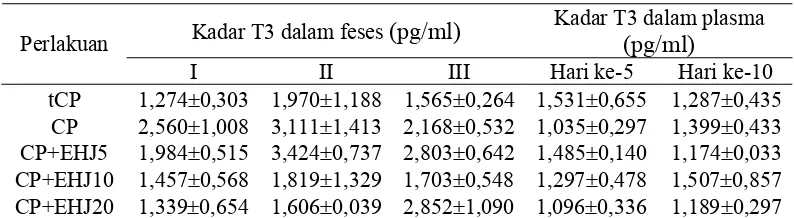
7. Rata-rata (±SD) kadar triiodotironin-bebas (T3b) (pg/ml) dalam feses pada 3 periode pengukuran dan kadar T3 dalam plasma pada 2 periode pengukuran... 62
8. Rata-rata (±SD) jumlah eritrosit (x 106/μl), hemoglobin (Hb), packed cell volume (PCV), jumlah leukosit (x 103/μl), dan rasio heterofil dan limfosit (H:L) ayam broiler yang diberi perlakuan cekaman panas dan EHJ... 63
9. Rata-rata (±SD) suhu tubuh (°C) ayam yang diukur setiap hari selama 5 hari pada 3 kali waktu pengukuran, yaitu 2 jam sebelum diberi perlakuan (I), 2, dan 4 jam setelah diberi cekaman panas (II dan III) pada masing-masing perlakuan... 73
11. Rata-rata (±SD) tinggi (μm) dan luas permukaan (μm2) vili duodenum, yeyunum, dan ileum pada ayam broiler yang diukur setelah 10 hari pemberian perlakuan... 75
12. Hasil pengamatan tingkah laku ayam broiler yang diberi cekaman panas tanpa EHJ (CP) dan diberi cekaman panas dan EHJ 10 mg/kg BB (CP+EHJ)... 87
13. Rata-rata (±SD) kadar glukosa (mg%) dan kalsium (ppm) dalam serum ayam yang diberi cekaman panas tanpa diberi EHJ (CP) dan diberi cekaman panas dan EHJ 10 mg/kg BB (CP+EHJ)... 90
1. Pohon, bunga, dan daun tanaman jaloh (Salix tetrasperma Roxb).. 6
2. Diagram zona suhu nyaman (thermoneutral zone) pada lingkungan pemeliharaan untuk optimasi produktivitas ayam... 14
3. Jalur aktivasi hipotalamus-hipofisa-adrenal korteks pada keadaan menderita cekaman panas dan dampak utama yang ditimbulkannya serta jalur sekresi, metabolisme dan eskresi hormon kortisol... 16
4. Skema metabolisme kortisol dengan prazat kolesterol pada jaringan adrenal korteks... 21
5. Ilustrasi aktivasi pembentukan iNOS yang melibatkan beberapa produk proinflamasi [IL-1 (interleukin 1), TNF (tumor necrosis factor), IFN (interferon)], nukleus faktor-kaffa B (NF-κB), hambatan (inhibiton)-kaffa B (I-κB), dan arginin serta peran senyawa NO di dalam sel untuk proses aktivasi vasodilatasi sel-sel otot polos dengan melibatkan GS (guanosin siklase), GTP (guanosin trifosfat), cGMP (siklik guanosin monofosfat), PK-G (protein kinase G), Na+K+ATP-Ase (sodium kalium ATP-ase), (Na+)i (ion Na intraselular), (Ca2+)i (ion Ca intraselular)... 25
6. Skema fraksinasi ekstrak kulit batang jaloh dengan cara maserasi menggunakan larutan n-heksan (Fr. Heksan), etil asetat (Fr. EtOAc), dan etanol (Fr. EtOH)... 29
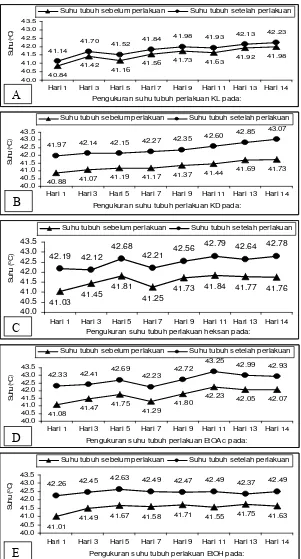
7. Rata-rata suhu tubuh ayam sebelum dan sesudah diberi cekaman panas pada masing-masing perlakuan A) KL= Kontrol luar ayam tanpa diberi cekaman panas dan ekstrak jaloh; B) KD=Kontrol dalam ayam diberi cekaman panas tanpa diberi fraksi jaloh; C) Fr. Hek = Diberi cekaman panas dan diberi fraksi heksan 10 mg/kg BB; D) Fr. EtOAc= Diberi cekaman panas dan diberi fraksi etil asetat 10 mg/kg BB; E) Fr. EtOH = Diberi cekaman panas dan diberi fraksi etil alkohol 10 mg/kg BB... 35
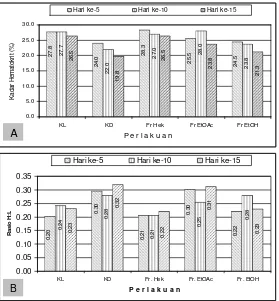
8. Rata-rata (±SD) kadar hematokrit (A) dan rasio H:L (B) ayam broiler yang tidak diberi cekaman panas (KL) dan perlakuan yang diberi cekaman panas disertai pemberian ekstrak jaloh... 39
10. Suhu kandang selama penelitian dilakukan (Gambar A) dan rata-rata suhu tubuh (Gambar B) ayam perlakuan CP (diberi cekaman panas tanpa EHJ) dan CP+EHJ (diberi cekaman panas dan EHJ dosis 10 mg/kgBB) sejak 2 jam sebelum penelitian dimulai dan 2 jam setelah cekaman panas dihentikan... 86
11. Jumlah sel yang secara imunoreaktif positif terhadap iNOS (tanda panah) pada ayam kontrol (A), CP (diberi cekaman panas tanpa diberi EHJ, B), dan CP+EHJ (diberi cekaman panas dan EHJ 10 mg/kg BB, C) pada metode pewarnaan dengan DAB... 91
12. Beberapa hipotesis mekanisme kerja senyawa EHJ dalam mengurangi dampak cekaman panas yang diduga terjadi melalui 4 jalur, yaitu 1 senyawa EHJ dirombak menjadi eikosanoid, 2 senyawa EHJ digunakan sebagai zat nutrien, 3 senyawa EHJ membantu pertumbuhan mikoflora dalam saluran pencernaan, dan 4 senyawa EHJ berperan sebagai antioksidan... 97
13. Ilustrasi kemungkinan jalur mekanisme kerja EHJ dalam mengaktivasi pembentukan iNOS pada jaringan paru yang melibatkan nukleus faktor-kaffa B (NF-κB) dan inhibiton-kaffa B (I-κB)... 99
1. Hasil anova pengukuran suhu tubuh ayam yang diukur setiap hari selama 5 hari pada 3 kali waktu pengukuran. Pengukuran I dilakukan 2 jam sebelum diberi perlakuan, pengukuran II dan III dilakukan 2 dan 4 jam setelah diberi cekaman panas pada masing-masing perlakuan... 118
2. Hasil anova selisih suhu tubuh ayam yang diukur pada pengukuran II dengan pengukuran I dan pengukuran III dengan pengukuran I. Pengukuran I dilakukan 2 jam sebelum diberi perlakuan, pengukuran II dan III dilakukan 2 dan 4 jam setelah diberi cekaman panas pada masing-masing perlakuan... 119
3. Hasil anova jumlah gerakan pernapasan terhadap perlakuan... 120
4a. Hasil anova kadar glukosa dan kalsium dalam serum... 121
4b. Hasil anova sel jumlah sel positif iNOS pada jaringan paru 121
5. Surat hasil identifikasi/determinasi tumbuhan jaloh asal Desa Montasek Kabupaten Aceh Besar... 122
Ayam dapat berproduksi secara optimum atau hidup dengan nyaman bila
faktor-faktor internal dan ekternal berada dalam batasan-batasan normal yang
sesuai dengan kebutuhan hidupnya. Keadaan suhu lingkungan merupakan salah
satu faktor ekternal, yang dapat mempengaruhi kenyamanan dan produktivitas
ayam. Suhu panas pada suatu lingkungan industri ayam telah menjadi salah satu
perhatian utama karena dapat menyebabkan kerugian ekonomi akibat peningkatan
angka kematian ataupun penurunan produktvitas (St-Pierre et al. 2003). Di
Indonesia laporan kerugian ekonomi karena pengaruh cekaman panas pada ternak
unggas sampai sejauh ini belum ditemukan. Gambaran nyata di lapangan tentang
kerugian akibat cekaman panas ini diduga relatif besar, mengingat suhu
lingkungan dan kelembaban udara yang relatif tinggi. Pada siang hari rata-rata
suhu harian berkisar antara 27,7 dan 34,6oC dengan kelembaban udara berkisar
antara 55,8 dan 86,8% (BPS 2003). Sebagai pembanding dapat dilihat laporan
Kuczynski (2002) yang menyatakan bahwa pemeliharaan ayam broiler sampai
umur 35 hari pada suhu di atas 31oC menyebabkan penurunan bobot badan
mencapai 25%, jika dibadingkan dengan pemeliharaan pada suhu 21,1-22,2oC.
Kerugian tersebut belum termasuk peningkatan angka kematian dan nilai rasio
konversi pakan.
Ayam merupakan hewan berdarah panas (endotermik/homeotermik) yang
suhu tubuhnya diatur dalam suatu kisaran yang sesuai. Pada keadaan normal, suhu
tubuh ayam dewasa berkisar antara 41 dan 42oC dengan variasi antara 1,5oC. Bila
suhu lingkungan meningkat, suhu tubuh ayam juga akan meningkat (Cooper &
Washburn 1998; Aengwanich & Simaraks 2004). Umumnya diperlukan suhu
lingkungan yang relatif lebih tinggi untuk anak ayam berumur 1-2 minggu,
sedangkan broiler berumur 4-6 minggu (saat bulu kasar telah tumbuh)
memerlukan suhu lingkungan yang lebih rendah guna menjaga keseimbangan
antara pembentukan dan pelepasan panas tubuh agar pertumbuhannya optimum
(Kuczyński 2002). Pada ayam broiler berumur di atas 20 hari, keadaan suhu
lingkungan yang optimum untuk pertumbuhan berkisar antara 20 dan 25oC
Ayam broiler berumur di atas 3 minggu akan mengalami cekaman panas serius
bila suhu lingkungan lebih tinggi dari 32oC (Cooper & Washburn, 1998).
Cekaman panas dihasilkan dari adanya ketidakseimbangan (keseimbangan
negatif) antara jumlah panas yang dilepaskan dari tubuh ke lingkungan di
sekitarnya dengan jumlah panas yang dihasilkan tubuh (Lin et al. 2005). Selama
ayam mengalami cekaman, terjadi perubahan-perubahan fisiologis dan
metabolisme tubuh dalam upaya mempertahankan diri dengan pengembangan
sistem homeostasis yang ada, agar suhu tubuh berada pada kisaran normal.
Upaya-upaya tersebut berupa percepatan pengeluaran panas dengan perubahan
tingkah laku dan perubahan metabolisme tubuh (Roberts et al. 2002).
Cekaman panas (heat stress) menyebabkan penurunan pertumbuhan dan
tidak efisiennya penggunaan pakan pada ayam broiler (Donkoh 1989; Mashaly et
al. 2004). Penurunan pertumbuhan ini terkait dengan penurunan konsumsi pakan
selama ayam mengalami cekaman panas (McFarlane et al. 1989), sedangkan tidak
efisiennya penggunaan pakan diduga salah satu penyebabnya terkait dengan
terganggunya pertumbuhan saluran pencernaan. Pada ayam broiler yang
mengalami cekaman panas, villi pada duodenum dan yeyunum akan memendek
(Mitchell & Carlisle 1992). Komposisi zat dalam makanan dan zat aktif dalam
ekstrak tanaman tertentu dalam pakan dapat juga mempengaruhi pertumbuhan vili
usus (Jamroz et al. 2006).
Cekaman panas menyebabkan penurunan pertambahan bobot badan dan
gangguan pembentukan sel-sel darah putih (Cooper & Washburn 1998),
peningkatan sel-sel heterofil dan penurunan sel-sel limfosit sehingga rasio antara
heterofil dan limfosit meningkat (Aengwanich & Chinrasri, 2002; Bedanova et al.
2003), dan penurunan kadar hematokrit (Packed cell volume = PCV) (Altan et al.
2000). Peningkatan rasio heterofil:limfosit selalu digunakan sebagai indikator
yang akurat akibat cekaman panas yang kronis pada ayam (Bedanova et al. 2003).
Pada ayam yang mengalami cekaman panas, jalur utama untuk menjaga
keseimbangan suhu adalah pelepasan panas melalui penguapan air (evaporasi)
pada kulit dan saluran pernapasan dengan cara panting (Hoffman & Walsberg
1999; Ophir et al. 2002). Evaporasi terjadi dengan cara pelebaran pembuluh
perifer (vasodilatasi) sehingga darah lebih banyak membawa panas dari dalam
berperan dalam perangsangan vasodilatasi pembuluh darah adalah nitrat oksida
(NO). Nitrat oksida terbentuk dari asam amino arginin dan enzim nitrat oksida
sintase (NOS) yang berperan sebagai biokatalisatornya (Taylor & Bishop 1993;
Mori & Gotoh 2004). Dari 3 bentuk (isoform) NOS, iNOS diketahui banyak
berperan pada keadaan hewan menderita cekaman. Secara normal iNOS sangat
rendah kadarnya pada sel (Tedeschi et al. 2004). Aktivasi iNOS diinduksi oleh
beberapa jenis sitokin seperti interleukin 1 (IL-1) (Virag et al. 1998; Pitt & Croix
2002; Teng et al. 2002; Chen et al. 2004).
Berbagai upaya telah dilakukan untuk mengurangi pengaruh suhu panas
pada pemeliharaan ayam broiler, baik aspek eksternal seperti pengembangan
disain kandang dan pemasangan instalasi penyejuk maupun internal tubuh ayam
seperti pengaturan pemberian pakan berupa suplementasi mikronutrient (vitamins
dan mineral) (Abu-Dieyeh 2006; Lin et al. 2006). Penelitian-penelitian tentang
penanganan aspek internal tubuh ayam telah banyak menjadi perhatian peneliti.
Hasil penelitian menunjukkan bahwa suplementasi mikronutrient dilaporkan dapat
mengurangi dampak cekaman panas pada ayam, tetapi efek pemberiannya hanya
bersifat simptomatis, tidak berefek langsung pada kenyamanan ayam. Pemberian
tersebut lebih mengarah kepenggantian senyawa-senyawa yang hilang dan efek
antioksidan pada saat terjadi cekaman
Beberapa hasil penelitian menunjukkan bahwa pemberian bahan tanaman
obat dapat dimanfaatkan sebagai antistres pada ayam broiler. Aspek yang banyak
menjadi kajian adalah efek pemberian ekstrak tanaman pada performans produksi
daging maupun produksi telur (Roy et al 1996; Dhal et al. 1997; Narayanswamy
et al. 2004; Setiaji & Sudarman 2006; Kusnadi et al. 2006). Aspek kajian yang
lebih mendalam terkait mekanisme kerja masih belum banyak dilaporkan. Potensi
pemanfaatan bahan asal tanaman obat sangat besar, mengingat Indonesia memiliki
kekayaan biodeversitas yang luas.
Di Nanggroe Aceh Darussalam (NAD) telah lama diketahui ada sejenis
tanaman yang biasa digunakan sebagai obat tradisionil dalam bahasa Aceh disebut
jaloh (bak sijalŏh). Dari hasil identifikasi, tanaman tersebut sejenis dengan Salix
sp, dari famili Salicaceae, yaitu Salix tetrasperma Roxb. Pada beberapa daerah di
NAD, tumbuhan jaloh ini biasanya digunakan oleh masyarakat sebagai obat
telah lama diketahui, terutama di negara-negara Eropa dan Asia sebagai obat pada
manusia (Fiebich & Chrubasik 2004). Sayangnya, sejak ditemukannya aspirin dan
dapat dibuat secara sintetik, penelitian khasiat ekstraksi Salix spp jarang
dilakukan. Pembahasan tentang aktivitas ekstraksi Salix spp selalu mengacu ke
hasil penelitian asam salisilat (aspirin) (Vane 2000; Long et al. 2001).
Tanaman Salix spp telah terbukti sebagai bahan obat antipiretik
(Chrubasik et al. 2000; Fabricant & Farnsworth 2001), antiinflamasi (Fiebich &
Chrubasik 2004; Khayyal et al. 2005), dan antioksidan (Kahkonen et al. 1999).
Analisis dan penentuan kandungan senyawa pada tanaman salix yang telah
dilaporkan umumnya diekstraksi dengan etanol atau larutan yang bersifat polar
lainnya (Kammerer et al. 2005). Hasil analisis pada beberapa spesies Salix
(seperti Salix alba; S. daphnoides, S. purpurea, S. matsudana) umumnya
mengandung senyawa glikosida, seperti salisin. Selain itu, diidentifikasi juga
beberapa senyawa terpen, flavonoid, dan beberapa jenis steroid (Chrubasik et al.
2001; Du et al 2004; Zheng et al. 2005; Kammerer et al. 2005). Kajian terakhir
menunjukkan bahwa senyawa bioaktif pada ekstrak beberapa jenis tanaman salix
dapat bekerja menghambat aktivitas enzim siklooksigenase (Marz & Kemper
2002; Zheng et al. 2005) dan pelepasan tumor nekrosis faktor-alpha (TNF-α),
interleukin-1 beta (IL-1β), serta IL-6 (Fiebich & Chrubasik 2004).
Diduga bahwa peran ekstrak tanaman jaloh dalam mengurangi dampak
cekaman panas pada ayam broiler berkaitan dengan peran enzim nitrat oksida
sintase tipe indusibel (iNOS = inducible nitrate oxide synthase) untuk proses
vasodilatasi sehingga terjadi peningkatan pelepasan panas tubuh melalui
evaporasi. Penelitian ke arah ini pada ayam broiler yang mengalami cekaman
panas belum ditemukan. Oleh karena itu, dirumuskan suatu kerangka pemikiran
untuk mengkaji penggunaan ekstrak kulit batang jaloh untuk mengurangi dampak
cekaman panas pada ayam broiler.
Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk mempelajari penggunaan ekstrak
kulit batang jaloh (Salix tetrasperma Roxb) dalam upaya mengurangi dampak
cekaman panas pada ayam broiler sehingga dapat memperbaiki performans dan
adalah menentukan jenis fraksi ekstrak kulit batang jaloh yang dapat mengurangi
dampak cekaman panas, dosis efektif, kandungan senyawa kimia ekstrak jaloh,
dan mempelajari kemungkinan jalur mekanisme kerjanya.
Untuk mencapai tujuan tersebut, dilakukan 3 tahap pelaksanaan penelitian.
Ketiga tahap pelaksanaan penelitian tersebut adalah tahap pertama penentuan
jenis fraksi ekstrak kulit batang jaloh yang dapat digunakan untuk mengurangi
dampak cekaman panas. Tahap kedua adalah penentuan dosis efektif ekstrak
n-heksan kulit batang jaloh (EHJ). Tahap ketiga adalah penentuan jalur mekanisme
kerja EHJ dengan melihat ekspresi iNOS pada jaringan paru. Selain itu dilakukan
juga analisis kandungan senyawa di dalam EHJ dengan menggunakan GC-MS.
Dari ke-3 tahapan pelaksanaan penelitian dan analisis kandungan senyawa EHJ
tersebut, laporan hasil penelitian disertasi ini dibuat dalam 5 subjudul artikel.
Hipotesis Penelitian
1. Ekstrak kulit batang jaloh (Salix tetrasperma Roxb) dapat mengurangi
dampak cekaman panas pada ayam broiler.
2. Ekstrak n-heksan kulit batang jaloh efektif bekerja mengurangi dampak
cekaman panas pada dosis 10 mg/kg bobot badan.
3. Kandungan utama senyawa dalam EHJ adalah asam-asam lemak.
4. Mekanisme kerja ekstrak n-heksan kulit batang jaloh mengurangi dampak
cekaman panas terjadi melalui aktivasi enzim iNOS pada jaringan paru.
Manfaat Penelitian
Penelitian ini diharapkan menemukan jenis tanaman obat yang dapat
digunakan untuk mengurangi kerugian akibat cekaman panas pada ayam broiler,
terutama di musim kemarau. Selain itu, penelitian ini juga berupaya menggali dan
memanfaatkan sumber hayati tanaman obat yang terdapat di tanah air guna
memperbaiki produktivitas ayam broiler dalam upaya meningkatkan produktivitas
Jaloh (Jalŏh atau Sijalŏh) dalam bahasa Aceh merupakan sebutan untuk
suatu jenis tumbuhan perdu dari famili Salicaceae, yaitu Salix tetrasperma Roxb.
Jaloh merupakan tumbuhan subtropis daerah Asia, terutama India dan Cina.
Penyebaran tanaman ini ke daratan Indonesia adalah melalui Semenanjung
Malaysia. Penyebaran tanaman jaloh di Indonesia terbatas hanya pada beberapa
wilayah di Pulau Sumatera (bagian Utara dan Tengah), di Pulau Jawa (Jawa
Tengah dan Jawa Barat bagian Utara), Pulau Madura, dan beberapa daerah di
Pulau Lombok, Sumbawa, Sumba serta Flores (Burkill 1935; VanSteenis 1976).
Jaloh mempunyai nama daerah antara lain Kapeh-kapeh (Minangkabau),
Dalu-dalu atau Dĕdalu (Melayu), Anyang atau Kayu Anyang (Madura dan Jawa)
(Clercq & Greshoff 1909).
Gambar 1. Pohon, bunga, dan daun tanaman jaloh (Salix tetrasperma Roxb)
Tumbuhan ini berupa pohon yang hidup di daerah berawa dan mempunyai
tinggi berkisar 3 sampai 10 m. Daun bagian bawahnya berwarna putih, pinggir
bergerigi, panjang 4-10 cm dan lebar 1-2,5 cm. Permukaan kulit batang bagian
luarnya yang muda mengkilap berwarna cokelat tua atau agak kehijauan,
sedangkan kulit batang yang tua terlihat kasar. Gambar daun dan bunga jaloh
Magnoliophyta; kelas: Magnoliopsida; subklas: magnoliidae; ordo: Salicales;
famili: Salicaceae; genus: Salix; spesies: Salix tetrasperma Roxb. Sinonim
tanaman ini Salix azaolana Blanco atau Salix horsfieldiana Miquel (Hanum,
1997).
Penggunaan Tanaman Jaloh sebagai Bahan Obat Tradisional.
Penggunaan tanaman Salix spp sebagai bahan obat tradisonal telah lama
diketahui, terutama di negara-negara Eropa dan Asia. Dalam dunia farmasi,
beberapa spesies Salix (seperti S. alba dan S. purpurea) telah populer diketahui
karena dari ekstrak tumbuhan inilah asal mula ditemukannya aspirin (Bowman &
Rand 1980; Vane 2000). Di kawasan Semanjung Malaysia, tanaman salix ini telah
lama dimanfaatkan sebagai obat penurun panas (antipiretik) pada kasus demam
(Burkill 1935). Di beberapa daerah di Aceh (NAD), jaloh ini biasanya digunakan
sebagai obat penurun panas. Pemanfaatannya tidak hanya sebagai bahan obat pada
manusia tetapi juga pada ternak. Menurut Daniel et al. (2001) di beberapa daerah
di India dan China, Salix spp digunakan sebagai obat tonik dan gangguan pada
saluran pencernaan.
Beberapa hasil penelitian uji klinis menunjukkan pemberian ekstrak
tanaman salix efektif untuk mengurangi rasa sakit, seperti pada kasus reumatik
dan sakit otot punggung (Chrubasik et al. 2000; Fabricant & Farnsworth 2001).
Pada umumnya, ekstrak tanaman Salix spp selalu dimanfaatkan sebagai
antiinflamasi, analgesik, dan juga antipiretik (Fiebich & Chrubasik 2004; Khayyal
et al. 2005) dan sebagai antioksidan (Kahkonen et al. 1999). Penelitian terakhir
menunjukkan bahwa pemberian ekstrak Salix spp terbukti efektif untuk mencegah
kejadian trombus dan arterosklerosis (Zheng et al. 2005), sebagai bahan obat
untuk lipolisis (Zhang et al. 2000; Han et al. 2003), antinosiseptif (Marz &
Kemper 2002), antileukemia (El-Shemy et al. 2003), dan antikarsinogenik pada
kulit (Sultana & Saleem 2004).
Komposisi Senyawa Bioaktif Tanaman Jaloh. Dalam ekstrak tumbuhan
Salix spp terkandung berbagai senyawa kimia, antara lain golongan glukosida.
Salah satu golongan glukosida sebagai kandungan aktifnya adalah salisilat yang
merupakan prekursor salisin dan turunan-turunannya (Chrubasik et al. 2001).
salikortin, dan diglukosida salisin. Secara in vitro salikortin dan beberapa salisilat
lainnya, seperti tremulasin dan asetil salixortin (yang mengandung
1-hidroksi-6-okso-2-sikloheksena-1-karbonil), sangat labil dan mudah didegradasi menjadi
salisin, tetapi sangat lambat didegradasi bila dalam keadaan utuh di dalam
tanaman (Ruuhola 2000).
Ada beberapa senyawa salisilat yang dapat mengalami reaksi reversibel
untuk pembentukan salisin, seperti salikortin, salisin diglukosida, dan salsisil
alkohol serta melalui pembentukan zat antara seperti 2-O-asetilsalisin dan
tremuloidin. Kandungan kimia salisin pada tanaman salix bergantung pada
spesies, sebagai contoh pada S. purpurea kandungan salisinnya mencapai 3
sampai 8,5%, sedangkan pada S. alba hanya 0,5 sampai 1% (Bone & Morgan
2002).
Pada 10 tahun terakhir ini penelitian tentang penggunaan dan kandungan
kimia tanaman Salix spp menunjukkan peningkatan, terutama pada ekstrak polar
(air dan etanol) dan semi polar (etil asetat). Hampir semua ekstrak asal Salix spp
mengandung senyawa glukosida, seperti salisin dan diglukosida salisin
(Chrubasik et al. 2001). Hasil penapisan dengan HPLC dan MS pada kulit batang
S. daphnoides, S. purpurea, dan persilangan S. purpurea × S. daphnoides
ditemukan beberapa senyawa bioaktif seperti saligenin, asam salisilat, isosalisin,
pikein, salidrosida, triandrin, salikosilsalicin, isosalipurposida, salipurposida,
naringenin-7-O-glukosida dan tremulasin (Kammerer et al. 2005). Pada daun S.
matsudana telah diisolasi juga beberapa senyawa seperti apigenin 7-O-β-D
-glukopiranuronida, luteolin 7-O-β-D-glukopiranuronida, m-hidroksi-benzil β-D
-glukosida, dan krisoeriol 7-O-β-D-glukopira-nuronida (Zheng et al. 2005). Hasil
identifikasi ekstrak kulit batang S. alba dengan menggunakan kromatografi cairan
kinerja tinggi menunjukkan ada tiga jenis senyawa utama flavonoid, yaitu
eriodiktiol, 5,7 dihidroksikromen 4-one, dan naringenin (Du et al. 2004).
Efek Farmakologi Senyawa Bioaktif Tanaman Jaloh. Penggunaan
ekstrak tanaman Salix spp telah terbukti efektif sebagai obat antiinflamasi dan
antipiretik. Oleh sebab itu, dalam kurun waktu 5 tahun terakhir ini
terkandung dalam ekstrak salix terkait dengan efeknya sebagai antiinflamasi dan
antipiretik.
Kajian efek ekstrak kulit batang salix sebagai antipiretik diketahui terjadi
melalui hambatan aktivitas enzim siklooksigenase (cyclooxigenase = COX) yang
merupakan enzim kunci yang diperlukan untuk menghidrolisis asam arakidonat
menjadi prostaglandin (Marz & Kemper 2002). Menurut Zheng et al. (2005)
selain menghambat aktivitas enzim COX, senyawa pada ekstrak salix juga
menghambat pembentukan asam 12-hidroks-5,8,10,14-ieikosatetraenoik
(12-HETE) dan tromboksan (Zheng et al. 2005). Hal ini diduga terkait dengan
pengaruh ekstrak salix pada fungsi trombosit (Marz & Kemper 2002). Senyawa
aktif ekstrak salix terbukti juga bekerja melalui hambatan pelepasan tumor
necrosis factor-alpha (TNF-α), interleukin-1 beta (IL-1β), dan IL-6 (Fiebich &
Chrubasik 2004). Peran ekstrak salix lainnya adalah mengurangi deposit lipid
yang terjadi melalui peningkatan pelepasan asam lemak bebas pada sel-sel lipid
dengan melibatkan hormon norepinefrin dan mengurangi absorbsi asam palmitat
pada membran usus kecil (Zhang et al. 2000; Han et al. 2003).
Ekstrak salix dapat bekerja sebagai antiinflamasi melalui pengurangan
kadar glutation tereduksi (G-SH), suatu senyawa yang mempunyai efek untuk
membatasi pembentukan peroksidasi lipid. Selain itu juga mengurangi
pembentukan malondialdehid yang berperan dalam proteksi tubuh terhadap stres
atau cekaman oksidatif-oksidatif (Khayyal et al. 2005). Sebagai antikarsinogenik
pada kulit, senyawa ekstrak salix diduga bekerja melalui hambatan pembentukan
sintesis DNA, hambatan ornitin dekarboksilase (ODC), dan xantin oksidase yang
ditimbulkan bahan karsinogenik dan juga aktivitas ekstrak salix sebagai
antioksidan (Sultana & Saleem 2004).
Pemberian ekstrak etanol ternyata efektif untuk menghancurkan sel-sel
tumor pada biakan selnya. Diduga efek destruksi ini terjadi melalui inaktivitasi
beberapa jenis enzim yang terlibat dalam pertumbuhan sel tumor, dengan cara
pengikatan senyawa aktif salix pada reseptor sel tumor (El-Shemy et al. 2003).
Hasil uji sebagai antioksidan membuktikan bahwa dari 60 jenis tanaman pohon
yang biasa dipakai sebagai bahan obat, ternyata bahan ekstrak asal tanaman salix
Lipida pada Tanaman
Lipida pada tanaman merupakan unsur penting pembentukan dinding sel.
Padas tanaman kandungan lipid 5-10% bobot kering. Pada tanaman, umumnya
lipid banyak terdapat dalam biji, buah, dan daun (Ohlroggeav & Browseb 1995).
Pada biji tanaman umumnya banyak terdapat asam-asam lemak terutama asam
palmitat (asam heksadekanoat = C16), asam linoleat dan beberapa jenis sterol.
Asam palmitat merupakan asam lemak jenuh utama yang juga banyak terdapat
dalam daun (Harborne 1996). Umumnya, senyawa asam lemak dengan jumlah
C-16 dan C18 banyak ditemukan dalam buah, biji, daun, ataupun bunga. Pada akar
dan kulit batang tanaman relatif rendah (Ogunwande et al. 2006). Selain itu
ditemukan juga golongan asam lemak tak jenuh (C16:3 dan C18:3) dan biasanya
asam-asam lemak ini banyak ditemukan dalam biji-bijian ataupun buah (Robinson
1995; Dewick 2001). Banyaknya jenis asam lemak pada buah dan daun ini
mungkin terkait dengan aktivitas protektif terhadap hama dan pertumbuhan.
Beberapa jenis asam lemak memiliki efek pengaturan pertumbuhan (Robinson
1995). Lipida pada tanaman umumnya mengandung dalam jumlah besar asam
lemak linoleat (ALA = 18:3ω3) (Simopoulos 2004).
Pada tanaman, senyawa asam 9,12-oktadekadienal dan asam
9,12,15-oktadekadienal merupakan asam lemak tak jenuh terbentuk dari perombakan asam
9,12-oktadekadienoat (Tillman et al. 1999). Menurut Hamberg et al. (1999)
pembentukan 9,12,15-oktadekadienal dari asam oleat akibat teraktivasinya enzim
oksigenase. Aktivasi oksigenase terkait dengan keberadaan bakteri patogen pada
tumbuhan. Keberadaan senyawa 9,12,15-oktadekadienal diduga terkait dengan
perannya dalam pengembangan sistem petahanan tubuh.
Semua atom karbon yang terdapat pada asam lemak tanaman merupakan
turunan dari senyawa asetilkoenzim A (KoA) yang ada di dalam plasmid
(Ohlroggeav & Browseb 1995). Pembentukan asam lemak dimulai dengan
karboksilasi dari asetil-KoA oleh enzim asetil-KoA karboksilase ke dalam asam
mevalonat (Gueguen et al 2000). Asam palmitat dibentuk dari perombakan asam
mevalonat pada metokondria. Asam-asam lemak utama yang disintesis dari asam
mevalonat ini adalah asam oktanoat (C8), asam heksadekanoat (C16), dan asam
Pada tanaman juga terdapat lipida golongan sterol. Senyawa ini terlibat di
dalam pengendalian dari proses-proses metabolisme yang berhubungan dengan
membran sel, seperti pengaturan permeabilitas membran dan sinyal transduksi dan
aktivitas enzim-enzim yang terikat pada membran (Kemal & Amar 2006).
Stigmast-5-en-3-ol merupakan golongan fitosterol yang paling sering ditemukan
pada tanaman (Lavoie & Stevanovic 2005). Stigmast-5-en-3-ol (sitosterol)
biasanya banyak ditemukan pada biji-bijian yang menghasilkan minyak seperti
biji buah kapas, jagung, kedelai, gandum dan beberapa jenis bijian lainnya (Tyler
et al. 1988). Sitosterol ini sering juga ditemukan pada tanaman golongan
angiosperma, gimnosperma, dan pakis-pakisan (Hernes & Hedges 2004) dan pada
jaringan tanaman yang hidup di daerah berair, seperti tanaman mangrof yang
hidup di daerah pantai (Hernes et al. 2001). Beberapa jenis senyawa sterol pada
tanaman berfungsi sebagai pelindung untuk menolak serangga dan menolak
serangan mikroba (Harborne 1996).
Cekaman (Stres) pada Ayam
Cekaman (stres) dapat didefinisikan sebagai suatu keadaan tertekan yang
diderita seekor hewan sebagai akibat adanya satu atau lebih pencekam (stressor)
yang berasal dari internal dan atau eksternal tubuh hewan (Borrel 2001).
Meskipun belum ada kesepakatan yang jelas tentang definisi cekaman ini,
setidaknya keadaan cekaman selalu dihubungkan dengan emosi dan sensasi yang
tak nyaman, seperti rasa sakit, kesusahan (distress), takut, frustrasi, lapar, haus,
kepanasan, dan kedinginan (Pacak & Palkovits 2001; Turner 2006). Untuk
penyusuaian terhadap adanya cekaman, tubuh menstimulasi/menginduksi
berbagai perubahan fisiologis dan tingkah laku sebagai upaya tubuh melakukan
homeostasis untuk adaptasi (Borrel 2001).
Cekaman yang terjadi pada seekor hewan merupakan suatu ancaman
keseimbangan bagi tubuh hewan dan akan menyebabkan kematian bila
antisipasinya berjalan lambat. Proses adaptasi terhadap cekaman (allostasis)
adalah upaya organisme agar terus dapat bertahan hidup dalam keadaan seimbang.
Hewan mempertahankan kehidupannya dengan mempertahankan keseimbangan
dinamis dengan lingkungan di sekitarnya. Adanya cekaman baik dari luar maupun
dalam suatu rangkaian proses homeostasis (Hillman et al. 2000; Oconnor et al.
2000).
Cekaman Panas pada Ayam. Ayam termasuk hewan yang tidak
memiliki kelenjar keringat sehingga pelepasan panas tubuh melalui permukaan
kulit menjadi sangat terbatas. Terjadinya gangguan keseimbangan pembentukan
dan pelepasan panas tubuh menyebabkan ayam menderita cekaman dan hal ini
dapat terjadi pada berbagai tingkat umur. Ayam termasuk jenis hewan yang sangat
rentan terhadap peningkatan suhu lingkungan (Dawson & Whittow 2000; Defra
2005). Untuk menjaga keseimbangan suhu tubuhnya, hewan memerlukan
kesesuaian suhu di lingkungannya. Pada ayam broiler, kesesuaian suhu
lingkungan dipengaruhi beberapa faktor, seperti umur, aktivitas dan bobot badan
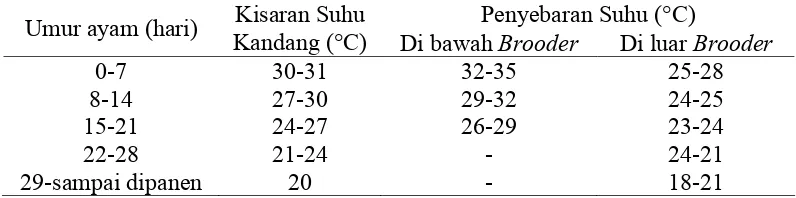
Tabel 1 Kisaran suhu lingkungan yang direkomendasikan untuk produksi optimum pertumbuhan pada berbagai tingkat umur ayam broiler (sumber: Kuczynski 2002)
Penyebaran Suhu (°C) Umur ayam (hari) Kisaran Suhu
Kandang (°C) Di bawah Brooder Di luar Brooder
0-7 30-31 32-35 25-28
8-14 27-30 29-32 24-25 15-21 24-27 26-29 23-24
22-28 21-24 - 24-21
29-sampai dipanen 20 - 18-21
ayam (Hillman et al. 2000). Umumnya, anak ayam berumur 1-2 minggu
memerlukan suhu lingkungan yang relatif lebih tinggi (pada kisaran 29-32oC),
sedangkan broiler berumur 4-6 minggu (saat bulu kasar telah tumbuh)
memerlukan suhu lingkungan lebih rendah (pada kisaran 18-24oC) guna
penyesuaian untuk pertumbuhan optimumnya (Kuczyński 2002). Kesesuaian suhu
pada ayam broiler berumur sehari (day old chicken = DOC) sampai masa panen
dapat dilihat pada Tabel 1.
Pada ayam, untuk dapat bertumbuh dan berkembang secara optimal
diperlukan suatu keadaan suhu dalam batasan zona lingkungan tertentu untuk
dapat hidup dalam suasana nyaman, batasan zona suhu lingkungan yang
diperlukan ayam ini disebut dengan daerah suhu nyaman (thermoneutral zone)
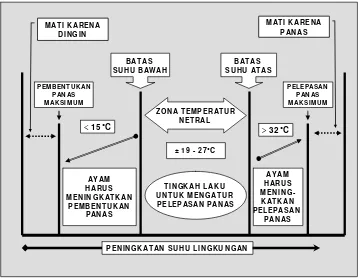
(Defra 2005). Pada Gambar 2 terlihat bahwa pada zona temperatur netral memiliki
dan umur. Pada zona ini produktivitas ayam mencapai titik optimum sesuai
potensi genetiknya. Pada ayam broiler berumur di atas 21 hari, keadaan suhu
lingkungan yang optimum untuk pertumbuhan berkisar antara 20-25oC dengan
kelembaban relatifnya berkisar antara 50-70% (Borges et al. 2004), sedangkan
zona suhu nyaman pada broiler berkisar antara 19 dan 27oC (Hillman et al. 2000).
Peningkatan suhu yang relatif tinggi melebihi kisaran dalam zona suhu nyaman
menyebabkan terjadinya cekaman panas (Austic 2000).
Pada suhu lingkungan lebih tinggi dari 32°C, pembuangan panas melalui
radiasi, konduksi, dan konveksi umumnya tidak cukup mampu untuk
mempertahankan temperatur tubuh ayam. Pada suhu lingkungan lebih tinggi dari
32°C evaporasi melalui pernapasan maupun permukaan kulit ayam merupakan
cara utama untuk melepaskan panas tubuh (Nalon et al. 1978; Dawson & Whittow
2000). Sebagai respons terhadap suhu yang meningkat, tubuh berupaya
mengurangi pembentukan panas dan meningkatkan pelepasan panas tubuh melalui
vasodilatasi (Campbell et al. 2004).
Ayam termasuk golongan hewan berdarah panas (endotermik/
homeotermik) yang suhu tubuhnya diatur dalam suatu batasan yang sesuai. Secara
normal, suhu tubuh ayam dewasa berkisar mulai dari 41 sampai 42oC dengan
variasi sekitar 1,5oC (Aengwanich & Simaraks 2004). Suhu tubuh ayam tersebut
dipertahankan dalam kisaran normal dengan cara pelepasan energi panas yang
dibentuk di dalam tubuh sama dengan yang dilepaskan dari dalam tubuh ke
lingkungannya (Dawson & Whittow 2000).
Peningkatan suhu lingkungan direspons oleh tubuh melalui suatu proses
termoregulasi yang kompleks agar suhu tubuh dapat dipertahankan atau
mendekati keadaan normal (Bouchama & Knochel 2002). Pada hewan mamalia,
pengaturan suhu tubuh merupakan suatu sistem homeostasis kompleks yang
difasilitasi oleh mekanisme umpan balik hipotalamus. Sel-sel saraf yang
mengontrol termoregulasi terkonsentrasi pada hipotalamus. Hipotalamus memiliki
termostat yang merespons bila ada peningkatan atau penurunan suhu tubuh
(Campbell et al. 2004). Hipotalamus memainkan peranan penting dalam
mengontrol temperatur tubuh melalui koordinasi informasi panas dari reseptor
panas yang terdapat pada permukaan kulit tubuh (Cooper 2002). Peningkatan
tubuh dan hipotalamus. Pengaktifan sentral termoregulator pada hipotalamus
menyebabkan peningkatan aliran darah ke jaringan kulit (Bouchama & Knochel
2002).
Gambar 2 Diagram zona suhu nyaman (thermoneutral zone) pada lingkungan pemeliharaan untuk optimasi produktivitas ayam (Adaptasi dari sumber: Graham 2002; Defra 2005).
Peningkatan aliran darah ke kulit diatur oleh beberapa faktor, seperti sel
endotel, sistem saraf, dan humoral (Berghoff et al. 2002). Pada hewan
endotermik, terdapat suatu mekanisme yang dapat mengatur pertukaran panas
yang melibatkan adaptasi sistem sirkulasi melalui vasodilatasi. Sinyal saraf
menyebabkan otot dinding pembuluh darah berelaksasi sehingga lebih banyak
darah mengalir melalui pembuluh darah tersebut (Campbell et al. 2004).
Perubahan mikrovaskular pada jaringan kutaneus adalah upaya tubuh untuk
melepaskan panas melalui penguapan (evaporasi) air (Ophir et al. 2002).
Penguapan air dengan cara evaporasi pada permukaan kulit adalah sesuatu yang
sangat penting dalam upaya pembuangan panas tubuh (Hoffman & Walsberg
1999). Keadaan suhu lingkungan yang panas menyebabkan peningkatan jumlah
evaporasi melalui pernapasan dan permukaan kulit yang pada jenis unggas
penghilangan air melalui pernapasan dan permukaaan kulit mencapai 80-100%
(Wolf & Walsberg 1996).
Pengaruh Cekaman Panas pada Jalur Hipotalamus-Hipofisa-Adrenal
Ayam. Setidaknya ada 3 jenis jaringan yang sangat terpengaruh dan saling
berinteraksi sebagai respons adanya cekaman panas, yaitu hipotalamus, hipofisa,
dan adrenal. Ketiga jenis jaringan tersebut berada dalam satu sistem yang akan
menginduksi aktivasi endokrin, sistem imun, dan sistem saraf pusat. Keterkaitan
ketiga jaringan tersebut pada suatu sistem biasa disebut dengan jalur
hipotalamus-hipofisa-adrenal atau biasa disingkat dengan jalur HPA
(hipothalamus-pituitary-adrenal-axis) (Hillman et al. 2000; Borrel 2001). Keterlibatan berbagai jenis
jaringan tersebut pada hewan yang mengalami cekaman panas merupakan bentuk
homeostasis pengaturan suhu tubuh agar dapat bertahan hidup (Wiernusz &
Teeter 1996). Menurut Downing dan Bryden (2002) berbagai respons cekaman
tersebut adalah bagian normal aktivitas tubuh sebagai strategi terhadap perubahan
keadaan lingkungannya. Telah diketahui bahwa kelenjar adrenal merupakan kunci
utama reaksi hormon akibat cekaman panas. Adanya triger cekaman panas,
sekresi glukokortikoid meningkat dalam darah dan peningkatan ini merupakan
mekanisme endokrin terdepan pada hewan dalam mempertahankan keadaan bila
ada cekaman (Mostl & Palme 2002).
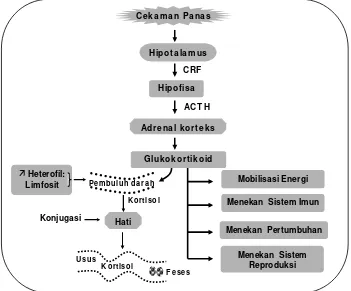
Pada Gambar 3 terlihat suatu rangkaian respons fisiologi tubuh akibat
adanya cekaman. Tahap awal respons tubuh terhadap cekaman adalah
pembentukan CRH (corticotropin releasing hormone = CRH) dan CRH akan
menstimulasi pembentukan ACTH (adrenocorticotropic hormone) pada hipofisa
dan ACTH ini menginduksi pembentukan glukokortikoid pada kelenjar adrenal.
Pelepasan glukokortikoid menimbulkan berbagai efek terhadap metabolisme
normal tubuh, seperti gangguan sistem sekresi hormon, pertahanan (imunitas)
tubuh, pertumbuhan, dan aktivitas reproduksi.
Pada hewan yang mengalami cekaman panas terjadi peningkatan
pelepasan berbagai sitokin dan mediator inflamasi (Kiecolt-Glaser et al. 2003).
Efek adanya cekaman menimbulkan peningkatan output jalur sistem
hormon-hormon adrenal dan hipofisa) dan berbagai sitokin (Oconnor et al. 2000;
Downing & Bryden 2002). Hewan yang mengalami cekaman (stres) menunjukkan
Mobilisasi Energi
Menekan Sistem Imun
Menekan Pertumbuhan
Menekan Sistem Reproduksi Hipot a la m us
CRF
Hipofisa
ACT H
Adre na l k ort e k s
Gluk ok ort ik oid
Pe m buluh d a ra h
K ortiso l ÊHeterofil:
Limfosit
Ce k a m a n Pa na s
Hati
U sus
Fe se s K ortiso l
Konjugasi
Gambar 3 Jalur aktivasi hipotalamus-hipofisa-adrenal korteks pada keadaan menderita cekaman panas dan dampak utama yang ditimbulkannya serta jalur sekresi, metabolisme dan eskresi hormon kortisol (Adaptasi dari beberapa sumber: Elrom 2000b; Möst dan Palme 2002; Boonstra 2004).
peningkatan pembentukan dan sekresi beberapa jenis sitokin, seperti interleukin 1
(IL-1) dan 6 (IL-6) serta tumor nekrosis faktor (TNF). Peningkatan sekresi sitokin
tersebut menyebabkan teraktivasinya kerja jalur HPA (Turnbull & Rivier 1999).
Menurut Licino dan Wong (1999) sel-sel otak termasuk neuron, mikroglia, sel-sel
endotel, dan sel-sel astrosit dari beberapa hewan mamalia dapat menghasilkan
berbagai sitokin, seperti IL-1, TNF dan IL-6. Interleukin-1β ini merupakan
stimulan poten terhadap pembentukan CRH yang akan mengaktivasi jalur
hipotalamus-hipofisa-adrenal.
Interleukin-1, IL-6, TNF, dan ACTH dapat berkerja langsung pada target
jaringan, seperti otot kerangka, jaringan adiposa, hati, dan tulang. Secara tidak
jenis hormon, seperti hormon pertumbuhan, insulin, glukagon, dan
glukokortikoid. Akibatnya, terjadi peningkatan oksidasi protein, proteolisis otot,
ekskresi nitrogen, dan anabolisme hepatik (Dan & Lall 1998; Downing & Bryden
2002).
Siegel (1995) menyatakan bahwa adanya stimulasi cekaman, baik dari
dalam maupun luar tubuh akan menginduksi suatu seri reaksi kaskade pada sistem
saraf dan endokrin, yang dimulai dengan stimulasi hipotalamus yang
menghasilkan CRH. Selanjutnya CRH menstimulasi hipofisa anterior untuk
melepaskan ACTH, dan berakhir dengan stimulasi jaringan adrenal korteks oleh
ACTH untuk meningkatkan produksi kortikosteroid. Menurut Scanes (2000)
sekresi ACTH terjadi di bawah kontrol beberapa faktor
hipotalamus-hipofisiotropik dan glukokortikoid. Glukokortikoid menghambat pelepasan
ACTH sebagai bentuk umpan balik negatif.
Pada ayam yang mengalami cekaman, hambatan glukokortikoid pada
pelepasan ACTH kelihatannya menjadi tidak efektif. Pada ayam yang menderita
cekaman, baik yang berasal dari dalam ataupun di luar tubuhnya, kadar
glukokortikoid, ACTH dan beberapa hormon lainnya meningkat di dalam serum
(Sapolsky et al. 2000; Borrel 2001; Mashaly et al. 2004).
Dampak Cekaman Panas pada Ayam. Cekaman panas (heat stress)
pada industri unggas telah menjadi salah satu perhatian utama penyebab kerugian
ekonomi karena meningkatnya angka kematian dan menurunnya produktvitas,
terutama selama musim kemarau. Di Amerika, kerugian ekonomi akibat cekaman
panas pada industri peternakan ayam berkisar antara $128 sampai 165 juta
pertahun (St-Pierre et al. 2003). Di Indonesia laporan kerugian ekonomi karena
pengaruh cekaman panas pada industri peternakan, khususnya ternak unggas,
sampai sejauh ini belum ditemukan. Akan tetapi, gambaran nyata di lapangan
tentang kerugian akibat cekaman panas ini diduga relatif besar, mengingat suhu
rata-rata harian di beberapa daerah di Indonesia relatif tinggi, terutama pada
musim kemarau. Selain itu, ayam broiler yang dipelihara di Indonesia umumnya
berasal dari hasil pengembangan genetis di negara-negara beriklim dingin
sehingga kemungkinan kehilangan produksi ayam broiler akibat cekaman panas
Sebagai pembanding dapat dilihat penelitian Soeharsono (1977) yang
melaporkan bahwa pemeliharaan ayam broiler di lokasi bersuhu 32oC
menyebabkan penurunan berat badan mencapai 22%. Kuczynski (2002)
melaporkan bahwa pemeliharaan ayam broiler sampai umur 35 hari pada suhu di
atas 31oC yang menyebabkan penurunan bobot badan mencapai 25%, jika
dibadingkan dengan pemeliharaan pada suhu 21,1-22,2oC.
Selain itu, temperatur lingkungan yang panas menyebabkan penurunan
kecepatan pertumbuhan dan konsumsi pakan serta produktivitas telur, seperti
ukuran dan kekuatan kulit telur (Austic 2000). Menurut Sahin et al. (2001) ayam
yang mendapat cekaman panas mengalami penurunan aktivitas kelenjar tiroid dan
konsentrasi hormon triiodotironin (T3) dan tiroksin (T4) dalam sirkulasi darah.
Hormon T3 dan T4 dihasilkan oleh kelenjar tiroid. Kedua hormon ini memegang
peranan penting dalam mempercepat pertumbuhan dan metabolisme energi.
Kebanyakan organ tubuh dan sistem fisiologis sensitif terhadap kerja
glukokortikoid, seperti jantung, cairan tubuh, sistem imunitas/inflamasi,
metabolisme, fungsi syaraf dan reproduksi (Sapolsky et al. 2000), peningkatan
pembentukan glukosa di dalam tubuh dengan meningkatkan katabolisme protein,
glikogen, dan lipida (Hillman et al. 2000), dan peningkatan sekresi elektrolit,
penurunan berat badan serta asupan makanan (Borges et al. 2004). Menurut
Sapolsky et al. (2000), tingginya kadar glukokortikoid dalam darah akan
meningkatkan filtrasi glomerular melalui peningkatan pengeluaran polipeptida
arterinatriuretik. Hal ini menyebabkan peningkatan ekskresi air. Hillman et al.
(2000) menjelaskan bahwa aktivitas glukokortikoid menggangu pertumbuhan,
melalui stimulasinya pada hipotalamus untuk mensekresikan somatostatin.
Somatostatin menghambat sekresi hormon pertumbuhan dari pituitari anterior.
Pemberian cekaman panas dengan temperatur 33 ± 1°C selama 21 hari dengan lama waktu pemberian 6 jam/hari pada ayam broiler menimbulkan
beberapa kelainan pada organ jantung, paru, hati, dan ginjal, baik secara
makroskopis maupun mikroskopis (Aengwanich & Simaraks 2004). Ayam yang
terpapar dengan cekaman panas menyebabkan kerugian bagi peternak karena
banyak terbuang energi secara percuma, terjadinya pernurunan konversi pakan,
produksi telur, keterlambatan dewasa, penurunan daya tetas telur, penurunan
Wiernusz dan Teeter (1996) pengurangan asupan pakan dimaksudkan tidak hanya
mengurangi pembentukan panas, tetapi juga untuk meningkatkan efisiensi
respirasi. Menurut Austic (2000) suhu panas merupakan stimulus negatif terhadap
konsumsi pakan.
Cekaman panas tidak hanya berpengaruh pada performans, tetapi juga
menghambat fungsi sel-sel imun. Hormon-hormon stres dapat menyebabkan
gangguan proliferasi sel-sel imun, mengganggu produksi berbagai sitokin yang
diperlukan untuk respons imun dan mengurangi fungsi-fungsi effektor sel-sel
makrofag, natural killer (NK), dan limfosit (Mashaly et al. 2004). Cekaman panas
menyebabkan pelepasan hormon glukokortikoid dan katekolamin. Terlihat bahwa
banyak reseptor sel-sel imun dapat berikatan dengan glukokortikoid. Hal ini akan
menggangu fungsi beberapa jenis sel-sel imun dan berakibat pada pengaturan
aktivitas produksi sitokin yang bertanggung jawab atas pembentukan sel-sel imun
(Padgett & Glaser 2003).
Indikator Adanya Cekaman Panas pada Ayam. Cekaman panas
menimbulkan berbagai perubahan, baik yang dapat dilihat atau dirasa secara
langsung, seperti tingkah laku dan kenaikan suhu, maupun yang tidak terlihat
langsung, seperti perubahan metabolisme tubuh. Adanya perubahan-perubahan
yang dapat diamati tersebut dapat dijadikan sebagai indikator atau petunjuk bahwa
seekor atau sekelompok ayam sedang menderita karena cekaman panas. Indikator
yang paling mudah diamati pada ayam broiler yang mengalami cekaman panas
adalah adanya kegelisahan yang disertai dengan kenaikan suhu tubuh dan
pernapasan yang cepat dan dangkal (panting) (Hillman et al. 2000; Downing &
Bryden 2002).
Adanya perubahan berupa ganggguan sekresi beberapa jenis hormon dan
efek fisiologisnya pada sistem imun menyebabkan pengukuran hormon dan sel-sel
pertahanan tubuh tertentu dapat dijadikan sebagai petunjuk adanya cekaman.
Pengukuran kadar kortisol dan perbandingan heterofil dan limfosit pada hewan
jenis unggas merupakan indikator yang selalu digunakan sebagai petunjuk hewan
menderita cekaman panas (Siegel 1995; Altan et al. 2000; Scope et al 2001;
Dehnhard et al. 2003; Boonstra 2004; Smith 2004). Untuk mendapatkan
salah satu indikator stres dianggap kurang tepat karena pada masing-masing
indikator tersebut terdapat beberapa kelebihan dan kekurangan (Mostl & Palme
2002).
Adanya reaksi kaskade akibat cekaman panas menstimulasi kelenjar
adrenal korteks mensekresikan hormon glukokortikoid sehingga kadarnya
meningkat dalam peredaran darah. Peningkatan kadar glukokortikoid ini dapat
digunakan sebagai indikator cekaman panas (Mostl & Palme 2002). Pada hewan
mamalia, yang termasuk hormon glukokortikoid adalah kortisol dan kortikosteron
(Jauregui et al. 2005). Kedua hormon glukokortikoid ini dibentuk dari prekursor
yang sama, yaitu kolesterol dengan jumlah atom karbon (C) 27. Pada sel zona
fasikulata adrenal korteks, kolesterol mengalami perubahan oksidasi dan reduksi
sehingga terbentuk kortikosteron dan kortisol (Scanes 2000). Pembentukan
hormon kortikosteron dan kortisol dari prazat kolesterol dapat dilihat pada
Gambar 4. Kortikosteron dan kortisol merupakan golongan sterol yang memiliki
atom C-21 dan struktur dasarnya adalah siklopentanoperhidropenantren.
Puvadolpirod dan Thaxton (2000) melaporkan bahwa peningkatan
kortison dalam plasma terjadi setelah 2 jam pemberian ACTH, sedangkan
peningkatan rasio antara heterofil dan limfosit terjadi setelah 2 hari pemberian
ACTH. Pengukuran kortikosteron dan kortisol merupakan indikator stress yang
sangat sensitif pada hewan mamalia (Siegel 1995; Altan et al. 2000; Scope et al
2001; Smith 2004).
Cekaman panas yang terjadi secara kronis dapat menimbulkan dampak
buruk pada pembentukan sel-sel pertahanan tubuh (sistem imunitas) ayam (Borrel
2001; Khajavi et al. 2003; Mashaly et al. 2004). Hal ini terkait dengan efek kronis
pelepasan hormon glukokortikoid. Keberadaan reseptor glukokortikoid pada
berbagai sel-sel pembentuk sel imun akan mengganggu fungsi nukleus faktor-
kaffa B (NF-κB) yang mengatur gen pengaturan produksi sel-sel imun.
Glukokortikoid menghambat proliferasi sel limfosit dan pembentukan beberapa
jenis sitokin dan reseptornya, seperti IL-1 dan IL-2 serta juga menstimulasi
sintesis molekul penghalang seperti lipokortin-1 dan reseptor IL-1 tipe II.
Aktivitas glukokortikoid ini akhirnya dapat mengganggu fungsi dan produksi
sel-sel imun, seperti sel-sel limfosit (Dan & Lall 1998; Gupta & Lalchhandama 2002;
+ 3-ket o
+ 11-OH PROGEST ERON
+ 21-OH
K ORT I K OSTERON
ALDOSTERON (C21) + 18-ALDEH I D
+ 21-OH + 3-ket o
+ 11-OH + 17-OH
K ORTI SOL (C21) 17-OH PROGESTERON 17-OH PREGN EN OLON KOLESTEROL (C27)
+ 1 7 -OH
ADREN AL K ORT EK S
Gambar 4 Skema metabolisme kortisol dengan prazat kolesterol pada jaringan adrenal korteks.
Cekaman menyebabkan terjadinya leukositosis. Hal ini disebabkan oleh
peningkatan jumlah neutrofil (neutrofilia). Neutrofilia ini terjadi akibat adanya
induksi glukokortikoid pada jalur pembentukan dan pelepasan neutrofil cadangan
pada sumsum tulang (Blecha 2000). Pada jenis unggas, heterofil digunakan untuk
menggantikan sebutan neutrofil pada mamalia (Harmon 1998).
Aplikasi Penanganan Cekaman Panas pada Ayam Broiler.
Upaya-upaya penanganan cekaman panas ditujukan agar pertumbuhan ayam broiler dapat
optimal sesuai potensi genetik yang dimilikinya. Berbagai upaya telah dilakukan
untuk mengurangi dampak negatif cekaman panas, baik dari aspek eksternal
maupun internal tubuh ayam. Penanganan aspek eksternal yang paling mudah
dilakukan adalah dengan pemasangan instalasi penyejuk dan kipas angin disertai
dengan disain dan pemasangan insulator kandang (Defra 2005). Namun
upaya-upaya ini terlihat masih sulit diterapkan karena relatif mahal, terutama pada usaha
peternakan ayam skala kecil. Pengelolaan aspek internal tubuh ayam telah
menjadi perhatian banyak peneliti, seperti pengaturan pakan berupa pemberikan
suplemen mikronutrient (vitamin dan mineral) (Sahin et al. 2001; Sands & Smith
(Zulkifli et al. 2003; Abu-Dieyeh 2006; Lin et al. 2006), dan peningkatan
kemampuan termotoleransi ayam (De Basilio et al. 2003; Yahav et al. 2004).
Pemberian probiotik terlihat efektif untuk mengurangi dampak cekaman panas
(Lan et al. 2004) dan akan lebih efektif bila ditambah dengan antibiotik. Hal ini
terkait dengan efek probiotik dan antibiotik pada perbaikan struktur vili usus
(Sandikci et al. 2004). Pada dasawarsa terakhir ini juga telah dilakukan seleksi
ayam-ayam pedaging yang memiliki bulu penutup tubuh yang relatif sedikit
(Mazzi et al. 2002).
Pemberian vitamin C telah banyak dibuktikan dapat mengurangi dampak
cekaman panas pada ayam. Hal ini terkait dengan berkurangnya pembentukan
vitamin C akibat gangguan pada organ tubuh penghasil vitamin tersebut sehingga
untuk memenuhi kebutuhannya perlu disuplai dari luar. Pemberian vitamin C 800
mg/kg pakan dapat meningkatkan imunitas humoral pada ayam broiler yang diberi
cekaman panas kronis (Aengwanich et al. 2003). Pemberian suplemen vitamin E
dikombinasi dengan vitamin A (dosis 250 mg α-tokoferol asetat dan 15.000 IU
retinol/kg pakan) terbukti dapat mengurangi efek cekaman panas pada penurunan
performans pada ayam broiler (Sahin et al. 2001). Efek vitamin E yang
melindungi ayam yang menderita cekaman panas terkait dengan kemampuannya
sebagai antioksidan. Pada ayam yang mengalami cekaman panas, terjadi
peningkatan redikal bebas (Puthpongsiriporn et al. 2001). Ayam yang terpapar
dengan cekaman panas mengalami peningkatan sekresi elektrolit, oleh sebab itu
pemberian elektrolit diperlukan untuk pengganti kehilangan elektrolit tersebut
(Borges et al. 2004).
Pemberian asetil salisilat (aspirin) telah dilaporkan juga dapat
memperbaiki keadaan fertilisasi pada ayam jantan yang mengalami cekaman
panas (McDaniel & Parker 2004). Akan tetapi, hasil penelitian Balog et al.(2000)
menunjukkan bahwa pemberian aspirin pada ayam broiler yang dipelihara di
daerah tinggi (hipobarik) tidak mampu mengurangi dampak cekaman sedangkan
Naseem et al. (2005) melaporkan bahwa pemberian aspirin dikombinasi dengan
vitamin C dapat memperbaiki performans ayam.
Penggunaan bahan asal tanaman obat sebagai antistres untuk mengurangi
stres karena cekaman panas pada ayam belum begitu banyak menjadi perhatian
penelitian terkait penggunaan tanaman obat untuk mengurangi dampak cekaman
panas pada ayam. Dari beberapa laporan yang ditemukan diketahui bahwa
pemberian beberapa ekstrak tanaman dapat memperbaiki performans ayam yang
turun akibat cekaman panas (Roy et al. 1996; Dhal et al. 1997; Kusnadi 2004;
Narayanswamy et al. 2004; Setiaji & Sudarman 2005). Pemberian ramuan herbal
asal india (Zeetress) 1 g/100 ekor selama 7 dan 10 hari pada ayam petelur pada
musim kemarau dapat meningkatkan berat telur, tetapi tidak berpengaruh pada
nilai konversi pakan (Roy et al. 1996). Pengaruh zeestress pada ayam broiler
sampai umur 6 minggu dapat mengurangi kehilangan berat badan sampai 15%
(Dhal et al. 1997). Kombinasi beberapa jenis herbal asal per gunungan Himalaya
(Geriforte) pada ayam broiler pada musim kemarau dapat memperbaiki efisiensi
pakan, mempercepat pertumbuhan dan mengurangi kematian (Narayanswamy et
al. 2004). Menurut Setiaji dan Sudarman (2005) ekstrak daun beluntas (Pluchea
indica Less) dapat mengurangi dampak stres yang disebabkan kepadatan kandang
pada ayam broiler. Kusnadi et al. (2006) melaporkan bahwa pemberian antanan
(Centellas asiatica) sebanyak 5% dalam ransum dan vitamin C cenderung paling
efektif digunakan dalam mengatasi cekaman panas ayam broiler.
Enzim Nitrat Oksida Sintase dan Nitrat Oksida
Penentuan peran nitrat oksida diawali dengan ditemukannya suatu faktor
yang disebut endothelium derived relaxing factor (EDRF). Faktor EDRF ini
mempunyai peran sangat penting dalam perangsangan relaksasi pembuluh darah
(vasodilatasi) dan kini diketahui bahwa faktor EDRF tersebut adalah nitrat oksida
(NO) (Thatcher & Weldon 1998). Nitrat oksida memiliki waktu paruh yang
pendek secara in vivo (1-5 detik) dan molekulnya memiliki 1 elektron yang tidak
berpasangan. Hal ini membuat NO sangat reaktif dengan molekul-molekul lainnya
seperti oksigen, radikal-radikal superoksida, dan logam-logam transisi. Bentuk
bioaktif NO adalah sebagai nitroksil (NO¯) atau nitrosonium (NO+). Bentuk
kedua jenis senyawa ini mempunyai waktu paruh singkat (1 detik) tetapi stabil
bila berada dalam kompleks biologi seperti tiol (RS¯... +NO), nitrat (O2N¯... +NO)
dan target-target intermediet lainnya (Ricciardolo et al. 2003).
Nitrat oksida disintesis dari asam amino arginin oleh enzim nitrat oksida
dihasilkan dari gen, lokasi, dan regulasi yang berbeda telah diisolasi dan
diindentifikasi. Penulisan ketiga isoform ini menurut tata nama umum sebagai
nNOS (dikenal sebagai Tipe I, NOS-I/1) yang merupakan isoform pertama dan
banyak ditemukan di dalam jaringan neuronal; iNOS (dikenal sebagai Tipe II,
NOS-II/2) jenis isoform NOS yang banyak ditemukan pada sel makrofag dan
dalam cakupan luas pada sel-sel lainnya di dalam tubuh; dan eNOS (juga dikenal
sebagai Tipe III, NOS-III/3) merupakan isoform yang ditemukan di dalam
jaringan endotel sel vaskuler (Alderton et al. 2001). Enzim NOS tipe I dan III
diaktivasi oleh peningkatan ion kalsium (Ca2+)/calmodulin (CaM) atau
(Ca2+/CaM)-dependent, sedangkan isoform iNOS tidak bergantung pada
Ca2+/CaM atau (Ca2+/CaM)-independent (Katsuyama et al. 1998; Ganster et al.
2001; Ricciardolo et al 2003; Peng et al. 2005).
Peran Nitrat Oksida pada Proses Evaporasi. Nitrat oksida bertanggung
jawab atas pengaturan suhu tubuh (termoregulator) normal (Gerstberger 1999).
Pada pengaturan suhu tersebut, NO berfungsi sebagai mediator termoregulasi
melalui vasodilatasi pembuluh darah. NO merupakan bahan vasoaktif utama yang
disintesis oleh berbagai sel sebagai vasodilator (Taylor & Bishop 1993; Thatcher
& Weldon 1998). Pada hewan endotermik, pengaturan pertukaran panas yang
melibatkan adaptasi sistem sirkulasi melalui vasodilatasi menjadi sangat penting
terutama pada jaringan paru dan kulit (Ophir et al. 2002; Campbell et al. 2004).
Evaporasi pada paru dan juga permukaan kulit adalah sesuatu yang sangat penting
dalam upaya pembuangan panas tubuh (Hoffman & Walsberg 1999). Pada jenis
unggas yang menderita cekaman panas dapat menyebabkan peningkatan jumlah
evaporasi melalui saluran pernapasan dan kulit sehingga mencapai 40 sampai 75%
dari total kehilangan air tubuh.
Kadar Ca2+ sitosol pada sel-sel otot polos menjadi sangat penting dalam
merespons untuk meningkatkan permiabilitas dinding sel (Lum & Malik 1996).
Nitrat oksida berdifusi ke dalam sel otot polos dan menginduksi pembentukan
siklik guanosin monofosfat (cGMP). Siklik guanosin monofosfat mengaktivasi
protein kinase G (PKC) dan menyebabkan berkurangnya jumlah ion Ca2+ di dalam
sel-sel otot polos pembuluh darah, dan hal ini menyebabkan sel mengalami