STUDI PENGARUH PENCUCIAN DAN PERENDAMAN TERHADAP PENURUNAN KADAR FORMALIN PADA MI TIAW SECARA
SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
OLEH:
PEBRIANA MEGA SARI NIM 081524014
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
STUDI PENGARUH PENCUCIAN DAN PERENDAMAN TERHADAP PENURUNAN KADAR FORMALIN PADA MI TIAW SECARA
SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
PEBRIANA MEGA SARI NIM 081524014
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Lembar Pengesahan Skripsi
STUDI PENGARUH PENCUCIAN DAN PERENDAMAN TERHADAP PENURUNAN KADAR FORMALIN PADA MI TIAW SECARA
SPEKTROFOTOMETRI SINAR TAMPAK OLEH:
PEBRIANA MEGA SARI NIM 081524014
Dipertahankan dihadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal:
Disetujui oleh:
Pembimbing I, Panitia penguji,
Dra. Masfria, M.S., Apt. Prof.Dr.Siti Morin Sinaga, M.Sc.,Apt. NIP 195707231986012001 NIP 195008281976032002
Dra. Masfria, M.S., Apt. Pembimbing II, NIP 195707231986012001
Drs. Fathur Rahman Harun, M.Si., Apt. Dra. Tuty Roida Pardede, M.Si., Apt. NIP 195201041980031002 NIP 195008221974121002
Drs.Maralaut Batubara, M.Phill, Apt.
NIP 195101311976031003
Disahkan oleh: Dekan,
KATA PENGANTAR
Puii dan syukur penulis haturkan atas kehadirat Allah SWT yang telah melimpahkan rahmat, hidayah dan kemudahan kepada penulis sehingga dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Studi Pengaruh Pencucian dan Perendaman Terhadap Penurunan Kadar Formalin pada Mi Tiaw Secara Spektrofotometri Sinar Tampak” sebagai salah satu syarat untuk mencapai gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Penulis mempersembahkan rasa terima kasih yang tak terhingga kepada Ayahanda Hermanto dan Ibunda Chairiah yang telah memberikan semangat dan cinta yang teramat tulus, dukungan moril maupun materi. Pada kesempatan ini, penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Dra. Masfria, M.S., Apt. dan Drs. Fathur Rahman Harun , M.Si., Apt. selaku pembimbing yang telah memberikan waktu, bimbingan dan nasehat selama penelitian hingga selesainya penyusunan skripsi ini.
2. Bapak Dekan dan Bapak/Ibu Pembantu Dekan, Bapak dan Ibu staf pengajar Fakultas Farmasi USU yang telah mendidik penulis selama masa perkuliahan dan Bapak Ginda Haro, selaku penasehat akademik yang telah memberikan arahan dan bimbingan kepada penulis selama ini.
4. Bapak dan Ibu staf Laboratorium Kimia Farmasi Kualitatif yang telah memberikan arahan dan fasilitas selama penulis melakukan penelitian.
5. Sahabat-sahabat penulis : Mimi Maulidina, Putri Pratiwi, Eva Suryanti, Muharni Saputri, dan rekan-rekan mahasiswa Farmasi khususnya stambuk 2008 atas dukungan, semangat, bantuan dan persahabatan yang indah selama ini serta seluruh pihak yang telah, memberikan kasih sayang, bantuan, motivasi dan inspirasi bagi penulis selama masa perkuliahan sampai penyusunan skripsi ini.
Semoga Allah SWT memberikan balasan yang berlipat ganda dan pahala yang sebesar-besarnya kepada semua pihak yang telah membantu penyelesaian skripsi ini.
Penulis mengharapkan kritik dan saran yang membangun dari semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Januari 2011 Penulis,
STUDI PENGARUH PENCUCIAN DAN PERENDAMAN TERHADAP PENURUNAN KADAR FORMALIN PADA MI TIAW SECARA
SPEKTROFOTOMETRI SINAR TAMPAK ABSTRAK
Mi basah seperti mi tiaw merupakan jenis makanan yang tidak dapat tahan lama. Penggunaan formalin sebagai pengawet mayat telah disalah gunakan oleh sebagian produsen mi tiaw sebagai pengawet makanan. Pengawet formalin menurut Menteri Kesehatan RI No.1168/MENKES/PER/X/1999 dilarang digunakan sebagai bahan tambahan makanan. Penelitian ini bertujuan untuk mengidentifikasi kandungan formalin pada mi tiaw serta melihat pengaruh pencucian dengan air mengalir dan perendaman dengan air biasa dan air mendidih terhadap penurunan kadar formalin pada mi tiaw yang diperoleh dari pasar tradisional dan supermarket.
Formalin diidentifikasi dengan menggunakan pereaksi asam kromatropat, sampel dinyatakan positif apabila memberikan warna violet. Penetapan kadar dilakukan secara spektofotometri sinar tampak berdasarkan terbentuknya kompleks formalin dengan pereaksi Nash yang menghasilkan larutan berwarna kuning, kemudian serapannya diukur pada panjang gelombang maksimum 412nm.
Hasil identifikasi menunjukkan bahwa semua sampel yang dianalisis mengandung formalin. Proses pencucian dengan air mengalir dan perendaman dengan air biasa maupun air mendidih dapat menurunkan kadar formalin pada sampel, dimana pengaruh perendaman dalam air mendidih terhadap penurunan kadar formalin lebih tinggi dibandingkan dengan perendaman dalam air biasa dan pencucian dengan air mengalir. Hasil penurunan kadar formalin dalam mi tiaw yang diperoleh di pasar tradisional dengan perendaman dalam air mendidih yaitu 57,78 %, perendaman dalam air biasa 38,83%, dan pencucian dengan air mengalir 8,52%. Sedangkan hasil penurunan kadar formalin dalam mi tiaw yang diperoleh dari supermarket dengan perendaman dalam air mendidih yaitu 63,77%, perendaman dalam air biasa 42,66% dan pencucian dengan air mengalir 8,89%. Hasil rata-rata persen perolehan kembali (%recovery) pada penelitian ini yaitu 92,59% dengan standar deviasi (SD) 0,0714%. Sedangkan hasil uji presisi dengan nilai Relatif Standar Deviasi (RSD) yang diperoleh yaitu 1,1675%. Dari hasil yang diperoleh menunjukkan bahwa metode yang dilakukan memiliki akurasi dan presisi yang baik. Batas deteksi dan kuantitasi yang diperoleh yaitu 0,0639 mcg/ml dan 0,2130 mcg/ml.
THE STUDY ON INFLUENCE OF WASHERY AND SOAKING TO THE REDUCE OF FORMALINE CONTENT IN TIAW NOODLE BY VISIBLE
BEAM SPECTROPHOTOMETRY ABSTRACT
The fresh noodle such as tiaw noodle is one of perishable food. The using of formaline as corpse preservative is abused by producer of tiaw noodle as the food preservative. Formaline according to Decree of Health Minister of RI No.168/MENKES/PER/X/1999 is prohibited for use as food additive. This research aims to identify the content of formaline in tiaw noodle and to see the influence of the washery by the flow water and soaking by the fresh water and boilingwater to the reduce of formaline content in tiaw noodle that bought from traditional marketand Supermarket.
Formaline is identified by chromatropic acid reagent, in which the sample is positive if produce the violet color. The content of formaline is determined by visible beam spectrofotometry based on the formation of formaline complex by Nash reagent that produce the yellow solution and its absorbance is measured on the maximum wagelength not more than 412 nm.
The results of identification indicates that all of the analyzed sample contain formaline. The washery process by flow water and the soaking by the fresh water and boiling water can reduce the formaline content in sample in which influence of soaking with boiling water to the reduce of formaline content is higher than soaking with fresh water and the washery by flow water. The reduce of formaline content in tiaw noodle from the traditional market by the soaking into the boiling water is 57,78 %, the soaking into the fresh water is 38,83% and the washery by the flow water is 8,52%. While the reduce of formaline content in tiaw noodle from supermarket by the soaking into the boiling water is 63,77%, soaking in the fresh water is 42,66% and washery by the flow water is 8,89%. The average percentage recovery (%recovery) in this research is 92,59% by the standard deviation (SD) 0,0714%. While the results of precision test by score of Relative Standard Deviation (RSD) is 1,1675%. Based on results indicates that the applied method has a good accuracy and precision. Limit of detection and limit of quantitation is 0,0639 mcg/ml and 0,2130 mcg/ml
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iii
ABSTRAK ... iv
ABSTRACT ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
BAB II TINJAUN PUSTAKA ... 5
2.1 Mi Basah ... 5
2.1.1 Fungsi Mi Basah ... 5
2.1.2 Pengawetan Mi Basah ... 5
2.2 Zat Pengawet ... 7
2.3 Formalin ... 7
2.3.1 Rumus Bangun ... 8
2.3.2 Sifat Fisika dan Kimia ... 8
2.3.3 Penggunaan Formalin ... 8
2.3.4 Bahaya Penggunaan Formalin Pada Makanan ... 9
2.3.5 Pemeriksaan Kualitatif Formalin ... 9
2.4 Pemeriksaan Kuantitatif Formalin dengan Metode Spektrofotometri ... 10
2.4.1 Spektrofotometri ... 10
2.5.2 Ketelitian (Presisi) ... 14
2.5.3 Batas Deteksi (LOD) ... 15
2.5.4 Batas Kuantitsi (LOQ) ... 15
BAB III METODOLOGI PENELITIAN... 17
3.1 Alat-alat ... 17
3.2 Bahan-bahan ... 17
3.3 Sampel ... 17
3.4 Pembuatan Pereaksi ... 18
3.4.1 Larutan Asam Kromatropat 0,05% (b/v) ... 18
3.4.2 Asam Fosfat 10% (v/v) ... 18
3.4.3 Pereaksi Nash ... 18
3.4.4 Natrium Hidroksida 1 N ... 18
3.4.5 Asam Klorida 1 N ... 18
3.4.6 Larutan Fenolftalein 0,2 % (b/v) ... 19
3.4.7 Larutan Merah Metil 0,1% (b/v) ... 19
3.4.8 Hidrogen Peroksida 6% (v/v) ... 19
3.5 Prosedur Penelitian ... 19
3.5.1 Pembakuan Natrium Hidroksida 1 N ... 19
3.5.2 Pembakuan Asam Klorida 1 N ... 19
3.5.3 Penetapan Kadar Formalin Baku Pembanding ... 20
3.5.4 Pemeriksaan Kualitatif Formalin pada Sampel ... 20
3.5.5 Penetapan Kadar Formalin ... 21
3.5.5.1 Pembuatan Larutan Induk Baku I (LIB I) ... 21
3.5.5.2 Pembuatan Larutan Induk Baku II (LIB II) ... 21
3.5.5.3 Penentuan Panjang Gelombang Maksimum Larutan Formalin ... 21
3.5.5.4 Penentuan Waktu Kerja Larutan Formalin ... 22
3.5.5.5 Penentuan Linieritas Kurva Kalibrasi Larutan Formalin ... 22
3.5.6 Penentuan Kadar Formalin pada Sampel ... 22
3.5.6.1 Pencucian Mie Tiaw dengan Air Mengalir ... 22
3.5.6.2 Perendaman Mie Tiaw dengan Air Biasa ... 23
3.5.6.4 Destilasi Formalin dalam Sampel Mie Tiaw
Sebelum Dicuci dan Direndam ... 23
3.5.6.5 Destilasi Formalin dalam Sampel Mie Tiaw Setelah Dicuci dengan Air Mengalir ... 24
3.5.6.6 Destilasi Formalin dalam Sampel Mie Tiaw Setelah Direndam dengan Air Biasa ... 24
3.5.6.7 Destilasi Formalin dalam Sampel Mie Tiaw Setelah Direndam dengan Air Panas ... 24
3.6 Analisa Data secara Statistik ... 24
3.7 Uji Validasi Metode Analisis ... 26
3.7.1 Akurasi ... 26
3.7.2 Presisi ... 26
3.7.3 Penentuan Batas Deteksi dan Batas Kuantitasi ... 27
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1 Penentuan Kadar Formalin secara Titrasi Asam Basa ... 28
4.2 Pemeriksaan Kualitatif Formalin pada Sampel Hasil Destilasi ... 28
4.3 Penetapan Kadar ... 29
4.3.1 Penentuan Panjang Gelombang Maksimum Larutan Formalin ... 29
4.3.2 Penentuan Waktu Kerja Larutan Formalin ... 31
4.3.3 Penentuan Linieritas Kurva Kalibrasi Larutan Formalin ... 31
4.3.4 Kadar Formalin pada Sampel ... 32
4.3.5 Penurunan Kadar Formalin ... 34
4.4 Uji Validasi Metode Analisis ... 35
BAB V KESIMPULAN DAN SARAN ... 37
5.1. Kesimpulan ... 37
5.2. Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR TABEL
Halaman Tabel 1. Hasil Pemeriksaan Kualitatif Formalin pada Sampel Hasil
Destilasi ... 29 Tabel 2. Kadar Formalin pada Sampel .. ... 33 Tabel 3. Persentase Penurunan Kadar Formalin pada Sampel . ... 34 Tabel 4. Data Perolehan Kembali Formalin Baku yang Ditambahkan pada
DAFTAR GAMBAR
Halaman Gambar 1. Diagram Blok Spektrofotometer UV-VIS ... 12 Gambar 2. Kurva Serapan Larutan Formalin Konsentrasi 2 ppm secara
Spektrofotometri Sinar Tampak ... 30 Gambar 3. Kurva Kalibrasi Larutan Formalin pada Panjang Gelombang
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Perhitungan Pembakuan Natrium Hidroksida 1 N ... 28
Lampiran 2. Perhitungan Pembakuan Asam Klorida 1 N ... 29
Lampiran 3. Perhitungan Pembakuan Larutan Formalin secara Titrasi Asam- Basa ... 30
Lampiran 4. Hasil Pemeriksaan Kualitatif Formalin pada Sampel ... 31
Lampiran 5. Perhitungan Pembuatan Larutan Formalin 1000 ppm ... 33
Lampiran 6. Data Panjang Gelombang Maksimum Larutan Formalin ... 34
Lampiran 7. Data Pengukuran Waktu Kerja Larutan Formalin ... 35
Lampiran 8. Data Kurva Kalibrasi Larutan Formalin pada Panjang Gelombang 412 nm ... 37
Lampiran 9. Perhitungan Persamaan Regresi ... 38
Lampiran 10. Contoh Perhitungan Kadar Formalin dalam Sampel ... 39
Lampiran 11. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam Destilat Mie Tiaw di Pasar Tradisional sebelum Dicuci dan Direndam ... 40
Lampiran 12. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam Destilat Mie Tiaw di Pasar Tradisional sesudah Dicuci dengan Air Mengalir ………... 42
Lampiran 13. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam Destilat Mie Tiaw di Pasar Tradisional sesudah Direndam dengan Air Biasa selama 30 menit ………. 44
Lampiran 14. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam Destilat Mie Tiaw di Pasar Tradisional sesudah Direndam dengan Air Panas selama 30 menit ………. 46
Lampiran 15. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam Destilat Mie Tiaw di Carefour sebelum Dicuci dan Direndam ………... 49
Lampiran 16. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam Destilat Mie Tiaw di Carefour sesudah Dicuci dengan Air Mengalir ……….………. 52 Lampiran 17. Analisa Data Statistik untuk Menghitung Kadar Formalin
Lampiran 18. Analisa Data Statistik untuk Menghitung Kadar Formalin dalam Destilat Mie Tiaw di Carefour sesudah Direndam
dengan Air Panas selama 30 menit ………. 56
Lampiran 19. Hasil Orientasi Pengukuran Kadar Sampel dengan Proses Perendaman dalam Air Panas selama 30 menit ……….. 58
Lampiran 20. Hasil Analisa Kadar Formalin dalam Sampel ... 59
Lampiran 21. Contoh Perhitungan Persen Penurunan Kadar Formalin dalam Sampel ... 62
Lampiran 22. Hasil Analisa Persen Penurunan Kadar Formalin dalam Sampel ... 63
Lampiran 23. Data Perolehan Kembali Formalin Baku yang Ditambahkan pada Sampel (Metode Penambahan Baku) ... 64
Lampiran 24. Contoh Perhitungan Persen Perolehan Kembali ... 65
Lampiran 25. Perhitungan Batas Deteksi dan Batas Kuantitasi ... 67
Lampiran 26. Nilai Distribusi t ... 68
Lampiran 27. Foto Sampel ... 69
STUDI PENGARUH PENCUCIAN DAN PERENDAMAN TERHADAP PENURUNAN KADAR FORMALIN PADA MI TIAW SECARA
SPEKTROFOTOMETRI SINAR TAMPAK ABSTRAK
Mi basah seperti mi tiaw merupakan jenis makanan yang tidak dapat tahan lama. Penggunaan formalin sebagai pengawet mayat telah disalah gunakan oleh sebagian produsen mi tiaw sebagai pengawet makanan. Pengawet formalin menurut Menteri Kesehatan RI No.1168/MENKES/PER/X/1999 dilarang digunakan sebagai bahan tambahan makanan. Penelitian ini bertujuan untuk mengidentifikasi kandungan formalin pada mi tiaw serta melihat pengaruh pencucian dengan air mengalir dan perendaman dengan air biasa dan air mendidih terhadap penurunan kadar formalin pada mi tiaw yang diperoleh dari pasar tradisional dan supermarket.
Formalin diidentifikasi dengan menggunakan pereaksi asam kromatropat, sampel dinyatakan positif apabila memberikan warna violet. Penetapan kadar dilakukan secara spektofotometri sinar tampak berdasarkan terbentuknya kompleks formalin dengan pereaksi Nash yang menghasilkan larutan berwarna kuning, kemudian serapannya diukur pada panjang gelombang maksimum 412nm.
Hasil identifikasi menunjukkan bahwa semua sampel yang dianalisis mengandung formalin. Proses pencucian dengan air mengalir dan perendaman dengan air biasa maupun air mendidih dapat menurunkan kadar formalin pada sampel, dimana pengaruh perendaman dalam air mendidih terhadap penurunan kadar formalin lebih tinggi dibandingkan dengan perendaman dalam air biasa dan pencucian dengan air mengalir. Hasil penurunan kadar formalin dalam mi tiaw yang diperoleh di pasar tradisional dengan perendaman dalam air mendidih yaitu 57,78 %, perendaman dalam air biasa 38,83%, dan pencucian dengan air mengalir 8,52%. Sedangkan hasil penurunan kadar formalin dalam mi tiaw yang diperoleh dari supermarket dengan perendaman dalam air mendidih yaitu 63,77%, perendaman dalam air biasa 42,66% dan pencucian dengan air mengalir 8,89%. Hasil rata-rata persen perolehan kembali (%recovery) pada penelitian ini yaitu 92,59% dengan standar deviasi (SD) 0,0714%. Sedangkan hasil uji presisi dengan nilai Relatif Standar Deviasi (RSD) yang diperoleh yaitu 1,1675%. Dari hasil yang diperoleh menunjukkan bahwa metode yang dilakukan memiliki akurasi dan presisi yang baik. Batas deteksi dan kuantitasi yang diperoleh yaitu 0,0639 mcg/ml dan 0,2130 mcg/ml.
THE STUDY ON INFLUENCE OF WASHERY AND SOAKING TO THE REDUCE OF FORMALINE CONTENT IN TIAW NOODLE BY VISIBLE
BEAM SPECTROPHOTOMETRY ABSTRACT
The fresh noodle such as tiaw noodle is one of perishable food. The using of formaline as corpse preservative is abused by producer of tiaw noodle as the food preservative. Formaline according to Decree of Health Minister of RI No.168/MENKES/PER/X/1999 is prohibited for use as food additive. This research aims to identify the content of formaline in tiaw noodle and to see the influence of the washery by the flow water and soaking by the fresh water and boilingwater to the reduce of formaline content in tiaw noodle that bought from traditional marketand Supermarket.
Formaline is identified by chromatropic acid reagent, in which the sample is positive if produce the violet color. The content of formaline is determined by visible beam spectrofotometry based on the formation of formaline complex by Nash reagent that produce the yellow solution and its absorbance is measured on the maximum wagelength not more than 412 nm.
The results of identification indicates that all of the analyzed sample contain formaline. The washery process by flow water and the soaking by the fresh water and boiling water can reduce the formaline content in sample in which influence of soaking with boiling water to the reduce of formaline content is higher than soaking with fresh water and the washery by flow water. The reduce of formaline content in tiaw noodle from the traditional market by the soaking into the boiling water is 57,78 %, the soaking into the fresh water is 38,83% and the washery by the flow water is 8,52%. While the reduce of formaline content in tiaw noodle from supermarket by the soaking into the boiling water is 63,77%, soaking in the fresh water is 42,66% and washery by the flow water is 8,89%. The average percentage recovery (%recovery) in this research is 92,59% by the standard deviation (SD) 0,0714%. While the results of precision test by score of Relative Standard Deviation (RSD) is 1,1675%. Based on results indicates that the applied method has a good accuracy and precision. Limit of detection and limit of quantitation is 0,0639 mcg/ml and 0,2130 mcg/ml
BAB I PENDAHULUAN 1.1Latar Belakang
Menurut catatan sejarah, mi dibuat pertama kali di Cina dan kemudian berkembang dan menyebar ke Negara-negara di Asia tenggara termasuk Indonesia. Secara umum beberapa jenis mi yang dikenal di pasaran yaitu mi basah dan mi kering (Widyaningsih, 2006). Mi basah (fresh noodle atau wet noodle) merupakan salah satu jenis mi yang sudah dikenal luas dan menjadi
makanan yang disukai masyarakat di Indonesia. Alasannya adalah karena sifat mi yang enak dan praktis. Mi basah yang dijual di pasar tradisional dan supermarket terdapat dalam keadaan curah maupun terkemas (Anonim,2007).
Mi basah umumnya memiliki umur simpan yang relatif singkat, yaitu berkisar antara 10-12 jam bila disimpan pada suhu kamar. Sehingga produsen mi sering menambahkan formalin sebagai bahan pengawet agar mi basah bisa bertahan lebih lama. Penggunaan formalin pada mi basah dapat menghasilkan mi yang dapat disimpan hingga 4 hari. Mi berformalin tidak hanya ditemukan di pedagang-pedagang kecil di pasar tradisonal, tetapi juga di supermarket (Astawan, 2009).
Berdasarkan hasil survei yang telah dilakukan oleh peneliti, bahwa mi tiaw yang di jual di pasar tradisional dan supermarket mempunyai tekstur yang mengkilat, lebih berminyak, tidak mudah putus dan beraroma yang menyengat (Yuliarti, 2007). Berdasarkan hal tersebut kemungkinan mi tiaw yang berada di- pasar tradisional dan supermarket mengandung formalin.
Menurut IPCS (International Programme on Chemical Safety), secara umum ambang batas formaldehida yang boleh masuk ke dalam tubuh dalam bentuk makanan untuk orang dewasa adalah 1,5 mg hingga 14 mg per hari (WHO,1980).
Pemeriksaan formalin secara kualitatif dilakukan terhadap sampel yang telah dilakukan proses destilasi dengan menambahkan asam kromatropat dan asam sulfat pekat dengan pemanasan selama 15 menit akan terjadi warna violet (Herlich, 1990).
Penentuan kadar formalin dapat dilakukan dengan beberapa metode, antara lain titrasi volumetrik asam-basa (Ditjen POM, 1979), spektrofotometri sinar tampak menggunakan pereaksi Nash (Herlich, 1990) dan Kromatografi Cair Kinerja Tinggi (Moffat, 1986). Dalam penelitian ini digunakan spektrofotometri sinar tampak karena metode tersebut sederhana dan memiliki tingkat ketelitian yang baik.
1.2Perumusan Masalah
- Apakah mi tiaw yang beredar di pasar tradisional dan supermarket mengandung formalin sebagai pengawet
- Apakah kadar formalin yang terdapat pada mi tiaw berada di atas ambang batas yang masih dapat diterima oleh tubuh
1.3Hipotesis
- Mi tiaw yang beredar di pasar tradisional dan supermarket mengandung formalin sebagai bahan pengawet
- Proses pencucian dan perendaman dengan air dapat menurunkan kadar formalin pada mi tiaw
- Kadar formalin yang terdapat pada mi tiaw berada di atas ambang batas yang masih dapat diterima oleh tubuh
1.4Tujuan Penelitian
- Melakukan identifikasi formalin pada mi tiaw
- Mengetahui penurunan kadar formalin pada mi tiaw setelah dilakukan proses pencucian dan perendaman dengan air
- Mengetahui kadar formalin yang terdapat pada mi tiaw dilihat dari ambang batas yang masih dapat diterima oleh tubuh
1.5Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA 2.1 Mi Basah
Mi merupakan makanan yang digemari oleh masyarakat, karena rasanya yang enak dan praktis. Mi yang beredar di pasaran dikenal beberapa jenis yaitu mi basah dan mi kering. Mi kering merupakan mi yang berbentuk kering dengan kadar air yang rendah sehingga lebih awet dibandingkan dengan mi mentah dan mi basah. Sedangkan mi basah adalah jenis mi yang mengalami proses perebusan, dimana kadar airnya tinggi dapat mencapai 52% sehingga memiliki daya tahan yang singkat. Salah satu jenis mi yang termasuk dalam mi basah adalah mi tiaw (Widyaningsih & Murtini, 2006).
2.1.1 Fungsi Mi Basah
Mi merupakan bahan makanan yang digunakan sebagai sumber karbohidrat pengganti nasi. Mi basah banyak digunakan sebagai bahan baku dalam berbagai masakan, antara lain seperti soto mi, mi kocok, mi ayam, mi bakso, mi goreng maupun bahan cemilan lainnya (Widyaningsih & Murtini,2006). 2.1.2 Pengawetan Mi Basah
Mi basah memiliki daya tahan yang singkat, karena mengandung kadar air yang cukup tinggi. Dimana pada suhu kamar mi basah hanya bertahan selama 10-12 jam, sehingga perlu ditambahkan bahan pengawet untuk meningkatkan daya simpannya (Widyaningsih & Murtini, 2006).
Menurut Widyaningsih & Murtini (2006), proses pengolahan mi basah dapat dilakukan dengan berbagai cara seperti:
1. Pemilihan tepung terigu sebaiknya yang mengandung gluten 8-12%. Gluten adalah protein yang terdapat pada terigu,gluten bersifat elastis sehingga akan mempengaruhi sifat elastisitas dan tekstur mi yang dihasilkan.
2. Soda Abu
Soda abu adalah bahan tambahan yang harus ditambahkan pada proses pembuatan mi. Soda abu merupakan campuran dari garam natrium karbonat dan kalium karbonat (9 : 1). Berfungsi untuk mempercepat pengikatan gluten, meningkatkan kehalusan tekstur dan sifat kenyal dari mi basah.
3. Garam Dapur
Selain untuk memberi rasa, garam dapur ini juga dapat memperkuat tekstur mi serta mengikat air.
4. Sodium Tri Poly Phospat (STPP)
5. Gliserin
Gliserin berfungsi sebagai emulsifier karena kemampuannya untuk mengikat air dan lemak. Sifat gliserin sebagai pengemulsi dapat mempercepat penyerapan air pada tepung dan mengembangkan adonan. Selain itu juga berfungsi agar mi tidak mudah putus. Gliserin yang digunakan sekitar 1%.
6. Carboxy Methyl Cellulose (CMC)
Fungsi CMC adalah sebagai pengembang, Jumlah CMC yang ditambahkan untuk pembuatan mi antara 0,5-1% dari berat tepung terigu. Penggunaan yang berlebihan akan menyebabkan tekstur mi yang terlalu keras.
2.2 Zat Pengawet
Secara garis besar zat pengawet dibedakan menjadi 3 jenis. Pertama, GRAS ( Generally Recognized as Safe) yang umumnya bersifat alami, sehingga aman dan tidak berefek racun sama sekali. Kedua, ADI (Acceptable Daily Intake), yang selalu ditetapkan batas penggunaan hariannya (daily intake) guna melindungi kesehatan konsumen. Ketiga, zat pengawet yang memang tidak layak dikonsumsi karena bukan untuk makanan alias berbahaya seperti formalin (Widyaningsih & Murtini, 2006).
2.3 Formalin
Formalin merupakan larutan formaldehid di dalam air, yang mengandung 37% gas formaldehid dalam air dengan rumus molekul CH2O. Biasanya
Kadar formaldehid tidak kurang dari 34% dan tidak lebih dari 38 % (Moffat,1986).
2.3.1 Rumus Bangun
2.3.2 Sifat Fisika dan Kimia
Formalin merupakan cairan jernih tidak berwarna dengan bau yang menusuk, uap dapat merangsang selaput lendir hidung dan tenggorokan dan mempunyai rasa yang membakar. Bobot tiap milliliter adalah 1,08 gram. Dapat bercampur dengan air dan alkohol, tetapi tidak bercampur dengan kloroform dan eter. Titik didih formalin adalah 96oC (Merck Index, 1976).
2.3.3 Penggunaan Formalin
Formalin merupakan larutan yang digunakan sebagai desinfektan. Selain itu juga digunakan pada industri tekstil untuk mencegah bahan menjadi kusut dan meningkatkan ketahanan bahan tenunan. Dalam bidang farmasi formalin digunakan sebagai obat penyakit kutil karena kemampuan formalin yang dapat merusak protein (Cahyadi, 2009).
2.3.4 Bahaya Penggunaan Formalin Pada Makanan
Besarnya manfaat formalin di bidang industri ternyata disalahgunakan untuk penggunaan pengawetan industri makanan. Biasanya hal ini sering ditemukan dalam industri rumahan karena mereka tidak terdaftar dan tidak terpantau oleh Depkes dan Balai POM. Salah satu bahan makanan yang ditambahkan formalin adalah mi basah (Yuliarti, 2007). Orang yang mengkonsumsi makanan yang berformalin beberapa kali saja belum begitu merasakan akibatnya. Efek dari makanan berformalin ini baru akan terasa beberapa tahun kemudian (Cahyadi, 2009).
Formalin sangat berbahaya jika terakumulasi di dalam tubuh, tidak hanya dikonsumsi melainkan kontak terhadap formalin. Gangguan kesehatan yang terjadi akibat kontak dengan formalin tergantung pada cara masuk zat tersebut dalam tubuh. Kontak dengan formalin dapat menyebabkan luka bakar jika mengenai kulit, iritasi pada saluran pernafasan bila terhirup uapnya dalam konsentrasi yang tinggi, maupun reaksi alergi dan bahaya kanker (Yuliarti, 2007).
Formalin dalam saluran pencernaan dapat menyebabkan rasa sakit disertai radang. Hal ini karena sifatnya yang merupakan iritan kuat. Dapat juga menyebabkan muntah dan diare (Cahyadi, 2009).
2.3.5 Pemeriksaan Kualitatif Formalin
Formalin dengan penambahan asam kromatropat dan asam sulfat pekat dengan pemanasan selama 15 menit akan menimbulkan warna violet (Herlich,1990).
Analisis kuantitatif formalin dilakukan dengan menggunakan spektrofotometri. Metode ini dapat dilakukan dengan penambahan pereaksi Nash (ammonium asetat dan asetil aseton) disertai pemanasan selama 30 menit akan membentuk kompleks berwarna kuning yang mantap, sehingga dapat diukur serapannya pada panjang gelombang maksimum 415 nm (Herlich, 1990).
2.4.1Spektrofotometri
Spektrofotometri adalah pengukuran absorbsi energi cahaya oleh suatu atom atau molekul pada panjang gelombang tertentu (Day, 2002). Sinar ultraviolet mempunyai panjang gelombang antara 200-400 nm, sedangkan sinar tampak mempunyai panjang gelombang 400-750 nm (Rohman, 2007).
Menurut Day (2002) dan Rohman (2007), hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan dan berbanding terbalik dengan transmitan. Hukum tersebut dituliskan dengan rumus:
A = abc = log 1/T Keterangan : A = absorbansi
a = absorbtivitas b = tebal sel (cm) c = konsentrasi
Ada beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometri ultraviolet dan cahaya tampak terutama untuk senyawa yang tidak berwarna yang akan dianalisis yaitu :
Cara yang digunakan adalah dengan merubahnya menjadi senyawa lain atau direaksikan dengan pereaksi tertentu sehingga dapat menyerap sinar UV-Vis.
2. Waktu kerja (operating time)
Tujuannya ialah untuk mengetahui waktu pengukuran yang stabil. Waktu kerja ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan.
3. Pemilihan panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal.
4. Pembuatan kurva kalibrasi
Dilakukan dengan membuat seri larutan baku dalam berbagai konsentrasi kemudian absorbansi tiap konsentrasi diukur lalu dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi.
5. Pembacaan absorbansi sampel
Asorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,6.
Gambar 1. Diagram Blok Spektrofotometer UV-VIS a. Sumber cahaya
Sumber energi radiasi yang biasa untuk daerah ultraviolet dan daerah cahaya tampak adalah sebuah lampu wolfram ataupun lampu tabung discas hidrogen (atau deutrium).
b. Monokromator
Monokromator berfungsi mengubah cahaya polikromatis menjadi cahaya yang monokromatis. Alatnya dapat berupa prisma atau kisi difraksi.
c. Sel
Sel yang digunakan untuk daerah tampak terbuat dari kaca sedang untuk daerah ultraviolet digunakan sel kuarsa atau kaca silika. Sel tampak dan ultraviolet yang khas mempunyai panjang lintasan 1 cm, namun tersedia juga sel dengan ketebalan kurang dari 1 milimeter, sampai 10 cm bahkan lebih
d. Detektor
Peranan detektor adalah memberikan respon terhadap cahaya pada berbagai panjang gelombang. Detektor yang paling sederhana digunakan ialah tabung foto.
e. Recorder
Recorder digunakan sebagai perekam absorbansi yang dihasilkan dari pengukuran.
Validasi metode dilakukan untuk menjamin bahwa metode analisis yang dilakukan akurat, spesifik, reprodusibel dan tahan pada kisaran analit yang akan dianalisis.
Menurut Rohman (2007), suatu metode analisis harus divalidasi ketika: 1. Metode baru dikembangkan
2. Metode yang sudah baku direvisi untuk menyesuaikan perkembangan
3. Penjaminan mutu yang mengindikasikan bahwa metode baku telah berubah seiring dengan berjalannya waktu
4. Metode baku digunakan di laboratorium yang berbeda, dikerjakan oleh analis yang berbeda atau dikerjakan dengan alat yang berbeda
2.5.1Kecermatan (Akurasi)
Akurasi merupakan ketelitian metode analisis atau kedekatan antara nilai terukur dengan nilai yang diterima. Akurasi diukur sebagai banyaknya analit yang diperoleh kembali pada suatu pengukuran (Rohman, 2007).
Kecermatan ditentukan dengan dua cara yaitu metode simulasi (spiked placebo recovery) dan metode penambahan baku (standard addition method).
Dalam metode simulasi, sejumlah analit bahan murni pembanding kimia ditambahkan ke dalam campuran bahan pembawa sediaan farmasi (plasebo) lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan. Metode adisi dapat dilakukan dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa lalu dianalisis lagi dengan metode tersebut (Harmita, 2004).
% Perolehan kembali = A
A F C
C C
*
Keterangan : CF = konsentrasi sampel yang diperoleh setelah penambahan
larutan baku
CA = konsentrasi sampel awal sebelum penambahan baku
C∗A = konsentrasi larutan baku yang ditambahkan
2.5.2 Ketelitian (Presisi)
Presisi merupakan ukuran keterulangan metode analisis dan biasanya diekspresikan sebagai simpangan baku relatif dari sejumlah sampel yang berbeda signifikan secara statistik. Presisi mencakup simpangan baku, simpangan baku relatif (RSD). Untuk senyawa-senyawa aktif dalam jumlah yang banyak nilai RSD antara 1-2% (Rohman, 2007).
Keterangan : X = nilai dari masing-masing pengukuran = rata-rata dari pengukuran
n = frekuensi penetapan n-1 = derajat kebebasan RSD =
Keterangan : RSD = Relative Standard Deviation
SD = Standard Deviation
X = Kadar Rata-rata Formalin dalam Sampel 2.5.3Batas Deteksi (LOD)
Batas deteksi (limit of detection) didefenisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat dideteksi oleh alat, dimana hasil yang
1 )
( 2
− − =
∑
n X X SD
X
diperoleh belum tepat karena tidak memenuhi akurasi dan presisi (Rohman, 2007).
Keterangan : SD = Standard Deviation
LOD = Limit of Detection (Batas Deteksi)
2.6.3 Batas Kuantifikasi (LOQ)
Batas kuantifikasi (limit of quantitation) didefenisikan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan akurasi dan presisi yang dapat diterima pada kondisi operasional metode yang digunakan (Rohman,2007).
Keterangan : SD = Standard Deviation
LOQ = Limit of Quantitation (Batas Kuantitasi) 2
)
( 2
− − =
∑
n Yi Y SD
Slope SB x LOD=3
BAB III
METODOLOGI PENELITIAN
Metode penelitian yang dilakukan adalah metode eksperimental. Penelitian ini dilaksanakan di Laboratorium Kimia Farmasi Kualitatif Fakultas Farmasi Universitas Sumatera Utara dan Balai Riset dan Standarisasi Industi Medan.
3.1 Alat–Alat
Alat-alat yang digunakan dalam penelitian ini adalah satu unit Spektrofotometer UV-Vis (Shimadzu mini 1240), neraca analitis (AND GF-200), termometer, dan alat-alat gelas seperti labu takar, gelas ukur, erlenmeyer, buret, tabung reaksi, beaker glass dan alat destilasi.
3.2 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini berkualitas proanalisis keluaran E-Merck yaitu Formalin 37 %, Asam kromatropat, Asam sulfat 98 %, Ammonium asetat, Asetil aseton, asam asetat glasial, Natrium hidroksida, Asam klorida 37 %, Fenolftalein, Kalium bifthalat, Natrium karbonat anhidrat, Merah metil, Etanol 90 %, Asam Fosfat 85% kecuali Hidrogen peroksida 30 % dan air suling.
Sampel yang digunakan adalah mi tiaw yang diambil di pasar tradisional (pusat pasar medan) dan supermarket (carrefour). Pengambilan sampel secara purposif didasarkan atas pertimbangan bahwa populasi sampel adalah homogen dan sampel yang akan dianalisis dianggap sebagai sampel yang representative (Sudjana, 1996).
3.4 Pembuatan pereaksi
3.4.1 Larutan Asam Kromatropat 0,05 % (b/v)
Dilarutkan 5 mg asam kromatropat dalam 10 ml campuran 9 ml asam sulfat 98% dan 4 ml air ( Ditjen POM, 1979).
3.4.2 Asam Fosfat 10% (v/v)
Diencerkan 11,8 ml asam fosfat 85% dengan air suling hingga 100 ml (Ditjen POM, 1979).
3.4.3 Pereaksi Nash
Dilarutkan 150 g ammonium asetat dengan 3 ml asam asetat , 2 ml asetilaseton dan sedikit air, setelah larut sempurna lalu dicukupkan volumenya hingga 1 liter ( Herlich, 1990).
3.4.4 Natrium Hidroksida 1 N
Dilarutkan 40 g natrium hidroksida dengan air bebas CO2 dalam labu
1000 ml. Setelah larut sempurna dicukupkan volumenya dengan air bebas CO2
sampai garis tanda (Ditjen POM, 1979). 3.4.5 Asam Klorida 1 N
Diencerkan 8,3 ml HCl 37 % dengan air suling hingga 100 ml ( Ditjen POM, 1995).
Dilarutkan 200 mg fenolftalein dalam 60 ml etanol 90 % dan tambahkan air suling hingga 100 ml (Ditjen POM, 1979).
3.4.7 Larutan Merah Metil 0,1 % b/v
Dilarutkan 100 mg merah metil dalam etanol 96 % dalam labu 100 ml (Ditjen POM, 1995).
3.4.8 Hidrogen Peroksida 6 % v/v
Diencerkan 20 ml H2O2 30 % dengan air suling hingga 100 ml (Ditjen
POM, 1979).
3.5 Prosedur Penelitian
3.5.1 Pembakuan Natrium Hidroksida 1 N
Ditimbang seksama 300 mg kalium bifthalat kemudian dilarutkan dalam air bebas CO2 sebanyak 30 ml. Ditambah 2 tetes indikator fenolftalein,
dititrasi dengan NaOH 1 N hingga terjadi warna merah muda mantap (Ditjen POM, 1995). Dilakukan perlakuan yang sama tiga kali dan dihitung normalitas larutan.
1 ml natrium hidroksida 1 N setara dengan 204,2 mg kalium biftalat. 3.5.2 Pembakuan Asam Klorida 1 N
1 ml asam klorida 1 N setara dengan 52,99 mg natrium karbonat anhidrat 3.5.3 Penetapan Kadar Formalin Baku Pembanding
Ditimbang seksama 1,5 gram larutan formalin 37%, ditambahkan pada campuran 12,5 ml hidrogen peroksida 6% dan 25 ml NaOH 1 N, hangatkan diatas penangas air hingga pembuihan berhenti. Dititrasi dengan asam klorida 1 N menggunakan indikator fenolftalein. Dilakukan titrasi blanko (Ditjen POM, 1979). Dilakukan perlakuan yang sama tiga kali dan dihitung normalitas larutan.
1 ml natrium hidroksida 1 N setara dengan 30,03 mg formalin 3.5.4 Pemeriksaan Kualitatif formalin pada sampel
Sampel Mi Tiaw yang telah dihaluskan ditimbang sebanyak 100 g, kemudian dimasukkan ke dalam labu destilasi 500 ml, ditambahkan 100 ml air dan 5 ml asam fosfat 10%, lalu dikocok. Labu destilasi dihubungkan dengan pendingin yang dipakai untuk destilasi. Kemudian didestilasi perlahan-lahan dan destilat ditampung dalam gelas ukur. Sebanyak 1 ml destilat dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 5 ml larutan asam kromatropat 0,05%. Larutan kemudian dipanaskan di atas penangas air selama 15 menit. Diamati selama pemanasan, jika terbentuk warna violet menunjukkan adanya formalin (Herlich, 1990).
3.5.5 Penetapan Kadar Formalin
3.5.5.1 Pembuatan Larutan Induk Baku I (LIB I)
hingga homogen. Kemudian larutan dicukupkan dengan air suling hingga garis tanda dan dihomogenkan ( Konsentrasi 1000 ppm).
3.5.5.2 Pembuatan Larutan Induk Baku II (LIB II)
Dipipet 10 ml larutan induk baku I lalu dimasukkan ke dalam labu tentukur 250 ml. Ditambahkan air suling secukupnya dan dikocok hingga homogen. Kemudian larutan dicukupkan dengan air suling hingga garis tanda dan dihomogenkan ( konsentrasi 40 ppm).
3.5.5.3 Penentuan Panjang Gelombang Maksimum Larutan Formalin
Dipipet 5 ml larutan induk baku II dan dimasukkan ke dalam labu tentukur 100 ml ( konsentrasi 2 ppm), lalu ditambahkan 10 ml Pereaksi Nash dan dikocok hingga homogen. Selanjutnya ditambahkan air suling hingga garis tanda lalu larutan dihomogenkan. Larutan kemudian dipanaskan di dalam penangas air pada suhu 37˚C ±1˚C selama 30 menit hingga terbentuk warna kuning yang mantap. Diukur serapan maksimum pada panjang gelombang 360-460 nm dengan menggunakan blanko yaitu air suling yang dimasukkan ke dalam labu tentukur 100 ml, lalu ditambahkan 10 ml pereaksi Nash dan dicukupkan dengan air suling hingga garis tanda (Herlich, 1990).
3.5.5.4 Penentuan Waktu Kerja Larutan Formalin
3.5.5.5 Penentuan Linieritas Kurva Kalibrasi Larutan Formalin
Dipipet larutan Induk Baku II (LIB II) ke dalam labu tentukur 100 ml berturut-turut 2,5 ml; 3,7 ml; 5,0 ml; 6,2 ml; dan 7,5 ml (1,0; 1,5; 2,0; 2,5 dan 3 ppm). Ke dalam masing-masing labu tentukur tersebut ditambahkan 10 ml pereaksi Nash, kocok hingga homogen lalu ditambahkan air suling hingga garis tanda dan dihomogenkan. Kemudian masing-masing larutan ini dipanaskan di dalam penangas air pada suhu 37˚C ±1˚C selama 30 menit hingga terbentuk warna kuning yang mantap. Kemudian diukur serapannya pada panjang gelombang maksimum yang diperoleh, serta menggunakan larutan blanko (Herlich, 1990). 3.5.6 Penentuan Kadar Formalin Pada Sampel
3.5.6.1 Pencucian Mi Tiaw dengan Air Mengalir
Sampel mi tiaw sebanyak 600 g dicuci dengan air mengalir hingga bersih, kemudian sampel yang telah dicuci dilakukan destilasi.
3.5.6.2 Perendaman Mi Tiaw dengan Air Biasa
Sampel mi tiaw sebanyak 600 g direndam dalam 600 ml air biasa selama 30 menit, kemudian ditiriskan, kemudian sampel yang telah direndam dilakukan destilasi.
3.5.6.3 Perendaman Mi Tiaw dengan Air Mendidih (100oC)
Sampel mi tiaw sebanyak 600 g direndam dalam 600 ml air mendidih selama 30 menit, kemudian ditiriskan, kemudian sampel yang telah direndam dilakukan destilasi.
Sampel mi tiaw dihaluskan, kemudian ditimbang sebanyak 100 g, lalu dimasukkan ke dalam labu destilasi 500 ml. Ke dalam labu destilasi ditambahkan 100 ml air dan 5 ml asam fosfat 10%, lalu dikocok. Labu destilasi dihubungkan dengan pendingin yang dipakai untuk destilasi. Sampel didestilasi perlahan-lahan dan destilat ditampung dalam gelas ukur. Dalam hal ini destilat yang diperoleh sebanyak 80 ml (BPOM, 2007). Pada destilat dilakukan pengujian kadar formalin. Dipipet 10 ml destilat, dimasukkan ke dalam labu tentukur 50 ml. Selanjutnya ke dalam larutan tersebut ditambahkan 10 ml pereaksi Nash. Lalu dicukupkan dengan air suling hingga garis tanda dan dikocok hingga homogen. Larutan dipanaskan di atas penangas air pada suhu 37 ± 1oC selama 30 menit hingga terbentuk warna kuning yang mantap. Kemudian diukur serapannya pada panjang gelombang 412 nm. Perlakuan ini diulangi sebanyak 6 kali.
3.5.6.5 Destilasi Formalin dalam Sampel Mi Tiaw Setelah Dicuci dengan Air Mengalir
Sampel mi tiaw yang telah dicuci, dihaluskan, kemudian ditimbang sebanyak 100 g, lalu dimasukkan ke dalam labu destilasi 500 ml. Proses destilasi dilakukan sama seperti destilasi formalin dalam sampel mi tiaw sebelum dicuci dan direndam (3.5.6.4).
3.5.6.6 Destilasi Formalin dalam Sampel Mi Tiaw Setelah Direndam dengan Air Biasa
3.5.6.7 Destilasi Formalin dalam Sampel Mi Tiaw Setelah Direndam dengan Air Mendidih
Sampel mi tiaw yang telah direndam dengan air mendidih selama 30 menit, dihaluskan, kemudian ditimbang sebanyak 100 g, lalu dimasukkan ke dalam labu destilasi 500 ml. Proses destilasi dilakukan sama seperti destilasi formalin dalam sampel mi tiaw sebelum dicuci dan direndam (3.5.6.4).
3.6 Analisa Data secara Statistik
Rumus yang digunakan untuk menentukan Standart Deviasi yaitu :
SD=
1 )
( 2
− −
∑
n X Xi
Data diterima jika thitung lebih kecil daripada ttabel pada interval kepercayaan 95%
dengan nilai α = 0,05. Rumus yang digunakan untuk menentukan t hitung yaitu :
t hitung =
n SD
X Xi
/ −
Keterangan : Xi = kadar formalin dalam satu perlakuan X = kadar rata-rata formalin dalam sampel
n = jumlah perlakuan SD = standard deviation α = tingkat kepercayaan
Untuk menghitung rentang kadar formalin secara statistik dalam sampel digunakan rumus:
Rentang Kadar Formalin (μ) = X ± (tα/2,dk xSD / n)
Keterangan : SD = standard deviation
μ = rentang kadar formalin n = jumlah perlakuan t = harga t tabel sesuai dk
dk =derajat kebebasan
3.7 Uji Validasi Metode Analisis 3.7.1 Akurasi
Akurasi ditentukan dengan menggunakan metode penambahan baku (the method of standard additives), yakni ke dalam sampel mi tiaw ditambahkan
larutan formalin baku sebanyak 50%, 100%, 150% dari rata-rata kadar formalin yang terdapat pada sampel, kemudian dianalisis dengan prosedur yang sama seperti pada sampel (Epshtein, 2004). Hasil dinyatakan dalam persen perolehan kembali (%recovery). Persen perolehan kembali dihitung dengan menggunakan rumus sbb:
% Perolehan kembali = A
A F C
C C
*
− x 100%
Keterangan : CF = konsentrasi sampel yang diperoleh setelah penambahan
larutan baku
CA = konsentrasi sampel awal sebelum penambahan baku
C∗A = konsentrasi larutan baku yang ditambahkan
3.7.2 Presisi
Uji presisi (keseksamaan) ditentukan dengan parameter RSD (Relative Standard Deviation) dengan rumus :
RSD = x100% X
Keterangan : RSD = Relative Standard Deviation
SD = Standard Deviation
3.7.3 Penentuan Batas Deteksi dan Batas Kuantitasi
Batas deteksi (Limit Of Detection/LOD) dan batas kuantitasi (Limit Of Quantitation/LOQ) dihitung dari persamaan regresi kurva kalibrasi baku
pembanding. Batas deteksi dan batas kuantitasi dapat dihitung dengan menggunakan rumus sebagai berikut :
Keterangan : SD = Standard Deviation
LOD = Limit of Detection (Batas Deteksi)
LOQ = Limit of Quantitation (Batas Kuantitasi) 2
)
( 2
− − =
∑
n Yi Y SD
Slope SD x LOD=3
BAB IV
HASIL DAN PEMBAHASAN
4.1Penentuan Kadar Formalin secara Titrasi Asam-Basa
Larutan formalin yang digunakan sebagai baku pembanding dalam penelitian ini mempunyai kadar yang tertera pada etiket yaitu 37%. Maka, kadar larutan formalin yang sebenarnya perlu ditetapkan secara titrasi asam basa sehingga dapat digunakan sebagai baku pembanding dalam penentuan kadar sampel secara spektrofotometri. Dari hasil penetapan kadar formalin yang diperoleh berbeda dengan kadar yang tertera pada etiket yaitu 35,4591%, hal ini disebabkan oleh sifat-sifat fisika dan kimia dari larutan formalin yang mudah menguap (Ditjen POM, 1979).
Data dan perhitungan dapat dilihat pada lampiran 3.
4.2 Pemeriksaan Kualitatif Formalin pada Sampel Hasil Destilasi
Sebelum dilakukan analisa kuantitatif formalin pada sampel, perlu dilakukan identifikasi untuk mengetahui ada tidaknya formalin dengan menggunakan pereaksi asam kromatropat 0,05%. Sampel dinyatakan mengandung formalin apabila dengan penambahan pereaksi asam kromatropat dalam asam sulfat pekat dengan pemanasan selama 15 menit akan terjadi warna violet (Herlich, 1990).
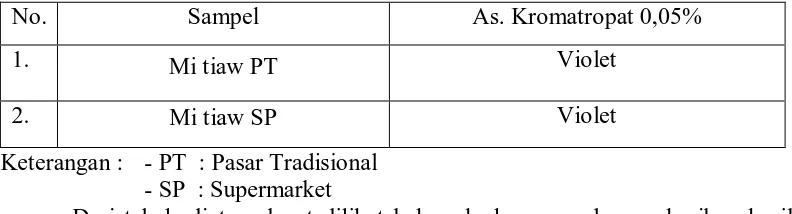
Tabel 1. Hasil Pemeriksaan Kualitatif Formalin pada Sampel Hasil Destilasi
Keterangan : - PT : Pasar Tradisional - SP : Supermarket
Dari tabel diatas, dapat dilihat bahwa kedua sampel memberikan hasil yang positif yaitu warna violet yang jika direaksikan dengan pereaksi asam kromatropat 0,05%. Hal ini menunjukkan bahwa semua sampel mengandung formalin. Selanjutnya dilakukan penetapan kadar formalin terhadap sampel yang positif mengandung formalin.
Gambar hasil pemeriksaan kualitatif formalin dapat dilihat pada lampiran 4. 4.3 Penetapan Kadar
4.3.1 Penentuan Panjang Gelombang Maksimum Larutan Formalin
Hasil penentuan panjang gelombang maksimum larutan formalin dengan konsentrasi 2 ppm, diperoleh panjang gelombang maksimum pada 412 nm. Kurva serapan panjang larutan formalin dapat dilihat pada gambar 1.
No. Sampel As. Kromatropat 0,05%
1. Mi tiaw PT Violet
Gambar 2. Kurva serapan Larutan Formalin Konsentrasi 2 ppm
Panjang gelombang maksimum yang diperoleh berbeda dengan yang tercantum dalam literatur yaitu 415 nm (Herlich, 1990). Menurut Moffat batas toleransi yang diperkenankan yaitu lebih kurang 2 nm, namun menurut prosedur tetap yang dilakukan di Balai Pengawasan Obat dan Makanan panjang gelombang maksimum yang dipakai untuk formalin yaitu 412nm. Maka, panjang gelombang yang dipakai dalam penelitian ini mengacu pada prosedur tetap yang dilakukan oleh BPOM.
4.3.2 Penentuan Waktu Kerja Larutan Formalin
Reaksi yang terjadi antara formalin dengan pereaksi Nash umumnya tidak stabil sehingga perlu dilakukan penentuan waktu kerja larutan formalin. Penentuan waktu kerja (kestabilan warna) larutan formalin baku dengan pereaksi Nash secara spektrofotometri sinar tampak dilakukan dengan selang waktu 1 menit setelah diangkat dari penangas air. Dari data waktu kerja, tidak diperoleh data yang mempunyai kesamaan angka 4 desimal. Sehingga dalam hal ini yang diambil sebagai waktu kerja adalah data yang mempunyai kesamaan angka 2 desimal. Hal ini kemungkinan disebabkan kondisi alat dan listrik yang tidak stabil. Dari data yang diperoleh, waktu pengukuran yang stabil dimulai dari menit ke-9 sampai menit ke-16.
Data dan perhitungan dapat dilihat pada lampiran 7.
4.3.3 Penentuan Linearitas Kurva Kalibrasi Larutan Formalin
Linearitas kurva kalibrasi larutan formalin diperoleh pada konsentrasi 1,0 hingga 3,0 ppm, kemudian diukur serapannya pada panjang gelombang 412 nm. Gambar Linearitas kurva kalibrasi larutan formalin dapat dilihat pada gambar 2.
Dari hasil perhitungan persamaan regresi kurva kalibrasi diatas diperoleh persamaan garis Y = 0,1690X + 0,0002 dengan koefisien korelasi (r) sebesar 0,9998. Hal ini berarti terdapat hubungan yang linear antara konsentrasi dengan serapan, karena harga koefisien korelasi (r) mendekati 1 (Sudjana, 2002).
Data dan perhitungan dapat dilihat pada lampiran 8 dan 9. 4.3.4 Kadar Formalin pada Sampel
Penetapan kadar formalin ditentukan menggunakan metode spektrofotometri sinar tampak. Sebelum ditentukan kadar formalin dalam sampel perlu dilakukan proses destilasi untuk menarik formalin yang terdapat di dalam sampel. Proses destilasi ini dilakukan di Balai Riset dan Standarisasi Industri Medan.
Perlakuan sampel dilakukan dengan pencucian dengan air mengalir dan perendaman dalam air biasa dan air mendidih selama 30 menit. Dari hasil orientasi, pelepasan formalin yang maksimum diperoleh dengan perendaman dalam air biasa dan perendaman dalam air mendidih pada menit ke 30.
Hasil orientasi dapat dilihat pada lampiran 19.
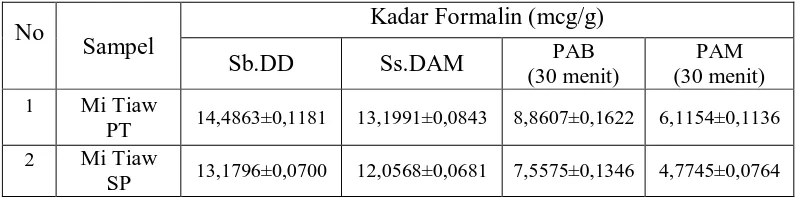
Hasil penetapan kadar formalin pada sampel sesudah dicuci dan direndam dalam air biasa dan air mendidih selama 30 menit dapat dilihat pada tabel 2. Tabel 2. Kadar Formalin pada Sampel
No
Sampel
Kadar Formalin (mcg/g)
Sb.DD Ss.DAM PAB
(30 menit)
PAM (30 menit)
1 Mi Tiaw
PT 14,4863±0,1181 13,1991±0,0843 8,8607±0,1622 6,1154±0,1136
2 Mi Tiaw
Keterangan : Sb.DD = Sebelum dicuci dan direndam Ss.DAM =Sesudah dicuci dengan air mengalir PAB =Perendaman dalam air biasa
PAM =Perendaman dalam air mendidih
Sampel diperoleh dari pasar tradisional dan supermarket, adapun alasan dari pemilihan 2 tempat tersebut karena merupakan pasar-pasar yang rame dikunjungi oleh konsumen, sehingga pengambilan sampel akan mewakili sampel mi tiaw di kota medan.
Gambar sampel mi tiaw di pasar tradisional dan supermarket dapat dilihat pada lampiran 27.
Dari tabel diatas dapat dilihat bahwa kadar formalin yang paling tinggi terdapat pada sampel mi tiaw yang terdapat di pasar tradisional, dimana sampel ini dengan berbagai perlakuan dapat menurunkan kadar formalin di dalam sampel. Pelepasan formalin pada air mendidih lebih tinggi dari pada dalam air biasa.
Dari data yang diperolah sampel mi tiaw yang diperoleh dari pasar tradisional sebelum pencucian dan perendaman menunjukkan kadar formalin yang melampaui batas yang masih diterima oleh tubuh yaitu antara 1,5 mg hingga 14 mg per hari (WHO, 1980).
Contoh perhitungan dapat dilihat pada lampiran 10. 4.3.5 Penurunan Kadar Formalin
Tabel 3. Persentase Penurunan Kadar Formalin Pada Sampel No
Sampel
Penurunan Kadar Formalin (%)
Ss.DAM PAB
Dari tabel di atas dapat dilihat bahwa persentase penurunan kadar formalin yang tertinggi yaitu dengan merendam mi tiaw dalam air mendidih selama 30 menit.
Contoh perhitungan dapat dilihat pada lampiran 21. 4.4 Uji Validasi Metode Analisis
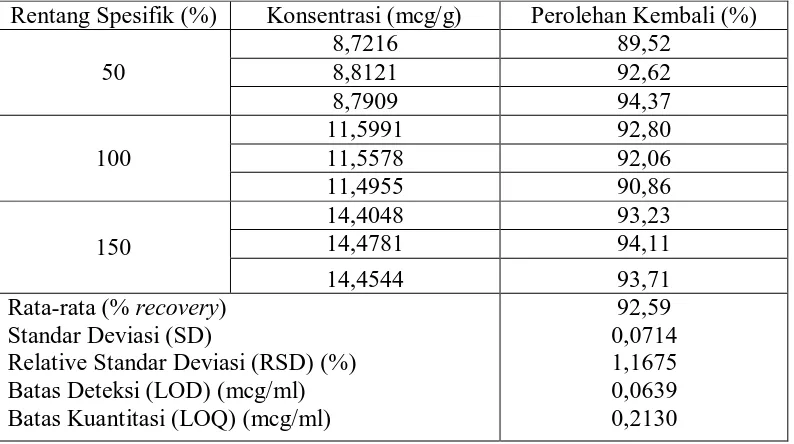
Uji akurasi dengan parameter persen perolehan kembali dilakukan dengan membuat 3 konsentrasi sampel dengan rentang spesifik 50%, 100%, dan 150%, dihitung dari kadar rata-rata formalin dari sampel masing-masing dengan 3 replikasi. Hasil perolehan kembali dapat dilihat pada tabel 4.
Tabel 4. Data Perolehan Kembali Formalin Baku yang Ditambahkan pada Sampel (Metode Penambahan Baku)
Rentang Spesifik (%) Konsentrasi (mcg/g) Perolehan Kembali (%)
50 Standar Deviasi (SD)
Dari data di atas diperoleh kadar rata-rata persen recovery, yaitu 92,59 % dengan standar deviasi (SD) sebesar 0,0714 %. Hasil persen perolehan kembali ini memenuhi persyaratan uji akurasi dimana rentang rata-rata hasil perolehan kembali adalah 80-120 % (Ermer & Miller, 2005). Dari hasil yang diperoleh menunjukkan bahwa metode yang dilakukan memiliki kecermatan yang baik.
Sedangkan dari hasil uji presisi dengan parameter Relatif Standar Deviasi (RSD) yang diperoleh adalah 1,1675 %. Hasil Relatif Standard Deviasi (RSD) ini memenuhi persyaratan presisi, dimana nilai RSD yang diizinkan adalah ≤ 2 % (WHO, 1992). Dari hasil yang diperoleh menunjukkan bahwa metode yang dilakukan memiliki presisi yang baik. Batas deteksi dan batas kuantitasi yang diperoleh dari penelitian ini ialah berturut-turut 0,0639 mcg/ml dan 0,2130 mcg/ml.
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
- Semua sampel mi tiaw yang diidentifikasi menggunakan pereaksi Asam kromatropat memberikan hasil yang positif yaitu mengandung formalin - Proses pencucian dengan air mengalir, perendaman dalam air biasa dan
perendaman dalam air mendidih selama 30 menit dapat menurunkan kadar formalin pada sampel mi tiaw yang berbeda
- Kadar formalin pada sampel mi tiaw yang diperiksa dari pasar tradisional sebelum pencucian dan perendaman berada di atas ambang batas yang dapat diterima oleh tubuh yaitu antara 1,5 mg hingga 14 mg per hari. 5.2Saran
- Disarankan kepada masyarakat untuk melakukan proses perendaman dalam air mendidih selama 30 menit terhadap mi tiaw sebelum dikonsumsi - Disarankan kepada peneliti selanjutnya untuk melakukan pemeriksaan
DAFTAR PUSTAKA
Anonim. (2007). Formalin Pada Mi Basah.
Aminah, M., S., dan Himawan, C.. (2009). Bahan-bahan Berbahaya Dalam Kehidupan. Jakarta. Salamadani Pustaka Semesta. Hal 23-25.
Astawan, M.. (2009). Mi Lezat Bergizi tetapi Rawan Formalin.
Cahyadi, W.. (2009). Analisis dan Aspek Kesehatan Bahan Tambahan Pangan. Edisi Kedua. Jakarta. Bumi Aksara. Hal 254-262.
http://www.okefood.com
Day, R. A. and A. L. Underwood. (2002). Analisis Kimia Kuantitatif. Edisi Keenam. Jakarta. Penerbit Erlangga. Hal 394, 396-404
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta. Departemen Kesehatan RI. Hal 58, 648, 650, 653, 675, 743-744, 748.
Ditjen POM. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta. Departemen Kesehatan RI. Hal 1066, 1176.
Epshtein, N., A.. (2004). Validation of HPLC for Pharmaceutical Analysis. Volume 38. Number 4. Pharmaceutical Chemistry Journal. Page 219. Ermer, J and Miller, J. H.. (2005). Method Validation in Pharmaceutical Analysis.
Weinheim. WILEY-VCH Verlag GmbH & Co. KGaA. Page 171.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Vol. I No 3. Majalah Ilmu Kefarmasian. Hal 117-121. Herlich, K.. (1990). Official Methods Of Analysis. 15th edition. Virginia. AOAC
Inc. Page 934.
Khopkar, S. M.. (1990). Konsep Dasar Kimia Analitik. Jakarta. Penerbit Universitas Indonesia. Hal. 216-217.
Moffat, A.C.. (1986). Clarke’s Isolation and Identification of Drugs. Second Edition. London. The Pharmaceutical Press. Page 633.
Peraturan Menteri Kesehatan RI No.1168/MenKes/Per/X/1999 tentang Perubahan Atas Peraturan Menteri Kesehatan RI No.722/MenKes/Per/IX/1988 tentang Bahan Tambahan Pangan.
Schunack, W., Mayer, K., dan Haake, M.. (1990). Senyawa Obat. Edisi kedua. Penerjemah: Joke Wattimena dan Sriewoelan Soebito. Yogyakarta. Penerbit Universitas Gadjah Mada. Hal 768.
Sudjana. (2002). Metode Statistika. Edisi Statistika. Edisi Keenam. Bandung. Penerbit Tarsito. Hal 168, 371.
Sukesi dan Ulfin, I.. (2007). Deformalinisasi Makanan Berformalin. Surabaya. Institut Teknologi Sepuluh Nopember. Hal 3-4.
WHO. (1980). The International Programme on Chemical Safety.
Widyastuti, A.. (2006). Pengaruh Pencucian dan Pemanasan Terhadap Penurunan Kadar Formalin pada Ikan yang Diawetkan Secara Spektrofotometri Sinar Tampak. Skripsi Jurusan Farmasi FMIPA USU. Yuliarti, N.. (2007). Awas! Bahaya di Balik Lezatnya Makanan. Edisi Pertama.
Lampiran 1. Perhitungan Pembakuan Natrium Hidroksida 1 N
No. Berat K-Bifthalat (mg) Volume NaOH (ml)
1. 302 1,6
BE K-Bifthalat = 204,2 N1 = 0,9243 N
N2 = 0,9794 N
N3 = 0,9213 N
Normalitas rata-rata (Nr) dan persen deviasi (% d)
Nr = 0,9519
Normalitas NaOH adalah Normalitas rata-rata dengan persen deviasi terkecil, yaitu
Lampiran 2. Perhitungan Pembakuan Asam Klorida 1 N
No. Berat Na2CO3 anhidrat (mg) Volume HCl (ml)
1. 151 2,9
2. 150 2,8
3. 153 3,0
Normalitas HCl =
anhidrat
Normalitas rata-rata (Nr) dan persen deviasi (% d)
Nr1= 0,9966
Lampiran 3. Perhitungan Pembakuan Larutan Formalin secara Titrasi Asam- Basa
No Berat Formalin (mg) Kadar rata-rata (Kr) dan persen deviasi (% d)
Kr1= 35,1963%
Lampiran 4. Hasil Pemeriksaan Kualitatif Formalin Pada Sampel Hasil Destilasi
Hasil Kualitatif Blanko Formalin
Keterangan:
A : Hasil Pemeriksaan Kualitatif Formalin Pada Sampel Mi Tiaw di Pasar Tradisional
Lampiran 5. Perhitungan Pembuatan Larutan Formalin 1000 ppm Kadar larutan Formalin yang diperoleh yaitu 35,4591%
Formalin 36,3784% = mcg ppm
ml
Untuk pembuatan larutan Formalin 1000 ppm
45 45 0,4282
46 46 0,4292
47 47 0,4292
48 48 0,4301
49 49 0,4310
50 50 0,4319
51 51 0,4324
52 52 0,4333
53 53 0,4342
54 54 0,4357
55 55 0,4371
56 56 0,4375
57 57 0,4380
58 58 0,4390
59 59 0,4390
60 60 0,4403
61 61 0,4409
62 62 0,4418
63 63 0,4427
64 64 0,4436
65 65 0,4447
66 66 0,4456
67 67 0,4467
68 68 0,4475
69 69 0,4475
70 70 0,4485
71 71 0,4498
72 72 0,4509
73 73 0,4504
74 74 0,4514
75 75 0,4518
76 76 0,4537
77 77 0,4529
78 78 0,4534
79 79 0,4543
Keterangan :
Lampiran 9. Perhitungan Persamaan Regresi
Maka, persamaan regresinya adalah : y = 0,1690x + 0,0002
Lampiran 10. Contoh Perhitungan Kadar Formalin dalam Sampel Berat sampel yang ditimbang = 100,052 gram
Serapan (y) = 0,4803
Rumus Perhitungan Kadar Formalin : K =
BS Fp V
x× ×
Dimana K = kadar total formalin dalam sampel (mcg/g) x = kadar formalin sesudah pengenceran V = volume sampel (ml)
Fp = faktor pengenceran BS = Berat sampel
Lampiran 11. Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Destilat Mi Tiaw di Pasar Tradisional sebelum Dicuci dan Direndam
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 3 diperoleh nilai t tabel
Lampiran 12. Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Destilat Mi Tiaw di Pasar Tradisional Sesudah Dicuci dengan Air Mengalir
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 3 diperoleh nilai t tabel
Lampiran 13. Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Destilat Mi Tiaw di Pasar Tradisional Sesudah Direndam dengan Air Biasa selama 30 menit
No Xi Xi-X (Xi-X )
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 2 diperoleh nilai t tabel
Lampiran 14. Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Destilat Mi Tiaw di Pasar Tradisional Sesudah Direndam dengan Air Mendidih selama 30 menit
No Xi Xi-X (Xi-X )
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 4 diperoleh nilai t tabel
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 3 diperoleh nilai t tabel
Lampiran 15. Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Destilat Mi Tiaw di Supermarket Sebelum Dicuci dan Direndam
No Xi Xi-X (Xi-X )
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 4 diperoleh nilai t tabel
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 3 diperoleh nilai t tabel
Lampiran 16. Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Destilat Mi Tiaw di Supermarket Sesudah Dicuci dengan Air Mengalir
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 3 diperoleh nilai t tabel
Lampiran 17. Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Destilat Mi Tiaw di Supermarket Sesudah Direndam dengan Air Biasa Selama 30 menit
No Xi Xi-X (Xi-X )
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 3 diperoleh nilai t tabel
Lampiran 18. Analisa Data Statistik untuk Menghitung Kadar Formalin Dalam Destilat Mi Tiaw di Supermarket Sesudah Direndam dengan Air Mendidih Selama 30 menit
No Xi Xi-X (Xi-X )
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai t tabel
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 4 diperoleh nilai t tabel
Lampiran 19. Hasil Orientasi Pengukuran Kadar Sampel dengan Proses Perendaman dalam Air Mendidih selama 30 menit
No Waktu Perendaman (menit)
Kadar Formalin yang Terlepas (mcg/g)
1 5 2,1293
2 10 4,3560
3 15 6,6248
4 20 8,6678
5 25 12,1318
6 30 15,1249
7 35 12,0002
Lampiran 20. Hasil Analisa Kadar Formalin dalam Sampel
1. Hasil Analisa Kadar Formalin dalam Sampel Mi Tiaw di Pasar Tradisional
a. Sebelum Pencucian dan Perendaman No. Berat
b. Pencucian Menggunakan Air Mengalir No. Berat
d. Perendaman Menggunakan Air Mendidih Selama 30 menit
2. Hasil Analisa Kadar Formalin dalam Sampel Mi Tiaw di Supermarket a. Sebelum Pencucian dan Perendaman
No. Berat
c. Perendaman Menggunakan Air Biasa Selama 30 menit No. Berat
(gram)
Fp Absorbansi Kadar (mcg/g)
Kadar Sebenarnya (mcg/g) 1 100,226
50/10
0,2520 7,4327
7,5575±0,1346
2 100,361 0,2587 7,6205
3 100,418 0,2593 7,6336
4 100,289 0,2551 7,5198
5 100,432 0,2603 7,6624
6 100,193 0,2527 7,4561
d. Perendaman Menggunakan Air Mendidih Selama 30 menit No. Berat
(gram)
Fp Absorbansi Kadar (mcg/g)
Kadar Sebenarnya (mcg/g) 1 100,288
50/10
0,1602 4,7199
4,7745±0,0764
2 100,143 0,1597 4,7123
3 100,357 0,1676 4,9349
4 100,086 0,1614 4,7649
5 100,219 0,1637 4,8269
Lampiran 21. Contoh Perhitungan Persen Penurunan Kadar Formalin dalam Sampel
Pada destilat sampel mi tiaw yang dicuci menggunakan air mengalir Kadar rata-rata formalin sebelum dicuci = 14,4863
Kadar rata-rata formalin sesudah dicuci = 13,1991 % penurunan kadar formalin sesudah dicuci
=kadar rata-rata formalin sebelum dicuci–kadar rata-rata formalin sesudah dicuci Kadar formalin sebelum dicuci
x 100%
=
g mcg
g mcg g
mcg
/ 4863 , 14
/ 1991 , 13 / 4863 ,
14 −
= 8,89%