EKSPLORASI DAN PREVALENSI CACING
GASTROINTESTINAL PADA KERBAU DI DAERAH
JAWA DAN LOMBOK, INDONESIA
WAHYUDIN ABD. KARIM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Eksplorasi dan Prevalensi Cacing Gastrointestinal pada Kerbau di daerah Jawa dan Lombok, Indonesia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Wahyudin Abd. Karim
RINGKASAN
WAHYUDIN ABD. KARIM. Eksplorasi dan Prevalensi Cacing Gastrointestinal pada Kerbau di daerah Jawa dan Lombok, Indonesia. Dibimbing oleh ACHMAD FARAJALLAH dan BAMBANG SURYOBROTO.
Cacing gastrointestinal merupakan salah satu permasalahan peternakan saat ini. Cacing gastrointestinal dapat menyebabkan kerugian yang sangat besar pada inang, karena menurunkan produktivitas dan mengakibatkan gangguan pertumbuhan, gangguan pencernaan, anemia, dan bahkan menyebabkan kematian. Tingkat infestasi cacing gastrointestinal pada ruminansia dipengaruhi kondisi geografis suatu daerah. Perbedaan jenis cacing dan prevalensi masing-masing tempat akan berbeda sesuai dengan habitat dan kondisi lingkungannya. Beberapa daerah di pulau Jawa dan di luar pulau Jawa memiliki kondisi lingkungan yang berbeda. Jawa Barat merupakan salah satu daerah yang memiliki curah hujan yang sangat tinggi. Tingginya curah hujan akan berpengaruh terhadap infestasi cacing gastrointestinal.
Beberapa penelitian tentang cacing gastrointestinal pada feses kerbau telah dilakukan di Italia, Bangladesh, India dan Pakistan. Sedangkan penelitian cacing gastrointestinal pada feses kerbau di Indonesia masih sangat sedikit di eksplorasi. Hal tersebut yang melatarbelakangi dilakukan penelitian tentang Eksplorasi dan Prevalensi Cacing Gastrointestinal pada Kerbau di daerah Jawa dan Lombok, Indonesia. Tujuan dari penelitian ini adalah untuk: (1) mengidentifikasi jenis-jenis cacing gastrointestinal pada kerbau di daerah Jawa dan Lombok (2) mempelajari hubungan adanya cacing gastrointestinal terhadap manajemen pemeliharaan dan kondisi lingkungan (3) membandingkan prevalensi dan infestasi cacing gastrointestinal pada setiap lokasi geografis yang berbeda, faktor jenis kelamin dan umur.
Penelitian ini dilaksanakan pada bulan November 2013 hingga Juli 2014. Penelitian ini dilakukan di daerah Jawa yaitu Kabupaten Bogor (Darmaga, Ciampea, dan Tenjolaya) sebanyak 27 kerbau, Kabupaten Demak (Mranggen) sebanyak 15 kerbau, Jawa Timur (Tulungagung, Kepanjen, dan Lamongan) sebanyak 37 kerbau, dan daerah Lombok (Lamper) sebanyak 10 kerbau. Pengambilan sampel feses pada kerbau dibagi berdasarkan jenis kelamin dan faktor umur. Pembagian kelompok umur dibagi menjadi tiga bagian yaitu < 1 tahun, 1 – 5 tahun, > 5 tahun.
Pemilihan lokasi dilakukan berdasarkan kondisi geografisnya. Jawa Barat dipilih untuk mewakili lokasi dengan kondisi basah/lembab. Sedangkan lokasi yang cukup kering diwakili oleh Jawa Tengah, Jawa Timur dan Lombok/NTB. Data parameter lingkungan yang meliputi curah hujan, suhu dan kelembaban diperoleh dari Badan Meterologi, Klimatologi dan Geofisika (BMKG). Ketinggian lokasi diukur menggunakan Global Positioning System (GPS).
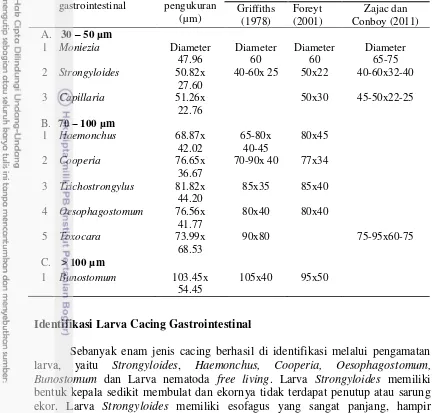
Identifikasi larva cacing gastrointestinal berdasarkan bentuk kepala, ekor, karateristik sel usus dan tipe esofagus.
Hubungan prevalensi dan infestasi cacing gastrointestinal yang diamati adalah manajemen pemeliharaan dan faktor lingkungan. Pengukuran morfometrik telur menggunakan program image J (ij148). Perbedaan lokasi georafis, faktor jenis kelamin dan umur dianalisis menggunakan perhitungan prevalensi, sedangkan tingkat intensitas telur dihitung berdasarkan Faecal Eggs Count (FEC). Feses kerbau yang diperiksa ada 89 individu. Jenis - jenis telur cacing gastrointestinal yang ditemukan dalam saluran pencernaan kerbau di Jawa ditemukan sembilan genus, yaitu Moniezia, Haemonchus, Bunostomum, Cooperia, Strongyloides, Trichostrongylus, Oesophagostomum, Capillaria dan
Toxocara, sedangkan untuk daerah Lombok ditemukan lima genus, yaitu
Moniezia, Bunostomum, Cooperia, Strongyloides, Trichostrongylus. Jenis larva yang ditemukan ada enam jenis yaitu Strongyloides, Haemonchus, Cooperia, Oesophagostomum, Bunostomum dan larva free living.
Ukuran morfologi telur cacing gastrointestinal yang ditemukan memiliki perbedaan ukuran panjang dan lebar dengan literatur. Adanya infeksi cacing gastrointestinal pada kerbau sangat dipengaruhi oleh manajemen pemeliharaan dan faktor lingkungan. Prevalensi dan infestasi berdasarkan perbedaan kondisi geografis yaitu antara daerah basah dan kering lebih besar ditemukan di daerah basah (Bogor) yaitu 62.1% dan 840 EPG, dibandingkan di daerah kering (Demak ) yaitu 53.3% dan 375 EPG, Jawa Timur (35.1% dan 570 EPG) dan Lombok (50% dan 135 EPG). Prevalensi untuk faktor jenis kelamin lebih besar ditemukan pada jantan dibandingkan betina, yaitu sebesar 57.9% dan 43.4%, sedangkan infestasinya lebih besar ditemukan pada betina dibandingkan jantan, yaitu 113.3 EPG dan 101.7 EPG. Prevalensi faktor umur lebih besar ditemukan pada umur < 1 tahun dibandingkan umur 1-5 tahun dan > 5 tahun, yaitu sebesar 66.7%, 54.3% dan 39%, sedangkan infestasinya lebih besar ditemukan pada umur 1-5 tahun, yaitu sebesar 81.7 EPG, diikuti umur > 5 tahun 68.3 EPG dan umur < 1 tahun 63.3 EPG.
SUMMARY
WAHYUDIN ABD. KARIM. An Exploration and Prevalence of Gastrointestinal Worm in Buffalo from Java and Lombok, Indonesia. Supervised by ACHAMAD FARAJALLAH and BAMBANG SURYOBROTO.
Gastrointestinal worm is one of the main problem in livestock today, that can be affecting directly to the productivity of the ruminant. The huge losses of the host can be caused by parasitic worms, due to the decrease in productivity and growth disorders, digestive disorders, anemia, even the death.
Gastrointestinal worms infestation in ruminant can be affected by geografical condition of the area. The differences of worms and the prevalence of each location will be different due to the habitat and environmental condition. Some areas in Java and other areas have different environmental condition. Areas that have environmental condition that are different with other areas was Bogor district. Bogor is one of the areas in West java which has high rainfall. The highest rainfall will influence the gastrointestinal worm infestation.
Some research on gastrointestinal worms in buffalo have been conducted in Italy, Bangladesh, India dan Pakistan. In indonesia, the study of gastrointestinal worm has not been widely explored. These reasons are the background of the research about on the An Exploration and Prevalence of Gastrointestinal Parasite Infections in Buffalo (Bubalus bubalis) from Java and Lombok, Indonesia. The study was aimed : (1) identified the types of gastrointestinal worms in buffaloes from java and Lombok, (2) Study the relationship of gastrointestinal worms to livestock management and environmental condition (3) Compared the prevalence and infestation of gastrointestinal worms infestation of each different geographycal location, sex factor and age.
The faecal of 27 buffaloes were collected in several areas from Bogor (Darmaga, Ciampea, and Tenjolaya), 15 from Demak (Mranggen), 37 from East Java (Tulungagung, Kepanjen, and Lamongan) and 10 from Lombok (Lamper). Faecal samples were collected in buffalo based on the sex and age. The buffaloes categories of age i.e < 1 years, 1 – 5 years, and > 5 years).
The location was selected based on geographical condition. West Java was chosen to represent the location with moist/damp condition. Whereas the dry location represented by Central Java, East java, and Lombok/NTB. The environmental parameters include rainfall, temperature and humidity obtained from the Meterelogy, Climatology and geophysics (BMKG). The altitude of this location was measured using the Global Positioning System (GPS).
Samples were analyzed at the Laboratory of Fisiology and Behaviour, Departement of Biology, Bogor Agricultural University. The gastrointestinal worms were observed using floatation solution tehnique. Identification of gastrointestinal worm eggs based on the character were size (lenght and width), eggs shape and charateristic cell in eggs.
in geographic location, sex and age were analyzed using prevalence, whereas the intensity rate eggs the calculation based of Faecal Eggs Count (FEC).
Faecal samples were collected from 89 buffaloes, the types of gastrointestinal worm eggs found in the digestive tract of buffalo in Java, there were nine genera i.e Moniezia, Haemonchus, Bunostomum, Cooperia, Strongyloides, Trichostrongylus, Oesophagostomum, Capillaria and Toxocara, while in Lombok were found five genus i.e Moniezia, Bunostomum, Cooperia, Strongyloides, Trichostrongylus. Types larvae were found six i.e Strongyloides, Haemonchus, Cooperia, Oesophagostomum, Bunostomum and free living larvae.
The size of morphology from gastrointestinal worm eggs had differences in length and width. The prevalence and infestation of gastrointestinal worm infection were influenced by the livestock management and enviromental factors. The highest prevalence and infestation based different geographycal condition i.e moist and dry areas were found moist area (Bogor) i.e 62.1% and 840 EPG, compared dry areas in (Demak) i.e 53.3% and 375 EPG, in East Jawa (35.1% and 570 EPG) and Lombok (50% and 135 EPG). The highest prevalence of sex factor was in male than female i.e 57.9% and 43.4%, whereas highest infestation was found in female than male i.e 113.3 EPG and 101.7 EPG. The highest prevalence based on the age was in < 1 years than 1-5 years and > 5 years, i.e 66.7%, 54.3% and 39%, whereas highest infestation was found in 1-5 years (81.7 EPG), followed > 5 years (68.3 EPG) and < 1 years (63.3 EPG).
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biosains Hewan
EKSPLORASI DAN PREVALENSI CACING
GASTROINTESTINAL PADA KERBAU DI DAERAH
JAWA DAN LOMBOK, INDONESIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga Tesis dengan judul Eksplorasi dan Prevalensi Cacing Gastrointestinal pada Kerbau di Daerah Jawa dan Lombok, Indonesia telah berhasil diselesaikan. Penelitian ini berlangsung dari bulan November 2013 sampai bulan Juli 2014. Penelitian ini terlaksana atas bantuan dana dan fasilitas penelitian dari Direktorat Jenderal Pendidikan Tinggi (DIKTI).
Terima kasih penulis ucapkan yang tak terhingga kepada komisi pembimbing Dr Achmad Farajallah dan Dr Bambang Suryobroto selaku pembimbing. Terima kasih juga kepada penguji luar komisi Dr Rika Raffiudin dan Ibu Dr RR Dyah Perwitasari selaku ketua program studi. Terima kasih juga penulis ucapkan kepada Fahri Fahrudin, Silvia Puspitasari, Ellena Yusti, Budi Setiawan dan Ivan Permana Putra yang telah membantu penulis dalam menyelesaikan naska Tesis ini. Kepada bapak Adi Surahman dan Ibu Tini Wahyuni, terima kasih telah memberikan izin dan fasilitas laboratorium kepada penulis.
Penulis juga mengucapkan terima kasih kepada Rektor Universitas Tadulako, Dekan Fakultas FMIPA UNTAD, dan Ketua Jurusan Biologi FMIPA UNTAD yang telah merekomendasikan penulis untuk melanjutkan studi Magister di IPB. Ucapan terima kasih juga penulis sampaikan kepada seluruh staf pengajar Biosains Hewan (BSH) atas semua ilmu, pengalaman dan bimbingannya. Ucapan terima kasih untuk teman-teman BSH angkatan 2012 atas kebersamaan, keceriaan, dan semangat yang diberikan. Terima kasih juga kepada seluruh teman-teman
zoocorner atas persahabatan selama ini. Ucapan terima kasih kepada teman-teman di Asrama Mahasiswa Pascasarjana Sulawesi Tengah atas bantuan dan kerjasamanya.
Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
3
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE 2 Waktu dan Tempat 2 Pemilihan Lokasi 2
Pengambilan Sampel Feses 2 Pengamatan Telur Cacing Gastrointestinal 3
Identifikasi Telur Cacing Gastrointestinal 3
Pengkulturan Larva Cacing Gastrointestinal 4
Identifikasi Larva Cacing Gastrointestinal 4
Parameter Lingkungan 4
Analisis Data 6 3 HASIL DAN PEMBAHASAN 6
Identifikasi Telur Cacing Gastrointestinal 4
UkuranTelur Cacing Gastrointestinal 9
Identifikasi Larva Cacing Gastrointestinal 10
Manajemen Pemeliharaan dan Data Lingkungan Setiap Lokasi Sampling 13
Prevalensi Cacing Gastrointestinal Berdasarkan Lokasi Penelitian 15
Prevalensi dan Infestasi Cacing Gastrointestinal di Daerah Basah dan kering 16
Prevalensi dan Infestasi Cacing Gastrointestinal Menurut Tingkatan Kerbau (Jenis Kelamin dan Umur) 16
Infestasi Cacing Gastrointestinal Berdasarkan Faecal Eggs Count (FEC) 17
DAFTAR TABEL
1 Klasifikasi Cacing Gastrointestinal 7
2 Perbandingan Ukuran Panjang dan Lebar Telur Cacing
Gastrointestinal 10
3 Manajemen Pemeliharaan dan Faktor Lingkungan 14
4 Prevalensi Cacing Gastrointestinal Berdasarkan Lokasi Penelitian 15 5 Total Prevalensi dan Infestasi Cacing Gastrointestinal Daerah Basah
dan Kering 16
6 Prevalensi Cacing Gastrointestinal Berdasarkan Jenis Kelamin dan
Umur 17
7 Tingkat Infestasi Cacing Gastrointestinal Berdasarkan Perhitungan
Faecal Eggs Count (FEC) 17
DAFTAR GAMBAR
1 Skematik dari Telur Cacing Gastrointestinal pada Ruminansia 3
2 Kultur Larva Dengan Direndam Air 4
3 Skematik Dari Larva Cacing Gastrointestinal Pada
Ruminansia 5
4 Telur Genus Eimeria 7
5 Telur Genus Strongyloides 8
6 Telur Genus Capillaria 8
7 Telur Genus Haemonchus 8
8 Telur Genus Cooperia 8
9 Telur Genus Trichostrongylus 9
10 Telur Genus Toxocara 9
11 Telur Genus Oesophagostomum 9
12 Telur Genus Bunostomum 9
13 Larva Genus Strongyloides 11
14 Larva Genus Haemonchus 11
15 Larva Genus Cooperia 11
16 Larva Genus Oesophagostomum 12
17 Larva Genus Bunostomum 12
18 Larva Nematoda Free Living 12
19 Grafik Prevalensi Cacing Gastrointestinal pada Faktor Jenis Kelamin 18 20 Grafik Prevalensi Cacing Gastrointestinal pada Faktor Umur 19
LAMPIRAN
1
1
PENDAHULUAN
Latar Belakang
Cacing gastrointestinal merupakan cacing yang hidup pada sistem pencernaan di organisme yang lebih besar/inang (Shah 2012). Cacing gastrointestinal ada yang bersifat parasit dan tidak parasit. Cacing yang bersifat parasit dapat menyebabkan kerugian yang sangat besar pada ternak, karena menurunkan produktivitas dan mengakibatkan gangguan pertumbuhan, gangguan pencernaan, anemia dan bahkan menyebabkan kematian (Zajac dan Conboy 2011; Sahinduran 2012). Jenis - jenis cacing gastrointestinal yang bisa ditemukan dalam saluran pencernaan ruminansia antara lain Trichuris dan Oesophagostomum di usus besar, Trichostrongylus, Cooperia, Nematodirus, Bunostomum,
Strongyloides, Moniezia dan Cryptosporodium di usus kecil, Paramphistomum di rumen, Haemonchus, Ostertagia dan Trichostrongylus di abomasum (Foreyt 2001; Southwell et al. 2008), sedangkan cacing gastrointestinal yang bisa ditemukan pada kerbau antara lain Trichostrongylus, Oesophagostomum,
Haemonchus, Toxocara, Ostertagia, Bunostomum, Strongyloides, Trichuris
(Afridi et al. 2007).
Tingkat infestasi cacing gastrointestinal pada ruminansia dipengaruhi kondisi geografis suatu daerah. Perbedaan jenis cacing dan prevalensi masing-masing tempat akan berbeda sesuai dengan habitat dan kondisi lingkungannya. Beberapa daerah di pulau Jawa dan di luar pulau Jawa memiliki kondisi lingkungan yang berbeda. Jawa Barat merupakan salah satu daerah yang memiliki curah hujan yang sangat tinggi. Tingginya curah hujan akan berpengaruh terhadap infestasi cacing gastrointestinal. Tingkat infestasi cacing gastrointestinal pada ruminansia akan lebih tinggi ditemukan pada musim hujan, dibandingkan musim panas (Chavhan et al. 2008; Patel et al. 2015). Selain itu, manajemen pemeliharaan, perbedaan umur dan jenis kelamin merupakan faktor yang penting adanya infestasi cacing gastrointestinal (Soulsby 1982; Levine 1994). Cacing gastrointestinal ada yang bersifat spesifik pada inang tertentu (host-specific) dan tidak bersifat spesifik (hidup dilebih dari satu inang). Cacing gastrointestinal seperti Toxocara sp. dan Oesophagostomum sp. bisa ditemukan pada sapi dan kerbau, Haemonchus sp.bisa ditemukan pada domba, kambing (Raza et al. 2007), sapi dan kerbau sungai (Bilal et al. 2009; Choubisa dan Jaroli 2012).
Identifikasi jenis cacing gastrointestinal pada ruminansia bisa dilakukan berdasarkan pengamatan telur dan larva. Identifikasi telur masih menggunakan hubungan antara karakter ukuran (panjang dan lebar), bentuk dan karateristik sel (Griffiths 1978; Foreyt 2001; Zajac dan Conboy 2011). Dalam tubuh inang, telur cacing gastrointestinal dikeluarkan bersamaan dengan feses. Jumlah telur cacing yang ditemukan pada setiap gram feses dapat dijadikan ukuran menentukan tingkat infestasi cacing. Identifikasi jenis cacing berdasarkan morfologi telur sangat sulit untuk mengenali hingga tahap genus karena ukuran telur overlapping
Beberapa penelitian tentang cacing gastrointestinal pada feses kerbau telah dilakukan di Italia (Rinaldi et al. 2009), Bangladesh (Mamun et al. 2011), India (Choubisa dan Jaroli 2012; Singh et al. 2012) dan Pakistan (Bilal et al. 2009; Raza el al. 2013). Sedangkan penelitian cacing gastrointestinal pada feses kerbau di Indonesia masih sangat sedikit. Hal ini yang menjadi masalah dalam mengidentifikasi jenis - jenis cacing gastrointestinal yang terdapat pada feses kerbau.
TujuanPenelitian
Tujuan dari penelitian ini adalah untuk (1) mengidentifikasi jenis - jenis cacing gastrointestinal pada kerbau di daerah Jawa dan Lombok (2) mempelajari hubungan adanya cacing gastrointestinal terhadap manajemen pemeliharaan dan kondisi lingkungan (3) membandingkan prevalensi dan infestasi cacing gastrointestinal pada setiap lokasi geografis yang berbeda, faktor jenis kelamin dan umur.
Manfaat Penelitian
Hasil penelitian ini diharapkan memberikan data dasar dan sumber informasi mengenai jenis-jenis cacing gastrointestinal pada kerbau di daerah Jawa dan Lombok.
2 BAHAN DAN METODE
Waktu dan Tempat
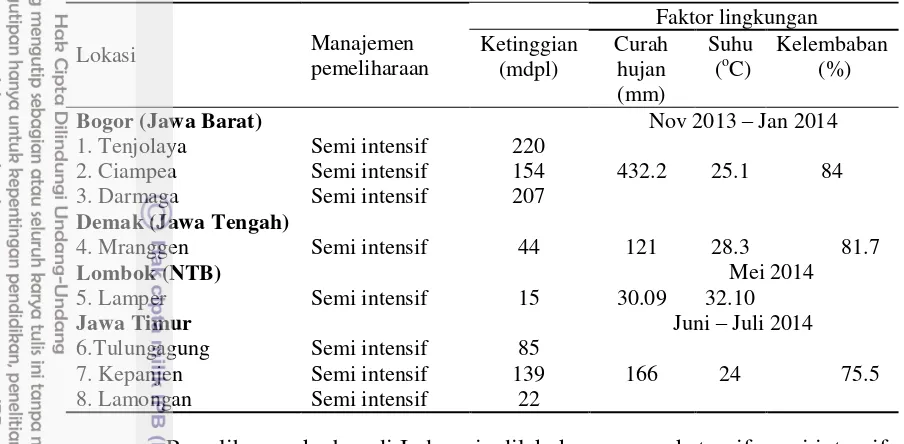
Penelitian ini dilaksanakan pada bulan November 2013 hingga Juli 2014. Pengambilan sampel feses kerbau dilakukan di daerah Jawa yaitu Kabupaten Bogor, Jawa Barat (Desa Cibereum, Kampug Tegal, dan Tapos 1), Kabupaten Demak, Jawa Tengah (Kecamatan Mranggen), Provinsi Jawa Timur (Tulungagung, Kepanjen dan Lamongan). Sedangkan untuk daerah Kabupaten Lombok di Desa Lamper. Pemeriksaan sampel feses dilakukan di Laboratorium Fisiologi dan Perilaku, Departemen Biologi Institut Pertanian Bogor.
Pemilihan Lokasi
Pemilihan lokasi dilakukan berdasarkan kondisi geografisnya. Jawa Barat dipilih untuk mewakili lokasi dengan kondisi basah/lembab. Sedangkan lokasi yang cukup kering diwakili oleh Jawa Tengah, Jawa Timur dan Lombok/NTB.
Pengambilan Sampel Feses Kerbau
Pengkulturan Larva Cacing Gastrointestinal
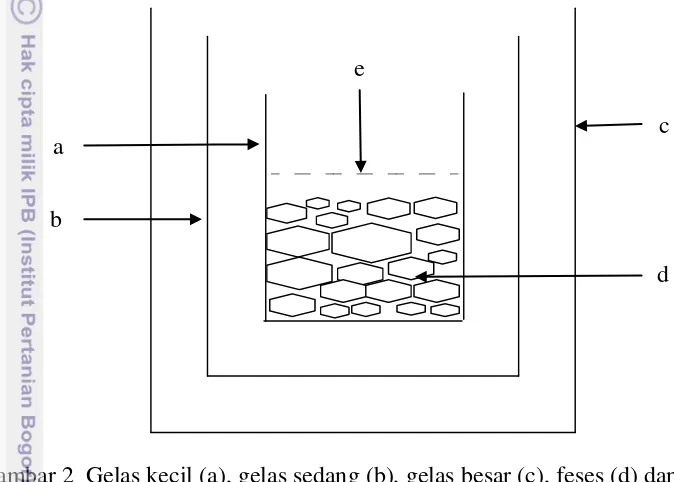
Teknik pengkulturan ini menggunakan media air. Feses direndam dalam air (Hutchinson 2009). Wadah disusun seperti pada Gambar 2. Wadah gelas kecil dimasukkan ke dalam wadah gelas sedang yang berisi air. Wadah gelas sedang dimasukkan ke dalam wadah gelas besar. Wadah ini ditempatkan di tempat yang gelap. Larva di panen setelah dari hari pertama sampai hari ke tujuh sejak kultur dilakukan (Hutchinson 2009).
Gambar 2 Gelas kecil (a), gelas sedang (b), gelas besar (c), feses (d) dan air (e) kultur larva dengan direndam air
Identifikasi Larva Cacing Gastrointestinal
Identifikasi larva cacing gastrointestinal berdasarkan bentuk kepala, ekor, karateristik sel usus dan tipe esofagus (Wyk dan Mayhew 2013). Adapun gambar skematik dari larva cacing gastrointestinal pada ruminansia terlihat pada Gambar 3.
Parameter Lingkungan
Data parameter lingkungan yang meliputi curah hujan, suhu dan kelembaban diperoleh dari Badan Meterologi, Klimatologi dan Geofisika (BMKG). Ketinggian lokasi diukur menggunakan Global Positioning System
(GPS).
c a
d b
Analisis Data
Pengukuran morfometrik telur menggunakan program image J (ij148). Hubungan kejadian infestasi cacing gastrointestinal yang diamati adalah manajemen pemeliharaan dan faktor lingkungan. Perbedaan lokasi geografis, jenis kelamin dan umur dianalisis menggunakan perhitungan prevalensi berdasarkan Rehman et al. (2011). Perhitungan Faecal Eggs Count (FEC) berdasarkan (Cringoli et al. 2004; Zajac dan Conboy (2011) yaitu:
Prevalensi (%) =
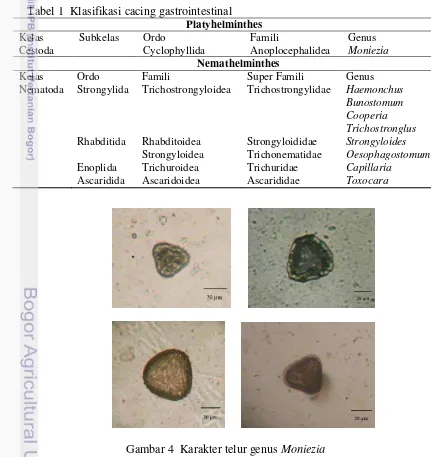
Telur cacing gastrointestinal yang ditemukan pada penelitian ini terdiri dari lima ordo, enam famili dan sembilan genus (Tabel 1). Ordo Strongylida merupakan ordo yang memiliki jumlah terbanyak (Tabel 1). Hasil identifikasi dan deskripsi telur dan larva cacing gastrointestinal memiliki bentuk dan karakter morfologi yang berbeda-beda. Hasil pengamatan menunjukan telur genus
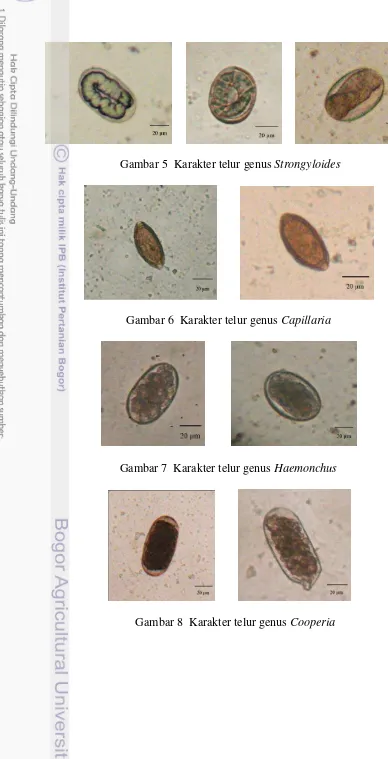
Moniezia memiliki rentang diameter telur 28.63 – 60.79 µm dan berbentuk segitiga (Gambar 4). Strongyloides memiliki panjang telur 45.61 - 65.03 µm (r = 50.82 µm); lebar antara 19.76 - 34.21 µm (r = 27.60 µm). Hasil pemeriksaan menunjukan telur Strongyloides bersisi larva dan tidak memiliki operculum, dengan dinding sel yang tipis serta sel telurnya berwarna transparan (Gambar 5).
Hasil ini menunjukan Capillaria memiliki dua kutub di ujung telur. Telur
Capillaria memiliki panjang telur 48.05 - 51.26 µm (r = 49.46 µm); lebar antara 21.78 - 23.74 µm (r = 22.76 µm). Telur Capillaria bentuknya memanjang seperti galah, sel telur berwarna kekuningan (Gambar 6). Telur Haemonchus memiliki panjang telur 61.98 – 85.01 µm (r = 68.87 µm); lebar antara 35.61 – 54.29 µm (r = 42.02 µm). Telur Haemonchus memiliki bentuk oval, selnya berwarna kekuningan, mempunyai tiga lapisan di kulit luar dengan bentuk telur sama panjang, serta mempunyai sel embrionik yang hampir menutupi seluruh rongga telur (Gambar 7).
7
telur meruncing dan tumpul, bagian luar Trichostrongylus tersusun atas tiga lapisan, dinding berwarna kekuningan dan sel embrionik tidak menutupi seluruh rongga telur (Gambar 9).
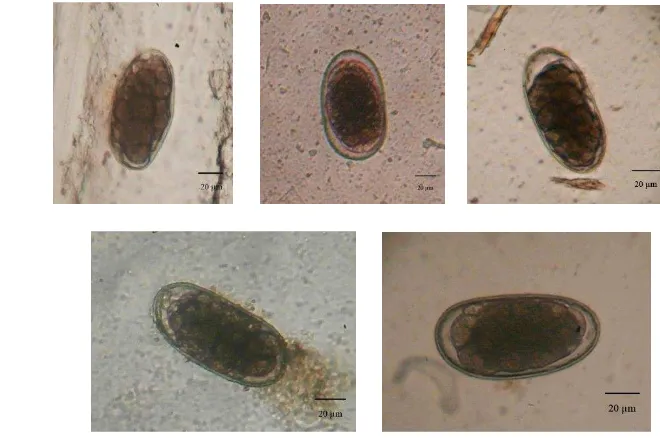
Telur Toxocara berbentuk membulat, sel telur berwarna kuning gelap dan berdinding tebal. Panjang telur antara 72.55 - 75.43 µm (r = 73.99 µm); lebar antara 67.52 - 69.54 µm (r = 68.53 µm) (Gambar 9). Telur Oesophagostomum
memiliki panjang telur 67.52 - 85.60 µm (r = 76.56 µm); lebar antara 35.31 - 48.23 µm (r = 41.77 µm). Telur Oesophagostomum memiliki ujung telur membulat, lapisan kulit luarnya tipis, sel telur berwarna kuning gelap dan mempunyai tiga lapisan di kulit luar, serta sel embrioniknya tidak menutupi seluruh rongga telur (Gambar 10). Telur Bunostomum memiliki panjang telur antara 87.03 – 128.12 µm (r = 103.45 µm); lebar antara 43.97 – 68.79 µm (r = 54.45 µm). Bentuk telur tumpul membulat, sel telur berwarna coklat kehitaman, dengan sel embrionik tidak menutupi seluruh rongga telur (Gambar 11).
Tabel 1 Klasifikasi cacing gastrointestinal Platyhelminthes
Kelas Subkelas Ordo Famili Genus
Cestoda Cyclophyllida Anoplocephalidea Moniezia
Nemathelminthes
Kelas Ordo Famili Super Famili Genus
Nematoda Strongylida Trichostrongyloidea Trichostrongylidae Haemonchus
Bunostomum Cooperia Trichostronglus
Rhabditida Rhabditoidea Strongyloididae Strongyloides
Strongyloidea Trichonematidae Oesophagostomum
Enoplida Trichuroidea Trichuridae Capillaria
Ascaridida Ascaridoidea Ascarididae Toxocara
Gambar 5 Karakter telur genus Strongyloides
Gambar 6 Karakter telur genus Capillaria
Gambar 7 Karakter telur genus Haemonchus
9
Gambar 9 Karakter telur genus Trichostrongylus dan Toxocara
Gambar 10 Karakter telur genus Oesophagostomum
Gambar 11 Karakter telur genus Bunostomum
Ukuran Telur Cacing Gastrointestinal
Tabel 2 Perbandingan ukuran panjang dan lebar telur cacing gastrointestinal
40-60x 25 50x22 40-60x32-40
3 Capillaria 51.26x
3 Trichostrongylus 81.82x 44.20
85x35 85x40
4 Oesophagostomum 76.56x 41.77
Identifikasi Larva Cacing Gastrointestinal
11
Gambar 12 ekor (a), esofagus (b) dan kepala (c) larva genus Strongyloides
Gambar 13 kepala (a) dan ekor (b) larva genus Haemonchus
Gambar 14 Kepala (a), refractile bodies (b) dan ekor (c) larva genus Cooperia
a
c b
b
c
a
a
13
Larva cacing genus Strongyloides ini disebut sebagai cacing benang.
Genus ini banyak ditemukan di mukosa usus halus di domba, kambing, sapi dan berbagai hewan ruminansia lain. Larva Strongyloides dapat menyebabkan radang usus apabila terdapat jumlah yang sangat banyak (levine 1994). Tipe esofagus dari larva ini sangat berbeda, yaitu panjang esofagusnya hampir sama dengan panjang tubuhnya. Hal ini sesuai dengan penelitian yang dilakukan oleh Wyk dan Mayhew (2013), bahwa panjang esofagusnya mencapai 40 % dari panjang tubuhnya.
Haemonchus merupakan kelas nematoda yang paling berpengaruh pada ruminansia terutama di domba, kambing, sapi dan ruminansia lain (Levine 1994). Cacing Haemonchus dapat menyebabkan anemia, depresi, mengurangi berat badan, dan dapat menyebabkan kematian (Miller dan Horohov 2006). Bentuk morfologi dari larva ini yaitu kepala meruncing dan sarung ekornya tidak terlalu panjang. Menurut Wyk dan Mayhew (2013), bahwa bentuk kepala dari larva
Haemonchus meruncing seperti peluru dan sarung ekornya tidak terlalu panjang.
Cooperia merupakan nematoda usus pada ruminansia. Cooperia tidak terlalu patogen tetapi banyak ditemukan di ruminansia. Larva ini terdapat pada usus halus domba, kambing, sapi dan biasanya ditemukan pada bison. Bentuk morfologi pada larva memiliki dua titik dibagian kepala. Menurut Wyk dan Mayhew (2013), serta Zajac dan Conboy (2011), bahwa larva Cooperia memiliki
refractile bodies.
Oesophagostomum disebut sebagai cacing benjol. Larva ini terdapat pada usus besar domba, kambing sapi, zebu dan kerbau sungai. Larva ini menyebabakan radang edema dinding usus, anemia, diare dan nafsu makan berkurang (Levine 1994). Larva Oesophagostomum memiliki sarung ekor yang sangat panjang. Menurut Wyk dan Mayhew (2013), bahwa larva
Oesophagostomum memiliki sarung ekor yang sangat panjang dan berbentuk filamen.
Bunostoumum adalah cacing kait yang terdapat pada usus halus domba, kambing dan sapi. Larva ini dapat menyebabkan anemia. Larva ini memiliki gelembung atau berbentuk bola pada esofagusnya. Menurut Wyk dan Mayhew (2013), bahwa larva Bunostoumum memiliki bulb atau tonjolan pada tipe esofagusnya. Larva nematoda free living yang ditemukan pada penelitian ini memiliki tipe esofagus Rhaditiform, yaitu terdapat corpus, isthmus dan bulb. Larva ini banyak ditemukan pada penelitian ini. Menurut Wyk dan Mayhew (2013), bahwa larva nematoda free living mendominasi disetiap pengkulturan larva pada feses ruminansia.
Manajemen Pemeliharaan dan Data Lingkungan Setiap Lokasi Sampling
Tabel 3 Manajemen pemeliharaan dan faktor lingkungan
6.Tulungagung Semi intensif 85
166 24 75.5
7. Kepanjen Semi intensif 139
8. Lamongan Semi intensif 22
Pemeliharaan kerbau di Indonesia dilakukan secara ekstensif, semi intensif dan intensif. Pemeliharaan secara intensif yaitu pemeliharaan ternak hampir sepanjang hari berada dalam kandang. Pemeliharaan ekstensif yaitu pemeliharaan ternak yang dilepas di padang penggembalaan sepanjang hari mulai dari pagi sampai sore hari. Pemeliharaan semi intensif yaitu kerbau dilepas di padang penggembalaan pada pagi hari dan sore atau malam hari dikandangkan.
Manajemen pemeliharaan kerbau dalam penelitian ini yaitu semi intensif (Tabel 3). Sistem pemeliharaan kerbau pada penelitian ini yaitu dilepaskan pada pagi hari di padang rumput pukul 06.00 sampai 16.00 WIB. Kerbau yang dilepaskan di padang rumput pada pagi hari akan lebih berisiko terinfeksi cacing gastrointestinal. Larva cacing gastrointestinal akan naik ke pucuk rumput pada saat cahaya matahari belum panas dan kondisi rumput dalam keadaan masih basah (Bukhari dan Sanyal 2009). Lokasi penggembalaannya adalah padang rumput yang sering digunakan peternak untuk melepaskan ternak ruminansia. Padang rumput yang sering digunakan untuk menggembalakan ternak akan menyebabkan terjadinya perpindahan cacing antar kerbau. Kerbau yang digembalakan akan terinfeksi cacing pada saat memakan rumput mengandung parasit larva (Saverwyns 2008). Kerbau yang digembalakan juga mempunyai jangkauan tempat mencari pakan lebih luas di padang rumput, sehingga risikonya lebih besar terinfeksi parasit (Waller 2003).
Selain itu, peternakan yang terletak diketinggian memiliki prevalensi infeksi cacing gastrointestinal lebih tinggi. Daerah yang berada di ketinggian memiliki kondisi iklim yang cocok bagi perkembangan siklus hidup cacing gastrointestinal (Kantzoura et al. 2012). Ketinggian tempat yang berbeda-beda dengan permukaan laut akan menyebabkan suhu dan kelembaban udara yang berbeda pula (Roza 1991).
15
kerbau disebabkan adanya perbedaan kondisi lingkungannya yaitu suhu dan curah hujan (Bilal et al. 2009; Dijk et al. 2010).
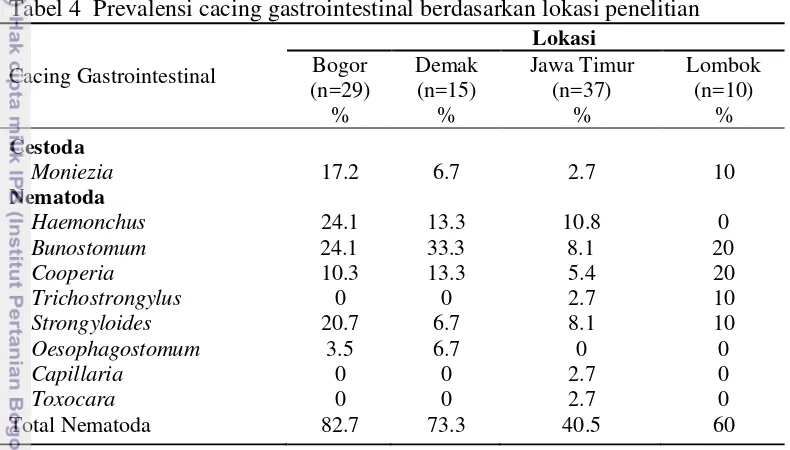
Prevalensi Cacing Gastrointestinal Berdasarkan Lokasi Penelitian
Infeksi cacing gastrointestinal di setiap lokasi penelitian menunjukan perbedaan prevalensi. Prevalensi tertinggi Cestoda (Moniezia) dan Nematoda ditemukan di daerah Bogor (Tabel 4). Total prevalensi cacing gastrointestinal pada kerbau berdasarkan perbedaan lokasi penelitian, lebih besar ditemukan di daerah Bogor dibandingkan daerah Demak, Jawa Timur dan Lombok (Tabel 4). Tabel 4 Prevalensi cacing gastrointestinal berdasarkan lokasi penelitian
Cacing Gastrointestinal untuk perkembangan Cestoda. Cestoda memerlukan inang perantara untuk mencapai fase larva, yaitu tungau rumput. Jenis tungau rumput ini membutuhkan kondisi iklim yang cocok untuk keberadaannya yaitu antara 12-28 oC dengan kelembaban antara 85-100% (Narsapur 1988). Tungau akan tertelan oleh kerbau pada saat mencari pakan di padang rumput. Telur cestoda akan berkembang menjadi larva membutuhkan adanya suhu yang hangat dan kelembaban yang tinggi. Kondisi suhu yang baik untuk perkembangan telur Cestoda menjadi larva yaitu 25 oC (Narsapur 1988).
Nematoda merupakan cacing gastrointestinal yang tidak memerlukan inang perantara, sehingga untuk berlangsungnya siklus cacing lebih cepat (Southwell 2008). Nematoda dapat tumbuh dengan optimum pada curah hujan di atas 55 mm dengan suhu maksimum rata-rata di atas 18 oC (Levine 1994). Hal ini mempengaruhi tingginya tingkat intensitas pada infeksi cacing gastrointestinal Nematoda di Bogor (Tabel 4). Cacing gastrointestinal ini berkembang dengan baik pada musim hujan dibandingkan musim panas (Chiejina dan Fakae 1984; Pfukenyi et al. 2007).
Kondisi lingkungan yang baik mempengaruhi perkembangan tingkat infeksi cacing gastrointestinal.
Prevalensi dan Infestasi Cacing Gastrointestinal di Daerah Basah/Lembab dan Kering
Total prevalensi dan infestasi cacing gastrointestinal di daerah basah/lembab (Jawa Barat) memiliki prevalensi tertinggi sebesar 62.1%, dibandingkan dengan daerah kering (Jawa Tengah yaitu 53.3%, diikuti Lombok 50% dan Jawa Timur 35.1%). Sedangkan untuk perhitungan Faecal Eggs Count
Berdasarkan data prevalensi dan infestasi cacing gastrointestinal di daerah basah/lembab dan kering, bahwa daerah Bogor (Jawa Barat) memiliki prevalensi dan infestasi cacing lebih besar, dibandingkan dengan daerah kering yaitu di Demak (Jawa Tengah), Jawa Timur dan Lombok (NTB). Prevalensi dan infestasi daerah Bogor sebesar (62.1% dan 840 EPG), Jawa Tengah (53.3% dan 375 EPG), Jawa Timur (35.1% dan 570 EPG) dan Lombok (50% dan 135 EPG) (Tabel 5). Hal ini disebabkan karena perbedaan faktor lingkungan dan kondisi geografis. Data yang diperoleh melalui BMKG Darmaga (2014), bahwa curah hujan bulanan daerah Bogor antara bulan November 2013 sampai bulan Januari 2015 yaitu 186.9 mm, 407.7 mm dan 702 mm, dengan curah hujan bulanan rata-rata 432.2 mm dan suhu rata-rata 25.1 oC serta kelembaban rata-rata sebesar 84%. Curah hujan dan kelembaban bulanan ini termasuk dalam kategori sangat tinggi. Adanya curah hujan yang tinggi mempengaruhi keberadaan cacing gastrointestinal (Patel et al. 2015). Selain faktor lingkungan yang mempengaruhi adanya cacing gastrointestinal, faktor ketinggian juga mempengaruhi adanya cacing gastrointestinal (Kantzoura et al. 2012). Daerah Bogor memiliki ketinggian rata-rata 193.7 mdpl, sedangkan daerah lain rata-rata-rata-rata dibawah 100 mdpl (Tabel 3). Data ketinggian ini menunjukan bahwa daerah Bogor memiliki ketinggian yang berbeda dengan daerah lain pada penelitian ini. Ketinggian ini mempengaruhi kondisi lingkungannya, sehingga akan berdampak pada perkembangan cacing gastrointestinal.
Prevalensi Cacing Gastrointestinal Menurut Tingkatan Kerbau (Jenis Kelamin dan Umur)
17
10.5% dan nematoda 68.4%, sedangkan faktor umur lebih besar ditemukan pada umur < 1 tahun, yaitu untuk Moniezia sebesar 13.3% dan nematoda 66.6% (Tabel 6).
Tabel 6 Prevalensi cacing gastrointestinal berdasarkan jenis kelamin dan umur
Cacing
Infestasi Cacing Gastrointestinal Berdasarkan Faecal Eggs Count (FEC)
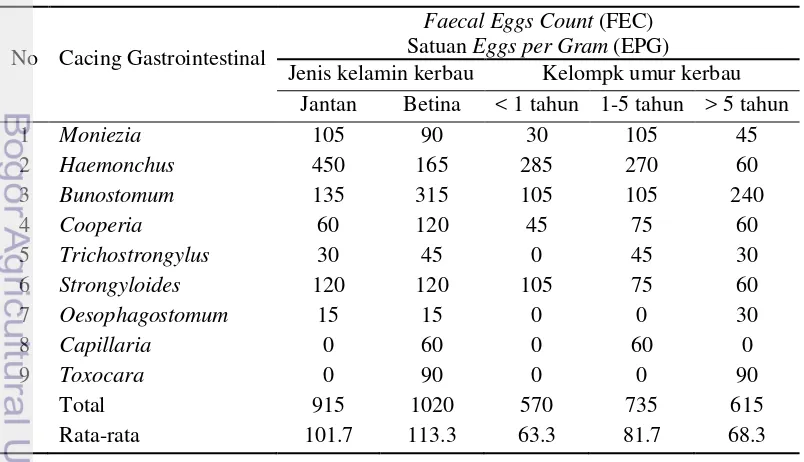
Tingkat infestasi cacing gastrointestinal berdasarkan perhitungan Faecal Eggs Count (FEC) pada jenis kelamin ditemukan lebih besar pada betina yaitu sebesar 1020 (r = 113.3) Eggs Per Gram (EPG) dan jantan hanya 900 (r = 100) EPG. Perhitungan FEC pada kelompok umur, ditemukan lebih besar di umur 1-5 tahun sebesar 735 (r = 81.7) EPG, diikuti umur > 5 tahun yaitu 615(r = 68.3) EPG dan umur < 1 tahun yaitu 570 (r = 63.3) EPG.
Tabel 7 Tingkat infestasi cacing gastrointestinal berdasarkan perhitungan Faecal Eggs Count (FEC)
No Cacing Gastrointestinal
Faecal Eggs Count (FEC)
Satuan Eggs per Gram (EPG)
Jenis kelamin kerbau Kelompk umur kerbau
Prevalensi Cacing Gastrointestinal Berdasarkan Faktor Jenis kelamin
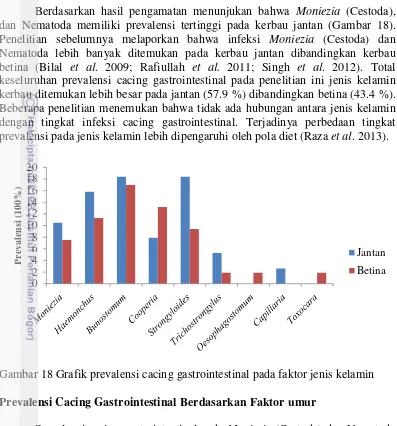
Berdasarkan hasil pengamatan menunjukan bahwa Moniezia (Cestoda), dan Nematoda memiliki prevalensi tertinggi pada kerbau jantan (Gambar 18). Penelitian sebelumnya melaporkan bahwa infeksi Moniezia (Cestoda) dan Nematoda lebih banyak ditemukan pada kerbau jantan dibandingkan kerbau betina (Bilal et al. 2009; Rafiullah et al. 2011; Singh et al. 2012). Total keseluruhan prevalensi cacing gastrointestinal pada penelitian ini jenis kelamin kerbau ditemukan lebih besar pada jantan (57.9 %) dibandingkan betina (43.4 %). Beberapa penelitian menemukan bahwa tidak ada hubungan antara jenis kelamin dengan tingkat infeksi cacing gastrointestinal. Terjadinya perbedaan tingkat prevalensi pada jenis kelamin lebih dipengaruhi oleh pola diet (Raza et al. 2013).
Gambar 18 Grafik prevalensi cacing gastrointestinal pada faktor jenis kelamin
Prevalensi Cacing Gastrointestinal Berdasarkan Faktor umur
Prevalensi cacing gastrointestinal pada Moniezia (Cestoda) dan Nematoda tertinggi ditemukan pada umur < 1 tahun (Gambar 19). Prevalensi tertinggi
Moniezia (Cestoda) dan Nematoda ditemukan pada kelompok umur masih muda
19
Gambar 19 Grafik prevalensi cacing gastrointestinal pada faktor umur
Umur merupakan salah satu faktor penting yang memiliki dampak serius terhadap prevalensi cacing gastrointestinal pada kerbau (Patel et al. 2015). Semua umur berisiko terinfeksi cacing gastrointestinal. Kelompok umur kerbau memiliki tingkat kekebalan terhadap cacing parasit yang berbeda, dikarenakan sistem kekebalan tubuh. Tingkat infeksi lebih tinggi pada ruminansia yang masih muda dibandingkan dengan ruminansia lebih dewasa. Hal ini disebabkan ruminansia masih muda memiliki perlawanan antibodi terhadap cacing gastrointestinal lebih rendah (Colditz et al. 1996; Khan et al. 2010). Infeksi cacing gastrointestinal pada kerbau berumur muda dapat terjadi akibat beberapa cara diantaranya adalah akibat terinfeksi oleh kerbau lain, sanitasi kandang yang kurang baik dan pemeliharaan dalam satu kandang dengan kerbau berumur yang lebih tua (Nugraha 2015).
Faecal Eggs Count (FEC)
Tingkat infestasi cacing gastrointestinal berdasarkan perhitungan Faecal Eggs Count (FEC) menunjukan lebih besar pada betina (r = 113.3 EPG) dibandingkan jantan (r = 101.7 EPG). Sedangkan untuk umur lebih besar ditemukan pada umur 1 - 5 tahun (r = 81.7 EPG), diikuti > 5 tahun (r = 68.3 EPG) dan < 1 tahun (63.3 EPG) (Tabel 7). Hal ini berbeda dengan hasil yang dilaporkan oleh Mamun et al. (2011), dimana kerbau jantan memiliki EPG tertinggi dibandingkan betina. Sedangkan untuk faktor umur lebih besar ditemukan pada umur 6 bulan sampai 2 tahun, dibandingkan umur 2 – 5 tahun dan > 5 tahun.
4 SIMPULAN
Jenis - jenis telur cacing gastrointestinal yang ditemukan dalam saluran pencernaan kerbau di Jawa ditemukan sembilan genus, yaitu Moniezia,
Haemonchus, Bunostomum, Cooperia, Strongyloides, Trichostrongylus, Oesophagostomum, Capillaria dan Toxocara, sedangkan untuk daerah Lombok ditemukan lima genus, yaitu Moniezia, Bunostomum, Cooperia, Strongyloides,
Trichostrongylus. Jenis larva yang ditemukan ada enam jenis yaitu Strongyloides, Haemonchus, Cooperia, Oesophagostomum, Bunostomum dan larva free living.
Ukuran morfologi telur cacing gastrointestinal yang ditemukan memiliki perbedaan ukuran panjang dan lebar. Prevalensi dan infestasi berdasarkan perbedaan kondisi geografis lebih besar ditemukan di daerah Bogor. Prevalensi cacing gastrointestinal pada jenis kelamin, lebih besar ditemukan di jantan dibandingkan betina, sedangkan untuk infestasi lebih besar ditemukan pada betina. Prevalensi cacing gastrointestinal pada faktor umur lebih besar ditemukan pada umur < 1 tahun, sedangkan infestasinya lebih besar ditemukan pada umur 1 – 5 tahun.
DAFTAR PUSTAKA
Afridi ZK, Khan K, Zaman G, Ullah S, Habibullah Q. 2007. Prevalence of gastro-intestinal nematode parasites of economic importance in dairy Buffaloes in Peshawar. Sarhad J Agric. 23(3): 787-792.
Bilal MQ, Hameed A, Ahmad T. 2009. Prevalence of gastrointestinal parasites in Buffalo and Cow calves in Rural areas of Toba Tek Singh, Pakistan. J Animal & Plant Scie. 19(2): 67-70.
Bukhari S, Sanyal PK. 2011. Epidemiological intelligence for grazing management in strategic control of parasitic gastroenteritis in small ruminants in India – a review. Vet World. 4(2): 92-96.
Badan Meterologi, Klimatologi dan Geofisika (BMKG) Stasiun Klimatologi Darmaga Bogor. 2014. Bogor (ID).
Chavhan PB, Khan LA, Raut PA, Maske DK, Rahman S, Podchalwar KS, Siddiqui MFMF. 2008. Prevalence of Nematoda parasites of Ruminants at Nagpur. Vet World. Vol (1): 140.
Chiejina SN, Fakae BB. 1984. Development and survival of infective larvae of gastrointestinal nematode parasites of cattle on pasture in eastern Nigeria.
Res Vet Scie. 37: 148-153.
Choubisa SL, Jaroli VJ. 2012. Gastrointestinal parasitic infection in diverse species of domestic ruminants inhabiting tribal rural areas of southern Rajasthan, India. J Parasit Dis.
Cringoli G, Rinaldi L, Veneziano V, Capelli G, Scala A. 2004. The influence of flotation solution, sample dilution and the choice of McMaster slide area (volume) on the reliability of the McMaster technique in estimating the faecal egg counts of gastrointestinal strongyles and Dicrocoelium dendriticum in sheep. Vet Parasitol. 123(1-2): 121–131.
Colditz IG, Watson DL, Gray GD, Eady SJ. 1996. Some relationship between age, Immune responsiveness and resistance to parasite in ruminant. Int J Parasitol. 26 (8/9): 869-877.
Dijk JV, Sargison ND, Kenyon F, Skuce PJ. 2010. Climate change and infectious disease: helminthological challenges to farmed ruminants in temperate regions. Animal. 4(3): 377–392.
21
Foreyt WJ. 2001. Veterinary Parasitology Reference Manual. Amerika Serikat (US). Blackwell Publishing.
Griffiths HJ. 1978. A Handbook Of Veterinary Parasitology Domestic Animals Of North America. Amerika Serikat (US). University of Minnesota Press. Hutchinson, Gareth W. 2009. Nematode Parasites of Small Ruminants, Camelids,
and Cattle Diagnosis with Emphasis of Anthelmintic Efifacy and Resistance Testing. Australia: Woodbridge Road, Menangle.
Kantzoura V, Kouam MK, Theodoropoulou H, Feidas H. 2012. Prevalence and Risk Factors of Gastrointestinal Parasitic Infections in Small Ruminants in the Greek Temperate Mediterranean Environment. Open J Vet Medicine. 2(1):25-33.
Khan MN, Sajid MS, Kasib MK, Iqbal Z, Hussain A. 2010. Gastrointestinal helminthiasis: prevalence and associated determinants in domestic ruminants of district Toba Tek Singh, Punjab, Pakistan. Parasitol Res.
107(4): 787-794.
Levine ND. 1994. Parasitology Veteriner. Yogyakarta (ID). Gajah Mada University Press.
Mamun MAA, Begum N, Mondal MMH. 2011. A coprological survey of gastro-intestinal parasites of water buffaloes (Bubalus bubalis) in Kurigram district of Bangladesh. J Bangladesh Agril Univ. 9(1):103-109.
Miller JE, Horohov DW. 2006. Immunological aspects of nematode parasite control in sheep. J Anim Sci. 84(13):124-132.
Narsapur VS. 1988. Pathogenisis and biology of Anoplocephaline cestodes of domestic animals. Ann Rec Vet. 19 (1): 1-17.
Nugraha AB. 2015. Kajian Prevalensi dan Faktor Risiko Kriptosporidiosis pada Peternakan Sapi Perah di Kabupaten Bogor [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Patel HC, Hasnani JJ, Patel PV, Pandya SS, Solanki JB, Jadav SJ. 2015. A study on helminth parasites of buffaloes brought to ahmedabad slaughter house , Gujarat , India. Vet Parasitol. 5(1).
Pfukenyi DM, Mukaratirwa S, Willingham AL, Monrad J. 2007. Epidemiological studies of parasitic gastrointestinal nematodes, cestodes and coccidia infections in cattle in the highveld and lowveld communal grazing areas of Zimbabwe. Onderstepoort J Vet Research. 74(2): 129–142.
Rafiullah, Turi AA, Sajid A, Shah SR, Ahmad S, Shahid M. 2011. Prevalence of gastrointestinal tract parasites in Cattle of Khyber Pakhtunkhwa. J Agr Bio Scie. 6(9).
Raza MA, Iqbal Z, Jabbar A, Yassen M. 2007. Point prevalence of gastrointestinal helminthiasis in ruminants in southern Punjab, pakistan. J Helmin.
81(3):323-328.
Raza MA, Murtaza S, Ayaz MM, Akhtar SM. 2013. Toxocara vitulorum
infestation and associated risk factors in Cattle and Buffalo at multan District, Pakistan. Sci Int (Lahore). 25 (2): 291-294.
Raza MA, Murtaza S, Ayaz MM, Murtaza S, Akhtar SM. 2013. Prevalence of GIT helminths in Cattle at the vicinities of Tehsil Jatoi, Punjab, Pakistan.
Rehman TU, Khan MN, Sajid MS, Abbas RZ, Arshad M, Iqbal Z, Iqbal A. 2011. Epidemiology of Eimeria and associated risk factors in cattle of district Toba Tek Singh, Pakistan. Parasitol. Res. 108: 1171-1177.
Rinaldi L, Musella V, Veneziano V, Condelo RU, Cringoli G. 2009. Helmintic infections in water buffaloes on Italian farms: a spatial analysis. Geospatial Health. 3(2): 233-239.
Roza E. 1991. Pengaruh Ketinggian Tempat Terhadap Pertumbuhan kambing Kacang di Sumatera Barat [Tesis]. Bogor (ID): Institut Pertanian Bogor. Saverwyns H. 2008. Study of Ostertagia ostertagi excretory-secretory product.
Faculty of Veterinary Medicine. Ghent University.
Sahinduran S. 2012. Protozoan Diseases in Farm Ruminants, A Bird's-Eye View of Veterinary Medicine. Carlos C, Marin P, editor. Akif Ersoy (TR). Published InTech.
Shah MM. 2012. Parasitology. Janeza Trdine and Rijeka (CR). Published InTech. Shorb DA. 1939. Differentations of Eggs of Various Genera of Nematodes
Parasitic in Domestic Ruminant in the United States. Tec Bulletin No.694. Singh NK, Harkirat S, Jyoti, Haque M, Rath SS. 2012. Prevalence of parasitic
infections in buffaloes in and around Ludhiana District, Punjab, India: a preliminary study. J Buffalo Scie. 1(1):113-115.
Soulsby, EJL. 1982. Helminths, Arthropods, and Protozoa of Domesticated Animal. Amerika Serikat (US). Academic Press.
Southwell, Jason, Fisk C, Sallur N. 2008. Internal Parasite Control in Sheep Reference Manual. Deborah Maxwell, DPI, and Queensland F, editor. South Wales (GB). Sheep CRC.
Waller, PJ. 2003. Domestication of ruminant livestock and the impact of nematode parasites: possible implications for the reindeer industry.
Rangifer. 25 (1):39-50.
Wyk JAV, Mayhew E. 2013. Morphological identification of parasitic nematode infective larvae of small ruminants and cattle: A practical lab guide.
Onderstepoort J of Vet Res 80(1):14-539.
23
LAMPIRAN
Tabel 1 Ukuran panjang dan lebar telur cacing gastrointestinal di Bogor
No Cacing GI Bogor
Min (µm) Mak (µm) Rata-rata (µm)
1 Moniezia 28.63 51.47 42.03
2 Haemonchus 64.97x37.84 74.70x49.01 69.74x44.66
3 Bunostomum 98.33x54.18 116.85x60.13 107.69x56.80
4 Cooperia 68.11x36.10 69.52x37.86 68.81x36.37
5 Strongyloides 46.14x19.76 59.03x32.90 51.51x25.89
6 Trichostrongylus 85.84x47.23 85.84x47.23 85.84x47.23
7 Oesophagostomum 85.60x38.23 85.60x38.23 85.60x38.23
Tabel 2 Ukuran panjang dan lebar telur cacing gastrointestinal di Demak
No Cacing GI Demak
Min (µm) Mak (µm) Rata-rata (µm)
1 Moniezia 48.02 48.02 48.02
2 Haemonchus 61.98x35.61 76.81x45.65 67.39x39.74
3 Bunostomum 87.03x43.97 110.63x58.12 95.54x53.98
4 Cooperia 73.79x32.68 81.47x38.09 76.64x35.99
5 Strongyloides 51.95x25.72 51.95x25.72 51.95x25.72
6 Oesophagostomum 67.52x35.31 67.52x35.31 67.52x35.31
Tabel 3 Ukuran panjang dan lebar telur cacing gastrointestinal di Jawa Timur
No Cacing GI Jawa Timur
Min (µm) Mak (µm) Rata-rata (µm)
1 Moniezia 44.01 60.79 54.52
2 Haemonchus 63.61x36.82 85.01x54.29 69.49x41.67
3 Bunostomum 96.16x44.16 119.36x68.79 107.11x52.58
4 Cooperia 84.28x36.56 85.37x38.71 84.82x37.64
5 Strongyloides 45.61x22.48 53.86x34.13 48.99x31.18
6 Trichostrongylus 70.03x38.67 85.55x43.65 77.79x41.16
7 Capillaria 48.05x21.78 51.26x23.74 49.46x22.76
Tabel 4 Ukuran panjang dan lebar telur cacing gastrointestinal di Lombok
No Cacing GI Lombok
Min (µm) Max (µm) Rata-rata (µm)
1 Moniezia 43.18 47.90 47.27
2 Bunostomum 107.05x50.24 128.12x60.62 116.74x56.03
3 Cooperia 74.16x35.10 82.27x35.71 78.22x35.46
4 Strongyloides 50.71x31.21 65.03x34.21 57.87x32.21
5 Trichostrongylus 71.96x36.37 71.96x36.37 71.96x36.37
Tabel 5 Perbandingan ukuran telur cacing gastrointestinal diseluruh lokasi
Cacing GI Jumlah
telur
Ukuran telur
Kisaran Diameter Panjang Lebar
X±SD X±SD X±SD
Moniezia 21 0-50 45.38±6.38
Strongyloides 21 0-50 47.88±9.88 31.85±9.31
Capillaria 10 0-50 49.46±1.36 22.86±0.94
Haemonchus 33 0-100 69.03±4.80 42.41±4.73
Cooperia 10 0-100 76.74±6.99 36.57±1.94
Trichostrongylus 6 0-100 79.50±7.30 42.39±4.47
Oesophagostomum 3 0-100 74.86±6.49 36.85±1.47
Toxocara 3 0-100 73.84±1.46 67.96±1.41
25
RIWAYAT HIDUP
Penulis dilahirkan di Desa Poroan, Kecamatan Lamala Kabupaten Banggai, Provinsi Sulawesi Tengah pada tanggal 30 Oktober 1987 dari pasangan Bapak Patahudin Abd. Karim dan Ibu Atiah Gilim. Penulis merupakan putra terakhir dari lima bersaudara.