POTENSI BERAS PUTIH (Oryza sativa), BERAS HITAM (O.
sativa L. indica), DAN BERAS MERAH (O. nivara) SEBAGAI
ANTIOKSIDAN DAN INHIBITOR TIROSINASE
MEILISA MAHARNI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Potensi Beras Putih (Oryza sativa), Beras Hitam (O. sativa L. indica), dan Beras Merah (O. nivara) sebagai Antioksidan dan Inhibitor Tirosinase adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari skripsi saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Meilisa Maharni
ABSTRAK
MEILISA MAHARNI. Potensi Beras Putih (Oryza sativa), Beras Hitam (O. sativa L. indica), dan Beras Merah (O. nivara) sebagai Antioksidan dan Inhibitor Tirosinase. Dibimbing oleh IRMANIDA BATUBARA dan SITI SA’DIAH.
Beras diketahui memiliki banyak aktivitas hayati bermanfaat dan sering digunakan sebagai bedak dingin pada wajah. Kandungan vitamin, mineral, serat, dan beberapa jenis antioksidan, seperti asam ferulat, asam fitat, tokoferol, dan orizanol diduga berpotensi sebagai inhibitor tirosinase. Tujuan penelitian ini adalah menentukan potensi ekstrak dari berbagai jenis beras, yaitu beras putih, beras merah, dan beras hitam sebagai antioksidan dan inhibitor tirosinase dengan pelarut pengekstraksi n-heksana, etil asetat, dan metanol. Ekstrak beras yang memiliki aktivitas antioksidan tertinggi dengan metode 1,1-difenil-2-pikrilhidrazil adalah ekstrak metanol beras hitam (IC50 290 µg/mL) dan ekstrak etil asetat beras putih memiliki aktivitas antioksidan tertinggi dengan metode fosfomolibdat (41 mmol α-tokoferol ekuivalen/g sampel). Jadi, ekstrak metanol beras hitam dan ekstrak etil asetat beras putih berpotensi sebagai antioksidan, sedangkan ekstrak beras yang memiliki aktivitas inhibitor tirosinase tertinggi adalah ekstrak n -heksana beras merah pada monofelase (3156 µg/ml).
Kata kunci: antioksidan, beras, inhibitor tirosinase
ABSTRACT
MEILISA MAHARNI. The potency of White Rice (Oryza sativa), Black Rice (O. sativa L. indica), and Red Rice (O. nivara) as Antioxidant and Tyrosinase Inhibitor. Supervised by IRMANIDA BATUBARA and SITI SA’DIAH.
Rice is known to have many beneficial biological activities and is often used as “bedak dingin”, a powder put. The content of vitamins, minerals, fiber, and several types of antioxidants, such as ferulic acid, phytic acid, tocopherol, and oryzanols are predicted to be potential as a tyrosinase inhibitor. The purpose of this study is to determine the potency of extracts from there types of rice, namely white, red, and black rice as an antioxidant and tyrosinase inhibitor by using n -hexane, ethyl acetate, and methanol. Rice extract that has the highest antioxidant activity using 1,1-diphenyl-2-picrylhydrazyl method is the methanol extract of black rice (IC50 290 µg/mL). Meanwhile, ethyl acetate extract of white rice has the highest antioxidant activity with fosfomolibdat method (41 mmol α-tocopherol equivalents/g sample). Thus, methanol extract of black rice and ethyl acetate extract of white rice are potential as an antioxidant, whereas the highest extract as tyrosinase inhibitor is n-hexane extract of red rice (IC50 3156 µg/mL).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
POTENSI BERAS PUTIH (Oryza sativa), BERAS HITAM (O.
sativa L. indica), DAN BERAS MERAH (O. nivara) SEBAGAI
ANTIOKSIDAN DAN INHIBITOR TIROSINASE
MEILISA MAHARNI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur Penulis panjatkan atas segala karunia kesehatan dan kemudahan yang dilimpahkan oleh Allah SWT selama proses penyusunan skripsi dengan judul “Potensi Beras Putih (Oryza sativa), Beras Hitam (O. sativa L. indica), dan Beras Merah (O. nivara) sebagai Antioksidan dan Inhibitor Tirosinase“. Skripsi ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Maret 2014 hingga April 2015 di Laboratorium Kimia Analitik, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB) dan Pusat Studi Biofarmaka IPB, Bogor.
Penulis mengucapkan terima kasih kepada Dr Irmanida Batubara, MSi dan Siti Sadiah, MSi, Apt selaku pembimbing yang telah memberikan arahan, bimbingan, motivasi, dan doa selama penelitian. Disamping itu, penulis juga mengucapkan terima kasih kepada seluruh laboran Kimia Analitik dan PSB atas bantuannya selama penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, keluarga, serta sahabat saya khususnya Ajeng, Herdi, Lily, Nanda, Kak Apit, Gemilang, Fahmi, Ami, dan Anis selaku teman seperjuangan atas segala doa dan dukungannya baik secara akademik maupun teknis. Semoga Allah SWT memberikan balasan atas segala amal yang diperbuat dan senantiasa menyertai hamba-Nya dengan kasih dan sayang-Nya.
Semoga skripsi ini bermanfaat bagi penulis dan yang membacanya.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Waktu dan Tempat Penelitian 2
METODE 2
Alat dan Bahan 2
Metode Penelitian 2
HASIL DAN PEMBAHASAN 6
Penentuan Kadar Air dan Kadar Abu 6
Ekstraksi Bertingkat 6
Fitokimia 7
Aktivitas Inhibitor Tirosinase Ekstrak Kasar Beras Hitam, Beras Merah, dan
Beras Putih 8
Aktivitas Antioksidan 9
Penentuan Eluen Terbaik 11
KLT Bioautografi 12
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
LAMPIRAN 17
DAFTAR GAMBAR
1 Kromatogram penentuan eluen terbaik ekstrak metanol beras hitam dengan pelarut 1. n-heksana; 2. toluena; 3. aseton; 4. kloroform; 5.diklorometana; 6. n-butanol; 7. dietil eter; 8. etil asetat; 9. metanol; dan 10. asam asetat dideteksi pada =254 nm dan 366 nm 11 2 Kromatogram penentuan eluen terbaik ekstrak metanol beras hitam
dengan pelarut metanol:kloroform pada berbagai perbandingan 11 3 Kromatogram KLT bioautografi; (a) sebelum penyemprotan pada
=366 (b) deteksi menggunakan pereaksi DPPH (c) deteksi menggunakan fosfomolibdat (1) asam askorbat (2) ekstrak metanol
beras hitam 12
4 Kromatogram KLT uji flavonoid; (a) sebelum penyemprotan pada =366 (b) setelah penyemprotan dengan AlCl3 pada =366 (1) kuersetin (2) ekstrak metanol beras hitam) 14 5 Kromatogram KLT uji triterpenoid; (a) sebelum penyemprotan pada
=366 (b) sebelum penyemprotan pada sinar tampak (c) setelah
penyemprotan dengan Liebermann-Buchard pada =366 (1) asiatikosida (2) ekstrak metanol beras hitam 14
DAFTAR LAMPIRAN
1 Diagram alir penelitian 17
2 Contoh perhitungan kadar air beras hitam, beras merah, dan beras
putih 18
3 Contoh perhitungan kadar abu beras hitam, beras merah, dan beras
putih 18
DAFTAR GAMBAR
5 Diagram alir penelitian 17
6 Contoh perhitungan kadar air beras hitam, beras merah, dan beras
putih 18
7 Contoh perhitungan kadar abu beras hitam, beras merah, dan beras
putih 18
8 Contoh perhitungan rendemen ekstrak beras hitam 18 9 Contoh perhitungan IC50 aktivitas inhibitor tirosinase ekstrak
n-heksana beras hitam Error! Bookmark not defined.
10 Contoh perhitungan aktivitas antiioksidan fosfomolibdat ekstrak
beras Error! Bookmark not defined.
PENDAHULUAN
Latar Belakang
Beras merupakan bahan pangan pokok bagi sebagian besar penduduk Indonesia dan merupakan komponen penting dalam sistem ketahanan pangan nasional. Selain menjadi bahan makanan pokok, dari zaman dahulu nenek moyang kita juga menggunakan beras untuk memenuhi kebutuhan nutrisi pada kulit dan dipercaya memutihkan kulit wajah dan tubuh. Pada zaman belum dikenal banyak produk yang dapat dimanfaatkan untuk kecantikan, masyarakat sudah menggunakan bahan alami yang disediakan oleh alam, salah satunya adalah beras. Beras tidak hanya merupakan sumber energi dan protein saja, tapi juga merupakan sumber vitamin, mineral, serat, dan beberapa jenis antioksidan, seperti asam ferulat, asam fitat, tokoferol, dan orizanol (Soi-ampornkul et al. 2010).
Dewasa ini penggunaan beras sebagai pemutih sangat banyak digunakan di pasaran, terutama beras Jepang. Padahal di Indonesia, beras telah digunakan sebagai pemutih secara tradisional secara turun-temurun di berbagai daerah seperti Sumatera, Banjar, Madiun, Medan, dan daerah lain di Indonesia. Masyarakat di daerah tersebut percaya bahwa bedak beras berkhasiat memutihkan dan menghaluskan kulit terutama pada wajah. Bedak beras atau bedak dingin secara tradisional umumnya dibuat dari beras putih dengan campuran berbagai jenis ekstrak misalnya ekstrak lemon, minyak zaitun, ekstrak bunga melati, bunga mawar, sirih merah, kenanga, sedap malam, cempaka, dan lain-lain sesuai dengan kebiasaan daerah masing-masing (Femina 2013).
Beras sebagai substrat memiliki beberapa macam warna yang berbeda secara genetik, yaitu beras putih, beras merah, dan beras hitam. Masing-masing beras tersebut mengandung manfaat yang berbeda-beda. Selain sebagai sumber utama karbohidrat, beras terutama beras merah juga mengandung protein, beta-karoten, zat besi, dan antioksidan (Frei 2004). Antioksidan merupakan senyawa yang mampu menunda, memperlambat, atau menghambat reaksi oksidasi (Pokorny et al. 2001). Zat ini mampu memperlambat atau menghambat oksidasi zat yang mudah teroksidasi meskipun dalam konsentrasi rendah. Senyawa antioksidan dapat melindungi sel dari efek berbahaya yang disebabkan radikal bebas. Radikal bebas ini berasal dari metabolisme tubuh maupun dari luar tubuh (Halliwell B et al. 1995).
2
Tujuan Penelitian
Penelitian ini bertujuan menentukan potensi berbagai jenis beras, yaitu beras putih, beras merah, dan beras hitam sebagai antioksidan dan inhibitor tirosinase.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Maret 2014 hingga April 2015 di Laboratorium Kimia Analitik Departemen Kimia FMIPA Institut Pertanian Bogor dan Laboratorium Pusat Studi Biofarmaka LPPM IPB.
METODE
Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini antara lain oven, neraca analitik, eksikator, pelat kromatografi lapis tipis (KLT), kolom, lampu ultraviolet (UV), pelat tetes/sumur, pelat kaca, multi well plate reader dan spektrofotometer UV-Vis serta berbagai macam alat kaca. Bahan-bahan yang digunakan antara lain sampel beras merah, beras hitam, dan beras putih, n-heksana, dietil eter, n-butanol, metanol, asam asetat, diklorometana, etil asetat, aseton, toluena, kloroform, dimetil sulfoksida (DMSO), buffer fosfat pH 6.5, NH4OH, H2SO4 2 M, pereaksi Mayer, Wagner, Dragendorf, amil alkohol, DPPH, fosfomolibdat, HCl 37%, etanol 95%, FeCl3, asam kojat, silika gel, L-DOPA, L-tirosina, dan enzim tirosinase (Sigma, 333 unit/mL dalam bufer fosfat).
Metode Penelitian
Metode penelitian yang dilakukan meliputi beberapa tahap, yaitu preparasi sampel, ekstraksi bertingkat, uji fitokimia, uji aktivitas, dan KLT bioautografi. Sampel beras putih, beras merah, dan beras hitam dikeringkan terlebih dahulu lalu digiling agar diperoleh sampel berbentuk bubuk. Bubuk sampel kemudian diuji kadar air dan kadar abunya (AOAC 2006). Sampel bubuk diekstraksi dengan ekstraksi bertingkat menggunakan pelarut n-heksana, etil asetat, dan metanol. Ekstrak kasar diuji fitokimia (Harborne 1987), antioksidan (Salazar-Alandra 2009), dan inhibitor tirosinase (Batubara et al. 2010). Penentuan eluen terbaik dilakukan pada ekstrak yang memiliki aktivitas teraktif diantara ekstrak kasar pada uji awal. Penentuan eluen terbaik dilakukan menggunakan KLT. Ekstrak teraktif selanjutnya diindentifikasi dengan KLT Bioautografi.
Preparasi Sampel
3
Penentuan Kadar Air (AOAC 2006)
Cawan porselin dikeringkan pada suhu 105°C selama 30 menit, kemudian didinginkan dalam eksikator dan setelah itu ditimbang. Sebanyak 3 g masing-masing sampel serbuk beras putih, beras hitam, dan beras merah dimasukkan ke cawan dan dipanaskan pada suhu 105°C selama 5 jam, lalu didinginkan dalam eksikator. Bobot dari sampel bubuk ditimbang hingga diperoleh hasil konstan. Penentuan kadar air dilakukan 3 kali ulangan. Kadar air dapat ditentukan dengan rumus sebagai berikut.
adar air ( ) =A BA 100
Keterangan:
A = Bobot contoh sebelum dikeringkan (g) B = Bobot contoh setelah dikeringkan (g)
Penentuan Kadar Abu (AOAC 2006)
Selama 30 menit cawan porselen dikeringkan dalam tanur pada suhu 600oC dan kemudian didinginkan dalam eksikator selama 30 menit dan ditimbang guna menentukan bobot kosong cawan porselen (g). Sebanyak 1 g sampel dimasukkan ke dalam cawan porselen. Sampel dibakar menggunakan pembakar Bunsen hingga tidak terlihat asap muncul saat pembakaran. Setelah itu, cawan porselen yang telah berisi sampel yang telah dibakar dimasukkan ke dalam tanur dengan suhu 600oC selama 30 menit dan kemudian didinginkan di dalam eksikator selama 30 menit dan kemudian ditimbang sehingga dapat ditentukan bobot abu sampel
z = bobot cawan dan bahan setelah diabukan (g)
Ekstraksi Bertingkat Ekstrak Beras Putih, Beras Merah, dan Beras Hitam (BPOM 2004)
4
Uji Fitokimia (Harborne 1987)
Ekstrak dari berbagai pelarut diuji fitokimia untuk mengetahui senyawa yang terkandung dalam ekstrak. Uji dilakukan dengan menggunakan reagen yang sesuai.
Uji Alkaloid. Sebanyak 0.1 g ekstrak dilarutkan dalam 10 mL CHCl3 dan 4 tetes NH4OH. Larutan disaring dan filtratnya dimasukkan ke dalam tabung reaksi tertutup. Ekstrak CHCl3 dalam tabung reaksi dikocok dengan 10 tetes H2SO4 2 M dan lapisan asamnya dipisahkan ke dalam tabung reaksi lainnya. Lapisan asam ini diteteskan pada lempeng tetes dan ditambahkan pereaksi Mayer, Wagner, dan Dragendorf yang akan menimbulkan endapan berturut-turut berwarna putih, cokelat, dan merah jingga jika terdapat alkaloid.
Uji Saponin dan flavonoid. Beberapa gram ekstrak ditambahkan 100 mL air panas dan dididihkan selama 5 menit. Kemudian disaring dan filtratnya digunakan untuk uji saponin dengan menambahkan sebanyak 10 mL filtrat kedalam tabung reaksi dan dikocok selama 10 menit. Keberadaan saponin ditunjukkan dengan terbentuknya buih yang stabil pada larutan. Sebanyak 10 mL dari sisa filtrat dimasukkan kedalam tabung reaksi, kemudian ditambahkan 0.5 g serbuk Mg, 2 mL alkohol klorhidrat (campuran HCl 37% dan etanol 95% dengan perbandingan volume yang sama) dan 20 mL amil alkohol, kemudian dikocok. Keberadaan flavonoid detunjukkan oleh warna kuning atau jingga pada lapisan amil alkohol.
Uji Triterpenoid dan steroid. Beberapa gram ekstrak dilarutkan dengan 25 mL etanol panas (50°C), larutan kemudian disaring ke dalam pinggan porselin dan diuapkan sampai kering. Residu ditambahkan eter, kemudian ekstrak eter dipindahkan ke dalam lempeng tetes. Ekstrak eter ditambahkan 3 tetes anhidrida asetat dan 1 tetes H2SO4 pekat (uji Liebermann-Buchard). Hasil positif terhadap triterpenoid ditunjukkan oleh warna merah atau ungu, sedangkan steroid ditunjukkan oleh warna hijau atau biru.
Uji Tanin. Beberapa gram ekstrak ditambahkan 10 mL air panas, dididihkan selama 5 menit dan kemudian disaring. Filtrat yang diperoleh ditambahkan larutan FeCl3 1%. Hasil positif terhadap tanin ditunjukkan oleh warna hijau kehitaman.
Uji Aktivitas Antioksidan Fosfomolibdat ( Zarai et al. 2013)
Sampel dilarutkan dalam etanol 96% ke dalam tabung reaksi, kemudian ditambahkan pereaksi fosfomolibdat (0.6 M asam sulfat, 28mM natrium fosfat, dan 4 mM amonium molibdat). Tabung reaksi ditutup dan diinkubasi dalam water bath pada suhu 95°C selama 90 menit. Campuran sampel tersebut didinginkan pada suhu kamar dan absorbans diukur pada panjang gelombang 695 nm. BHT digunakan sebagai standar. Aktivitas antioksidan dinyatakan sebagai ekuivalen α-tokoferol berdasarkan persamaan berikut:
Absorbans = Keterangan
5
Uji Aktivitas Antioksidan DPPH (Salazar-Alandra 2009)
Sampel dilarutkan dalam etanol 96% dan dibuat dengan rentang konsentrasi tertentu. Sebanyak 100 μL larutan ekstrak DPPH 125 μM dalam etanol 96% ditambahkan ke dalam 100 μL larutan sampel sehingga volume total menjadi 200 μL. Campuran diinkubasi pada suhu 37°C selama 30 menit. Serapan kemudian diukur pada panjang gelombang 517 nm menggunakan multi-well plate reader. Kontrol positif dalam uji ini adalah asam askorbat. Aktivitas inhibisi ditentukan berdasarkan persamaan berikut:
Inhibisi =1 A blanko A sampelA blanko 100
Keterangan
A sampel adalah absorbans sampel A blangko adalah absorbans etanol
Uji Aktivitas Inhibitor Tirosinase (Batubara et al. 2010)
Ekstrak dilarutkan dalam larutan DMSO hingga konsentrasi 20 mg/mL, larutan stok ekstrak kemudian disiapkan dengan cara melarutkan ekstrak pekat ke dalam buffer fosfat 50 mM (pH 6,5) sehingga diperoleh konsentrasi 600 g/mL. Setelah itu, ekstrak diuji mulai konsentrasi 7,8-2000 g/mL dan asam kojat sebagai kontrol positif yang juga diuji pada konsentrasi 7,8-2000 g/mL dalam pelat tetes λ6 sumur. Sebanyak 70 L dari masing-masing ekstrak pengenceran ini ditambahkan dengan 30 L enzim tirosinase (Sigma 333 unit/mL dalam buffer fosfat), setelah itu dilakukan inkubasi pada suhu kamar selama 5 menit. Kemudian ditambahkan 110 L substrat(2 mM L-tirosin atau 12 mM L-dopa) ke dalam tiap lubang multi-well plate, campuran diinkubasi selama 30 menit pada suhu kamar. Campuran diukur dengan menggunakan multi-well plate reader pada panjang gelombang 492 nm, hal ini bertujuan untuk menentukan persen inhibisi dan nilai konsentrasi hambat 50% (IC50). Persentase inhibisi dihitung dengan cara membandingkan serapan sampel tanpa penambahan ekstrak dan sampel dengan penambahan ekstrak. Nilai IC50 diperoleh dari persamaan kurva regresi linier antara % inhibisi (sebagai sumbu y) dan konsentrasi ekstrak (sebagai sumbu x).
% inhibisi = A – B x 100
A
Keterangan
A = absorbans pada 492 nm tanpa ekstrak
6
Penentuan Eluen Terbaik
Penentuan eluen terbaik dengan KLT dilakukan pada ekstrak beras yang memiliki aktivitas inhibisi terbaik. Ekstrak ditotolkan pada pelat KLT. Setelah kering, pelat KLT langsung dielusi dengan eluen tunggal, yaitu n-heksana, dietil eter, n-butanol, metanol, asam asetat, diklorometana, etil asetat, aseton, toluena, dan kloroform. Pelat yang telah kering selanjutnya diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm. Eluen terbaik dilihat dari banyaknya jumlah spot yang teramati. Jika dengan dihasilkan pada beberapa pelarut menunjukkan jumlah spot yang sama banyak, maka dilakukan penentuan eluen terbaik dengan campuran eluen terbaik dengan perbandingan tertentu dari masing-masing eluen tunggal.
KLT bioautografi (Marston 2011)
Pelat KLT berisi sampel dan asam askorbat yang telah dielusi dengan eluen terbaiknya disemprot dengan pereaksi semprot. Setelah 30 menit, pelat KLT diamati perubahan warnanya.
HASIL DAN PEMBAHASAN
Penentuan Kadar Air dan Kadar Abu
Penentuan kadar air berguna untuk menyatakan kandungan zat dalam tumbuhan sebagai persen bahan keringnya. Selain itu, penentuan kadar air dilakukan untuk mengetahui ketahanan tumbuhan terhadap jamur dan mikroba, sehingga dapat diperkirakan cara penyimpanan terbaiknya (Harjadi 1993). Kandungan air pada beras hitam, beras merah, dan beras putih sebesar 12.23 %, 13.15 %, dan 11.55 %. Hal ini menunjukkan bahwa sampel tersebut tidak dapat disimpan dalam waktu lama, karena kadar air sampel lebih besar dari 10%. Kestabilan optimum bahan akan tercapai bila kadar air suatu tumbuhan kurang dari 10%, sehingga pertumbuhan mikroba dapat dikurangi (Winarno 2002). Namun sampel beras tersebut memiliki mutu yang baik sesuai SNI (2008), karena kadar air maksimum beras yang memiliki mutu baik menurut SNI (2008) adalah 14%.
Penentuan kadar abu merupakan salah satu cara untuk menentukan adanya mineral atau senyawa anorganik dalam suatu bahan. Kadar abu beras hitam, beras merah, dan beras putih sebesar 2.63 %, 8.59 %, dan 7.46 %. Kadar abu beras hitam lebih kecil dibandingkan dengan beras merah dan beras putih. Hal ini menunjukkan bahwa kandungan mineral sebagai senyawa anorganik yang tertinggal dalam bentuk abu pada beras hitam lebih sedikit daripada beras merah dan beras putih.. Hasil perhitungan kadar air dan kadar abu dapat dilihat pada Lampiran 2 dan 3.
Ekstraksi Bertingkat
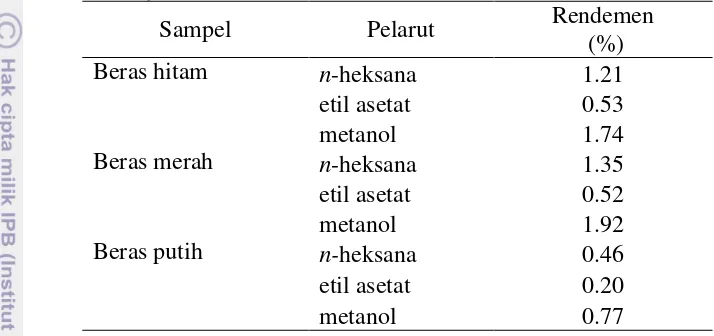
7 akan tetapi dapat menjaga kandungan senyawa dalam sampel yang tidak tahan panas tidak rusak dan dapat diekstrak dalam jumlah yang banyak. Ekstraksi sampel beras hitam, beras merah, dan beras putih masing-masing menggunakan pelarut n-heksana, etil asetat, dan metanol. Pemilihan pelarut ini berdasarkan peningkatan kepolaran. Rendemen ekstraksi dapat dilihat pada Tabel 1.
Tabel 1 Rendemen ekstraksi beras hitam, beras merah, dan beras putih dengan
Perbedaan tingkat kepolaran pelarut menghasilkan rendemen ekstrak yang berbeda-beda. Ekstrak metanol pada setiap sampel beras memiliki rendemen yang paling besar dibandingkan ekstrak lain (Tabel 1). Hal ini menunjukkan bahwa senyawa aktif yang terkandung dalam beras dapat tersari dalam pelarut metanol dengan baik dibandingkan dengan pelarut n-heksana dan etil asetat. Harborne (1987) menyatakan bahwa pelarut metanol dapat mengikat senyawa polar dan non polar. Sedangkan pelarut etil asetat memiliki rendemen yang paling sedikit dikarenakan sedikitnya senyawa aktif pada beras yang bersifat semi polar. Hasil perhitungan dapat dilihat pada Lampiran 4.
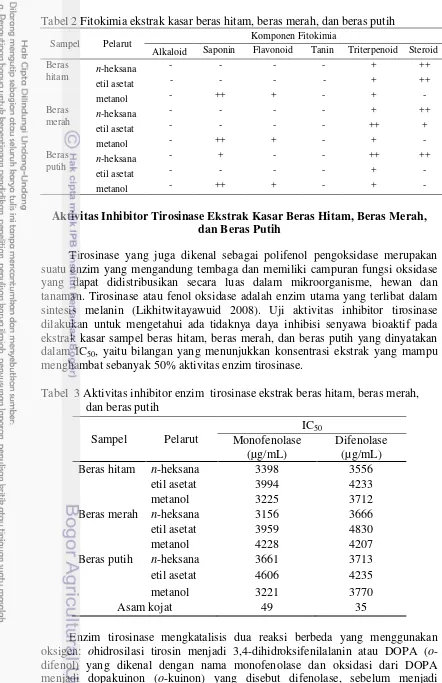
Fitokimia
Analisis fitokimia adalah salah satu cara untuk mengetahui kandungan metabolit sekunder pada suatu tanaman. Analisis fitokimia dilakukan pada ekstrak kasar n-heksana, etil asetat, dan metanol beras hitam, beras merah, dan beras putih. Senyawa yang diuji adalah alkaloid, saponin, tanin, flavonoid, triterpenoid, dan steroid.
8
Tabel 2 Fitokimia ekstrak kasar beras hitam, beras merah, dan beras putih
Sampel Pelarut Komponen Fitokimia
Alkaloid Saponin Flavonoid Tanin Triterpenoid Steroid Beras
Aktivitas Inhibitor Tirosinase Ekstrak Kasar Beras Hitam, Beras Merah, dan Beras Putih
Tirosinase yang juga dikenal sebagai polifenol pengoksidase merupakan suatu enzim yang mengandung tembaga dan memiliki campuran fungsi oksidase yang dapat didistribusikan secara luas dalam mikroorganisme, hewan dan tanaman. Tirosinase atau fenol oksidase adalah enzim utama yang terlibat dalam sintesis melanin (Likhitwitayawuid 2008). Uji aktivitas inhibitor tirosinase dilakukan untuk mengetahui ada tidaknya daya inhibisi senyawa bioaktif pada ekstrak kasar sampel beras hitam, beras merah, dan beras putih yang dinyatakan dalam IC50, yaitu bilangan yang menunjukkan konsentrasi ekstrak yang mampu menghambat sebanyak 50% aktivitas enzim tirosinase.
Tabel 3 Aktivitas inhibitor enzim tirosinase ekstrak beras hitam, beras merah, dan beras putih
9 eumelanin atau feomelanin (Likhitwitayawuid 2008). Reaksi antara substrat L-Tirosin dan L-DOPA dengan enzim tirosinase menghasilkan dopakrom dan dilanjutkan dengan terbentuknya melanin. Pembentukan dopakrom dapat dihambat oleh inhibitor tirosinase. Ekstrak yang memiliki daya inhibisi terhadap enzim tirosinase dapat menghambat produksi melanin. Pembentukan dopakrom dalam penelitian ini ditandai dengan pembentukan warna cokelat. Adanya inhibitor tirosinase dapat menyebabkan terhambatnya reaksi substrat-tirosinase sehingga produk dopakrom semakin berkurang. Hal ini ditandai dengan penurunan intensitas warna cokelat yang dihasilkan. Aktivitas inhibitor enzim tirosinase dapat dilihat dari IC50 monofenolase dan difenolase yang ditunjukkan pada Tabel 3.
Ekstrak n-heksana beras merah memiliki aktivitas inhibitor tirosinase yang paling tinggi untuk monofenolase dengan nilai IC50 sebesar 3156 µg/mL dibandingkan dengan ekstrak sampel beras lainnya. Pada Tabel 3 menunjukkan bahwa aktivitas inhibitor tirosinase pada semua sampel melalui monofenolase maupun difenolase memiliki nilai IC50 yang tidak tidak jauh berbeda antara satu dengan yang lain. Sampel beras hitam, beras merah, maupun beras putih memiliki aktivitas inhibitor tirosinase yang kecil karena IC50 sampel tersebut hampir seratus kali lipat lebih besar dibandingkan dengan asam kojat sebagai kontrol positifnya, yaitu dengan nilai IC50 sebesar 3156 µg/mL pada ekstrak n-heksana beras merah sampai dengan 4606 µg/mL pada ekstrak etil asetat beras merah pada monofenolase. Sedangkan asam kojat hanya memiliki IC50 49 µg/mL (monofenolase) dan 35 µg/mL (difenolase). Tingginya nilai IC50 menunjukkan bahwa aktivitas inhibitor tirosinase beras sangat kecil, demikian juga dengan difenolase yang memiliki IC50 yang sangat tinggi dibandingkan dengan kontrol positif asam kojat.
Aktivitas Antioksidan
Aktivitas antioksidan beras hitam, beras merah, dan beras putih ditentukan dengan dua metode, yaitu metode DPPH dan metode fosfomolibdat. Metode DPPH merupakan metode yang paling umum digunakan untuk pengujian aktivitas antioksidan karena bersifat stabil dalam bentuk radikal sehingga pengukuran yang dihasilkan cukup akurat. Radikal bebas DPPH dapat menangkap atom hidrogen komponen ekstrak yang dicampurkan dan bereaksi menjadi bentuk tereduksinya yang ditandai dengan berkurangnya intensitas warna ungu larutan DPPH.
10
Selain itu, dilakukan pula uji antioksidan dengan metode fosfomolibdat untuk mengetahui ekuivalen α-tokoferol pada sampel beras. Fosfomolibdat merupakan suatu oksidator terdiri dari ammonium molibdat dan natrium fosfat yang akan membentuk ammonium molibdat. Selama reaksi berlangsung, gugus hidroksil pada senyawa fenolik akan bereaksi langsung dengan perekasi fosfomolibdat yang membentuk kompleks molibdenum (Zengin et al. 2010; Prieto
et al. 1999). Aktivitas antioksidan beras hitam, beras merah, dan beras putih dinyatakan dalam ekuivalen α-tokoferol dengan BHT (butil hidroksi toluena) sebagai kontrol positifnya. Ekstrak etil asetat beras putih memiliki aktivitas terbesar sebagai antioksidan sebesar 41.13 mmol α-tokoferol ekuivalen/g sampel, dikuti dengan ekstrak n-heksana beras merah sebesar 32.95 mmol α-tokoferol ekuivalen/g sampel dibandingkan dengan ekstrak beras lainnya. Aktivitas antioksidan ini memiliki nilai yang lebih besar daripada BHT sebagai kontrol positifnya yang merupakan senyawa aktif antioksidan yaitu sebesar 28.58 mmol α-tokoferol ekuivalen/g sampel (Tabel 4).
Tabel 4 Aktivitas antioksidan ekstrak beras hitam, beras merah, dan beras putih
Sampel Pelarut IC50
Keterangan ; -*:tidak mencapai inhibisi 50% sampai konsentrasi maksimum 5000 (µg/mL).
Aktivitas antioksidan pada ekstrak beras dengan metode fosfomolibdat memiliki hasil yang berbeda dengan metode DPPH. Pada metode DPPH, ekstrak yang memiliki aktivitas tertinggi adalah ekstrak metanol beras hitam, sedangkan pada metode fosfomolibdat, ekstrak etil asetat beras putih memiliki aktivitas yang terbaik. Hal ini diduga disebabkan oleh perbedaan senyawa aktif masing-masing ekstrak dan prinsip metode yang digunakan.
11 Disamping itu, hasil analisis fitokimia (Tabel 2) menunjukkan dugaan bahwa ekstrak metanol beras hitam mengandung senyawa flavonoid yang diduga berperan sebagai inhibitor tirosinase (Chang 2009).
Penentuan Eluen Terbaik
Penentuan eluen terbaik dilakukan terlebih dahulu sebelum melakukan KLT bioautografi. Penentuan eluen terbaik dilakukan menggunakan kromatografi lapis tipis (KLT) dengan fase diam silika G60F254. KLT merupakan metode pemisahan dengan kromatografi yang dilakukan pada lapisan tipis fase diam (100-200 m) dan silika gel umumnya terdapat pada pelat (Day & Underwood 2002). Eluen terbaik dalam pemisahan senyawa dilihat dari jumlah noda/spot yang diamati di bawah sinar lampu UV pada panjang gelombang 254 dan 366 nm. Eluen yang digunakan dimulai dengan beberapa macam eluen tunggal, hasil pemisahan eluen tunggal dengan menggunakan ekstrak metanol beras hitam ditunjukkan pada Gambar 1. Pemisahan dengan pelarut tunggal tersebut tidak diperoleh pemisahan yang cukup baik, sehingga dilakukan kombinasi dua pelarut.
Gambar 1 Kromatogram penentuan eluen terbaik ekstrak metanol beras hitam dengan pelarut 1. n-heksana; 2. toluena; 3. aseton; 4. kloroform; 5.diklorometana; 6. n-butanol; 7. dietil eter; 8. etil asetat; 9. metanol; dan 10. asam asetat dideteksi pada =254 nm dan 366 nm
12
Keberhasilan pemisahan dilakukan kembali dengan kombinasi pelarut kloroform dan metanol. Eluen terbaik yang diperoleh dengan menggunakan kromatografi lapis tipis (KLT) pada ekstrak metanol beras hitam adalah metanol:kloroform (1:9). Kromatogram yang diperoleh dengan pelarut ini memiliki spot paling banyak, yaitu 7 spot dan pemisahan yang dihasilkan paling baik dibandingkan dengan yang lainnya (Gambar 2).
KLT Bioautografi
Kromatografi lapis tipis (KLT) bioautografi merupakan metode kualitatif penentuan aktivitas antioksidan pada sampel dengan kombinasi antara kromatografi lapis tipis dan metode deteksi biologis yang membutuhkan sampel minimum dan waktu yang sedikit (Marston 2011). KLT bioautografi menunjukkan noda/spot senyawa yang memiliki aktivitas antioksidan DPPH ditunjukkan dengan warna putih-kuning setelah dilakukan penyemprotan menggunakan DPPH. Uji kualitatif menggunakan KLT bioautografi dilakukan terhadap ekstrak metanol beras hitam karena memiliki aktivitas antioksidan dengan metode DPPH. Metanol:kloroform (1:9) digunakan sebagai eluen, sedangkan DPPH dan fosfomolibdat digunakan sebagai pereaksi semprotnya.
Gambar 3 Kromatogram KLT bioautografi; (a) sebelum penyemprotan pada =366 (b) deteksi menggunakan pereaksi DPPH (c) deteksi menggunakan fosfomolibdat (1) asam askorbat (2) ekstrak metanol beras hitam
a b c
13 Gambar 3 menunjukkan kromatogram KLT bioautografi ekstrak metanol beras hitam dengan pereaksi DPPH dan fosfomolibdat. Kromatogram sebelum penyemprotan menghasilkan 7 noda pada KLT (Gambar 3a). Setelah dilakukan penyemprotan menggunakan DPPH, diperoleh 5 noda berwarna putih kuning yang berada pada bagian bawah KLT (Gambar 3b). Hal tersebut menunjukkan bahwa senyawa yang berpotensi sebagai antioksidan dengan pereaksi DPPH pada ekstrak metanol beras hitam bersifat polar karena tidak mampu terelusi oleh eluen metanol:kloroform (1:9) dan tertahan pada silika.
Kromatogram hasil KLT bioautografi ekstrak metanol beras hitam dengan pereaksi fosfomolibdat ditunjukkan pada Gambar 3c. Setelah dilakukan penyemprotan menggunakan fosfomolibdat, diperoleh 2 noda berwarna hijau biru seulas yang berada pada bagian atas KLT. Hal tersebut menunjukkan bahwa senyawa yang berpotensi sebagai antioksidan dengan pereaksi fosfomolibdat pada ekstrak metanol beras hitam bersifat kurang polar karena terelusi oleh eluen dan tidak tertahan pada silika. Namun, noda asam askorbat pada Gambar 3b secara kualitatif tidak menunjukkan adanya aktivitas antioksidan dengan pereaksi fosfomolibdat.
Pada kromatogram KLT bioautografi menggunakan pereaksi semprot DPPH dan fosfomolibdat (Gambar 3) terdapat satu spot/noda ekstrak yang aktif sebagai antioksidan baik menggunakan DPPH maupun menggunakan fosfomolibdat, hal ini menunjukkan bahwa spot/noda tersebut merupakan fraksi terbaik sebagai antioksidan dibandingkan dengan spot/noda yang lain. Menurut Chang (2009) golongan senyawa yang berperan sebagai antioksidan ialah flavonoid dan triterpenoid. Flavonoid di alam merupakan senyawa yang bersifat polar karena berada dalam bentuk glikosida (terikat dengan gula). Sehingga diduga senyawa yang berperan sebagai antioksidan menggunakan pereaksi DPPH ialah flavonoid. Lain halnya dengan triterpenoid yang bersifat nonpolar, senyawa ini diduga berperan sebagai antioksidan menggunakan pereaksi fosfomolibdat. Pernyataan tersebut didukung oleh hasil uji fitokimia (Tabel 2) yang menunjukkan bahwa ekstrak metanol beras hitam positif mengandung flavonoid dan triterpenoid sehingga diduga senyawa yang berperan sebagai antioksidan pada ekstrak metanol beras hitam adalah senyawa flavonoid dan terpenoid.
Untuk memastikan golongan senyawa aktif tersebut dilakukan dilakukan uji lebih lanjut pada KLT untuk ekstrak metanol beras hitam. Hasilnya menunjukkan bahwa tidak terdeteksi adanya senyawa flavonoid dengan kuersetin sebagai standar setelah dilakukan penyemprotan menggunakan AlCl3 yang ditunjukkan pada Gambar 4, yaitu tidak munculnya warna kuning pada ekstrak metanol beras yang hitam seperti pada standar kuersetin.
Hasil uji triterpenoid dengan asiatikosida sebagai standar juga menunjukkan hasil yang sama, yaitu tidak terdeteksi adanya triterpenoid pada ekstrak metanol beras hitam setelah disemprot dengan pereaksi Liebermann-Burchard karena tidak munculnya warna ungu kecoklatan pada sampel seperti pada asiatikosida yang muncul spot berwarna ungu kecoklatan setelah dilakukan penyemprotan (Gambar 5c). Hal ini terjadi diduga karena beberapa faktor, seperti terjadinya overlapping
14
Gambar 4 Kromatogram KLT uji flavonoid; (a) sebelum penyemprotan pada =366 (b) setelah penyemprotan dengan AlCl3 pada =366 (1) kuersetin (2) ekstrak metanol beras hitam
Gambar 5 Kromatogram KLT uji triterpenoid; (a) sebelum penyemprotan pada =366 (b) sebelum penyemprotan pada sinar tampak (c) setelah
penyemprotan dengan Liebermann-Buchard pada =366 (1) asiatikosida (2) ekstrak metanol beras hitam
1 2
a b
a b c
1 2
15
SIMPULAN DAN SARAN
Simpulan
Ekstrak metanol beras hitam berpotensi sebagai antioksidan, dengan IC50 291 µg/mL menggunakan metode DPPH, sedangkan ekstrak etil asetat beras putih memiliki aktivitas terbaik dengan metode fosfomolibdat sebesar 41.13 mmol α-tokoferol ekuivalen/g sampel. Ekstrak beras yang memiliki aktivitas inhibitor tirosinase tertinggi adalah ekstrak n-heksana beras merah pada monofelase (IC50 3156 µg/ml).
Saran
Perlu dilakukan pemisahan lebih lanjut untuk mengetahui senyawa aktif pada sampel beras agar diperoleh aktivitas antioksidan dan inhibitor tirosinase yang lebih baik.
DAFTAR PUSTAKA
Al-Farsi MA, Lee CY. 2008. Optimization of phenolic and dietary fibre extraction from date seeds. Food Chem. 108:977-985.
[AOAC] Association of Official Analytical Chemist. 2006. Official Methods of AOAC International. Revisi ke-2. Vol ke-1. Maryland (US): Association of Official Analytical Chemist.
Arung ET, Shimizu K, Kondo R. 2006. Inhibitory effect of artocarpanone from
Artocarpus heterophyllus on melanin biosynthesis. J Biol. 29:1966-1969. Batubara I, Darusman LK, Mitsunaga T, Rahminiwati M, Djauhari E. 2010.
Potency of Indonesia medicinal plants as tyrosinase inhibitor and antioxidants agent. J Biol Sci. 10:138-144.
[BPOM] Badan Pengawas Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan Obat Indonesia. Jakarta (ID): BPOM RI.
Chang TS. 2009. An update review of tyrosinase inhibitors. J Mol Sci. 10:2440-2473.
Day RA, AL Underwood. 2002. Analisis Kimia Kuantitatif Ed. ke-4. Alih bahasaIis Sopyan, Editor Hilarius Wibi & Lameda Simarmata. Jakarta (ID):Erlangga. Terjemahan dari: Quantitative Analysis 4th Ed.
Femina. 2013. Merawat wajah dengan bedak dingin. Femina.
Frei KB 2004. Improving the nutrient availability in rice-biotechnology or bio-diversity. In A. Wilcke (Ed.) Agriculture & Development. Contributing to International Cooperation 11(2): 64–65.
Halliwell B, Aeschbach R, Loliger J, Auroma OI. 1995. The characterization of antioxidants. Food Chem Toxicol. 33: 601-617.
16
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta (ID): Gramedia.
Kaneda I, Iwaki K, Kubo H, Sakurai H. 2006. Antioxidative compounds in the axtracts of black rice brans. J Health Sci. 52:495-511.
Likhitwitayawuid K. 2008. Stillbenes with tyrosinase inhibitory activity. J Curr Sci. 94:44-52.
Marston A. 2011. Thin-layer chromatography with biological detection in phytochemistry. J Chromatography A. 1218:2876-2683.
Pokorny J, Yanishlieva N, Gordon M. 2001. Antioxidant in Food: Practical Application. New York(US): CRC Pr.
Rouessac F, Rouessac A. 2007. Chemical Analysis: Modern Instrumentation Methods and Techniques Ed. Ke-2. West Sussex (GB): J Wiley.
Salazar-Alandra R, Perez-Lopez LA, Loppez Arroyo J, Alanis-Garza BA, Torres NW. 2009. Antimicrobial and antioxidant activities of plants from Northeast of Mexico. Evidence-Based Complementary and Alternative Med. 2011:1-6.
[SNI] Standar Nasional Indonesia. 2008. Beras. Jakarta (ID): Badan Standardisasi Nasional. SNI 6128:2008.
Soi-ampornkul, Rungtip et al. 2012. Antioxidative and Neuroprotective Activities of the Pre-Germinated Brown Rice Extract. Food and Nutrition Sci. 3: 135-140.
Winarno FG. 2002. Kimia Pangan dan Gizi. Jakarta (ID): Gramedia Pustaka Utama.
Zarai Z, Boujelbene E, Salem NB, Gargouri Y, Sayari A. 2012. Antioxidant and antimicrobial activities of various solvent extracts, piperinae and piperic acid from Piper nigrum. LWT - Food Sci Technol. 50(2):634-641.
17
LAMPIRAN
Lampiran 1 Diagram alir penelitian
Sampel segar beras putih, beras merah, beras hitam
Kadar air dan kadar abu
Ekstraksi bertingkat Pengeringan 40-50 °C, penggilingan
KLT Bioautografi
Penenetuan eluen terbaik Sampel serbuk
Ekstrak n-heksana
Uji aktivitas dan uji fitokimia Ekstrak etil asetat Ekstrak metanol
ekstrak teraktif
18
Lampiran 2 Contoh perhitungan kadar air beras hitam, beras merah, dan beras putih
Kadar air beras hitam (Ulangan 1)
(
(
Lampiran 3 Contoh perhitungan kadar abu beras hitam, beras merah, dan beras putih
Kadar abu beras hitam (Ulangan 1)
(
Lampiran 4 Contoh perhitungan rendemen ekstrak beras hitam Rendemen ekstrak n-heksana beras hitam (Ulangan 1)
(
( (
(
19
RIWAYAT HIDUP
Penulis dilahirkan di Padang pada tanggal 5 Mei 1992 sebagai putri ketiga dari Bapak Jasrizal dan Ibu Yetmawati. Penulis lulus dari SMA Negeri 2 Jakarta pada tahun 2010 dan pada tahun yang sama diterima di Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) .
Selama menjadi mahasiswa IPB, penulis pernah menjadi asisten mata kuliah Kimia Dasar Tingkat Persiapan Bersama (TPB) pada tahun 2012, asisten praktikum mata kuliah Kimia Analitik Layanan Biologi pada tahun 2014, dan asisten praktikum matakuliah Praktikum Analisis Instrumental pada tahun 2015. Selama kuliah, penulis pernah melakukan Praktik Lapang di PT Pertamina
Research and Development Jakarta dengan judul laporan “Analisis Produk HTU (Hydro Treating Unit) dengan Umpan IDIS” pada tahun 2013. Dalam bidang
organisasi, penulis pernah mengikuti kepanitian sebagai Master of Ceremony