FRAKSINASI DAN UTILISASI PROTEIN KACANG
KEDELAI (
Glycine max (L). Merrill
) DAN KACANG MERAH
(
Phaseolus vulgaris L
.) DENGAN PERBEDAAN
SUHU PENGERINGAN
YESI CHWENTA SARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Fraksinasi dan Utilisasi Protein Kacang Kedelai (Glycine max (L). Merrill) dan Kacang Merah (Phaseolus vulgaris L.) dengan Perbedaan Suhu Pengeringan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
YESI CHWENTA SARI. Fraksinasi dan Utilisasi Protein Kacang Kedelai (Glycine max (L). Merrill) dan Kacang Merah (Phaseolus vulgaris L.) dengan Perbedaan Suhu Pengeringan. Dibimbing oleh ERIKA B. LACONI, DIDID DIAPARI, dan ANURAGA JAYANEGARA.
Penentuan kebutuhan protein di Indonesia masih berbasis protein kasar. Jika kebutuhan protein hanya dilihat dari kandungan protein kasar, hal ini tidak efektif karena hanya sebagian protein yang dapat diutilisasi oleh ternak ruminansia. Protein banyak dikandung oleh kacang-kacangan yaitu mencapai 20 sampai 40%. Kacang kedelai dan kacang merah banyak tumbuh serta mudah diperoleh di Indonesia menjadi salah satu alasan kacang-kacangan tersebut digunakan dalam penelitian ini, supaya ketersediaannya berkesinambungan serta dapat ditentukan berapa persen (%) protein yang terikat dalam dinding sel dan kecernaannya sehingga dapat menggambarkan protein terutilisasi oleh ternak ruminansia. Tujuan penelitian ini adalah untuk mendapatkan suhu pengeringan yang tepat dan aman dalam pengolahan bahan pakan serta untuk mengevaluasi fraksinasi dan utilisasi protein kacang kedelai dan kacang merah. Fraksinasi dan utilisasi protein penting untuk diteliti dan dipertimbangkan sebagai analisis rutin di laboratorium yang berkaitan dengan pakan dan nutrisi ternak.
Kacang kedelai dan kacang merah diperoleh dari pasar tradisional dalam keadaan segar dan dipilih berdasarkan penilaian secara fisik, kemudian kacang kedelai dan kacang merah tersebut ditimbang sebagai berat segar, untuk perlakuan sebelum dikeringkan di oven semua sampel berdasarkan jenis kacang dicampur sampai homogen, lalu diambil 1 kg yang kemudian digunakan untuk perlakuan. Kacang kedelai dan kacang merah dimasukkan ke dalam oven selama 24 jam dengan 4 level suhu pengeringan yang berbeda (50, 60, 70, 80 oC) dengan tiga ulangan. Sampel ditimbang dan digiling, kemudian disaring melalui screen 1 mm, yang kemudian digunakan untuk pengujian. Peubah yang diukur yakni analisis proksimat (bahan kering, kadar abu, kadar protein kasar dan kadar lemak kasar), analisis Van soest (NDF: Neutral Detergent Fiber; ADF: Acid Detergent Fiber), analisis fraksi protein kasar (NDICP: Neutral Detergent Insoluble Crude Protein; ADICP: Acid Detergent Insoluble Crude Protein), analisis in vitro (total produksi gas, kecepatan produksi gas, pH, kecernaan bahan kering/KCBK, kecernaan protein kasar/KCPK, konsentrasi amonia/NH3, konsentarsi VFA parsial dan total VFA.
mengandung kadar lemak yang lebih tinggi dibandingkan kacang merah karena lemak tidak berkontribusi terhadap total produksi gas yang dihasilkan di rumen. Kecepatan produksi gas tidak memberikan interaksi oleh perlakuan. Faktor jenis kacang berpengaruh nyata terhadap kecepatan produksi gas. Kecepatan produksi gas pada kacang kedelai lebih tinggi dibandingkan pada kacang merah karena kacang kedelai mengandung protein yang mudah dicerna lebih banyak untuk mikroba rumen. Faktor suhu berpengaruh nyata terhadap kecepatan produksi gas, dimana semakin tinggi suhu pengeringan akan menurunkan laju kecepatan produksi gas. Hal ini disebabkan semakin tinggi suhu pengeringan maka kecernaan akan semakin menurun. Semakin besar kecernaan bahan pakan akan berkorelasi positif terhadap kecepatan produksi gas dan total produksi gas. KCBK, VFA tertinggi diperoleh kacang merah karena kacang merah kaya akan karbohidrat, kadar BETN yang tinggi dan nilai NPN yang tinggi, sedangkan KCPK, NH3 tertinggi diperoleh kacang kedelai karena kacang kedelai mengandung protein kasar yang paling tinggi sebesar 44.32%.
SUMMARY
YESI CHWENTA SARI. Fractionation and Protein Utilization of Soybean (Glycine max (L). Merrill) and Redbean (Phaseolus vulgaris L.) with Different Drying Temperatures. Supervised by ERIKA B. LACONI, DIDID DIAPARI and ANURAGA JAYANEGARA.
Determination of protein requirement in Indonesia is still based on crude protein. Protein requirement only seen from the crude protein content as an indicator of animal diet, it was ineffective because the only some proteins could be utilization by ruminants. The beans were containing the protein about 20-40%. Soybean and redbean were growth, produce an available easily in Indonesia, that’s why as one of the reasons that the beans were used in this study. Furthermore, in this study will be seen how many percent (%) protein bound in the cell wall and digestibility thus can describe protein utilization by ruminants. This study was aimed to get proper drying temperature in the processing of feed and to evaluate fractionation and protein utilization of soybean and redbean. Fractionation and protein utilization were important to be measured and should be considered as a routine analysis in the laboratory related to animal feed and nutrition.
Soybean and redbean obtained from traditional markets in a fresh state and selected based on physical assessment. Then the beans are weighed as fresh weight, for treatment before being dried in the oven all samples based on the types of beans should be mixed until homogeneous, then taken 1 kg which was then ADICP (Acid Detergent Insoluble Crude Protein). In vitro analysis is conducted to measure of total gas production and kinetics, pH, digestibility’s value of dry material and the value of crude protein digestibility, the concentration of ammonia/NH3, VFA partial and total VFA components.
easily protein digested for the rumen microbes. Temperatures Factor ware affected significant to kinetics gas production, where the higher the drying temperature will be decrease the kinetics gas production. This was due to the higher drying temperatures will be decrease the digestibility. The greater digestibility feed materials will be positively correlated total gas production and kinetics. Redbean have the highest level of KCBK and total value of VFA because redbean are rich in carbohydrates, and high levels of BETN and NPN value, while the soybean have the highest level of KCPK and NH3 because Soybean contains the highest crude protein of 44.32%.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Nutrisi dan Pakan
FRAKSINASI DAN UTILISASI PROTEIN KACANG
KEDELAI (
Glycine max (L). Merrill
) DAN KACANG MERAH
(
Phaseolus vulgaris L
.) DENGAN PERBEDAAN
SUHU PENGERINGAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Fraksinasi dan Utilisasi Protein Kacang Kedelai (Glycine max (L). Merrill) dan Kacang Merah (Phaseolus vulgaris L.) dengan Perbedaan Suhu Pengeringan
Nama : Yesi Chwenta Sari NIM : D251140181
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Erika B. Laconi, MS Ketua
Dr Ir Didid Diapari, MSi Dr Anuraga Jayanegara, SPt MSc
Anggota Anggota
Diketahui oleh
Ketua Program Studi Ilmu Nutrisi dan Pakan
Prof Dr Ir Yuli Retnani, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 24 Juni 2016 (tanggal pelaksanaan ujian tesis)
Tanggal Lulus:
(tanggal penandatanganan tesis oleh Dekan Sekolah
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala rahmat dan kasih sayang-Nya sehingga penulis dapat menyelesaikan penyusunan karya ilmiah ini. Shalawat beserta salam tercurah untuk baginda Rasulullah Muhammad SAW atas semua perjuangan dan dakwah beliau. Penelitian yang telah dilaksanakan sejak bulan November 2015 sampai April 2016 ini berjudul “Fraksinasi dan Utilisasi Protein Kacang Kedelai (Glycine max (L). Merrill) dan Kacang Merah (Phaseolus vulgaris L.) dengan Perbedaan Suhu Pengeringan”. Karya ilmiah ini merupakan salah satu syarat kelulusan untuk memperoleh gelar Magister Sains, Program Studi Ilmu Nutrisi dan Pakan, Sekolah Pascasarjana, Institut Pertanian Bogor. Sebagian isi dari karya ilmiah ini telah dipublikasikan pada Seminar Internasional ‘BaSIC’ pada tanggal 2-3 Maret 2016 dan sudah diterbitkan dalam Proceeding (ISSN : 2338-0128, Volume: 6) dengan judul “Increase of Insoluble Nitrogen Fractions in Soybean (Glycine max (L.) Merrill) and Redbean (Phaseolus vulgaris L.) due to Higher Drying Temperatures”.
Terima kasih penulis ucapkan kepada Direktorat Jenderal Pendidikan Tinggi (DIKTI) atas Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPP-DN) Calon Dosen tahun 2014-2016 yang telah penulis terima selama menempuh kuliah di Sekolah Pascasarjana IPB. Terima kasih kepada Ibu Prof Dr Ir Erika B. Laconi, MS, Bapak Dr Ir Didid Diapari, MS, dan Bapak Dr Anuraga Jayanegara, SPt MSc selaku komisi pembimbing yang telah banyak memberikan bimbingan, motivasi dan arahan dalam penulisan karya ilmiah ini, serta kepada dosen dan pegawai Program Studi Pascasarjana Ilmu Nutrisi dan Pakan atas bimbingan dan bantuannya. Terima kasih untuk dana proyek penelitian atas nama Bapak Dr Anuraga Jayanegara, SPt MSc yang telah membantu dalam pendanaan penelitian ini. Terima kasih pula saya ucapkan kepada Bapak Prof Dr Ir H Novirman Jamarun, MSc dan Bapak Dr Ir Adrizal, MS selaku dosen S1 di Universitas Andalas yang telah memberikan rekomendasi Homebase mengajar sebagai persyaratan untuk mendapatkan beasiswa BPPDN DIKTI tahun 2014. Secara khusus penulis sampaikan terima kasih kepada Syafri Nanda, SPt MSi sebagai sahabat yang selalu memberi motivasi dan kasih sayang sehingga penulis dapat menyelesaikan karya ilmiah ini.
Ungkapan terima kasih, rasa cinta, dan sayang sedalam-dalamnya juga penulis sampaikan kepada Ayahanda Arnawi, SPd dan ibunda Elly Apriani serta dank David Fery Andrio, SPt, donga Rio Akbar, adik Putri Mayang Sari dan seluruh keluarga atas segala doa, dukungan, semangat serta kasih sayangnya sehingga penulis dapat menyelesaikan karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat bagi para pembaca dan bisa menambah khasanah keilmuan terutama dibidang peternakan.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 MATERI DAN METODE 4
Waktu dan Tempat 4
Bahan 4
Alat 4
Metode Penelitian 4
Analisis Data 10
3 HASIL DAN PEMBAHASAN 12
4 SIMPULAN DAN SARAN 23
Simpulan 23
Saran 23
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR TABEL
1 Komposisi nutrien kacang kedelai dan kacang merah dengan 4 level
suhu pengeringan 12
2 Hasil analisis Van soest kacang kedelai dan kacang merah dengan 4
level suhu pengeringan 14
3 Hasil analisis fraksinasi protein kacang kedelai dan kacang merah
dengan 4 level suhu pengeringan 15
4 Total Produksi Gas (ml) dan Kecepatan Produksi Gas (ml/jam) 15
5 Derajat keasaman (pH) cairan rumen 17
6 Hasil kecernaan bahan kering dan kecernaan protein kasar kacang kedelai dan kacang merah dengan 4 level suhu pengeringan 18 7 Produksi amonia (mM) kacang kedelai dan kacang merah setelah
inkubasi 24 jam dengan 4 level suhu pengeringan 20 8 Produksi VFA parsial (%) dan total VFA (mM) kacang kedelai dan
kacang merah setelah inkubasi 24 jam dengan 4 level suhu
pengeringan 21
DAFTAR GAMBAR
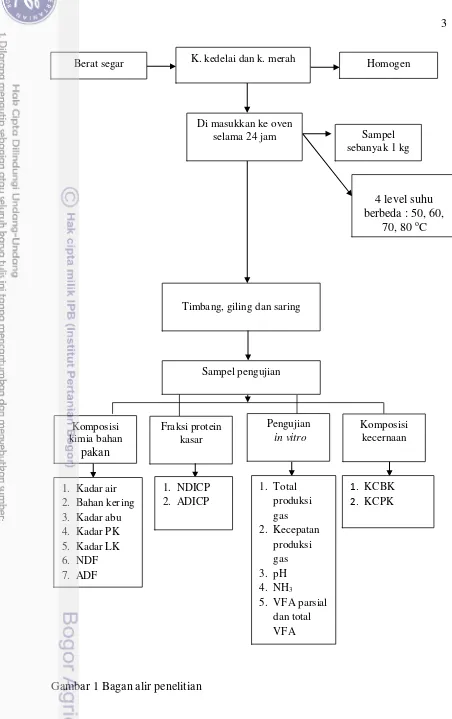
1 Bagan alir penelitian 3
2 Warna sampel kacang merah setelah pengeringan dengan oven. M1: suhu 50 oC, M2: 60 oC, M3: 70 oC, M4: 80 oC. 19 3 Warna sampel kacang kedelai setelah pengeringan dengan oven. P1:
suhu 50 oC, P2: 60 oC, P3: 70 oC, P4: 80 oC. 19
DAFTAR LAMPIRAN
1 Hasil analisis ragan bahan kering (BK) 27
2 Hasil analisis ragam kadar abu 27
3 Hasil analisis ragam protein kasar (PK) 28
4 Hasil analisis ragam lemak kasar (LK) 28
5 Hasil analisis ragam NDF (neutral detergent fiber) 28 6 Hasil analisis ragam ADF (acid detergent fiber) 29 7 Hasil analisis ragam NDICP (neutral detergent insoluble crude
protein) 29
8 Hasil analisis ragam ADICP (acid detergent insoluble crude protein) 30
9 Hasil analisis ragam total produksi gas (b) 30
10 Hasil analisis ragam kecepatan produksi gas (c) 31
11 Hasil analisis ragam pH cairan rumen 31
12 Hasil analisis ragam kecernaan bahan kering (KCBK) 31 13 Hasil analisis ragam kecernaan protein kasar (KCPK) 32
14 Hasil analisis ragam produksi amonia (NH3) 32
15 Hasil analisis ragam asam asetat (C2) 33
16 Hasil analisis ragam asam propionat (C3) 33
17 Hasil analisis ragam asam butirat (C4) 33
1
PENDAHULUAN
Latar Belakang
Kacang-kacangan merupakan tanaman yang sangat familiar di kalangan masyarakat dan telah banyak diberikan kepada ternak sebagai bahan pakan sumber protein. Bahan pakan dikatakan sebagai sumber protein apabila mengandung protein kasar minimal atau lebih dari 20% (Hardianto 2000). Menurut Almatsier (2009) protein dapat diperoleh dari bahan-bahan pakan yang berasal dari tumbuhan berupa hijauan leguminosa seperti daun turi, lamtoro, ataupun dari konsentrat biji-bijian/kacang-kacangan. Protein diperlukan oleh ternak untuk mengganti dan membangun sel tubuh yang rusak dan juga berperan dalam pembentukan biomolekul dibandingkan dengan makronutrien lainnya seperti karbohidrat dan lemak, oleh karena itu protein dapat dipakai sebagai sumber energi ketika tubuh kekurangan energi.
Beberapa jenis kacang-kacangan yang potensial dijadikan sebagai sumber protein adalah kacang kedelai dan kacang merah. Kualitas dari protein ditentukan oleh susunan asam amino didalamnya. Kacang kedelai memiliki susunan asam amino yang relatif lengkap dan seimbang. Kandungan asam amino yang membentuk protein pada kacang kedelai mendekati kandungan asam amino pada protein hewani. Kacang kedelai juga mengandung asam lemak tidak jenuh tinggi yang dapat menurunkan total kolesterol dalam darah. Kacang kedelai dapat digunakan untuk berbagai macam keperluan, antara lain untuk makanan manusia, makanan ternak, dan untuk bahan industri (Cahyadi 2007). Selain kacang kedelai, jenis kacang-kacangan yang juga tinggi protein yaitu kacang merah. Kacang merah merupakan kacang yang potensial karena menyumbang protein by-pass terbesar sehingga lebih efektif untuk ternak ruminansia (Dewi 2015). Biasanya yang dimanfaatkan dari kacang merah adalah bijinya karena biji kacang merah merupakan sumber protein. Disamping kaya akan protein nabati, biji kacang merah juga mengandung karbohidrat, mineral, dan vitamin. Dibandingkan jenis kacang-kacangan lainnya, kacang merah memiliki kadar karbohidrat yang tertinggi. Keunggulan kacang merah jika dibandingkan dengan sumber protein hewani yakni kacang merah bebas kolesterol. Protein kacang merah juga dapat menurunkan kadar kolesterol LDL yang bersifat jahat bagi kesehatan, serta bisa meningkatkan kadar kolesterol HDL yang bersifat baik bagi kesehatan (Astawan 2009).
Pengolahan bahan pakan berprotein dapat dilakukan dengan berbagai cara diantaranya dengan pengolahan fisik. Secara fisik biasanya dilakukan dengan pengeringan, akan tetapi pengolahan bahan pakan berprotein yang tidak dikontrol dengan baik dapat menyebabkan terjadinya penurunan nilai gizi. Protein merupakan senyawa reaktif yang tersusun dari beberapa asam amino yang mempunyai gugus reaktif yang dapat berikatan dengan komponen lain, misalnya gula pereduksi, polifenol, lemak dan produk oksidasinya. Reaksi antara protein dengan gula pereduksi yang dikenal dengan reaksi Maillard juga merupakan penyebab utama terjadinya kerusakan protein selama pengolahan.
2
menentukan jumlah nitrogen total yang dikandung suatu bahan. Utilisasi protein pakan dapat ditentukan apabila jumlah nitrogen yang terikat pada dinding sel pakan dianalisis dan dikuantifikasi. Jika kebutuhan protein hanya dilihat dari kandungan protein kasar, hal ini tidak efektif karena tidak semua kandungan protein dalam pakan dapat diutilisasi oleh ternak ruminansia (Tamminga et al. 1994; Filho et al. 2010; Van Duinkerken et al. 2011), selain itu di Indonesia penelitian mengenai fraksinasi dan utilisasi protein dinding sel masih sedikit, sehingga diperlukan penelitian-penelitian terkait dengan hal tersebut supaya bisa dikembangkan sistem formulasi ransum ternak ruminansia berbasis protein terutilisasi.
Metode evaluasi degradasi bahan pakan dalam rumen dapat dilaksanakan dengan beberapa metode, salah satunya adalah dengan metode in vitro. Metode in vitro merupakan suatu percobaan pendugaan kecernaan secara tidak langsung yang dilakukan di laboratorium dengan meniru proses pencernaan yang terjadi di dalam saluran pencernaan ruminansia. Metode in vitro dipilih karena memiliki beberapa kelebihan diantaranya adalah waktu yang lebih singkat, biaya yang lebih murah, dan dapat dikerjakan dengan banyak sampel sekaligus, serta bahan pakan yang tidak bisa diberikan secara tunggal pada ternak daya cernanya dapat diteliti dengan metode in vitro (Getachew et al. 2004).
Tujuan Penelitian
Untuk mendapatkan suhu pengeringan yang tepat dan aman dalam pengolahan bahan pakan serta untuk mengevaluasi fraksinasi dan utilisasi protein kacang kedelai dan kacang merah.
Manfaat Penelitian
3
4
2
MATERI DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan November 2015 sampai April 2016. Analisis proksimat, analisis fraksi protein kasar, dan in vitro dilaksanakan di Laboratorium Ilmu dan Teknologi Pakan, Laboratorium Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor, analisis Van soest dilaksanakan di Pusat Penelitian Bioteknologi LIPI (Lembaga Ilmu Pengetahuan Indonesia) Cibinong serta analisis VFA parsial dilaksanakan di Laboratorium Pusat Studi Pangan dan Gizi, Universitas Gadjah Mada, Yogyakarta.
Bahan
Bahan-bahan yang digunakan antara lain kacang kedelai, kacang merah, cairan rumen sapi fistula untuk uji in vitro, larutan Mc Dougalls, aquadest, larutan ADS (Acid Detergent Solution), larutan NDS (Neutral Detergent Solution), larutan pepsin HCl 0.2%, larutan H2SO4 0.005 N, vaselin tawar, larutan NaOH 1 N 0.5 mL dan bahan-bahan kimia lainnya.
Alat
Peralatan yang digunakan dalam penelitian ini antara lain oven, buret, water bath, hot plate, kain kasa, botol fermentor, kertas saring Whatman #41, vacuum pump, cawan, penutup karet, penutup alumunium, termometer, tabung reaksi, cawan conway, Gas Chromatograph Shimadsu GC-8A. Alat untuk membuat larutan McDougalls yaitu beaker glass, labu ukur kapasitas 1 liter, erlenmeyer, pH meter, pipet dan alat-alat laboratorium lainnya.
Metode Penelitian
Preparasi Sampel Pakan
Kacang kedelai dan kacang merah diperoleh dari pasar tradisional dalam keadaan segar dan dipilih berdasarkan penilaian secara fisik, kemudian kacang-kacangan tersebut ditimbang sebagai berat segar, untuk perlakuan sebelum dikeringkan di oven sampel berdasarkan jenis kacang harus dicampur sampai homogen, lalu diambil 1 kg yang kemudian digunakan untuk perlakuan. Sampel dimasukkan ke dalam oven selama 24 jam dengan 4 level suhu pengeringan yang berbeda (50, 60, 70, 80 oC), setelah itu ditimbang dan digiling lalu disaring melalui screen 1 mm yang kemudian digunakan untuk pengujian.
Analisis Komposisi Kimia Pakan
5 analisis fraksi protein kasar yang meliputi NDICP (Neutral Detergent Insoluble Crude Protein), ADICP (Acid Detergent Insoluble Crude Protein).
Analisis Proksimat
Kadar air (AOAC 2005). Cawan sebelumnya telah dipanaskan sekitar 1 jam pada oven 105 °C kemudian didinginkan dalam eksikator dan ditimbang berat cawan. Sampel ditimbang sebanyak 5 g dan dimasukkan ke dalam cawan, lalu cawan dan sampel tersebut dimasukkan ke dalam oven 105 °C selama sekitar 4-6 jam (sampai tercapai bobot tetap), lalu cawan diangkat dan didinginkan dalam eksikator. Setelah itu ditimbang beratnya. Kadar air ditentukan menggunakan rumus :
Kadar air (%) = ( berat sebelum oven 105 °C (gberat sampel (g)-berat setelah oven 105 °C (g)) ) x 100%
Bahan Kering : Pakan bebas air. Menghitung kadar bahan kering dengan rumus sebagai berikut :
BK= 100% - KA Keterangan :
BK = kadar bahan kering (%) KA = kadar air (%)
Kadar abu (AOAC 2005). Cawan sebelumnya telah dipanaskan pada tanur 400-600 °C, kemudian didinginkan dalam eksikator, lalu berat cawan ditimbang. Sampel ditimbang sebanyak 5 g dan dimasukkan ke dalam cawan lalu ditimbang. Sampel dibakar di atas hot plate sampai tidak berasap sekitar 2 jam, lalu dimasukkan ke dalam tanur. Setelah itu diangkat dan didinginkan dalam eksikator dan ditimbang beratnya. Kadar abu ditentukan menggunakan rumus :
Kadar abu (%) = ( berat cawan dan residu gberat sampel (g)-berat cawan kosong (g) ) x 100%
6
Kadar protein kasar (%) = ( (blanko mL - sampel (mL)) x N NaOH x 14 x 6.25
berat sampel (g) ) x 100%
Kadar Lemak Kasar (AOAC 2005). Labu penyari disiapkan dengan batu didih didalamnya yang sebelumnya telah dipanaskan pada suhu 105 oC dan dinginkan di dalam eksikator kemudian labu penyari ditimbang. Sampel ditimbang sebanyak 1 gram, kemudian dimasukkan ke dalam selongsong penyari, lalu ditutup menggunakan kapas tidak berlemak, setelah itu selongsong penyari dimasukkan ke dalam alat soxlet lalu disari menggunakan petroleum benzin, selanjutnya dihubungkan dengan kondensor. Proses ini dilakukan menggunakan alat FATEX-S. Labu dimasukkan ke dalam oven 105 oC sampai tetap (sekitar 4-6 jam), diangkat dan didinginkan dalam eksikator. Bobot akhir ditimbang.
Kadar lemak kasar (%) = ( berat labu akhir g-berat labu awal (g)
berat sampel (g) ) x 100%
Analisis Fraksi Serat Van Soest
Neutral detergent fibre (NDF) (Van Soest 1991). Sampel ditimbang sebanyak 0.5-1 g (kering udara dan sudah digiling) lalu dimasukkan ke dalam gelas beaker 600 mL dan ditambahkan sebanyak 100 mL larutan detergen netral dan 2-3 tetes dekalin, setelah itu dipanaskan selama 5 sampai 6 menit sampai mulai panas kemudian dihitung waktu pemanasannya selama 60 menit sambil di reflux dengan aliran air, setelah 60 menit pendidihan, beaker diambil dari pemanas dan dibiarkan sebentar supaya bahan padatan mengendap di bawahnya. Gelas saring disiapkan pada tempatnya dan dipanaskan dengan air mendidih. Bahan larutan disaring secara pelan-pelan mulai dari bahan cairan yang terlarut dengan vakum yang rendah dayanya. Pada bagian padatannya dimasukkan ke saringan sambil dibilas dengan air mendidih. Vakum bisa ditambah kekuatanya sesuai dengan kebutuhan. Sampel dicuci sekitar 2 kali dengan air panas, 2 kali dengan aseton dan kemudian dapat dikeringkan. Gelas penyaring dapat dikeringkan minimal selama 8 jam (atau disimpan semalam apabila analisis dilanjutkan hari berikutnya) pada suhu 105 °C dalam oven yang dilengkapi dengan sistem kipas, setelah ditimbang akan didapatkan berat kering residu NDF. NDF (%) = ( berat sampel setelah oven gberat sampel (g)– berat sampel setelah tanur (g) ) x 100%
Acid detergent fibre (ADF) (Van Soest 1991). Prosedurnya sama dengan NDF, namun yang berbeda hanya pada pelarutnya. Pada ADF digunakan larutan detergen asam.
ADF (%) = ( berat sampel setelah oven berat sampel (g)g– berat sampel setelah tanur (g) ) x 100%
Analisis Fraksi Protein Kasar
Acid detergent insoluble crude protein (ADICP) (Licitra et al. 1996).
7 ADF diinginkan. Kertas dilipat ke dalam corong dan digunakan corong sudut 60 oC dan saringan kerucut (Fisher Cat. No. 9-760) untuk melindungi tip, lalu kertas dicuci menggunakan air panas sampai bebas asam kemudian aseton. Kertas yang telah dilipat tersebut dimasukkan ke dalam krusibel yang telah dipanaskan, kemudian dikeringakan pada oven 105 0C selama 8 jam atau semalaman dan ditimbang jika ingin menentukan ADF, lalu residu kertas dipindahkan ke dalam labu kjeldahl. Nitrogen pada residu ditentukan menurut prosedur kjeldahl. Destilasi titrasi menggunakan asam standar 0.01 N.
ADICP (BK%) = ( kadar protein
100 ) x % ADF ADICP (PK%) = ( PK sampel (%BK) ADICP (%BK) ) x 100%
Neutral detergent insoluble crude protein (NDICP) (Licitra et al. 1996).
Prosedur untuk NDICP persis mengikuti prosedur ADICP kecuali pereaksinya dan sodium sulfit diabaikan. Dimana prosedur NDF dilakukan terlebih dahulu, kemudian dilakukan uji protein kasar Kjeldahl pada residu NDF.
NDICP (BK%) = ( kadar protein100 ) x % NDF NDICP (PK%) = ( PK sampel (%BK) NDICP (%BK) ) x 100%
Pelaksanaan Uji In vitro
Pengambilan Cairan Rumen
Termos disiapkan yang sebelumnya sudah diisi air panas dengan suhu 39 oC, setelah itu cairan rumen diambil di LIPI Cibinong pada pagi hari sebelum sapi diberi pakan. Cairan rumen diambil dari 3 sapi fistula supaya lebih banyak mikroba rumen yang bisa diperoleh lalu cairan rumen dimasukkan ke dalam termos yang sebelumnya air panas di dalam termos dibuang terlebih dahulu, kemudian segera dibawa ke laboratorium yang perlengkapan fermentasi in vitro telah disiapkan.
Pembuatan Larutan McDougall (Saliva Buatan)
Larutan ini sebagai buffer dalam fermentasi in vitro dengan komposisi sebagai berikut (dalam 1000 ml) : NaHCO3 : 9.8 gram, Na2HPO4.7H2O : 3.71 gram, KCl : 0.57 gram, NaCl : 0.47 gram, MgS04.7H2O : 0.12 gram, CaCl2 : 0.04 gram.
Pembuatan Larutan Pepsin
8
Inkubasi In vitro
Inkubasi in vitro menggunakan modifikasi metode Theoudorou et al. (1994) dan metode Tilley dan Terry (1963). Buffer yang digunakan mengacu pada Tilley dan Terry (1963) sedangkan prosedur mengacu pada Theoudorou et al. (1994), yakni substrat sebanyak 0.75 gram dimasukkan ke dalam botol vial injection berukuran 100 ml. Tambahkan 75 ml cairan rumen dan buffer untuk digunakan sebagai media inkubasi yang telah dijenuhkan menggunakan gas CO2. Campuran antara substrat perlakuan, buffer, dan cairan rumen dimasukkan ke dalam botol kemudian ditutup menggunakan penutup karet dan diperkuat oleh penutup aluminium, selanjutnya diinkubasikan ke dalam water bath (Lab master) suhu 39 oC selama 24 jam untuk profil fermentasi, 48 jam untuk kecernaan, dan 72 jam untuk kinetika produksi gas. Selama masa inkubasi dilakukan pengocokan botol secara manual setiap 30 menit sebelum pengukuran gas dan setiap setelah pengukuran gas.
Pengukuran Total Produksi Gas dan Kecepatan Produksi Gas
Total produksi gas dan kecepatan produksi gas diukur pada jam ke 2, 4, 6, 8, 10, 12, 24, 36, 48, 72 setelah inkubasi. Pengukuran ini menggunakan syringe plastik dengan volume 60 ml. Syringe pada bagian ujungnya ditusukkan melewati penutup karet ke dalam botol menuju ke bagian ruang dari botol tanpa mengenai permukaan cairan yang ada di dalam botol. Gas total yang dihasilkan akan mendorong bagian dalam syringe ke atas. Setelah gas mendorong syringe secara sempurna, dilakukan pencabutan syringe dari karet botol. Nilai total volume gas (ml) dapat diketahui dengan pembacaan secara manual pada skala yang terdapat pada syringe.
Total produksi gas dan kecepatan produksi gas akan diestimasi menggunakan persamaan Orskov’s (Orskov dan McDonald 1979). Bentuk persamaannya sebagai berikut :
p= b (1-exp-c.t) Keterangan :
p : produksi gas kumulatif pada waktu t jam b : produksi gas maksimum pada t = ∞ (ml) c : kecepatan produksi gas (ml/jam)
t : waktu inkubasi (h).
Pengukuran pH
Pengukuran pH cairan rumen dilakukan setelah masa inkubasi 24 jam dengan menggunakan pH meter. Ujung pH meter dimasukkan ke dalam cairan rumen hasil penampungan yang sudah diinkubasi 24 jam. Sebelum dilakukan pengukuran pH, pH meter terlebih dahulu dilakukan kalibrasi dengan pH 4 dan pH 7.
Pengukuran Konsentrasi Total VFA dan VFA Parsial (Goering dan Van Soest 1970)
9 digunakan yaitu GC 8A, Shimadzu Crop, Kyoto, Japan dengan kolom berisi 10% SP-1200, 1% H3PO4 on 80/100 Cromosorb WAW. Sampel VFA parsial yang digunakan berasal dari proses fermentasi dengan inkubasi 48 jam yang diambil sebanyak 1,5 mL ke dalam tabung eppendorf, selanjutnya sampel dianalisis dengan menginjeksikan 0,4 µL sampel pada GC. Dengan membaca kromatogram standar acuan VFA yang konsentrasinya sudah diketahui maka konsentrasi VFA yang akan diukur dapat dilihat pada kromatogram. Satuan VFA parsial yang diperoleh adalah dalam µ mol/ml atau mM. Kandungan total VFA didapatkan melalui penjumlahan masing-masing VFA parsial penyusunnya.
mM sampel VFA = Area contoh x 10 mMArea standar VFA (Asetat) (%) = Asetat (mM)VFA total x 100 %
Keterangan : perhitungan sama untuk butirat dan propionat.
Pengukuran Konsentrasi NH3 (General Laboratory Procedure 1966)
Penentuan produksi NH3 dilakukan dengan menggunakan metode mikrodifusi Conway (General Laboratory Procedure 1966), sebelum digunakan bibir cawan conway dan tutupnya terlebih dahulu diolesi dengan vaselin. Cairan rumen sebanyak 1 mL diletakkan pada salah satu sekat cawan Conway, pada sisi yang lain diletakkan 1 ml Na2CO3 jenuh. Pada bagian tengah diisi dengan asam borat berindikator methil merah, kemudian Conway ditutup rapat dengan cawan bervaselin lalu digoyang-goyangkan supaya supernatan bercampur dengan Na2CO3, setelah itu dibiarkan selama 24 jam, amonia yang terikat dengan asam borat dititrasi dengan H2SO4 0.005 N sampai titik awal perubahan dari warna biru menjadi kemerah-merahan.
Kadar amonia dapat dihitung dengan rumus: N NH3 ( mM ) = Hsampel 2SO4 (mL)g x BK sampel (g) x N H2SO4 x 1000
Pengukuran KCBK (Tilley dan Terry 1963)
10
kertas saring Whatman no. 41 (yang sudah diketahui bobotnya) dengan bantuan pompa vakum. Endapan yang ada di kertas saring dimasukkan ke dalam cawan porselen, setelah itu dimasukkan ke dalam oven 105 °C selama 24 jam, setelah 24 jam cawan porselen, kertas saring dan residu dikeluarkan kemudian dimasukkan ke dalam eksikator dan ditimbang untuk mengetahui kadar bahan keringnya. Sebagai blanko dipakai residu asal fermentasi tanpa bahan pakan.
KCBK (%) = ( BK sample g -(BK residu BK sampel (g)g -BK blanko g ) ) x 100%
Pengukuran KCPK (Tilley dan Terry 1963)
Kecernaan Protein Kasar (KCPK) mengacu pada metode Tilley dan Terry (1963). Tabung fermentor yang telah diisi dengan 0.5 g sampel, ditambahkan 40 mL larutan McDougall. Tabung dimasukkan ke dalam water bath dengan suhu 39 °C, kemudian diisi cairan rumen 10 mL, tabung dikocok dengan dialiri CO2 selama 30 detik, dicek pH (6.5–6.9), kemudian ditutup dengan karet berventilasi, dan difermentasi selama 48 jam, setelah 48 jam dibuka tutup karet tabung fermentor, diteteskan 2-3 tetes HgCl2 untuk membunuh mikroba. Tabung fermentor dimasukkan ke dalam sentifugasi kemudian dilakukan sentrifugasi dengan kecepatan 4 ribu rpm selama 10 menit. Substrat akan terpisah menjadi endapan di bagian bawah dan supernatan yang bening berada di bagian atas. Supernatan dibuang dan endapan hasil sentrifugasi pada kecepatan 4 ribu rpm selama 15 menit ditambahkan 50 mL larutan pepsin-HCl 0.2%. Campuran ini lalu diinkubasi kembali selama 48 jam. Sisa pencernaan disaring dengan kertas saring Whatman no. 41 (yang sudah diketahui bobotnya) dengan bantuan pompa vakum. Endapan yang ada di kertas saring dimasukkan ke dalam cawan porselen, setelah itu dimasukkan ke dalam oven 60 °C selama 24 jam. Setelah 24 jam, cawan porselen, kertas saring dan residu dikeluarkan, dan dilanjutkan dengan analisis protein kasar menggunakan metode Kjeldahl.
KCPK (%) = ( (PK awal (%)PK awal (%)-PK residu (%)) ) x 100
Analisis Data
11 Model matematika rancangan percobaan yang digunakan menurut Steel dan Torrie (1991) adalah sebagai berikut :
Rancangan Acak Lengkap (RAL) Pola Faktorial :
� = μ + + + + � Rancangan Acak Kelompok (RAK) Pola Faktorial :
� = μ + + + + K� + � Keterangan :
� : nilai pengamatan pada taraf ke-i dari faktor A, taraf ke-j dari faktor B, dan ulangan ke-k
μ : rataan umum
: pengaruh taraf ke-i dari faktor A : pengaruh taraf ke-j dari faktor B
αβij : pengaruh interaksi antara taraf ke-i dari faktor A dengan taraf ke-j dari faktor B
Kk : pengaruh taraf ke-k dari faktor kelompok
� : pengaruh acak dari satuan percobaan ke-k yang memperoleh kombinasi perlakuan ij
Adapun perlakuan terdiri atas 2 faktor (Faktor A dan Faktor B), dimana ; Faktor A adalah jenis kacang yang terdiri dari 2 jenis yaitu
A1 = Kacang kedelai A2 = Kacang merah
Faktor B adalah suhu pengeringan dengan oven yang terdiri dari 4 level yaitu B1 = 50 0C
B2 = 60 0C B3 = 70 0C B4 = 80 0C
Peubah yang Diamati
1. Komposisi kimia bahan pakan meliputi bahan kering (BK), kadar abu, protein kasar (PK), lemak kasar (LK), NDF, ADF.
2. Fraksi protein kasar meliputi NDICP (Neutral Detergent Insoluble Crude Protein), ADICP (Acid Detergent Insoluble Crude Protein).
3. Total produksi gas dan kecepatan produksi gas
4. Pengujian In vitro meliputi kecernaan bahan kering (KCBK) dan kecernaan protein kasar (KCPK).
12
3
HASIL DAN PEMBAHASAN
Analisis Komposisi Nutrien Kacang Kedelai dan Kacang Merah
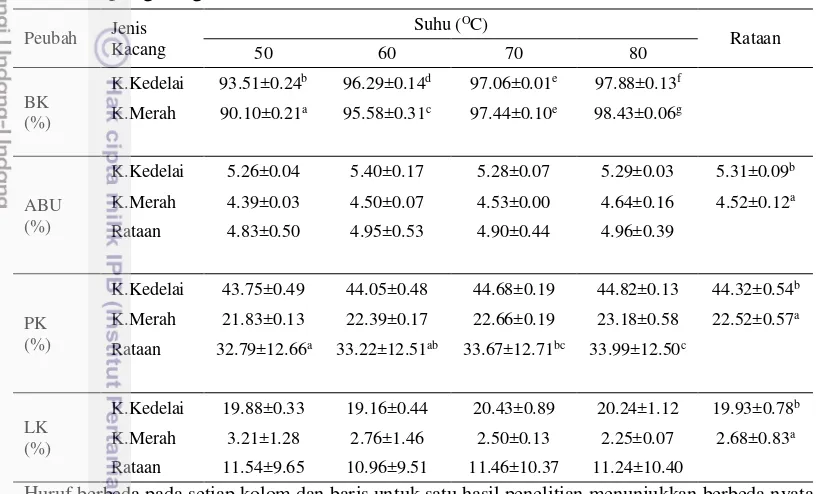
Hasil analisis BK, Abu, PK dan LK kacang kedelai dan kacang merah disajikan pada Tabel 1.
Hasil penelitian menunjukkan bahwa perlakuan memberikan interaksi yang nyata terhadap kandungan BK, dimana kandungan BK kacang kedelai lebih tinggi dari kacang merah pada suhu 50 dan 60 oC karena konsentrasi bahan organik dan anorganik kacang kedelai lebih tinggi dari kacang merah. Pada suhu 70 oC bahan kering kacang kedelai dan kacang merah menunjukkan hasil tidak berbeda nyata, hal ini disebabkan kacang kedelai dan kacang merah kehilangan kadar air yang sama banyak, sedangkan pada suhu 80 oC BK kacang merah lebih tinggi dari kacang kedelai karena dalam keadaan segar (as feed) kacang merah lebih banyak mengandung kadar air dibandingkan kacang kedelai sehingga jika suhu ditingkatkan maka kadar air (moisture) yang hilang semakin banyak pada kacang merah. Nilai BK diperoleh setelah bahan pakan dikeringkan dalam oven sampai merupakan kumpulan dari mineral-mineral yang terdapat dalam bahan. Analisis kadar abu berfungsi untuk memisahkan bahan organik dan anorganik. Hasil penelitian menunjukkan bahwa perlakuan tidak memberikan interaksi yang nyata Tabel 1 Komposisi nutrien kacang kedelai dan kacang merah dengan 4 level suhu
pengeringan
K.Kedelai 93.51±0.24b 96.29±0.14d 97.06±0.01e 97.88±0.13f
K.Merah 90.10±0.21a 95.58±0.31c 97.44±0.10e 98.43±0.06g
ABU (%)
K.Kedelai 5.26±0.04 5.40±0.17 5.28±0.07 5.29±0.03 5.31±0.09b
K.Merah 4.39±0.03 4.50±0.07 4.53±0.00 4.64±0.16 4.52±0.12a
Rataan 4.83±0.50 4.95±0.53 4.90±0.44 4.96±0.39
PK (%)
K.Kedelai 43.75±0.49 44.05±0.48 44.68±0.19 44.82±0.13 44.32±0.54b
K.Merah 21.83±0.13 22.39±0.17 22.66±0.19 23.18±0.58 22.52±0.57a
Rataan 32.79±12.66a 33.22±12.51ab 33.67±12.71bc 33.99±12.50c
LK (%)
K.Kedelai 19.88±0.33 19.16±0.44 20.43±0.89 20.24±1.12 19.93±0.78b
K.Merah 3.21±1.28 2.76±1.46 2.50±0.13 2.25±0.07 2.68±0.83a
Rataan 11.54±9.65 10.96±9.51 11.46±10.37 11.24±10.40
13 terhadap kandungan abu. Faktor jenis kacang berbeda nyata terhadap abu sedangkan faktor suhu tidak berbeda nyata terhadap kandungan abu, dimana kandungan abu pada kacang kedelai lebih tinggi dibandingkan pada kacang merah. Hal ini disebabkan kandungan abu dalam kondisi segar pada kacang kedelai lebih tinggi dari kacang merah, meskipun suhu pengeringan ditingkatkan namun tidak berpengaruh nyata terhadap kandungan abu.
Protein kasar adalah banyaknya kandungan nitrogen pakan dikalikan faktor protein rata-rata (6.25) karena rata-rata nitrogen dalam protein sebesar 16%. Hasil penelitian menunjukkan bahwa perlakuan tidak memberikan interaksi yang nyata terhadap kandungan PK. Faktor jenis kacang berbeda nyata terhadap kandungan PK. PK kacang kedelai lebih tinggi dari kacang merah yakni 44.32%. Hal ini sesuai dengan pendapat Chandrasekharaiah et al. (2002) bahwa kacang kedelai memiliki kadar protein kasar paling tinggi dengan kisaran 34.5 sampai 44.6%, selain itu protein kedelai memiliki mutu yang mendekati mutu protein hewani yang memiliki susunan asam amino lengkap dan seimbang. Tabel 1 juga menunjukkan pada suhu pengeringan 50 dan 60 0C memberikan hasil yang tidak berbeda nyata terhadap kandungan PK, akan tetapi jika suhu pengeringan ditingkatkan menjadi suhu 70 dan 80 0C maka konsentrasi kandungan PK lebih tinggi karena bahan pakan kehilangan kadar air selama pengeringan. Lemak kasar adalah suatu zat yang larut dalam proses ekstraksi menggunakan pelarut organik seperti petroleum benzin. Istilah lemak kasar dipergunakan karena kemungkinan yang terlarut dalam pelarut organik ini bukan hanya lemak tetapi juga antara lain : glyserida, chlorophyl, asam lemak terbang, kolesterol, lechitin dan lain-lain dimana zat-zat tersebut tidak termasuk zat makanan tetapi terlarut dalam pelarut lemak. Hasil penelitian menunjukkan bahwa perlakuan tidak memberikan interaksi yang nyata terhadap kandungan LK. Faktor jenis kacang berbeda nyata terhadap kandungan LK, dimana LK kacang kedelai lebih tinggi dari kacang merah. Hal ini berarti kacang kedelai lebih banyak zat yang terlarut dalam pelarut organik.
Hasil Analisis Van Soest Kacang Kedelai dan Kacang Merah
Metode Van soest mengelompokkan komponen isi sel dan dinding sel. Isi sel merupakan komponen yang sangat mudah dicerna sedangkan komponen dinding sel meliputi NDF dan ADF. NDF terdiri atas lignin, selulosa, hemiselulosa, dan protein yang berikatan dengan dinding sel sedangkan ADF terdiri atas selulosa dan lignin dinding sel tanaman (Van Soest et al. 1991). Analisis Van soest bertujuan untuk menentukan kandungan serat dalam pakan dan fraksi-fraksinya ke dalam kelompok tertentu berdasarkan keterikatannya dengan kation atau anion detergen atau disebut juga dengan metode detergen, yang terdiri atas 2 bagian yaitu 1) sistem netral untuk mengukur total serat atau serat yang yang tidak larut dalam detergen netral (NDF), 2) sistem detergen asam digunakan untuk mengisolasi selulosa tidak larut dan lignin serta beberapa komponen lain yang terikat dengan keduanya (ADF). Hasil analisis Van soest yang meliputi NDF dan ADF disajikan pada Tabel 2.
14
kacang merah lebih banyak dari kacang kedelai. Tabel 2 juga menunjukkan bahwa perlakuan tidak memberikan interaksi yang nyata terhadap kandungan ADF. Faktor jenis kacang berbeda nyata dengan ADF, dimana ADF kacang kedelai lebih tinggi dari kacang merah. Hal ini berarti kacang kedelai lebih banyak selulosa dan lignin yang tidak terlarut dalam detergen asam. Faktor suhu berbeda nyata terhadap ADF, dimana kandungan ADF pada suhu 70 dan 80 0C lebih tinggi dibandingkan pada suhu 50 dan 60 0C karena suhu mempengaruhi ikatan selulosa dan lignin dinding sel tanaman. Schroeder (2004) menyatakan bahwa ADF mempunyai korelasi negatif dengan kecernaan pakan yaitu kandungan ADF yang tinggi dalam pakan akan menyebabkan penurunan kecernaan pakan.
Hasil Analisis Fraksinasi Protein Kacang Kedelai dan Kacang Merah
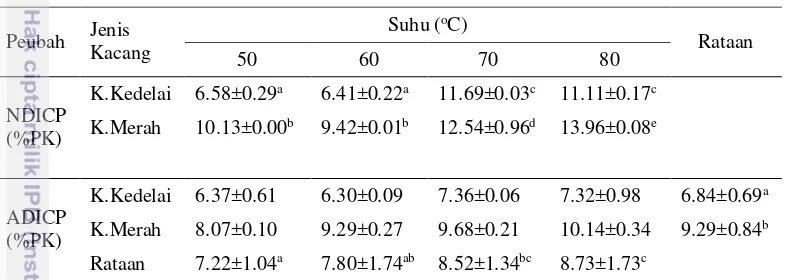
Neutral detergent insoluble crude protein (NDICP) disebut juga protein yang masih ada dalam residu NDF sedangkan Acid detergent insoluble crude protein (ADICP) disebut juga protein yang masih ada dalam residu ADF karena setelah ekstraksi selesai, tidak semua nitrogen dapat terlarut (Licitra et al. 1996). NDICP dan ADICP merupakan protein kasar yang masih terikat di dinding sel disebut juga protein tahan degradasi rumen sehingga menyebabkan kecernaan protein kasar rendah. Hasil analisis fraksinasi protein yang meliputi NDICP dan ADICP disajikan pada Tabel 3.
Hasil penelitian menunjukkan bahwa suhu pengeringan 50 dan 60 oC merupakan suhu yang aman untuk pemanasan bahan pakan dibandingkan suhu pengeringan 70 dan 80 oC, jika suhu pengeringan ditingkatkan sampai 80 oC dapat meningkatkan NDICP. Hal ini disebabkan suhu dapat mempengaruhi peningkatan fraksi nitrogen yang tidak larut, sehingga semakin banyak protein yang terikat dalam dinding sel, akibatnya bahan pakan menjadi sulit dicerna oleh mikroba rumen. Hal ini berarti protein bahan pakan sebagian besar tidak dapat dimanfaatkan dengan baik (utilisasi rendah) oleh mikroba rumen maupun oleh ternak yang menjadi induk semangnya. Van Der Meer dan Van Es (2001) menyatakan bahwa kecernaan bahan pakan serat akan sangat dipengaruhi oleh Tabel 2 Hasil analisis Van soest kacang kedelai dan kacang merah dengan 4 level
suhu pengeringan
K.Kedelai 20.68±0.64a 22.06±1.05a 22.10±0.19a 22.27±0.43a
K.Merah 27.92±0.40b 34.96±0.08c 35.56±1.47c 35.41±0.02c
ADF (%BK)
K.Kedelai 15.82±0.27 15.39±0.67 16.56±0.13 17.20±1.24 16.24±0.92b
K.Merah 10.52±0.34 10.81±0.11 11.62±0.28 12.20±0.16 11.29±0.73a
Rataan 13.17±3.07a 13.10±2.68a 14.09±2.85b 14.70±2.98b
15 kandungan penyusun dinding sel bahan. Dinding sel yang banyak terkandung dalam pakan akan menyebabkan pakan sulit terdegradasi dalam rumen. Tabel 3 juga menunjukkan bahwa perlakuan tidak memberikan interaksi yang nyata terhadap ADICP. Faktor suhu dan jenis kacang berbeda nyata terhadap ADICP, dimana ADICP kacang kedelai lebih rendah dari kacang merah karena pada kacang kedelai sedikit protein yang terikat dalam dinding sel. Suhu pengeringan 50 oC dan 60 oC memberikan hasil yang tidak berbeda nyata terhadap kandungan ADICP, sedangkan suhu 50 oC berbeda nyata dengan suhu 70 dan 80 oC karena semakin tinggi suhu pengeringan maka kandungan ADICP semakin meningkat.
Hasil Analisis Kecernaan In Vitro
Hasil Analisis Total Produksi Gas dan Kecepatan Produksi Gas
Hasil analisis total produksi gas dan kecepatan produksi gas dari sistem fermentasi rumen secara in vitro selama 72 jam disajikan pada Tabel 4.
Tabel 3 Hasil analisis fraksinasi protein kacang kedelai dan kacang merah dengan 4 level suhu pengeringan
Peubah Jenis
K.Merah 10.13±0.00b 9.42±0.01b 12.54±0.96d 13.96±0.08e
ADICP (%PK)
K.Kedelai 6.37±0.61 6.30±0.09 7.36±0.06 7.32±0.98 6.84±0.69a
K.Merah 8.07±0.10 9.29±0.27 9.68±0.21 10.14±0.34 9.29±0.84b
Rataan 7.22±1.04a 7.80±1.74ab 8.52±1.34bc 8.73±1.73c
Huruf berbeda pada setiap kolom dan baris untuk satu hasil penelitian menunjukkan berbeda nyata (P<0.05), NDICP: Neutral detergent insoluble crude protein, ADICP: Acid detergent insoluble crude protein.
Tabel 4 Total Produksi Gas (ml) dan Kecepatan Produksi Gas (ml/jam) Peubah Jenis
K. Kedelai 158±3.02 161±5.25 158±3.92 156±2.38 158±4.15a
K. Merah 232±5.09 243±5.75 241±12.64 242±6,74 240±8.85b
Rataan 195±38.80a 202±42.80b 200±44.51ab 199±45.46ab
Kecepatan produksi gas (ml/jam)
K. Kedelai 0.111±0.00 0.110±0.01 0.106±0.01 0.101±0.01 0.107±0.01b
K. Merah 0.074±0.00 0.068±0.00 0.063±0.01 0.061±0.00 0.067±0.01a
Rataan 0.092±0.02d 0.089±0.02bc 0.085±0.02ab 0.081±0.02a
16
Produksi gas yang dihasilkan menunjukkan terjadinya proses fermentasi pakan oleh mikroba. Gas yang diproduksi oleh mikroba rumen selama inkubasi sebagiannya merupakan produk hasil metabolisme mikroba dalam mencerna dan memfermentasi pakan atau substrat, sedangkan sebagian lainnya adalah dari hasil proses buffering larutan saliva buatan (larutan buffer) terhadap asam lemak terbang yang dihasilkan (Getachew et al. 1998; McDonald et al. 2010), ditambahkan oleh McDonald et al. (2010) bahwa komposisi gas di dalam rumen adalah 40% karbon dioksida (CO2), 30-40% metana (CH4), 5% hidrogen, dan sebagian kecil oksigen dan nitrogen.
Hasil penelitian menunjukkan bahwa perlakuan tidak memberikan interaksi yang nyata terhadap total produksi gas. Faktor jenis kacang berpengaruh nyata terhadap total produksi gas, dimana produksi gas kacang kedelai lebih rendah dari kacang merah. Hal ini disebabkan kacang kedelai mengandung kadar lemak yang lebih tinggi dibandingkan kacang merah (Tabel 1) karena lemak tidak berkontribusi terhadap total produksi gas yang dihasilkan di rumen. Asam lemak tidak dimetabolisme di dalam rumen, mikroba rumen tidak memfermentasi asam lemak rantai panjang. Asam lemak rantai panjang akan masuk ke sel-sel epithelium dan akan diserap di usus halus, akan tetapi mikroba rumen bisa memfermentasi gliserol (C3H8O3) menjadi gas namun dari segi struktur molekul proporsinya sedikit (3C) jika dibandingkan asam lemak (rata-rata 18C) sehingga yang berkontribusi terhadap terbentuknya gas di dalam rumen juga sedikit. Fisroni (2005) menyatakan bahwa produksi gas yang dihasilkan menunjukkan terjadinya proses fermentasi dan degradasi yang terjadi di dalam rumen.
Lemak (trigiliserida, glikolipida, fosfolipida) dalam rumen akan mengalami 2 proses penting yaitu hidrolisis (lipolisis) dan biohidrogenasi. Pertama kali lemak dari pakan masuk ke dalam rumen akan mengalami proses hidrolisis (lipolisis) yaitu pemutusan ikatan ester antara gliserol dengan asam lemak. Gliserol selanjutnya akan diubah menjadi VFA khususnya propionat. Proses hidrolisis (lipolisis) lemak dalam rumen dikerjakan oleh bakteri Anaerovibrio lipolytica dan Butyrivibrio fibrisolvens yang akan mengeluarkan enzim lipase, galactosidase, dan phospholipase (Doreau dan Chilliard 1997; Harfoot dan Hazlewood 1997). Tahap selanjutnya yaitu asam lemak tak jenuh oleat (18:1), linoleat (18:2), dan linolenat (18:3) didalam rumen kemudian akan mengalami hidrogenasi. Langkah pertama dari proses biohidrogenasi adalah isomerasi dari bentuk cis menjadi trans. Proses biohidrogenasi menyebabkan pengurangan asam lemak tak jenuh dengan hasil akhir asam lemak jenuh (stearat= C18:0).
17 pakan akan berkorelasi positif terhadap kecepatan produksi gas dan total produksi gas.
Hasil Analisis Derajat Keasaman (pH) Cairan Rumen
Hasil analisis Derajat keasaman (pH) cairan rumen disajikan pada Tabel 5.
Hasil penelitian menunjukkan bahwa perlakuan tidak memberikan interaksi yang nyata terhadap pH cairan rumen. Hal ini disebabkan pengaruh pemberian buffer Mc Dougalls (saliva buatan) yang berperan dalam mempertahankan pH sehingga pH rumen tetap stabil, sesuai pendapat Church dan Pond (1988) menyatakan bahwa saliva berperan sebagai buffer untuk menjaga kestabilan pH cairan rumen. Nilai pH cairan rumen pada penelitian ini 6.61 kacang merah dan 6.85 kacang kedelai. Nilai pH pada kacang kedelai lebih tinggi dibandingkan pada kacang merah namun nilai pH tersebut masih dalam kisaran nilai pH optimal untuk pertumbuhan mikroba rumen. pH rumen ideal untuk perkembangbiakan mikroorganisme rumen adalah berkisar 6-7 (Church dan Pond 1988).
Hasil Analisis Kecernaan Bahan Kering (KCBK) dan Kecernaan Protein Kasar (KCPK)
Kecernaan zat-zat makanan merupakan salah satu ukuran dalam menentukan kualitas dari pakan. Semakin tinggi kecernaan bahan kering maka semakin tinggi juga peluang nutrisi yang dapat dimanfaatkan ternak untuk pertumbuhannya. Kecernaan pakan dipengaruhi oleh pencampuran pakan, cairan rumen dan inokulasi, pH kondisi fermentasi, pengaturan suhu fermentasi, lama waktu fermenatsi, ukuran sampel, dan larutan penyangga (Selly 1994). Hasil analisis kecernaan yang meliputi KCBK dan KCPK disajikan pada Tabel 6.
Hasil penelitian menunjukkan bahwa perlakuan tidak memberikan interaksi yang nyata terhadap KCBK. Faktor jenis kacang memberikan pengaruh nyata terhadap kecernaan bahan kering, dimana nilai kecernaan bahan kering pada kacang merah lebih tinggi dibandingkan kacang kedelai. Hal ini berarti kacang merah dapat dicerna dengan baik oleh mikroba rumen. Menurut Said (2014) kecernaan bahan kering yang tinggi pada ternak ruminansia mengindikasi tingginya zat nutrisi yang dicerna terutama yang dicerna oleh mikroba rumen. Kecernaan juga dapat dipengaruhi oleh komponen dalam pakan. Sejalan yang
Tabel 5 Derajat keasaman (pH) cairan rumen Peubah Jenis
K.Kedelai 6.87±0.10 6.87±0.10 6.83±0.05 6.83±0.05 6.85±0.08b
K.Merah 6.62±0.16 6.57±0.14 6.62±0.16 6.63±0.19 6.61±0.15a Rataan 6.74±0.18 6.72±0.19 6.73±0.16 6.73±0.17
18
diungkapkan oleh De Boever et al. (2005) bahwa komponen struktural bahan pakan asal tanaman seperti selulosa, lignin, dinding sel, NDF, ADF, akan mengurangi nilai kecernaan nutrien ransum, sedangkan karbohidrat mudah larut (pati) dan protein kasar dapat meningkatkan kecernaan nutrien tersebut.
Tabel 6 juga menunjukkan bahwa perlakuan memberikan interaksi yang nyata terhadap KCPK, dimana secara keseluruhan KCPK tertinggi diperoleh kacang kedelai pada semua level suhu dibandingkan kacang merah. Hal ini disebabkan kacang kedelai memiliki kandungan protein yang tinggi yaitu 44.32% dan ADICP yang rendah yaitu 6.84% sehingga sedikit protein yang berikatan dalam dinding sel. Suhu pengeringan 50 dan 60 oC merupakan suhu yang aman untuk pengolahan bahan pakan, jika suhu pengeringan ditingkatkan sampai 80 oC dapat menurunkan kecernaan protein kasar. Hal ini dikarenakan terjadi reaksi Maillard antara protein dengan gula pereduksi sehingga menyebabkan kecernaan protein dan ketersediaan atau availabilitas asam-asam amino esensial menurun, dimana secara fisik bahan pakan akan berubah warna menjadi kecoklatan.
Reaksi maillard merupakan reaksi pencoklatan non enzimatis yang terjadi karena adanya reaksi antara gula pereduksi dengan gugus amina bebas dari asam amino atau protein. Reaksi maillard dipengaruhi oleh jenis gula. Pada glukosa, semakin lama sampel dipanaskan maka akan semakin pekat warna coklatnya (melanoidin). Hasil reaksi maillard mungkin dikehendaki, misalnya pada pembentukan kulit luar coklat pada roti, dan mungkin juga tidak dikehendaki, seperti pada pelunturan coklat susu yang diuapkan dan disterilkan. Selain itu reaksi maillard dapat menurunkan daya cerna protein (Prangdimurti et al. 2007). Tabel 6 Hasil kecernaan bahan kering dan kecernaan protein kasar kacang
kedelai dan kacang merah dengan 4 level suhu pengeringan
Peubah Jenis
K.Kedelai 81.12±5.65 81.63±5.35 82.29±5.80 82.30±5.91 81.83±5.32a
K.Merah 87.01±3.60 89.73±5.05 84.81±2.94 87.52±1.62 87.27±3.74b
Rataan 84.06±5.47 85.68±6.52 83.55±4.58 84.91±4.95
KCPK (%)
K.Kedelai 90.97±1.44e 90.41±0.56e 86.90±1.74d 86.00±2.23d
K.Merah 76.18±1.31b 77.43±1.51b 80.78±4.53c 68.36±1.99a
19
Hasil Analisis Konsentrasi Amonia (NH3)
Amonia merupakan komponen penting untuk sintesa asam amino dan protein sel mikroba (Sakinah 2005). Kadar amonia diperoleh dari hasil fermentasi protein dalam pakan. Protein dari pakan akan didegradasi oleh bakteri proteolitik dengan bantuan enzim protease menjadi peptida, selanjutnya dihidrolisis menjadi amonia. McDonald et al. (2010) menyatakan bahwa amonia diproduksi bersamaan dengan beberapa peptida kecil dan asam amino bebas, dimanfaatkan oleh organisme rumen untuk sintesis protein mikroba. Dijelaskan kembali oleh Arora (1995) bahwa hidrolisa protein menjadi asam amino diikuti oleh proses deaminasi untuk membebaskan amino. McDonald et al. (2010) menambahkan bahwa beberapa asam amino akan dicerna lebih lanjut menjadi asam organik, amonia (NH3), dan karbon dioksida (CO2). Kandungan amonia atau N-NH3 rumen merupakan pencerminan dari aktivitas degradasi protein pakan dan endogenous Gambar 3 Warna sampel kacang kedelai setelah pengeringan dengan oven. P1:
suhu 50 oC, P2: 60 oC, P3: 70 oC, P4: 80 oC.
20
protein oleh mikroba rumen melalui mekanisme keseimbangan N dari tubuh ternak. Hasil analisis amonia (NH3) disajikan pada Tabel 7.
Hasil penelitian menunjukkan bahwa perlakuan tidak memberikan interaksi yang nyata terhadap NH3. Faktor suhu pengeringan dan jenis kacang memberikan pengaruh yang nyata terhadap produksi NH3. Kacang kedelai memiliki NH3 yang lebih tinggi dibandingkan kacang merah yakni sebesar 36.47 mM. Hal ini disebabkan kacang kedelai memiliki kandungan protein dan kecernaan protein kasar lebih tinggi dibandingkan kacang merah. Produksi amonia yang lebih tinggi di dalam rumen berasal dari degradasi protein dari kacang kedelai yang tinggi akan kandungan protein dan didegradasi oleh mikroba rumen menjadi aktivitas proteolitik yaitu perombakan protein menjadi asam-asam amino dan aktivitas deaminasi yaitu terjadinya pembentukan asam-asam organik, ammonia dan CO2. Hal ini sesuai dengan pendapat Rahmadi et al. (2010) yang menyatakan bahwa protein di dalam rumen dihidrolisis oleh enzim proteolitik yang dihasilkan mikroba rumen menjadi oligopeptida. Mikroba dapat memanfaatkan oligopeptida yang mudah terfermentasi untuk membuat protein tubuhnya, sebagian dihidrolisis lagi menjadi asam amino. Mikroba rumen akan merombak asam-asam amino sebanyak 82 % menjadi amonia untuk menyusun tubuhnya. Hal ini dikarenakan mikroba rumen terutama bakteri tidak mempunyai sistem transportasi untuk mengangkut asam amino ke dalam tubuhnya. Mikroba mendegradasi protein dalam rumen tidak mengenal batas, proses degradasi protein tersebut dapat berlangsung terus walaupun amonia yang dihasilkan telah cukup memenuhi kebutuhan mikroba rumen (Indriani et al. 2013).
Hasil penelitian juga menunjukkan semakin tinggi suhu pengeringan maka produksi amonia (NH3) semakin sedikit karena fermentasi protein dalam rumen menjadi terhambat. Rata-rata produksi amonia kacang kedelai 36.47 mM, kacang merah 21.34 mM. Kisaran hasil penelitian ini sedikit berbeda dengan kisaran normal yang dinyatakan oleh Sutardi (1980) yaitu sekitar 4-12 mM dan McDonald et al. (2002) yaitu 6 sampai 21 mM. Hal ini disebabkan perbedaan lama waktu inkubasi, dalam penelitian ini pengukuran konsentrasi NH3 dilakukan setelah inkubasi selama 24 jam, sedangkan menurut literatur menggunakan lama inkubasi 4 jam. Pengukuran NH3 secara in vitro dapat digunakan untuk mengestimasi degradasi protein dan kegunaannya oleh mikroba. Jika pakan defisien protein atau tinggi kandungan protein yang lolos degradasi, maka konsentrasi NH3 rumen akan rendah sebaliknya jika degradasi protein lebih cepat daripada sintesis protein mikroba maka NH3 akan terakumulasi dan melebihi Tabel 7 Produksi amonia (mM) kacang kedelai dan kacang merah setelah
inkubasi 24 jam dengan 4 level suhu pengeringan Peubah Jenis
K.Kedelai 46.86±2.09 40.87±2.15 30.39±1.57 27.76±1.96 36.47±8.12b
K.Merah 30.40 ± 0.99 25.11 ± 3.87 16.76 ± 2.56 13.08±1.21 21.34±7.32a
Rataan 38.63±8.74d 32.99±8.75c 23.57±7.40b 20.42±7.82a
21 konsentrasi optimumnya. Menurut Haryanto dan Djajanegara (1993) konsentrasi NH3 dipengaruhi oleh kandungan protein, tingkat degradasi protein, dan kelarutan protein bahan pakan. Selain faktor tersebut, ada beberapa faktor lagi yang mempengaruhi konsentrasi NH3 di dalam rumen yakni sumber intake nitrogen, taraf dan sumber energi, serta keseimbangan mineral (Suwandyastuti 2011).
Hasil Analisis Volatile Fatty Acid (VFA) Parsial dan Total VFA
VFA merupakan produk akhir fermentasi karbohidrat dan sumber energi utama bagi ternak ruminansia (Parakkasi 1999). Hasil analisis VFA parsial dan total VFA disajikan pada Tabel 8.
Karbohidrat pakan di dalam rumen mengalami dua tahap pencernaan oleh enzim-enzim yang dihasilkan oleh mikroba rumen. Pada tahap pertama karbohidrat mengalami hidrolisis menjadi monosakarida, seperti glukosa, fruktosa, dan pentosa. Hasil pencernaan tahap pertama masuk jalur glikolisis untuk mengalami pencernaan tahap kedua yang menghasilkan piruvat. Piruvat tersebut akan diubah menjadi Volatile Fatty Acid (VFA). VFA mempunyai peran ganda yaitu sebagai sumber energi bagi ternak ruminansia dan kerangka karbon untuk pembentukan protein mikroba (Sutardi et al. 1983). Komponen utama VFA terdiri atas asam-asam organik yang mudah menguap yakni asam asetat, propionat, dan butirat (Arora 1995). Susanti et al. (2001) menyatakan bahwa asam asetat merupakan senyawa non glukogenik dan hampir semua jaringan tubuh mampu mengoksidasinya akibatnya menimbulkan heat increament yang tinggi sehingga nilai efisiensinya menjadi rendah. Asam propionat adalah senyawa sugar precursor atau bakalan glukogenik utama. Asam butirat adalah senyawa yang Tabel 8 Produksi VFA parsial (%) dan total VFA (mM) kacang kedelai dan
kacang merah setelah inkubasi 24 jam dengan 4 level suhu pengeringan Peubah Jenis
K.Kedelai 64.35±0.92 66.02±2.19 65.01±1.70 65.35±2.38 65.18±1.72 K.Merah 64.12±1.65 62.89±1.43 64.49±1.08 64.39±0.69 63.97±1.27 Rataan 64.24±1.20 64.45±2.38 64.75±1.30 64.87±1.65
C3 (%)
K.Kedelai 24.33±0.42 23.25±1.08 23.86±0.75 24.18±1.42 23.90±0.95 K.Merah 23.84±1.60 24.26±1.04 23.48±0.65 23.55±0.50 23.78±0.94 Rataan 24.08±1.08 23.75±1.10 23.67±0.66 23.87±1.01
C4 (%)
K.Kedelai 11.32±0.88 10.73±1.20 11.13±0.96 10.47±0.96 10.91±0.92a
K.Merah 12.04±1.29 12.85±0.70 12.03±0.61 12.05±0.70 12.24±0.83b
Rataan 11.68±1.06 11.79 ± 1,46 11.58 ± 0.87 11.26 ± 1.15
Total VFA (mM)
K.Kedelai 31.79±15.73 55.27±13.06 37.50±14.31 37.58±10.88 40.53±14.82 K.Merah 43.96±30.44 50.79±24.84 46.98±10.10 52.63±2.63 48.59±17.69
Rataan 37.87±22.67 53.03±17.92 42.24±12.23 45.10±10.86
22
dapat dimetabolisme menjadi badan keton sebagai sumber energi alternatif. Produksi VFA yang tinggi merupakan indikator kecukupan energi bagi ternak (Sakinah 2005).
Hasil analisis ragam menunjukkan bahwa perlakuan tidak berbeda nyata terhadap persentase C2 dan C3. McDonald et al. (1988) melaporkan bahwa C2 dan C3 merupakan asam lemak yaitu prekursor bagi pembentukan lemak air susu maupun tubuh, sehingga jika ratio perbandingan C2/C3 tinggi, maka kadar lemak air susu akan naik, sebaliknya jika ratio perbandingan C2/C3 rendah, maka kadar lemak air susu akan turun. Perbandingan C2/C3 yang rendah akan merangsang pembentukan lemak tubuh. Produksi C2 lebih tinggi dibandingkan C3 dan C4, hal ini dikarenakan cairan rumen diambil dari sapi fistula yang diberi pakan dengan jumlah hijauan lebih banyak dibandingkan konsentrat.
Hasil penelitian juga menunjukkan bahwa perlakuan tidak memberikan interaksi yang nyata terhadap konsentrasi C4. Faktor jenis kacang berbeda nyata terhadap konsentrasi C4, dimana persentase C4 kacang kedelai lebih rendah dibandingkan kacang merah. Hal ini diduga ketika inkubasi protein pada kacang kedelai lebih banyak digunakan dalam pembentukan NH3 dibandingkan pada kacang merah. Sebagian kecil protein dicerna oleh bakteri Clostridium sporogenus yang mengubah asam laktat menjadi asam butirat di dalam rumen sehingga menyebabkan pembusukan, dimana ketika sampel setelah diinkubasi dikeluarkan dari botol vial injection mengeluarkan bau yang lebih busuk dibandingkan sampel hijauan atau pakan serat. Asam butirat dalam rumen sebelum diserap terlebih dulu dirubah menjadi beta hidroksi butirat dan bersama dengan asam asetat masuk kedalam peredaran darah dalam bentuk badan-badan keton yang nantinya dalam jaringan tubuh digunakan sebagai sumber energi. Asam propionat setelah masuk dalam peredaran darah dibawa ke hati. Di hati asam ini diubah menjadi glukosa. Sebagian glukosa disimpan di hati sebagai glikogen hati dan sebagian lagi menjadi alfa gliserolfosfat untuk digunakan sebagai koenzim pereduksi dalam sintesa lemak tubuh, sebagai sumber energi dan dalam tubuh disimpan sebagai glikogen otot. Oleh sebab itu asam propionat disebut juga asam yang bersifat glukogenik karena dapat dikatabolisme menjadi glukosa atau sebagai sumber glukosa tubuh.
Penyerapan VFA sangat dipengaruhi oleh perbedaan konsentrasi VFA dalam cairan rumen dengan konsentrasi VFA yang terdapat di dalam sel-sel epitel atau darah. Semakin panjang rantai atom C nya maka semakin cepat laju absorbsinya, sehingga urutan absorbsinya adalah asam butirat, asam propionat dan asam asetat. Pada ternak laktasi asam asetat digunakan untuk sintesis lemak susu diambing. Persentase asam asetat, propionat, dan butirat berdasarkan hasil penelitian secara berturut-turut yaitu 63.97% dan 65.18%, 23.78% dan 23.90%, 10.91% dan 12.24%. Menurut Mc Donald et al. (2002) secara umum jumlah produksi VFA untuk C2 adalah 65%, untuk C3 adalah 21%, untuk C4 adalah 14%.
23 inkubasi 24 jam sedangkan pada literatur selama 4 jam (Van Soest 1982). Nilai total VFA tertinggi diperoleh kacang merah yaitu 48.59 mM. Hal ini disebabkan kacang merah kaya akan karbohidrat, kadar BETN yang tinggi dan nilai NPN yang tinggi sehingga kacang merah sangat mudah difermentasi oleh mikroba rumen akibat dari karbohidrat terlarutnya yang tinggi. Konsentrasi VFA dipengaruhi oleh penyerapan dan fermentabilitas dari pakan sumber karbohidrat (Hindratiningrum et al. 2011). Hal ini sesuai dengan yang dikemukan oleh Arora (1995) bahwa tinggi rendahnya produksi VFA dipengaruhi oleh tingkat fermentabilitas bahan pakan, jumlah karbohidrat yang mudah larut, pH rumen, kecernaan bahan pakan, jumlah serta macam bakteri yang ada di dalam rumen.
4
SIMPULAN DAN SARAN
Simpulan
Suhu pengeringan yang tepat dan aman berdasarkan fraksinasi dan utilisasi protein adalah suhu 50 dan 60 0C karena tidak menimbulkan masalah pada ternak ruminansia, jika suhu pengeringan ditingkatkan maka fraksi nitrogen yang tidak larut (NDICP dan ADICP) akan meningkat sehingga lebih banyak protein yang tidak bisa diutilisasi oleh ternak ruminansia akibatnya kecernaan protein kasar menurun. Total produksi gas, KCBK, VFA tertinggi diperoleh kacang merah, sedangkan kecepatan produksi gas, KCPK, NH3 tertinggi diperoleh kacang kedelai.
Saran
1. Saran bagi petani atau masyarakat adalah jika bahan pakan yang akan dikeringkan jumlahnya banyak dan kurang efektif menggunakan oven maka dapat dikeringkan dengan cara dijemur di bawah cahaya matahari karena kering matahari suhunya berkisar 60 oC sehingga tidak merusak kandungan nutrien bahan pakan.
2. Perlu dilakukan penelitian lanjutan yaitu analisis in vitro tiga tahap dengan menggunakan enzim pankreatin supaya dapat diketahui berapa jumlah protein yang terserap di usus halus sehingga dapat menggambarkan kecernaan protein secara utuh pada saluran pencernaan ternak ruminansia.
DAFTAR PUSTAKA
Almatsier S. 2009. Prinsip Dasar Ilmu Gizi. Jakarta (ID): EGC.
[AOAC] Association of Analytical Communities. 2005. Official Methods of Analyses of AOAC International (18th ed.). Arlington (US): Association of Official Analytical Chemical.