KONDISI
VIABLE BUT NONCULTURABLE
Cronobacter sakazakii
SELAMA PEMBENTUKAN BIOFILM
YESICA MARCELINA ROMAULI SINAGA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kondisi Viable but Nonculturable Cronobacter sakazakii selama Pembentukan Biofilm adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2016
Yesica Marcelina Romauli Sinaga
RINGKASAN
YESICA M. R. SINAGA. Kondisi Viable but Nonculturable Cronobacter sakazakii selama Pembentukan Biofilm. Dibimbing oleh SULIANTARI dan RATIH DEWANTI-HARIYADI.
Cronobacter sakazakii merupakan bakteri patogen bawaan pangan yang
telah diasosiasikan dengan penyakit septisemia, meningitis dan enterokolitis pada bayi yang baru lahir akibat konsumsi susu formula bubuk. Bakteri ini memiliki kemampuan untuk bertahan dalam kondisi suboptimal seperti Aw rendah. Selain itu bakteri ini dilaporkan dapat membentuk biofilm pada permukaan kontak pangan seperti silikon, lateks, polikarbonat, dan stainless steel yang dapat menjadi sumber kontaminasi.
Sebagai mekanisme pertahanan pada lingkungan yang tidak menguntungkan, bakteri yang bukan pembentuk spora dapat memasuki kondisi
viable but nonculturable (VBNC). Bakteri yang berada pada kondisi VBNC
masih memiliki viabilitas tetapi tidak dapat membentuk koloni pada media agar. Keberadaan Cronobacter spp. dalam kondisi VBNC dapat menjelaskan hasil negatif yang diperoleh pada pengujian sampel susu formula bubuk atau produk lainnya yang terkontaminasi bakteri tersebut. Pengamatan kondisi VBNC menggunakan bakteri mutan yang dilabel GFP (green fluorescent protein) telah dilaporkan. Selain itu, bakteri C. sakazakii pGFPuv mutan diketahui memiliki tingkat pertumbuhan yang sama dengan wildtype (WT). Hasil penelitian
sebelumnya menggunakan C. sakazakii pGFPuv mutan menunjukkan densitas
biofilm bakteri yang dihitung menggunakan direct microscopic count (DMC) berbeda dari hitungan menggunakan media agar. Hal ini diduga karena bakteri tersebut memasuki kondisi VBNC.
Penelitian ini bertujuan untuk mengetahui kemampuan bakteri Cronobacter sakazakii memasuki kondisi VBNC selama pembentukan biofilm pada permukaan pelat stainless steel (SS) dan kemampuannya untuk diresusitasi. C. sakazakii
YRt2a mutan pGFPuv dan wildtype (WT) yang sebelumnya diisolasi dari susu formula bubuk digunakan dalam penelitian ini. Biofilm dibentuk pada permukaan SS dalam 1/10 Trypticase Soy Broth (TSB). Kulturabilitas biofilm diamati dengan
menyeka dan menumbuhkan sel sesil WT dan mutan berturut-turut ke dalam media Trypticase Soy Agar (TSA) atau TSA yang mengandung 100 μg/mL ampisilin (TSAA). Sementara itu, viabilitas sel sesil dihitung dengan mikroskop fluoresens menggunakan direct microscopic count (DMC) untuk isolat mutan dan direct viable count (DVC) untuk WT. Biofilm C. sakazakii mutan pGFPuv pada pelat SS berada dalam kondisi VBNC pada pengamatan hari ke-25, sementara biofilm C. sakazakii WT masih dapat dikulturkan sampai pengamatan hari ke-63.
Natrium piruvat di dalam media padat dan cair tidak mampu meresusitasi sel biofilm C. sakazakii pGFPuv dalam kondisi VBNC. C. sakazakii mutan lebih cepat memasuki kondisi VBNC dibandingkan isolat WT. Nutrisi yang semakin berkurang diduga mengakibatkan biofilm C. sakazakii pGFPuv memasuki VBNC.
SUMMARY
YESICA M. R. SINAGA. Viable but Nonculturable State of Cronobacter sakazakii during Biofilm Formation. Supervised by SULIANTARI and RATIH DEWANTI-HARIYADI.
Cronobacter sakazakii is a foodborne pathogen that has been associated
with septicemia, meningitis and necrotizing enterocolitis in certain groups of neonates due to powder infant formula. The bacteria have the ability to survive in suboptimal conditions such as low Aw. Additionally the bacterium has been reported to form biofilm in food contact surfaces such as silicon, latex, polycarbonate, and stainless steel which could serve as a source of contamination.
As a survival mechanism in adverse condition, non-sporeforming bacteria could enter viable but nonculturable (VBNC) state. Bacteria in the VBNC state are alive and capable of metabolic activity but fail to grow and develop into colonies on the agar media. VBNC state may explain negative result for
Cronobacter contamination test in powdered infant formula or other products that
actually are contaminated with Cronobacter spp. Studies on VBNC using GFP-labelled bacteria have been reported. Furthermore, it is known that the growth rate of transformant pGFPuv-labeled C. sakazakii and the wildtype were similar. Our
previous studies using a pGFPuv-labeled bacteria suggested that biofilm density of C. sakazakii enumerated by direct microscopic count (DMC) was differ from that on culture media. This was likely because the bacteria enter a VBNC state.
This research aimed to study the ability of C. sakazakii to enter a VBNC
state during biofilm formation on stainless steel (SS) surfaces and its resuscitability using sodium pyruvate. C. sakazakii YRt2a pGFPuv mutant and
wildtype (WT) previously isolated from powder infant formula were used in this study. Biofilms were developed on SS surfaces in 1/10 Trypticase Soy Broth (TSB). Culturability of the biofilms was monitored by swabbing and plating the WT or mutant sessile cells onto Trypticase Soy Agar (TSA) or TSA containing 100 μg/mL ampicillin (TSAA), respectively. Meanwhile, their viability was measured by a fluorescence microscope using DMC for mutant isolates and direct viable count (DVC) for the WT. Biofilm of C. sakazakii pGFPuv mutant on SS
enters VBNC state in the observation at day 25, while the WT C. sakazakii
biofilms was still culturable until day 63. Sodium pyruvate in solid and liquid medium was not able to resuscitate biofilm cells of C. sakazakii pGFPuv in
VBNC state. C. sakazakii pGFPuv mutants enter VBNC state faster than the WT
isolates. Depleted nutrient is thought to drive biofilm of C. sakazakii pGFPuv to enter VBNC.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
i
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
KONDISI
VIABLE BUT NONCULTURABLE
Cronobacter sakazakii
SELAMA PEMBENTUKAN BIOFILM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2015 dengan judul Kondisi
Viable but NonculturableCronobacter sakazakii selama Pembentukan Biofilm.
Terima kasih penulis ucapkan kepada Ibu Dr Dra Suliantari, MS dan Ibu Prof Dr Ir Ratih Dewanti-Hariyadi, MSc selaku dosen pembimbing yang telah banyak memberi arahan dan bimbingan selama penulis melaksanankan penelitian hingga menjadi suatu bentuk karya ilmiah. Ucapan terima kasih kepada Direktorat Jendral Pendidikan Tinggi, Kementerian Pendidikan dan Kebudayaan Republik Indonesia yang telah memberikan beasiswa BPPDN selama tahun 2013-2015. Selain itu penulis juga mengucapkan terima kasih kepada penguji luar komisi ibu Dr Siti Nurjanah, STP, MSi dan ibu Dr Ir Harsi Dewantari Kusumaningrum selaku Ketua Program Studi Ilmu Pangan IPB, yang telah memberikan masukan pada saat ujian siding tesis untuk membuat karya ilmiah ini menjadi lebih baik.
Ungkapan terima kasih juga disampaikan kepada ayahanda Drs Antonius Sinaga MS (Alm), ibunda Dr Dra Murniaty Simorangkir MS, kakak Yomi Sinaga SHut, adik Jeremia Sinaga dan Yani Sarah Sinaga serta seluruh keluarga besar, atas segala doa dan kasih sayangnya. Terima kasih juga penulis ucapkan kepada staf Laboratorium SEAFAST Center IPB Mbak Ari, Mbak Tami, Kak Al, teman-teman dan adik-adik Lab Mikrobiologi 2015 dan 2016, teman-teman-teman-teman IPN 2013 serta semua pihak yang telah membantu dalam penyelesaian tugas akhir ini yang tidak dapat disebutkan satu per satu.
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2016
v
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesis 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Karakteristik Cronobacter spp. 3
C. sakazakii pGFPuv 5
Kondisi VBNC pada Bakteri 5
Resusitasi 7
3 METODE 10
Waktu dan Tempat Penelitian 10
Bahan dan Alat 10
Prosedur Penelitian 10
Persiapan dan Konfirmasi Isolat 11
Pembentukan Biofilm untuk Menginduksi Kondisi VBNC 12
Viabilitas dan Kulturabilitas Sel Biofilm 12
Resusitasi di dalam Media Padat dan Cair 13
Pengamatan Sel Biofilm C. sakazakii WT dengan SEM 13
4 HASIL DAN PEMBAHASAN 14
Viabilitas dan Kulturabilitas Cronobacter sakazakii pGFPuv dan
Cronobacter sakazakii WT selama Pembentukan Biofilm 14
Resusitasi C. sakazakii pGFPuv dan C. sakazakii WT 18
Hasil Pengamatan Sel Biofilm C. sakazakii WT dengan SEM 20
5 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 21
DAFTAR PUSTAKA 22
DAFTAR TABEL
1 Isolat Cronobacter spp. asal pangan di Indonesia 4
2 Resusitasi C. sakazakii pGFPuv dalam media padat dan cair 18
DAFTAR GAMBAR
1 Pengaruh lingkungan yang tidak optimal terhadap pertumbuhan
bakteri 6
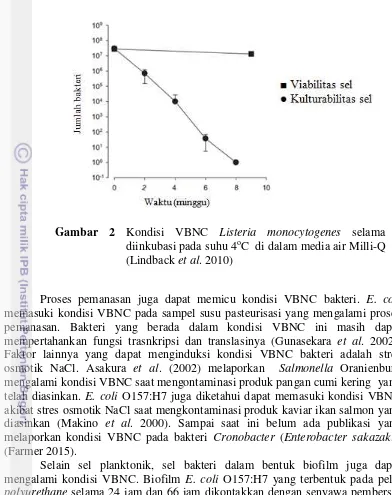
2 Kondisi VBNC Listeria monocytogenes selama diinkubasi pada
suhu 4oC di dalam media air Milli-Q 7
3 Struktur kimia asam piruvat dan natrium piruvat 8
4 Diagram alir penelitian 11
5 Sel biofilm C. sakazakii YRt2a pGFPuv hari ke-7 di bawah
mikroskop fluoresens 14
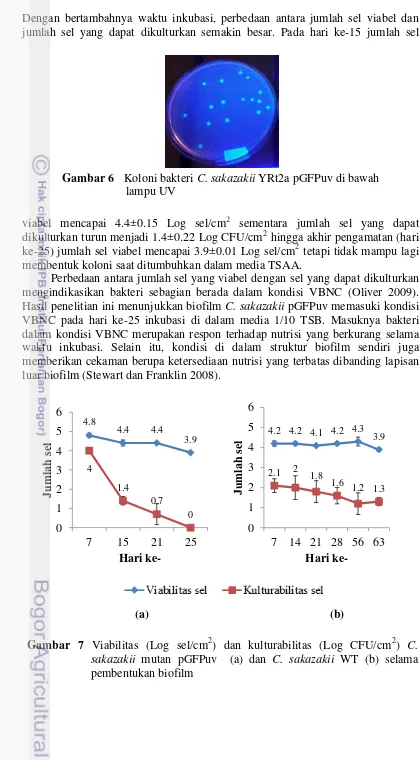
6 Koloni bakteri C. sakazakii YRt2a pGFPuv di bawah lampu
UV 15
7 Viabilitas dan kulturabilitas C. sakazakii mutan pGFPuv dan C.
sakazakii WT selama pembentukan biofilm 15
8 Sel VBNC C. sakazakii WT hari ke-63 yang diamati
menggunakan metode DVC di bawah mikroskop fluoresens 16 9 Resusitasi C. sakazakii WT di dalam media padat 19
10 Sel biofilm C. sakazakii WT setelah 24 jam dan 63 hari pada
1
PENDAHULUAN
Latar Belakang
Cronobacter sakazakii adalah salah satu spesies dari Cronobacter spp yang bersifat bakteri Gram negatif, berbentuk batang, fakultatif anaerob dan motil (Healy et al. 2010; Iversen et al. 2008). Cronobacter spp. sebagai bakteri patogen
bawaan pangan telah diasosiasikan dengan penyakit septisemia, meningitis dan enterokolitis pada bayi yang baru lahir (Emami et al. 2012; Townsend et al. 2008).
Kasus infeksi pada bayi oleh Cronobacter spp. diduga akibat konsumsi susu
formula bayi yang tercemar bakteri tersebut.
C. sakazakii tergolong bakteri yang dapat bertahan dalam kondisi tidak menguntungkan. Cronobacter spp. bertahan lebih baik pada sereal dengan Aw
rendah selama 12 bulan dibandingkan Aw tinggi (Lin dan Beuchat 2007). Selain itu, kemampuan bakteri ini menempel pada peralatan makan bayi dapat menjadi sumber cemaran C. sakazakii. Bakteri ini diketahui dapat menempel dan
membentuk biofilm pada permukaan kontak pangan seperti silikon, lateks, polikarbonat, dan stainless steel (Lee et al. 2012; Pratomo 2015).
Bakteri yang tidak memiliki kemampuan membentuk spora umumnya dapat memasuki kondisi viable but nonculturable (VBNC) sebagai mekanisme
pertahanan pada lingkungan yang tidak menguntungkan (Colwell 2000). Bakteri dalam kondisi VBNC masih memiliki viabilitas yang ditandai dengan adanya integritas membran, berespirasi, aktif bermetabolisme, dan mempertahankan transkripsi mRNA tetapi tidak dapat membentuk koloni pada media agar (Pinto et al. 2013). Keberadaan bakteri Cronobacter spp. dalam kondisi VBNC dapat menjelaskan hasil negatif yang diperoleh pada pengujian sampel susu formula bubuk atau produk lainnya yang terkontaminasi bakteri tersebut (Farmer 2015).
Estimasi jumlah bakteri patogen pada sampel pangan yang lebih rendah dari sebenarnya dan kegagalan mengidentifikasi bakteri patogen saat dikulturkan menimbulkan resiko terkait keamanan pangan (Ramamurthy et al. 2014). Bakteri
dalam kondisi VBNC masih dapat mempertahankan sifat virulensinya. Bakteri C. jejuni yang dapat mempertahankan kondisi VBNC dengan lebih baik memiliki virulensi yang lebih tinggi (Magajna dan Schraft 2015). E. coli yang berada pada
kondisi VBNC masih dapat menghasilkan sejumlah kecil verotoksin (Dinu dan Bach 2011).
Pengamatan kondisi VBNC telah dilakukan dengan menggunakan bakteri mutan yang dilabel dengan GFP (green fluorescent protein) (Dinu dan Bach
2011). Pelabelan C. sakazakii dengan pGFPuv telah dilakukan Nurjanah et al. (2014) dan bakteri mutan tersebut sudah digunakan dalam pengujian pembentukan biofilm pada berbagai permukaan kontak pangan (Pratomo 2015). Enumerasi biofilm C. sakazakii pGFPuv menggunakan DMC (direct microscopic count)
menghasilkan densitas bakteri yang lebih tinggi hingga 2 Log CFU/cm2 dibandingkan dengan metode pemupukan tuang. Hal ini diduga karena terdapat beberapa sel C. sakazakii mutan yang berada dalam kondisi VBNC (Pratomo
2015).
cholerae dan Escherichia coli dapat diresusitasi pada media dengan penambahan natrium piruvat dan katalase (Imamura et al. 2015; Na et al. 2006); Salmonella
Typhimurium dan E. coli diresusitasi dengan ferrioxamine E, oksirase dan autoinducer enterobakteria (Reissbrodt et al. 2002); dan Vibrio cholera dapat diresusitasi dengan mengkulturkan bakteri bersama sel eukariotik (Senoh et al. 2010).
Tujuan penelitian ini adalah mengevaluasi apakah C. sakazakii wildtype
(WT) dan mutan pGFPuv dapat memasuki kondisi VBNC selama pembentukan biofilm di dalam media dengan nutrisi yang rendah. Selain itu, penelitian ini juga bertujuan untuk mengetahui apakah sel VBNC yang terbentuk pada penelitian ini dapat diresusitasi dengan natrium piruvat.
Perumusan Masalah
Keberadaan bakteri dalam kondisi VBNC dapat mengakibatkan estimasi jumlah bakteri patogen pada sampel pangan yang lebih rendah dari sebenarnya dan kegagalan mengidentifikasi bakteri patogen saat dikulturkan akan menimbulkan resiko terkait keamanan pangan. Kemampuan bakteri C. sakazakii
untuk membentuk biofilm pada permukaan kontak pangan diketahui dapat menjadi sumber cemaran. Oleh sebab itu perlu dikaji kemampuan C. sakazakii
memasuki kondisi VBNC selama pembentukan biofilm.
Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Mengevaluasi kemampuan C. sakazakii memasuki kondisi VBNC selama
pembentukan biofilm pada permukaan stainless steel (SS)
2. Mengetahui kemampuan natrium piruvat dalam meresusitasi sel VBNC yang terbentuk.
Hipotesis
C. sakazakii dapat memasuki kondisi VBNC selama pembentukan biofilm
pada permukaan SS dan dapat diresusitasi pada media dengan penambahan natrium piruvat.
Manfaat Penelitian
3
pembentukan biofilm dan kemampuannya diresusitasi dengan natrium piruvat sebagai pertimbangan dalam analisis pengujian keamanan pangan.
2
TINJAUAN PUSTAKA
Karakteristik Cronobacter spp.
Bakteri Cronobacter spp. (Enterobacter sakazakii) merupakan bakteri gram
negatif, berbentuk batang, tidak membentuk spora, motil, dan bersifat fakultatif anaerob (ICMSF 2002). Berdasarkan klasifikasi terbaru bakteri ini dibagi menjadi enam spesies antara lain C. sakazakii, C. malonaticus, C. turicensis, C. muytjensii,
C. dublinensis, dan C. genomospecies I (Iversen et al. 2007; 2008).
Cronobacter spp. diketahui sebagai bakteri emerging patogen oportunistik
asal pangan karena dapat menyebabkan infeksi yang cukup parah seperti septisemia, meningitis, dan enterokolitis pada kelompok usia tertentu seperti pada bayi dan bayi yang baru lahir (Emami et al. 2012; Townsend et al. 2008). Bakteri
ini banyak ditemukan di berbagai tempat, di lingkungan, di peralatan rumah tangga, dan di bahan pangan (Molloy et al. 2009). Akan tetapi, susu formula bayi
umumnya diduga sebagai sumber kasus infeksi pada bayi (Himelright et al. 2002;
Iversen dan Forsythe 2004). Selain itu, bakteri ini juga diisolasi dari berbagai sumber pangan lain selain susu formula bayi seperti keju, daging, sayuran, biji-bijian, herbal dan rempah-rempah (Iversen dan Forsythe 2003). C. sakazakii juga
dapat tumbuh dengan baik pada potongan buah segar seperti apel, melon, semangka, kubis, wortel, timun, dan tomat (Beuchat et al. 2009). Di Indonesia,
Cronobacter spp. telah diisolasi dari berbagai sampel pangan kering seperti susu
formula (Meutia et al. 2008), susu formula lanjutan (Estuningsih et al.
2006a;2006b), makanan bayi (Meutia et al. 2008; Estuningsih et al. 2006a;2006b; Gitapratiwi et al. 2012), pati jagung atau maizena dan bubuk coklat (Gitapratiwi
et al. 2012). Isolat-isolat tersebut dapat dilihat pada Tabel 1.
Isolat-isolat tersebut telah diteliti kinetika inaktivasinya. Isolat C. sakazakii
YRt2a yang diisolasi dari susu formula telah diuji aktivitas sitotoksiknya secara invitro pada sel Vero dan diketahui bahwa isoat tersebut merupakan isolat nontoksik (Nurjanah 2014). Isolat YRt2a memiliki nilai D pada suhu 50-58oC yang lebih besar dibandingkan dengan nilai D untuk isolat DESb7a, DESb10, DESc13 (Seftiono 2012). Isolat YRt2a memiliki nilai D 119.05-169.40 menit pada suhu 50oC, 43.10-80.00 menit pada suhu 52oC, 31.64-33.67 menit pada suhu 54oC, dan 5.83 menit pada suhu 56oC (Seftiono 2012).
Selain berada dalam bahan pangan, bakteri ini juga dapat tumbuh pada permukaan kontak pangan. C. sakazakii telah dilaporkan dapat melakukan
Cronobacter spp. tumbuh optimal pada suhu 37- 43oC dan mampu bertahan pada suhu 6oC (Iversen et al. 2004). Pada susu formula bubuk dan sereal, C. sakazakii akan bertahan lebih baik justru ketika aw produk rendah (0.25-0.3)
dibandingkan aw tinggi (0.69-0.82) dan bertahan lebih baik pada suhu 4oC dibandingkan pada suhu 30oC selama 12 bulan penyimpanan (Beuchat et al. 2009). Edelson-Mammel et al. (2005) melaporkan C. sakazakii dengan populasi awal 6
log CFU/g yang diinokulasikan dalam susu formula bubuk mengalami penurunan populasi sel sebesar 2.4 log CFU/g pada penyimpanan suhu 20-22oC selama 150
hari, selanjutnya terjadi penurunan kembali sebesar 1 siklus log setelah penyimpanan 534 hari. Larasati (2012) menguji C. sakazakii YRC3a yang
ditumbuhkan pada produk susu bubuk hasil pengeringan semprot yang disimpan selama 12 minggu pada berbagai RH dan diketahui jumlah bakteri C. sakazakii
menurun sebesar 0.21 log CFU/g (RH 70%), sebesar 3.13 log CFU/g (RH 50%), dan sebesar 3.31 log CFU/g (RH 90%) dari jumlah awal 5.39 log CFU/g.
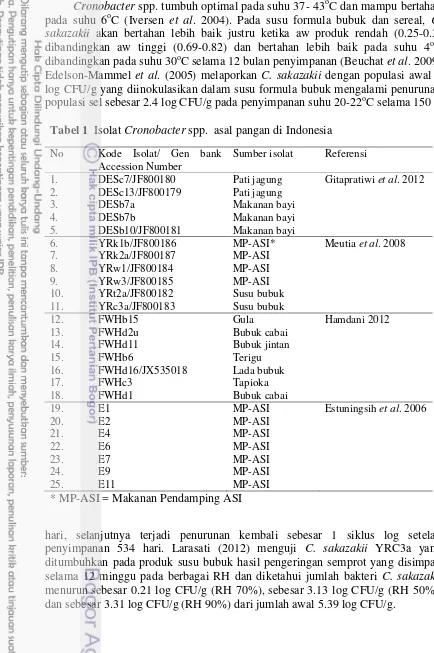
Tabel 1 Isolat Cronobacter spp. asal pangan di Indonesia
No Kode Isolat/ Gen bank Accession Number
Sumber isolat Referensi
1. DESc7/JF800180 Pati jagung Gitapratiwi et al. 2012 2. DESc13/JF800179 Pati jagung
3. DESb7a Makanan bayi
4. DESb7b Makanan bayi
5. DESb10/JF800181 Makanan bayi
5
C. sakazakii pGFPuv
Pelabelan C. sakazakii YRt2a dan FWHd16 dengan plasmid GFPuv melalui proses transformasi dengan metode CaCl2 telah dilakukan oleh Nurjanah et al.
(2014). Bakteri mutan hasil transformasi tersebut memiliki kestabilan plasmid setelah 2 subkultur sebesar 97.00% untuk isolat FWHd16 dan 93.95% untuk isolat YRt2a. Bakteri mutan mampu mengekspresikan plasmid GFPuv tersebut ketika dikonfirmasi secara fenotip di bawah mikroskop fluoresens. Kedua isolat mutan juga menunjukkan kurva pertumbuhan yang sama dengan isolat WT.
Isolat-isolat mutan tersebut telah diaplikasikan untuk mempelajari ketahanan panas bakteri tersebut selama pengeringan jagung pada suhu 40oC, 45oC dan 50oC. Isolat toksik FWHd16 lebih tahan pada ke-3 suhu pengeringan dibandingkan dengan isolat nontoksik YRt2a (Nurjanah et al. 2013). Selain itu, kedua isolat mutan tersebut telah digunakan dalam pengujian pembentukan biofilm pada permukaan kontak pangan seperti stainless steel, PTFE, dan Buna-N (Pratomo 2015). Hasil menunjukkan bahwa densitas biofilm isolat mutan yang terbentuk pada permukaan kontak pangan selama 3 hari inkubasi tidak menunjukkan perbedaan yang signifikan dengan densitas biofilm yang dihasilkan isolat WT. Perbedaan densitas biofilm isolat mutan justru teramati antara densitas biofilm yang dihitung dengan metode pengamatan mikroskop secara langsung dan metode hitungan cawan. Densitas biofilm yang diperoleh dengan hitungan mikroskop lebih tinggi 2 Log dibandingkan dengan metode hitungan cawan. Hal ini diduga karena sel mutan memasuki kondisi VBNC (Pratomo 2015).
Kondisi VBNC pada Bakteri
Sel bakteri ketika mengalami stres akan memberi respon yang berbeda, bergantung tingkat keparahan stres. Ketika berada pada lingkungan suboptimum untuk pertumbuhan, bakteri dapat mengalami stres adaptif. Paparan terhadap stres yang lebih besar selanjutnya dapat mengakibatkan injuri pada bakteri. Bakteri yang mengalami injuri dengan keparahan rendah, atau disebut juga mengalami injuri subletal, dapat dipulihkan dengan mudah dalam media nonselektif atau dalam media kaya nutrisi. Injuri bakteri dengan keparahan yang lebih tinggi lagi, dimana pemulihannya memerlukan media dan lingkungan yang lebih kompleks, dapat mengakibatkan masuknya bakteri ke kondisi viable but nonculturable
(VBNC) (Ray dan Bhunia 2014) (Gambar 1).
Menurut Xu et al. (1982) sel bakteri yang berada dalam kondisi VBNC
tidak dapat membentuk koloni pada media agar tetapi masih memiliki aktivitas metabolik. Dan sel bakteri E. coli dan V. cholera yang berada dalam larutan garam 5-25% tidak mampu tumbuh di dalam media agar akan tetapi masih memiliki viabilitas.
Kemampuan bakteri memasuki kondisi VBNC berbeda-beda antara spesies bakteri yang dipengaruhi antara lain oleh jumlah inokulum, waktu inkubasi dan suhu inkubasi dari bakteri tersebut (Nicolo et al. 2011; Dinu dan Bach 2011). Bakteri patogen pangan yang telah dilaporkan mengalami kondisi VBNC antara lain Escherichia coli O157:H7 (Dinu dan Bach 2013), Campylobacter jejuni (Magajna dan Schraft 2015; Cappelier et al. 1999),
Salmonella Thypi (Cho dan Kim 1999), Vibrio parahaemolyticus (Mizunoe et al.
2000; Wong et al. 2004) dan Shigella dysenteriae (Rahman et al. 1994). Dari
Gambar 2 dapat dilihat bahwa Listeria monocytogenes mengalami kondisi VBNC yang ditandai dengan perbedaan antara viabilitas sel yang dihitung menggunakan mikroskop dan kulturabilitas sel yang dihitung dengan metode agar cawan. Ketidakmampuan membentuk koloni pada media agar cawan dan adanya viabilitas sel harus diverifikasi untuk mengetahui sel berada dalam kondisi VBNC (Pinto et al. 2013).
Nicolo et al. (2011) menunjukkan bahwa bakteri patogen E. coli O157:H7
dan Salmonella Typhimurium memasuki kondisi VBNC di dalam jus anggur yang sudah dipasteurisasi dan disimpan di suhu rendah selama 24 jam inkubasi. Jus anggur dapat menjadi media yang menimbulkan stres bagi pertumbuhan mikroba karena karakteristiknya yang mengandung senyawa antimikroba alami, pH rata-rata sekitar 3 dan kandungan karbohidrat yang rendah.
E.coli O157:H7 yang diinokulasi pada permukaan daun selada memasuki
kondisi VBNC pada suhu 8oC (Dinu dan Bach 2011). Kondisi stres pada nutrisi rendah (PBS) dan suhu yang rendah sebesar 4oC juga dapat menyebabkan kondisi VBNC pada Campylobacter jejuni (Magajna dan Schraft 2015).
7
Proses pemanasan juga dapat memicu kondisi VBNC bakteri. E. coli
memasuki kondisi VBNC pada sampel susu pasteurisasi yang mengalami proses pemanasan. Bakteri yang berada dalam kondisi VBNC ini masih dapat mempertahankan fungsi trasnkripsi dan translasinya (Gunasekara et al. 2002).
Faktor lainnya yang dapat menginduksi kondisi VBNC bakteri adalah stres osmotik NaCl. Asakura et al. (2002) melaporkan Salmonella Oranienburg mengalami kondisi VBNC saat mengontaminasi produk pangan cumi kering yang telah diasinkan. E. coli O157:H7 juga diketahui dapat memasuki kondisi VBNC
akibat stres osmotik NaCl saat mengkontaminasi produk kaviar ikan salmon yang diasinkan (Makino et al. 2000). Sampai saat ini belum ada publikasi yang
melaporkan kondisi VBNC pada bakteri Cronobacter (Enterobacter sakazakii)
(Farmer 2015).
Selain sel planktonik, sel bakteri dalam bentuk biofilm juga dapat mengalami kondisi VBNC. Biofilm E. coli O157:H7 yang terbentuk pada pelat polyurethane selama 24 jam dan 66 jam dikontakkan dengan senyawa pembersih
(P3-TOPAX M95) dan desinfektan (P3-FONGIKLLAR) mengakibatkan sel biofilm memasuki kondisi VBNC (Marouani-Gadri et al. 2010). Penelitian yang
dilakukan Magajna dan Schraft (2015) menunjukkan sel biofilm memasuki kondisi VBNC lebih cepat dibandingkan sel planktonik. Sel biofilm C. jejuni
memasuki kondisi VBNC setelah 10 hari perlakuan sementara sel planktonik memasuki kondisi VBNC setelah 30-40 hari perlakuan pada media dengan nutrisi rendah (PBS) dan suhu inkubasi 4oC.
Resusitasi
Beberapa penelitian menunjukkan bakteri yang berada dalam kondisi VBNC dapat diresusitasi kembali sehingga dapat membentuk koloni pada media
agar cawan. Resusitasi merupakan transisi sel dari kondisi VBNC ke kondisi yang dapat dikulturkan (Pinto et al. 2011). Resusitasi dapat dilakukan dengan menginkubasikan sampel yang mengandung bakteri yang berada dalam keadaan VBNC selama waktu tertentu pada media cair ataupun padat yang disuplementasi zat tertentu.
Natrium piruvat merupakan salah satu zat yang digunakan dalam resusitasi. Asam piruvat dan garamnya yaitu piruvat (Gambar 3) merupakan senyawa kimia intermediet penting yang dihasilkan melalui siklus biologis dari metabolisme gula. Garam natrium dari asam piruvat merupakan garam yang paling penting dari asam
α-oksokarboksilat, yang dikenal sebagai garam natrium dari asam 2-oksopropanoit atau asam α-ketopropionat (Ingle et al. 2014).
Piruvat, anion dari asam piruvat merupakan produk akhir glikolisis, dimana glukosa dikonversi menjadi piruvat asetil CoA, yang kemudian dioksidasi sempurna menjadi CO2. Ketika oksigen tidak tersedia dalam jumlah yang cukup,
piruvat dimetabolisme menjadi laktat. Pada organisme anaerobik seperti khamir, piruvat dikonversi menjadi etanol. Pada glukoneogenesis, piruvat dikonversi menjadi glukosa (Sigma Aldrich).
Kemampuan piruvat untuk mencegah kematian sel akibat H2O2 telah
dilaporkan (Hinoi et al. 2006; Desagher et al. 1997). Piruvat melindungi sel dari H2O2 melalui mekanisme nonenzimatis (Desagher et al. 1997). Piruvat bereaksi
dengan H2O2 menghasilkan karbondioksida, air dan asam asetat: CH3COCOO- +
H2O2→ CH3COO- + CO2 + H2O (Hinoi et al. 2006).
Natrium piruvat dapat meresusitasi sel yang berada dalam keadaan VBNC. H2O2 baik yang diproduksi oleh sel ketika ditumbuhkan dalam media agar cawan
maupun yang secara alami terdapat pada media padat diduga berperan dalam masuknya sel ke kondisi VBNC (Oliver 2009). Oleh sebab itu, karena memiliki kemampuan mereduksi H2O2, maka natrium piruvat dapat digunakan untuk
resusitasi sel VBNC (Na et al. 2006). Selain kemampuannya mereduksi H2O2,
natirum piruvat dapat meresusitasi sel VBNC karena piruvat juga diketahui sebagai penyedia sumber energi yang cepat dimana senyawa ini akan dimetabolisme dengan cepat dan efisien (Guccione et al. 2008). Lebih lanjut Morishige et al. (2013) meneliti kemampuan resusitasi piruvat pada bakteri Salmonella Enteritidis yang berada dalam keadaan VBNC. Hasil penelitian menunjukkan biosintesis DNA dan protein mengalami perubahan dengan adanya piruvat. Piruvat memberikan kemampuan pada sel menyatukan radio-label yang lebih banyak ke dalam prekursor selama proses resusitasi sel VBNC sehingga memacu pembentukan makromolekul seperti DNA dan protein (Morishige et al.
2013).
Asam piruvat Natrium piruvat
9
Faktor lainnya yang digunakan untuk resusitasi adalah ferrioxamine E, oksirase, dan AI (autoinducer) Enterobacteriaceae. Reissbrodt et al. (2002) menguji kemampuan ketiga faktor ini dalam meresusitasi S. Typhimurium dan
EHEC yang mengalami kondisi cekaman akibat waktu inkubasi yang lama dalam air yang mengalami proses destilasi dua kali dan akibat proses pemanasan. Dari ketiga senyawa tersebut AI Enterobacteriaceae paling efektif dalam meresusitasi bakteri dalam kondisi VBNC dibandingkan dengan oksirase dan ferrioxamine E.
Ferrioxamine E mencegah kerusakan sel yang berada dalam proses pemulihan akibat radikal oksigen. Senyawa ini berperan mengurangi produksi radikal oksigen. Resusitasi bakteri yang berada dalam keadaan VBNC didalam BPW yang ditambahkan ferrioxamine E dapat memperpanjang masa resusitasi S. enterica serovar Typhimurium yang berada dalam kondisi sangat stres dibandingkan dengan resusitasi dalam media BPW tanpa penambahan ferrioxamine E. Bakteri E. coli tidak dapat menggunakan ferrioxamine untuk
mendapatkan zat besi sehingga tidak dapat diresusitasi dengan suplementasi ferrioxamine E seperti Salmonella (Reissbrodt et al. 2002). Ferrioxamine E dapat
digunakan dalam proses resusitasi Cronobacter spp. yang berada dalam keadaan
VBNC seperti yang dinyatakan oleh perusahaan komersial Sigma Aldrich (Farmer 2015).
Antioksidan oksirase yang ditambahkan ke dalam p-TSB (phosphate -buffered TSB) mampu meresusitasi EHEC yang berada dalam kondisi VBNC dengan waktu yang lebih lama dibandingkan resusitasi dalam p-TSB yang tidak disuplementasi oksirase. Oksirase berperan mereduksi radikal oksigen yang terbentuk dalam pertumbuhan sel (Reissbrodt et al. 2002).
AI (autoinducer) merupakan senyawa nonprotein yang bersifat stabil terhadap panas hasil sekresi enterobakteri yang dihasilkan dengan adanya hormon neuroendokrin (NE) mamalia (Freestone et al. 1999). Penelitian yang dilakukan Reissbrodt et al. (2002) menggunakan bakteri Yersinia ruckeri dalam memproduksi AI. Resusitasi bakteri EHEC O8:H- menggunakan AI dalam media p-TSB menunjukkan kemampuan meresusitasi bakteri sampai 455 hari, sementara tanpa suplementasi AI, resusitasi hanya berlangsung selama 88 hari. Mekanisme AI dalam meresusitasi bakteri belum diketahui. Salah satu dugaan mekanisme resusitasi oleh AI yaitu fungsinya sebagai sensor kuorom dari bakteri yang mengalami cekaman.
Selain faktor yang telah disebutkan di atas, penelitian lainnya juga melaporkan bahwa katalase dapat digunakan untuk resusitasi bakteri yang berada dalam keadaan VBNC. Mizuone et al. (2000) menambahkan katalase dalam
media agar sehingga V. parahaemolyticus yang berada dalam kondisi VBNC akibat inkubasi dalam media dengan nutrisi rendah (PBS termodifikasi) dan suhu rendah (4oC) mampu membentuk koloni. Penambahan katalase pada permukaan media agar juga menstimulasi pertumbuhan baik secara fisik maupun kimia mikroorganisme yang mengalami cekaman. Sel yang mengalami cekaman akibat panas diketahui mengalami penurunan aktivitas katalase dan katalase yang ditambahkan berperan untuk mencegah akumulasi hidrogen peroksida di dalam maupun di sekitar sel yang mengalami stres (Martin et al. 1976).
Penelitian lainnya menunjukkan bahwa resusitasi bakteri V. parahaemolyticus yang berada dalam keadaan VBNC justru terjadi akibat
resusitasi dengan menambahkan katalase pada media agar juga diujikan dalam penelitian tersebut. Akan tetapi, perlakuan ini tidak signifikan dalam meresusitasi bakteri. Kemungkinan kondisi VBNC yang terjadi pada penelitian ini berbeda dengan kondisi VBNC yang terjadi akibat sel yang sensitif terhadap peroksida, yang dapat diresusitasi dengan menambahkan katalase atau piruvat pada media agar.
3
METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan selama bulan Maret 2015 – Juni 2016 di Laboratorium Mikrobiologi Mutu dan Keamanan Pangan SEAFAST Center IPB, Ruang Persiapan Departemen Ilmu dan Teknologi Pangan IPB, dan di Lab Zoologi-PUSLIT Biologi-LIPI, Cibinong.
Bahan dan Alat
Bakteri Cronobacter spp. yang digunakan dalam penelitian ini adalah
Cronobacter sakazakii wildtype (WT) YRt2a yang diisolasi dari susu formula
bubuk (Meutia 2008) dan Cronobacter sakazakii pGFPuv mutan YRt2a yang
ditransformasi menggunakan metode CaCl2 (Nurjanah et al. 2014). Bahan yang digunakan pada penelitian ini adalah Brain Heart Infusion (BHI) (Oxoid Ltd.,
UK), Buffered Peptone Water (BPW) (Oxoid Ltd., UK), Tryptic Soy Agar (TSA)
(Oxoid Ltd., UK), Tryptic Soy Broth (TSB) (Oxoid Ltd., UK), natrium piruvat (Sigma-Aldrich, USA), Garam fisiologis NaCl 0.85% (GF), pelat stainless steel
(SS) (ukuran 1.0 x 1.0 cm), Na-heksametafosfat (Sigma-Aldrich, USA), Yeast Extract (Oxoid Ltd, UK), Asam Nalidiksat (Sigma-Aldrich, USA) dan ampisilin (PT. Erita Farma, Indonesia).
Alat utama yang digunakan adalah sentrifus (Hermle Labortechnik, Wehningen, Jerman), lampu UV (Desage Heidelberg Min UVIS), mikroskop fluoresen (Olympus CH3O, Olympus Corporation, Center Valley, USA), mikroskop scanning electron microscopy (JSM-5310 LV, Japan) dan shaker.
Prosedur Penelitian
11
Persiapan dan Konfirmasi Isolat
Isolat C. sakazakii pGFPuv dan wildtype (WT) dari stok manik-manik beku disegarkan dalam BHI (Oxoid Ltd, UK) dengan penambahan ampisilin (PT. Erita Farma, Indonesia) (100μg/ml) (BHIA) untuk isolat mutan pGFPuv dan tanpa penambahan ampisilin (BHI) (Oxoid Ltd, UK) untuk isolat WT. Bakteri diinkubasi dalam inkubator (Heraeus, Germany) selama 24 jam pada suhu 37oC. Kultur yang telah disegarkan dikonfirmasi dengan menumbuhkan bakteri pada media TSA (Oxoid Ltd, UK) dengan penambahan ampisilin (PT. Erita Farma, Indonesia) 100μg/ml (TSAA) untuk bakteri mutan pGFPuv dan DFI (Oxoid Ltd, UK) untuk isolat WT, kemudian bakteri diinkubasi pada suhu 37oC selama 24 jam. Pengamatan koloni yang tumbuh pada media TSAA (Oxoid Ltd, UK) dilakukan di bawah lampu UV (Desaga, Heidelberg, Germany) dengan panjang gelombang 366 nm. Isolat yang telah dikonfirmasi pada TSAA (Oxoid Ltd, UK) dan DFI (Oxoid Ltd, UK) masing-masing diambil satu ose dan dimasukkan ke dalam BHIA (Oxoid Ltd, UK) atau BHI (Oxoid Ltd, UK) lalu diinkubasi pada suhu 37oC selama 16-17 jam sampai fase logaritmik akhir sehingga didapatkan kultur dengan populasi sel sekitar 108-109 CFU/mL (Nurjanah et al. 2013). Sebelum
kembali (HERMLE Z383K, Germany) selama 4 menit pada kecepatan 4500 rpm suhu 4 oC. Pelet diresuspensi dalam 1 mL BPW (Oxoid Ltd, UK). Masing-masing
inokulum siap digunakan untuk induksi kondisi VBNC.
Pembentukan Biofilm untuk Menginduksi Kondisi VBNC
Pembentukan biofilm dilakukan pada stainless steel (SS) berukuran 1 cm x
1 cm. Sebelum digunakan pelat direndam dalam larutan deterjen komersial selama 1 jam kemudian dibilas dengan akuades. Pelat dikeringkan lalu dibersihkan dengan alkohol 70%. Setelah proses sanitasi pelat dikeringkan pada suhu 55oC selama 1 malam menggunakan inkubator (H.ORTH GmbH, West Germany) (Marques et al. 2007).
Pembentukan biofilm dilakukan berdasarkan Pratomo (2015) dengan modifikasi. Modifikasi yang dilakukan adalah konsentrasi media yang digunakan (dari 1/5 TSB menjadi 1/10 TSB) dan jumlah mikroba awal dari (dari 105 CFU/mL menjadi 107 CFU/mL). Media dengan nutrisi rendah (1/10 dari takaran pembuatan TSB yang ditetapkan produsen) 200mL yang telah berisi pelat SS disterilisasi pada suhu 121oC selama 15 menit (ALP Co.,Ltd, Tokyo, Japan). Masing-masing inokulum C. sakazakii pGFPuv dan WT hasil sentrifugasi
sebanyak 2 mL diinokulasikan ke dalam media tersebut sehingga diperoleh jumlah mikroba awal 107 CFU/mL. Sampel diinkubasi pada suhu kamar (28-30oC) dengan agitasi 70 rpm (InnovaTM 2300, New Brunswick Scientific, New Jersey, USA). Pada interval waktu tertentu pelat SS diambil dan dilakukan penghitungan viabilitas dan kulturabilitas sel biofilm.
Viabilitas dan Kulturabilitas Sel Biofilm
Viabilitas sel biofilm diamati menggunakan mikroskop fluoresens (Olympus CH3O) pada panjang gelombang 395 nm dan emisi 509 nm. Biofilm C. sakazakii pGFPuv pada permukaan SS dibilas menggunakan GF 0.85% steril dan
ditiriskan kemudian diamati di bawah mikroskop fluoresens (Pratomo 2015). Sel yang berfluoresens saat pengamatan kemudian dihitung dengan DMC (direct microscopic count) (Parizzi et al. 2004). Untuk biofilm C. sakazakii WT
pengamatan viabilitas dilakukan dengan metode DVC (direct viable count) (modifikasi Du et al. 2007). Modifikasi yang dilakukan yaitu perubahan suhu inkubasi dari 26oC menjadi suhu ruang (28-30oC) dan waktu inkubasi dari 16 jam menjadi 18 jam. Setelah biofilm pada SS dibilas, pelat direndam dalam larutan yang mengandung yeast extract (Oxoid Ltd, UK) dan asam nalidiksat (Sigma-Aldrich, USA) dengan konsentrasi masing-masing 0.025% dan 0.002% pada suhu ruang dan kondisi gelap selama 18 jam. Berikutnya pelat dibilas dengan GF 0.85% steril dan dilanjutkan dengan pewarnaan menggunakan acridine orange
13
et al. 2004). Hasil perhitungan yang diperoleh dinyatakan dalam bentuk Log sel/cm2.
Kulturabilitas diamati dengan menghitung koloni pada media agar. Biofilm pada permukaan SS dibilas dengan GF 0.85% steril dan diusap dengan kapas steril. Hasil usapan biofilm C. sakazakii pGFPuv atau WT masing-masing dimasukkan ke dalam tabung yang berisi 9 mL BPW (Oxoid Ltd, UK) dan 1 mL Na-heksametafosfat 0.1% (Sigma-Aldrich, USA) (Pratomo 2015). Tabung kemudian divortex (Vortex Genie 2, Scientific Industries Inc., USA), dan 0.1 mL masing-masing isolat tersebut disebar dalam media TSAA atau TSA dalam cawan yang diinkubasi selama 24 jam pada suhu 37oC. Jumlah koloni yang tumbuh kemudian diamati. Kondisi VBNC dianggap tercapai jika bakteri sudah tidak membentuk koloni pada media agar tetapi masih dapat dihitung dengan DMC atau DVC (Pinto et al. 2013).
Resusitasi di dalam Media Padat dan Cair
Resusitasi menggunakan media padat dilakukan dengan menumbuhkan sebanyak 0.1 mL sel biofilm hasil usapan dalam tabung yang berisi BPW+Na-heksametafosfat seperti yang sudah dijelaskan sebelumnya ke dalam media agar TSAA (Oxoid Ltd, UK) dan TSA (Oxoid Ltd, UK) yang mengandung natrium piruvat 0.1% (9mM) (Sigma-Aldrich, USA) (Imamura et al. 2015). Sementara itu, resusitasi menggunakan media cair dilakukan dalam BPW (Oxoid Ltd, UK) yang mengandung natrium piruvat 0.1% (9mM) (Sigma-Aldrich, USA) (modifikasi Wai et al. 2000). Modifikasi yang dilakukan adalah perubahan air steril menjadi
BPW (Oxoid Ltd, UK). Resusitasi dalam media cair dilakukan hanya untuk isolat mutan saja. Hasil usapan biofilm dalam tabung BPW+Na-heksametafosfat sebanyak 0.1 ml dimasukkan pada 10 mL media cair dan diinkubasi selama 24 jam pada suhu 37oC (Heraeus, Germany). Sebanyak 0.1 ml suspensi bakteri hasil inkubasi disebar pada media TSAA untuk melihat ada tidaknya pembentukan koloni. Jika setelah inkubasi 24 jam resusitasi belum berhasil, inkubasi diperpanjang hingga 72 jam kemudian ditumbuhkan kembali pada media TSAA.
Pengamatan Sel Biofilm C. sakazakii WT dengan SEM
Biofilm C. sakazakii WT yang terbentuk pada permukaan pelat SS setelah 24
jam dan 63 hari inkubasi diamati dengan menggunakan mikroskop scanning electron microscopy. Pelat SS dibersihkan terlebih dahulu dengan merendam pelat dalam caccodylate buffer kurang lebih 2 jam, dan dilakukan agitasi dalam
ultrasonic cleaner selama 5 menit. Prefiksasi sampel selanjutnya dilkukan dengan
sebanyak 4 kali selama 5 menit, kemudian direndam dalam alkohol 70% selama 20 menit, dalam alkohol 85% selama 20 menit, dan dalam alkohol 95% selama 20 menit berturut-turut. Terakhir sampel direndam dalam etanol sebanyak 2 kali selama 10 menit. Sampel selanjutnya dikeringkan dengan melakukan perendaman sampel dalam tert butanol sebanyak 2 kali selama 10 menit, dibekukan dalam
freezer hingga beku, kemudian dimasukkan dalam freeze dryer. Sampel
direkatkan pada specimen stub, dan dilapisi dengan Au menggunakan ion coater.
Sampel kemudian siap diamati dengan menggunakan mikroskop scanning electron microscopy (Goldstein et al. 1992).
4
HASIL DAN PEMBAHASAN
Viabilitas dan Kulturabilitas Cronobacter sakazakii pGFPuv dan Cronobacter
sakazakii WT selama Pembentukan Biofilm
Bakteri C. sakazakii pGFPuv dapat membentuk biofilm pada permukaan SS.
Bakteri sesil mutan ini terlihat berpendar hijau di bawah mikroskop fluoresens pada panjang gelombang 396 nm yang menandakan viabilitas (Gambar 5). Demikian juga dengan koloni bakteri mutan yang tumbuh pada media TSAA saat diamati di bawah lampu UV menghasilkan warna hijau fluoresens (Gambar 6). Bakteri yang telah disisipi gen GFP akan mengekspresikan GFP sehingga berpendar hijau karena protein tersebut memiliki kromofor yang dibentuk oleh 3 residu asam amino pada rantai peptida (Shimomura 2009).
Sel biofilm C. sakazakii pGFPuv yang terbentuk pada permukaan SS menunjukkan viabilitas dan kulturabilitas yang baik pada hari ke-7 dengan jumlah sel viabel yang lebih tinggi 0.8 Log yaitu 4.8±0.10 Log sel/cm2 dibandingkan jumlah sel yang dapat dikulturkan (4.0±0.15 Log CFU/cm2) (Gambar 7a).
15
Dengan bertambahnya waktu inkubasi, perbedaan antara jumlah sel viabel dan jumlah sel yang dapat dikulturkan semakin besar. Pada hari ke-15 jumlah sel
viabel mencapai 4.4±0.15 Log sel/cm2 sementara jumlah sel yang dapat dikulturkan turun menjadi 1.4±0.22 Log CFU/cm2 hingga akhir pengamatan (hari ke-25) jumlah sel viabel mencapai 3.9±0.01 Log sel/cm2 tetapi tidak mampu lagi membentuk koloni saat ditumbuhkan dalam media TSAA.
Perbedaan antara jumlah sel yang viabel dengan sel yang dapat dikulturkan mengindikasikan bakteri sebagian berada dalam kondisi VBNC (Oliver 2009). Hasil penelitian ini menunjukkan biofilm C. sakazakii pGFPuv memasuki kondisi
VBNC pada hari ke-25 inkubasi di dalam media 1/10 TSB. Masuknya bakteri dalam kondisi VBNC merupakan respon terhadap nutrisi yang berkurang selama waktu inkubasi. Selain itu, kondisi di dalam struktur biofilm sendiri juga memberikan cekaman berupa ketersediaan nutrisi yang terbatas dibanding lapisan luar biofilm (Stewart dan Franklin 2008).
Gambar 6 Koloni bakteri C. sakazakii YRt2a pGFPuv di bawah
Sel biofilm bakteri C. sakazakii yang memasuki kondisi VBNC belum pernah dilaporkan tetapi untuk bakteri lain sudah dilaporkan. Sel biofilm
Campylobacter jejuni memasuki kondisi VBNC dengan ditumbuhkan di dalam
media dengan nutrisi rendah phosphate buffered saline (PBS) dan inkubasi dilakukan pada suhu rendah 4oC (Magajna dan Schraft 2015). Sel biofilm C. jejuni tersebut memasuki kondisi VBNC dalam 10-20 hari inkubasi. Sel biofilm Staphylococcus aureus yang diinkubasi pada suhu 37oC dalam media minimal M9
tanpa glukosa memasuki kondisi VBNC setelah 40 hari inkubasi (Pasquaroli et al. 2014).
Pengamatan viabilitas isolat WT di bawah mikroskop fluoresens dapat dilihat pada Gambar 8. Viabilitas ditandai dengan adanya sel yang memanjang sesuai dengan penelitian Na et al. (2006) yang juga mengamati sel VBNC E. coli
dengan metode DVC. Dengan metode ini, yeast extract yang ditambahkan
berperan sebagai sumber nutrisi yang akan dimetabolisme oleh sel yang viabel sementara asam nalidiksat berperan sebagai inhibitor spesifik replikasi DNA yang mencegah pembelahan sel sehingga dihasilkan sel yang memanjang atau membesar (Babu et al. 2014).
Berbeda dengan isolat mutan, viabilitas dan kulturabilitas sel biofilm isolat
C. sakazakii WT pada hari ke-7 menunjukkan perbedaan lebih besar yakni 2 Log
(Gambar 7b). Meskipun demikian, viabilitas isolat WT relatif lebih stabil selama 56 hari inkubasi dengan jumlah sel biofilm berkisar antara 4.1-4.3 Log sel/cm2. Penurunan dalam jumlah kecil sel viabel (0.4 Log) terjadi pada akhir pengamatan (hari ke-63). Sementara itu kulturabilitas isolat WT yang pada awal pengamatan berjumlah 2.1±0.34 Log CFU/cm2 menunjukkan penurunan seiring bertambahnya waktu inkubasi meski dalam jumlah kecil (0.8 Log selama 63 hari inkubasi). Pada akhir pengamatan (hari ke-63) sel biofilm WT masih dapat dikulturkan mencapai 1.3±0.20 Log CFU/cm2 meskipun jumlah ini lebih kecil dibandingkan viabilitas biofilm WT yang mencapai jumlah 3.9 ±0.07 Log sel/ cm2.
Sel biofilm C. sakazakii WT masih dapat dikulturkan hingga hari ke-63. Hasil ini berbeda dengan Magajna dan Schraft (2015) yang mengamati kondisi
Gambar 8 Sel VBNC C. sakazakii WT hari ke-63 yang
17
VBNC sel biofilm C. jejuni setelah 10-20 hari inkubasi pada suhu 4oC demikian juga dengan hasil Pasquaroli et al. (2014) yang mengamati sel biofilm S. aureus
memasuki VBNC setelah 40 hari. Sel biofilm C. sakazakii dapat dikulturkan
dengan lebih lama dibanding bakteri tersebut diduga akibat perbedaan media yang digunakan untuk inkubasi. Media 1/10 TSB yang digunakan dalam penelitian ini masih memiliki nutrisi yang lebih tinggi dibandingkan media PBS yang digunakan pada bakteri C. jejuni dan media minimal M9 tanpa glukosa yang
digunakan pada sel biofilm S. aureus. Selain itu, adanya perlakuan suhu rendah juga kemungkinan mempercepat sel biofilm C. jejuni memasuki VBNC.
Sel biofilm mutan sudah memasuki kondisi VBNC pada hari ke-25 sedangkan biofilm isolat WT masih dapat dikulturkan hingga hari ke-63. Perbedaan respon sel biofilm mutan dan WT terhadap cekaman berupa kekurangan nutrisi mungkin dipengaruhi oleh penyisipan GFP pada bakteri mutan. Allison dan Sattenstall (2007) melaporkan bahwa GFP yang disisipkan pada bakteri Escherichia coli memiliki efek signifikan terhadap sifat fisiologis bakteri tersebut dan mengakibatkan bakteri menjadi lebih rentan terhadap cekaman senyawa antimikroba dibandingkan dengan bakteri WT. Adanya protein GFP dapat menimbulkan cekaman fisiologis pada bakteri dengan mengalihkan fungsi-fungsi seluler penting bakteri untuk mereplikasi protein asing tersebut dalam jumlah tinggi. Oleh karena itu diduga protein GFP pada bakteri C. sakazakii
mutan memberikan pengaruh pada pertumbuhan bakteri saat menghadapi cekaman sehingga menunjukkan perbedaan dengan isolat WT yang tidak disisipi GFP. Nurjanah et al. (2014) memperlihatkan tidak adanya perbedaan yang
signifikan antara kurva pertumbuhan sel planktonik C. sakazakii isolat mutan dan
WT. Akan tetapi, pengujian pertumbuhan isolat mutan dan WT ini dilakukan pada kondisi pertumbuhan optimal yaitu dalam media BHI yang tidak memberikan cekaman nutrisi rendah.
Kestabilan plasmid bakteri mutan juga kemungkinan berpengaruh pada ketidakmampuan bakteri mutan untuk tumbuh pada media TSA yang mengandung ampisilin. Bakteri mutan dapat kehilangan plasmid GFPuv yang sebelumnya disisipkan ke dalam bakteri tersebut, sehingga bakteri tersebut juga kehilangan sifat resistensi terhadap ampisilin. Bakteri mutan yang disisipi pGFPuv memiliki sifat resisten terhadap ampisilin karena plasmid tersebut mengandung gen resisten ampisilin (Sambrook dan Russel 2001). Proses segregasi atau pemisahan plasmid mempengaruhi kestabilan plasmid pada sel. Ketidakseimbangan antara kecepatan pembelahan sel dengan distribusi plasmid dapat mengakibatkan adanya generasi sel bakteri yang tidak mengandung plasmid sehingga sel anak yang tidak mendapatkan plasmid menjadi sel normal kembali (Akasaka et al. 2015; Ma et al. 2011). Media yang digunakan untuk
Resusitasi C. sakazakii pGFPuv dan C. sakazakii WT di dalam Media Padat dan Cair
Resusitasi sel VBNC bakteri C. sakazakii pGFPuv pada hari ke-26 di
dalam media padat TSAA yang disuplementasi natrium piruvat tidak mampu mengembalikan kemampuan bakteri untuk membentuk koloni (Tabel 2). Penggunaan media cair BPW yang disuplementasi dengan natrium piruvat juga tidak berhasil meresusitasi sel VBNC bakteri C. sakazakii pGFPuv bahkan setelah
perpanjangan inkubasi 72 jam di dalam media cair (Tabel 2).
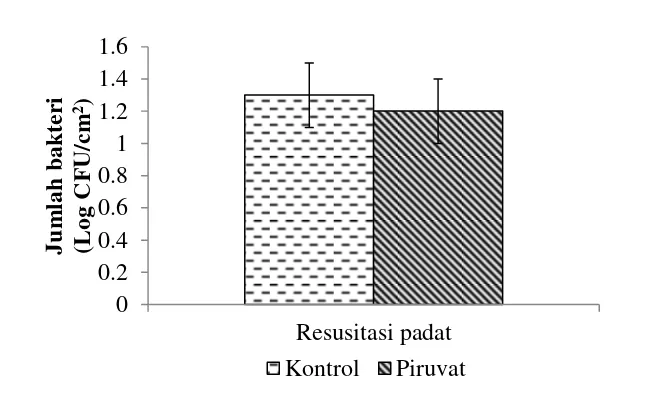
Sel biofilm isolat WT hari ke-63 juga tidak mengalami peningkatan jumlah sel yang dapat dikulturkan saat ditumbuhkan pada media agar yang ditambahkan piruvat (Gambar 9). Tidak ada perbedaan jumlah koloni yang terbentuk pada media TSA dengan (1.2±0.20 Log CFU/cm2) atau tanpa penambahan piruvat pada hari ke-63 (1.3±0.20 Log CFU/cm2). Penambahan natrium piruvat hanya dilakukan pada media pertumbuhan padat untuk isolat WT karena sel biofilm masih dapat dikulturkan hingga hari ke-63.
Oliver (2009) menyebutkan bahwa H2O2 baik yang diproduksi oleh sel
bakteri ketika dicawankan atau yang secara alami terdapat pada media agar, berpengaruh pada kondisi VBNC Vibrio vulnificus. Pada kondisi cekaman suhu
rendah, ekpresi gen katalase (katG) menurun seiring dengan kemampuan
pembentukan koloni yang juga menurun. Natrium piruvat merupakan senyawa yang dapat mereduksi H2O2 (Reissbrodt et al. 2002). Oleh sebab itu natrium
piruvat dapat digunakan untuk resusitasi sel VBNC. Selain itu piruvat juga diketahui sebagai penyedia sumber energi yang dimetabolisme dengan cepat dan efisien (Guccione et al. 2008).
Dalam penelitian ini, penambahan natrium piruvat dalam media TSAA atau TSA tidak dapat meningkatkan kulturabilitas baik sel biofilm isolat mutan maupun WT. Hal ini menunjukkan bahwa sel memasuki VBNC tidak disebabkan oleh sel yang sensitif terhadap H2O2. Ketidakmampuan senyawa pereduksi H2O2
dalam resusitasi sel C. sakazakii VBNC memberikan bukti bahwa kondisi VBNC
pada bakteri tidak hanya disebabkan oleh sensitivitas sel terhadap akumulasi H2O2
yang mencegah sel untuk dikulturkan (Lleo et al. 2001).
Ketidakberhasilan resusitasi sel VBNC di dalam media yang disuplementasi senyawa antioksidan seperti katalase maupun natrium piruvat
Tabel 2 Resusitasi C. sakazakii pGFPuv dalam media padat dan cair
19
sudah dilaporkan pada sel Listeria monocytogenes yang memasuki VBNC setelah
inkubasi dalam air Milli-Q pada suhu 4oC (Lindback et al. 2010); sel VBNC E. coli yang diinkubasi dalam air keran pada suhu 23oC (Aurass et al. 2011) dan sel
biofilm S. aureus yang memasuki kondisi VBNC setelah 40 hari inkubasi pada
suhu 37oC dalam media nutrisi rendah yaitu M9 tanpa glukosa (Pasquaroli et al. 2013). Gupte et al. (2003) mengamati kondisi VBNC Salmonella Typhimurium yang diinkubasi pada suhu 5oC dan 21oC di dalam media 2.3% Instant Ocean.
Media agar dengan dan tanpa penambahan katalase digunakan untuk menghitung koloni bakteri. Hasil yang diperoleh menunjukkan sejak awal pengamatan, jumlah koloni bakteri pada media dengan dan tanpa penambahan katalase tidak berbeda. Dari hasil penelitian tersebut diduga bahwa sel memasuki VBNC bukan karena sensitif terhadap H2O2.
Meskipun demikian beberapa penelitian lainnya menunjukkan sel VBNC dapat diresusitasi menggunakan senyawa antioksidan. Media yang mengandung natrium piruvat berhasil meresusitasi sel biofilm VBNC Campylobacter jejuni
yang memasuki VBNC dalam 10-20 hari (Magajna dan Schraft 2015) dan sel biofilm S. aureus yang memasuki kondisi VBNC ≤ 30 hari akibat inkubasi dalam
media M9 tanpa glukosa yang mengandung antibiotik (Pasquaroli et al. 2013).
Hasil penelitian Pinto et al. (2011) menunjukkan bahwa sel bakteri E. coli
yang berada dalam kondisi VBNC yang tidak mampu diresusitasi dengan natrium piruvat dapat diresusitasi dengan penambahan senyawa lain seperti asam amino dan autoinducer (AI) dari Enterobacteriaceae. Autoinducer (AI) sebagai quorum sensor pada bakteri juga diketahui berperan penting dalam pembentukan biofilm
E. coli O157:H7 (Lim et al. 2016). Selain itu faktor-faktor lain yang dapat
meresusitasi sel VBNC adalah sel eukariotik (Senoh et al. 2010) dan senyawa antioksidan lainnya seperti ferrioxamine E dan oksirase (Reissbrodt et al. 2002) juga telah dilaporkan.
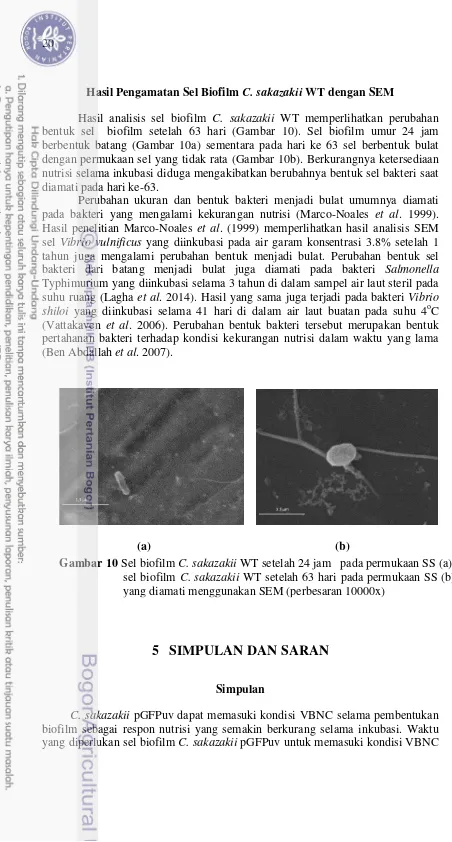
Hasil Pengamatan Sel Biofilm C. sakazakii WT dengan SEM
Hasil analisis sel biofilm C. sakazakii WT memperlihatkan perubahan bentuk sel biofilm setelah 63 hari (Gambar 10). Sel biofilm umur 24 jam berbentuk batang (Gambar 10a) sementara pada hari ke 63 sel berbentuk bulat dengan permukaan sel yang tidak rata (Gambar 10b). Berkurangnya ketersediaan nutrisi selama inkubasi diduga mengakibatkan berubahnya bentuk sel bakteri saat diamati pada hari ke-63.
Perubahan ukuran dan bentuk bakteri menjadi bulat umumnya diamati pada bakteri yang mengalami kekurangan nutrisi (Marco-Noales et al. 1999).
Hasil penelitian Marco-Noales et al. (1999) memperlihatkan hasil analisis SEM
sel Vibrio vulnificus yang diinkubasi pada air garam konsentrasi 3.8% setelah 1 tahun juga mengalami perubahan bentuk menjadi bulat. Perubahan bentuk sel bakteri dari batang menjadi bulat juga diamati pada bakteri Salmonella
Typhimurium yang diinkubasi selama 3 tahun di dalam sampel air laut steril pada suhu ruang (Lagha et al. 2014). Hasil yang sama juga terjadi pada bakteri Vibrio shiloi yang diinkubasi selama 41 hari di dalam air laut buatan pada suhu 4oC
(Vattakaven et al. 2006). Perubahan bentuk bakteri tersebut merupakan bentuk
pertahanan bakteri terhadap kondisi kekurangan nutrisi dalam waktu yang lama (Ben Abdallah et al. 2007).
5
SIMPULAN DAN SARAN
Simpulan
C. sakazakii pGFPuv dapat memasuki kondisi VBNC selama pembentukan biofilm sebagai respon nutrisi yang semakin berkurang selama inkubasi. Waktu yang diperlukan sel biofilm C. sakazakii pGFPuv untuk memasuki kondisi VBNC
(a) (b)
Gambar 10 Sel biofilm C. sakazakii WT setelah 24 jam pada permukaan SS (a), sel biofilm C. sakazakii WT setelah 63 hari pada permukaan SS (b)
21
lebih cepat dibandingkan C. sakazakii. Pada hari ke-25 C. sakazakii pGFPuv sudah memasuki kondisi VBNC dengan jumlah sel viabel 3.9 Log sel/cm2. Sementara C. sakazakii WT hingga hari ke-63 masih memiliki sel yang dapat
dikulturkan dengan jumlah 1.3 Log CFU/cm2 dan sel viabel berjumlah 3.9 Log sel/cm2. Penambahan natrium piruvat ke dalam media padat dan cair tidak berhasil meresusitasi sel biofilm C. sakazakii yang berada dalam kondisi VBNC.
Saran
Perlu penelitian lebih lanjut dengan menggunakan media padat yang disuplementasi natrium piruvat 0.3% pada setiap pengamatan untuk melihat kemampuan resusitasi sel VBNC yang baru terbentuk di awal pengamatan. Kemudian untuk mengetahui faktor yang menyebabkan masuknya bakteri pada kondisi VBNC, maka resusitasi dapat dilakukan dengan menggunakan senyawa antioksidan lain seperti oksirase, senyawa yang dapat mencegah pembentukan H2O2 seperti ferrioxamine E dan faktor resusitasi lainnya seperti asam amino, AI,
DAFTAR PUSTAKA
Allison DG, Sattenstall MA. 2007. The influence of green fluorescent protein incorporation on bacterial physiology: a note of caution. J Appl Microbiol. 103:318-324.doi:10.1111/j.1365-2672.2006.03243.x.
Asakura H, Makino SI, Takagi T et al. 2002. Passage in mice causes a change in
the ability of Salmonella enterica serovar Oranienburg to survive NaCl osmotic stress: resuscitation from the viable but non-culturable state. FEMS Microbiol Lett. 212(1):87–93.
Auras P, Prager R, Flieger A. 2011. EHEC/EAEC O104:H4 strain linked with the 2011 German outbreak of haemolytic uremic syndrome enters into the viable but non-culturable state in response to various stresses and resuscitates upon stress relief. Environ Microbiol. 13(12):3139-3148. doi:
10.1111/j.1462-2920.2011.02604.x.
Ben Abdallah F, Lagha R, Bakhrouf A. 2007. Resuscitation and morphological alterations of Salmonella bovismorbificans cells under starvation in soil. World J Microbiol Biotechnol. 126:794-800.
Beuchat LR, Kim H, Gurtler JB, Lin L, Ryu J, Richards GM. 2009. Cronobacter sakazakii in foods and factors affecting its survival, growth, and inactivation. Int J Food Microbiol. 136:204–213.doi:10.1016/j.ijfoodmicro.2009.02.029. Cappelier JM, Magras C, Jouve JL dan Federighi M. 1999. Recovery of viable but
non-culturable Campylobacter jejuni cells in two animal models. Food Microbiol.16:375-383.
Cho JC, Kim SJ. 1999. Viable, but non-culturable, state of a green £uorescence protein-tagged environmental isolate of Salmonella Typhi in groundwater
and pond water. FEMS Microbiol Lett. 170:257-264.
Colwell RR. 2000. Viable but nonculturable bacteria: a survival strategy. J Infect Chemother. 6:121–125. doi:10.1007/PL00012151.
Desagher S, Glowinski J, Premont J. 1997. Pyruvate protects neurons against hydrogen peroxide-induced toxicity. J Neurosci. 17(23):9060-9067.doi: Dinu LD, Bach S. 2011. Induction of viable but non-culturable Escherichia coli
O157:H7 in the phyllosphere of lettuce: a food safety risk factor. Appl Environ Microb. 77(23):8295-8302. doi: 10.1128/AEM.05020-11.
Du M, Chen J, Zhang X, Li A, Li Y, Wang Y. 2007. Retention of virulence in a viable but nonculturable Edwardsiella tarda isolate. Appl Environ Microb.
73(4):1349-1354. doi: 10.1128/AEM.02243-06.
Edelson-Mammel SG, Porteus MK, Buchanan RL. 2005. Survival of
Enterobacter sakazakii in a dehydrated powdered infant formula. J Food Protect. 68: 1900-1902
Emami CN, Mittal R, Wang L, Ford HR, Prasadarao NV. 2012. Role of neutrophils and macrophages in the pathogenesis of necrotizing enterocolitis caused by Cronobacter sakazakii. J Surg Res. 172:18–28. doi:
10.1016/j.jss.2011.04.019.
Estuningsih S, Kress C, Hassan AA, Akineden Ö, Schneider E, Usleber E. 2006a.
Cronobactericeae in dehydrated powdered infant formula manufactured in
23
Estuningsih S, Rochman N, Wibawan IWT. 2006b. Potensi kejadian meningitis pada neonates akibat infeksi Enterobacter sakazakii yang diisolasi dari makanan dan susu bayi. Penelitian Hibah Bersaing XIV Perguruan Tinggi. Bogor: Lembaga Penelitian dan Pemberdayaan Masyarakat, Institut Pertanian Bogor.
Farmer JJ. 2015. Review: My 40-year history with Cronobacter/Enterobacter sakazakii – lessons learned, myths debunked, and recommendations
[review]. Frontiers in Pediatrics. 3(84):1-12. doi: 10.3389/fped.2015.00084. Gitapratiwi D, Dewanti-Hariyadi R, Hidayat SH. 2012. Genetic relatedness of
Cronobacter spp. (Enterobacter sakazakii) isolated from dried food
products in Indonesia. Int Food Research J. in press. 19(4): 1745-1749. Goldstein JI, Newbury DE, Echlin P, Joy DC, Romig AD, Lyman CE, Fiori C,
Lifshin E. 1992. Scanning Electron Microscopy and X-ray Microanalysis: A Text for Biologist, Materials Scientist, and Cytologists 2nd ed. New York
(US): Plemun Press.p820.
Guccione E, Leon-Kempis MD, Pearson BM, Hitchin E, Mulholland F, van Diemen PM et al. 2008. Amino acid-dependent growth of Campylobacter jejuni: key roles for aspartase (AspA) under microaerobic and oxygen-limited conditions and identification of AspB (Cj0762), essential for growth on glutamate. Mol Microbiol. 69(1):77-93.doi:10.1111/j.1365-
2958.2008.06263.x.
Gunasekara TS, Sorensen A, Attfield PV, Sorensen SJ, Veal DA. 2002. Inducible gene expression by nonculturable bacteria in milk after pasteurization. Appl Environ Microbiol. 68(4):1988-1993.
Gupte AR, de Rezende CLE, Joseph SW. 2003. Induction and resuscitation of viable but nonculturable Salmonella enterica serovar Typhimurium DT104. App Environ Microbiol. 69(11):6669-6675.
Healy B, Cooney S, O’Brien S, Iversen C, Whyte P, Nally J, Callanan JJ, FanningS. 2010. Cronobacter (Enterobacter sakazakii): An oppurtunistic
foodborne pathogen. Foodborne Pathog Dis. 7: 339-350. doi:
10.1089/fpd.2009.0379.
Himelright I, Harris E, Lorch V, Anderson M, Jones T, Craig A, Kuehnert M, Forster T, Arduino M, Jensen B et al. 2002. The growth profile,
thermotolerance and biofilm formation of Enterobacter sakazakii grown in infant formula milk- Tennessee, 2001. J Am Med Association. 287(17):297-300. http://jama.jamanetwork.com.
Hinoi E, Takarada T, Tsuchihashi Y, Fujimori S, Moriguchi N, Wang L, Uno K, Yoneda Y. 2006. A molecular mechanism of pyruvate protection against cytotoxicity of reactive oxygen species in osteoblasts. Mol Pharmacol.
70(3):925-935.doi: 10.1124/mol.106.024398.
[ICMSF] Internatioanal Commission for Microbiological Specifications for Foods. 2002. Selection of cases and attributes plans. Microorganisms in Foods 7. Microbiological testing in food safety management. New York (US):
Kluwer Academic/Plenum Publisher. hlm 145-165.
Imamura D, Mizuno T, Miyoshi S, Shinoda S. 2015. Stepwise changes in viable but nonculturable Vibrio choleare cells. Microbiol Immunol. 59:305-310.
Ingle U, Rajagopalan S, Padmanabhan S. 2014. Isolation and scale-up of sodium pyruvate from fermentation broth using a repulsive extraction and crystallization method. J Chem Technol Biotechnol. 90:2240-2248. doi:
10.1002/jctb.4539.
Iversen C, Forsythe S. 2003. Risk profile of Enterobacter sakazakii, an emergent pathogen associated with infant milk formula. Trends Food Sci Tech.
14(11):443-454.
Iversen C, Forsythe S. 2004. Isolation of Enterobacter sakazakii and other Enterobacteriaceae from powdered infant formula milk and related products. Food Microbiol. 21:771–777
Iversen C, Lane M, Forsythe SJ. 2005. The growth profile, thermotolerance and biofilm formation of Enterobacter sakazakii grown in infant formula milk.
Lett Appl Microbiol. 38:378–382.doi:10.1111/j.1472-765X.2004.01507.x.
Iversen C, Lehner A, Mullane N, Marugg J, Fanning S, Stephan R, Joosten H. 2007. Identification of “Cronobacter” spp (Enterobacter sakazakii). J Clin Microbial. 45:3814-3816
Iversen C, Mullane N, McCardell B, Tall BD, Lehner A, Fanning S, Stephan R, Joosten H. 2008. Cronobacter gen. nov., a new genus to accomodate the biogroups of Enterobactersakazakii, and proposal of Cronobacter sakazakii
gen. nov., comb. nov., Cronobacter malonaticus sp. nov., Cronobacter turicensis sp. Nov., Cronobacter muytjensii sp. nov., Cronobacter dublinensis sp. nov., Cronobacter genomospecies 1, and of three subspecies,
Cronobacter dublinensis subsp. Dublinensis subsp nov., Cronobacter dublinensis subsp. lausannensis subsp. nov. And Cronobacter dublinensis
subsp. lactaridi subsp. nov. Int J Syst Evol Microbiol. 58:1442-1447. doi: 10.1099/ijs.0.65577-0.
Lagha R, Bellon-Fontaine M, Renault M, Briandet R, Herry J, Mrabet B, Bakhrouf A, Chehimi MM. 2014. Impact of long-term starvation on adhesion to and biofilm formation on stainless steel 316 L and gold surfaces of Salmonella enterica serovar Typhimurium. Ann Microbiol. doi:
10.1007/s13213-014-0872-5.
Larasati F. 2012. Sintasan isolat lokal Enterobacter sakazakii (Cronobacter spp.)
dalam susu skim selama pengeringan, penyimpanan dan rekonstitusi. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Lee YD, Park JH, Chang H. 2012. Detection, antibiotic susceptibility and biofilm formation of Cronobacter spp. from various foods in Korea. J Food Cont.
24:225-230. doi: 10.1016/j.foodcont.2011.09.023.
Lehner A, Riedel K, Eberl L, Breeuwer P, Diep B, Stephan R. 2005. Biofilm formation, extracellular polysaccharide production, and cell-to-cell signaling in various Enterobacter sakazakii strains: aspects promoting environmental
persistence. J. Food Prot. 68: 2287–2294.
Lim J, Lee K, Park CY, Kim HV, Kim Y, Park S. 2016. Quorum sensing is crucial to Escherichia coli O157:H7 biofilm formation under static or very
slow laminar flow conditions. Bio Chip J. 10(3): 241-249. doi: 10.1007/s13206-016-0310-9.
Lin LC, Beuchat LR. 2007. Survival of Enterobacter sakazakii in infant cereal as
affected by composition, water activity, and temperature. Food Microbiol.