YOGO ARDI NUGROHO
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Dengan ini saya menyatakan bahwa skripsi berjudul Induksi Poliploid dengan Kolkisin pada Tanaman Anggrek Dendrobium lasianthera (J.J. Smith) Secara In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2015
AnggrekDendrobium lasianthera(J.J. Smith) SecaraIn Vitro. Dibimbing oleh NI MADE ARMINI WIENDI.
Perkembangan pemuliaan anggrek sebagai bunga potong di Indonesia masih cukup terbatas.Dendrobium lasianthera(J.J. Smith) merupakan salah satu spesies terbaik sebagai sumber gen untuk anggrek potong. Penggunaan kolkisin diharapkan mampu meningkatkan keragaman genetik sebagai langkah awal pemuliaan tanaman. Penelitian ini bertujuan untuk mempelajari pengaruh konsentrasi kolkisin dan lama perendaman terhadap pertumbuhan protocorm like body dan karakter sitologi tanaman Dendrobium lasianthera (J. J. Smith). Rancangan yang digunakan adalah rancangan acak lengkap (RAL) dua faktor, konsentrasi kolkisin dan waktu perendaman. Hasil penelitian menunjukkan 0.025% kolkisin dengan perendaman 1 jam menghasilkan pertumbuhan plb terbaik. Persentase muncul kalus tertinggi didapat dari perlakuan tanpa kolkisin dengan perendaman 1 jam. Perlakuan kolkisin menginduksi keragaman genetik terhadap jumlah kloroplas, stomata, ukuran stomata, dan kromosom dari planlet yang terbentuk. Jumlah kloroplas terbanyak didapat dari perlakuan 0.025% kolkisin dengan lama perendaman 24 jam. Kerapatan stomata tertinggi didapat dari perlakuan tanpa kolkisin dengan lama perendaman 1 dan 24 jam. Ukuran stomata terbesar dihasilkan oleh perlakuan 0.025% kolkisin selama 1 jam (panjang stomata) dan 24 jam (lebar stomata). Konsentrasi 0.050% menginduksi poliploid terbanyak dan jumlah kromosom tertinggi diperoleh dari perlakuan 0.075% kolkisin selama 48 jam. Nilai LD50 untuk konsentrasi kolkisin sebesar
ii
ABSTRACT
YOGO ARDI NUGROHO. In Vitro Polyploid Induction of Dendrobium lasianthera (J.J. Smith) Orchid with Colchicine. Supervised by NI MADE ARMINI WIENDI.
The development of orchid breeding as cut flower on Indonesia are still limited. Dendrobium lasianthera (J.J. Smith) is one of the best character source for cutting orchid. Colchicine usage are expected to increase the diversity of Dendrobium lasianthera (J.J. Smith) as a first step in plant breeding. This study aims were to observe the effect of some colchicine consentration at some submersion duration to the explant growth and cytology character of Dendrobium lasianthera (J.J Smith). The study used a completely randomized design (CRD) with two factor, colchicine consentration and submersion duration. The results showed that 0.025% colchicine with 1 hour duration give the highest vegetative growth. The highest callus percentage acquired from 1 hour submersion without colchicine. Colchicine treatment give diversity to chloroplast, stomata, stomata size, and chromosome count from planlet. Chloroplast counting give the highest number from 0.025% colchicine with 24 hours duration. The highest stomata density was obtained from submersion duration for 1 and 24 hours without colchicine. The highest stomata measurement obtained from 0.025% colchicine for 1 hour (stomata length) and 24 hours (guard cell width). The highest rate of polyploid cell is achieved from 0.050% colchicine with the highest chromosome number was obtained from 0.075% colchicine consentration with 48 hours treatment. LD50 vallue for colchicine consentration are 0.122%, while for submersion duration are 70.32hours.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
YOGO ARDI NUGROHO
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
i
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala rahmat-Nya sehingga karya ilmiah yang berjudul Induksi Poliploid dengan Kolkisin pada Tanaman Anggrek Dendrobium lasianthera (J.J. Smith) Secara In Vitro ini dapat diselesaikan.
Terima kasih penulis ucapkan kepada:
1. Ibu, Bapak, dan seluruh saudara yang telah memberikan dukungan, doa dan kasih sayangnya yang tak terhingga.
2. Dr. Ir. Ni Made Armini Wiendi, M.S. selaku pembimbing tugas akhir yang telah banyak memberikan pengarahan, perhatian, saran, dan telah mendanai penelitian ini.
3. Dr. Dwi Guntoro, SP, M.Si. selaku dosen pembimbing akademik
4. Seluruh rekan di Laboratorium Kultur Jaringan 2 Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor.
5. Teman-teman AGH angkatan 47 Edelweiss, khususnya Danu, Arisudana, Ijul, Listya, Taufiq, Rony, Sandy, Surya, Dita Maulina, Erin, Zamzam, serta teman-teman lainnya.
Semoga karya ilmiah ini bermanfaat bagi semua pihak yang berkepentingan dan untuk pengembangan ilmu pengetahuan.
Bogor, Desember 2015
i
DAFTAR ISI
DAFTAR TABEL iii
DAFTAR GAMBAR iii
DAFTAR LAMPIRAN iv
PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
Hipotesis 2
TINJAUAN PUSTAKA 2
Botani Anggrek 2
Kultur Jaringan Anggrek 4
Induksi Mutasi 4
Poliploidisasi dengan Kolkisin 5
Lethal Dose50 (LD50) 6
BAHAN DAN METODE 7
Waktu dan Tempat Penelitian 7
Bahan dan Alat 7
Rancangan Percobaan Penelitian 7
Pelaksanaan Penelitian 8
Pembuatan larutan kolkisin 8
Pembuatan larutanaceto-orcein2% 9
Perlakuan perendaman dan sub kultur plb 9
Analisis morfologi stomata 9
Uji sitologi 9
Pengamatan 10
HASIL DAN PEMBAHASAN 10
Kondisi Umum 10
Jumlah Plb Sekunder dan Jumlah Tunas 14
Jumlah Daun 20
Persentase Eksplan Berkalus 22
Jumlah Akar 23
Analisis Morfologi Stomata 26
Analisis Sitologi Kromosom 29
ii
Lethal Dose(LD) 33
SIMPULAN 34
DAFTAR PUSTAKA 35
LAMPIRAN 38
iii
DAFTAR TABEL
1 Kombinasi perlakuan konsentrasi kolkisin dengan lama perendaman pada
plb Dendrobium lasianthera(J.J. Smith) 8
2 Persentase tingkat kontaminasi kulturDendrobium lasianthera(J.J. Smith)
setelah mendapat perlakuan kolkisin 11
3 Rekapitulasi hasil uji F pengaruh konsentrasi kolkisin dan lama perendaman serta interaksinya terhadap pertumbuhan plb Dendrobium
lasianthera(J.J. Smith) 12
4 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap jumlah
plbsekunderDendrobium lasianthera(J.J. Smith) 15
5 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap jumlah
tunasDendrobium lasianthera(J.J. Smith) 17
6 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap
multiplikasiDendrobium lasianthera(J.J. Smith) 19
7 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap jumlah
daunDendrobium lasianthera(J.J. Smith) 21
8 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap persentase eksplan berkalus tanaman anggrek Dendrobium lasianthera
(J.J. Smith) 22
9 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap jumlah akar tanaman anggrekDendrobium lasianthera(J.J. Smith) 24 10 Pengaruh perlakuan kolkisin terhadap jumlah kloroplas pada 36 MSP 26 11 Pengaruh perlakuan kolkisin terhadap ukuran dan nilai rata-rata kerapatan
stomata pada 36 MSP 28
12 Pendugaan ploidi sel tanaman Dendrobium lasianthera (J.J. Smith) hasil
perlakuan kolkisin 30
13 Nilai rata-rata dan standar deviasi pengaruh kolkisin terhadap jumlah
kromosom 32
14 Persentase hidup eksplan pada minggu terakhir pengamatan (16 MSP) 33 15 Nilai Lethal Dose kolkisin terhadap Dendrobium lasianthera (J.J. Smith)
secarain vitro 34
DAFTAR GAMBAR
1 Morfologi bunga dan pseudobulb Dendrobium lasianthera (J.J. Smith). Sumber foto A) orchidspecies.com, B) Lembaga Biologi Nasional-LIPI 3 2 Kromosom somatik jaringan ujung akar Dendrobium phalaenopsis hasil
perlakuan kolkisin (Chaicharoen dan Saejew 1980) 6
3 Kontaminasi yang terjadi pada kulturDendrobium lasianthera(J.J. Smith) karena cendawan (A) dan bakteri (B) seperti yang ditunjukkan tanda
panah 11
4 Pengaruh konsentrasi kolkisin terhadap pertambahan jumlahplbsekunder 14 5 Pengaruh lama perendaman terhadap pertambahan jumlahplbsekunder 14 6 Pengaruh interaksi konsentrasi kolkisin dan lama perendaman terhadap
iv
7 Pengaruh konsentrasi kolkisin terhadap pertambahan jumlah tunas 16 8 Pengaruh lama perendaman terhadap pertambahan jumlah tunas 16 9 Pengaruh interaksi konsentrasi kolkisin dan lama perendaman terhadap
jumlah tunas pada 8 dan 16 MSP 17
10 Pengaruh konsentrasi kolkisin terhadap multiplikasiplb 18
11 Pengaruh lama perendaman terhadap multiplikasiplb 18
12 Pengaruh interaksi konsentrasi kolkisin dan lama perendaman terhadap
multiplikasi pada 8 dan 16 MSP 19
13 Pengaruh konsentrasi kolkisin terhadap pertambahan jumlah daun 20 14 Pengaruh lama perendaman terhadap pertambahan jumlah daun 20 15 Pengaruh interaksi konsentrasi kolkisin dan lama perendaman terhadap
jumlah daun pada 8 dan 15 MSP 21
16 Pengaruh konsentrasi kolkisin dan lama perendaman terhadap persentase
jumlah kalus 22
17 Pengaruh konsentrasi kolkisin terhadap pertambahan jumlah akar 23 18 Pengaruh lama perendaman terhadap pertambahan jumlah akar 23 19 Pengaruh interaksi konsentrasi kolkisin dan lama perendaman terhadap
jumlah akar pada 8 dan 16 MSP 24
20 Pertumbuhan kultur hasil mutasi pada minggu terakhir pengamatan (16
MSP) 25
21 Pengaruh konsentrasi kolkisin (A) dan lama perendaman (B) terhadap
jumlah kloroplas 26
22 Pengaruh konsentrasi kolkisin (grafik A) dan lama perendaman (grafik B)
terhadap kerapatan stomata 27
23 Kerapatan stomata daunDendrobium lasianthera(J.J. Smith) hasil mutasi 27 24 Pengaruh konsentrasi kolkisin dan lama perendaman terhadap panjang
(grafik A) dan lebar (grafik B) stomata 28
25 Stomata daun Dendrobium lasianthera (J.J, Smith) hasil mutasi Kolkisin
pada 36 MSP 29
26 Sel hasil uji sitologi diduga diploid (A), tetraploid (B), hexaploid (C),
oktaploid (D), dan dodekaploid (E) 30
27 Hasil uji sitologi pada kontrol dengan jumlah kromosom 37 31 28 Kimera tingkat organ pada perlakuan konsentrasi kolkisin 0.025% dengan
lama perendaman 24 jam 31
29 Kimera tingkat jaringan pada perlakuan konsentrasi kolkisin 0.075% dan
lama perendaman 1 jam 31
30 Keragaman jumlah kromosom setiap perlakuan kolkisin padaDendrobium
lasianthera(J.J. Smith) 33
DAFTAR LAMPIRAN
1 Komposisi media Murashige-Skoog 38
2 Pengaruh kolkisin terhadap nilai rata-rata dan standar deviasi jumlah
kloroplasDendrobium lasianthera 39
3 Pengaruh kolkisin terhadap nilai rata-rata dan standar deviasi kerapatan
stomataDendrobium lasianthera 40
stomataDendrobium lasianthera
5 Pengaruh kolkisin terhadap nilai rata-rata dan standar deviasi lebar
stomataDendrobium lasianthera 42
6 Sebaran persentase eksplan hidup berdasarkan konsentrasi kolkisin yang
digunakan (0, 0.025%, 0.050%, dan 0.075%) 43
7 Sebaran persentase eksplan hidup berdasarkan lama perendaman (tanpa
1 Latar Belakang
Anggrek dari famili Orchidaceae merupakan jenis tanaman berbunga dengan jumlah spesies terbanyak. Anggrek banyak digunakan untuk berbagai keperluan seperti upacara keagamaan, hiasan dan dekorasi ruangan, serta sebagai hadiah untuk ucapan selamat. Karena memiliki keunikan bentuk dan warna yang berbeda dengan jenis anggrek lainnya di dunia, banyak negara yang menjadi pengimpor anggrek dari Indonesia (Balitbangtan 2008).
Dendrobium merupakan salah satu genus anggrek yang cukup diminati oleh masyarakat luas, baik di dalam negeri maupun di luar negeri. Genus ini merupakan genus kedua terbesar dari keluarga anggrek dengan penyebaran yang sangat luas (Sarwono 2002) dan rentang habitat yang bervariasi. Spesies anggrek Dendrobium terbaik banyak terdapat di kawasan timur Indonesia, seperti Papua dan Maluku (Widiastoetyet al. 2010). Salah satu spesies unggul yang berasal dari daerah tersebut adalah Dendrobium lasianthera (J.J. Smith). Karakter tangkai dengan bentuk dan warna bunganya yang unik, yaitu sepal dan petal keriting dan warna mahkota bunga yang gelap, menjadikan spesies ini sebagai induk silangan yang cukup banyak dicari (Sarwono 2002). Dendrobium lasianthera (J.J. Smith) termasuk dalam spesies yang dilindungi dalam Peraturan Pemerintah No. 7 tahun 1999 serta masuk dalam kategori CITES Appendiks II (CITES 2015), yaitu kategori spesies yang tidak terancam kepunahan, tetapi terancam punah jika eksploitasi dan perdagangan terus berlanjut.
Faktor penting dalam pengembangan tanaman hias adalah keragaman genetik. Keragaman genetik dalam satu spesies anggrek cukup rendah, terutama untuk jenis-jenis yang menyerbuk sendiri. Perlu dilakukan upaya-upaya untuk meningkatkan keragaman genetik sehingga dihasilkan galur-galur yang dapat dikembangkan sebagai varietas baru dengan warna sepal dan petal yang lebih beragam dan berukuran besar. Cara lain untuk menginduksi keragaman genetik selain dengan persilangan adalah mutasi dengan pemberian mutagen, baik mutagen fisik ataupun mutagen kimia (Poespodarsono 1998). Mutagen kimia yang sering digunakan antara lain kolkisin, yang telah banyak digunakan untuk menduplikasi kromosom pada beberapa tanaman (Alard 1989).
2
perendaman 9 hari dengan konsentrasi kolkisin 0.03% menghasilkan tanaman dengan tingkat ketegaran yang tinggi.
Tujuan
Penelitian ini bertujuan untuk mempelajari pengaruh perendaman plb anggrek Dendrobium lasianthera (J.J. Smith) dengan kolkisin pada berbagai konsentrasi dan lama perendaman terhadap pertumbuhan dan ploidi plb, serta menentukan LD50 kolkisin. Diharapkan penelitian ini dapat menghasilkan galur
tanaman baru yang memiliki ploidi yang beragam untuk digunakan sebagai bahan seleksi dalam rangka pemuliaan anggrekDendrobium lasianthera(J.J. Smith).
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1. Pertumbuhan dan perkembangan plb Dendrobium lasianthera (J.J. Smith) dipengaruhi oleh interaksi antara konsentrasi dan lama waktu perendaman dalam larutan kolkisin.
2. Poliploidisasi kromosom pada plb Dendrobium lasianthera (J.J. Smith) dipengaruhi konsentrasi kolkisin.
3. Poliploidisasi kromosom pada plb Dendrobium lasianthera (J.J. Smith) dipengaruhi lama perendaman dalam larutan kolkisin.
4. Poliploidisasi kromosom pada plb Dendrobium lasianthera (J.J. Smith) dipengaruhi oleh interaksi antara konsentrasi dan lama waktu perendaman dalam larutan kolkisin.
TINJAUAN PUSTAKA
Botani Anggrek
A B
penyatuan anther dan pistil; rostellum, berfungsi sebagai pemisah organ jantan dan betina, serta sebagai bagian yang memproduksi substansi lengket untuk menyebarkan polen; dan biji, anggrek dapat menghasilkan antara 500 000 sampai jutaan biji dalam satu buah (pod). Biji anggrek tidak memiliki endosperma (Sheehan 1992). Biji anggrek mungkin bisa berkecambah secara alami, tetapi tidak akan berkembang tanpa adanya infeksi dari mikoriza, yang menyuplai tanaman muda dengan gula dan nutrisi yang dibutuhkan sampai tanaman cukup besar untuk memproduksinya sendiri.
Salah satu genus yang paling sering diperjualbelikan adalah Dendrobium. Dendrobium berasal dari bahasa Yunani, yakni dendron yang berarti pohon atau tumbuhan danbiosyang berarti hidup. Genus ini merupakan genus kedua terbesar dari keluarga anggrek setelah Bulbophyllum, terdiri dari sekitar 1 400 spesies dengan penyebaran yang sangat luas, dari Sri Lanka hingga Hawaii dan dari Australia hingga Jepang (Sarwono 2002). Spesies yang paling diminati dalam genus ini, terutama sebagai tetua silangan adalah Dendrobium lasianthera (J.J. Smith) dari seksi Ceratobium/Spathulata. Anggrek ini tersebar di daerah Papua dan Papua Nugini. Dendrobium lasianthera (J.J. Smith) merupakan salah satu spesies anggrek epifit yang merumpun (simpodial). Batang palsu (pseudobulb) anggrek ini dapat tumbuh mencapai 3 m. Rangkaian bunganya (inflorescence) mencapai 40 cm dengan 10-20 kuntum bunga yang terangkai rapat pada setengah panjang tangkai inflorescence, karakter yang penting sebagai indukan untuk menghasilkan anggrek potong silangan (Teoh 2005). Panjang bunga berukuran 6.5 cm dengan petal melintir dengan variasi warna merah gelap, merah muda, merah keunguan dan merah jingga. Menurut Sastrapradja et al. (1979) anggrek ini memiliki daun berbentuk lonjong dengan panjang 15 cm. Daun tersusun berselang seling dalam 2 deretan, dengan tekstur kaku. Gagang pembungaan tegak dan kaku dan pembungaan muncul pada bagian ujung batang. Tanaman ini umumnya tumbuh baik didataran rendah agak teduh tapi berhawa panas.
4
Kultur Jaringan Anggrek
Kultur jaringan tanaman adalah perbanyakan sel, jaringan, organ, atau tanaman utuh dalam kondisi dan nutrisi yang terkontrol, yang dapat digunakan untuk menghasilkan klon tanaman. Konsep yang mendasari kultur jaringan adalah teori totipotensi, yang menyatakan tentang kemampuan sel untuk membentuk tanaman lengkap jika kondisi lingkungan mendukung/sesuai karena di dalam setiap sel tumbuhan mengandung informasi genetik yang lengkap (Wetherell 1982).
Banyak penelitian yang telah dilakukan terkait kultur jaringan terhadap tanaman anggrek. Morel pada tahun 1960 memulai kultur jaringan pada anggrek Cymbidium dan mendapatkan tanaman yang bebas virus melalui kultur meristem. Protocorm like body (plb) yang didapatkan dari kultur meristem sangat mirip dengan yang berasal dari kultur biji yang berkecambah. Widiastoety (1994) melaporkan bahwa penambahan air kelapa sebanyak 150 ml ke dalam media sangat berpengaruh terhadap pembentukkan plb Cymbidium. Widiastoety (1995) juga menyatakan bahwa penggunaan 10 g L-1 karbohidrat dapat mempercepat pertumbuhan batang, daun dan akar planlet Dendrobium. Suaria (2000) menyatakan bahwa 2 dari 3 kelompok isolat bakteri dari media kultur anggrek Cymbidium yang terkontaminasi dapat memberikan pengaruh positif terhadap pertumbuhan kultur in vitro anggrek Dendrobium hibrida melalui penambahan bobot kering planlet. Pant dan Thapa (2012) menyatakan konsentrasi IAA sebesar 0.5 mg L-1 dalam media MS (Murashige dan Skoog) menghasilkan jumlah akar terbanyak pada kultur Dendrobium primulinum dibandingkan dengan IBA dan NAA. Penambahan 1 mg L-1BA, 1 mg L-1NAA, dan 15% air kelapa pada media MS meningkatkan jumlahplbyang dihasilkan dari kulturRhyncostylis retusa(L.) Bl (Parab dan Krishnan 2012). Hasil penelitian Athicart (2013) menyatakan bahwa penambahan BA sebanyak 0.5 dan 1 mg L-1 dengan media dasar VW (Vacin Went) menghasilkan proliferasi terbesar pada plb Dendrobium chrysotoxumyang diberi perlakuan 0.03% dan 0.04% kolkisin.
Induksi Mutasi
Mutagenesis adalah proses perubahan informasi genetik suatu organisme pada kondisi stabil. Mutagenesis di alam terjadi akibat adanya kesalahan dalam perbaikan DNA. Mutasi adalah perubahan pada material genetik yang bukan merupakan hasil rekombinasi atau segregasi dan dapat diturunkan ke generasi selanjutnya. Mutasi dapat terjadi secara alami maupun buatan. Mutasi alami adalah perubahan materi genetik secara spontan di alam, sedangkan mutasi buatan terjadi akibat adanya kontak dengan mutagen secara sengaja untuk tujuan pemuliaan tanaman. Individu yang membawa mutasi pada genomnya disebut mutan. Pemuliaan tanaman menggunakan mutasi umumnya terbatas pada induksi mutasi secara fisik dan kimiawi.
Kemajuan di setiap generasinya adalah kunci dalam riset genetik dan pemuliaan. Pemuliaan konvensional umumnya menggunakan kode P untuk parental (tetua) dan kode F untuk filial (generasi). Sejalan dengan penamaan tersebut, generasi pertama hasil mutasi diberi kode M1. Tanaman yang diproduksi
disebut M0. Embrio yang dihasilkan dari persilangan dari polen dan atau kantung
embrio termutasi juga disebut generasi pertama mutasi (M1). Notasi M1V1, M1V2,
dan seterusnya digunakan untuk tanaman hasil perbanyakan vegetatif dari tanaman hasil mutasi. Variasi somaklonal menggunakan notasi S, sedangkan mutasi dengan transformasi genetik menggunakan notasi T.
Seleksi mutan dibutuhkan untuk mengidentifikasi individu dengan fenotip mutasi yang dinginkan. Seleksi mutasi terdiri dari dua tahap, screeningmutan dan konfirmasi mutan. Screening mutan adalah proses seleksi individu dari populasi hasil mutasi yang besar dengan kriteria target. Konfirmasi mutan adalah proses evaluasi ulang mutan dengan pengulangan dan kondisi yang ketat, menggunakan ukuran contoh yang besar, umumnya progeni dari individu putatif pilihan.
Poliploidisasi dengan Kolkisin
Berbagai macam bahan yang digunakan dalam induksi mutasi terbagi 2 kelompok penting, yaitu mutagen fisik dan mutagen kimiawi. Kemungkinan mutagen dapat menghasilkan sel mutan lebih tinggi dibanding mutasi alami, 103 per lokus, tetapi variasinya masih bisa diamati (Van Harten 1998). Mutasi fisik biasanya dilakukan menggunakan radiasi (sinar X, sinar , sinar , sinar ), sedangkan mutasi kimia menggunakan bahan-bahan kimia yang mutagenik seperti kolkisin.
Kolkisin pertama kali diekstrak dari biji Colchicum autumnale. Kolkisin mudah larut dalam air dan bisa menginduksi sel-sel poliploid pada konsentrasi yang tidak terlalu tinggi, selain itu kolkisin memiliki spektrum yang luas bagi berbagai spesies tanaman. Kolkisin bekerja dengan menghambat terbentuknya benang-benang plasma dari gelendong inti (spindle) sehingga pemisahan kromosom pada anafase dari mitosis tidak berlangsung dan menyebabkan penggandaan kromosom tanpa pembentukan dinding sel (Suryo 1995).
6
perlakuan selama 72 jam di media padat. Perlakuan kolkisin pada Anthurium plowmaniiCroat. menghasilkan 95% mutan putatif, dengan perlakuan konsentrasi 0.02% dan lama perendaman 1 jam yang menghasilkan tanaman dengan jumlah kromosom terbanyak (Nurwanti 2010). Hasil uji morfologi daun (jumlah kloroplas, kerapatan stomata, ukuran stomata) terbesar diperoleh dari perlakuan 0.04% kolkisin dengan lama perendaman 72 jam. Induksi poliploid pada tanaman nilam (Pogostemon cablin Benth.) var. sidikalang terbaik didapat dari perlakuan kolkisin 0.02% (Anne 2011). Wardhani (2011) melaporkan perlakuan kolkisin 0.04% pada kedelai varietas Wilis dan Tanggamus menghasilkan jumlah kromosom terbanyak dan kerapatan stomata terbesar.
Gambar 2 Kromosom somatik jaringan ujung akar Dendrobium phalaenopsis hasil perlakuan kolkisin (Chaicharoen dan Saejew 1980). A) normal diploid 2n = 38, B) tetraploid 2n = 76.
Lethal Dose50 (LD50)
Keberhasilan mutagenesis in vitro ditentukan oleh kemampuan induksi mutagen dan kemampuan regenerasi tanaman yang mendapat perlakuan mutasi. Tahap penting lain dalam induksi mutasi adalah menentukan dosis mutagen yang tepat, yang bervariasi antar spesies, level ploidi, tahap perkembangan, dan kondisi fisiologi. Cara yang umum dipakai dalam menentukan dosis mutagen yang tepat didasarkan pada sensitivitas jaringan atau sel, yang diukur berdasarkan kurva sensitivitas dosis dan kemampuan tumbuh. Dosis mutagen yang dapat menyebabkan kematian 50% dari populasi yang dimutasi disebut lethal dose 50. Penentuan LD50 untuk suatu spesies tanaman dapat ditentukan dengan mengikuti
laporan penelitian sebelumnya atau dengan melakukan beberapa uji sederhana dengan berbagai konsentrasi (Suprasanna et al. 2011). Dosis optimal dalam induksi mutasi yang menimbulkan keragaman dan menghasilkan mutan terbanyak biasanya terjadi di sekitar nilai LD50(Aisyahet al.2009).
Konsentrasi yang dipakai dalam penelitian ini mengikuti hasil penelitian Sarathum et al. (2010) terhadap Dendrobum scabrilingue L. karena tidak ditemukannya literatur terhadap Dendrobium lasianthera (J.J. Smith). Pada penelitian Sarathumet al., konsentrasi yang dipakai antara 0 0.1%, tetapi karena konsentrasi tertinggi sudah mencapai kematian lebih dari 60%, maka yang dipakai
dipertimbangkan akan berpengaruh terhadap tingkat kematian.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Mei 2014 sampai dengan bulan Januari 2015. Pelaksanaan kultur jaringan dilakukan di Laboratorium Kultur Jaringan Tanaman 2, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB, Bogor. Pengamatan morfologi stomata daun dan jumlah kromosom melalui uji sitologi dilakukan di Laboratorium Mikro Teknik, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor, Bogor.
Bahan dan Alat
Bahan tanaman yang digunakan dalam penelitian ini adalah protocorm-like body(plb) tanaman anggrekDendrobium lasianthera(J.J. Smith) berumur 2 bulan dari penyemaian biji hasil selfing yang ditumbuhkan dalam media VW dengan tambahan bahan organik tomat. Media kultur jaringan yang dipakai adalah MS53, dengan komposisi MS dasar+ 0.5 mg IAA+ 1.5 mg BA+ 50 mL air kelapa untuk membuat 1 L media, yang digunakan untuk menumbuhkan plb yang telah direndam menggunakan kolkisin. Sumber karbohidrat berasal dari gula 30 g L-1. Pemadat yang digunakan adalah agar-agar sebanyak 7 g L-1. Media yang digunakan untuk perlakuan perendaman adalah media MS53 cair. Media padat dan media cair diatur pada pH 5.9.
Bahan yang digunakan untuk uji sitologi adalah akar planlet tanaman anggrek Dendrobium lasianthera (J.J. Smith), HCl 1N, aceto-orcein2%, dan cat kuku yang tidak berwarna. Bahan lain yang digunakan untuk subkultur adalah alkohol 70% dan spiritus. Peralatan yang digunakan di laboratorium yaitu autoklaf, laminar air flow cabinet, timbangan analitik, labu takar, gelas ukur, pengaduk, pH meter, labu erlenmeyer, gelas piala, botol kultur, cawan petri, gunting, pinset,scalpel,sprayer,magnetic stirrer, panci perebus, pipet, rak kultur, label, penggaris, alat pengering, bunsen, kertas tissue dan kamera. Peralatan yang digunakan untuk uji sitologi yaitu mikroskop, silet, botol, lemari pendingin, pensil dengan ujung berpenghapus, pemanas air, pinset dan gelas kimia.
Rancangan Percobaan Penelitian
8
perendaman digunakan sebagai kontrol. Model statistika yang digunakan mengacu pada Mattjik dan Sumertajaya (2013) sebagai berikut:
Yijk= µ + i+ j+( )ij+ ijk
Keterangan:
Yijk : Hasil pengamatan terhadap sampel pada perlakuan konsentrasi kolkisin
ke-i, lama perendaman ke-j, dan ulangan ke-k µ : Nilai tengah umum
i : Pengaruh faktor konsentrasi kolkisin ke-i {i=1,2,3,4} j : Pengaruh faktor lama perendaman ke-j {j=1,2,3,4}
( )ij: Pengaruh interaksi antara konsentrasi kolkisin dan lama perendaman
ijk : Pengaruh galat pada konsentrasi kolkisin ke-i, lama perendaman ke-j, dan
ulangan ke-k
Perlakuan yang digunakan dalam percobaan disajikan pada Tabel 1.
Tabel 1 Kombinasi perlakuan konsentrasi kolkisin dengan lama perendaman padaplb Dendrobium lasianthera(J.J. Smith)
Perlakuan Lama perendaman (jam)
Konsentrasi kolkisin (%) 0 1 24 48 72 0 Kontrol 0 Kontrol 1 Kontrol 2 Kontrol 3 Kontrol 4
0.025 P1 P2 P3 P4
0.050 P5 P6 P7 P8
0.075 P9 P10 P11 P12
Data yang diperoleh dianalisis dengan uji F pada taraf 5%. Apabila terdapat perbedaan yang nyata dari nilai tengahnya akan dilanjutkan dengan uji Duncan Multiple Range Test(DMRT) dant-Dunnetpada taraf 5%.
Pelaksanaan Penelitian
Pembuatan larutan kolkisin
Penelitian diawali dengan pembuatan larutan stok kolkisin. Larutan stok dibuat dengan melarutkan 312.5 mg kolkisin (SIGMA) dalam 50 ml aquabidest (0.625% w/v). Pembuatan larutan kolkisin dilakukan di dalam laminar air flow cabinet. Serbuk kolkisin sebanyak 312.5 mg dimasukkan ke labu erlenmeyer, kemudian ditambahkan aquabidest sedikit demi sedikit sampai 50 ml sambil digoyang agar kolkisin terlarut. Larutan stok yang sudah jadi disimpan dalam freezeryang bersuhu 4oC.
laminar. Pada pembuatan media cair dengan kolkisin sebesar 0.025%, media cair dicampur larutan stok kolkisin (0.625%) sebanyak 1 ml. Selanjutnya untuk konsentrasi 0.050 dan 0.075%, masing-masing sebanyak 2 ml dan 3 ml stok kolkisin 0.625%.
Pembuatan larutanaceto-orcein2%
Bahan yang digunakan untuk membuat larutan pewarna aceto-orcein 2% adalah serbukorcein(MERCK) dan asam asetat glasial (99%). Pembuatan larutan aceto-orcein 2% sebanyak 50 ml, diawali dengan pemanasan asam asetat glasial sebanyak 22.5 ml sampai hampir mendidih, angkat, kemudian orcein serbuk sebanyak 1 g dimasukkan. Larutan diaduk sambil dipertahankan suhunya antara 90-95 oC selama 10 menit. Setelah cukup dingin, akuades sebanyak 27.5 ml dimasukkan, lalu diaduk/digoyang agar larutan homogen. Larutan pewarna aceto-orceinyang sudah jadi disimpan dalam botol gelap atau yang ditutupi alumunium foildan diletakkan di ruang yang sejuk.
Perlakuan perendaman dan sub kulturplb
Plb yang dikulturkan di media asal diambil, kemudian diletakkan di atas cawan petri untuk dibagi sesuai perlakuan. Perendaman dilakukan sekaligus dalam satu hari sesuai dengan kombinasi perlakuan, sedangkan sub kultur ke media MS53 dilakukan bertahap. Setelah 1 jam, sebagianplbdiambil dan ditanam di dalam media. Penanaman ke media diulang pada 24, 48, dan 72 jam setelah perendaman dalam larutan kolkisin. Setiap penanaman, plb yang telah mendapat perlakuan perendaman dikeringkan terlebih dahulu diatas kertas tisu steril dalam cawan petri selama 10 menit. Semua peralatan yang digunakan disemprot alkohol 70% sebelum digunakan.
Alat alat yang digunakan untuk memindahkan plb, sebelum digunakan dibakar dahulu sampai panas kemudian didiamkan sampai dingin. Inkubasi kultur dilakukan pada ruangan dengan penyinaran ± 650 lux, 16 jam/hari dan suhu ± 23
o
C.
Analisis morfologi stomata
Pengamatan stomata menggunakan tiga sampel per ulangan. Sampel berupa potongan daun yang cukup dewasa. Pembuatan preparat dengan cara mengikis langsung bagian atas daun. Daun yang telah diambil sebelumnya diletakkan diatas kaca objek dengan posisi bagian bawah daun menghadap kaca objek. Bagian atas daun lalu dikikis/kerok menggunakan silet sampai tersisa epidermis daun bagian bawah. Daun yang telah dikikis lalu dibalik, kemudian ditetesi air sebelum ditutup kaca penutup. Variabel yang diamati adalah jumlah stomata dan jumlah kloroplas. Pengamatan dilakukan dengan menggunakan mikroskop cahaya dengan pembesaran 4×10. Pengukuran panjang stomata dan lebar sel penjaga stomata dilakukan dengan menggunakan software Olympus DP2-BSW yang terintegrasi dengan mikroskop cahaya dengan preparat yang sama.
Uji sitologi
10
preparat dilakukan antara jam 07.00 11.00, dengan selang waktu pengambilan preparat setiap 30 menit sekali, untuk mendapatkan tahap mitosis yang tepat. Setelah mengetahui waktu yang tepat, analisis sampel yang lain dilakukan pada jam yang sama ketika metafase terdeteksi. Semua perlakuan dilakukan uji sitologi dengan sampel yang diambil secara acak. Sampel diambil sebanyak 3 tanaman/perlakuan, dari setiap tanaman diambil 2 3 akar sesuai dengan ketersediaan akar.
Akar yang digunakan untuk uji sitologi dipotong sepanjang 0.5 1 cm dari ujung akar, lalu direndam dalam larutan HCl 1N selama 20 menit. Setelah perendaman dalam HCl 1N, akar kemudian diangkat dan ditiriskan, lalu diletakkan diatas kaca arloji atau palet dan ditetesiaceto-orcein2% dan dibiarkan selama 15 20 menit. Ujung akar lalu diletakkan di atas kaca objek dan dipotong 1 2 mm dari ujung akar. Aceto-orcein diteteskan sebanyak 2 tetes di atas akar, lalu ditutup dengan gelas penutup. Preparat yang sudah jadi dilewatkan di api bunsen sebanyak 2 3 kali, baru kemudian diketuk menggunakan ujung pensil berpenghapus. Selanjutnya gelas penutup ditekan halus dengan jempol dan bagian pinggir direkat dengan cat kuku tak berwarna dan siap diamati di bawah mikroskop (Olympus). Setelah terlihat penyebaran kromosom dilakukan penghitungan jumlah kromosom dan dibuat dokumentasinya. Foto yang dihasilkan diperbesar dengan menggunakan Microsoft Office Picture Manager dan kembali dihitung jumlah kromosomnya. Sampel yang diamati jumlah kromosomnya adalah sebanyak 3 sampel per perlakuan.
Pengamatan
Pengamatan yang dilakukan meliputi persentase kontaminasi, jumlah akar, multiplikasi plb, jumlah daun, persentase eksplan berkalus, jumlah kromosom, jumlah stomata, kerapatan serta ukuran stomata, dan jumlah kloroplas pada sel penjaga stomata. Pengamatan dilakukan dari luar botol seminggu sekali selama 4 bulan dan sekali untuk pengamatan kromosom dan daun di akhir pengamatan. Data pengamatan terhadap jumlah plb yang mati dari pengamatan awal sampai akhir dianalisis untuk menentukan nilai LD50.
HASIL DAN PEMBAHASAN
Kondisi Umum
ditanam.
Gambar 3 Kontaminasi yang terjadi pada kultur Dendrobium lasianthera (J.J. Smith) karena cendawan (A) dan bakteri (B) seperti yang ditunjukkan tanda panah
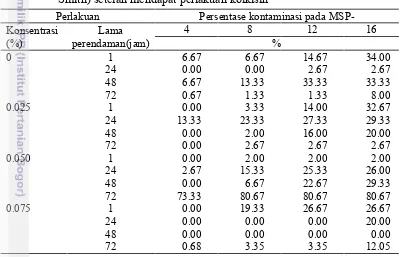
Tabel 2 Persentase tingkat kontaminasi kultur Dendrobium lasianthera (J.J. Smith) setelah mendapat perlakuan kolkisin
Perlakuan Persentase kontaminasi pada MSP-Konsentrasi
(%)
Lama perendaman(jam)
4 8 12 16
%
0 1 6.67 6.67 14.67 34.00
24 0.00 0.00 2.67 2.67 48 6.67 13.33 33.33 33.33 72 0.67 1.33 1.33 8.00
0.025 1 0.00 3.33 14.00 32.67
24 13.33 23.33 27.33 29.33 48 0.00 2.00 16.00 20.00 72 0.00 2.67 2.67 2.67
0.050 1 0.00 2.00 2.00 2.00
24 2.67 15.33 25.33 26.00 48 0.00 6.67 22.67 29.33 72 73.33 80.67 80.67 80.67 0.075 1 0.00 19.33 26.67 26.67 24 0.00 0.00 0.00 20.00 48 0.00 0.00 0.00 0.00 72 0.68 3.35 3.35 12.05 Keterangan : MSP= minggu setelah perlakuan
12
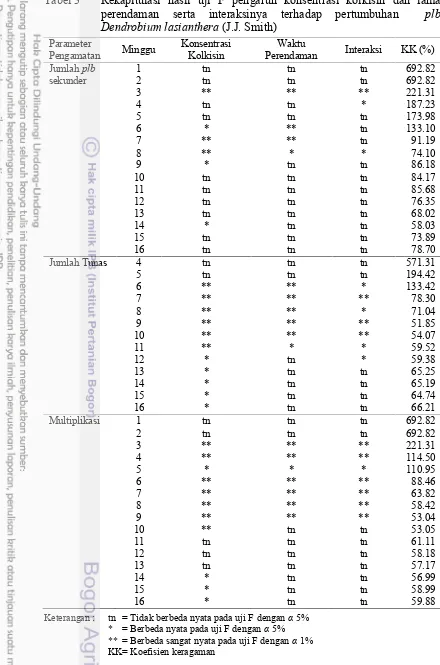
Tabel 3 Rekapitulasi hasil uji F pengaruh konsentrasi kolkisin dan lama perendaman serta interaksinya terhadap pertumbuhan plb Dendrobium lasianthera(J.J. Smith)
Jumlah Tunas 4 tn tn tn 571.31
5 tn tn tn 194.42
Multiplikasi 1 tn tn tn 692.82
2 tn tn tn 692.82
perendaman terhadap eskplan Dendrobium lasianthera (J.J. Smith).
Keterangan : tn = Tidak berbeda nyata pada uji F dengan 5% * = Berbeda nyata pada uji F dengan 5% ** = Berbeda sangat nyata pada uji F dengan 1% KK= Koefisien keragaman
14
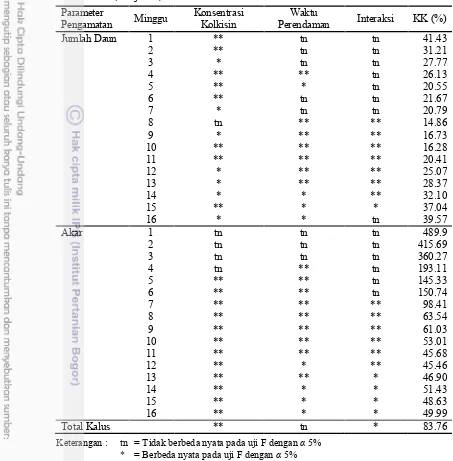
konsentrasi berpengaruh nyata terhadap danplbsekunder (3, 6 9, dan 14 MSP) jumlah daun (1 7 dan 9 16 MSP), tunas (6 16 MSP), dan jumlah akar (4 16 MSP). Faktor lama perendaman berpengaruh nyata terhadap jumlahplb sekunder (3 MSP dan 6 8 MSP), jumlah daun (4, 5, dan 8 16 MSP), jumlah tunas (6 11 MSP), dan jumlah akar (4 16 MSP). Jumlah plb berkalus nyata dipengaruhi oleh konsentrasi kolkisin dan interaksinya dengan lama perendaman. Koefisien keragaman tinggi di minggu awal pengamatan, tetapi menurun selama pengamatan sampai 16 MSP. Diduga sel-sel plb yang masih muda cukup aktif menyerap kolkisin yang dapat menyebabkan gangguan dalam pembelahan sel dan menginduksi penggandaan kromosom, sehingga perlu pengaturan ulang dalam proses mitosis dan metabolisme sel.
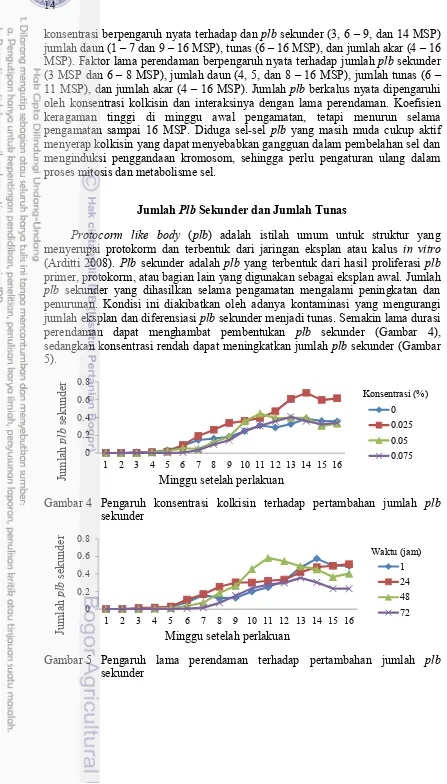
JumlahPlbSekunder dan Jumlah Tunas
Protocorm like body (plb) adalah istilah umum untuk struktur yang menyerupai protokorm dan terbentuk dari jaringan eksplan atau kalus in vitro (Arditti 2008). Plb sekunder adalah plb yang terbentuk dari hasil proliferasi plb primer, protokorm, atau bagian lain yang digunakan sebagai eksplan awal. Jumlah plb sekunder yang dihasilkan selama pengamatan mengalami peningkatan dan penurunan. Kondisi ini diakibatkan oleh adanya kontaminasi yang mengurangi jumlah eksplan dan diferensiasiplbsekunder menjadi tunas. Semakin lama durasi perendaman dapat menghambat pembentukan plb sekunder (Gambar 4), sedangkan konsentrasi rendah dapat meningkatkan jumlah plb sekunder (Gambar 5).
Gambar 4 Pengaruh konsentrasi kolkisin terhadap pertambahan jumlah plb sekunder
menghasilkan plb sekunder adalah perlakuan 0.025% kolkisin dengan lama perendaman 24 jam. Hasil ini tidak berbeda nyata dengan perlakuan tanpa kolkisin dengan perendaman 24 jam dan 0.025% kolkisin dengan perendaman 1, 48, dan 72 jam. Diduga pembelahan sel yang terinduksi mutasi terganggu akibat kromosom yang lebih banyak dari tanaman normal sehingga perlu energi lebih besar dalam proses mitosis. Berdasarkan uji t-Dunnet, perlakuan 0.025% kolkisin selama 1 jam menghasilkan plb paling banyak dan lebih dari kontrol tetapi tidak berbeda nyata. Gambar 6 menunjukkan pengaruh interaksi konsentrasi kolkisin dan lama perendaman terhadap pertambahan jumlah plb sekunder pada 8 dan 16 MSP. Athicart (2013) yang melakukan penelitian tentang induksi mutasi anggrek Dendrobium chrysotoxum, menyatakan pada media VW (Vacin dan Went) eksplan yang mendapat perlakuan 0.02% kolkisin menghasilkan tunas proliferasi paling banyak, dan semakin menurun seiring penambahan konsentrasi kolkisin. Tabel 4 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap
jumlahplbsekunderDendrobium lasianthera(J.J. Smith)
Minggu Konsentrasi 0.050 0.05 ed 0.10 cde 0.20 bcde 0.23 abcde 0.13 B 0.075 0.02 ed 0.12 cde 0.13 cde 0.10 cde 0.09 B Rata-rata 0.12 B 0.26 A 0.18 AB 0.09 B
16 MSP 0 0.93 0.66 0.49 0.23 0.13 0.15
0.025 1.01 0.94 0.36 0.33 0.13
0.050 0.31 0.30 0.34 0.68 0.16
0.075 0.18 0.38 0.59 0.16 0.12
Rata-rata 0.54 0.52 0.38 0.32
Keterangan : -Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT dengan 5%
Gambar 6 Pengaruh interaksi konsentrasi kolkisin dan lama perendaman terhadap jumlahplbsekunder pada 8 dan 16 MSP
Tunas merupakan perkembangan dari plb dan plb sekunder. Munculnya tunas ditandai dengan membengkaknya plb yang kemudian diikuti dengan merekahnya ujung eksplan sehingga membentuk nod (bakal tunas) (Siska et al. 2013). Tunas yang dihitung adalah tunas yang tumbuh dari plb sekunder. Semua
16
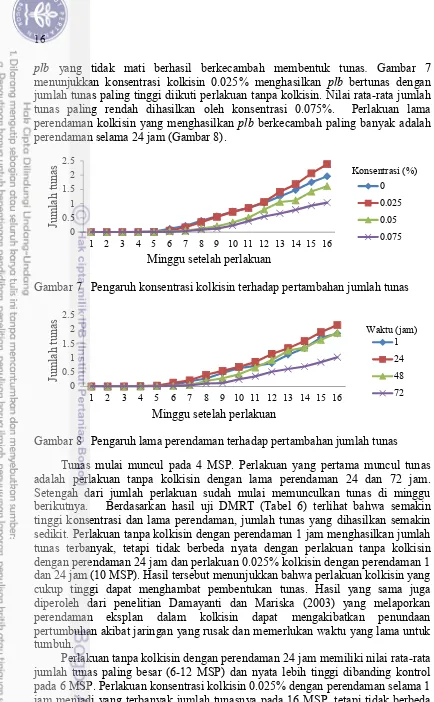
plb yang tidak mati berhasil berkecambah membentuk tunas. Gambar 7 menunjukkan konsentrasi kolkisin 0.025% menghasilkan plb bertunas dengan jumlah tunas paling tinggi diikuti perlakuan tanpa kolkisin. Nilai rata-rata jumlah tunas paling rendah dihasilkan oleh konsentrasi 0.075%. Perlakuan lama perendaman kolkisin yang menghasilkan plb berkecambah paling banyak adalah perendaman selama 24 jam (Gambar 8).
Gambar 7 Pengaruh konsentrasi kolkisin terhadap pertambahan jumlah tunas
Gambar 8 Pengaruh lama perendaman terhadap pertambahan jumlah tunas
Tunas mulai muncul pada 4 MSP. Perlakuan yang pertama muncul tunas adalah perlakuan tanpa kolkisin dengan lama perendaman 24 dan 72 jam. Setengah dari jumlah perlakuan sudah mulai memunculkan tunas di minggu berikutnya. Berdasarkan hasil uji DMRT (Tabel 6) terlihat bahwa semakin tinggi konsentrasi dan lama perendaman, jumlah tunas yang dihasilkan semakin sedikit. Perlakuan tanpa kolkisin dengan perendaman 1 jam menghasilkan jumlah tunas terbanyak, tetapi tidak berbeda nyata dengan perlakuan tanpa kolkisin dengan perendaman 24 jam dan perlakuan 0.025% kolkisin dengan perendaman 1 dan 24 jam (10 MSP). Hasil tersebut menunjukkan bahwa perlakuan kolkisin yang cukup tinggi dapat menghambat pembentukan tunas. Hasil yang sama juga diperoleh dari penelitian Damayanti dan Mariska (2003) yang melaporkan perendaman eksplan dalam kolkisin dapat mengakibatkan penundaan pertumbuhan akibat jaringan yang rusak dan memerlukan waktu yang lama untuk tumbuh.
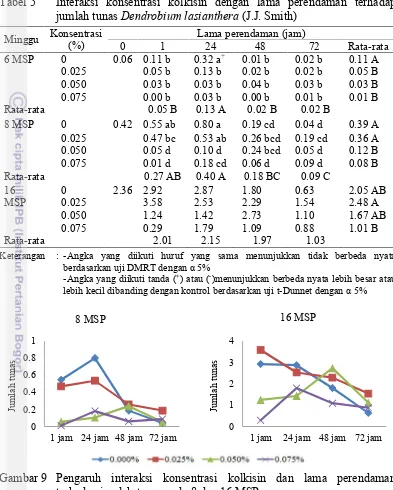
Perlakuan tanpa kolkisin dengan perendaman 24 jam memiliki nilai rata-rata jumlah tunas paling besar (6-12 MSP) dan nyata lebih tinggi dibanding kontrol pada 6 MSP. Perlakuan konsentrasi kolkisin 0.025% dengan perendaman selama 1 jam menjadi yang terbanyak jumlah tunasnya pada 16 MSP, tetapi tidak berbeda nyata dibandingkan dengan kontrol. Perlakuan dengan jumlah tunas paling sedikit
kolkisin dalam konsentrasi rendah dapat meningkatkan produksi hormon endogen sehingga memacu pertumbuhan tunas.
Tabel 5 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap jumlah tunasDendrobium lasianthera(J.J. Smith)
Minggu Konsentrasi 0.050 1.24 1.42 2.73 1.10 1.67 AB 0.075 0.29 1.79 1.09 0.88 1.01 B Rata-rata 2.01 2.15 1.97 1.03
Keterangan : -Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT dengan 5%
-Angka yang diikuti tanda (+) atau (-)menunjukkan berbeda nyata lebih besar atau lebih kecil dibanding dengan kontrol berdasarkan uji t-Dunnet dengan 5%
Gambar 9 Pengaruh interaksi konsentrasi kolkisin dan lama perendaman terhadap jumlah tunas pada 8 dan 16 MSP
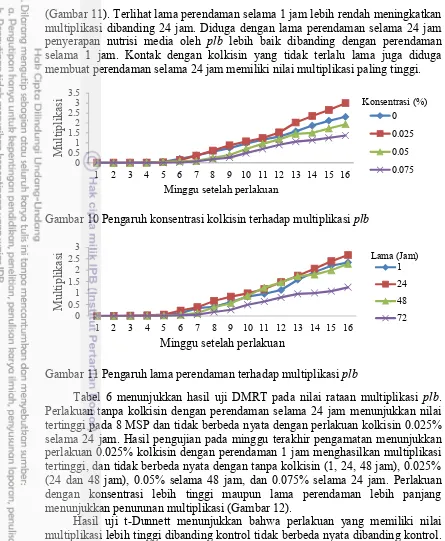
Multiplikasi adalah kemampuan eksplan untuk memperbanyak diri. Jumlah multiplikasi dalam penelitian ini adalah total jumlah plb sekunder dan jumlah tunas yang dihasilkan. Gambar 10 menunjukkan pola yang sama seperti pertambahan tunas, perlakuan dengan konsentrasi terendah (0.025%) dapat meningkatkan multiplikasi eksplan lebih besar dibanding kontrol, tetapi konsentrasi 0.050% dan 0.075% berturut-turut menurunkan tingkat multiplikasi dan lebih rendah dibanding kontrol. Lama perendaman dalam media perlakuan yang paling efektif untuk meningkatkan multiplikasi adalah selama 24 jam
18
(Gambar 11). Terlihat lama perendaman selama 1 jam lebih rendah meningkatkan multiplikasi dibanding 24 jam. Diduga dengan lama perendaman selama 24 jam penyerapan nutrisi media oleh plb lebih baik dibanding dengan perendaman selama 1 jam. Kontak dengan kolkisin yang tidak terlalu lama juga diduga membuat perendaman selama 24 jam memiliki nilai multiplikasi paling tinggi.
Gambar 10 Pengaruh konsentrasi kolkisin terhadap multiplikasiplb
Gambar 11 Pengaruh lama perendaman terhadap multiplikasiplb
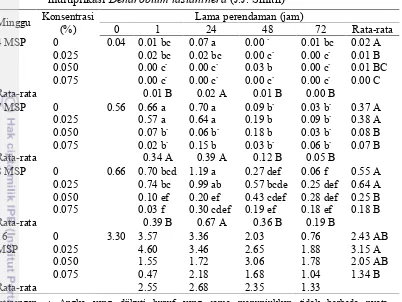
Tabel 6 menunjukkan hasil uji DMRT pada nilai rataan multiplikasi plb. Perlakuan tanpa kolkisin dengan perendaman selama 24 jam menunjukkan nilai tertinggi pada 8 MSP dan tidak berbeda nyata dengan perlakuan kolkisin 0.025% selama 24 jam. Hasil pengujian pada minggu terakhir pengamatan menunjukkan perlakuan 0.025% kolkisin dengan perendaman 1 jam menghasilkan multiplikasi tertinggi, dan tidak berbeda nyata dengan tanpa kolkisin (1, 24, 48 jam), 0.025% (24 dan 48 jam), 0.05% selama 48 jam, dan 0.075% selama 24 jam. Perlakuan dengan konsentrasi lebih tinggi maupun lama perendaman lebih panjang menunjukkan penurunan multiplikasi (Gambar 12).
Hasil uji t-Dunnett menunjukkan bahwa perlakuan yang memiliki nilai multiplikasi lebih tinggi dibanding kontrol tidak berbeda nyata dibanding kontrol. Perlakuan yang tidak menunjukkan multiplikasi nyata lebih rendah dibanding kontrol pada 4 MSP, sedangkan perlakuan tanpa kolkisin (24 dan 48 jam), 0.025% selama 72 jam, 0.050% (1, 24, dan 72 jam), serta 0.075% (1, 48, dan 72 jam), nyata lebih rendah dibanding kontrol pada 7 MSP. Pengamatan pada minggu lainnya tidak menunjukkan hasil yang berbeda nyata dengan kontrol, diduga keragaman yang tinggi akibat mutasi yang membuat hasil uji berbeda setiap minggu. Andrea et al. (2006) melaporkan bahwa kolkisin berkonsentrasi rendah (0.001%) dapat meningkatkan jumlah tunas 95% lebih banyak dari kontrol pada eksplan akar Cichorium intybus L, baik pada media regenerasi tunas maupun
menurunkan sebanyak 93% jumlah tunas dibanding kontrol.
Tabel 6 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap multiplikasiDendrobium lasianthera(J.J. Smith)
Minggu Konsentrasi 0.050 1.55 1.72 3.06 1.78 2.05 AB 0.075 0.47 2.18 1.68 1.04 1.34 B Rata-rata 2.55 2.68 2.35 1.33
Keterangan : -Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT dengan 5%
-Angka yang diikuti tanda (+) atau (-)menunjukkan berbeda nyata lebih besar atau lebih kecil dibanding dengan kontrol berdasarkan uji t-Dunnet dengan 5%
Gambar 12 Pengaruh interaksi konsentrasi kolkisin dan lama perendaman terhadap multiplikasi pada 8 dan 16 MSP
20
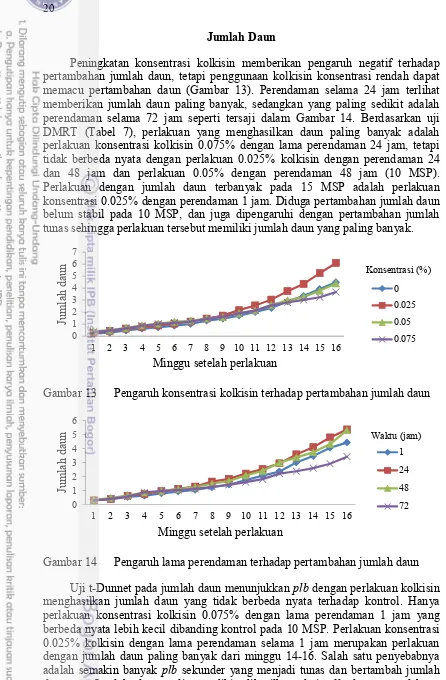
Jumlah Daun
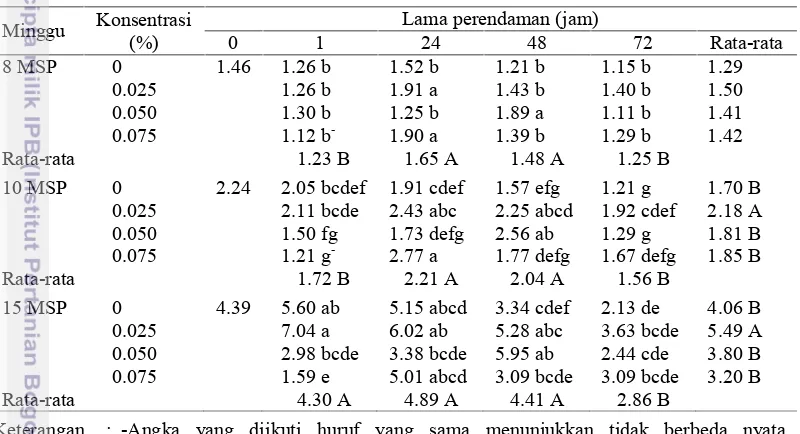
Peningkatan konsentrasi kolkisin memberikan pengaruh negatif terhadap pertambahan jumlah daun, tetapi penggunaan kolkisin konsentrasi rendah dapat memacu pertambahan daun (Gambar 13). Perendaman selama 24 jam terlihat memberikan jumlah daun paling banyak, sedangkan yang paling sedikit adalah perendaman selama 72 jam seperti tersaji dalam Gambar 14. Berdasarkan uji DMRT (Tabel 7), perlakuan yang menghasilkan daun paling banyak adalah perlakuan konsentrasi kolkisin 0.075% dengan lama perendaman 24 jam, tetapi tidak berbeda nyata dengan perlakuan 0.025% kolkisin dengan perendaman 24 dan 48 jam dan perlakuan 0.05% dengan perendaman 48 jam (10 MSP). Perlakuan dengan jumlah daun terbanyak pada 15 MSP adalah perlakuan konsentrasi 0.025% dengan perendaman 1 jam. Diduga pertambahan jumlah daun belum stabil pada 10 MSP, dan juga dipengaruhi dengan pertambahan jumlah tunas sehingga perlakuan tersebut memiliki jumlah daun yang paling banyak.
Gambar 13 Pengaruh konsentrasi kolkisin terhadap pertambahan jumlah daun
Gambar 14 Pengaruh lama perendaman terhadap pertambahan jumlah daun
Uji t-Dunnet pada jumlah daun menunjukkanplb dengan perlakuan kolkisin menghasilkan jumlah daun yang tidak berbeda nyata terhadap kontrol. Hanya perlakuan konsentrasi kolkisin 0.075% dengan lama perendaman 1 jam yang berbeda nyata lebih kecil dibanding kontrol pada 10 MSP. Perlakuan konsentrasi 0.025% kolkisin dengan lama perendaman selama 1 jam merupakan perlakuan dengan jumlah daun paling banyak dari minggu 14-16. Salah satu penyebabnya adalah semakin banyak plb sekunder yang menjadi tunas dan bertambah jumlah daunnya. Jumlah daun paling sedikit dihasilkan dari plb dengan perlakuan
konsentrasi rendah diduga dapat meningkatkan pertumbuhan tanaman. Kolkisin dengan konsentrasi tinggi dapat mengganggu pembelahan sel akibat hilangnya benang spindel sehingga pertumbuhan terhambat. Penelitian yang dilakukan oleh Anne (2012) pada tanaman nilam menunjukkan tanaman nilam yang diberi perlakuan kolkisin 0.04% selama 24 jam menghasilkan jumlah daun paling banyak, sedangkan yang paling sedikit adalah tanaman dengan perlakuan 0.06% kolkisin selama 48 jam. Hal yang sama juga dilaporkan oleh Kurniati (2014), yang menunjukkan bahwa kultur Dendrobium spectabile yang diberi perlakuan kolkisin dengan konsentrasi lebih rendah (0.5, 1, 1.5, dan 2 mg L-1) menghasilkan jumlah daun yang lebih banyak dibandingkan kontrol. Konsentrasi perlakuan yang menghasilkan daun paling banyak adalah 1 mg L-1.
Tabel 7 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap jumlah daunDendrobium lasianthera(J.J. Smith)
Minggu Konsentrasi 0.025 2.11 bcde 2.43 abc 2.25 abcd 1.92 cdef 2.18 A 0.050 1.50 fg 1.73 defg 2.56 ab 1.29 g 1.81 B 0.075 1.21 g- 2.77 a 1.77 defg 1.67 defg 1.85 B Rata-rata 1.72 B 2.21 A 2.04 A 1.56 B
15 MSP 0 4.39 5.60 ab 5.15 abcd 3.34 cdef 2.13 de 4.06 B 0.025 7.04 a 6.02 ab 5.28 abc 3.63 bcde 5.49 A 0.050 2.98 bcde 3.38 bcde 5.95 ab 2.44 cde 3.80 B 0.075 1.59 e 5.01 abcd 3.09 bcde 3.09 bcde 3.20 B Rata-rata 4.30 A 4.89 A 4.41 A 2.86 B
Keterangan : -Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT dengan 5%
-Angka yang diikuti tanda (+) atau (-)menunjukkan berbeda nyata lebih besar atau lebih kecil dibanding dengan kontrol berdasarkan uji t-Dunnet dengan 5%
Gambar 15 Pengaruh interaksi konsentrasi kolkisin dan lama perendaman terhadap jumlah daun pada 8 dan 15 MSP
22
Persentase Eksplan Berkalus
Kalus merupakan struktur sel yang belum terdiferensiasi. Kalus muncul dari bagian dasar eksplan dan membentuk massa tidak teratur. Kalus anggrek memasuki fase plb ketika mulai memunculkan bentuk membulat dan muncul kuncup tunas. Faktor konsentrasi kolkisin dan interaksi berpengaruh nyata terhadap jumlah kalus yang terbentuk, tetapi konsentrasi terlihat lebih menghambat pembentukan kalus (Gambar 16). Hasil uji DMRT (Tabel 8) menunjukkan perlakuan yang menghasilkan persentase eksplan berkalus tertinggi adalah perlakuan tanpa kolkisin dengan perendaman 1 jam, tetapi tidak berbeda nyata dengan perlakuan tanpa kolkisin dengan perendaman 24 dan 48 jam; kolkisin 0.025% dengan perendaman 1, 24 dan 72 jam; kolkisin 0.050% dengan perendaman 48 jam; dan 0.075% kolkisin dengan perendaman 24 jam.
Gambar 16 Pengaruh konsentrasi kolkisin dan lama perendaman terhadap persentase jumlah kalus
Tabel 8 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap persentase eksplan berkalus tanaman anggrekDendrobium lasianthera (J.J. Smith) Rata-rata 4.50 4.33 4.33 2.17
Keterangan : -Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT dengan 5%
-Angka yang diikuti tanda (+) atau (-)menunjukkan berbeda nyata lebih besar atau lebih kecil dibanding dengan kontrol berdasarkan uji t-Dunnet dengan 5%
Berdasarkan uji t-Dunnet, perlakuan yang membentuk kalus paling banyak tidak berbeda nyata dengan kontrol. Perlakuan yang berbeda nyata lebih kecil dibanding kontrol adalah tanpa kolkisin selama 72 jam, 0.025% (24 jam), 0.050% (1, 24, 72 jam), dan perlakuan 0.075% kolkisin dengan lama perendaman 1, 48, dan 72 jam. Dutt et al. (2010) dalam penelitiannya mengenai produksi autotetraploid pada ponkan mandarin menggunakan kultur suspensi sel,
hari menunjukkan pembentukan kalus yang paling cepat dan paling banyak menghasilkan embrio. Tetapi perlakuan tersebut tidak lebih tinggi dibandingkan kontrol.
Jumlah Akar
Data rata-rata jumlah akar menunjukkan semakin tinggi konsentrasi kolkisin perlakuan maka jumlah akar mengalami penurunan, tetapi konsentrasi rendah dapat meningkatkan jumlah akar yang muncul dibanding kontrol (Gambar 17). Lama perendaman dalam media perlakuan selama 24 jam menghasilkan pertambahan jumlah akar terbaik (Gambar 18). Hasil analisis ragam menunjukkan jumlah akar nyata dipengaruhi oleh interaksi antara konsentrasi dan lama perendaman dalam larutan kolkisin mulai dari 6 MSP. Tabel 9 menunjukkan hasil uji DMRT dan t-Dunnett pada 8, 10, dan 16 MSP. Perlakuan konsentrasi kolkisin 0.025% selama 1 jam menghasilkan akar paling banyak pada 10 MSP dan minggu terakhir pengamatan tetapi tidak berbeda nyata dengan kontrol. Diduga banyaknya daun dan tunas pada perlakuan ini memacu pertumbuhan akar untuk mendapat lebih banyak nutrisi dari media kultur. Akar paling sedikit pada 10 MSP dihasilkan dari perlakuan tanpa kolkisin dengan perendaman 48 jam sedangkan pada 16 MSP dari perlakuan 0.075% dengan perendaman 1 jam, keduanya nyata lebih kecil dibanding kontrol. Konsentrasi optimal untuk meningkatkan jumlah akar adalah konsentrasi 0.025 % selama 1 jam (Gambar 19).
Gambar 17 Pengaruh konsentrasi kolkisin terhadap pertambahan jumlah akar
Gambar 18 Pengaruh lama perendaman terhadap pertambahan jumlah akar
Menurut penelitian Rodiansah (2007), tanaman stevia yang diberi perlakuan konsentrasi kolkisin 0.06% selama 72 jam menghasilkan plb berakar yang paling
24
sedikit, tetapi konsentrasi rendah meningkatkan jumlah plb berakar walaupun tidak berbeda nyata dengan kontrol. Pada penelitiannya, Rafina (2012) melaporkan bahwa kultur tanaman jelutung (Dyera costulata (Hook. F.)) yang diberi perlakuan konsentrasi tertinggi (2 mg L-1) menghasilkan akar dengan jumlah paling banyak dan paling panjang dibandingkan pelakuan lainnya dan kontrol. Banyaknya jumlah akar pada konsentrasi rendah kemungkinan disebabkan karena kolkisin memacu pertumbuhan tanaman melalui peningkatan produksi enzim dalam tanaman. Jumlah akar yang semakin sedikit diduga diakibatkan oleh penyerapan kolkisin. Semakin tinggi konsentrasi kolkisin, maka penyerapan semakin tinggi dan pertumbuhan terhambat karena pembelahan sel terganggu.
Tabel 9 Interaksi konsentrasi kolkisin dengan lama perendaman terhadap jumlah akar tanaman anggrekDendrobium lasianthera(J.J. Smith)
Minggu Konsentrasi
Keterangan : -Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT dengan 5%
-Angka yang diikuti tanda (+) atau (-)menunjukkan berbeda nyata lebih besar atau lebih kecil dibanding dengan kontrol berdasarkan uji t-Dunnet dengan 5%
Gambar 19 Pengaruh interaksi konsentrasi kolkisin dan lama perendaman terhadap jumlah akar pada 8 dan 16 MSP
25
Gambar 20 Pertumbuhan kultur hasil mutasi pada minggu terakhir pengamatan (16 MSP). A-D: tanpa kolkisin dengan lama perendaman 1, 24, 48, dan 72 jam. E-H: konsentrasi kolkisin 0.025% dengan lama perendaman 1, 24, 48, dan 72 jam. I-L: konsentrasi kolkisin 0.050% dengan lama perendaman 1, 24, 48, dan 72 jam. M-P: konsentrasi kolkisin 0.075% dengan lama perendaman 1, 24, 48, dan 72 jam
H G
F E
L K
J I
P O
26
Analisis Morfologi Stomata
Kloroplas yang diamati adalah yang terdapat di dalam sel penjaga stomata. Organel ini menjadi salah satu alternatif pendugaan poliploidi tanaman. Hal tersebut dikarenakan kromosom mengandung molekul unit DNA sehingga jumlah kromosom dapat diidentifikasi dengan jumlah kloroplas. Omidbaigi et al. (2010) melaporkan bahwa semakin meningkatnya tingkat ploidi tanaman, jumlah kloroplas akan semakin meningkat. Penghitungan kloroplas lebih sederhana secara teknis serta relatif lebih stabil menggambarkan latar belakang genetik (Qin dan Rotino 1995).
Interaksi faktor konsentrasi kolkisin dengan lama perendaman menyebabkan keragaman terhadap jumlah kloroplas di setiap perlakuan. Gambar 21 menunjukkan konsentrasi dan lama perendaman dapat meningkatkan jumlah kloroplas Dendrobium lasianthera (J.J. Smith), tetapi pada konsentrasi tertinggi dan durasi perlakuan terlama terlihat menurun. Walaupun jumlah kromosom hasil sitologi menunjukkan penambahan jumlah kromosom, terdapat perlakuan yang memiliki jumlah kloroplas lebih kecil dibandingkan kontrol.
Gambar 21 Pengaruh konsentrasi kolkisin (A) dan lama perendaman (B) terhadap jumlah kloroplas
Tabel 10 menunjukkan nilai rata-rata jumlah kloroplas setiap perlakuan. Perlakuan yang memiliki jumlah kloroplas tertinggi adalah perlakuan perendaman dalam 0.025% kolkisin selama 24 jam, dengan rentang jumlah kloroplas antara 30 61 kloroplas. Sedangkan perlakuan dengan jumlah kloroplas terendah adalah perlakuan 0.025% kolkisin dengan lama perendaman 1 jam (19 29).
Tabel 10 Pengaruh perlakuan kolkisin terhadap jumlah kloroplas pada 36 MSP
Konsentrasi
Rata-rata 28 32 33 32
stomata pada perbesaran 4×10, lalu membagi nilainya dengan luas bidang pandang mikroskop. Bidang pandang pada perbesaran 4×10 adalah 0.19625 mm2. Stomata adalah bagian daun yang sangat penting untuk proses fotosintesis sehingga semakin tinggi kerapatan stomata maka pertumbuhan makin baik. Konsentrasi kolkisin yang semakin tinggi menurunkan kerapatan jumlah stomata, tetapi pada konsentrasi tertinggi kembali meningkat (Gambar 22). Perlakuan kolkisin menyebabkan keragaman jumlah stomata antar perlakuan, seperti tersaji dalam Tabel 11. Kerapatan stomata tertinggi dihasilkan oleh perlakuan tanpa kolkisin dengan perendaman 1 dan 24 jam (87 102 stomata mm-2). Sedangkan perlakuan kolkisin 0.050% selama 48 jam memiliki kerapatan stomata terendah
Gambar 22 Pengaruh konsentrasi kolkisin (grafik A) dan lama perendaman (grafik B) terhadap kerapatan stomata
dengan rentang 25 - 51 stomata mm-2 . Penelitian tentang induksi mutasi pada nilam (Anne 2012) menunjukkan kerapatan stomata terendah dihasilkan dari perlakuan 0.02% kolkisin, sedangkan yang tertinggi adalah kontrol. Kerapatan stomata yang tidak terlalu tinggi dapat menjadi indikator bahwa sel stomata membesar sehingga jumlahnya semakin sedikit dalam epidermis daun. Hal ini dikarenakan poliploidisasi seringkali menyebabkan sel meristem dan sel penjaga mengalami peningkatan ukuran. Gambar 23 menunjukkan perubahan kerapatan stomata hasil mutasi dibandingkan dengan kontrol.
A B C
Gambar 23 Kerapatan stomata daun Dendrobium lasianthera (J.J. Smith) hasil mutasi. Kerapatan stomata kontrol (A), daun dengan kerapatan stomata lebih tinggi (B) pada perlakuan 0.025% selama 24 jam, dan lebih rendah (C) pada perlakuan 0.050% selama 48 jam
28
Ukuran stomata yang diamati memiliki keragaman. Tanaman kontrol memiliki panjang stomata antara 30.59 35.51 µm dan lebar sel penjaga stomata 31.16 38.44 µm. Perlakuan dengan ukuran panjang stomata terbesar adalah perlakuan kolkisin 0.025% selama 1 jam. Lebar terbesar diperoleh dari perlakuan kolkisin 0.025% selama 24 jam. Tanaman yang memiliki jumlah kromosom lebih banyak akibat poliploid biasanya akan menunjukkan sifat morfologi yang lebih besar, lebih kekar, sel dan inti sel yang lebih besar, dan mempunyai stomata yang lebih besar (Suryo 1995). Keragaman ukuran stomata dapat dilihat pada Gambar 25.
Berdasarkan Tabel 11, terlihat bahwa perlakuan dengan ukuran stomata yang besar tidak selalu memiliki kerapatan stomata yang rendah. Perlakuan 0.050% kolkisin selama 24 jam memiliki ukuran stomata paling kecil, tetapi kerapatan stomatanya lebih kecil dibanding perlakuan dengan ukuran stomata terbesar. Diduga hal ini diakibatkan oleh adanya kimera antar contoh daun yang yang digunakan sebagai preparat. Kondisi planlet dalam botol kultur juga dapat mempengaruhi kondisi stomata planlet.
Gambar 24 Pengaruh konsentrasi kolkisin dan lama perendaman terhadap panjang (grafik A) dan lebar (grafik B) stomata
Tabel 11 Pengaruh perlakuan kolkisin terhadap ukuran dan nilai rata-rata kerapatan stomata pada 36 MSP
Gambar 25 Stomata daun Dendrobium lasianthera (J.J, Smith) hasil mutasi kolkisin pada 36 MSP. A-D: tanpa kolkisin dengan lama perendaman 1, 24, 48, dan 72 jam. E-H: konsentrasi kolkisin 0.025% dengan lama perendaman 1, 24, 48, dan 72 jam. I-L: konsentrasi 0.050% dengan lama perendaman 1, 24, 48, dan 72 jam. M-P: konsentrasi 0.075% dengan lama perendaman 1, 24, 48, dan 72 jam. Skala menunjukkan ukuran 20 µm
Analisis Sitologi Kromosom
Sampel yang diambil untuk uji sitologi adalah bagian akar planlet. Setiap perlakuan diambil 3 sampel. Pengambilan sampel dilakukan antara jam 09.45-10.00 pagi. Akar menjadi pilihan terbaik untuk pengamatan kromosom karena tidak memilki klorofil dan mudah menyerap pewarna. Jika akar belum muncul maka pucuk dapat digunakan sebagai sampel. Bagian basal tanaman anggrek juga bisa menjadi alternatif sampel analisis kromosom. Jumlah kromosom tanaman anggrek Dendrobium lasianthera(JJ.Smith) adalah 38 (2n=2x) (Kamemotoet al. 1999). Beberapa sel yang diduga mengalami poliploidisasi disajikan pada Gambar 26.
30
penggandaan dari diploid ke tetraploid lebih mudah karena hanya perlu satu kali mitosis tanpa spindel.
Gambar 26 Sel hasil uji sitologi diduga diploid (A), tetraploid (B), hexaploid (C), oktaploid (D), dan dodekaploid (E)
Perlakuan tanpa kolkisin terlihat memiliki sel yang masuk kategori tetraploid. Diduga sel telah mencapai tahap awal anafase sehingga jumlah kromosom terlihat lebih banyak. Jumlah sel poliploid pada konsentrasi 0.075% tidak sebanyak konsentrasi 0.050%, tetapi ada sel yang mencapai kategori dodekaploid (2n=12x), hal ini diduga karena konsentrasi yang tinggi dengan durasi yang cukup lama lebih kuat menginduksi poliploidisasi. Pembilasan yang tidak dilakukan setelah perlakuan juga diduga membuat sisa kolkisin yang bersentuhan dengan plb tetap bereaksi setelah ditanam ke media padat. Eksplan daun tanaman Pyrus communis L. kultivar Fertility yang diberi perlakuan kolkisin 0.4% selama 48 jam menghasilkan tingkat induksi tunas poliploid paling besar dibandingkan lama perlakuan 24 jam dan 72 jam (Qingrong et al. 2009). Dalam penelitian mengenai induksi poliploid pada Dendrobium scabrilingue L., Sarathumet al.(2010), menunjukkan semakin tinggi konsentrasi dan semakin lama durasi perlakuan meningkatkan persentase planlet poliploid. Jumlah poliploid tertinggi diperoleh dari kolkisin 0.1% dan durasi perlakuan selama 21 hari dalam media padat. Perlakuan tersebut juga mengakibatkan sitokimera. Tanaman yang memiliki sitokimera hexaploid dan oktaploid tumbuh lebih lambat dan menunjukan morfologi yang abnormal.
Tabel 12 Pendugaan ploidi sel tanaman Dendrobium lasianthera (J.J. Smith) hasil perlakuan kolkisin
Konsentrasi kolkisin (%)
Pendugaan ploidi sel (%)
Diploid Tetraploid Hexaploid Oktaploid Dodekaploid
0 93.33 6.67 - -
-0.025 14.81 77.78 3.70 3.70 -0.050 4.17 66.67 16.67 12.50 -0.075 20.00 60.00 6.67 3.33 10
A B C D
Kimera adalah fenomena mutasi pada jaringan somatik yang hanya mempengaruhi beberapa bagian tanaman sehingga satu tanaman dapat memilki dua atau lebih tipe sel (Acquaah 2007). Kimera pada induksi mutasi dapat diakibatkan oleh penyerapan mutagen yang berbeda pada tingkat individu, jaringan, maupun organ. Menurut Poespodarsono (1988), terdapat perbedaan kepekaan terhadap pengaruh kolkisin di antara spesies tanaman, bahkan di antara bagian tanaman yang berbeda. Dalam penelitiannya, Handro et al. (1993) mengemukakan bahwa dalam satu agregat kalus yang telah direndam dengan kolkisin 10-3 selama 72 hari, menunjukkan perbedaan karakteristik dari bentuk dan jumlah ploidi sel didalamnya tergantung pada kekompakkan agregatnya. Variasi kemampuan penyerapan kolkisin ini menyebabkan keragaman jumlah kromosom baik di tingkat organ (akar yang berbeda dari 1 planlet) maupun di tingkat jaringan (dari akar yang sama) seperti tersaji pada Gambar 28 dan Gambar 29.
Gambar 27 Hasil uji sitologi pada kontrol dengan jumlah kromosom 37
Gambar 28 Kimera tingkat organ pada perlakuan konsentrasi kolkisin 0.025% dengan lama perendaman 24 jam. Jumlah kromosom pada sel A terhitung 83, dan sel B 51 kromosom.
Gambar 29 Kimera tingkat jaringan pada perlakuan konsentrasi kolkisin 0.075% dan lama perendaman 1 jam. Jumlah kromosom pada sel A terhitung 54, dan sel B 80 kromosom.
Perlakuan tanpa kolkisin pada semua lama perendaman walaupun tidak mendapat perlakuan kolkisin, terlihat memiliki jumlah kromosom yang lebih banyak dibandingkan kontrol, tetapi lebih kecil dibandingkan perlakuan yang diberi berbagai konsentrasi kolkisin(Tabel 13). Diperkirakan hal ini terjadi karena sel akar yang teramati mendekati fase anafase sehingga jumlah kromosom yang
A B
A
32
Tabel 13 Nilai rata-rata dan standar deviasi pengaruh kolkisin terhadap jumlah kromosom
terlihat menjadi lebih banyak. Perlakuan yang menghasilkan sel dengan jumlah kromosom terbanyak adalah perendaman dalam 0.075% kolkisin selama 48 jam. Tanaman yang memiliki banyak kromosom (dibanding tanaman normalnya), biasanya memiliki pertumbuhan yang lambat. Hal tersebut sesuai dengan hasil penelitian ini dilihat dari paramater pertumbuhan bahwa perlakuan tersebut memiliki nilai yang termasuk rendah, walaupun masih ada perlakuan lain yang lebih rendah. Keragaman kromosom antar perlakuan dapet dilihat di Gambar 30.
Lambatnya pertumbuhan tanaman yang mengalami poliploid diduga karena banyaknya kromosom, maka proses pembelahan sel semakin melambat. Hal tersebut mengakibatkan tingkat pertumbuhan rendah. Terlihat kimera antar sel akar yang diamati cukup sering terjadi. Planlet yang diamati sudah memasuki fase M1V1, yaitu tanaman hasil mutasi yang diperbanyak secara vegetatif. Planlet tidak
dianggap telah terjadi perbanyakan vegetatif. Generasi mutan M1V1 umumnya
memiliki mutasi yang belum solid. Seleksi mutan umumnya dimulai dari M1V2,
tetapi kemungkinan untuk mengidentifikasi mutan pada populasi M1V2 cukup
rendah sehingga diperlukan seleksi pada generasi M1V3sampai M1V4(Suprasanna
et al.2011).
Gambar 30 Keragaman jumlah kromosom setiap perlakuan kolkisin pada Dendrobium lasianthera (J.J. Smith). Jumlah kromosom masing-masing sel: 38 (A), 42 (B), 38 (C), 38 (D), 88 (E), 60 (F), 86 (G), 50 (H), 92 (I), 76 (J), 157 (K), 130 (L), 69 (M), 61 (N), 245 (O), 78 (Q).
Lethal Dose(LD)
Jumlah tanaman hidup dihitung dari total eksplan yang tidak terkontaminasi di minggu terakhir pengamatan. Tabel 14 menunjukkan plb pada perlakuan 0.025% kolkisin selama 48 jam memiliki persentase hidup paling tinggi, tetapi tidak terlalu berbeda dengan kontrol secara umum. Persentase hidup terendah didapat dari perlakuan 0.075% kolkisin selama 1 jam.
Tabel 14 Persentase hidup eksplan pada minggu terakhir pengamatan (16 MSP)
Konsentrasi (%)
Lama perendaman (Jam) Rata-rata
0 1 24 48 72
0 65.91 55.77 54.72 32.50 21.89 46.15 0.025 57.26 66.53 39.44 40.32 50.88 0.050 23.97 26.45 45.22 28.16 30.95 0.075 20.00 41.11 42.67 37.56 35.33 Rata-rata 65.91 39.25 47.20 39.95 31.98
34
Nilai LD50 dihasilkan dari persentase tanaman hidup pada minggu terakhir
setelah diberi perlakuan mutagen kolkisin melalui programCurveExpert1.4. Data yang dimasukkan dan diolah akan ditampilkan dalam bentuk kurva. Kurva yang direkomendasikan akan ditampilkan, sedangkan lainnya dapat menjadi pilihan. Tabel 15 Nilai Lethal Dose kolkisin terhadap Dendrobium lasianthera (J.J.
Smith) secarain vitro
Faktor Model Persamaan LD30 LD50 r Konsentrasi
kolkisin Linear Fit y = a + bx 0.078% 0.122% 0.731 Lama perendaman Linear Fit y = a + bx 24.57 jam 70.32 jam 0.692
Hasil analisis menunjukkan bahwa konsentrasi optimum (LD50) kolkisin
untuk menginduksi mutasi pada Dendrobium lasianthera (J.J. Smith) adalah 0.122% dan lama perendaman dalam perlakuan menunjukkan nilai 70.32 jam (Tabel 15). Hal ini menunjukkan bahwa konsentrasi masih bisa ditingkatkan untuk mendapatkan persentase mutasi yang lebih besar sedangkan lama perendaman dalam media sudah cukup. Tingkat penyerapan kolkisin setiap tanaman, bahkan bagian tanaman, berbeda. Hal tersebut dapat menyebabkan perbedaan jumlah kematian eksplan yang akan berpengaruh pada nilai LD50. Pola
sebaran persentase tanaman hidup yang dihasilkan untuk konsentrasi kolkisin dan lama perendaman dalam kolkisin dipilihLinear Fit.
SIMPULAN
Interaksi antara konsentrasi kolkisin dan lama perendaman dalam media perlakuan berpengaruh nyata terhadap pertumbuhan dan perkembangan plb Dendrobium lasianthera (J.J. Smith). Konsentrasi kolkisin yang semakin tinggi dan semakin lama durasi perlakuan menurunkan nilai parameter pertumbuhan, tetapi dalam konsentrasi rendah dan durasi yang tidak terlalu lama meningkatkan parameter pertumbuhan dibanding kontrol. Perlakuan 0.025% kolkisin dengan lama perendaman 24 jam menghasilkan jumlah tunas, multiplikasi, daun, dan akar tertinggi, tetapi nilai akhir tidak berbeda nyata dengan kontrol. Jumlah plb sekunder tertinggi didapat dari perlakuan 0.025% kolkisin selama 1 jam. Peningkatan konsentrasi kolkisin berpengaruh nyata menurunkan persentase eksplan berkalus, dengan nilai tertinggi diperoleh dari perlakuan tanpa kolkisin selama 1 jam dan tidak berbeda nyata dengan kontrol.
Peningkatan konsentrasi kolkisin dan lama perendaman meningkatkan jumlah kloroplas dan ukuran stomata, serta menurunkan kerapatan stomata. Jumlah kloroplas terbanyak diperoleh dari perlakuan konsentrasi kolkisin 0.025% selama 24 jam. Kerapatan stomata terbesar dihasilkan dari perlakuan tanpa kolkisin selama 1 jam dan 24 jam. Ukuran stomata terbesar dihasilkan dari perlakuan 0.025% kolkisin selama 1 jam (panjang stomata) dan 0.025% selama 24 jam (lebar penjaga stomata). Perlakuan kolkisin menginduksi terbentuknya sel tetraploid, hexaploid, oktaploid, dan dodekaploid. Sel poliploid terbanyak diperolah dari konsentrasi 0.050% kolkisin. Nilai LD50 konsentrasi kolkisin pada