ISOLASI BAKTERI PENGHASIL LIPASE TERMOFILIK
KLONING DAN EKSPRESI GEN PENYANDI LIPASE
ALBERT SEMBIRING
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi Bakteri Penghasil Lipase Termofilik Kloning dan Ekspresi Gen Penyandi Lipase adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2015
Albert Sembiring
RINGKASAN
ALBERT SEMBIRING. Isolasi Bakteri Penghasil Lipase Termofilik Kloning dan Ekspresi Gen Penyandi Lipase. Dibimbing oleh ANTONIUS SUWANTO dan NISA RACHMANIA MUBARIK.
Bakteri termofil merupakan kelompok bakteri yang dapat tumbuh optimal pada suhu 70-80oC. Enzim lipase yang berasal dari bakteri ini memiliki ketahanan
terhadap denaturan kimia seperti detergen, agen chaotropic (urea, guanidinium chloride), pelarut organik dan pH ekstrem, sehingga cukup menjanjikan hasil yang maksimal untuk digunakan dalam proses industri. Lipase (triacyl glycerol acylhidrolase EC 3.1.1.3) merupakan kelompok enzim kelas hidrolase yang mengkatalisis reaksi hidrolisis ikatan ester pada rantai panjang asam lemak (trigliserida) menjadi gliserol dan asam lemak bebas pada permukaan air dengan minyak. Selain itu lipase mendapat perhatian khusus karena keunikannya yaitu pada kondisi yang sedikit air (micro-aqueous) mampu mengkatalisis reaksi esterifikasi, trans-esterifikasi, aminolisis dan asidolisis. Tujuan penelitian ini ialah melakukan isolasi bakteri termofilik penghasil lipase; identifikasi dari isolat terpilih; kloning dan ekspresi gen lipase dari isolat terpilih yang berasal dari sumber air panas geiser di Cisolok, Sukabumi, Jawa Barat yang suhunya dapat mencapai 95oC.
Bakteri termofil yang diisolasi dari sumber air panas geiser, Sukabumi, Jawa Barat, Indonesia yang memiliki pH 8 dan suhu mencapai 95oC menggunakan metode pengenceran bertingkat yang disebar pada media padat Luria Bertani
Rhodamine B. Bakteri termofil ini memiliki kemampuan menghasilkan lipase secara ekstraseluler yang ditunjukkan dengan terjadinya pendaran orange bila diamati di bawah sinar UV dengan panjang gelombang 350 nm. Isolat yang diperoleh diukur kemampuannya dalam menghasilkan lipase dengan metode titrasi. Isolat bakteri termofilik S4-01 memiliki aktivitas tertinggi sebesar 3.91 U menit-1
yang dipilih untuk dilakukan uji selanjutnya. Identifikasi bakteri dilakukan secara molekuler dengan metode 16S rRNA, hasil sekuensing parsial gen 16S rRNA menunjukkan isolat ini berkerabat paling dekat dengan Bacillus amyloliquefaciens.
Gen lipase yang berasal dari isolat S4-01 diisolasi dengan primer BamyKpnI-F dan BamyNotI-R yang didesain berdasarkan gen yang diambil dari genebank ncbi.nih.nlm.gov. Hasil isolasi menunjukkan gen lipase memiliki panjang 645 pb dan telah berhasil dikloning ke dalam vektor p-GEMT-Easy pada E. coli TOP10 dengan metode heat shock. Untuk ekspresi gen lipase dilakukan pada vektor ekspresi pET15-by dalam inang E. coli BL21(DE3) pLyss. Produksi lipase rekombinan dilakukan dengan induksi 0.5 mM IPTG pada nilai 0.5-0.6 OD600nm.
Penentuan suhu optimum dilakukan dengan metode 4-para nitrofenil palmitat (pNPP) dan pH optimum menggunakan metode 4-para nitrofenil oktanoat (pNPC). Hasil uji menunjukkan lipase rekombinan ini memiliki suhu dan pH optimum pada 40oC dan pH 8. Pengujian terhadap pelarut organik dengan metode pNPP
menunjukkan bahwa lipase rekombinan toleran terhadap n-heksan dan substrat nitrofenil ester dilakukan dengan metode pNPP dan pNPC yang menunjukkan lipase rekombinan lebih suka terhadap substrat C6 (heksanoat) dan C14 (miristat).
SUMMARY
ALBERT SEMBIRING. Isolation of A Lipolytic Thermophilic Bacterium Cloning and Expressing Lipase Gene. Supervised by ANTONIUS SUWANTO and NISA RACHMANIA MUBARIK
The optimum temperature for thermophile bacteria range between 70oC to 80oC. Most lipase from these bacteria are tolerant to detergent, chaotropic agent,
organic solvent, and extreme pH therefore give a guarantee for industrial application. Lipase (triacyl glycerol acylhydrolase EC 3.1.1.3) is hydrolase enzyme that able to catalyze the hydrolysis of ester bonds in long chain fatty acids (triglycerides) into glycerol and free fatty acid over an oil-water interface. In addition lipases can catalyze acidolysis, aminolysis, trans-esterification, and esterification in micro-aqueous condition, which is very unique. The objectives of this research were to isolate lipase producing thermophilic bacteria, clone and express the lipase gene from selected isolate.
A thermophilic bacteria were spread on solidified Luria Bertani (LB) containing Rhodamine B with serial dilution 10-1-10-5 from a hot spring Geyser
(95oC, pH 8), located in Sukabumi, West Java, Indonesia. The thermophilic bacteria showed extracellular lipase acitivity as identified orange fluorescent halo under UV light while they were grown on the Rhodamine B agar plate. Isolate producing lipase was determined by titrimetric method. S4-01 demonstrated the highest lipase activity 3.91 U ml-1 among other isolates and selected for the next test. Bacterial identification uses 16S rRNA as marka moleculer. Based on partial sequencing of 16S rRNA gene, S4-01 was related to Bacillus amyloliquefaciens. Lipase gene from S4-01 isolate, was isolated by a pair of oligonucleotide primers with restriction enzyme were designed and named as BamyKpnI-F and BamyNotI-R, the reference gene was taken from genebank ncbi.nih.nlm.gov. The lipase gene of S4-01 645 bp long, was successfully isolated and cloned with heat shock methode into p-GEMT-Easy vector on E. coli TOP10. For lipase expression was induced with 0.5 mM isopropyl-β-ɒ-thiogalactopyranoside (IPTG) on E. coli BL21(DE3) pLyss when OD600nm attained 0.5-0.6.
The effect temperature was investigated by evaluating lipase activity towards 4-paranitrophenyl palmitate (pNPP) methode and the optimum pH was determined by monitoring lipase activity towards 4-paranitrophenyl octanoate (pNPC). The test showed that the optimum temperature and pH were at 40oC and 8 respectively. The enzyme was determined with pNPP methode in some organic solvent and showed only tolerant to n-hexane. Substrate specificity assay was tested with pNPP and pNPC methode, indicated that S4-01 lipase showed preference to hexanoate (C6) or myristate (C14).
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
ISOLASI BAKTERI PENGHASIL LIPASE TERMOFILIK
KLONING DAN EKSPRESI GEN PENYANDI LIPASE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga penulisan tesis ini berhasil diselesaikan. Tesis ini disusun dalam rangka memenuhi persyaratan memperoleh gelar Magister Sains pada Program Studi Bioteknologi Sekolah Pascasarjana Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih kepada: Prof. Dr. Ir. Antonius Suwanto, M.Sc dan Dr. Nisa Rachmania Mubarik, M.Si selaku komisi pembimbing yang telah memberikan arahan dan masukan dalam penyusunan karya ini. Ucapan terima kasih berturut-turut diasampaikan kepada; Prof. Dr. Ir. Suharsono, selaku ketua program studi Bioteknologi; PT. Wilmar Benih Indonesia, Cikarang yang telah memberikan fasilitas selama mengerjakan penelitian; Esti Puspitasari Griselda Herman Natadiputri dan Andreas Adhi Satya Putra, selaku staf R&D PT. Wilmar Benih Indonesia, Cikarang; dan seluruh staf laboratorium Bioteknologi PT. Wilmar Benih Indonesia, Cikarang; Dirjen Pendidikan Tinggi (DIKTI) Indonesia yang telah memberikan dana melalui beasiswa Pendidikan Pasca Sarjana Dalam Negeri (BPPDN) 2013; Rekan-rekan Bioteknologi (BTK) 2013, khususnya Tira Siti Nur Afiah, Siti Nabila, Jekmal Malau, Retno Tri Astuti, Arif Setiawan dan Natalia Lusianingsih Sumanto yang telah memberikan bantuan, dukungan dan motivasi selama perkuliahan dan penelitian berlangsung; Kedua orang tua, saudara-saudara, dan Nina Septania Damanik yang telah memberi dukungan dan doa kepada penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2015
DAFTAR ISI
DAFTAR TABEL v
DAFTAR GAMBAR v
DAFTAR LAMPIRAN v
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 3
Bakteri Termofilik 3
Struktur, Peranan, dan Mekanisme Lipase 4
Vektor 6
3 METODE 7
Waktu dan Tempat Peneitian 7
Bahan 7
Alat 7
Isolasi Bakteri Termofil Penghasil Lipase 7
Produksi Enzim Ekstrak Kasar Lipase 8
Pengukuran Aktivitas Enzim Ekstrak Kasar Lipase 8
Identifikasi Bakteri 8
Isolasi Gen Lipase 9
Kloning Gen Lipase 9
Ekspresi Gen Lipase pada E. coli BL21 (DE3) pLyss 9
Karakterisasi Enzim Ekstrak Kasar Lipase 10
4 HASIL DAN PEMBAHASAN 11
Isolasi Bakteri dan Pengukuran Aktivitas Lipase Termofilik 11
Identifikasi Bakteri 11
Isolasi, Kloning, dan Analisis Sekuen Gen Penyandi Lipase 12
Ekspresi Lipase Rekombinan 14
Karakterisasi Lipase Rekombinan 16
Pembahasan 18
5 SIMPULAN DAN SARAN 22
Simpulan 22
Saran 22
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR TABEL
1 Pengukuran aktivitas enzim lipase 11
DAFTAR GAMBAR
1 Skema pelipatan α/β hidrolase 4
2 Mekanisme katalitik lipase 6
3 Hasil elektroforesis amplifikasi gen 16S rRNA isolat S4-01 12 4 Konstruksi pohon filogenetik isolat S4-01 berdasarkan gen 16S rRNA 12 5 Hasil elektroforesis amplifikasi gen lipase isolat S4-01 12
6 Hasil konstruksi pGEM-Lip 13
7 Hasil PCR koloni seleksi bakteri transforman pGEM-Lip 13 8 Konstruksi pohon filogenetik gen lipase isolat S4-01 berdasarkan urutan
asam amino 14
9 Prediksi triad katalitik lipase Ser110Asp166His189 14 10 Hasil pemotongan pGEM-Lip menggunakan KpnI dan NotI 15
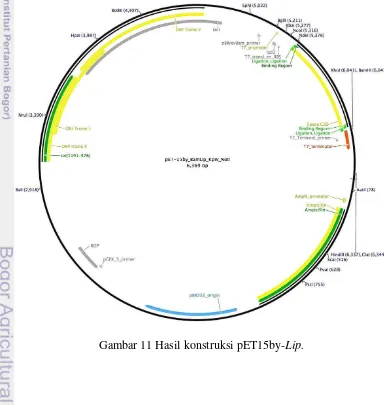
11 Hasil konstruksi pET15by-Lip 15
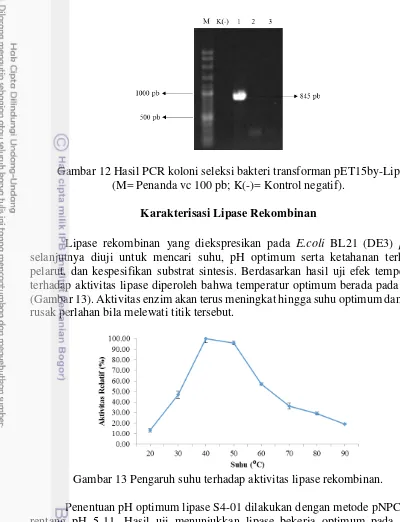
12 Hasil PCR koloni seleksi bakteri transforman pET15by-Lip 16 13 Pengaruh suhu terhadap aktivitas lipase rekombinan 16 14 Pengaruh pH terhadap aktivitas lipase rekombinan 17 15 Pengaruh pelarut organik terhadap aktivitas lipase rekombinan 17 16 Pengaruh substrat p-nitrofenil ester terhadap aktivitas lipase rekombinan 18
DAFTAR LAMPIRAN
1 Sekuen nukleotida parsial gen 16S rRNA bakteri isolat S4-01 27 2 Sekuen nukleotida gen lipase bakteri isolat S4-01 27 3 Prediksi asam amino menggunakan software expasy 28
4 Kurva standar p-nitrofenil oktanoat (pNPC) 28
5 Kurva standar p-nitrofenil palmitat (pNPP) 28
6 Pengukuran aktivitas lipase terhadap suhu 29
7 Pengukuran aktivitas lipase terhadap pH 29
1
PENDAHULUAN
Latar Belakang
Mikrob berserta enzimnya seperti amilase, protease, dan lipase memiliki peranan penting dalam proses industri. Lipase dari mikrob mendapat perhatian khusus untuk dimanfaatkan dalam industri detergen, food additives, kesehatan, bioremediasi dan bahan bakar ramah lingkungan (biodiesel) (Sangeetha et al. 2011) karena memiliki kemampuan stabil terhadap pH dan temperatur yang ekstrem, pelarut organik, substrat yang luas, serta selektivitas yang tinggi sebagai chemo,
regio dan enantio (Verma et al. 2012; Gupta et al. 2004) sebab proses industri umumnya memerlukan temperatur tinggi yang memberikan keuntungan berupa menurunkan viskositas dan kontaminasi, meningkatkan koefisien difusi, kelarutan dan bioavaibility senyawa organik (Niehaus et al. 1999).
Bakteri memiliki relung (niche) hidup yang lebih luas karena dapat tumbuh subur pada lingkungan ekstrem dibandingkan dengan mikrob lainnya (kapang, khamir) sehingga dapat menjadi alternatif yang sangat menarik untuk dieksplor lebih jauh dalam aplikasinya di industri. Ekstremofil merupakan kelompok bakteri yang tumbuh subur pada lingkungan ekstrem dalam parameter fisiologi yang meliputi tekanan, radiasi, temperatur, parameter geokimia (kekeringan, salinitas, pH) atau bahkan secara biologis (keterbatasan nutrisi, predator dan kepadatan populasi) (Rothschild dan Mancinelli 2001;Martinez et al. 2010). Bakteri termofil merupakan kelompok bakteri yang dapat tumbuh optimal pada suhu 70-80oC dan hipertermofil pada suhu 85-100oC atau lebih (Niehaus et al. 1999), lingkungan
eksotis ini biasanya terdapat pada berbagai macam geotermal dan daerah vulkanik seperti deep-seageothermal vents, fumarol, dan geiser (Walsh 2014). Kemampuan bakteri tersebut untuk bertahan dalam kondisi seperti ini kemungkinan besar karena hasil perkembangan novel biokimia dan metabolisme seluler yang termasuk enzim di dalamnya (Kiran et al. 2014). Enzim lipase yang berasal dari bakteri ini memiliki ketahanan terhadap denaturan kimia seperti detergen, agen chaotropic (urea,
guanidinium chloride), pelarut organik dan pH ekstrem (Martinez et al. 2010), sehingga cukup menjanjikan hasil yang maksimal untuk digunakan dalam proses industri.
Lipase (triacyl glycerol acylhidrolase EC 3.1.1.3) merupakan kelompok enzim kelas hidrolase yang mengkatalisis reaksi hidrolisis ikatan ester pada rantai panjang asam lemak (trigliserida) menjadi gliserol dan asam lemak bebas pada permukaan air dengan minyak (Helen et al. 2010). Selain itu lipase mendapat perhatian khusus karena keunikannya yaitu pada kondisi yang sedikit air ( micro-aqueous) mampu mengkatalisis reaksi esterifikasi, trans-esterifikasi, aminolisis dan asidolisis (Joseph et al. 2008). Keunikan yang dimiliki lipase ini menjadikannya teratas sebagai biokatalis dengan potensi yang telah terbukti berkontribusi dalam menghasilkan milyaran dolar dalam pemanfaatan bioindustri teknologi lipid dan telah digunakan juga dalam metabolisme lipid secara in situ dan berbagai peranan dalam aplikasi di industri secara ex situ (Jaeger dan Eggert 2002).
2
penggunaan kembali lipase, memungkinkan dalam penggunaan proses yang berkelanjutan (Hamid et al. 2003). Sebuah ciri khas utama dari lipase ialah memiliki
interfacial activation, walaupun setelah diidentifikasi terdapat beberapa lipase yang tidak melakukan interfacial activation. Sisi aktif dari lipase mengandung sebuah sisi katalitik triad yang terdiri dari Ser-His-Asp/Glu. Sebuah penutup menutupi sisi aktif ini sehingga membuat pelarut dan substrat tidak dapat mencapainya. Penutup ini terbuka pada saat ada proses interfacial activation yang membuat substrat lipid dapat berikatan dengan sisi aktif (Zheng et al. 2010).
Secara khusus penggunaan enzim ini dilakukan untuk memproduksi biodiesel melalui proses transesterifikasi. Lipase mengkatalisis transesterifikasi antara lipid dengan rantai pendek alkohol yang menghasilkan ester dan gliserol (Sangeetha et al. 2011). Produksi biodiesel memerlukan lingkungan yang sedikit air sebab keberadaan air akan menghambat proses transesterifikasi sebaliknya menginduksi hidrolisis minyak, keuntungan lipase dalam menghasilkan biodiesel ialah reaksi dapat berjalan dalam kondisi mild (dingin), menggunakan energi yang lebih sedikit dan mudah mengembalikan gliserol dari biodiesel (Bajaj et al. 2010). Dengan demikian enzim lipase termofilik merupakan pilihan yang potensial untuk meningkatkan proses industri. Namun terdapat kendala lain bahwa lipase yang dihasilkan oleh bakteri termofil umumnya dalam jumlah yang sedikit, sehingga diperlukan cara untuk meningkatkan produksi enzim sampai pada level tertinggi dengan melakukan kloning dan ekspresi gen lipase termofilik ke dalam berbagai host mesofilik yang sesuai. Beberapa penelitian telah berhasil melakukannya seperti pada Geobacillus thermoleovorans (Fattah dan Gaballa 2008), Geobacillus sp. (Tayyab et al. 2010), Geobacillus stearothermophillus
(Apituley 2012), Bacillus subtilis (Emtenani et al. 2013), Bacillus amyloliquefaciens (Cai et al. 2014). Dari penelitian ini diharapkan mendapat isolat rekombinan yang potensial dalam penggunaan enzim lipase di bidang industri.
Perumusan Masalah
Sampai saat ini ketergantungan akan minyak bumi untuk digunakan sebagai bahan bakar masih sangat tinggi, sementara itu cadangan minyak bumi semakin menipis dan bersifat tidak dapat diperbarui selain itu hasil pembakarannya menyebabkan polusi udara dan pemanasan bumi, oleh karena itu diperlukan produksi energi terbarukan, seperti biodiesel, dengan menggunakan enzim lipase yang ramah lingkungan dan bersifat biodegradable dibandingkan penggunaan bahan kimia.
Tujuan Penelitian
Manfaat Penelitian
Manfaat yang diperoleh dari penelitian ini antara lain isolat bakteri rekombinan penghasil lipase dapat dimanfaatkan secara khusus untuk produksi biodiesel, serta sebagai sumber informasi yang berkaitan dengan gen penyandi lipase yang berasal dari bakteri termofil.
2
TINJAUAN PUSTAKA
Bakteri Termofilik
Termofilik adalah kelompok organisme yang dapat tumbuh subur pada suhu yang tinggi. Kelompok organisme yang dapat tumbuh optimal pada suhu di atas 45oC disebut dengan termofilik sedangkan organisme yang tumbuh optimal lebih dari 80oC disebut hipertermofilik (Madigan et al. 2011). Daerah dengan suhu yang
demikian tinggi biasa dijumpai pada berbagai macam habitat panas bumi seperti
geothermal vents, sumber mata air panas, fumarol, kawah gunung berapi dan geiser (Walsh 2014). Hasil studi terhadap spesies yang tersebar di alam terhadap tingkatan suhu serta pengujian pada berbagai habitat sumber air panas dengan suhu yang berbeda-beda menyimpulkan bahwa prokariot dapat tumbuh subur pada suhu yang jauh lebih tinggi dibandingkan dengan eukariot sehingga disebut dengan bakteri termofil dan hipertermofil. Bakteri termofil dari kelompok bakteri fototropik terdiri atas sianobakter, bakteri hijau dan ungu, kelompok eubakteria yaitu Bacillus, Clostridium, Thiobacillus, Thermus, Actinomycetes dan genus lainnya. Kelompok arkea berasal dari genus Pyrococcus, Thermococcus, Thermoplasma, Sulfolobus dan Metanogen (Madigan et al. 2011; Rothschild dan Macinelli 2001).
Bakteri termofil dan hipertermofil menjadi sangat menarik tidak hanya untuk alasan biologi semata tetapi karena menawarkan beberapa keuntungan dalam proses industri sebab banyak proses industri yang dapat berjalan lebih efisien pada suhu tinggi. Keuntungan yang ditawarkan tidak terlepas dari mekanisme bakteri ini untuk dapat bertahan pada kondisi suhu lingkungan yang ekstrem. Mekanisme tersebut meliputi perkembangan lipid pada membran sel dan kestabilan protein (Zeikus 1979; Kumar dan Nussinov 2001).
4
mengubah komponen spesifik asam lemak mereka agar tetap memiliki viskositas membran yang stabil sebagai respon terhadap perubahan suhu yang disebut dengan
homeoviscous adaptation (Sinensky 1974).
Mekanisme yang tidak kalah pentingnya ialah kemampuan protein dan enzim untuk dapat bertahan pada kondisi yang demikian esktrem. Hasil beberapa studi menunjukkan bahwa terdapat sedikit perbedaan urutan asam amino pada enzim, yang mengkatalisis reaksi yang sama pada bakteri mesofil. Hal ini menjelaskan bahwa pergantian residu asam amino penting pada lokasi tertentu mampu membuat pelipatan enzim menjadi tahan panas (Madigan et al. 2011). Hasil penelitian menjelaskan bahwa terdapat beberapa mekanisme yang bekontribusi dalam enzim termostabil yaitu terdapatnya interaksi van der walls, inti enzim bersifat lebih hidrofobik, susunan tambahan ikatan hidrogen, peningkatan struktur sekunder (Berezovsky dan Shakhnovich 2005), pengepakan atom yang lebih kompak, peningkatan residu prolin pada daerah loop, konten heliks, area permukaan yang bersifat polar dan pembentukan jembatan garam yang lebih baik (Nussinov dan Kumar 2001). Hal ini menunjukkan bahwa interaksi dari berbagai mekanisme tersebut terdapat pada struktur protein termostabil.
Struktur, Peranan, dan Mekanisme Lipase
Lipase (triacylglycerol acylhydrolases E.C. 3.1.1.3) merupakan enzim yang tersebar luas di alam dan diproduksi oleh beberapa tanaman, hewan dan mikroorganisme yang memiliki potensi cukup besar secara fisiologis dan industri (Gupta et al. 2004). Lipase mengkatalisis reaksi hidrolisis trigliserida menjadi asam lemak bebas dan gliserol yang menunjukkan aktivitas yang rendah terhadap substrat yang larut dalam air (Sharma et al. 2001). Dalam kondisi yang sedikit air lipase memiliki kemampuan yang unik karena dapat mengkatalisis reaksi esterifikasi, alkoholisis dan asidolisis (Joseph et al. 2008), di samping lipolitik, lipase juga mempunyai aktivitas esterolitik yang membuatnya memiliki jenis substrat yang beragam, walaupun demikian sebagai katalis, lipase tetap memiliki selektifitas kespesifikan kemo, regio dan enantio yang tinggi (Pandey et al. 1999).
Lipase merupakan serin hidrolase yang mengkatalisis reaksi bila terjadi
lipid-water interface. Triad katalitik lipase tersusun dari Ser-Asp/Glu-His yang terdapat pada daerah di sekeliling sisi aktif serin, bentuk struktur tiga dimensinya menunjukkan karakteristik pelipatan α/β hidrolase, serin residu biasanya terdapat pada daerah lestari pentapeptida Gli-Xaa-Ser-Xaa-Gli (Arpigny dan Jaeger 1999).
5 Enzim lipolitik menjadi pusat perhatian karena potensinya dalam pengaplikasian di bidang industri bioteknologi lipid. Saat ini enzim lipase yang digunakan dalam industri detergen, lipid dan biodiesel sebagian besar berasal dari mikroba terutama fungi dan bakteri (Gupta et al. 2004) karena biasanya lebih tahan panas dibandingkan dari tanaman dan hewan. Bakteri penghasil lipase termostabil ekstraseluler memiliki nilai komersial yang penting karena proses produksinya mudah disamping kelebihannya toleran terhadap pelarut organik dan memiliki aktivitas yang lebih besar pada suhu tinggi (Schmidt-Dannert et al. 1996). Proses produksi yang berjalan pada suhu tinggi memberikan keuntungan seperti mempercepat proses difusi, meningkatkan kelarutan lipid dan substrat hidrofobik lainnya serta mengurangi resiko kontaminasi (Becker et al. 1997). Lipase memiliki ciri khas yang dikenal dengan istilah interfacial activation yaitu suatu mekanisme yang mana sisi aktif lipase akan terbuka ketika berinteraksi dengan substrat yang memiliki kelarutan rendah terhadap air (Zhang et al. 2010).
Dengan berbagai fitur tersebut lipase sering digunakan pada berbagai jenis industri yaitu
a. Industri makanan; terutama dalam produksi produk susu seperti keju, modifikasi lemak dan minyak (misalnya perusahaan mentega, margarin, minyak goreng baru), produksi makanan bayi dan lipid berstruktur unik (mentega, coklat yang sehat, pengganti susu manusia, lemak berkalori rendah atau tinggi, asam lemak tidak jenuh). Lipase juga digunakan sebagai emulsifier pada perkembangan produk roti dan pasta serta sebagai bahan tambahan dalam makanan hewan (Houde et al. 2004; Aloulou et al. 2007)
b. Detergen dan agen pembersih; karena sebagai bahan tambahan, lipase aktif dan stabil pada suhu tinggi serta pH alkali, selain itu juga berperan dalam produksi sabun, pembersih piring, larutan pembersih yang cepat kering dan kontak lensa (Pandey et al. 1999; Hasan et al. 2006)
c. Bahan kimia berkualitas tinggi; dalam industri farmasi produksi enansiomer murni melalui resolusi campuran rasemat (misalnya molekul kiral seperti prostaglandin, sefalosporin, obat antiinflamasi nonsteroid, hidantoin dan penisilin) (Jaeger dan Eggert 2002). Molekul kiral biasanya juga digunakan sebagai herbisida dalam industri agrokimia. Lipase digunakan juga untuk memproduksi aroma parfum, selain itu juga digunakan dalam produk perawatan kulit sebagai pelembut dan pelembab dalam industri kosmetik dan parfum (Casas-Godoy et al. 2012).
d. Industri kesehatan; lipase sebagai aplikasi alternatif dimanfaatkan untuk alat diagnostik, karena keberadaan dan jumlah mereka dapat mengindikasikan sebuah penyakit atau infeksi serta sebagai obat baru berfungsi mengobati masalah pencernaan dan kadar kolesterol yang tinggi (Hasan et al. 2006). e. Industri kertas dan bubur kertas: mengontrol penghilangan trigliserida dan lilin,
disamping meningkatkan keputihan dan mengurangi polusi dalam air limbah (Casas-Godoy et al. 2012).
f. Proses bioremediasi; membantu degradasi air limbah yang kaya akan minyak, sampah organik dan berbagai sampah industri lainnya (Hasan et al. 2006). g. Industri energi; produksi pelumas, dan sebuah biokerosin dari sumber
6
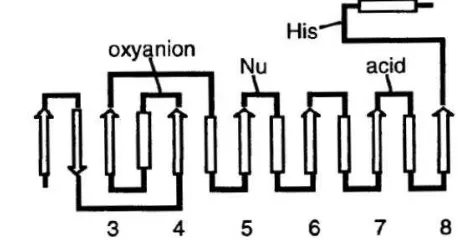
Mekanisme katalisis lipase terhadap substrat diawali dengan terjadinya pembentukan oxyanion hole. Selama proses katalisis dihasilkan sebuah tetrahedral intermediet yang distabilkan oleh ikatan hidrogen bersama dua asam amino yang membentuk oxyanion hole, ikatan hidrogen ini terbentuk dari kelompok amida pada enzim dan gugus karbonil oksigen pada substrat. Menurut Bezborodov dan Zagustina (2014) jenis oxyanion hole yang terbentuk berperan penting terhadap kespesifikan substrat lipase.
Katalisis dimulai dengan asilasi, tahap ini melibatkan transfer proton antara residu aspartat, histidin dan serin pada triad katalitik sehingga hidroksil serin diaktifkan. Proses ini meyebabkan nukleofil bersifat lebih reaktif yang membuat gugus hidroksil serin menyerang gugus karbonil substrat. Tetrahedral intermediet pertama yang terbentuk dengan muatan negatif pada oksigen dari gugus karboksil distabilkan oleh oxyanion hole dengan distribusi muatan dan mengembalikan energi tetrahedral melalui pembentukan minimal dua ikatan hidrogen (Bornscheuer 2002). Selanjutnya komponen alkohol (R-OH) dilepaskan dari bagian intermediet sedangkan bagian asam pada substrat tetap berikatan secara kovalen dengan residu serin dalam enzim asetil intermediet (Casas-Godoy et al. 2012), tahapan deasetilasi terjadi ketika nukleofil yang menyerang enzim menghasilkan produk dan terjadi regenerasi enzim.
Gambar 2. Mekanisme katalitik lipase (Casas-Godoy et. al. 2012).
Vektor
Pengertian vektor dalam biologi molekuler mengacu pada molekul DNA yang dapat melakukan replikasi dan membawa gen klon atau fragmen DNA. Fragmen DNA tidak memiliki situs awal untuk memulai replikasi DNA sehingga untuk dapat melakukan perbanyakan di dalam sel harus ditempatkan ke dalam vektor yang memiliki situs awal replikasi (Weaver 2012). Umumnya vektor terdiri dari dua jenis yaitu vektor kloning dan ekspresi. Vektor kloning digunakan untuk menyimpan dan memperbanyak fragmen DNA sedangkan vektor ekspresi untuk mengekspresikan gen target.
7 penanda untuk gen yang tersisipi (misal gen lacZ), menghasilkan salinan vektor dalam jumlah besar (Sambrook et al. 2001; Howe 2007). Vektor umum yang digunakan dalam teknik biologi molekuler ialah plasmid. Perbedaan utama antara plasmid untuk kloning dengan plasmid ekspresi ialah keberadaan promoter. Contoh plasmid kloning ialah pGEMT-Easy yang menggunakan prinsip TA kloning sedangkan contoh plasmid ekspresi yang banyak digunakan ialah pET. Sistem ekspresi pET sering digunakan karena menyediakan enam kemungkinan kombinasi vektor dengan inang untuk dapat mengatur ekspresi gen target secara optimal. Sistem ini dibutuhkan karena setiap ekspresi protein target membutuhkan kondisi yang berbeda-beda (Studier et al. 1990).
3
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Oktober 2014-Mei 2015 di Laboratorium Bioteknologi PT. Wilmar Benih Indonesia, Cikarang, Bekasi.
Bahan
Bahan-bahan yang digunakan dalam penelitian ini yaitu media tumbuh bakteri Luria Bertani (LB) yang mengandung natrium klorida, ekstrak khamir, tripton, Rhodamine B, substrat p-nitrophenil ester (C2-C18), olive oil/minyak zaitun
(SIGMA), Escherichia coli TOP10 (Invitrogen), ampisilin, kanamisin, plasmid pGEM-T Easy (Promega), pET15by, Isopropil β-D Tiogalatosida (IPTG), X-gal, Agarosa, Wizard Genomic DNA Purification kit (Promega), QiAquick PCR
purification kit (Qiagen), marka molekuler 100 pb DNA ladder (Vivantis), 1000 pb DNA ladder (Promega) PCR Go Taq Green Master Mix (Promega), enzim T4 ligase (New England Biolabs).
Alat
Alat-alat yang digunakan dalam penelitian ini ialah botol falkon steril, mesin PCR BIORAD Thermal Cycler C1000, sentrifus (sorval biofuge primo R), neraca analitik, spektrofotometer (BIORAD), mikropipet, shaker, sequencer (AB Applied Biosystems Hitachi 3130 Genetic Analyzer), perangkat elektroforesis BIORAD,
software Geneious R7.
Isolasi Bakteri Termofil Penghasil Lipase
Sampel diperoleh dengan mengambil sedimen dan air hasil semburan geiser (95o, pH 8) dengan botol falkon steril, lalu dimasukkan ke dalam cool box, kemudian dibawa ke laboratorium. Isolasi bakteri penghasil lipase dilakukan dengan menginokulasikan 1 ml air dan sedimen ke dalam media Basal Salt Solution (BSM) (0.8 g L-1 K2HPO4; 0.6 g L-1 KH2PO4; 1 g L-1 (NH4)2SO4; 0.2 g
L-1 MgSO
4·7H2O; 0.05 g L-1 CaC2·2H2O; 3 g L-1 NaCl dan 0.001 g L-1 FeCl3) yang
8
bergoyang dengan kecepatan agitasi 200 rpm 50oC. Setelah itu dilakukan
pengenceran 10-1, 10-2, 10-3, 10-4, 10-5 dan disebar ke atas media agar-agar Luria Bertani (LB) yang mengandung 1% natrium klorida, 1% tripton, 0.5% ekstrak khamir, 1.5% agar-agar bakto 1% Rhodamine B, 1% minyak zaitun (Kouker dan Jaeger 1987), Polivinil alkohol 2% (PVA)/minyak zaitun (3:1) dalam 500 ml, lalu diinkubasi pada suhu 50oC selama 24 jam. Koloni yang tumbuh diamati di bawah lampu UV dengan panjang gelombang 350 nm, jika dihasilkan pendaran berwarna jingga mengindikasikan bahwa koloni mampu menghasilkan lipase.
Produksi Enzim Ekstrak Kasar Lipase
Proses produksi enzim ekstrak kasar diawali dengan pembuatan starter (inokulum) dengan menginokulasikan bakteri sebanyak 1 lup ke dalam 10 ml media LB cair (1% tripton, 1% natrium klorida, 0.5% ekstrak khamir) dan diinkubasi menggunakan inkubator bergoyang dengan kecepatan agitas 200 rpm pada suhu 50oC selama 24 jam, setelah itu diinokulasikan starter sebanyak 2% ke dalam 50 ml
media produksi yang mengandung (1% tripton, 1% natrium klorida, 0.5% ekstrak khamir, 1% minyak zaitun), kemudian diinkubasi pada inkubator bergoyang dengan kecepatan agitasi 200 rpm pada suhu 50oC selama 24 jam. Hasil kultur selama 24
kemudian disentrifugasi dengan kecepatan 10.000 rpm (jenis rotor 7591) selama 15 menit pada suhu 4oC lalu supernatan yang mengandung enzim ekstrak kasar dipindahkan ke dalam tabung falkon untuk digunakan pada pengukuran aktivitas enzim ekstrak kasar.
Pengukuran Aktivitas Enzim Ekstrak Kasar Lipase
Aktivitas enzim ekstrak kasar diukur menggunakan metode (Xu et al. 2002) yang dimodifikasi dengan membuat 4 ml campuran PVA dan minyak zaitun (3:1), kemudian ditambahkan 2 ml 0.1 M bufer natrium fosfat pH 7, 2.5 ml akuades, 0.5 ml 0.1 M CaCl2, 1 ml enzim ekstrak kasar, lalu diinkubasi selama 15 menit pada
inkubator bergoyang dengan kecepatan agitasi 200 rpm pada suhu 50oC. Setelah itu reaksi dihentikan dengan menambahkan 10 ml etanol absolut 96%. Lalu campuran ditetesi dengan 4 tetes fenolftalein dan dititrasi dengan 0.05 M NaOH. Setiap pengukuran dilakukan dengan 4 kali pengulangan. Satu unit aktivitas lipase didefinisikan dengan jumlah enzim yang menghasilkan 1 µmol asam lemak per menit pada kondisi pengkuran aktivitas.
Identifikasi Bakteri
Identifikasi bakteri dilakukan dengan mengisolasi DNA genom bakteri menggunakan wizard genomic DNA purification kit Promega. Amplifikasi 16S rRNA dilakukan dengan 10 µl reaksi PCR yang mengandung 1 µl DNA genom, 5 µl GoTaq Green Master Mix (Promega), 1 µl primer 63F 1 µl 1387R (Marchesi et al. 1998) dan 1 µl ddH2O. Kondisi PCR yang digunakan ialah pre denaturasi 95oC
3 menit, denaturasi 95oC 30 detik, penempelan 55oC 30 detik dan pemanjangan 72oC 1 menit yang dilakukan sebanyak 30 siklus pada mesin Thermocylcer
BIORAD. Hasil PCR diimigrasikan ke dalam gel agarosa 1% pada kondisi 100 volt 40 menit. Setelah itu dilakukan pewarnaan gel dengan merendam pada larutan
9 merendam pada akuades selama 15 menit. Gel kemudian divisualisasikan pada UV transluminator BIORAD. Hasil PCR kemudian dipurifikasi dengan metode EXO-SAP untuk kemudian dilakukan sekuensing dengan mesin Applied Biosystems Hitachi 3130 Genetic Analyzer. Hasil sekuensing dinalisis menggunakan software
Geneious R7, kemudian dibandingkan dengan sekuen 16S rRNA data genebank
dengan menggunakan software BLASTn (Basic Local Alignmet Search Tools for nucleotide).
Isolasi Gen Lipase
Untuk memperoleh gen lipase maka didesain primer forward dan reverse
menggunakan sekuen open reading frame (ORF) gen lipase atau full genome yang diambil dari genebank. Desain primer dibuat dengan melihat daerah yang conserve
dengan software Geneious. Kondisi PCR yang digunakan yaitu pradenaturasi 95oC selama 3 menit dan dilanjutkan dengan denaturasi 95oC 1 menit, penempelan 55oC 30 detik dan pemanjangan 72oC 1.5 menit serta setelah pemanjangan 72oC 5 menit.
Hasil PCR diimigrasikan ke dalam gel agarosa 1% pada kondisi 100 volt selama 40 menit. Setelah itu dilihat di bawah sinar UV transluminator yang nantinya akan menghasilkan satu pita. Selanjutnya pita yang diinginkan dipotong lalu dipurifikasi dari gel agarosa dengan QIAquick PCR Purification Gel Kit.
Kloning Gen Lipase
Gen hasil purifikasi diligasikan ke dalam plasmid pGEM-T Easy (Promega) menggunakan enzim T4 ligase (New England Biolabs), pada suhu 4oC selama 16 jam dan ditransformasikan ke dalam sel kompeten E. coli TOP10 (Novagen, USA) dengan metode (Sambrook et al. 2001). Hasil transformasi diseleksi dengan ditumbuhkan pada media agar-agar Luria Bertani yang mengandung ampisilin (100µg/ml) 0.1 mM IPTG, 80 µg/ml X-Gal yang diinkubasi selama semalam pada suhu 37oC. Koloni transforman yang membawa gen lipase yang diinginkan akan
berwarna putih, selanjutnya koloni transforman diverifikasi dengan melakukan PCR koloni menggunakan primer M13F dan M13R. Hasil PCR diimigrasikan ke dalam gel agarosa 1% dengan kondisi 100 volt 40 menit, kemudian dilakukan pewarnaan dengan Ethidium Bromida (EtBr) dan penghilangan warna masing-masing 15 menit lalu dilihat di bawah UV transluminator. Hasil PCR kemudian disekuensing, dibandingkan dengan data sekuen gen lipase pada genebank dengan
tools BLASTn (Basic Local Alignment Search Tools for nucleotide). Setelah itu prediksi asam amino dan sisi aktif gen lipase dilakukan menggunakan perangkat lunak http://web.expasy.org/translate/ dan http://zhanglab.ccmb.med.umich.edu, konstruksi pohon filogenetik berdasarkan asam amino menggunakan MEGA 6.06.
Ekspresi Gen Lipase pada E. coli BL21(DE3) pLyss
Plasmid pET15-by digunakan untuk ekspresi gen pada E. coli BL21(DE3)
10
TOP10, dan disebar ke dalam media agar-agar Luria Bertani yang mengandung ampisilin 100 µg/ml. Selanjutnya untuk verifikasi transforman dilakukan PCR koloni menggunakan primer yang didesain sebelumnya dan primer T7 promoter dan terminal, pemotongan plasmid menggunakan KpnI/NotI serta sekuensing menggunakan primer T7. Plasmid yang telah diverifikasi ditransformasikan ke dalam E.coli BL21(DE3) pLyss, kemudian produksi enzim dilakukan dengan menumbuhkan starter (inokulan awal) pada 10 mL media LB cair yang mengandung ampisilin 100 µg/ml dan kloramfenikol 35 µg/ml pada inkubator bergoyang kecepatan agitasi 200 rpm pada suhu 37oC selama semalam, lalu diinokulasikan 2% inokulum ke dalam media produksi, dan ditambahkan 0.5 mM IPTG ketika nilai absorbansi 0.5-0.6 pada OD600, inkubasi kultur bakteri dilanjutkan
selama semalam. Kultur bakteri dipanen dengan disentrifugasi 8000 rpm (jenis rotor 7591) 4oC selama 10 menit, pelet yang diperoleh dilarutkan menggunakan bufer 0.1 M Tris-HCl sebanyak 10% dari media produksi. Setelah itu sel dipecah dengan alat sonikator selama 10 menit, supernatan diperoleh dengan melakukan sentrifugasi 13000 rpm (jenis rotor 7591) 15 menit 4oC, selanjutnya enzim ekstrak kasar dikarakterisasi.
Karakterisasi Enzim Ekstrak Kasar Lipase
Penentuan suhu optimum dilakukan dengan pengujian pada suhu 20-90oC, untuk pH optimum pH 5 - pH 11, substrat spesifik dengan subtrat rantai pendek hingga panjang (C2-C18) dan pelarut organik metanol, etanol, 2-propanol, 1-butanol,
n-heksan.
Pengujian suhu optimun dilakukan dengan metode 4-para nitrofenil palmitat (pNPP) (Joseph et al. 2012), dengan mencampurkan substrat 30 mg para nitropalmitat ke dalam 10 ml isoproponal, setelah itu diambil 1 ml campuran substrat dilarutkan dengan 0.1 M bufer fosfat pH 8 yang mengandung 0.04 g gum arabic, dan 0.92 g sodium deoxycholate, hasil campuran disimpan selalu dalam keadaan dingin. Setelah itu 25 µl enzim ekstrak kasar ditambahkan 600 µl campuran substrat, lalu diinkubasi pada masing-masing suhu selama 15 menit menggunakan heating cooling dry block, reaksi dihentikan dengan penambahan 500 µl etanol 96%, lalu disentrifugasi 16200 × � selama 3 menit dan diukur absorbansi pada panjang gelombang 405 nm. Penentuan pH optimum dilakukan dengan metode 4-para nitorofenil oktanoat (pNPC) (Natadiputri et al. 2015) pada suhu optimum. Penentuan pH optimum lipase dilakukan pada berbagai pH dengan menginkubasi campuran reaksi 950 µl, 40µl etanol 96% dan 10 µl enzim pada bufer 0.1 M natrium asetat (pH 5-6), 0.1 M bufer fosfat (pH 6-8), 0.1 M tris-HCl (pH 8-10), dan 0.1 M KCl-NaOH (10-11) selama 5 menit, kemudian diukur absorbansi pada panjang gelombang 405 nm menggunakan spektrofotometer (BIORAD).
Pengujian substrat spesifik dilakukan menggunakan substrat p-nitrofenil dengan panjang rantai karbon C2-C18 (pNp-asetat, pNP-butirat, pNP-heksanoat,
pNP-Okatanoat, pNP-dekanoat, pNP-dodekanoat) dilarutkan dengan 10 ml asetonitril sedangkan (pNP-miristat, pNP-palmitat, pNP-stearat) dilarutkan dalam 10 ml isopropanol. Pengujian substrat C2-C12 (pNp-asetat, butirat,
pNP-heksanoat, pNP-Okatanoat, pNP-dekanoat, pNP-dodekanoat) dilakukan dengan metode pNPC, sedangkan C12-C18 sedangkan (miristat, palmitat,
11 pengujian stabilitas lipase pada berbagai pelarut organik (metanol, 2-isopropanol, etanol, 1-butanol, n-heksan) pada suhu optimum. Enzim ekstrak kasar sebanyak 300 µl dicampurkan dengan 100 µl pelarut, lalu diinkubasi pada inkubator bergoyang dengan kecepatan agitasi 200 rpm 30 menit dan disentrifugasi 16200 × � 2 menit, setelah itu pengukuran aktivitas dilakukan dengan metode pNPP seperti yang telah dijelaskan sebelumnya (Kim et al. 2012)
4
HASIL DAN PEMBAHASAN
Isolasi Bakteri dan Pengukuran Aktivitas Lipase Termofilik
Sampel yang digunakan dalam penelitian ini berupa air dan sedimen yang diambil dari sumber air panas geiser Cisolok Sukabumi Jawa Barat yang memiliki pH 8 dan suhu mencapai 95oC. Hasil isolasi diperoleh lima isolat bakteri yang mampu menghasilkan enzim lipase ditandai dengan adanya koloni berwarna merah muda pada media Rhodamine B dan berpendar bila diamati di bawah sinar ultraviolet (UV), pendaran ini terjadi karena hidrolisis substrat berupa minyak zaitun oleh lipase menjadi asam lemak monogliserida atau digliserida yang berikatan dengan pewarna Rhodamine B yang kemudian tereksitasi bila diamati pada panjang gelombang 350 nm (Kouker dan Jaeger 1987; Mackenzie et al. 1967).
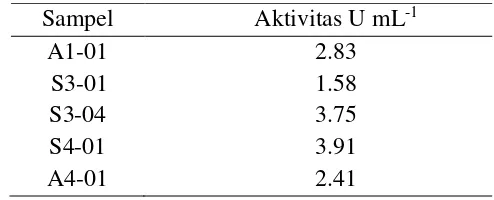
Kelima isolat diseleksi berdasarkan kemampuannya menghasilkan enzim lipase ekstraseluler melalui uji titrasi untuk mengukur aktivitas lipase (Tabel 1). Berdasarkan uji titrasi maka diperoleh aktivitas lipase ekstrak kasar tertinggi dari bakteri S4-01 sebesar 3.91 U mL-1. Aktivitas lipase ditunjukkan oleh adanya perubahan warna dari yang tidak berwarna menjadi merah muda dengan penambahan indikator fenolftalein. Perubahan ini terjadi akibat adanya perubahan pH pada larutan reaksi. Warna merah muda terjadi saat tidak ada lagi NaOH yang dapat berikatan dengan asam lemak sehingga pH larutan menjadi basa, sebab asam lemak memiliki pH yang bersifat asam lemah.
Tabel 1 Pengukuran aktivitas enzim lipase Sampel Aktivitas U mL-1
12
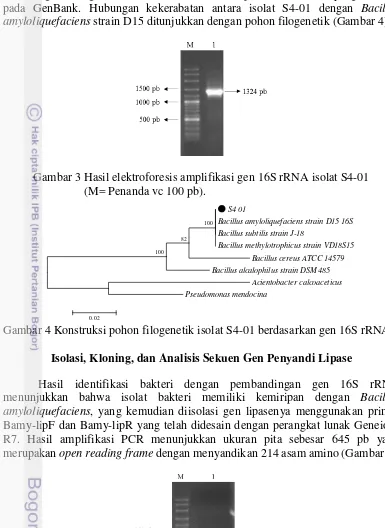
dibandingkan dengan melakukan BLAST terhadap data 16S rRNA yang terdapat pada GenBank. Hubungan kekerabatan antara isolat S4-01 dengan Bacillus amyloliquefaciens strain D15 ditunjukkan dengan pohon filogenetik (Gambar 4).
Gambar 3 Hasil elektroforesis amplifikasi gen 16S rRNA isolat S4-01 (M= Penanda vc 100 pb).
Gambar 4 Konstruksi pohon filogenetik isolat S4-01 berdasarkan gen 16S rRNA. Isolasi, Kloning, dan Analisis Sekuen Gen Penyandi Lipase
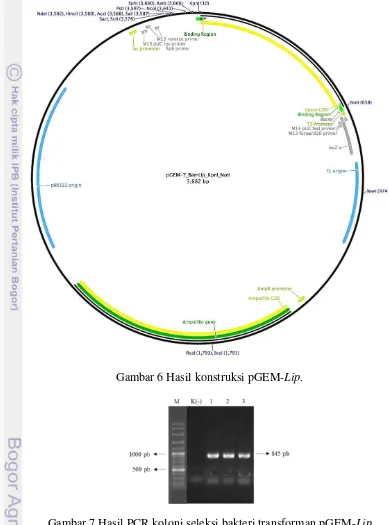
Hasil identifikasi bakteri dengan pembandingan gen 16S rRNA menunjukkan bahwa isolat bakteri memiliki kemiripan dengan Bacillus amyloliquefaciens, yang kemudian diisolasi gen lipasenya menggunakan primer Bamy-lipF dan Bamy-lipR yang telah didesain dengan perangkat lunak Geneious R7. Hasil amplifikasi PCR menunjukkan ukuran pita sebesar 645 pb yang merupakan open reading frame dengan menyandikan 214 asam amino (Gambar 5).
Gambar 5 Hasil elektroforesis amplifikasi gen lipase isolat S4-01 (M= Penanda vc 100 pb).
Hasil PCR ini dimurnikan dari gel elektroforesis kemudian diligasikan ke dalam vektor pGEMT-Easy dengan DNA T4 ligase (NEB) (Gambar 6) setelah itu ditransformasikan ke dalam E. coli TOP10. Seleksi biru putih digunakan untuk
S4 01
Bacillus amyloliquefaciens strain D15 16S Bacillus subtilis strain J-18
Bacillus methylotrophicus strain VD18S15 Bacillus cereus ATCC 14579 Bacillus alcalophilus strain DSM 485
Acientobacter calcoaceticus Pseudomonas mendocina
100 82
100
13 mendapatkan bakteri transforman dan diverifikasi dengan PCR koloni menggunakan primer M13 forward dan M13 reverse yang menghasilkan pita dengan ukuran sekitar 845 pb (Gambar 7).
Gambar 6 Hasil konstruksi pGEM-Lip.
Gambar 7 Hasil PCR koloni seleksi bakteri transforman pGEM-Lip (M= Penanda vc 100 pb; K(-)= Kontrol negatif).
Hasil plasmid rekombinan yang telah disekuensing lalu dikonstruksi pohon filogenetiknya berdasarkan prediksi asam amino. Pohon filogenetik menunjukkan bahwa sekuen asam amino isolat S4-01 lebih dekat terhadap B. methylotropicus
14
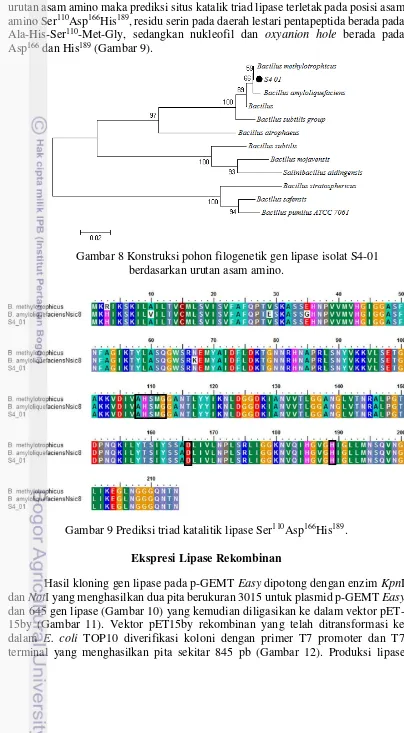
urutan asam amino maka prediksi situs katalik triad lipase terletak pada posisi asam amino Ser110Asp166His189, residu serin pada daerah lestari pentapeptida berada pada Ala-His-Ser110-Met-Gly, sedangkan nukleofil dan oxyanion hole berada pada Asp166 dan His189 (Gambar 9).
Gambar 8 Konstruksi pohon filogenetik gen lipase isolat S4-01 berdasarkan urutan asam amino.
Gambar 9 Prediksi triad katalitik lipase Ser110Asp166His189. Ekspresi Lipase Rekombinan
Hasil kloning gen lipase pada p-GEMT Easy dipotong dengan enzim KpnI dan NotI yang menghasilkan dua pita berukuran 3015 untuk plasmid p-GEMT Easy
15 relombinan dilakukan dalam E. coli BL21(DE3) pLyss pada media cair LB yang induksi oleh isopropyl-β-ɒ-thiogalaktopiranosida (IPTG).
Gambar 10 Hasil pemotongan pGEM-Lip menggunakan KpnI dan NotI (M= Penanda vc 100 pb; P= plasmid).
16
Gambar 12 Hasil PCR koloni seleksi bakteri transforman pET15by-Lip (M= Penanda vc 100 pb; K(-)= Kontrol negatif).
Karakterisasi Lipase Rekombinan
Lipase rekombinan yang diekspresikan pada E.coli BL21 (DE3) pLyss
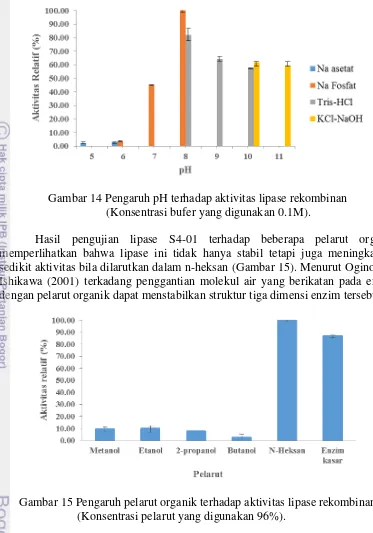
selanjutnya diuji untuk mencari suhu, pH optimum serta ketahanan terhadap pelarut, dan kespesifikan substrat sintesis. Berdasarkan hasil uji efek temperatur terhadap aktivitas lipase diperoleh bahwa temperatur optimum berada pada 40oC (Gambar 13). Aktivitas enzim akan terus meningkat hingga suhu optimum dan akan rusak perlahan bila melewati titik tersebut.
Gambar 13 Pengaruh suhu terhadap aktivitas lipase rekombinan.
17
Gambar 14 Pengaruh pH terhadap aktivitas lipase rekombinan (Konsentrasi bufer yang digunakan 0.1M).
Hasil pengujian lipase S4-01 terhadap beberapa pelarut organik memperlihatkan bahwa lipase ini tidak hanya stabil tetapi juga meningkatkan sedikit aktivitas bila dilarutkan dalam n-heksan (Gambar 15). Menurut Ogino dan Ishikawa (2001) terkadang penggantian molekul air yang berikatan pada enzim dengan pelarut organik dapat menstabilkan struktur tiga dimensi enzim tersebut.
Gambar 15 Pengaruh pelarut organik terhadap aktivitas lipase rekombinan (Konsentrasi pelarut yang digunakan 96%).
18
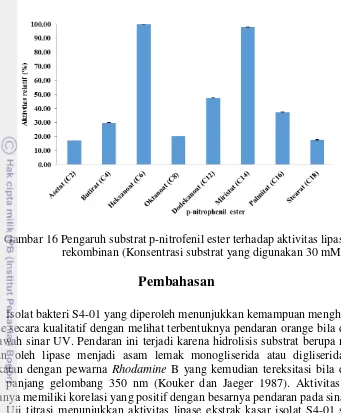
Gambar 16 Pengaruh substrat p-nitrofenil ester terhadap aktivitas lipase rekombinan (Konsentrasi substrat yang digunakan 30 mM).
Pembahasan
Isolat bakteri S4-01 yang diperoleh menunjukkan kemampuan menghasilkan lipase secara kualitatif dengan melihat terbentuknya pendaran orange bila diamati di bawah sinar UV. Pendaran ini terjadi karena hidrolisis substrat berupa minyak zaitun oleh lipase menjadi asam lemak monogliserida atau digliserida yang berikatan dengan pewarna Rhodamine B yang kemudian tereksitasi bila diamati pada panjang gelombang 350 nm (Kouker dan Jaeger 1987). Aktivitas enzim biasanya memiliki korelasi yang positif dengan besarnya pendaran pada sinar UV. Uji titrasi menunjukkan aktivitas lipase ekstrak kasar isolat S4-01 sebesar 3.91 U mL-1. Aktivitas lipase ditunjukkan oleh terjadinya perubahan warna dari yang tidak berwarna menjadi merah muda dengan penambahan indikator fenolftalein. Perubahan ini terjadi akibat adanya perubahan pH pada larutan reaksi. Warna merah muda terjadi saat tidak ada lagi NaOH yang dapat berikatan dengan asam lemak sehingga pH larutan menjadi basa, sebab asam lemak memiliki pH yang bersifat asam lemah.
19 perubahan sekuen acak yang cukup akurat bila digunakan untuk mengukur jarak evolusi, (iii) memiliki panjang sekitar 1500 pb yang cukup untuk tujuan informasi (Pangastuti 2006: Janda dan Abbot 2007).
Berdasarkan analisis pohon filogenetik, B. amyloliquefaciens menunjukkan berkerabat dekat dengan Bacillus subtilis. Spesies B. amyloliquefaciens merupakan spesies yang hampir mirip dengan B. subtilis, hingga pada tahun 1980-an masih dianggap satu spesies. Namun berdasarkan hasil penelitian Priest et al. (1987) menggunakan metode kromatografi gas cair firolisis, analisis berdasarkan perbedaan ciri-ciri fenotip dan berdasarkan profil elektroforesis enzim yang dihasilkan oleh masing-masing bakteri maka kedua bakteri tersebut tidak lagi dianggap sebagai satu spesies. Beberapa bakteri genus Bacillus yang sudah dilaporkan sebagai penghasil lipase adalah B. subtilis (Emtenani et al. 2013), B. pumilus (Ranlym et al. 2013), B. megaterium (Ruiz et al. 2002), B. thermoleovorans (Ochoa et al. 2005), dan B. sphaericus (Rahman et al. 2003).
Analisis pohon filogenetik dilakukan menggunakan metode neighbours joining
yaitu pasangan nukleotida yang mengalami perubahan terkecil di antara sekuen yang telah dibandingkan. Tujuan dari metode ini ialah untuk mengidentifikasi pohon pada posisi neighbours dengan benar, dan juga mempunyai cabang yang menghasilkan data orisinil sedekat mungkin yang dikontruksi dengan menggunakan perangkat lunak Mega 6.
Isolasi gen lipase dari bakteri B. amyloliquefaciens menggunakan primer Bamy-LipF dan Bamy-LipR yang menghasilkan pita dengan ukuran 645 pb. Karakterisitik primer umum yang ideal untuk dapat mengamplifikasi secara spesifik adalah memiliki panjang nukleotida 15-30 pasang basa, komposisi G+C sebesar 50% dan temperature melting (TM) tidak melebihi 60oC (Singh dan Kumar 2001).
Gen lipase yang telah diisolasi diligasikan ke dalam vektor pGEMT-Easy dan ditransformasikan ke E. coli TOP10 yang diseleksi menggunakan prinsip seleksi biru putih. Koloni bakteri berwarna putih merupakan transforman yang membawa gen yang diharapkan sedangkan berwarna biru hanya berisi plasmid tanpa gen yang diinginkan. Koloni berwarna biru timbul karena pada plasmid terdapat gen lacZ
yang mengodekan enzim β-galaktosidase. Protein ini bereaksi dengan X-gal (5-bromo-4-chloro-indolxyl-β-D-galaktosida) yang merupakan modifikasi dari glukosa membentuk 5-bromo-4-chloroindoxyl yang mudah teroksidasi menjadi 5.5'-dibromo-4.4'-dichloro-indigo pigmen warna biru yang tidak larut sedangkan isopropyl β-D-1-thiogalactopyranoside (IPTG) berfungsi sebagai induser untuk mengekspresikan gen lacZ (Sriram et al. 2011), sedangkan koloni yang berwarna putih menunjukkan bahwa enzim β-galaktosidase tidak dihasilkan karena masuknya gen insert yang diinginkan sehingga merusak gen lacZ. Selain itu koloni yang tumbuh juga memiliki kemampuan ketahanan terhadap antibiotik ampisilin dikarenakan pada plasmid terhadap gen bla/ampR yang mengodekan enzim β-laktamase sehingga merusak ampisilin dengan menghidrolisis struktur cincin β
lactam (Madigan et al. 2011). Vektor kloning seperti p-GEMT-Easy digunakan selain untuk memperbanyak fragmen yang juga berfungsi untuk verifikasi sekuensing agar gen insert yang telah diklon sesuai dengan yang diinginkan. Hasil analisis prediksi protein menunjukkan bahwa posisi residu serin pada daerah lestari pentapeptida berada pada Ala-His-Ser110-Met-Gly, sedangkan nukeleofil dan
20
kestabilan enzim (Jeong et al. 2002). Hasil analisis ini juga menunjukkan bahwa terdapat perbedaan empat asam amino bila dibandingkan dengan lipase yang berasal dari B. amyloliquefaciens Nsic8 (Cai et al. 2014) sedangkan dengan esterase
B. methylotropicus hanya terdapat satu asam amino yang berbeda. Hal ini memperjelas isolat S4-01 berbeda dari penelitian sebelumnya karena perbedaan satu asam amino saja pada posisi yang mempengaruhi aktivitas enzim dapat membuat enzim tersebut disebut novel.
Ekspresi enzim lipase dilakukan pada plasmid pET15 by di bawah kendali promoter T7. Promoter ini merupakan promoter kuat yang dapat mengekspresikan protein secara terus menerus. Namun promoter ini berada dalam kendali operator
lac sehingga diperlukan adanya induksi agar RNA polymerase T7 dapat mengenali prometer sehingga protein dapat diekspresikan, dalam hal ini diperlukan induksi oleh IPTG untuk mengikat protein repressor yang dihasilkan oleh lacI. Sel inang yang digunakan untuk mengekspresikan lipase adalah E. coli BL21(DE3) pLyss
sebab memiliki keuntungan seperti memiliki pertumbuhan yang cepat dalam media yang murah, sifat genetika sudah diketahui dengan baik, dapat menerima banyak vektor kloning, menghasilkan protein dalam jumlah besar (Sivashanmugam et al.
2009). Pada E. coli BL21(DE3) pLyss memiliki plasmid pLyss yang terdapat gen
Chloramfenicol Acetyltransferase (cat) berfungsi untuk resistensi terhadap kloramfenikol dengan mengikat secara kovalen satu atau dua gugus asetil dari asetil ko-enzimA yang kemudian menghambat kloramfenikol untuk berikatan dengan ribosom mekanisme ini dikatalisis oleh enzim kloramfenikol asetil transferase (Thirunalasundari et al. 2013). Selain resistensi terhadap antibiotik, plasmid ini juga dapat mengatur jumlah RNA polymerase T7 dengan mengekspresikan protein T7 lisozim yang berfungsi untuk menghambat kerja RNA polymerase T7 dengan menutup jalan transkripsi gen-gen akhir T7 dan replikasi DNA T7 sehingga dapat mengurangi tranksripsi dari gen target dalam keadaan tidak terinduksi, mekanisme seperti ini dilakukan untuk mencegah apabila protein yang dihasilkan bersifat toksik terhadap sel inang (Kumar dan Patel 1997).
Produksi enzim dilakukan dengan penambahan IPTG pada saat sel mencapai nilai optical density (OD)600 0.5-0.6 karena pada nilai ini sel dianggap
berada pada fase eksponensial yang mengalami pembelahan dengan cepat secara bersama-sama sehingga diharapkan protein yang dihasilkan dalam jumlah besar. Bakteri E. coli rekombinan biasanya menghasilkan protein tidak larut dalam bentuk agregat yang tidak disekresikan ke luar sel atau lingkungan yang disebut badan inklusi yang memiliki aktivitas rendah. Menurut Yang et al. (2011) bahwa E. coli
dapat mengekspresikan protein terlarut sebesar 30% sedangkan sisanya terdapat pada fraksi badan inklusi selain itu kondisi lingkungan juga sangat mempengaruhi hasil jumlah protein terlarut dan tidak terlarut. Ekspresi protein rekombinan dipengaruhi oleh beberapa faktor seperti, konsentrasi IPTG, waktu induksi, lama induksi, setelah induksi, suhu inkubasi, jenis vektor, kofaktor atau koenzim, pH, ketersediaan oksigen serta sel inang yang digunakan (Rosano dan Ceccarelli 2014).
21 Denaturasi yang terjadi mungkin meliputi perusakan ikatan kovalen dan nonkovalen yang diikuti agregasi molekuler atau pelipatan yang tidak sesuai (Bommarius dan Broering 2005), pada lipase termostabil terdapat beberapa mekanisme yang membuatnya tahan terhadap panas seperti stabilitas perputaran, kekompakan struktur sekunder dan pembungkusan inti protein. Faktor yang meningkatkan kestabilan enzim ialah peningkatan stabilitas muatan permukaan, adanya prolin, lebih banyak jembatan garam, ikatan disulfida dan ikatan hidrogen serta sedikit mengandung residu glisin dan residu labil seperti (Asn, Gln, Met, Cys) (Guncheva dan Zhiryakova 2011). Selain suhu, pH optimum merupakan faktor penting untuk melihat aktivitas enzim. Aktivitas enzim terhadap pH dipengaruhi oleh gugus ion pada sisi katalitik enzim dan muatan pada struktur tiga dimensi protein (Bisswanger 2008). Dengan demikian pada umumnya enzim akan mengalami denaturasi pada pH yang ekstrem. Biasanya sisi aktif enzim disusun oleh asam amino polar yang mudah mengalami ionisasi sehingga aktivitas katalitiknya tergantung pada pH. Sisi katalitik lipase disusun oleh katalitik triad yaitu residu serin, aspartat dan histidin. Kesamaan urutan motif pentapeptida terkonservasi pada residu serin yang merupakan asam amino polar pada Bacillus
yaitu Ala-Xaa-Ser-Xaa-Gly (Arpigny dan Jaeger 1999). Perubahan pH akan mempengaruhi ionisasi gugus katalitik dan substrat yang berefek pada pengikatan substrat dengan begitu dapat meningkatkan atau menurunkan aktivitas enzim, selain itu perubahan ini juga mempengaruhi gugus ionik pada bagian bukan sisi aktif namun berfungsi untuk mempertahankan struktur tiga dimensi enzim agar tetap fungsional (Dixon et al. 1979).
Hasil uji ketahanan lipase terhadap beberapa pelarut organik menujukkan bahwa aktivitas lipase meningkat bila dilarutkan dalam n-heksan dan cukup rendah dalam metanol dan etanol. Hal ini disebabkan n-heksan cenderung menginduksi perpindah group asil yang berkaitan dengan sifat kelarutan yang rendah dari asam lemak dan trigliserida sehingga mereka bergerak ke daerah micro-aqueous
mendekati lipase, dengan demikian proses perpindah group asil berjalan lebih optimum (Goh et al. 1993). Dalam produksi biodiesel biasa digunakan pelarut metanol dan etanol, yang mana diproduksi melalui alkoholisis transesterifikasi dari minyak nabati, dalam penggunaanya metanol lebih sering dipakai dibandingkan etanol karena lebih murah (Gupta dan Demirbas 2010).
22
sangat diperlukan dalam kontribusi semua ikatan nonkovalen dan ikatan hidrogen pada struktur protein sehingga mengakibatkan terganggunya interaksi antara residu asam amino pada sisi aktif lipase (Garcia dan Gonzales 1995).
Lipase memiliki kespesifikan terhadap jenis substrat yang berbeda-beda pada panjang rantai karbon yang bervariasi karena perbedaan sifat fisik-kimia antara daerah permukaan enzim dengan substrat. Hasil penelitian terhadap substrat p-nitrofenil ester menunjukkan lipase ini lebih menyukai substrat dengan panjang rantai karbon C6 dan C14 secara berturut-turut. Lipase jenis ini memiliki spektrum
substrat yang lebih luas karena memiliki aktivitas tertinggi terhadap rantai pendek (C6;heksanoat) atau rantai panjang (C14;miristat). Rantai panjang bila di atas C12
sedangkan rantai pendek di bawah C8 dan rantai sedang antara C8-C12. Substrat
yang banyak mengandung asam lemak miristat dapat dijumpai pada minyak yang berasal dari buah pala. Penelitian yang melaporkan lipase Bacillus menyukai C6
seperti B. thermoleovorans (Lee et al. 1999), Bacillus sp. (Handelsman et al. 1994). Penelitian tentang lipase yang dihasilkan oleh B. amyloliquefaciens (Cai et al. 2014) tidak mengkarakterisasi terhadap p-nitrofenil ester pada panjang rantai karbon yang bervariasi, sehingga ini dapat menjadi informasi awal untuk aplikasi dalam bidang industri.
5
SIMPULAN DAN SARAN
Simpulan
Bakteri termofilik S4-01 penghasil lipase telah berhasil diisolasi dari sumber air panas geiser, Sukabumi, Jawa Barat, Indonesia. Berdasarkan hasil sekuensing gen 16S rRNA, isolat ini memiliki kekerabatan dekat dengan Bacillus amyloliquefaciens. Pengukuran aktivitas lipase dengan metode titrasi menunjukkan bahwa isolat S4-01 memiliki aktivitas sebesar 3.91 µmol ml-1 menit-1. Gen lipase telah berhasil diisolasi dengan ukuran 645 pb dan diekspresikan di plasmid pET-15by pada E. coli BL21 pLyss. Karakterisasi lipase rekombinan menunjukkan suhu dan pH optimum pada 40oC dan pH 8. Pelarut n-heksan dapat meningkatkan
aktivitas enzim ini sementara berdasarkan uji kesepesifikan substrat, enzim ini lebih menyukai rantai C6(heksanoat) atau C14 (miristat).
Saran
DAFTAR PUSTAKA
Aloulou A, Rodriguez JA, Puccinelli D, Mouz N, Leclaire J, Leblond Y, Carriere F. 2007. Purification and biochemical characterization of the LIP2 lipase from Yarrowia lipolytica. Biochim Biophys Acta. 1771:228-237.
Apituley ET. 2012. Kloning gen penyandi lipase termofilik dari isolat bakteri asal mata air panas di Pulau Seram Maluku [thesis]. Institut Pertanian Bogor: Bogor.
Arpigny JE, Jaeger KE. 1999. Bacterial lipolytic enzymes: classification and properties. J Biochem. 343:177-83.
Bajaj A, Lohan P, Jha P, Mehrotra R. 2010. Biodiesel production through lipase catalyzed transesterification. J Molec Catal B: Enzyme. 62:9-14.
Becker P, Reesh IA, Markossian S, Antranikian G, Märkl H. 1997. Determination of the kinetic parameters during continuous cultivation of the lipase-producing thermophile Bacillus sp. IHI-91 on olive oil. Appl Microbiol Biotechnol. 48:184-190.
Berezovsky IN, Shakhnovich I. 2005. Physics and evolution of thermophilic adaptation. Proc Nat Aca Sci. 102(36):12742-12747.
Bezborodov AM, Zagustina NA. 2014. Lipases in catalytic reactions of organic chemistry. Appl Biochem Microbiol. 50(4):313-337.
Bisswanger H. 2008. Enzyme Kinetics: Principles and Methods. Ed ke-2. Tubingen (DE): Weinheim Wiley-VCH.
Bommarius AS, Broering JM. 2005. Established and novel tools to investigate biocatalyst stability. Biocatal Biotransform. 23(3/4):125–139.
Bornscheuer UT. 2002. Microbial carboxyl esterases: classification, properties and application in biocatalysis. FEMS Microbiol Rev. 26:73-81.
Cai X, Ma J, Wei DZ, Lin JP, Wei W. Functional expression of a novel alkaline-adapted lipase of Bacillus amyloliquefaciens from stinky tofu brine and development of immobilized enzyme for biodiesel production. Antony van Leeuwenhoek. 106:1049–1060.
Casas-Godoy L, Duquesne S, Bordes F, Sandoval G, Marty A. 2012. Lipases: An Overview. Di dalam Sandoval G, editor. Lipases and Phospholipases: Methods and Protocols, Methods in Molecular Biology. Volume 861. New York (US): Springer Science Business Media. hlm 3-30.
Chakravorty D, Parameswaran S, Dubey VK, Patra S. 2012. Uravelling the rationale behind organic solvent stability of lipases. Appl Biochem Biotechnol. 167:439-461.
Dixon M, Webb EC, Thorne CJR, Tipton KF. 1979. Enzymes. London (GB): Longman Group Ltd.
Emtenani S, Asoodeh A, Emtenani S. 2013. Molecular cloning of a thermo-akaliphilic lipase from Bacillus subtilis DR8806: Expression and biochemical characterization. Proc Biochem. 48:1679-1685.
Fattah YRA, Gaballa AA. 2008. Identification and over-expression of a thermostable lipase from Geobacillus thermoleovorans Toshki in
Escherichia coli. Microb Res. 163:13-20.
24
Goh SH, Yeong SK, Wang CW. 1993. Transesterification of cocoa butter by fungal lipase: effect of solvent on 1,3-specificity. J Am Oil ChemSoc. 70:567-570. Guncheva M, Zhiryakova D. 2011. Catalytic properties and potential applications
of Bacillus species. J Molec Catal B: Enzyme. 68:1-21.
Gupta R, Gupta N, Rathi P. 2004. Bacterial lipases: an overview of production, purification and biochemical properties. Appl Microbiol Biotechnol.
64:763-781.
Gupta RB, Demirbas A. 2010. Gasoline, diesel, and ethanol biofuels from grasses and plants. New York (US): Cambridge University Press.
Hamid NSA, Zen HB, Tein OB, Halifah YM, Saari N, Bakar FA. 2003. Screening and identification of extracellular lipase-producing thermophilic bacteria from a Malaysian hot spring. W J Microbiol Biotechnol. 19:961-968. Handelsman T, Shoham Y. 1994. Production and characterization of an
extracellular thermostable lipase from a thermophilic Bacillus sp. J Gen Appl Microbiol 40:435–43.
Hasan F, Shah AA, Hameed A. 2006. Industrial applications of microbial lipases. Enzyme Microb Technol. 39:235-251.
Helen T, De Oliveira D, Mazutti MA, Di Luccio M, Oliveira JV. 2010. A review on microbial lipase production. Food Bioproc Technol. 3:182-196.
Houde A, Kademi A, Leblanc D. 2004. Lipases and their industrial applications: an overview. Appl Biochem Biotechnol. 118(1-3):155-170.
Howe CJ. 2007. Gene Cloning and Manipulation. Ed ke-2. New York (US): Cambridge University Press.
Illanes A, Altamirano C. 2008. Enzyme reactors. Enzyme Biocatal. 5:205-251. Jaeger KE, Eggert T. 2002. Lipase for biotechnology. Curr Opin Biotechnol.
13:390-397.
Janda JM, Abbot SL. 2007. 16S rRNA Gene sequencing for bacterial identification in the diagnostic laboratory: Pluses, perils, and pitfalls. J Clinic Microbiol. 45(9):2761-2764.
Jeong, ST, Kim HK, Kim SJ, Chi SW, Pan JG, Oh TK, Ryu SE. 2002. Novel zinc-binding center and a temperature switch in the Bacillus stearothermophilus
L1 lipase. J Biol Chem. 277:17041–17047.
Joseph B, Ramteke PW, Thomas G. 2008. Cold active microbial lipases: Some hot issues and recent developments. Biotechnol Adv. 26:457-470.
Joseph B, Shrivastava N, Ramteke PW. 2012. Extracellular cold-active lipase of
Microbacterium luteolum isolated from Gangotri glacier, western Himalaya: Isolation, partial purification and characterization. J Gen Eng Biotechnol. 10:137-144.
Jusuf M. 2001. Genetika I: Struktur dan Ekspresi Gen. Jakarta (ID): Infomedika. Kim YO, Khosasih V, Nam BH, Lee SJ, Suwanto A, Kim HK. 2012. Gene cloning
and catalytic characterization of cold-adapted lipase of Photobacterium sp. MA1-3 isolated from blood clam. J Biosci Bioeng. 114(6):589-595.
Kiran GS, Lipton AN, Kennedy J, Dobson AD, Selvin J. A halotolerant thermostable lipase from the marine bacterium Oceanobacillus sp. PUMB02 with an ability to disrupt bacterial biofilms. Bioengineered. 5(5):305-318.
Kouker G, Jaeger KE. 1987. Spesific and sensitive plate assay for bacterial lipase.
25 Kumar A, Patel SS. 1997. Inhibition of T7 RNA Polymerase: Transcription initiation and transition from initiation to elongation are inhibited by T7 lisozyme via a ternary complex with RNA polymerase and promoter DNA.
Biochemistry. 36:13954-13962.
Kumar S, Nussinov R. 2001. How do thermophilic proteins deal with heat?. Cell
Mol Life Sci. 58:1216-1233.
Lee DW, Koh YS, Kim BC, Choi HJ, Kim DS, Suhartono MT, Pyun YR. 1999. Isolation and characterization of thermophilic lipase from Bacillus thermoleovorans ID-1. FEMS Microbiol Lett. 179:393-400.
Mackenzie RD, Blohm TR, Auxier EM, Luther AC. 1967. Rapid colorimetric micromethod for free fatty acids. J Lip Res. 8:589-587.
Madigan TM, Martinko JM, Stahl DA, Clark DP. 2011. Brock Biology of Microorganism. San Fransisco (US): Pearson Benjamin Cummings.
Mansilla MC, Cybulski LE, Albanesi D, De Mendoza D. 2004. Control of membrane lipid fluidity by molecular thermosensors. J Bacteriol. 186(20):6681-6688.
Marchesi JR, Sato T, Weightman AJ, Martin TA, Fry JC, Hiom SJ, Wade WG. 1998. Desgin and evaluation of useful bacterium-spesific PCR primers that amplify genes coding for bacterial 16S rRNA. Appl Environ Microbiol. 64:795-799.
Marieke GL, Elferink MGL, De Wit JG, Driessen AJM, Konings WN. 1994. Stability and proton-permeability of liposomes composed of archaeal tetraether lipids. Biochim Biophys Acta. 1193(2):247-254.
Martinez DLP, Gomez CR, Galbis DM, Chavez JAC, Alvaro GV, Ros RO. 2010 Thermophilic bacteria from Mexican thermal environments: isolation and potential applications. Environ Technol. 31(8):957-966.
Natadiputri GH, Suwanto A, Kim HK. 2015. One-step transesterification reaction using methanol-stable lipase for omega-3 fatty acid ethyl ester production.
J Korean Soc Appl Biol Chem. 58(2):195-202.
Niehaus F, Bertoldo C, Kahler M, Antranikian G. 1999. Extremophiles as a source of novel enzymes for industrial application. Appl Microbiol Biotechnol. 51:711-729.
Ochoa LDC, Gomez CR, Alfaro GV, Ros RO. 2005. Screening, purification and characterization of the thermoalkalophilic lipase produced by Bacillus thermoleovorans CCR11. Enzyme Microb Technol. 37:648–654.
Ogino H, Ishikawa H (2001) Enzymes which are stable in the presence of organic solvents. J Biosci Bioeng. 91:109-116.
Pandey A, Benjamin S, Soccol CR, Nigam P, Krieger N, Soccol VT. The realm of microbial lipases in biotechnology. Biotechnol Appl Biochem. 29(2):119-131.
Pangastuti A. 2006. Definisi spesies prokaryota berdasarkan urutan basa gen penyandi 16S rRNA dan gen penyandi protein. Biodiversitas. 7(3):292-296. Priest FG, Goodfellow M, Shute LA, Berkeley RCW. 1987. Bacillus
amyloliquefacies sp. nov., nom. rev. IJ Syst Bacteriol. 37: 69-71.